Allgemeine und Anorganische Chemie/ Struktur von Molekülen
Strukturvorhersagen nach VSEPR[Bearbeiten]
Das VSEPR-Modell (VSEPR ist die Abkürzung für Valence shell electron pair repulsion, deutsch Valenzschalen-Elektronenpaar-Abstoßung) wird manchmal auch EPA-Modell (Elektronenpaarabstoßungsmodell) genannt. Man kann es dazu verwenden die Struktur von einfachen Molekülen vorauszusagen.[1]
Es besagt, dass die Elektronenwolken in der Valenzschale des Zentralatoms sich so weit entfernt wie möglich anordnen. Schließlich sind sie stets negativ geladen und gleiche Ladungen stoßen sich ab. Die Molekülgestalt ist eine Konsequenz dieser gegenseitigen Abstoßung der Elektronenwolken.
Dreieck[Bearbeiten]
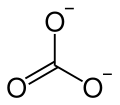
Für den Fall, dass sich drei Liganden um ein Zentralatom anordnen sollen, ist die Möglichkeit mit den größten Winkeln ein gleichseitiges Dreieck also 120° Abstand zwischen den Bindungspartnern. In der Chemie wird diese Struktur trigonal planar, also dreieckig flach, genannt.
Die gestrichelte Linie soll andeuten, dass es sich um mesomere Grenzzustände handelt, da formal gesehen, eine Doppelbindung vorkommen muss. In Wirklichkeit gibt es diesen Formalismus nicht.
Polyeder (Vielflächler)[Bearbeiten]
Tetraeder[Bearbeiten]
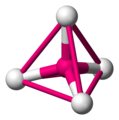
Möglicherweise hat man in der Mathematik schon etwas von Tetraedern gehört, wobei sie dort meist als Pyramide, mit einem gleichseitigem Dreieck als Grundfläche, bezeichnet werden. Ein Tetraeder hat vier Ecken, vier Flächen, und sechs Kanten. Jede Fläche ist ein gleichseitiges Dreieck.
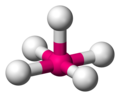
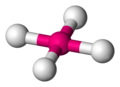
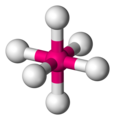
Der Tetraeder ist eine sehr wichtige und häufig vorkommende Geometrie in der Chemie, wobei das Molekül nicht aus Dreiecken besteht. Die folgenden Grafiken machen deutlich wie ein tetraedisches Molekül aussieht. Das Zentralatom ist magenta gezeichnet, die umgebenden Atome sind in weiß gehalten.
-
ein tetraedisches Molekül -
um den Tetraeder zu sehen, verbindet man (gedanklich) die äußeren Atome mit einer Linie -
Die Linien bilden die Kanten eines Tetraeders -
Zur Veranschaulichung nochmals die geometrische Figur eines Tetraeders

Wichtig in diesem Zusammenhang ist der Tetraederwinkel von ca. 109.5° im Gegensatz zum Quadrat in dem die Kanten jeweils nur einen Winkel von 90° bilden. Elektronenwolken, die sich abstoßen werden sich also immer tetraedisch anordnen um sich maximal aus dem Weg zu gehen.
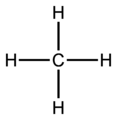
Chemiker verwenden Keile und Striche um auch in zwei-dimensionalen Zeichnungen die reale 3D-Gestalt anzudeuten.
-
eine flache Lewis-Strichformel für CH4 Methan -
eine realistischere Version, die Molekülgestalt berücksichtigt -
3D-Modell eines Methanmoleküls
Das Modell lässt sich auch auf einfache Ionen anwenden, daher hier noch ein paar weitere Beispiele für tetraedisch gebautete Moleküle:
-
Thiosulfat, S2O32− -
Sulfat, SO42− -
Phosphat, PO43− -
Ammonium, NH4+
ein freies Elektronenpaar[Bearbeiten]
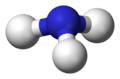
Nun betrachten wir den Fall, dass ein Elektronenpaar frei ist, also keinen Bindungspartner hat, am Beispiel von Ammoniak NH3. Die zwei Punkte in der Valenzstrichformel sollen deutlich machen, dass es sich um ein freies Elektronenpaar handelt. Normalerweise werden diese durch einen Balken abgekürzt. Das freie Elektronenpaar trägt zwar zur Struktur bei, die wirkliche Molekülgestalt wird aber letztendlich nur durch die Position der Atomkerne beschrieben.
-
Valenzstrichformel des Ammoniakmoleküls -
3D Modell mit freiem Elektronenpaar als gedachten Bindungspartner (Pseudostruktur) -
trigonal-pyramidale Struktur des Ammoniakmoleküls (Realstruktur)
Man geht also so vor, dass man freie Elektronenpaare wie Bindungspartner betrachtet, woraus sich eine tetraedische Pseudostruktur ergibt und denkt sich dann die Elektronenpaare weg. Was bleibt ist eine trigonal-pyramidale Struktur - eine Pyramide mit dreieckiger Grundfläche.
zwei freie Elektronenpaare[Bearbeiten]
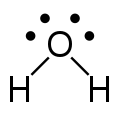
Ein Beispiel für zwei freie Elektronenpaare ist das Wassermolekül H2O. Auch hier geht man wieder von der tetraedischen Struktur aus und kommt dann ohne die zwei Elektronenpaare auf eine gewinkelte Struktur. Der Winkel beträgt 104,5°. Er weicht aufgrund des erhöhten Platzbedarfs der freien Elektronenpaare vom idealen Tetraederwinkel 109,5° ab.
-
Valenzstrichformel H2O (flach) -
3D Modell mit den beiden freien Elektronenpaaren (blaßgelb) -
gewinkeltes Wassermolekül
drei freie Elektronenpaare[Bearbeiten]
Zuletzt noch einmal am Beispiel des Fluorwasserstoffes ein lineares Molekül mit 3 freien Elektronenpaaren.
-
Valenzstrichformel -
3D-Modell mit freien Elektronenpaaren -
lineares Molekül des Fluorwasserstoffes
Trigonale Bipyramide[Bearbeiten]
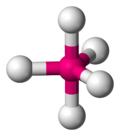
Fünf Liganden ordnen sich trigonal-bipyramidal um ein Zentralatom an, sprich das Molekül sieht aus wie eine doppelte Dreieckspyramide. Hierbei kommen zwei Winkel ins Spiel:
- Die dreieckige Grundfläche bieten den Bindungspartner einen Abstand von 120° - vgl. #Dreieck
- Die senkrecht darauf stehenden Atome von den übrigen Bindungspartner nur 90° von einander entfernt.
ein freies Elektronenpaar[Bearbeiten]
Das freie Elektronenpaar wird zunächst einen der 120° Plätze in der Grundfläche besetzen. Da es zudem auch noch mehr Platz beansprucht als ein gebundenes Elektronenpaar entsteht eine verzerrte Geometrie, die wie eine Wippe oder ein Schaukelbrett aussieht und auch bisphenoidal oder (irreführenderweise) "tetraedrisch verzerrt" genannt wird.
-
vier Liganden, ein freies Elektronenpaar -
es bleibt eine Art "Wippe" zurück
Der Unterschied zum #Tetraeder ohne freies Elektronenpaar ist sehr deutlich zu sehen. Die Struktur hat mit der tetraedischen Geometrie auch nichts zu tun.
zwei freie Elektronenpaare[Bearbeiten]
Auch das nächste freie Elektronenpaar wird sich einen Platz in der dreieckigen Grundfläche suchen, wodurch ein T-förmiges Molekül entsteht.
-
drei Liganden, zwei freie Elektronenpaare -
T-förmige Molekülgestalt
drei freie Elektronenpaare[Bearbeiten]
Jetzt fällt die gesamte trigonalen Grundfläche weg und es gibt wieder eine lineare Molekülgestalt.
-
zwei Liganden, drei freie Elektronenpaare -
Lineare Molekülgestalt
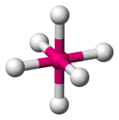
Oktaeder[Bearbeiten]
Die einzige Möglichkeit sechs Moleküle um ein Zentralatom anzuordnen und den größtmöglichen Abstandswinkel zu erhalten, ist ein sogenannter Oktaeder, ein Achtflächler. Er besitzt sechs Ecken, acht Flächen und zwölf Kanten. Der Winkel beträgt für alle Bindungspartner exakt 90°. Man könnte auch vierseitige Bipyramide mit quadratischer Grundfläche sagen, aber Oktaeder ist geläufiger.
-
ein beliebiges oktaedrisches Molekül -
um den Oktaeder zu sehen, verbinden wir die Liganden mit einer Linie -
Die Linien bilden die Kanten eines Oktaeders -
raumfüllendes Modell eines Oktaeders

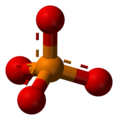
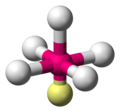
Ein Anwendungsbeispiel ist das Schwefelhexafluorid Molekül, dessen Atome sich oktaedrisch anordnen.
-
Schwefelhexafluorid SF6 mit -
Kugel-Stab-Modell von SF6 -
Stäbchenmodell von SF6
Oktaeder kommen häufig bei Verbindungen mit Übergangsmetallen in sogenannten Komplexverbindungen vor. Dort stößt das relativ einfache VSEPR-Modell jedoch an seine Grenzen und lässt sich nicht immer anwenden.
ein freies Elektronenpaar[Bearbeiten]
Wieder nach dem gleichen Prinzip ergeben sich die aus dem Oktaeder abgeleiteten Strukturen. Wird ein Elektronenpaar nicht zur Atombindung verwendet ergibt sich eine quadratisch-pyramidale Struktur.
-
fünf Liganden, ein freies Elektronenpaar -
übrig bleibt eine Seite der Pyramide
zwei freie Elektronenpaare[Bearbeiten]
Nehmen wir noch einen weiteren Bindungspartner weg, ergibt sich eine quadratisch-planare Struktur.
-
vier Liganden, zwei freie Elektronenpaar -
übrig bleibt die quadratische Grundfläche
Diese Struktur ist nicht mit dem #Tetraeder (vier Liganden, keine freien Elektronenpaare) zu verwechseln. Die freien Elektronenpaare bestimmen die Struktur mit und erzwingen in diesem Fall das Quadrat.
VSEPR Geometrien[Bearbeiten]
Häufig angetroffene Strukturen:
-
linear -
gewinkelt -
trigonal-planar -
pyramidal -
quadratisch-planar -
tetraedisch -
trigonal-bipyramidal -
oktaedrisch
Tabelle[Bearbeiten]
Hier nocheinmal in einer Tabelle kompakt alle VSEPR-Typen zusammengestellt. Um also eine Molekülstruktur korrekt vorherzusagen, muss man zunächst eine korrekte Valenzstrichformel aufstellen. Anhand der Anzahl der Atome und freien Elektronenpaare im Molekül kann man sich dann die günstigste räumliche Struktur überlegen. Nach etwas Übung hat man es heraus.
- ↑ Ronald J. Gillespie, Edward A. Robinson: Models of molecular geometry Chem. Soc. Rev., 2005, 34, S.396-407, DOI:10.1039/b405359c