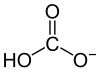
Biochemie und Pathobiochemie: HCO3-
| Kohlensäure und Hydrogencarbonat | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||
| Basisdaten und Verweise | ||||||||||||
|
Allgemeines[Bearbeiten]
Hydrogencarbonat (HCO3−) steht mit Kohlensäure (H2CO3) und Kohlendioxid (CO2) im chemischen Gleichgewicht, wobei die Carboanhydrase für die rasche Umsetzung sorgt (siehe hier). Über die Atmung (pCO2) und die renale HCO3−- und H+-Ausscheidung wird der Säure-Basen-Haushalt reguliert.
Hydrogencarbonat bzw. Kohlendioxid wird weiterhin für Carboxylierungsreaktionen und für die Bildung von Carbamoylphosphat genutzt. Letzteres wird z.B. für die Bildung von Pyrimidinen und Harnstoff benötigt.
Stoffwechselwege von Kohlendioxid bzw. Hydrogencarbonat[Bearbeiten]
Hier wird Kohlendioxid bzw. Hydrogencarbonat verwendet:
- Carboxylierungen (Biotin-abhängig, siehe dort)
- Harnstoffzyklus
- Pyrimidin-Biosynthese
Bei vielen oxidativen Abbauprozessen, wie z.B. der dehydrierenden Decarboxylierung von α-Ketosäuren oder im HMP-Weg wird Kohlendioxid freigesetzt.
Pathobiochemie[Bearbeiten]
- Respiratorische Azidose
- Respiratorische Alkalose
- Metabolische Azidose
- Metabolische Alkalose
Pharmakologie[Bearbeiten]
Natrium-Bicarbonat („NaBi“) wird bei schwerer Azidose zur Säurepufferung eingesetzt. Es muss streng i.v. verabreicht werden, da Paravasate zu schweren Nekrosen an der Injektionsstelle führen können.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.