Biochemie und Pathobiochemie: Purin-Stoffwechsel
Allgemeines
[Bearbeiten]Purine sind wichtige Biomoleküle. Sie bilden neben den Pyrimidinen die Bausteine der DNA, dienen als mobile Energiewährung und sind Ausgangsstoff des Biopterins und wichtiger intrazellulärer Signalmoleküle. Das primäre Abbauprodukt der Purine ist die Harnsäure.
Biosynthese von Inosin-5'-monophosphat (IMP)
[Bearbeiten]| All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| + Pi
- ADP, GDP |
ATP
AMP |
Ribose-phosphat- Diphosphokinase | 2.7.6.1 | Tr | PRPS1-assoziierte Syndrome | ||||||
|
|||||||||||
| + PRPP
- AMP, ADP, ATP, GMP, GDP, GTP |
Glutamin
PPi, Glutamat |
Amidophosphoribosyl- transferase | 2.4.2.14 | Tr | |||||||
|
|||||||||||
| ATP, Glycin
ADP + Pi |
Phosphoribosylamin--Glycin-Ligase | 6.3.4.13 | Lig | ||||||||
|
|||||||||||
| N10-Formyl-THF | Phosphoribosylglycinamid- Formyltransferase | 2.1.2.2 | Tr | ||||||||
|
|||||||||||
| ATP, Glutamin
ADP + Pi, Glutamat |
Phosphoribosylformyl- glycinamidin-Synthase | 6.3.5.3 | Lig | ||||||||
|
|||||||||||
| ATP
H2O, ADP + Pi |
Phosphoribosylformyl- glycinamidin-Cyclo-Ligase | 6.3.3.1 | Lig | ||||||||
|
|||||||||||
| CO2
|
Phosphoribosylaminoimidazol- Carboxylase | 4.1.1.21 | Ly | ||||||||
|
|||||||||||
| ATP, Aspartat
ADP + Pi |
Phosphoribosylaminoimidazol- succinocarboxamid-Synthase | 6.3.2.6 | Lig | ||||||||
|
|||||||||||
| Adenylosuccinat-Lyase | 4.3.2.2 | Ly | ADSL-Def. (Succinyl-purinämischer Autismus) | ||||||||
|
|||||||||||
| N10-Formyl-THF | Phosphoribosylaminoimidazol- carboxamid-Formyltransferase | 2.1.2.3 | Tr | AICA-Ribosurie | |||||||
|
|||||||||||
|
|
IMP-Cyclohydrolase | 3.5.4.10 | Hyd | AICA-Ribosurie | |||||||
|
|||||||||||
 |
 |
Allgemeines
[Bearbeiten]Der fertige Purinkern besteht aus 5 Kohlenstoff- und 4 Stickstoffatomen. Der Kohlenstoff stammt aus Glycin (2 C), 2 Formylresten aus 2 N10-Formyl-Tetrahydrofolsäure und 1 Kohlendioxid. Der Stickstoff stammt aus den nicht-essentiellen Aminosäuren Glycin, Glutamin (2x) und Aspartat.
Chemisch betrachtet besteht das Molekül aus zwei verschiedenen zusammenhängenden stickstoffhaltigen Ringsystemen (ein Pyrimidin und ein Imidazol), mit aromatischen Eigenschaften.
Die Purinbasen sind über ihr N-Atom 9 mit dem C-Atom 1' der Ribose verbunden.
Die Reaktionen im Detail
[Bearbeiten]Das Trägermolekül Ribose-5-phosphat, an dem die Purinbase synthetisiert wird, stammt aus dem Pentosephosphatweg. Zuvor muss es ATP-abhängig zu Phosphoribosylpyrophosphat (PRPP) phosphoryliert und damit „aktiviert“ werden. Da PRPP auch für die Pyrimidin- und NAD-Biosynthese sowie für die Purin-Wiederverwertung verwendet wird folgt der Beginn der eigentlichen de novo Purin-Synthese und ihre Regulation erst mit dem nächsten Schritt.
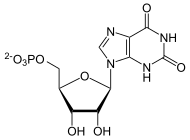
Ausgehend vom PRPP wird der Purinrest Inosin am C1-Atom des Phophoriboserestes in 10 Reaktionsschritten aufgebaut mit dem Nukleotid Inosin-5'-monophosphat (IMP) als (vorläufiges) Endprodukt. Was passiert nun im Einzelnen?
Im 1. Schritt erfolgt die Abspaltung von Pyrophosphat. Dies liefert genug Energie, um die Aminogruppe von Glutamin auf den Phosphoriboserest zu übertragen, so dass 5-Phosphoribosylamin (PRA) entsteht. Katalysiert wird die Reaktion von der Amidophosphoribosyltransferase. Das Enzym reguliert als Gatekeeper den Substratdurchfluss durch diesen Stoffwechselweg und wird entsprechend vom Feedforward-Aktivator PRPP allosterisch aktiviert und von den Endprodukten des Syntheseweges AMP, ADP, ATP, GMP, GDP und GTP allosterisch inhibiert (Feedback-Hemmung).
Im 2. Schritt katalysiert die Phosphoribosylamin--Glycin-Ligase die Anlagerung von Glycin an die Aminogruppe des 5-Phosphoribosylamins, womit das zweite von vier Stickstoffatomen eingebaut wäre und nun Glycinamidribonukleotid (GAR) vorliegt.
Im 3. Schritt wird ein Formylrest, der von N10-Formyl-Tetrahydrofolsäure angeliefert wird, an das Glycinamidribonukleotid angelagert, katalysiert von der Phosphoribosylglycinamid-Formyltransferase. Das Reaktionsprodukt ist Formylglycinamidribonukleotid (FGAR).
Im 4. Schritt liefert Glutamin ein weiteres Stickstoff-Atom, das unter ATP-Verbrauch von der Phosphoribosylformylglycinamidin-Synthase eingebaut wird und damit Formylglycinamidinribonukleotid (FGAM) liefert.
Im 5. Schritt erfolgt unter dem Einfluss der Phosphoribosylformylglycinamidin-Cyclo-Ligase der Ringschluß des Imidazol-Rings unter Wasserabspaltung, dabei kommt 5-Aminoimidazolribonukleotid (AIR) heraus. Die Reaktion kostet ein weiteres ATP.
Im 6. Schritt wird 5-Aminoimidazolribonukleotid (AIR) am C5-Atom des Imidazolrestes von der Phosphoribosylaminoimidazol-Carboxylase zum 5-Aminoimidazol-4-carboxylatribonukleotid (CAIR) carboxyliert.
Der 7. und 8. Reaktionsschritt sorgt nun via Aspartat-Zyklus für den Einbau des vierten Stickstoffatoms in den Purinkern. Auch das kostet wieder ein ATP. Die Kondesation mit Aspartat wird von der Phosphoribosylaminoimidazolsuccinocarboxamid-Synthase vermittelt, die folgende Abspaltung von Fumarat von der Adenylosuccinat-Lyase.
Der 9. Schritt erfordert einen weiteren Formylrest, der wieder von N10-Formyl-Tetrahydrofolsäure geliefert wird. Die Abhängigkeit vom Folsäure-Angebot erklärt zwanglos, warum ein Folat-Mangel die de novo Purinbiosynthese und damit die DNA-Synthese und Zellteilung beeinträchtigen kann. Die Phosphoribosylaminoimidazolcarboxamid-Formyltransferase katalysiert die Reaktion.
Im 10. Schritt wird auch der zweite Ring - der Pyrimidin-Ring - unter Wasserabspaltung von der IMP-Cyclohydrolase geschlossen. Der Purin-Kern ist nun fertig und kann weiter modifiziert werden.
Pharmakologie
[Bearbeiten]Die Purinbiosynthese kann durch Blockade des Folat-Stoffwechsels behindert werden, z.B. mit dem Dihydrofolatreduktase-Hemmer Methotrexat (MTX). In der Folge kommt es zu einem Mangel an DNA-Bausteinen und zu einer Hemmung der Zellvermehrung vor allem von proliferationsfreudigen Geweben. Dies macht man sich in der Therapie von Krebs (Tumorzellen) und Autoimmunerkrankungen (Immunzellen) zunutze.
Synthese von AMP aus IMP und Desaminierung zu IMP
[Bearbeiten]| All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| + GTP | GTP, Aspartat
GDP + Pi |
Adenylosuccinat-Synthase | 6.3.4.4 | Lig | |||||||
|
|||||||||||
| Adenylosuccinat-Lyase | 4.3.2.2 | Ly | ADSL-Def. (Succinyl-purinämischer Autismus) | ||||||||
|
|||||||||||
| H2O
NH3 |
AMP-Deaminase | 3.5.4.6 | Hyd | MADA-Defizienz, AMPD3-Defizienz | |||||||
|
|||||||||||
Die vorgenannten Reaktionen dienen nicht nur der Biosynthese von AMP im Rahmen der de novo Purinbiosynthese. Als sogenannter Purinnukleotidzyklus spielen sie eine wichtige Rolle im Skelettmuskel unter Belastung. Hier dient die Reaktionsfolge der Auffüllung des Citratzyklus mit Fumarat, das zuvor als Aspartat via Proteolyse in der Muskelzelle freigesetzt wurde (im Gegensatz zur reinen AMP-Synthese würde die Aspartat-Rekrutierung aus Oxalacetat, ebenfalls ein Citratzyklus-Intermediat, im Aspartatzyklus keinen Sinn machen). Ein weiterer Punkt ist der AMP-Spiegel, der durch die Deaminase-Reaktion konstant gehalten wird. Die Freisetzung von Ammoniak lässt sich laborchemisch als Ammoniakanstieg messen. Ein Defekt dieses Systems auf Ebene der AMP-Deaminase (MADA-Defizienz) ist die am weitesten verbreitete Ursache einer Myopathie.
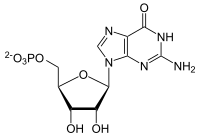
Synthese von GMP aus IMP und Desaminierung zu IMP
[Bearbeiten]| All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| H2O, NAD+ | IMP-Dehydrogenase | 1.1.1.205 | Ox | Retinitis pigmentosa 10 / Leber'sche kongenitale Amaurose 11 | |||||||
|
|||||||||||
| + ATP | H2O, ATP, Glutamin
AMP + PPi, Glutamat |
GMP-Synthase (Glutamin-hydrolysierend) | 6.3.5.2 | Lig | |||||||
|
|||||||||||
| NADPH/H+
NH3, NADP+ |
GMP-Reduktase | 1.7.1.7 | Ox | ||||||||
|
|||||||||||
Pharmakologie: Mycophenolat mofetil (MMF, MPA) hemmt die IMP-Dehydrogenase (IMPDH) und damit die GMP-Synthese. Dies beeinträchtigt wiederum die DNA-Biosynthese und Zellteilung vor allem von Lymphozyten, die ihren Purinbedarf vorwiegend über die de novo Purinbiosynthese decken. Der Wirsktoff kann daher als Immunsuppressivum z.B. zur Verhinderung einer Abstoßung nach Transplantation genutzt werden.
Regulation
[Bearbeiten]Das Schrittmacherenzym der Purin-Biosynthese, die Amidophosphoribosyltransferase wird durch die Endprodukte der Purin-Bildung gehemmt und durch PRPP stimuliert.
Nach der Verzweigungsstelle IMP findet man einen sinnigen Mechanismus, der beide Zweige im Gleichgewicht hält. ATP stimuliert die GMP-Synthese, so dass das IMP eher dort hin fließt. GTP stimuliert wiederum die AMP-Synthese, so dass das IMP wieder vermehrt in die andere Richtung fließt.
Stoffwechsel der Adenin- und Guaninnucleotide
[Bearbeiten]
- Die Nukleotide AMP und GMP und ihre Deoxyderivate dAMP und dGMP stellen die eine Hälfte der Bausteine der Nukleinsäuren (RNA und DNA).
- ATP und GTP dienen der Zelle als universelle „Energiewährung“, die vielen biochemischen Reaktionen die Energie liefert (die ATP-Hydrolyse ist stark exergon und verschiebt das Reaktionsgleichgewicht auf die Seite der Hydrolyse). Das ATP wird hauptsächlich von der ATP-Synthase an der inneren Mitochondrienmembran unter Sauerstoffverbrauch aus ADP und Pi erzeugt (Oxidative Phosphorylierung), zum Teil auch in der Glycolyse gewonnen (Substratkettenphosphorylierung). Letzteres wird von der Zelle besonders unter anaeroben Bedingungen genutzt. Eine weitere Substanz, die ein so hohes Gruppenübertragungspotential hat, dass sie ihr Phosphat auf ADP übertragen kann ist das Kreatinphosphat. Da das Kreatinphosphat das Phosphat vorher vom ATP übernommen hat entsteht hier netto kein neues ATP, Kreatinphosphat fungiert hier nur als „Zwischenspeicher“, um kurzzeitige ATP-Versorgungsengpässe auszugleichen. GTP entsteht z.B. indem GDP ein Phosphat von ATP übernimmt oder durch Substratkettenphosphorylierung im Citratzyklus. ATP treibt viele biochemische Reaktionen des Intermediärstoffwechsels an wie auch Proteine, z.B. ATP-abhängige Pumpen wie die Natrium-Kalium-Pumpe. Weiterhin liefert ATP auch meist das Phosphat für die Phosphorylierung von Proteinen durch Proteinkinasen. GTP treibt v.a. molekularbiologische Prozesse an wie z.B. den Transport von Kernproteinen in den Zellkern (Importine), die Proteinbiosynthese am Ribosom und den Aufbau der Mikrotubuli.
- ATP und GTP können von G-Protein-gesteuerten Enzymen (Adenylatzyklase, Guanylatzyklase) in zyklisches AMP (3',5'-cyclo-AMP, cAMP) und GMP (cGMP) umgewandelt werden, die wichtige second messenger darstellen (Botenstoffe der intrazellulären Signalübertragung).
- GTP ist auch der Rohstoff der Biopterin-Biosynthese.
Im Folgenden sind beispielhaft die möglichen Reaktionen der Adeninnukleotide tabellarisch aufgeführt:
| Reaktion | Co. | Enzym | EC | EG | Erkr. | ||
|---|---|---|---|---|---|---|---|
| AMP + ATP | ⇔ | 2 ADP | Adenylat-Kinase | 2.7.4.3 | Tr | AK1-Def. (Hämolyt. Anämie) | |
|
ADP + H2O ATP + H2O ATP + H2O |
⇒
⇒ ⇒ |
AMP + Pi
AMP + 2 Pi ADP + Pi |
Ca | Apyrase | 3.6.1.5 | Hyd | |
| ADP + Pi | ⇔ | ATP + H2O | FoF1-ATPase | 3.6.3.14 | Hyd | MTATP6-Def. (Leigh-S., NARP-S., Leber Opticusatrophie) | |
| ATP + NDP | ⇔ | ADP + NTP | Nucleosid-diphosphat-Kinase | 2.7.4.6 | Tr | ||
| ADP + 1,3-BPG | ⇔ | ATP + 3-PG | Phosphoglycerat-Kinase | 2.7.2.3 | Tr | PGK1-Def. | |
| ADP + PEP | ⇒ | ATP + Pyruvat | Pyruvat-Kinase | 2.7.1.40 | Tr | PKLR-Def. | |
| ATP + Kreatin | ⇔ | ADP + Kreatin-P | Kreatin-Kinase | 2.7.3.2 | Tr | ||
| ATP + H2O | ⇒ | ADP + Pi | Adenosintriphosphatase | 3.6.1.3 | Hyd | Hämolyt. Anämie | |
| NTP + RNAn | ⇔ | PPi + RNAn+1 | DNA-abhängige RNA-Polymerase | 2.7.7.6 | Tr | ||
| RNAn+1 + Pi | ⇔ | RNAn + NDP | Polyribonucleotid-Nucleotidyltransferase | 2.7.7.8 | Tr | ||
| ATP | ⇒ | 3',5'-cyclo-AMP + PPi | Adenylat-Cyclase | 4.6.1.1 | Ly | ||
| 3',5'-cyclo-AMP + H2O | ⇒ | AMP | 3',5'-cyclo-Nucleotid-Phosphodiesterase | 3.1.4.17 | Hyd | ||
| ADP + Thioredoxin | ⇒ | dADP + Thioredoxin- Disulfid + H2O | Ribonucleosid-diphosphat-Reduktase | 1.17.4.1 | Ox | ||
| ATP + dNDP | ⇔ | ADP + dNTP | Nucleosid-diphosphat-Kinase | 2.7.4.6 | Tr | ||
| dADP + PEP | ⇒ | dATP + Pyruvat | Pyruvat-Kinase | 2.7.1.40 | Tr | PKLR-Def. | |
| dNTP + DNAn | ⇔ | PPi + DNAn+1 | DNA-abhängige DNA-Polymerase | 2.7.7.7 | Tr | ||
| dAMP + dATP | ⇔ | 2 dADP | Adenylat-Kinase | 2.7.4.3 | Tr | AK1-Def. (Hämolyt. Anämie) | |
| dAMP + H2O | ⇔ | Deoxyadenosin + Pi | 5'-Nucleotidase | 3.1.3.5 | Hyd | ||
| Deoxyadenosin + PO4H3 | ⇔ | Adenin + 2-Deoxy-D-Rib-1-P | Purinnucleosid-Phosphorylase | 2.4.2.1 | Tr | PNP-Defizienz | |
| Deoxyadenosin + H2O | ⇔ | Deoxyinosin + NH3 | Adenosin-Deaminase | 3.5.4.4 | Hyd | Severe combined immunodeficiency (SCID) | |
| Deoxyinosin + Pi | ⇒ | Hypoxanthin + 2-Deoxy-D-Rib-1-P | Purinnukleosid-Phosphorylase | 2.4.2.1 | Tr | PNP-Defizienz | |
Purine werden zu Harnsäure abgebaut
[Bearbeiten]| Alternative Darstellung (kompakt) |
| Enzym | Co. | EC | EG | Erkr. |
|---|---|---|---|---|
| 1) 5'-Nucleotidase | 3.1.3.5 | Hyd | ||
| 2) Adenosin-Deaminase | 3.5.4.4 | Hyd | Severe combined immunodeficiency (SCID) | |
| 3) Purinnukleosid-Phosphorylase | 2.4.2.1 | Tr | PNP-Defizienz | |
| 4) Xanthin-Oxidase (XOD) | FAD, FeS, Mo | 1.17.3.2 | Ox | Xanthinurie I |
| 5) Guanin-Deaminase | 3.5.4.3 | Hyd |

Primaten, Vögel und einige Reptilien bauen Purine bis zur Harnsäure ab, die über den Urin ausgeschieden wird. Andere Tiere bauen die Harnsäure weiter ab zu besser wasserlöslichen Produkten wie Allantoin (die meisten Säugetiere), Harnstoff und Glyoxylsäure (Fische) oder Ammoniak (marine Invertebraten).
Harnsäure besitzt vermutlich eine antioxidative Wirkung, was den Verlust der Harnsäure-abbauenden Enzyme trotz des Nachteils der schlechteren Wasserlöslichkeit für Primaten u.a. Tiere lohnend gemacht haben könnte.
Pathobiochemie
[Bearbeiten]Ein übermäßiger Anfall von Harnsäure (purinreiche Kost (Innereien, Wurst), Tumorlyse) und/oder eine verschlechterte renale Ausscheidung (erbliche Transporter-Defekte, Alkohol (-> Acetat) und ASS durch Konkurrenz am tubulären Säuretransporter) führen zur Gicht. Hier kommt es durch die Überschreitung des Löslichkeitsprodukts zum Ausfällen von scharfkantigen Uratkristallen im Gewebe, die lokal eine Entzündungsreaktion hervorrufen.
Pharmakologie
[Bearbeiten]Die Xanthinoxidase kann durch das Hypoxanthin-Analogon Allopurinol gehemmt werden. Die Harnsäurebildung nimmt dadurch ab, die Bildung der besser wasserlöslichen Metaboliten Xanthin und Hypoxanthin nimmt zu.
Salvage Pathway
[Bearbeiten]| All. | ( ⇓ ) | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| - AMP | PPi | Adenin-Phosphoribosyl- transferase (APRT) | 2.4.2.7 | Tr | APRT-Defizienz | ||||||
|
|||||||||||
| All. | ( ⇓ ) | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| - IMP, GMP | PPi | Hypoxanthin-Phosphoribosyl- transferase (HGPRT) | 2.4.2.8 | Tr | Kelley-Seegmiller-Syndrom, Lesch-Nyhan-Syndrom | ||||||
|
|||||||||||
| All. | ( ⇓ ) | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| - IMP, GMP | PPi | Hypoxanthin-Phosphoribosyl- transferase (HGPRT) | 2.4.2.8 | Tr | Kelley-Seegmiller-Syndrom, Lesch-Nyhan-Syndrom | ||||||
|
|||||||||||
| All. | ( ⇓ ) | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| - AMP | PPi | Adenin-Phosphoribosyl-transferase (APRT) | 2.4.2.7 | Tr | APRT-Defizienz | ||||||
| - IMP, GMP | Hypoxanthin-Guanin-Phosphoribosyl-transferase (HGPRT) | 2.4.2.8 | Tr | Kelley-Seegmiller-Syndrom, Lesch-Nyhan-Syndrom | |||||||
|
|||||||||||
Die Purinbasen Adenin, Hypoxanthin, Xanthin und Guanin können mit Hilfe zweier Enzyme wiederverwertet werden, indem sie mit einem Phosphoribosylrest wieder zum Nucleotid aufgebaut werden. Dies ist sehr sinnvoll, da damit erstens ATP eingespart werden kann (die Bildung eines Purins kostet mindestens 7 (AMP) bzw. 9 (GMP) energiereiche Phosphatbindungen) und zweitens die Harnsäurebildung drastisch reduziert wird.
Pathobiochemie
[Bearbeiten]Beim X-chromosomal-rezessiven Lesch-Nyhan-Syndrom kommt es aufgrund eines Defektes der Hypoxanthin-Guanin-Phosphoribosyltransferase (HGPRT) zur fehlenden Rückgewinnung der Purinbasen und einem Überschuss an PRPP. Letzteres setzt zusammen mit dem Nukleotid-Mangel eine exzessive Purin- und damit Harnsäureproduktion in Gang. Die Erkrankung manifestiert sich in schweren neurologischen Störungen und Automutilation (Selbstverstümmelung), sowie Harnsäuresteinen. Eine abgeschwächte Form dieser Erkrankung mit einer HGPRT-Restfunktion stellt das Kelley-Seegmiller-Syndrom dar. Hier steht klinisch die Bildung von Harnsäuresteinen und die Harnsäurennephropathie im Vordergrund.
Weblinks
[Bearbeiten]- KEGG: Purine metabolism - Homo sapiens (human)
- RCSB PDB: Xanthine Oxidoreductase
- RCSB PDB: Hypoxanthine-guanine phosphoribosyltransferase (HGPRT)
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.