Lehrbuch der Biochemie: Biomoleküle: Aminosäuren
Allgemeines zu Aminosäuren[Bearbeiten]
In der Biochemie und Biologie sind Aminosäuren auf einer Ebene angesiedelt mit Lipiden, Monosacchariden und Nukleotiden. Im Falle der Aminosäuren handelt es sich vor allem um deren strukturelle und funktionelle Varianz die den biochemischen Roboter: Zelle so effektiv gestalten. Die aus ihnen gebildeten Proteine sind maßgeblich für die Struktur der Zellen verantwortlich und katalysieren als Enzyme eine Vielzahl wichtiger chemischer Reaktionen. Es gäbe auch die Möglichkeit Enzyme und Gerüstproteine durch Nukleotidgebilde zu ersetzen, wie sie zu Beginn des Lebens existierten. Ein Überbleibsel dieses Anfangs sind unsere Ribosomen, die zu einem Großteil aus RNA bestehen (mehr dazu in einem anderen Kapitel). Die Evolution selektierte jedoch Zellen mit höherer Effektivität, wie sie nur durch kompaktere (und somit sparsamere) und flexiblere Bauweise durch Aminosäuren möglich war. Aminosäuren sind jedoch nicht "nur" Bausteine für Proteine, sie dienen auch als Vorstufen verschiedener Metabolite, wie z.B. für Carnitin, Pyrimidine, Purine, Kreatine, usw. Sie besitzen auch physiologische Funktionen im Hormonhaushalt und im Neurostransmitterstoffwechsel.

Aminosäuren sind organische Säuren mit mindestens einer Aminogruppe und mindestens einer Carboxylgruppe. Wenn wir von Aminosäuren sprechen, meinen wir meist α-Aminosäuren. Das bedeutet, dass die Aminogruppe und die Carboxylgruppe am selben C-Atom hängen. Aminosäuren können aufgrund ihrer restlichen Struktur (=R in der Abbildung rechts) in verschiedene Gruppen eingeteilt werden. Es ist durchaus üblich, dass Aminosäuren an der Seitenkette neben dem Kohlenstoffgrundgerüst noch weitere funktionelle Gruppen besitzen. Diese Gruppen können z.B. folgende sein -COOH, -SH, -OH, -NH2,etc. Je nach ihrer Struktur, und ihren funktionellen Gruppen haben Aminosäure einen unterschiedlichen Einfluss auf die räumliche Struktur und Funktion der aus ihnen gebildeten Proteine. Aminosäuren sind die grundlegenden Bausteine der Proteine und kommen daher in jedem (bekannten) Lebewesen vor. Es geht sogar soweit, dass von den Viren bis zu den Menschen im wesentlichen die selben Aminosäuren verwendet werden, Darüber hinaus werden auch noch die selben Codons zur Codifizierung von Aminosäuren verwendet.
Detail am Rande:
Bei β-Aminosäuren, befindet sich die Carbonsäure auf dem C-Atom Nr.1 und die Aminogruppe auf dem C-Atom Nr.2. Zur Erinnerung, das Kohlenstoffgrundgerüst kann von dem jeweils wichtigsten C-Atom aus durchnummeriert werden. Die Regeln für das wichtigste C-Atom sind sehr kompliziert, es sollte uns daher reichen, dass bei Aminosäuren das C-Atom an welchem die COOH (Carboxylgruppe) hängt, als C-Atom Nr.1 bezeichnet wird. β-Aminosäuren sind jedoch eher selten, diverse Exemplare kann man z.B. bei Antibiotika finden.
Eigenschaften von Aminosäuren[Bearbeiten]
Zwitterionen[Bearbeiten]
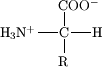
Durch die Aminogruppe, die ein Ion (auch Proton genannt) aufnehmen kann und die Säuregruppe, von der ein Proton abdissoziieren kann, sind sie sogenannte Zwitterione. So können Aminosäuren überwiegend entweder (in sauren Lösung) als Katione oder (in alkalischer Lösung) als Anione vorliegen. Ist gleichzeitig das Proton der Carboxylgruppe abdissoziiert und ein zusätzliches Proton an der Aminogruppe angelagert, befindet sich das Molekül in der Zwitterionen-Form. Den pH-Wert bei dem die Aminosäure nach außen hin als ungeladen vorliegt (=gleich viele positive wie negative Ladungen) nennt man den "Isoelektrischen Punkt" bzw. pI (Kürzel: IEP). Der isoelektrische Punkt kann durch Titration oder durch isoelektrische Fokussierung bestimmt werden. Befindet sich eine Aminosäure in der Zwitterionenform kann es keinen elektrischen Strom leiten, bzw. wandert sie nicht im elektrischen Feld. Dieses Prinzip wird bei der isoelektrischen Fokussierung angewandt. Weiters besitzt die Aminosäure im IEP die geringste Wasserlöslichkeit, da die Anlagerung von Wasser an das Zwitterion ungünstig ist.
Berechnung des isoelektrischen Punktes aus den Disoziationskonstanten:
Details am Rande:
- Verbindungen die sowohl als Säure als auch als Base reagieren können werden als Ampholyte bezeichnet.
- Bei Verbindungen aus mehreren Aminosäuren ergibt sich ein neuer isoelektrischer Punkt für die Verbindung.
Chiralität[Bearbeiten]

Chiralität ist in der Regel nur bei Atomen mit 4 oder mehr Bindungsarmen möglich (Phosphor, Kohlenstoff, Stickstoff wenn er positiv geladen ist = gespannt,....). Aminosäuren sind, mit Ausnahme von Glyzin, aufgrund des 1.C-Atoms chirale Moleküle (es trägt eine -COOH-Gruppe, eine NH2-Gruppe, ein H-Atom und einen Rest=R, also vier verschiedene Substituenden). Das ausschlaggebende Zentralatom wird als Sterozentrum bzw. auch als optisches Zentrum bezeichnet. Moleküle mit nur einem optischen Zentrum können nur in zwei verschiedenen Formen vorliegen und verhalten sich wie Bild und Spiegelbild, sie werden auch als enantiomer zueinander bezeichnet. Eine bessere Erklärung am Beispiel Glukose, deren rechtsdrehendes Enantiomer als D-Glukose und deren linksdrehendes Enantiomer als L-Glukose bezeichnet wird. Links- und rechtsdrehend bedeutet nun nicht unbedingt, dass sich die jeweiligen Moleküle in einer Lösung alle nach links bzw. nach rechts drehen. Diese Bezeichnung drückt vielmehr die Beschreibung nach verschiedenen Regeln aus (siehe unten). Enantiomere haben weitgehend die selben physikalischen und chemischen Eigenschaften (Schmelzpunkt, Siedepunkt,...), aber unterscheiden sich in ihren biochemischen Eigenschaften. So bestehen fast alle Proteine und somit der gesamte Stoffwechselapparat aus L-Aminosäuren. D-Aminosäuren können von Zellen in der Regel gar nicht synthetisiert werden bzw. würden Proteine aus D-Aminosäuren nicht von unser Enzymen bearbeitet werden können.
Regeln zur Beschreibung von chiralen Molekülen:
Für die Bezeichnung der Chiralität gibt es zwei verbreitete Methoden:
- D (dexter: lat. rechts) und L (laevus: lat. links) nach den Regeln der Fischer-Projektion. Am Beispiel einer Aminosäure erklärt: Die Strukturformel der AS wird so aufgeschrieben, dass das Kohlenstoffatom Nr. 1 oben steht und das restliche Kohlenstoffgerüst linear nach unten verläuft. Funktionelle Gruppen, Kohlenstoffreste und Wasserstoffatome werden nach links bzw. nach rechts der Grundachse ausgerichtet. Liegt nun im optischen Zentrum (vier verschiedene Substituenden) die markante Gruppe links oder rechts wird es entsprechend mit dem Kürzel D bzw. L bezeichnet.
- R (rectus: lat. rechts) und S (sinister: lat. links) nach den CIP-Regeln oder auch Cahn-Ingold-Prelog-Konvention genannt. Hierbei werden nach gewissen Regeln die Substituenden des jeweiligen Zentralatomes durchnummeriert. Je nachdem in welche Richtung das Zentralatom gedreht werden muss, um von der niedrigsten Nummer bis zur höchsten zu gelangen, wird die Bezeichnung R oder S verteilt.
Details am Rande:
- D-Aminosäuren werden lediglich von einigen Bakterien im Sekundärmetabolismus gebildet und dienen dort als Abwehrstoffe.
- Gemische aus linksdrehenden und rechtsdrehenden Molekülen werden als racemische Gemische oder auch als Racemat bezeichnet.
- Hat ein Moleküle mehr als ein optisches Zentrum sind mehr als zwei Varianten möglich. Bei diesen gibt es nicht nur Bild und Spiegelbild, sondern es sind auch Zwischenformen, sogenannte Diasteromere möglich. Diasteromere unterscheiden sich auch meist in den physikalischen und chemischen Eigenschaften voneinander(z.B: Glukose und Galaktose sind Diasteromere zueinander).
Unterteilung der Aminosäuren[Bearbeiten]
proteinogene Aminosäuren[Bearbeiten]

Aminosäuren (kurz: AS) unterscheiden sich durch den organischen Rest (R im Bild oben), der an der Grundstruktur des Moleküls angebunden ist. Es gibt theoretisch unendlich viele verschiedene AS. Es werden allerdings lediglich 23 verschiedene AS für den Aufbau von Proteinen verwendet. Diese nennt man "proteinogene Aminosäuren". In der Literatur werden häufig 20 proteinogene AS erwähnt, die übrigen drei sind Gegenstand aktuellerer Forschung.
nicht proteinogene Aminosäuren[Bearbeiten]
...sind in einer großen Anzahl natürlich vorkommend. Sie haben meist toxische Wirkungen auf den Menschen, da sie antagonistisch zu den "Standard-Aminosäuren" sind. Sie sind vor allem im Sekundärmetabolismus einiger Bakterien und auch in Pflanzensamen zu finden. Nicht proteinogene Aminosäuren sind bei weitem zahlreicher als proteinogene. Momentan (Stand Februar 2006) sind 250 nicht proteinogene Aminosäuren bekannt
essentielle Aminosäuren[Bearbeiten]
Der menschliche Organismus ist nicht in der Lage, alle notwendigen AS selbst zu synthetisieren. Er ist deshalb auf die Zufuhr dieser Moleküle durch die Nahrung angewiesen. Die AS, die der menschliche Körper nicht selbst synthetisieren kann, nennt man "Essentielle Aminosäuren". Manche Aminosäuren können nur im gesunden Zustand bzw. erst ab einer gewissen "Reife" der Zelle gebildet werden. Histidin und Arginin sind für den gesunden erwachsenen Menschen nicht essentiell, für Heranwachsende und für Menschen während der Genesung müssen diese Aminosäuren jedoch zugeführt werden.
8 Essentielle AS: Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan, Valin
kanonische Aminosäuren[Bearbeiten]
Als kanonische Aminosäuren werden die 20 Standardaminosäuren bezeichnet, welche in Form von Codons in der DNA gespeichert sind. Codons sind eine Abfolge von drei Nukleotiden welche durch den DNA-Code genau einer Aminosäure zugeordnet sind. Es gibt insgesamt 20 kanonische Aminosäuren (aber 23 proteinogene Aminosäuren). Proteinogene Aminosäuren, aber nicht kanonische Aminosäuren sind: Selenocystein, Pyrrolysin und Selenomethionin.
proteinogene Aminosäuren in der Übersicht[Bearbeiten]
Alanin[Bearbeiten]

Alanin kann im menschlichen Körper aus Pyruvat synthetisiert werden bzw. kann es so umgekehrt in den Abbaustoffwechsel (=Katabolismus) eingeschleust werden. Der Abbau von Alanin zu Pyruvat geschieht durch oxidative Desaminierung und wird durch das Enzym Alanin-Dehydrogenase katalysiert. Obwohl Aminosäuren in ihrer D-Form eigentlich relativ selten vorkommen wird D-Alanin zum Aufbau von Murein, ein bakterieller Zellwandbestandteil, verwendet.
| Kürzel | Ala, A | essentiell | nein |
| Summenformel | C3H7NO2 | Molare Masse | 89,1 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | 6,11 |
Arginin[Bearbeiten]

Arginin ist ein Zwischenprodukt vom Harnstoffzyklus. Arginin ist nahezu in jedem Eiweiß vorhanden. Aufgrund der Stickstoffgruppen am Ende der Seitenkette wirkt Arginin basisch. Diese Endgruppe ist bei neutralem pH-Wert immer positiv geladen. Dadurch, dass Arginin im Körper relativ leicht synthetisiert werden kann, ist es an einer Reihe biochemischer Funktionen in der Zelle beteiligt (Hormonstoffwechsel, Regulierung des Blutzucker- und Blutfettspiegels, Regulation des Blutflusses ...). Der Bedarf an Arginin kann jedoch nicht immer vom Körper selbst gedeckt werden, daher muss bei falscher Ernährung, bei bestimmten Krankheiten und bei Kindern im Wachstum diese Aminosäure zugeführt werden.
Details am Rande
- Die Bezeichnung Arginin kommt von argentum (lat. Silber), da die Aminosäure zu Beginn in Form eines Silbersalzes isoliert wurde.
| Kürzel | Arg, R | essentiell | für Kinder |
| Summenformel | C6H14N4O2 | Molare Masse | 174,20 g/mol |
| Seitenkette | basisch | isoelektrischer Punkt | 10,76 |
Asparagin[Bearbeiten]

Asparagin kann aus Asparaginsäure synthetisiert werden. Asparagin unterscheidet sich von der Asparaginsäure durch ihre endständige Amidgruppe und liegt daher bei physiologischem pH-Wert ungeladen vor.
| Kürzel | Asn, N | essentiell | nein |
| Summenformel | C4H8N2O3 | Molare Masse | 132,12 g/mol |
| Seitenkette | hydrophil | isoelektrischer Punkt | 5,41 |
Asparaginsäure[Bearbeiten]

Asparaginsäure kann aus Oxalacetat (aus dem Zitronensäurezyklus) durch Transaminierung synthetisiert werden. Asparaginsäure kommt auch im Harnstoffzyklus vor und liegt bei physiologischem pH-Wert als Salz vor.
Details am Rande
- Die Bezeichnung Asparaginsäure kommt von Asparagus (lat. Spargel), entweder wurde diese Aminosäure im Spargel als erstes entdeckt, oder die Bezeichnung rührt daher, da Spargel besonders viel Asparaginsäure enthält.
| Kürzel | Asp, D | essentiell | nein |
| Summenformel | C4H7NO4 | Molare Masse | 133,10 g/mol |
| Seitenkette | sauer | isoelektrischer Punkt | 2,85 |
Cystein[Bearbeiten]
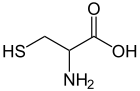
Cystein ist eine schwefelhaltige Aminosäure und mit einem anderen Cystein zur Bildung von Disulfidbrücken fähig. Diese Verbindung aus zwei Cysteinen wird Cystin genannt. Cystein an sich ist nicht essentiell, da sie aus Methionin und Serin gebildet werden kann. Methionin ist für die Übertragung der SH-Gruppe nötig. Bei Mangel an der essentiellen Aminosäure Methionin ist diese Synthese nicht möglich. Cystein hat einen großen Einfluss auf die Tertiärstruktur von Proteinen und ist in vielen Enzymen am Katalysemechanismus beteiligt.
| Kürzel | Cys, C | essentiell | nein |
| Summenformel | C3H7NO2S | Molare Masse | 121,16 g/mol |
| Seitenkette | hydrophil | isoelektrischer Punkt | 5,05 |
Glutamin[Bearbeiten]

Glutamin ist eine der am häufigsten vorkommenden Aminosäuren und gilt im Stoffwechsel als universeller NH2-Donor. Der Anteil von Glutamin an freien Aminosäuren beträgt in der Muskelzelle bis zu 50 %, im Plasma 20 % und in der Leber bis zu 15 %. Glutamin kann aus der Glutaminsäure durch das Enzym Glutamin-Synthetase hergestellt werden.
| Kürzel | Gln, Q | essentiell | nein |
| Summenformel | C5H10N2O3 | Molare Masse | 146,15 g/mol |
| Seitenkette | hydrophil | isoelektrischer Punkt | 5,65 |
Glutaminsäure[Bearbeiten]
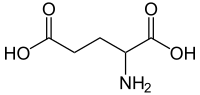
In der Biochemie wird hauptsächlich von dem Salz der Glutaminsäure, dem Glutamat, gesprochen, da in der Zelle die Aminosäure in dissozierter Form (= Salzform) vorliegt. Wie auch Glutamin ist Glutamat ein wichtiger Amino-Gruppen Donor. Die Desaminierung von Glutamat führt zu alpha-Ketoglutarat (= 2-Oxoglutarat), einem Zwischenprodukt vom Zitratzyklus. Glutamat dient außerdem zur Aufnahme von Ammoniak, welcher anschließend durch eine Transaminierung in den Harnstoffzyklus abgegeben werden kann.
Detail am Rande:
- Glutamat hat durch seine Verwendung als Geschmacksverstärker einen sehr hohen Bekanntheitsgrad. Die Verwendung von Glutamat führt zu der Geschmacksempfindung "Umami". Bei Überempfindlichkeit führt eine vermehrte Aufnahme von Glutamat zu dem sogenannten China-Restaurantsyndrom.
| Kürzel | Glu, E | essentiell | nein |
| Summenformel | C5H9NO4 | Molare Masse | 147,13 g/mol |
| Seitenkette | sauer | isoelektrischer Punkt | 3,22 |
Glyzin[Bearbeiten]

Glyzin ist die einzige Aminosäure ohne optischen Zentrum, es existiert somit kein D- oder L-Glyzin. Sie ist die kleinste und einfachste Aminosäue. Glyzin wird auch als Geschmacksverstärker mit der Bezeichnung E 640 eingesetzt.
| Kürzel | Gly, G | essentiell | nein |
| Summenformel | C2H5NO2 | Molare Masse | 75,07 g/mol |
| Seitenkette | H* = hydrophil | isoelektrischer Punkt | 6,06 |
H*....Wasserstoff
Histidin[Bearbeiten]

Histidin ist die einzige Aminosäure mit erwähnenswerter Pufferkapazität. Histidin bildet außerdem Komplexe mit Schwermetallen, diese Eigenschaft wird vor allem bei dem Design von rekombinanten Proteinen berücksichtigt. Eine beliebte Methode um nach einer Fermentation das gesuchte Protein aus dem Gemenge aller möglichen biologischen Stoffen herauszubekommen, ist die Affinitätschromatographie. Eine dieser Affinitätschromatographiemethoden basiert auf der Adsorption von Histidin an Nickelharz.
| Kürzel | His, H | essentiell | für Kinder |
| Summenformel | C6H9N3O2 | Molare Masse | 155,16 g/mol |
| Seitenkette | basisch | isoelektrischer Punkt | 7,6 |
Isoleucin[Bearbeiten]
Isoleucin ist eine aliphatische Aminosäure. Das bedeutet, dass

| Kürzel | Ile, I | essentiell | ja |
| Summenformel | C6H13NO2 | Molare Masse | 131,17 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | 5,94 |
Leucin[Bearbeiten]

| Kürzel | Leu, L | essentiell | ja |
| Summenformel | C6H13NO2 | Molare Masse | 131,17 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | 6,01 |
Lysin[Bearbeiten]

| Kürzel | Lys, K | essentiell | ja |
| Summenformel | C6H14N2O2 | Molare Masse | 146,19 g/mol |
| Seitenkette | basisch | isoelektrischer Punkt | 9,74 |
Methionin[Bearbeiten]

| Kürzel | Met, M | essentiell | ja |
| Summenformel | C5H11NO2S | Molare Masse | 149,21 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | 5,74 |
Phenylalanin[Bearbeiten]

| Kürzel | Phe, F | essentiell | ja |
| Summenformel | C9H11NO2 | Molare Masse | 165,19 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | 5,49 |
Prolin[Bearbeiten]

Prolin ist eigentlich keine Aminosäure im engeren Sinn, sondern eigentlich eine zyklische Aminosäure. Aufgrund seiner geschlossenen Struktur hat Prolin einen bedeutenden Einfluss auf die räumliche Struktur von Proteinen. Sie ist sehr oft als "Brecher" von α-Helices zu finden. Die Synthese von Prolin geschieht in einem Seitenzweig des Harnstoffcyklus. Prolin ist des weiteren die Vorstufe von Hydroxyprolin. Hydroxyprolin wird unter Beteiligung von Vitamin C in Kollagen eingebaut und beeinflusst somit die mechanischen Eigenschaften von Bindegewebe.
| Kürzel | Pro, P | essentiell | nein |
| Summenformel | C5H9NO2 | Molare Masse | 115,13 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | 6,3 |
Pyrrolysin[Bearbeiten]

Pyrrolysin ist durch das UAG-Codon codiert. Das UAG-Codon ist im Normalfall ein Stop-Codon, d.h. wenn dieses Codon ausgelesen wird, wird die Synthese für das Protein beendet. Durch zusätzliche Faktoren wird dieser Abbruch verhindert und der Einbau von Pyrrolysin ermöglicht. Pyrrolysin wird von einigen Prokaryonten für Enzyme des Methanstoffwechsels verwendet.
| Kürzel | Pyl, O | essentiell | nein |
| Summenformel | C12H21N3O3 | Molare Masse | 255,3 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | ??? |
Selenocystein[Bearbeiten]

Selenocystein ähnelt in seiner Struktur den Aminosäuren Serin und Cystein. Es ist in einigen Enzymen im reaktiven Zentrum zu finden und dient dort des öfteren als Gegenstück zu Cystein (S-Se-Bindung, anstatt der S-S Disulfidbrücke bei Cystin). Wird Selenocystein durch Cystein ersetzt, kommt es oft zu einem drastischen Rückgang der Aktivität bzw. verlieren sie fast gänzlich ihre katalytische Aktivität [2]. Im Vergleich zu Cystein ist Selenocystein redoxaktiver. Selenocystein ist nicht in der Standardcodierung der DNA enthalten, es kann jedoch durch einen Vorgang namens Recodierung dennoch in bestimmten Fällen in die Aminosäuresequenz eingebaut werden. Hierbei wird das Stopcodon UGA auf der mRNA unter Verwendung zusätzlicher Faktoren für den Einbau dieser Aminosäure verwendet (mehr dazu in einem anderen Kapitel unter Recodierung) [1]. Selen wirkt bereits in geringen Konzentrationen giftig, daher ist dieser Syntheseweg stark kontrolliert. Selenocystein t-RNA wird z.B. nur dann gebildet wenn es auch im Zuge der Proteinsynthese verwendet wird.
| Kürzel | Sec, U | essentiell | nein |
| Summenformel | C3H7NO2Se | Molare Masse | 168,0 g/mol |
| Seitenkette | hydrophil | isoelektrischer Punkt | ??? |
Selenomethionin[Bearbeiten]

Selenomethionin wird als Analogon (=Ersatzstoff) für Methionin verwendet. Diese Aminosäure wird in der Röngtenstrukturanalyse eingesetzt, da Selen deutlich schwerer ist als Schwefel und eine bessere Sichtbarkeit bestimmter Strukturen ermöglicht.
Detail am Rande:
- Als Analogon bezeichnet man Stoffe mit gleicher biologischer Wirkung wie der Ausgangsstoff. Aufgrund ihrer ähnlichen Struktur oder Ladungsverteilung lösen diese Stoffe z.B. die gleichen Signalkaskaden aus oder werden an die selben Stellen anstatt des Orginalstoffes eingebaut. Sie werden vor allem in der pharmazeutischen Chemie eingesetzt.
| Kürzel | SeMet, MSE | essentiell | nein |
| Summenformel | C5H11NO2Se | Molare Masse | 196,1 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | ??? |
Serin[Bearbeiten]

Serin spielt vor allem in Enzymen eine wichtige Rolle. Es ist einerseits häufig im aktiven Zentrum anzufinden. Des Weiteren kann Serin phosphoryliert werden und dient aufgrund dieser Eigenschaft häufig als Ein- bzw. Ausschalter der Aktivität.
| Kürzel | Ser, S | essentiell | nein |
| Summenformel | C3H7NO3 | Molare Masse | 105,09 g/mol |
| Seitenkette | hydrophil | isoelektrischer Punkt | 5,68 |
Threonin[Bearbeiten]

Wie Serin kann auch Threonin an seiner Hydroxylgruppe phosphoryliert werden und dient somit häufig als Schalter für die biologische Aktivität von Enzymen. Threonin ist eine essentielle Aminosäure.
| Kürzel | Thr, T | essentiell | ja |
| Summenformel | C4H9NO3 | Molare Masse | 119,12 g/mol |
| Seitenkette | hydrophil | isoelektrischer Punkt | 5,60 |
Tryptophan[Bearbeiten]

Tryptophan ist eine Aminosäure mit aromatischer Struktur und kann vom menschlichen Körper selbst nicht gebildet werden (=essentiell). Neben seiner Bedeutung als Baustein für Proteine dient Tryptophan auch als Vorläufer für verschiedene Botenstoffe, wie Serotonin und Melatonin und als Provitamin für Vitamin B3.
Detail am Rande:
In der Aufreinigung von Proteinen wird vor allem die Adsorption von ultraviolettem Licht zur Bestimmung z.B.: des Elutionszeitpunktes, des Elutionsprofils, etc. verwendet. Die aromatische Ringstruktur von Tryptophan, Phenylalanin und Tyrosin sind besonders gut geeignet Licht der Wellenlängen von 260-280 nm zu adsorbieren.
| Kürzel | Trp, W | essentiell | ja |
| Summenformel | C11H12N2O2 | Molare Masse | 204,23 g/mol |
| Seitenkette | hydrophob, aromatisch | isoelektrischer Punkt | 5,89 |
Tyrosin[Bearbeiten]

Tyrosin adsorbiert wie auch Tryptophan und Phenylalanin Licht bestimmter Wellenlängen (siehe bei Tryptophan). Tyrosin kommt in den meisten Proteinen vor und dient als Ausgangssubstanz für die Biosynthese von Catecholaminen, Melanin und Thyroxin. Der Mensch und andere Säugetiere kann Tyrosin aus der essentiellen Aminosäure Phenylalanin synthetisieren. Tyrosin kann wie auch Serin und Threonin phosphorlyliert werden und kann somit die Aktivität von Enzymen verändern.
| Kürzel | Tyr, Y | essentiell | nein |
| Summenformel | C9H11NO3 | Molare Masse | 181,19 g/mol |
| Seitenkette | hydrophob, aromatisch | isoelektrischer Punkt | 5,64 |
Valin[Bearbeiten]

| Kürzel | Val, V | essentiell | ja |
| Summenformel | C5H11NO2 | Molare Masse | 117,15 g/mol |
| Seitenkette | hydrophob | isoelektrischer Punkt | 6,0 |
Zusammenfassung[Bearbeiten]
Die 23 proteinogenen Aminosäuren sind die grundlegenden Bausteine der Proteine. Sie besitzen eine COOH-Gruppe, eine NH2-Gruppe und einen Rest R auf dem C-Atom Nr.1. Aufgrund der COOH-Gruppe und der NH2-Gruppe sind Aminosäuen Zwitterionen. Der pH-Wert, bei dem die Summe der Ladung der Aminosäure Null beträgt, nennt man isoelektrischer Punkt. Die Eigenschaften der Aminosäure wirken sich auf die Eigenschaften von Proteinen aus. Hydrophile Aminosäuren sind vor allem an der Oberfläche von hydrophilen Proteinen wie z.B.: Enzyme zu finden, lipophile (=hydrophobe) Aminosäuren hingegen finden wir vor allem auf der Oberfläche von Membranproteinen (sind in einer Doppellipidmembran eingelagert). Aminosäuren mit funktionellen Gruppen bzw. Aminosäuren mit besonderen Eigenschaften sind vor allem im aktiven Zentrum von Enzymen zu finden. Die Seitenketten beeinflussen somit wesentlich enzymatische Reaktionen..
Literaturverweise[Bearbeiten]
- Axley M J, Böck A, Stadtman T C - Catalytic properties of an Escherichia coli formate dehydrogenase mutant in which sulfur replaces selenium. - Proc. Natl. Acad. Sci. USA (1991) 88: 8450-8454
- Roth E, Karner J, Ohlenschläger G - Glutamine: An anabolic effector? - J-Parent-Enter-Nutr (1990) 14: 130S - 6S
- Thanbichler M R - Der Translationsfaktor SelB. Mechanismus der UGA-Dekodierung und Funktion in der Regulation der Genexpression. - Dissertation, Fakultät für Biologie der Ludwig-Maximilians-Universität München (2002)


