Lehrbuch der Biochemie: Grundlagen: Physik
Wer einen Einstieg in die Biochemie sucht, mag versucht sein dieses Kapitel zu überspringen, aber die behandelten Themen sind von fundamentaler Bedeutung für eine genauere Betrachtung biochemischer Vorgänge, wie bald ersichtlich werden wird.
Es ist wichtig zu verstehen, dass die Naturwissenschaften und ihre Beschreibungen immer Modellcharakter haben. Mathematische Formelzeichen und ihre Bedeutung ergeben sich nicht als Eigenschaften der Natur, die die Menschheit "entdeckt" hat, sondern als möglichst präzise Beschreibung von reproduzierbaren Beobachtungen in der menschengemachten Sprache der Mathematik und der Logik. Jede naturwissenschaftliche Beschreibung ist ein Modell, das Atom ist keine Einfache Kugel, chemische Reaktionen laufen nicht vollständig ab und der Apfel fällt bei Berücksichtigung aller Parameter (Atmosphäre, Erdrotation) nur annähernd senkrecht vom Baum. Zur Beschreibung des Falls reicht aber in einem Modell oft trotzdem der rechte Winkel, oder die Kugel; man vernachlässigt also bei der Beschreibung immer bestimmte Faktoren. Mit der möglichst exakten Beschreibung beschäftigen sich Felder wie die Molekulare Modellierung, oder die Quantenchemie.
Die Physik wird hier nur sehr oberflächlich behandelt, für eine Vertiefung sei auf die Literaturliste am Ende des Kapitels verwiesen.
Dieses Kapitel ist aktuell in Bearbeitung, das heißt dass Abschnitte unvollständig, oder zum Teil auch noch sachlich falsch sein können (ich lerne selbst noch). Sollten Fehler auffallen, bitte eine Nachricht an mich, oder sich gleich als Co-Autor beteiligen. Danke :) - Nothingserious 10:30, 2. Okt. 2014 (CEST)
Wärmelehre[Bearbeiten]
Für ein Verständnis der Wärmelehre, oder Thermodynamik, muss man zuerst den Begriff des physikalischen Systems definieren. Ein abgeschlossenes physikalisches System ist eine Modellbetrachtung, bei der sich ein Raum vollständig von äußeren Einwirkungen abgrenzen lässt, also keinerlei Wechselwirkung zu anderen Systemen stattfindet. In der Biologie kommen bei genauer Betrachtung nur geschlossene und offene Systeme vor, ein abgeschlossenes System lässt sich bestenfalls näherungsweise erreichen.
Ein Schnellkochtopf ist zum Beispiel als geschlossenes System zu betrachten, da zwar ein Austausch von Energie in Form von Wärme, aber kein Austausch von Materie stattfindet; beim Erhitzen bildet sich Druck im Inneren aus, da das verdampfende Wasser nicht entweicht (kein mechanischer Austausch), der Topf wird aber auch von außen heiß (Energieaustausch). Entfernt man den Deckel, hat man ein offenes System, da mit der Umgebung jetzt auch ein mechanischer Austausch von Materie stattfindet. Der Austausch von Materie und Energie kann nur zwischen mehreren Systemen stattfinden, in diesem Beispiel wäre das zweite, geschlossene System die Küche. Die Thermodynamik beschäftigt sich mit der energetischen Zustandsänderung von Systemen. Der Zustand lässt sich durch Parameter wie den Druck p und die Temperatur T beschreiben.
Der erste Hauptsatz der Thermodynamik[Bearbeiten]
Nach dieser Einführung kann man den populären ersten Hauptsatz der Thermodynamik betrachten:
- Energie kann von einer Form in eine andere umgewandelt, aber weder erzeugt noch vernichtet werden.
Das bedeutet unter anderem, dass die Gesamtmenge der Energie im Universum, einem tatsächlich abgeschlossenem System, konstant ist. Es bedeutet aber auch, dass wenn aus einem System Energie in Form von Wärme oder Bewegungsenergie abgeführt wird, sie einem anderen System zugeführt werden muss. Mathematisch ausgedrückt:
Wobei U die innere, also "Gesamt"-Energie eines Systems ist, E die mechanische und Q die Wärmeenergie. Kühlt der Kochtopf ab, verringert sich seine innere Energie und erwärmt sich die Küche, da seine Wärmeenergie nicht vernichtet werden kann.
Enthalpie[Bearbeiten]
Als nächstes sehen wir uns genauer an, was Wärme- und mechanische Energie im Zusammenhang mit chemischen Reaktionen bedeuten. Ein anschauliches Beispiel ist ein Verbrennungsmotor: In seinem Inneren läuft eine chemische Reaktion ab, bei der Gase entstehen, die wiederum durch ihre Ausdehnung den Druck p im Brennraum erhöhen. Da der Kolben beweglich gestaltet ist, verändert sich das Volumen V, indem der Kolben nach oben schnellt, hierbei wird mechanische Arbeit W geleistet, bei der Energie von einem System auf ein anderes übertragen (also abgeführt, deshalb ein negatives Vorzeichen) wird. Die geleistete Arbeit bezeichnet man in dem Fall als Volumenarbeit, die sich ergibt aus:
Für ein ideales Gas, gilt, dass bei gleicher Temperatur und gleichem Druck die gleiche Anzahl von Molekülen pro Volumen vorliegt:
wobei R eine naturwissenschaftliche Konstante (allgemeine Gaskonstante) ist und n die Stoffmenge.
In einem abgeschlossenen, stabilen Gefäß wäre also die Volumenarbeit 0, da sich bei einer Explosion wie im Motor zwar der Druck erhöhen, aber das Volumen nicht ändern würde. In der Regel finden Reaktionen jedoch bei konstantem Druck (man hat sich hier auf 1013 mbar bei Raumbedingungen geeinigt) und bei veränderlichem Volumen statt. Zünde ich mein Benzin-Luft-Gemisch in einem Reagenzglas, ändert sich das Volumen, es wird Arbeit verrichtet. Gleichzeitig wird aber auch chemische Bindungsenergie aus den Benzin-Molekülen in Form von Wärme frei, die innere Energie U des Systems ändert sich. Um das auszudrücken, benutzt man die Größe der Enthalpie H. Sie hängt zusammen durch:
Dabei ist zu beachten, dass die Enthalpie einer Reaktion nicht von dem chemischen Reaktionsweg abhängt, über den das Produkt entsteht, sondern ausschließlich von Edukt und Produkt.
Zusammenfassend kann man sagen, dass die Enthalpie eine Größe ist, die die thermodynamische Zustandsänderung bei einer chemischen Reaktion angibt. Vereinfachend: Jede chemische Bindung enthält Energie, und die Enthalpie gibt Auskunft darüber, ob man Energie aufwenden muss, oder erhält, wenn man die Bindung in eine andere überführt, oder aufhebt.
Der zweite Hauptsatz der Thermodynamik[Bearbeiten]

Der erste Hauptsatz lässt sich bislang noch nicht allgemeiner formulieren, oder aus sonstigen Naturgesetzen herleiten, er ist eine axiomatische Beobachtung. Trotzdem ist er intuitiv recht gut zu erfassen (es sei denn man hat sich zum Ziel gesetzt, ein Perpetuum Mobile zu konstruieren). Der zweite Hauptsatz ist ebenfalls axiomatisch, und führt uns einen Schritt näher zu den Schlussfolgerungen, die für die Biochemie interessant sind. Er lässt sich wie folgt formulieren:
- Ein System ist bestrebt, seine Unordnung zu vergrößern.

Wer seinen Schreibtisch regelmäßig benutzt, wird dies bestätigen können. Die Aussage lässt sich aber auch quantifizieren, indem man die Größe der Entropie S einführt. Sie ist ein Maß für die Ordnung, die einem System innewohnt. Veranschaulichen lässt sich dies gut an obiger Grafik. Hat man einen geschlossenen Behälter, der in der Mitte geteilt ist, und füllt in beide Hälften verschiedene Gase, wird sich bei Entfernung der Trennung ein Gemisch aus beiden Gasen bilden. In dem ersten, abgetrennten Zustand ist die Ordnung des Systems größer, im zweiten kleiner. Die Entropie nimmt zu, da sie ein Maß für die Unordnung des Systems ist. Ein anderes beliebtes Beispiel ist die Kaffeetasse, die vom Tisch fällt. Der Aufwand, die Tasse herzustellen ist größer, als sie zu zerstören, und sie wird sich nicht von selbst wieder zusammenfügen, ihre Entropie hat beim Auftreffen zugenommen. Die Entropie ist von dem ersten Hauptsatz und der Enthalpie unabhängig; eine Änderung der Entropie sagt nichts über die Änderung von innerer Energie oder Enthalpie aus.
Dieses Konzept mag beim Einstieg schwer zu fassen sein, aber je mehr man sich mit Naturwissenschaft beschäftigt, umso einleuchtender und selbstverständlicher wird es. Wer sich näher für die Implikationen interessiert, dem seien die Wikipedia-Artikel zur Zeit und zur Entropie empfohlen.
Freie Enthalpie[Bearbeiten]
Was hat die Thermodynamik mit der Biologie zu tun? Die Antwort darauf ist die freie Enthalpie. Die Enthalpie und der erste Hauptsatz machen keine Aussage darüber, in welche Richtung eine Reaktion abläuft, und der zweite Hauptsatz besagt, dass die Unordnung bestrebt ist zuzunehmen. Wie können aber dann komplexe Organismen wie Säugetiere, wie können selbst einfachste geordnete Stoffe wie ein Blatt Papier Bestand haben? Die Antwort erhält man, wenn man die beiden Hauptsätze in Verbindung bringt, und das geschieht über die freie Enthalpie G. Sie ist definiert als:
Mit ihr lässt sich eine Aussage darüber Treffen, ob Prozesse, in unserem Fall biochemische Reaktionen, "freiwillig", also spontan ablaufen, oder nicht. Genau wie die Enthalpie H ist auch diese Größe unabhängig von dem Weg, auf dem die Zustände eingenommen werden, sie hängt nur von der Art der Edukte und Produkte ab. Allgemein lässt sich sagen:
- ist findet die Reaktion von selbst statt
- ist findet keine Reaktion statt, das System befindet sich im Gleichgewicht
- ist findet die Reaktion nicht von selbst statt
Die Größe der freien Enthalpie wird uns beim Studium der Biochemie immer wieder begegnen, mit ihr lässt sich letztlich jede einzelne Reaktion begründen, die im menschlichen Körper und in der Biologie allgemein abläuft. Jedes Mal wenn man sich die Frage stellt: "Warum läuft diese Reaktion über diesen komplizierten Umweg ab?" sollte man sich an ΔG erinnern.
Weiter lässt sich hierzu noch sagen, dass Chemiker und Physiker von anderen Bedingungen ausgehen als man in der Biochemie vorfindet, deshalb hat man sich für biochemische Reaktionen darauf geeinigt, für die Ermittlung der freien Enthalpie als Umgebungsbedingungen "physiologische Bedingungen" einzuführen, also einen pH-Wert von 7 und eine Temperatur von 37°C, die sogenannte freie Standardenthalpie bei physiologischen Bedingungen ΔG°’.
Atommodell[Bearbeiten]
Dem heutigen Menschen ist die Vorstellung, dass die Welt (und alles drumherum) aus kleinsten, unteilbaren Teilchen zusammengesetzt ist, eine Selbstverständlichkeit. Doch der Weg hin zum ersten Atommodell (von griechisch átomos‚ unteilbar), und seitdem zum aktuellen Teilchenmodell der Physik ist häufigen Revisionen unterworfen. Vor allem in der ersten Hälfte des 20. Jahrhunderts mussten viele vorher schon etablierte Vorstellungen mit Aufkommen der Quantentheorie überdacht werden. Die Idee eines unteilbar kleinsten Teilchens geht zurück bis in die Antike, bei der die zugrunde liegende philosophische Frage ist: "Was passiert eigentlich, wenn ich ein Stück stoffliche Materie in immer kleinere Teile trenne?". Der Zugang zu einer exakten Antwort ergibt sich erst durch moderne Analysemethoden.
Grundsätzlich bedeutsam ist die schon vorher bekannte Tatsache, dass Atome aus betraglich äquivalenten positiven (Protonen, P) und negativen (Elektronen, e-) Ladungen bestehen, und sich die negativen Ladungen vergleichsweise leicht trennen lassen. Hier soll ein kurzer Abriss der Geschichte seit dem 20. Jahrhundert und des aktuellen Modells gegeben werden. Für eine detailliertere zeitliche Übersicht siehe Liste der Atommodelle.
Rutherford'sches Atommodell[Bearbeiten]

Nachdem vorherige Postulate zur Unteilbarkeit der Materie durch chemische und physikalische Forschung im 18. und 19. Jhdt. als bestätigt angesehen werden mussten, wurde durch den Rutherford'schen Streuversuch 1909 deutlich, dass das Verhältnis von tatsächlicher Materie zu leerem Raum in einem einzelnen Atom unvermutet klein sein muss. Der Versuch besteht darin, dass eine extrem dünne Schicht von Goldatomen (Goldfolie) mit Helium-Atomkernen (He2+) beschossen wird. Hinter der Folie befindet sich ein einfacher, kreisförmig angeordneter Detektor in Form eines Leuchtschirms, der das durch die Goldfolie hindurchtretende He2+ sichtbar macht. Die bahnbrechende Erkenntnis bestand darin, dass der weitaus größte Teil des He2+ ungehindert durch die geschlossene Goldfolie hindurchtreten konnte, während nur ein kleiner Teil abgelenkt oder zurückgeworfen wurde. Die naheliegende Erklärung für dieses Ergebnis ist, dass ein Großteil eines jeden Atoms nicht von Materie ausgefüllt ist. Jedes Atom nimmt also erheblich mehr Raum ein, als seine Bestandteile zusammengenommen ergeben würden. Anschaulich (nicht exakt!) ist das Größenverhältnis von Kern zu Elektronen etwa das von einem Fußball am Anstoßpunkt zu einem Stecknadelkopf auf dem Parkplatz vor dem Stadium. Fußball und Stecknadelkopf machen das Atom aus, der Zwischenraum ist leer.
Bohr'sches Atommodell[Bearbeiten]

Die Frage die als nächstes geklärt wurde, ist die nach den räumlichen Verhältnissen im Atom. Wenn sich der Kern am Mittelpunkt befindet, wie lässt sich dann bestimmen, wo sich das Elektron gerade aufhält. Die Neuerungen die das Bohr'sche Atommodell beinhaltet, stellen den ersten Schritt von der klassischen Physik zur Quantenphysik dar. Um die Beobachtungen des Streuversuchs in Einklang mit tatsächlichen Versuchsergebnissen zu bringen, stellte Nils Bohr 1913 folgende Theorie auf: Elektronen bewegen sich in fest definierten Bahnen um den Kern, und verlassen diese nur, um andere fest definierte Bahnen anzunehmen; sie sind also quantisiert.
Dieses Modell erhält seinen besonderen Reiz dadurch, dass eine Abbildung dieses Modells der Physik im Großen, also den Bewegungen von Planeten, Sternen und Galaxien im Wesentlichen entspricht. Das Elektron umkreist seinen Kern so, wie die Planeten einen Stern. Durch das Postulat von vordefinierten Bahnen unterscheidet es sich jedoch von der klassischen Physik dadurch, dass die Elektronen nur gequantelte Zustände einnehmen können, also Bahn 1 oder Bahn 2, keinen Zustand dazwischen. Wird ein Elektron auf eine höhere oder tiefere Bahn befördert, wird Energie aufgenommen oder freigesetzt. Diese Betrachtung ist in der Lage, eine Vielzahl von Phänomenen zu erklären, zum Beispiel Spektrallinien: Wird ein Elektron eines bestimmten Elements von einer Bahn auf eine andere befördert, wird Energie in Form von Licht, also Photonen freigesetzt, oder aufgenommen. Diese Energie ist, ebenso wie die Elektronenbahnen, gequantelt, kann also nur definierte Beträge annehmen. Ein einfacher, im Grunde auch zu Hause (mit Gasflamme und ungefährlichen Na-, K-, oder Cu-Salzen aus der Apotheke) nachvollziehbarer Versuch hierzu ist die Flammenfärbung zum Nachweis einiger Elemente. In der Grafik rechts wird ein Elektron durch ein Lichtquant in eine energetisch höhere Bahn "gehoben" und gibt beim "fallen" dieses Lichtquant wieder ab.
Orbitalmodell[Bearbeiten]
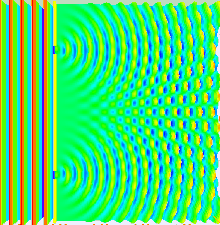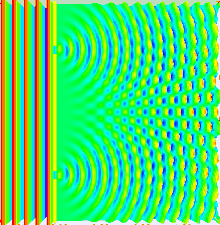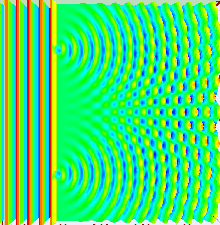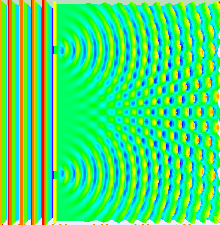
Das Bohr'sche Atommodell liefert ein einfaches, zweidimensionales Modell von der Natur des Atoms. Das Orbitalmodell führt zwei neue Schritte ein: Erstens die dreidimensionale Betrachtung des Atoms, und zweitens eine genauere Bestimmung der Aufenthaltswarscheinlichkeit des Elektrons. Beide Schritte gehen Hand in Hand, und basieren auf Resultaten aus dem Doppelspaltexperiment, durch das ursprünglich die Welleneigenschaft des Lichts (oder, wie wir heute wissen, elektromagnetischer Strahlung allgemein) nachgewiesen werden konnte. Lässt man Licht einen Doppelspalt passieren, dessen Spalte im Bereich der Wellenlänge des Lichts dimensioniert sind, zeigt sich auf einem Detektorschirm, dass das Ergebnisse dieselben Interferenzmuster zeigt wie durch die klassische Mechanik beschriebene Wellen (u.a. Wasser-, Schallwellen). Geht man nun von einer Teilchen-, oder "materiellen" Natur von Materie aus, sollten sich Elektronen in ihrem Verhalten klar von Lichtwellen unterscheiden. Beschießt man jedoch einen Doppelspalt mit Elektronen, zeigt ein Detektorschirm ebenfalls ein Interferenzmuster!
Die Eigenschaften des Lichts[Bearbeiten]
Licht als elektromagnetische Strahlung[Bearbeiten]

Sowohl das sichtbare (VISible) Licht, als auch ultraviolettes (UV) und infrarotes (IR) Licht lassen sich als ein Ausschnitt aus dem Spektrum elektromagnetischer Strahlung begreifen. Das besondere an sichtbarem Licht gegenüber anderen Arten von Strahlung, wie Röntgenstrahlung oder Radiowellen, ist die Wahrnehmbarkeit durch das menschliche Auge. Die beiden für biochemische Anwendungen hauptsächlich interessanten Eigenschaften des Lichts sind seine Wellenlänge λ, sowie seine Intensität I. Als elektromagnetische Strahlung entsteht bei Auftreffen von Licht auf verschiedene Oberflächen eine physikalische oder auch chemische Wechselwirkung, zum Beispiel Beugung (Diffraktion) oder Fluoreszenz. Der bedeutende Punkt daran ist, dass die Möglichkeit besteht, chemische Zusammenhänge mit Hilfe von Licht zu analysieren, oder zu beeinflussen. Darauf wird im Kapitel Methoden näher eingegangen werden.
Lichtspektren[Bearbeiten]
Das Spektrum des sichtbaren Lichts umfasst den Wellenlängenbereich von etwa 380 - 780 Nanometer (nm). Verschiedene Wellenlängen in diesem Bereich werden vom Auge als verschiedene Farben wahrgenommen, z.B. erscheint Licht bei 560 - 580 nm gelb und bei 420 - 480 nm blau. Licht einer einzigen Wellenlänge nennt man monochromatisch, Licht setzt sich jedoch meist aus mehreren Wellenlängen zusammen, dies nennt man polychromatisch.
Absorption, Extinktion[Bearbeiten]


In Flüssigkeit suspendierte oder gelöste Teilchen haben in vielen Fällen die Eigenschaft, Licht zu absorbieren, welches durch die Flüssigkeit geleitet wird. Diesen Effekt macht man sich in der Analytik zunutze, da in einem gewissen Rahmen die Absorption proportional zur gelösten Stoffmenge pro Volumen ist. An einem einfachen Photometer wird Licht einer einstellbaren Wellenlänge durch ein definiertes Probevolumen geleitet. Gemessen wird die Transmission T als Quotient aus der eingestrahlten Intensität I und der austretenden Intensität I0:
Die Intensität hängt ab von der Distanz d, die das Licht durch das Medium zurücklegen muss, der Konzentration des Stoffes in Lösung c, und der stoffspezifischen Größe des Extinktionskoeffizienten ελ bei der verwendeten Wellenlänge.
Um die Transmission linear auswerten zu können, wird normalerweise die Extinktion E verwendet, die der negative dekadische Logaritmus der Transmission ist:
Um in der Analytik eine größtmögliche Auflösung zu erreichen ist es wünschenswert, die Wellenlänge zu verwenden, bei der der zu untersuchende Stoff den größten Extinktionskoeffizienten hat. Für die meisten Stoffe findet man Literaturwerte, ansonsten kann man die Wellenlänge bei der das Absorptionsmaximum auftritt selbst wie in nebenstehender Grafik ermitteln. Zusätzlich muss eine Verdünnung angesetzt werden, wenn die Extinktion größer als 1 wird, da sonst keine genügende Proportionalität mehr gegeben ist. Mithilfe einer Kalibrierkurve, bei der eine Lösung mit bekannter Konzentration verwendet wird, ist dann die quantitative Bestimmung des gesuchten Stoffs durch grafische oder rechnerische Auswertung möglich.
Das Thema Photometrie wird in Methoden noch einmal aufgegriffen werden.
Fluoreszenz[Bearbeiten]
Literatur[Bearbeiten]
- Joachim Grehn, Joachim Krause: Metzler Physik. Schroedel, Hannover 2007, ISBN 978-3507107106.
- Charles E. Mortimer, Ulrich Müller: Chemie - Das Basiswissen der Chemie. Thieme, Stuttgart 2014, ISBN 978-3134843118.










