Medizinische Mikrobiologie: Immunologie
Einleitung[Bearbeiten]
Das Immunsystem (von lat.: immunis = frei, verschont, unberührt) ist ein komplexes System des Körpers zur Abwehr von Mikroorganismen und Vernichtung fehlerhafter Zellen, um so Gefahren für den Körper abzuwenden. Neben einem angeborenen Immunsystem, welches eine unspezifische Abwehr gegen Schadfaktoren darstellt, gibt es ein erworbenes Immunsystem (auch adaptives Immunsystem genannt), welches spezifische Mechanismen der Abwehr zur Verfügung stellt. In vivo arbeiten beide Systeme Hand in Hand und ergänzen sich gegenseitig.
Lebewesen müssen sich ständig mit Einflüssen aus der belebten Umwelt auseinandersetzen, einige davon stellen eine Bedrohung für die körperliche Unversehrtheit dar. In den Körper eindringende Mikroorganismen können zu Funktionsstörungen, Krankheiten und Tod führen. Typische Krankheitserreger sind Bakterien, Viren und pathogene Pilze, sowie ein- und mehrzellige Parasiten (z.B. Protozoen wie Plasmodien oder Bandwürmer).
Auch Veränderungen im Inneren des Körpers können die Existenz bedrohen: Wenn mutierte, dysplastische Körperzellen der Apoptose entgehen, können sie der Ausgangspunkt von Krebserkrankungen werden.
Ob nach einer Infektion eine Erkrankung auftritt, hängt vom komplexen Wechselspiel des Immunsystems mit dem (ungebetenen) Gast ab. Eine Rolle spielen etwa die Menge der eingebrachten Erreger und deren krankmachenden Eigenschaften (Virulenz), sowie der Zustand des Immunsystems der betroffenen Person - So kann durch vorherigen Kontakt mit dem Erreger bereits eine Immunität bestehen, die Erregerdosis oder -virulenz für einen Krankheitsausbruch zu gering sein oder der Kampf zwischen Immunsystem und Infektionserreger schlägt keine großen Wellen [inapparente/subklinische Infektion oder stille Feiung (Immunisierung ohne Impfung oder Erkrankung)]. Bei intaktem Immunsystem und geringer Erregerdosis kann also eine Erkrankung wie beispielsweise eine Erkältung entweder überhaupt nicht ausbrechen oder einen weniger schweren Verlauf nehmen. In der Tat versuchen tagtäglich tausende von Organismen in der Körper einzudringen, die vom Immunsystem daran gehindert werden.
Die wichtigste Fähigkeit des Immunsystems besteht darin "Eigen" und "Fremd" (inklusive Krankheitserreger und Krebszellen) zu unterscheiden und Fremdes zu bekämpfen. Dafür steht dem Körper ein höchst effektives System zur Verfügung, an dem viele Arten von Zellen und biochemischen Molekülen beteiligt sind.
Lymphatische Organe[Bearbeiten]
Das Knochenmark[Bearbeiten]

Die Blutbildung in der ersten Embryonalperiode findet im Dottersack statt und wird dann zunehmend in die Leber und Milz verlagert (Fetalperiode). Das rote Knochenmark ist nach dem 3. Lebensmonat der alleinige Ort der Blutbildung (Hämatopoese). Aus den Knochenmarksstammzellen gehen alle Blutzellen (Leukozyten, Erythrozyten, Thrombozyten) hervor.
Das Lymphsystem[Bearbeiten]
Zum Lymphsystem gehören vor allem die Lymphknoten und Lymphbahnen. Die meisten Abwehrzellen zirkulieren regelmäßig zwischen dem Blutkreislauf und dem Lymphsystem, welches am linken und rechten Angulus venosus mit der Vena jugularis interna in die Vena subclavia einmündet. In den Lymphknoten findet der wichtige Prozess der Antigenpräsentation und der klonalen Expansion statt. Die Antigene werden aus dem Gewebe über die blind beginnenden Lymphgefäße in die Lymphknoten transportiert. Weitere Aufgaben des Lymphsystem sind der Abtransport von interstitieller Flüssigkeit, die nicht in den venösen Kapillarschenkel zurück diffundiert (ca. 2l pro Tag) sowie der Abtransport von Nahrungslipiden und fettlöslichen Vitaminen (Chylomikronen) aus dem Darmtrakt.
Die Milz[Bearbeiten]
Die Milz gehört beim Erwachsenen zu den sekundären Immunorganen. Das retikuloendotheliale System aus Phagozyten filtert in den den Milzsinus defekte Erythrozyten (Blutmauserung) und (besonders bekapselte) Krankheitserreger heraus und baut diese ab.
Wird die Milz entfernt, so sind Impfungen gegen Pneumokokken und Haemophilus influenzae B dringend anzuraten.
Gaumen- und Rachenmandeln[Bearbeiten]
Die Gaumenmandeln (Tonsillae phyrengeae), Rachenmandel (Tonsilla palatina) und Zungenmandel (Tonsilla lingualis) gehören ebenfalls zu den lymphatischen Geweben und bilden zusammen mit den zahlreichen Lymphfollikeln der Rachenhinterwand den Waldeyer Rachenring. Dieser ist vor allem für die Abwehr von Krankheitserregern zuständig, die über Mund und Nase aufgenommen werden.
Der Thymus[Bearbeiten]
Der Thymus sitzt retrosternal dem Herzbeutel auf. Er ist bei Säuglingen und Kleinkindern im Verhältnis viel größer als bei Erwachsenen und dient der Entwicklung und Reifung von T-Lymphozyten. Gemeinsam mit dem Knochenmark zählt der Thymus zu den primären lymphatischen Organen.
Disseminiertes lymphatisches System[Bearbeiten]
In praktisch jedem Organ finden sich mehr oder weniger lokalisiert Abwehrzellen, die sich meist von Makrophagen (Monozyten-Makrophagen-System, MMS) ableiten. Hierzu gehören z.B. die "Kupffer'schen Sternzellen" der Leber.
Haut- und Schleimhaut-assoziierte Lymphgewebe[Bearbeiten]
Besonders ausgeprägt ist eine Ansammlung von Lymphgeweben im Bereich der inneren (mucosa-associated-lymphatic-tissue, MALT) und äußeren Körperoberflächen, wo sich Innen- und Außenwelt treffen (Magendarmtrakt, Atemwege usw. zählen dabei zur Außenwelt). Dazu gehört das gut-associated-lymphatic-tissue (GALT) des Dünndarms, das sich weiter distal im Ileum zu den "Peyer'schen Plaques" gruppiert. Auch der Appendix gehört dazu. Weitere Beispiele sind das bronchus- (BALT) und das skin- (SALT) associated lymphoid tissue.
Das Blut[Bearbeiten]
Auch das Blut mit den zirkulierenden Immunozyten, Antikörpern und dem Komplementsystem kann dem Immunsystem zugeordnet werden.
Leukozyten - Die zellulären Bestandteile des Immunsystem[Bearbeiten]

Leukozyten bilden das Gros der zellulären spezifischen (T-Lymphozyten), der unspezifischen (Granulozyten, Makrophagen), sowie der humoralen spezifischen Abwehr (Immunglobulin-bildende B-Zellen). Daneben sollen auch Thrombozyten eine geringe immunologische Aktivität entfalten.
Eigenschaften: Leukozyten verfügen je nach ihrer Art über unterschiedliche Gestalt und verschiedenen Aufbau. Die Größe der Leukozyten schwankt zwischen 7µm bei Lymphozyten und 20µm bei Monozyten. Im Ggs. zu Erythrozyten und Thrombozyten enthalten sie einen Zellkern. Die Lebensdauer reicht von wenigen Tagen bis zu mehreren Monaten. Leukozyten sind amöboid beweglich und können aktiv aus dem Blut in die verschiedenen Gewebe einwandern.
Bildung: Die Leukopoese findet beim Erwachsenen vorwiegend im roten Knochenmark der platten Knochen (Brustbein und dem Becken), bei Kindern auch in den Epiphysen langer Röhrenknochen statt. Ursprung aller Blutzellen sind die pluripotenten Knochenmarksstammzellen. Bei ihrer Teilung entstehen keine identischen Tochterzellen, sondern jeweils eine neue pluripotente Stammzelle und eine determinierte Stammzelle (Vorläuferzelle einer Blutzellreihe), welche anschließend weiter heranreift. Leukozyten differenzieren sich über zahlreiche Zwischenstufen zu den mehr oder weniger fertigen Zellen. Die endgültige Prägung der Lymphozyten erfolgt im lymphatischen System. Gesteuert wird die Leukopoese durch zahlreiche Zytokine, z.B. verschiedene colony stimulating factors (CSF), die z.T. auch therapeutisch verabreicht werden können.
Funktionen: Die einzelnen Untergruppen der Leukozyten übernehmen verschiedene Aufgaben innerhalb des Immunsystems von der Phagozytose, über die Markierung von Antigenen bis zur Bekämpfung von körpereigenen und körperfremden Zellen und Krebszellen. Neutrophile Granulozyten und Makrophagen zum Beispiel sind als Bestandteil der unspezifischen Abwehr zur Phagozytose fähig. Dabei nehmen sie Fremdmaterial auf und machen es mit Hilfe lysosomaler Enzyme unschädlich. B-Lymphozyten produzieren nach geeigneter Stimulation speziell gegen bestimmte Erreger oder schädigende Stoffe gerichtete Antikörper. Sie gehören somit zur spezifischen Abwehr. T-Lymphozyten dienen unter anderem der Koordination zwischen spezifischer und unspezifischer Abwehr. Auch an Entzündungen sind Leukozyten immer beteiligt, die sie durch Mediatoren wie Zytokine und Leukotriene aufrecht halten, modulieren oder beenden. Leukozyten spielen ausserdem eine wesentliche Rolle bei allen Autoimmunkrankheiten.
Morphologie der Leukozyten: Es gibt zahlreiche Möglichkeiten, die unterschiedlichen Leukozytenarten zu kategorisieren. Beispielsweise nach Bau und Zugehörigkeit. Hier einige Beispiele:
- Die oberflächlichste Einteilung wäre die Unterteilung in Granulozyten und Agranulozyten:
| Granulozyten | Agranulozyten |
|---|---|
| haben unregelmäßig gelappte Zellkerne und kleine Partikel im Cytoplasma |
besitzen rundliche oder bohnenförmige Zellkerne und keine Partikel im Zytoplasma |
| - Granulozyten | - Monozyten - Dendritische Zellen - Mastzellen - Lymphozyten |
- Aufgrund ihrer Abstammung und Farbe in der Pappenheim-Färbung können sie wie folgt unterschieden werden. Alle Zellen der lymphatischen Reihe gehen auf lymphatische Vorläuferzellen zurück, die der myeloiden Reihe entwickeln sich aus myeloiden Vorläuferzellen.
| lymphatische Reihe | myeloide Reihe |
|---|---|
| Lymphozyten | Monozyten Dendritische Zellen Mastzellen Granulozyten |
- Lymphozyten und Granulozyten werden in weitere Zelltypen unterteilt:
| Lymphozyten | Granulozyten |
|---|---|
| B-Lymphozyten T-Lymphozyten NK-Zellen |
- Neutrophile Granulozyten - Eosinophile Granulozyten - Basophile Granulozyten |
Durch die Bestimmung der charakteristischen Expressionsmuster an CD-Oberflächenmolekülen (cluster of differentiation) und der Enzymaustattung können alle Leukozyten (und entsprechend differenzierte Tumorzellen) in die hämatopoetische Reihe eingeordnet werden. Bsp.:
- Stammzelle: CD 34
- Myeloische Zellinie:
- Myeloische Vorstufen: CD 13, CD 33, CD 34, CD 41
- Granulozyten und Vorstufen (Blasten):
- MPO (Myeloperoxidase)
- CAE (Chlorazetatesterase) - Granulozyten vom frühen Promyelocyten bis zum reifen Neutrophilen:
- Monozyten und Megakaryozyten in allen Stadien: ANAE (alpha-Naphtylacetatesterase)
- Makrophagen: CD68
- Lymphozytenlinie:
- T-Zelle: CD 3, CD 5
- CD 4 - T-Helferzellen
- CD 8 - Zytotoxische T-Zellen
- B-Zelle:
- CD 10 - mittleres Reifestadien der B-Lymphozyten
- CD 19 - alle B-Zellen
- CD 20 - frühe B-Zellen
- CD 23 - B-Lymphozyten, dendritische Zellen
- CD 79a
- T-Zelle: CD 3, CD 5
- Myeloische Zellinie:
Funktionen der einzelnen Leukozyten im Überblick
| Immunzellen | Aufgabe und Funktion |
|---|---|
| Monozyten | Vorläufer der Makrophagen |
| Makrophagen | Phagozytose |
| Mastzellen | Freisetzung von Histamin |
| Antigenpräsentierende Zellen (z. B. Makrophagen, B-Zellen und Langerhanszellen) |
APZ phagozytieren Fremdantigen, zerlegen es in Oligopeptide und präsentieren es über MHC-II-Moleküle z.B. an T-Lymphozyten und leiten damit die Immunantwort ein. |
| Granulozyten | |
| Neutrophile Granulozyten | Phagozytose (Eiterbildung) |
| Eosinophile Granulozyten | Abwehr von Parasiten, allergische Reaktionen |
| Basophile Granulozyten | Abwehr von Parasiten, Auslösen allergischer Reaktionen, Entzündungsreaktionen |
| B-Zell-Gruppe | |
| B-Lymphozyten | Vorläufer der Plasmazellen im Blut |
| Plasmazellen | Antikörperproduktion |
| B-Gedächtniszellen | Langlebige B-Zellen mit einem Gedächtnis für spezielle Antigene |
| T-Zell-Gruppe | |
| T-Helferzellen | Aktivieren Plasmazellen und Killerzellen Erkennen Antigene auf den APZ |
| T-Supressorzellen | Bremsen die Immunantwort, hemmen die Funktion der B-Zellen und anderer T- Zellen |
| T-Gedächtniszellen | Langlebige T-Zellen mit einem Gedächtnis für spezielle Antigene |
| T-Killerzellen (zytotoxische T-Zellen) | Erkennen und zerstören von Viren befallene Körperzellen und Tumorzellen indem sie auf bestimmte Antigene der befallenen Zellen reagieren |
| Killerzellen | |
| Natürliche Killerzellen (NK) | Greifen unspezifisch virenbefallene und Tumorzellen an |
Bindung der Leukozyten an die Blutgefäße: Kommt es in einem Gewebe zum erregereintritt und zur Entzündung so produzieren ortsständige Immunzellen Zytokine, die die Endothelzellen der Blutgefäße dazu anregen, spezielle Adhäsionsmoleküle zu exprimieren. Die Leukozyten rollen normalerweise an den Endothlien entlang. Kommen sie mit solchen Signalstrukturen in Kontakt, werden sie aktiviert, heften sich an und beginnen zwischen den Endothelzellen hindurch in das Gewebe einzudringen (Leukodiapedese) um an den Ort der Entzündung zu gelangen. Im Rahmen der Entzündung zerstörte mikrobielle Bestandteile werden mit der Lymphe in die regionäen Lymphknoten abtransportiert und dort über MHC-II-Moleküle an Lymphozyten präsentiert. B-Lymphozyten erkennen dabei Antigene über membranständige Antikörper, T-Lymphozyten "tasten" mit speziellen T-Zell-Rezeptoren. Dabei kommt es zur Interaktion zwischen APZ, B-Zellen und T-Zellen wie den CD4-positiven T-Helferzellen. Die "scharf gemachten" Zellen der spezifischen Abwehr gelangen danach über das Lymphystem ins Blut und von dort wieder an den Ort der Entzündung.
Zahlen und Werte:
Normalwerte
| Normalwerte | alte Einheit | SI-Einheit |
|---|---|---|
| Erwachsene | 4.000 - 10.000/µl | 4 - 10 x 109/l |
| Schulkinder | 5.000 - 15.000/µl | 5 - 15 x 109/l |
| Kleinkinder | 6.000 - 17.500/µl | 6 - 17,5 x 109/l |
| Neugeborene | 9.000 - 30.000/µl | 9 - 30 x 109/l |
Zum Vergleich: Erythrozyten: ca. 4-5.000.000/µl (Auf siebenhundert rote Blutkörperchen kommt unter normalen Bedingungen etwa ein weißes Blutkörperchen), Thrombozyten: ca. 150.000-300.000/µl.
Prozentualer Anteil der Untergruppen an der Gesamtzahl der Leukozyten im Organismus (Differentialblutbild)
| Immunzellen | Anteil in % |
|---|---|
| Monozyten | 2 – 8 |
| Lymphozyten | 20 - 45 |
| Neutrophile Granulozyten segmentkernig | 50 - 70 |
| Neutrophile Granulozyten stabkernig | 3 - 5 |
| Eosinophile Granulozyten | 2 - 4 |
| Basophile Granulozyten | 0 - 1 |
Granulozyten[Bearbeiten]
Granulozyten machen ca. 60% aller Leukozyten aus. Ihre Lebensdauer beträgt 2-3 Tage. Der Abbau der Granulozyten erfolgt im mononukleären Phagozytosesystem (MPS=MMP). Sie können die Blutbahn verlassen und ins Gewebe einwandern. Ihre Funktion liegt vor allem in der unspezifischen Abwehr (angeborenen Immunantwort) von Bakterien, Parasiten und Pilzen.
Es gibt neutrophile, basophile und eosinophile Granulozyten, die je nach Färbeverhalten des Protoplasma beschrieben und unterteilt werden. Sie haben jeweils unterschiedliche Funktionen (s.u.).
Das Monozyten-Makrophagen-System (MMS)[Bearbeiten]
Monozyten sind mit einem Durchmesser von 12 - 25 μm die größten Zellen im Blut. Sie sind Bestandteil des Immunsystems und Vorläufer u. a. der Makrophagen.
Nach ihrer Entstehung im blutbildenden roten Knochenmark gelangen sie über das Blut in verschiedene Organe und wandeln sich dort je nach Gewebe in die entsprechenden Zellen des mononukleären Phagozytosesystems (MPS, = MMS (Monozyten-Makrophagen-System) = RES (Retikulo-Endotheliales System) = früherer Ausdruck RHS (Retikulo-Histiozytäres System) um. Dies sind:
- Makrophagen der meisten Gewebe
- Alveolarmakrophagen der Lunge
- Kupffer-Stern-Zellen der Leber
- Langerhans-Zellen der Haut
- Mikroglia des ZNS
- Osteo- und Chondroklasten von Knochen und Knorpel
- A-Synovialozyt der Gelenkkapsel
Die Aufgaben der Zellen des mononukleären Phagozytosesystems ist die Aufnahme (Phagozytose) von Fremdmaterial und Krankheitserregern sowie die Antigenpräsentation des prozessierten aufgenommenen Materials gegenüber T-Lymphozyten. Osteo- und Chondroklasten als Makrophagenabkömmlinge phagozytieren intaktes körpereigenes Material im Rahmen des normalen Knochenstoffwechsels bzw. der chondrogenen Ossifikation (Knochenbildung über eine Knorpelmatritze).
Etwa 8% der zirkulierenden Blutmonozyten entsprechen einem Phänotyp, der Makrophagen ähnelt. Er besitzt neben den Oberflächenantigenen CD14 und CD86 neu das CD16 Antigen, ein niedrig-affiner Fc-Gamma-III Rezeptor, der eng mit der Phagozytose in Verbindung steht.
Das CD14 Molekül ist das entscheidende Ziel-und Effektormolekül in der Erkennung von Bakterien und fungiert als sogenannter Endotoxinrezeptor. Endotoxine sind pathogener Bestandteil Gram-negativer Bakterien (z.B. E. coli, Klebsiellen, Pseudomonas aeruginosa). Über das monozytäre CD14 werden aber auch Gram-positive Bakterien (über Lipoteichonsäure, Proteoglykane) gebunden. Die Bindung aktiviert das CD14 Molekül auf der Monozytenoberfläche und verursacht im Zellinneren die vermehrte Synthese und schließlich die Freisetzung proinflammatorischer Mediatoren wie Interleukin 1ß, Interleukin 6, Tumor-Nekrose-Faktor.
CD14+ und CD16+ Monoyzten sind als Vorstufen von Makrophagen auf dem Weg in ein "Zielgewebe", z.B. um dort Cholesterin (in den Gefäßen) abzubauen, oder Erreger (Bakterien, Pilze) abzutöten. Zusätzlich exprimieren diese „zirkulierenden Makrophagen“ in höheren Konzentrationen HLA-DR Moleküle sowie "toll-like" Rezeptoren TLR2 und TLR4. TLR gehören zu den erst vor wenigen Jahren entdeckten, angeborenen Erkennungsstrukturen des Immunsystems (als sog. genuine Überlebensstrukturen; "Todesrezeptoren"). Sie sind für die Immunerkennung und -antwort und damit für das Überleben des Organismus unabdingbar. Das HLA-DR Molekül und seine Untergruppen gehört ebenfalls zu den Immunantwort- und Erkennungssystemen und spielt in der Transplantationsmedizin eine große Rolle (hier bei der Gewebsverträglichkeit von Spender und Empfänger). Monozyten sind Ziel und Effektorzellen für Fremd-und körpereigene Antigene, die kurz vor dem Abbau stehen. Der CD14+ CD16+ HLA-DR+ Phänotyp von Blutmonozyten (=„aktivierte Monozyten“) ist assoziiert mit einer akzelerierten Atheromatose, einer Mikroentzündung, chronischen Leber- und Nierenentzündungen, der Infektabwehr und der Propagation von Tumorzellen. An der Arteriosklerose sind Monozyten/Makrophagen mitbeteiligt.
Makrophagen (Riesenfresszellen)
Entwicklung: Makrophagen entwickeln sich im Knochenmark aus einer pluripotenten Stammzelle über die myeloide Reihe. Die Differenzierung aus der Vorläuferzelle geschieht durch Einwirken verschiedener Wachstumsfaktoren. Hierzu zählen zunächst GM-CSF (Granulozyten-Monozyten colony stimulating factor) und später vor allem M-CSF (Monozyten colony stimulating factor). Die gereifte Monozyte wird ins Blut abgegeben. Sie kann sich unter Einfluß von Zytokinen im Falle von Entzündungen in Makrophagen umwandeln und gleichzeitig in alle Körpergewebe einwandern. Unter normalen Umständen sind das Auge und der Hoden frei von Makrophagen, auch die Plazentaschranke können sie nicht überwinden. Im Falle von Entzündungen oder tumorösen Veränderungen können diese Schranken jedoch aufgehoben sein. Folgen sind oft Erblindung oder Sterilität. Makrophagen können sich aus im Blut zirkulierenden Monozyten entwickeln. Diese wandern dann in das Zielgewebe ein, zB in Arterien (Atherosklerose), Leber (Hepatitis), Niere (interstitielle Nephritis) etc. Im Blut zirkulieren bei Gesunden etwa 8% aller Monozyten in Form eines "Vortyps" (Phaenotyps) der an Makrophagen erinnert (CD14, CD16, HLA-DR positiv). Bei Infektionen, aber auch bei Systemerkrankungen sowie erhöhten Blutfettwerten steigt dieser Phaenotyp im Blut teilweise stark an. Der Immunphaenotyp CD14+CD16+ (siehe : www.monozyten.de) ist speziell sensitiv auf die Gabe von Glucocorticoiden.
Vorkommen: In den Geweben haben die Makrophagen verschiedene Namen:
- Histiozyt übergeordnete Bezeichnung für Gewebsmakrophagen (insbesondere des Bindegewebees)
- Alveolarmakrophagen in den Lungenalveolen. Als Herzfehlerzellen kommen sie im gefärbten Sputum (Berliner-Blau-Reaktion) von Patienten mit Linksherz-Insuffizienz vor. So können Makrophagen auch als diagnostische Hilfsmittel dienen.
- Kupffer-Stern-Zellen in der Leber
- Osteoklasten sind Knochen-abbauende Zellen im Knochengewebe
- Hofbauerzellen in der Plazenta
- Mikroglia im Gehirn
- Langerhans-Zellen sind dendritische Zellen in der Haut, die spezialisiert sind, Antigene aufzunehmen und vor Ort oder im Lymphknoten zu präsentieren.
- Schaumzellen sind mit Lipiden überladene Makrophagen. Sie kommen bei Fett-Stoffwechselstörungen, Fettsucht und Krankheiten wie dem Niemann-Pick-Syndrom oder dem Alport-Syndrom vor oder z.B. im Gehirn nach Schlaganfall (Abräumung der Kolliquationsnekrose) oder atherosklerotisch veränderten Gefäßwänden.
- Epitheloidzellen sind Makrophagenabkömmlinge, die bei der Tuberkulose eine Rolle spielen. Das innerhalb der Makrophage lebende Mycobacterium tuberculosis kann aufgrund der wachsartigen Zellwand-Beschaffenheit nicht verdaut werden. Um der Ausbreitung des Bakteriums im Organismus trotzdem Einhalt zu gebieten, werden aus dem Blut Monozyten rekrutiert, die sich nicht in phagozytierende, sondern in sekretorische Epiteloidzellen umwandeln. Diese, durch ihren katzenzungenartigen Zellkern auffallende Makrophagen-Abkömmlinge bilden einen Schutzwall, in dessen Zentrum es zur käsigen Nekrose kommt. Das gesamte, ca. 1mm durchmessende Gebilde wird als Granulom bezeichnet. Die Epitheloidzellen können zu mehrkernigen Langhans-Riesenzellen konfluieren, die nicht mit den Langerhans-Zellen der Epidermis zu verwechseln sind.
- Ungeordnete Riesenzellen sind ebenfalls mehrere Makrophagen, die sich zu einer Zelle zusammengeschlossen haben und um Fremdkörper entstehen (Fremdkörperriesenzelle). Eine Sonderform sind die Anitschow-Zellen, die beim rheumatischen Granulom vorkommen (Aschoff-Knötchen).
Die Funktion der Makrophagen ist vielfältig:
- Antigenpräsentation
- Phagozytose
- Entzündungs- und Granulomazellen
- Gewebereorganisation und Narbenbildung
- Lipidstoffwechsel
Körperfremde Proteine zum Beispiel auf der Oberfläche von Viren und Bakterien werden von den Makrophagen ständig phagozytiert, intrazellulär zerkleinert (zu Oligopeptiden prozessiert) und als Antigene auf der eigenen Zelloberfläche mit Hilfe des "Präsentiertellers" MHC-II-Komplex den T-Helferzellen präsentiert (Antigenpräsentation). Die Makrophagen selber sind Teil der unspezifischen Immunantwort (angeborenen Immunantwort), da sie ständig unspezifisch jede Art von potentiellen Körperfeinden phagozytieren. Werden diese jedoch in aufgearbeiteter Form den Lymphozyten präsentiert, kann hierdurch die für das jeweilige Antigen spezifische Immunantwort eingeleitet werden. Zusätzlich sind aktivierte Makrophagen in der Lage Zytokine freizusetzen, die die Durchblutung oder die Körpertemperatur erhöhen (Fieber) oder andere Leukozyten (unspezifisch) herbeilocken können (Chemotaxis durch Interleukin-1, TNF, Interleukin-12 uvm.).
Makrophagen phagozytieren auch körpereigene Zellen. So werden gealterte Zellen wie Erythrozyten in der Milz beseitigt. Zellen, die den programmierten Zelltod (Apoptose) sterben, werden ohne Entzündungsreaktion gefressen, während Zellen, die durch eine Nekrose zugrunde gehen, im Zuge einer Entzündungsreaktion von Makrophagen beseitigt werden. Nach dem Fressen der Zelltrümmer sorgen die Makrophagen für eine Narbenbildung (Granulationsgewebe, Einwanderung von Fibroblasten) und das Wiedereinspriessen von Blutgefäßen (Angiogenese). Im Falle einer Tuberkulose versuchen sie, die Eindringlinge (Mycobacterium tuberculosis, africanum, bovis oder microti) einzukapseln und an der Ausbreitung zu hindern. Die Zellen sind im Stande, durch die Produktion von Sauerstoff- und Stickstoffradikalen, Zytokinen und Enzymen Gewebe einzuschmelzen und zu zerstören und sie vermögen geschädigtes Gewebe durch Induktion der Narbenbildung wieder zu reorganisieren.
Neben der Aufgabe als Fresszellen sind sie stark in den Lipid-Stoffwechsel des Körpers eingebunden. Sie sind verantwortlich für die Oxidation der low-density Lipoproteine (LDL) und damit an der Entstehung der Arteriosklerose beteiligt (siehe Schaumzellen).
Lymphozyten[Bearbeiten]

Lymphozyten sind immunologisch aktive zelluläre Bestandteile des Blutes und bilden bei Erwachsenen etwa 25-40% der Leukozyten im peripheren Blut.
Aufgabe: Die Hauptaufgabe der Lymphozyten sind die Erkennung von Fremdstoffen -- wie zum Beispiel Bakterien und Viren -- und deren Entfernung mit immunologischen Methoden. Dazu werden die Zellen in Milz, Knochenmark, Thymus und Lymphknoten (vermutlich auch in der Appendix vermiformis) geprägt, was bedeutet, dass sie "lernen" müssen, welche Stoffe zum Körper dieses Menschen gehören (negative Selektion autoggressiver Zellen) und welche als fremd (positive Selektion) anzusehen sind. Damit gehören die Lymphozyten zur spezifischen Abwehr. Die Lebensdauer von Lymphozyten kann ein paar Stunden bis zu mehreren Jahren (Gedächtniszellen) betragen. Ihre Aufgabe erfüllen die Lymphozyten auf verschiedene Weise. Sie produzieren Botenstoffe (Zytokine), die andere Immunzellen und auch normale Zellen dazu bringen, potentielle Gefahren, wie Bakterien und Viren, zu bekämpfen. Sie produzieren Antikörper (B-Zellen bzw. Plasmazellen), die diese "Angreifer" als "fremd" markieren und inaktivieren (z.B. durch agglutinieren), opsonieren (für Phagozyten "schmackhaft" machen) oder zerstören (durch Komplementaktivierung) und sie zerstören infizierte Zellen auch direkt (zytotoxische T-Zellen).
Bildungsort und Morphologie: Die Lymphozyten entstehen als Vorläuferzellen aus Stammzellen im Knochenmark der Ossa plana (Becken, Brustbein, z.T. Schädelknochen), bei Kindern zusätzlich in den Epiphysen der langen Röhrenknochen. Die Vorläuferzellen reifen im Bursa-Äquivalent (beim Menschen das Knochenmark selbst) bzw. im Thymus zu differenzierten B- bzw. T-Lymphozyten.
Die Zellen sind kernhaltig und haben in der Gram-Färbung ein granuliertes Zellplasma. Mit zunehmendem Alter der Zellen wird der Zellkern kleiner (Zellgröße: 10-15µm).
Funktion: Es gibt verschiedene funktional unterscheidbare Typen von Lymphozyten:
- T-Lymphozyten sind Bestandteil der zellulären Immunantwort
- Zytotoxische T-Zellen (CD8-Zellen, T-Killerzellen)
- T-Suppressorzellen
- T-Helferzellen (CD4-Zellen)
- T-Gedächtniszellen
- B-Lymphozyten sind Bestandteil der humoralen Immunantwort
- B-Plasmazellen sezernieren Antikörper (B-Zellen tragen diese als Rezeptor auf der Zellmembran)
- B-Gedächtniszellen
- NK-Zellen (engl.: natural killer cells) sind eine weitere Gruppe von großen granulären Lymphozyten, die weder über einen T- noch über einen B-Zell-Rezeptor verfügen und durch Freisetzung lytischer Granula infizierte Zellen zerstören und bei der angeborenen Immunität wichtige Funktionen erfüllen.
Erkrankungen: Zu den Erkrankungen des lymphatischen Systems gehören die angeborenen primären und die erworbenen sekundären Immundefekte, sowie die von lymphatischen Zellen ausgehenden malignen Erkrankungen wie die Non-Hodgkin-Lymphome einschließlich der chronischen lympatischen Leukämie, der Morbus Hodgkin, das von den Plasmazellen ausgehende Plasmozytom und die akute lymphatische Leukämie. Auch Autoimmunerkrankungen können zu den Erkrankungen des lymphatischen Systems gezählt werden.
Im Rahmen einer HIV-Infektion kommt es zu einer Verminderung der Lymphozytenzahl.
T-Lymphozyten[Bearbeiten]
T-Lymphozyten oder kurz T-Zellen sind eine Subpopulation der Leukozyten (lymphoide Reihe) und neben den B-Lymphozyten an der adaptiven Immunantwort beteiligt.
Auch wenn die Vorläufer aus dem Knochenmark stammen, entwickeln sich T-Lymphozyten fast vollständig im Thymus (daher das T, für Thymus-abhängig). Sie tragen alle einen T-Zell-Rezeptor (TCR) an ihrer Oberfläche, der für die Erkennung von Antigenen verantwortlich ist. Die beiden antigenerkennenden Einheiten des TCRs liegen immer im Komplex mit mehreren CD3-Molekülen vor. Im Gegensatz zu den Immunglobulinen auf B-Lymphozyten erkennen T-Lymphozyten keine freien, sondern nur zellgebundene Antigene, die ihnen von anderen Zellen mittels MHC-Molekülen präsentiert werden. MHC-II wird von APZ exprimiert, MHC-I von allen kernhaltigen Körperzellen (Präsentation körpereigener Oligopeptide als "Personalausweis der Zelle" zur Eigen-Erkennung) .
Es werden mehrere Subtypen unterschieden, die unterschiedliche Funktionen im Immunsystem einnehmen.
T-Zell-Entwicklung: T-Zellen entwickeln sich vermutlich aus dem Lymphoblast (common lymphoid progenitor), einer Vorläuferzelle, die (wie alle Blutzellenvorläufer) im Knochenmark aus einer pluripotenten hämatopoetischen Stammzelle (auch Hämocytoblast) entsteht. Einige dieser Vorläuferzelle migrieren zum Thymus und differenzieren dort zur T-Zelllinie.
T-Helferzellen
T-Helferzellen tragen den CD4-Corezeptor an ihrer Oberfläche und erkennen Antigene, die ihnen von speziellen antigenpräsentierenden Zellen (dendritische Zellen, Makrophagen, B-Lymphozyten) auf MHC-II-Molekülen dargeboten werden. T-Helferzellen können die Immunantwort zum einen in eine zelluläre Richtung steuern, diese Aufgabe übernehmen die TH1-Zellen, und zum anderen in eine humorale, dafür sorgen TH2-Zellen:
- TH1-Zellen aktivieren durch die Ausschüttung von Zytokinen wie IFN-γ und IL-12 die sog. zelluläre Immunantwort. Dadurch werden Makrophagen aktiviert sowie die MHC-Produktion und Peptidprozessierung (also insgesamt die Peptidpräsentation). Zudem werden auch Zytotoxische-T-Zellen zur Proliferation angeregt. B-Zellen werden auch (aber nicht so stark wie durch TH2) angeregt und zwar zum Ig-Klassenwechsel (isotype switch) hin zur Produktion von opsonisierenden Antikörpern (v.a. IgG). Gleichzeitig wird eine TH2-Antwort durch die ausgeschütteten Zytokine inhibiert. Ausgelöst wird eine solche Antwort durch IFN-γ und IL-12, welche von Natürlichen Killerzellen (NK-Zellen) und dendritischen Zellen gebildet werden. Dieser Weg dient v.a. der Bekämpfung einiger intrazellulärer Bakterien sowie von Virusinfektionen. Die Produktion von IFN-γ blockiert gleichzeitig die Differenzierung zu TH2-Zellen.
- TH2-Zellen steuern die Immunantwort in eine humoral betonte Richtung: TH2-Zellen schütten Zytokine wie TNF-β (auch Lymphotoxin), IL-4 und IL-10 aus, die wie die von TH1-Zellen ausgeschütteten Cytokine die andere Helferzellentwicklung hemmen. Durch diese Kreuzhemmung wird eine einmal eingeschlagene Richtung für die Immunantwort beibehalten. Besonders IL-10 hemmt zusätzlich die Makrophagenaktivierung, die bei einer humoralen Antwort nicht nötig ist. IL-4 sorgt bei der Aktivierung von B-Zellen vor allem für die Bildung von neutralisierenden Antikörperklassen, d.h. einen Klassenwechsel (isotype switch) zu IgA, IgG, IgE. TH2-Zellen können B-Zellen dabei sehr stark anregen. Die humorale Immunantwort wird vor allem durch das Zytokin IL-4 ausgelöst, IL-6 verstärkt diese Tendenz. Woher das IL-4 bei der Initiierung einer TH2-Antwort kommt, ist ungeklärt.
Man nimmt an, dass eine Disposition zur TH2-Antwort an der Pathogenese von Allergien beteiligt ist.
T-Killerzellen
T-Killerzellen (auch Zytotoxische T-Zellen bzw. CD8+-Zellen) tragen typischerweise ein CD8-Heterodimer an ihrer Oberfläche und erkennen Antigene, die ihnen von allen kernhaltigen Zellen auf MHC-I-Molekülen dargeboten werden. Daher spielen sie vor allem in der Erkennung und Beseitigung von viral infizierten Zellen ein Rolle.
Sie sind in der Lage, diese Zellen über verschiedene Wege (Fas/FasL; Perforin/Granzyme) in den programmierten Zelltod zu treiben. Sie sollten nicht mit NK (natürliche Killer)-Zellen verwechselt werden, die zwar auch zu den Lymphozyten zählen, jedoch keinen T-Zell-Rezeptor an ihrer Oberfläche tragen. NK-Zellen sind demnach Teil des angeborenen Immunsystems.
T-Suppressorzellen
Die Existenz dieser Zellenpopulation wurde in den 1970er gefordert. Sie sollten ebenfalls den CD8 Corezeptor tragen und Toleranz gegenüber verschieden Antigenen vermitteln können. Nachdem sich herausstellte, daß einige der experimentellen Befunde, auf die sich das Model stützte, Artefakte waren, wurde das Konzept Mitte der 1980er verlassen. Trotzdem findet sich diese Zellpopulation weiterhin in einigen Lehrbücheren neueren Datums. Eindeutig nachgewiesen wurde allerdings die immunsuppressive Wirkung bestimmter T-Zellen. Ob es sich dabei um eine neue T-Zellpopulation handelt, bleibt bisher offen.
T-Regulatorzellen
Diese Population trägt neben dem CD4 Corezeptor noch einen Teil des IL2-Rezeptors (CD25) an ihrer Oberfläche. Sie wurde Mitte der 1990er erstmals beschrieben und soll ebenfalls Toleranz vermitteln. Im Gegensatz zu den T-Suppressorzellen ist die experimentelle Beweislage für diesen Zelltyp jedoch ausgezeichnet. Die Mechanismen der Toleranzvermittlung sind jedoch noch nicht vollständig aufgeklärt.
NK-T-Lymphozyten
Ursprünglich in der Maus identifiziert, rührt die Bezeichnung aus der Beobachtung, daß sie Oberflächenmarker tragen, die sonst auf NK-Zellen gefunden werden. Da diese Zellen jedoch auch einen T-Zell-Rezeptor tragen, werden sie den T-Lymphozyten zugerechnet. Sie sind meist doppelt negativ (kein CD4 und CD8), einige wenige aber CD4+. NK-T-Zellen erkennen das Molekül CD1b, ein MHC-ähnliches Molekül, welches vor allem ungewöhnliche Antigene bindet (vor allem lipidhaltige Antigene oder Moleküle wie Glycophosphatidylinositol). Der TCR dieser Zellen besitzt eine invariante α-Kette in Kombination mit drei verschiedenen β-Ketten. Obwohl NK-T-Zellen lytische Aktivität zeigen (wie T-Killerzellen, sie oben), gibt es Hinweise darauf, dass sie eine Bedeutung bei der Regulation der Immunantwort haben (also TH1 oder TH2). Für diesen Punkt spricht, dass sie sehr früh im Lauf einer Infektion reagieren, und alle entscheidenden Cytokine wie IFN-γ, IL-4 und IL-10 sezernieren können. Sie könnten den Übergang der Immunantwort vom angeborenen zum adaptiven Immunsystem darstellen. An diesen Zellen wird noch viel geforscht.
γδ T-Lymphozyten
Im Gegensatz zu den oben beschrieben Populationen tragen γδ-T-Zellen einen anderen Isotyp des T-Zell-Rezeptors an ihrer Oberfläche. Der Großteil dieser Zellpopulation hat keine CD4/CD8 Corezeptoren an ihrer Oberfläche. Die Funktion der γδ T-Lymphozyten ist noch nicht vollständig geklärt, einige von ihnen scheinen jedoch Stoffwechselprodukte von Mykobakterien zu erkennen. Sie scheinen vor allem im Darmlymphgewebe eine Rolle zu spielen (in Peyerschen Platten bzw. GALTs, engl: gut associated lymphoid tissues). Eine Untergruppe dieser Zellen trägt einen NK-Rezeptor, welcher MHC-ähnliche Moleküle (MIC-A und MIC-B) auf Darmepithelzellen erkennt. Diese werden nur bei Stress oder Verletzung der Epithelzellen exprimiert. Dieser Zelltyp ist dann in der Lage, solche Zellen zu erkennen und zu töten.
Hinweise: Es muss erwähnt werden, dass viele der Erkenntnisse vor allem über die genauere Regulation des Immunsystems (TH1- / TH2-Antwort, regulatorische T-Zellen etc.) im Mausmodell untersucht wurden. Obwohl die Maus als Testsystem durchaus eine Berechtigung hat, sollte daran gedacht werden, dass es gerade in einem hochkomplexen und evolutionär stark unter Druck stehendem System wie dem Immunsystem durchaus Unterschiede gibt. Es können also nicht alle Erkenntnisse als auch für den Menschen zutreffend angesehen werden.
B-Lymphozyten[Bearbeiten]
B-Lymphozyten oder kurz B-Zellen sind zusammen mit den T-Lymphozyten entscheidender Bestandteil des lymphatischen Systems und die Träger der humoralen Immunantwort (Bildung von Antikörpern). Wenn sie aktiviert werden, können sie sich zu Antikörper-sezernierenden Plasmazellen oder zu B-Gedächtniszellen differenzieren.
Die Bezeichnung "B-Zellen" stammt ursprünglich von ihrem Bildungsort in der Bursa Fabricii bei Vögeln. Bei Säugetieren entstehen die B-Zellen im Knochenmark, daher erhielt der Buchstabe B hier nachträglich die Bedeutung bone marrow (Knochenmark).
B-Lymphozyten zirkulieren im Blut und den lymphatischen Organen (Thymus, Milz, Lymphknoten, Knochenmark) von Wirbeltieren. Bindet eine B-Zelle an ein Antigen, das zu ihrem Rezeptor passt (variabler Teil des antigen binding fragment (Fab) der membrangebundenen Antikörper, jede B-Zelle exprimiert Antikörper mit nur einem spezifischen Fab-Teil), und bekommt sie gleichzeitig ein costimulatorisches Signal von T-Helferzellen (die ebenfalls dasselbe Antigen erkannt haben müssen) dann beginnen sie stark zu proliferieren (klonale Expansion).
Die Gene für die variablen Teile der Immunglobuline sind genetisch hochvariabel. Es werden in der B-Zell-Vorläuferzelle ständig Mutationen eingeführt, die zur Verbesserung der Antikörper-Affinität für das erkannte Antigen führen (somatische Hypermutation). Außerdem kann hier ein Klassenwechsel (IgG, IgM, IgA usw.) des konstanten Teils der Antikörper stattfinden, was wichtig ist für die Art, wie die Antikörper auf den Erreger weiterhin wirken beziehungsweise wohin die Antikörper im Körper gelangen.
B-Lymphozyten tragen auf ihrer Oberfläche eine Reihe von Oberflächenmarkern, die funktionell wichtig sind und zu ihrer Identifizierung z. B. im menschlichen Blut oder in Gewebeproben verwendet werden können. Neben den membranständigen Immunglobulinen (Antikörpern) zählen dazu z. B. CD19, CD20 und CD21.
Angeborenes und adaptives Immunsystem[Bearbeiten]
In der frühen Stammesgeschichte der Lebewesen (auf der Stufe der Eukaryoten) entwickelte sich zunächst ein relativ unspezifisch agierendes Verteidigungssystem: das angeborene Immunsystem. Erst später, mit dem Auftreten der Wirbeltiere, kam es zur Entwicklung des adaptiven Immunsystems, das gezielt gegen Erreger vorgeht und eine Art individuelles Gedächtnis in die Verteidigungsstrategie des Organismus einführte.
Das angeborene Immunsystem kann Infektionserreger bekämpfen, ohne dass der Organismus vorher mit dem Erreger Kontakt hatte. Dabei werden Mustererkennungs- und Verteidigungsstrategien verwendet, die sich schon zur Zeit der ersten Eukaryoten als effizient erwiesen haben. Es wird angenommen, dass etwa 90% aller Infektionen durch das angeborene Immunsystem erkannt und endgültig bekämpft werden. Die Aufgaben des angeborenen Immunsystems werden von verschiedenen Zellen wahrgenommen. Dazu gehören Granulozyten, Makrophagen, dendritische Zellen, Epithelzellen und natürliche Killerzellen (NK-Zellen). Diese Zellen sind zum Teil in der Lage, den Angreifer (Erreger) selbst zu vernichten. Außerdem versetzen sie bei Infektionen den Organismus durch Produktion von Mediatoren in eine Art Alarmzustand, was wiederum die zelluläre Abwehr stimuliert und zum Ort des Geschehens lockt (Chemotaxis). Die Wirkung einiger dieser Signalstoffe äußert sich erkennbar beispielsweise in Entzündungen und Fieber.
Das adaptive Immunsystem zeichnet sich durch die Anpassungsfähigkeit seiner Waffen gegenüber dem Angreifer aus. Im Rahmen dieser Anpassung sind die Zellen des adaptiven Immunsystems (T- und B-Lymphozyten) in der Lage, spezifische Strukturen der Angreifer zu erkennen und gezielt zelluläre Abwehrmechanismen und molekulare Antikörper zu bilden. Nach der Infektion bleiben diese spezifischen Antikörper und die sog. Gedächtniszellen erhalten, um zukünftig den gleichen Angreifer mit kürzerer Reaktionszeit unschädlich zu machen. Damit das adaptive Immunsystem vom Angreifer überhaupt Kenntnis erlangt, bedient es sich der Antigenpräsentierenden Zellen (APZ), hierzu gehören z.B. Makrophagen oder dendritische Zellen. Diese Zellen gehören zum angeborenen Immunsystem und sind in der Lage, auf ihrer Oberfläche Erregerantigene zu präsentieren. Hier besteht eine wichtige Schnittstelle zwischen dem angeborenen und dem adaptiven Immunsystem.
Das angeborene Immunsystem[Bearbeiten]
Die Elemente des angeborenen Immunsystems (z.T. auch als unspezifische Abwehr bezeichnet) sind
- mechanische Barrieren, die ein Eindringen der Schädlinge verhindern sollen,
- antibiotische Peptide und lytische Enzyme.
- Abwehrzellen (Granulozyten, Makrophagen, dendritische Zellen, Epithelzellen, natürliche Killerzellen (NK-Zellen)) und
- ihre Mediatoren zur Koordination der Abwehr.
Physikalisch-chemische Barrieren[Bearbeiten]
Diese sorgen dafür, dass die Pathogene erst gar nicht in den Körper eindringen können oder ihn möglichst schnell wieder verlassen:
- Haut - äußere Schicht als Barriere, Hauttalg, Schweiß, "Säureschutzmantel" und Normalflora (Kolonisationsresistenz) als Wachstumsbremsen für körperfremde Mikroorganismen
- Schleimhaut - Bindefunktion des Schleims, IgA,
- Nase - Abfangfunktion des Nasenschleims, Zilienschlag des Flimmerepithels
- Augen - Tränenfluss, Lysozym (antimikrobiell bes. auf Gram-positive Erreger)
- Atemwege - Bindefunktion des Schleims, Zilienschlag des Flimmerepithels
- Mundhöhle - Lysozym
- Magen - Magensäure und Proteasen
- Darm - Lymphatisches Gewebe, Kolonisationsresistenz, Abtransportfunktion durch ständige Entleerung
- Harntrakt - Abtransportfunktion durch ständige Harnausspülung sowie osmotische Effekte der hohen Harnstoffkonzentration, Schließmuskeln
- Weiblicher Genitaltrakt - Saurer pH (Milchsäurebakterien) in der Vagina, Zervixschleim, Zilienschlag und Flüssigkeitsstrom in den Tuben Richtung Uterus
Erkennung des infektiösen Agens[Bearbeiten]
Die Zellen des angeborenen Immunsystems sind mit Hilfe von Rezeptoren in der Lage, bestimmte Strukturmerkmale von Angreifern zu erkennen. Das angeborene Immunsystem ist dabei schon vor dem Erstkontakt mit einem Krankheitserreger "scharf geschaltet", es bedarf keiner Anpassung.
Entwicklungsgeschichtlich hat sich dabei eine Mustererkennung durchgesetzt, bei der für den Angreifer lebenswichtige molekulare Strukturmerkmale erkannt werden. Die Veränderung dieser Strukturen führen offensichtlich zur Verkrüppelung oder dem Absterben des Trägers. Die Selektion wirkt also im Sinne der Erhaltung dieser Merkmale. Zu diesen unverzichtbaren Proteinen gehören beispielsweise das Flagellin der Salmonellen und das Lipopolysaccharid gramnegativer Bakterien. Diese Merkmale haben sich entwicklungsgeschichtlich gehalten, so dass schon bei primitiven Eukaryoten Abwehrmechanismen entwickelt und im Verlauf der Phylogenese ohne Änderung beibehalten werden konnten.
Die Strukturmerkmale werden pathogen associated molecular pattern (PAMP) genannt und werden von verschiedenen Rezeptoren erkannt, darunter die Toll-artigen Rezeptoren (TLR).
Die Rezeptorproteine können in frei gelöster Form im Plasma zirkulieren oder an verschiedene Zellpopulationen gebunden sein. Dazu gehören
- Neutrophile Granulozyten,
- Monozyten/Makrophagen und
- Dendritische Zellen.
Das zelluläre angeborene Immunsystem[Bearbeiten]
Neutrophile Granulozyten, Monozyten/Makrophagen und dendritische Zellen können durch Aufnahme und Verdauung (Phagozytose) den Erreger selbst vernichten oder durch die Produktion von Immunmodulatoren und Zytokinen die Immunreaktion des Organismus steuern.
Neutrophile Granulozyten[Bearbeiten]
 |
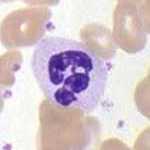 |
Die neutrophilen Granulozyten machen etwa 50%-65% der Zellen im Differentialblutbild aus. Je nach Form des Zellkerns unterscheidet man jugendliche stabkernige und ausgereifte segmentkernige neutrophile Granulozyten. Ihre mittlere Verweildauer im Blut beträgt 6-8 Stunden. Die neutrophilen Granulozyten enthalten zahlreiche Granula (Lysosomen).
Neutrophile sind Bestandteil des angeborenen, unspezifischen Abwehrsystems. Ihre Aufgabe besteht u.a. in der Bekämpfung von meist bakteriellen Infektionen durch Phagozytose und Exozytose von azurophilen Granula. Die Granula der Neutrophilen enthalten saure Hydrolasen, Defensine (30% des Inhalts), Plasminogenaktivatoren (t-PA, u-PA), Myeloperoxidase und neutrale Proteasen, wie Elastase, Kollagenase, Neuramidase und Cathepsin G. Dieser „Cocktail“ ermöglicht es den Neutrophilen, sich einen Weg durch das Bindegewebe und Fibringerinnsel zu bahnen und zu den Bakterien vorzudringen. Mit spezifischen Rezeptoren binden die Neutrophilen dabei die Proteasen auf der Zellmembran, so dass deren aktive Zentren von der Zelle weg in das Bindegewebe gerichtet sind.
Die Phagozyten entleeren dann auch sekundäre Granula. Diese enthalten Lactoferrin, ein Protein, das Eisen (Fe++) bindet und den Bakterien entzieht, sowie Lysozym, ein Enzym, das die Pepdidoglykane Gram-positiver Bakterien spaltet und damit toxisch auf diese Bakterien wirkt. Die Ausstattung der Neutrophilen mit Rezeptoren, die der Phagozytose dienen, ist ähnlich der der Makrophagen. Neutrophile besitzen ebenfalls CD14 und Mannose bindende Rezeptoren.
Eiter besteht zum großen Teil aus abgestorbenen neutrophilen Granulozyten. Dabei sind selbst die sterbenden Granulozyten noch für die Bakterien gefährlich. Wenn die Immunozyten sterben, stoßen sie aktiv ihren Zellkern aus. Die ausgeworfenen Nucleinsäuren bilden zusammen mit zytoplasmatischen bakteriziden Enzymen dichte Netze, sog. Neutrophil Extracellular Traps (NETs), in denen Bakterien hängen bleiben und abgetötet werden. An dieser Reaktion sind auch reaktive Sauerstoffspezies (ROS) beteiligt, die von der NADPH-Oxidase generiert werden. [1]
Bei Infektionen kommt es zu einem Anstieg der Zahl der neutrophilen Granulozyten im Blut (Neutrophilie). Zusätzlich kann es zu einer Zunahme des Anteils von stabkernigen Granulozyten und dem Auftreten von Vorstufen der Granulozyten im Differentialblutbild kommen. Man spricht von einer Linksverschiebung. Ein Mangel an neutrophilen Granulozyten (Neutropenie) kann zu schweren bakteriellen Infektionen führen. Bei der septischen Granulomatose ist deren Funktion völlig gestört; im Frühjahr 2006 wurde der erste erfolgreiche Versuch einer Gentherapie zur Behebung dieser Erkrankung veröffentlicht.
Makrophagen[Bearbeiten]
Makrophagen stellen ebenfalls einen Teil der Patrouille des Immunsystems dar. Sie gehen aus den Monozyten hervor und halten sich im Gewebe auf, wo sie eingedrungene Erreger erkennen und phagozytieren. So spielen Makrophagen direkt bei der Bekämpfung und Beseitigung von schädlichen Substanzen und Abfallprodukten eine entscheidende Rolle.
Zusätzlich werden die aufgenommenen Teile im Inneren der Makrophagen in Oligopeptide (Epitope) zerlegt und durch MHC-II-Moleküle auf der Oberfläche präsentiert. Der Makrophage wird also zu einer Antigen-präsentierenden Zelle und damit zu einem Informanten der spezifischen Abwehr. Auf die präsentierten Antigene sprechen die T-Zellen der Klasse CD4 (T-Helferzellen) an. Diese können so, und nur so, erkennen, welche Fremdantigene sich im Körper bewegen.
Natürliche Killerzellen[Bearbeiten]
Natürliche Killerzellen (NK-Zellen) sind Teil des angeborenen Immunsystems, obwohl sie sich einen Knochenmarksvorläufer mit T-Zellen teilen. Erstmals beschrieben wurden sie 1975 am Karolinska Institut in Stockholm. Im Gegensatz zu T-Zellen können sie ohne vorherige Aktivierung unmittelbar reagieren. Im Laufe der 1980er Jahre wurde klar, dass NK-Zellen unter normalen Umständen von so genannten "MHC Klasse I"-Molekülen inhibiert werden, die sich an der Oberfläche fast aller Körperzellen befinden. Wird eine Zelle infiziert oder wandelt sich in eine Tumorzelle um, gehen unter Umständen "MHC Klasse I"-Moleküle auf der Oberfläche verloren. Das Resultat ist eine von NK-Zellen getragene Immunantwort gegen genau diese Zellen. Dieses Konzept wurde international als so genannte "missing-self" Erkennung (Klas Kärre et al.) bekannt.
Während der 1990er Jahre wurde dieses Konzept dahingehend erweitert, dass die Kontrolle von NK-Zellen von einem fein ausbalancierten Gleichgewicht zwischen inhibierenden und aktiverenden Signalen abhängt. Sowohl der Verlust von inhibierenden als auch die vermehrte Präsenz aktivierender Signale kann demnach zu einer NK Zellantwort führen. Zur Verarbeitung dieser Signale tragen NK-Zellen eine Vielzahl unterschiedlicher Rezeptoren auf ihrer Oberfläche, die auf den potenziellen Zielzellen inhibierende oder aktivierende Liganden wahrnehmen. Diese Integration multipler Signale unterstreicht die hohe Komplexität auch des angeborenen Immunsystems.
Eosinophile Granulozyten[Bearbeiten]
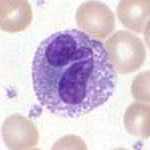
Eosinophile Granulozyten machen etwa 3 - 5% der Zellen im Differentialblutbild aus und sind an der zellulären Immunabwehr beteiligt. Ihren Namen beziehen sie vom Farbstoff Eosin, mit dem sie angefärbt werden können.
In ihrem Inneren enthalten sie Vesikel (Granula), die basische Proteine enthalten, z.B. das Major Basic Protein. Der Inhalt der Granula kann durch Exozytose an die Umgebung abgegeben werden.
Eosinophile werden unter anderem durch Antikörper der IgE-Klasse zur Exozytose angeregt. Sie sind zur Chemotaxis befähigt, d.h. sie können sich amöboid in Richtung eines anlockenden Stoffes (Attractant) fortbewegen.
Eosinophile spielen eine wichtige Rolle bei der Parasitenabwehr. Das vollzieht sich folgendermaßen: Sobald die Oberfläche des Parasiten mit IgE besetzt ist, können sich Eosinophile daran heften. Durch einen speziell angepassten Mechanismus geben sie ihre toxischen Proteine direkt auf die Oberfläche des Parasiten ab und schädigen diesen. Gleichzeitig dienen die exozytierten Proteine für andere Eosinophile als Lockstoffe, so dass die Abwehr verstärkt werden kann.
Eosinophile können aber auch eine für den Organismus selbst schädigende Rolle spielen. Bei Asthma beispielsweise wird das Lungenepithel durch die basischen Inhaltsstoffe der Eosinophilen angegriffen. Eine durch Eosinophile ausgelöste seltene Krankheit ist die eosinophile Fasciitis.
Bei Allergien ist die Anzahl der Eosinophile im Blut erhöht. Diese so genannte Eosinophilie ist ein wichtiger Indikator für das Vorhandensein einer Allergie. Eine Verminderung der Eosinophilenzahl nennt man Eosinopenie.
Basophile Granulozyten[Bearbeiten]

Basophile Granulozyten besitzen zahlreiche grobe unregelmäßige Granula, die u. a. Histamin und Heparin enthalten. Im Differentialblutbild machen sie nur einen geringen Anteil aus (< 2 %). Basophile sind aus dem Knochenmark stammende Granulozyten, die mit den Eosinophilen einen gemeinsamen Vorläufer besitzen. Wachstumsfaktoren für die Basophilen sind u. a. IL-3, IL-5 und GM-CSF. Es gibt Hinweise für eine wechselseitige Kontrolle bei der Reifung zwischen Basophilen und Eosinophilen. Beispielsweise unterdrückt TGF-beta in Gegenwart von IL-3 die Differenzierung von Eosinophilen und fördert die der Basophilen. Sie besitzen einen Rezeptor für IgE, weshalb man annimmt, dass sie eine Rolle bei der Immunabwehr des Wirts gegen Parasiten spielen.
Wenn ihre Rezeptoren durch an IgE gebundene Allergene kreuzvernetzt werden, degranulieren die Basophilen und schütten toxische Mediatoren, wie Histamin und PAF (Plättchenaktivierender Faktor -> Aggregation der Thrombocyten), aus. Eosinophile, Basophile und Mastzellen können miteinander in Wechselwirkung treten und die gegenseitige Degranulation noch verstärken.
Die Aktivierung von Immunzellen, die Rezeptoren für IgE besitzen, kann zur allergischen Sofortreaktion wie z. B. Heuschnupfen führen. Eine systematische Aktivierung dieser Zellen (also die Aktivierung im ganzen Körper) kann zum anaphylaktischen Schock führen.
Zu einer Vermehrung von basophilen Granulozyten im Blut kann es bei myeloproliferativen Erkrankungen, insbesondere der chronischen myeloischen Leukämie, kommen.
Das angeborene humorale Immunsystem[Bearbeiten]
Das Komplementsystem[Bearbeiten]
Das Komplementsystem, eine Klasse von Blutproteinen ist in der Lage, sich an körperfremde sowie körpereigene Strukturen zu binden. Körpereigene Strukturen schützen sich dagegen durch bestimmte Proteine.
Um erkannte körperfremde Proteine zu bekämpfen, bedient sich das Komplementsystem hauptsächlich zweier Strategien:
- Es ist in der Lage ein Porin zu bilden, welches die Zellwände des Eindringlings durchlöchert und diesen auslaufen lässt.
- Es hat die Möglichkeit, Fresszellen anzulocken (Chemotaxis) und auf das markierte Objekt anzusetzen (Opsonierung).
Das Komplementsystem ist neben den Phagozyten ein wesentlicher Bestandteil der angeborenen Immunabwehr. Die mehr als 30 Proteine des menschlichen Komplementsystems sind im Blutplasma gelöst oder zellgebunden und dienen der Abwehr von Mikroorganismen (z. B. Bakterien, Pilze, Parasiten), haben jedoch auch stark zellzerstörende Eigenschaften und können, wenn sie unreguliert wirken, im Verlauf vieler Krankheiten (z. B. Glomerulonephritis, hämolytisch-urämisches Syndrom, Herzinfarkt, systemischer Lupus erythematodes, Rheumatoide Arthritis) für Gewebsschäden verantwortlich sein.
Bestandteile des Komplementsystems
Direkt an den Signalwegen des Komplementsystem beteiligt sind folgende Proteine: die Komplementfaktoren C1 bis C9, das Mannose-bindende Lektin (MBL) und die an C1 bzw. MBL gebundenen Serin-Proteasen C1r und C1s bzw. MASP-1 bis 3 (engl. MBL-associated serine proteases). Durch Protease-vermittelte Spaltung der Komplementfaktoren C1 bis C5 und Zusammenlagerungen mit den Faktoren C6 bis C9 entsteht eine Vielzahl an Proteinen und Proteinkomplexen. Zu diesen gehören beispielsweise die Anaphylatoxine C3a, C5a und C2b mit gefäßerweiternder und chemotaktischer Wirkung (Entzündungsreaktion) und der Membranangriffskomplex (engl. Membrane Attack Complex (MAC)). Negativregulatoren des Systems sind der C1-Inhibitor, Faktor H, Faktor I, C4bp, CD35, CD46, CD55, CD59 und Vitronektin. Als einziger Positivregulator wirkt Properdin.
Ablauf und Wirkung der Komplement-Aktivierung
Man unterscheidet drei Wege durch die das Komplementsystem aktiviert wird:
- Den über Antikörper vermittelten klassischen Weg ("klassisch", weil zuerst entdeckt).
- Den spontanen und Antikörper-unabhängigen alternativen Weg.
- Den über Mannose-bindendes Lektin aktivierten Lektin-Weg.
Das Produkt jedes Wegs ist eine C3-Konvertase genannte Serin-Protease auf der Oberfläche der Zielzelle. Die von ihr ausgelöste Spaltungskaskade führt zu chemotaktischer Anlockung von Leukozyten, verstärkter Phagozytose, und letztendlich zur Lyse der Zielzelle. Spaltprodukte der Komplementfaktoren C1 bis C5 die in den einzelnen Wegen entstehen wirken zusätzlich als Anaphylatoxine und vermitteln eine Entzündungsreaktion.
Klassischer Weg Alternativer Weg
Zielzelle mit Antikörpern markiert Zielzelle mit auffälligen Membranproteinen
| (LPS, virusinduziert) |
|(schnell) (langsam) |
| P D |
| -> C1 -> C4 + C2 -> C4b2b = C3-Konvertase = C3bBb <- B + C3b <- C3 <-|
↑ ↓ ↓ |+ ..................↑ ↓
MASP C4a C2a C3 -> C3a + C3b C3a
↑ |
MBL C3b + C4b2b oder C3bBb -> C5-Konvertase
|+
Lektinweg C5a + C5b <- C5
|+
MAC (C5b-C9) <- C9-Polymerisation <- C5b + C6-C8
Der klassische Weg
Im klassischen Weg wird die „C3-Konvertase des klassischen Weges“ gebildet. Der Komplementfaktor C1 besitzt mehrere Bindungsdomänen für Antigen gebundenene Antikörper (Ig). Für die Aktivierung der an C1 gebundenen Serin-Proteasen (C1r und C1s) sind zwei 40nm voneinander entfernte Ig-Fc-Regionen nötig. Freie Antikörper führen daher nicht zur Aktivierung. Die Protease C1s katalysiert dann die beiden Startreaktionen des klassischen Weges, eine Spaltung von C2 in C2a und C2b und eine weitere von C4 in C4a und C4b. C2a und C4a diffundieren und wirken wiederum als Anaphylatoxine. C2b und C4b lagern sich zum C4b2b-Komplex zusammen und bilden so die „C3-Konvertase des klassischen Weges“.
Der alternative Weg
Der alternative Weg führt zur Bildung der „C3-Konvertase des alternativen Weges“. Ausgelöst wird dieser Weg durch den spontanen Zerfall des instabilen Komplementfaktors C3 in C3a und C3b. C3a diffundiert und besitzt eine chemotaktische und entzündungsauslösende Wirkung als Anaphylatoxin. C3b bindet kovalent an eine Zelloberfläche. Wenn es an körpereigene Zellen bindet wird es relativ rasch durch Regulatorproteine inaktiviert oder abgebaut. Auf pathogenen Oberfläche bleibt es dagegen aktiv und kann Faktor B binden. Am entstandenen C3bB-Komplex wird durch den Serum-Faktor D ein Stück des Faktors B (genannt Ba) abgeschnitten. Bb bleibt an C3b gebunden. Der Komplex C3bBb wird als „C3-Konvertase des alternativen Weges“ bezeichnet. Er ist sehr instabil und zerfällt, wenn er nicht von Properdin (P) stabilisiert wird.
Der Lektin-Weg
Im Lektin-Weg bindet das Mannose-bindende Lektin (MBL) an Mannose oder N-Acetyl-Glukosamin auf der pathogenen Oberfläche (z.B. bakterielles Peptidoglykan) und aktiviert dann die MBL-aktivierten Proteasen MASP-1, MASP-2 und MASP-3. Diese katalysieren dieselben Reaktionen wie im klassischen Weg. Auch hier bilden wieder C4b und C2b ein C4b2b-Heterodimer und damit ebenfalls die „C3-Konvertase des klassischen Weges“.
C3-Konvertase ausgelöste Reaktionen
Die im alternativen, klassischen und Lektin-Weg gebildeten C3-Konvertasen, C3bBb und C4b2b, spalten nun mit hoher Aktivität C3 in C3b und C3a. Die entstehenden C3b-Moleküle haben nun im Wesentlichen drei Möglichkeiten:
- Sie finden keine geeignete Oberfläche an die sie binden können und werden inaktiviert.
- Die Moleküle lagern sich an die Zelloberfläche einer Zielzelle an und führen so zu einem weiteren „Start“ des alternativen Weges. Eine positive Rückopplung entsteht. Außerdem wirken sie als Opsonine und markieren die Zielzelle als lohnendes Ziel zur Phagozytose.
- Einige der Moleküle binden an eine C3-Konvertase (C4b2a bzw. C3bBb). Die hierbei entstehenden trimolekularen Komplexe C4b2a3b und C3bBbC3b spalten nun nicht mehr C3 sondern C5, daher werden sie jetzt als „C5-Konvertasen des klassischen bzw. alternativen Weges“ bezeichnet.
Die beiden Produkte der C5-Spaltung fungieren einerseits als Anaphylatoxin und chemotaktischer Lockstoff (C5a) und andererseits leiten sie auch die Bildung des Membranangriffskomplex (MAC) ein (C5b). Dabei rekrutiert der „Anker“ C5b nacheinander die Faktoren C6, C7 und C8. Der entstandene C5b678-Komplex startet dann die Polymerisierung von C9. Nach der Zusammenlagerung von bis zu 18 C9 Monomeren stellt der C5b678poly9-Komplex den fertigen Membranangriffskomplex dar, der die Zielzelle unter anderem durch Porenbildung in der Zellmembran attackiert und zu ihrer Lyse führt.
Weblinks:
- http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/Complement.html
- http://www.srcf.ucam.org/~ajm226/mp/complement.jpg
- http://www.vu-wien.ac.at/i123/allvir/Komplement1.html
Das adaptive Immunsystem[Bearbeiten]
Darüber hinaus besitzt das Immunsystem höher entwickelter Organismen ein sehr anpassungsfähiges und auch erinnerungsfähiges Teilsystem, welches vor allem gegen Viren hocheffektiv ist. T- und B-Zellen gehören beide zu den Lymphozyten, einer Untergruppe der Leukozyten (weiße Blutkörperchen). Beide Zelltypen entwickeln sich im Knochenmark (engl. bone marrow), wobei die T-Zellen im Fötus vor der Geburt eine weitere Reifung im Thymus (Name!) durchlaufen; der Reifungsort der B-Zellen wurde zuerst bei Vögeln beschrieben (Bursa fabricii, Name!). Bei Säugern fehlt die Bursa fabricii, Reifungsort bei ihnen ist ebenfalls das Knochenmark.
Die adaptative zelluläre Abwehr[Bearbeiten]
T-Lymphozyten[Bearbeiten]
T-Lymphozyten werden nach verschiedenen Kriterien unterschieden. Für die folgenden Erläuterungen ist die Unterscheidung der T-Zellen nach ihren Rezeptoren, die sie auf ihrer Oberfläche tragen, entscheidend.
T-Zellen verfügen über mehrere Rezeptoren, um ihnen das Andocken an passende Antigene zu ermöglichen. Neben dem passenden T-Zell-Rezeptor, mit dem ein spezielles Antigen erkannt wird (Schlüssel-Schloss-Prinzip), ist noch ein Oberflächenmarker entscheidend, der sie als CD4 / T-Helferzelle bzw. als CD8 / T-Killerzelle klassifiziert. Die Abkürzung CD steht für engl. Cluster of differentiation.
CD4-Lymphozyten (T-Helferzellen)[Bearbeiten]
CD4-positive Zellen können über ihren spezifischen T-Zell-Rezeptor nur an körperfremde Strukturen andocken, die durch B-Zellen, antigenpräsentierende dendritische Zellen oder Makrophagen mit Hilfe des MHC-II Molekül präsentiert werden. Um die CD-4 Zelle in einen aktiven Zustand zu versetzen ist es zusätzlich Bedingung, dass die Makrophage die Kostimulanz B7 auf ihrer Oberfläche bildet und diese an den CD-28 Rezeptor der T-Zelle andockt. Die Aktivierung veranlasst die Teilung der T-Zelle und das Freisetzen von Lymphokinen, die weitere Teile des Immunsystems, die B-Zellen, mobilisieren.
CD8-Lymphozyten (Zytotoxische T-Zellen)[Bearbeiten]
CD8 positive T-Zellen erkennen mit ihrem T-Zell-Rezeptor fremde Peptide, die im MHC-I Komplex an der Oberfläche von körpereigenen Zellen präsentiert werden. Nur wenn sich auch noch das CD28 Oberflächenprotein der T-Zelle an den MHC-Peptid-Komplex geheftet hat, wird die T-Zelle aktiviert und sezerniert zytotoxische Substanzen, welche die infizierte oder krankhaft veränderte Zelle in die Apoptose treibt.
Neutrophile Granulozyten[Bearbeiten]
Bei einer kleinen Subgruppe der neutrophilen Granulozyten konnte kürzlich ein variables Antigen-Rezeptorsystem ähnlich dem T-Zellrezeptor nachgewiesen werden. Die Zellen bilden damit neben den B- und T-Lymphozyten offensichtlich ein weiteres Standbein der adaptativen Immunabwehr. [2]
Die adaptative humorale Immunantwort[Bearbeiten]
B-Lymphozyten[Bearbeiten]
B-Zellen, die mit ihrem an der Zelloberfläche befindlichen Antikörper bereits an ein Antigen angedockt haben, können durch Lymphokine aktiviert werden, die von aktivierten CD-4 T-Zellen ausgeschüttet werden (die ebenfalls das Antigen mit ihrem T-Zell-Rezeptor gebunden haben). Die aktivierte B-Zelle beginnt sich zu teilen (klonale Expansion) und die Tochterzellen wandeln sich in Antikörper-sezernierende Plasmazellen (z.T. auch in B-Gedächtniszellen) um. Während einer Erstinfektion dauert es mindestens fünf Tage, bis sich aus B-Zellen Plasmazellen entwickeln.
Diese sind in der Lage, auch freie (also nicht von MHC gebundene) Antigene zu erkennen und sie durch Anlagerung für das Komplementsystem oder Makrophagen zu markieren oder direkt z.B. durch Agglutination zu inaktivieren.
Antikörper[Bearbeiten]
Jeder Antikörper besteht aus zwei identischen schweren Ketten und zwei identischen leichten Ketten. Die schweren Ketten sind u.a. für die Verankerung des Antikörpers auf der Oberfläche von Granulozyten zuständig; die leichten Ketten bilden zusammen mit den schweren Ketten das für die Erkennung eines spezifischen Antigens verantwortliche Fab-Fragment (antigen binding fragment). Durch somatische Rekombination können Antikörper mehr als 100 Millionen verschiedene Fab-Fragmente bilden und damit eine Unzahl verschiedener Antigene erkennen.
Antikörper sind globuläre Proteine (Immunglobuline), die in Wirbeltieren als Antwort auf Antigene gebildet werden und der Abwehr dieser Fremdstoffe dienen. Als Antigene wirken fast ausschließlich Makromoleküle oder an Partikel gebundene Moleküle, zum Beispiel Lipopolysaccharide an der Oberfläche von Bakterien. Ein bestimmtes Antigen induziert in der Regel die Bildung nur eines bestimmten, dazu passenden Antikörpers, der spezifisch nur an diesen Fremdstoff gebunden wird. Die spezifische Bindung von Antikörpern an die Antigene bildet einen wesentlichen Teil der Abwehr gegen die eingedrungenen Fremdstoffe. Bei Krankheitserregern (Pathogenen) als Fremdstoffe kann die Bildung und Bindung von Antikörpern zur Immunität führen.
Antikörper werden von zu Effektorzellen differenzierten B-Zellen (=Plasmazellen) sezerniert. Sie kommen im Blut und in der extrazellulären Flüssigkeit der Gewebe vor. Sie "erkennen" meist nicht die gesamte Struktur des Antigens, sondern nur einen Teil desselben, die sogenannte antigene Determinante bzw. das Epitop.
Jeder Antikörper besteht aus zwei identischen schweren Ketten (heavy chains, H) und zwei identischen leichten Ketten (light chains, L), die durch kovalente Disulfidbrücken zu einer Ypsilon-förmigen Struktur miteinander verknüpft sind. Die beiden Leichtketten sind je nach Organismus und Immunglobulin-Subklasse entweder vom Typ kappa oder lambda und bilden zusammen mit den oberhalb der Gelenkregion (hinge region) liegenden Anteil der schweren Ketten das Antigenbindende Fragment Fab, welches enzymatisch mit Hilfe von Papain von dem darunterliegenden kristallinen Fragment Fc abgespalten werden kann. Die ausgesprochene Variabilität der Antikörperbindungsstellen (abgekürzt CDR, Complementarity Determining Region) erreicht der Organismus über die V(D)J-Rekombination.
Die V(D)J-Rekombination
Die V(D)J-Rekombination (wird auch als somatische Rekombination bezeichnet) ist ein genetischer Umlagerungsprozess, der für die Variabilität und immer neue Varianten von antikörperproduzierenden Zellen (B-Zellen) sowie von T-Zell-Rezeptoren sorgt. Es handelt sich um eine komplizierte Rekombination, bei der die DNA-Abschnitte der Gene für die leichten und schweren Ketten der Antikörper und T-Zell-Rezeptoren neu und zufällig miteinander kombiniert werden, so dass in den variablen Bereichen der Antikörper neue antigenerkennende Proteinabschnitte erzeugt werden. Sie ist der wichtigste Bestandteil der Adaptiven Immunantwort.
Der Vorgang der V(D)J-Rekombination respektive der somatischen Rekombination: Die Antikörper bestehen grundlegend aus zwei langen (schweren) Ketten und zwei kurzen (leichten). Die schweren und leichten Ketten bestehen hierbei aus bestimmten Abschnitten, die wiederum aus kleinen, einzelnen DNA Segmenten (Exons) bestehen. Bei der Reifung von Antikörpern wird im Regefall jeweils ein Exon (bzw. Segment) aus jeweils einem Abschnitt mit den anderen zusammengefügt. So dass letztendlich ungefähr 1,92 Millionen Kombinationsmöglichkeiten vorhanden sind.
Antikörper als B-Zell-Rezeptoren
Membranständige Antikörper (als B-Zell-Rezeptoren (BCR) bezeichnet) können B-Zellen aktivieren, wenn sie durch Antigene quervernetzt werden. Die B-Zelle nimmt daraufhin den Immunkomplex durch Endocytose auf, verdaut das Antigen proteolytisch und präsentiert über MHC Klasse II-Moleküle kurze Fragmente davon (Peptide mit einer Länge von 8-12 Aminosäuren) auf ihrer Zelloberfläche. Wenn die präsentierten Fragmente dann von einer CD4-T-Zelle (T-Helferzellen) als fremd erkannt werden, stimuliert diese T-Zelle die B-Zelle, was weitere Reifungsprozesse (somatische Hypermutation, Klassenwechsel) sowie die Umwandlung der B-Zelle zur antikörpersezernierenden Plasmazelle oder zur Memory B-Zelle auslöst. Diese Reifungsprozesse finden innerhalb von Keimzentren in den sekundären lymphatischen Organen (Milz, Lymphknoten) statt und werden unter dem Begriff der Keimzentrumsreaktion zusammengefasst.
Wirkungsweisen von sezernierten Antikörpern
Sezernierte Antikörper wirken durch verschiedene Mechanismen:
- Die einfachste ist die Neutralisation von Antigenen. Dadurch, dass der Antikörper das Antigen bindet, wird dieses blockiert und kann beispielsweise seine toxische Wirkung nicht mehr entfalten, oder andere Wechselwirkungen des Antigens mit Körperzellen werden verhindert.
- Ein weiterer ist die Opsonisierung durch das Einhüllen von Krankheitserregern und Fremdpartikeln mit Antikörpern.
- Eine dritte Wirkungsweise ist, dass Antiköper das Komplementsystem über den klassischen Weg aktivieren.
- Antikörper, die an körpereigene Zellen binden, können NK-Zellen aktivieren, welche diese Zellen dann abtöten. Dieser Prozess wird auch als "Antibody-dependent cell-mediated cytotoxicity" (ADCC) bezeichnet.
Verschiedene Klassen (Isotypen) von Antikörpern
Es gibt im Körper fünf verschiedene Gruppen (Klassen) von Antikörpern. Die verschiedenen Isotypen kommen in verschiedenen Kompartimenten des Körpers vor und haben unterschiedliche Aufgaben:
IgA

- IgA wird auf allen Schleimhäuten der Atemwege, der Augen, des Magen-Darm-Trakts, des Urogenitaltrakts sowie über spezielle Drüsen rund um die Brustwarze von Müttern sezerniert und schützt dort vor Pathogenen (auch das Neugeborene). Sezerniertes IgA kommt in Form von Homo-Dimeren vor; die beiden Anteile sind durch das "Joining-Peptide" verbunden.
IgD
- IgD wird durch differentielles Spleißen der IgM/IgD-Prä-mRNA zusammen mit IgM als B-Zell Rezeptor (BCR) auf reifen, naiven (antigenunerfahrenen) B-Zellen membranständig coexprimiert.
- Es ist nur in geringen Mengen in sezernierter Form in Blut und Lymphe vorhanden, die Funktion ist unbekannt.
IgE
- IgE vermittelt den Schutz vor Parasiten, wie z.B. Würmern. Es wird durch Fc-Rezeptoren auf Mastzellen gebunden. Aus diesem Grund ist nahezu alles IgE membrangebunden, im Blut ist es praktisch nicht vorhanden. Bei Antigenkontakt wird es quervernetzt, was zur Ausschüttung von Histamin, Granzymen etc. durch die Mastzellen und Granulozyten führt. Diese töten den Erreger ab. Letztere wirken außerdem stark gefäßerweiternd und Permeabilitätserhöhend, was das Herankommen anderer Immunzellen erleichtert. Es wirkt außerdem muskelkontraktierend, was die Ausscheidung der Erreger über Lunge und Darm erleichtert.
- IgE ist ebenso an der allergischen Sofortreaktion beteiligt.
IgM
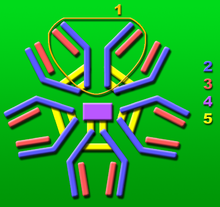
- IgM wird als erster Antikörper nach dem Kontakt mit Antigenen gebildet und zeigt die akute Infektionsphase einer Krankheit an. (z.B. Anti HBs IgM = gegen das Hepatitis B Virus gerichtete Antikörper der IgM-Klasse (Zeichen der aktiven Hepatitis B-Erkrankung)
- IgM ist ein Pentamer (Multimer) aus fünf Untereinheiten. Auch diese Untereinheiten sind durch das Joining Peptide verbunden.
- IgM ist nicht plazentagängig.
IgG

- IgG wird erst in einer verzögerten Abwehrphase (3 Wochen) gebildet und bleibt lange erhalten. Es zeigt eine durchgemachte Infektion an. (Bsp.: Anti HBs IgG = gegen das Hepatitis B-Virus gerichtete Antikörper der IgG-Klasse, Zeichen einer stattgefunden Hepatitis B-Erkrankung oder Impfung)
- IgG wird außerdem aktiv über das Blut und die Plazentaschranke in den Fötus transportiert und sorgt dort auch nachgeburtlich für einen ersten Schutz vor Infektionen (Nestschutz, Leihimmunität).
Anwendung von Antikörpern in der Medizin
Aus Tieren gewonnene Antikörper (Antiseren) werden als Therapeutikum für verschiedenste Zwecke eingesetzt. Ein wichtiges Beispiel ist die Verwendung als passiver Impfstoff.
Außerdem werden monoklonale Antikörper seit neuestem in der Medizin therapeutisch eingesetzt (Intravenöse Immunglobulingabe, IVIG). Hauptanwendungsgebiet ist die Hämatologie und Onkologie, daneben werden sie auch in der Behandlung von Autoimmunerkrankungen (z. B. bei Multipler Sklerose) wie der Rheumatoiden Arthritis (RA) eingesetzt. Hierbei erkennen diese Antikörper pro-inflammatorische Zytokine wie IL-1 oder TNF-a.
Antikörper können auch dazu benutzt werden bestimmte Stoffe im Körper ausfindig zu machen. Dazu hängt man an den Antikörper einen schwach radioaktiven Stoff. Wenn man den Antikörper nun darauf ausrichted, sich an einen bestimmten Stoff zu hängen, indem man die Antigen-Bindestelle entsprechend verändert, kann man durch Röntgenaufnahmen feststellen, wo der radioaktive Stoff sich genau befindet. Dies kann zum Beispiel dazu benutzt werden, Geschwülste im Körper ausfindig zu machen.
Früher war der konstante Teil der Antikörper noch murin (aus der Maus), was zu Abstoßungsreaktionen durch das Immunsystem führen konnte. Um dieses Problem zu umgehen, werden neuerdings sogenannte humanisierte Antikörper verwendet. Herkömmliche monoklonale Antikörper enthalten neben der die Spezifität gegen humane Antigene vermittelnden variablen Region immer noch Proteinbestandteile der Maus, die das menschliche Immunsystem möglicherweise als fremdartig abstößt. Mit Hilfe molekularbiologischer Verfahren werden deshalb die murinen Teile der konstanten Abschnitte entfernt und durch baugleiche konstante Teile menschlicher Antikörper ersetzt. Die konstanten Abschnitte der Antikörper spielen für die spezifische Bindung des monoklonalen Antikörpers keine Rolle. Der so entstandene monoklonale Antikörper wird als „humanisierter monoklonaler Antikörper" bezeichnet und wird vom Immunsystem des Menschen nicht mehr abgestoßen. Humanisierte Antikörper werden in einer Kultur aus Hamster-Ovarialzellen hergestellt, weshalb ihre Produktion sehr viel aufwendiger und deshalb auch teurer als die Produktion in Mikroorganismen ist.
Die hohe Spezifität, mit der Antikörper ihr Antigen erkennen, macht man sich in der Biologie und der medizinischen Diagnostik zu Nutze, um ein Antigen sichtbar zu machen. Es wird folgendermaßen vorgegangen: Zunächst muss das Antigen, gegen das der Antikörper gerichtet sein soll, ausgewählt und produziert werden. Dies kann auf verschiedene Weisen erreicht werden, zum Beispiel, indem ein Peptid in vitro synthetisiert wird oder das Protein als ganzes rekombinant in Bakterien hergestellt wird. Anschließend wird das Protein einem Tier injiziert, dessen Immunsystem dann Antikörper gegen das Protein bildet. Als Antikörper-Produzenten werden besonders Mäuse und Kaninchen, aber auch Ziegen, Schafe und Pferde verwendet. Die Immunisierung wird mehrfach wiederholt. Nach ein paar Wochen können die Antikörper aus dem Blut der immunisierten Tiere gewonnen werden und z.B. für die Immunhistochemie (Pathologie), die mikrobiologische Diagnostik (ELISA) oder anderes (Schwangerschaftstest, ELISPOT, FACS, SEREX) verwendet werden.
Zytokine[Bearbeiten]
Ein Zytokin ist ein Glykoprotein das regulierend in die Aktivität, Proliferation und Differenzierung bestimmter Körperzellen eingreift. Zu den Zytokinen zählen z.B. Wachstumsfaktoren und Entzündungsmediatoren. Einige Zytokine werden heute kommerziell als rekombinante Proteine produziert. Man unterscheidet im Wesentlichen vier Hauptgruppen von Zytokinen:
Interferone (IFN)
Interferone werden von Leukozyten, Fibroblasten und T-Lymphozyten gebildet und haben eine immunstimulierende, vor allem einen antivirale und antitumorale Wirkung. Interferone werden auch als Medikamente eingesetzt, z.B. zur Behandlung chronischer Virushepatitiden. Nebenwirkungen sind hier unter anderem als ausgeprägte grippeähnliche Symptome möglich.
Interleukine (IL)
Interleukine dienen der Kommunikation der Leukozyten untereinander.
Koloniestimulierende Faktoren (CSF)
Hierbei handelt es sich um Wachstumsfaktoren der Blutzellen. Beispiele sind Erythropoetin (Erythrozyten) und G-CSF, Granulozyten-Koloniestimulierender Faktor). Therapeutische Einsatzmöglichkeiten bestehen bei der Niereninsuffizienz, bei Knochenmarkschäden nach Chemotherapie oder beim Myelodysplastischen Syndrom (MDS).
Tumornekrosefaktoren (TNF)
Zytokinrezeptoren
Die Rezeptoren für Zytokine lassen sich in 7 Gruppen unterteilen:
- Die Hämatopoetin-Rezeptorfamilie, Rezeptoren für IL-2, IL-3, IL-4, IL-5, IL-7, IL-9, IL-11, L-12,IL-13, IL-15, EPO, TPO, LIF, G-CSF, GM-CSF
- Die Interferon-Rezeptorfamilie, Rezeptoren für IFNa/b, IFNg, IL-10
- Die TNF-Rezeptorfamilie (death receptors), Rezeptoren für TNF-alpha, TNF-beta, FasL, CD27, CD30, CD40 (Trimere Rezeptoren)
- Die Immunglobulin(Ig)-Superfamilie-Rezeptoren, Rezeptoren für IL-1a, IL-1b (aber auch BCR, TCR, MHC u.a.)
- Die Tyrosinkinase-Rezeptoren, Rezeptoren für M-CSF, SCF
- Ras/Raf-pathway
- Jak/STAT-pathway
- Die Serin-/Threoninkinase-Rezeptoren, Rezeptoren für TGFb u.a.
- Die Chemokin-Rezeptoren (7TMHR)
Interferone[Bearbeiten]
IFN ist ein Protein oder Glykoprotein, das eine immunstimulierende, vor allem antivirale und antitumorale Wirkung entfaltet. Es wird als körpereigenes Gewebehormon v.a. von Leukozyten, Fibroblasten und T-Lymphozyten gebildet.
Interferon-alpha
- "Leukozyten-IFN", früher Typ I
- Struktur: Protein aus 150-172 Aminosäuren; 23 bekannte Varianten, die meisten davon sind nicht glykosyliert
- Bildung: Alpha-Interferon wird von Monozyten gebildet, die von Viren befallen sind oder Kontakt mit bösartigen Zellen gehabt haben.
- Antivirale Wirkung: Interferon aktiviert umliegende virusinfizierte sowie nichtinfizierte Zellen. In diesen Zellen werden folglich Proteine gebildet welche a) eine weitere (Virus-)Proteinsynthese in jenen Zelle hemmen und b) den Abbau von viraler und zellulärer RNA bewirken. Vermehrt werden MHC-Klasse-I-Moleküle sowie Proteasen gebildet, welche virusinfizierte Zellen durch T-Lymphozyten leichter angreifbar machen. Interferon alpha aktiviert NK-Zellen (natürliche Killer-Zellen dienen der Virus- und Tumorabwehr).
- Therapeutischer Einsatz : Interferon-alpha wird seit mehreren Jahren zur Therapie der akuten und chronischen Hepatitis-B- sowie zur Therapie der chronischen Hepatitis C-Infektion eingesetzt. Therapeutisch kommt bei diesen Erkrankungen das Interferon-alpha-2b zum Einsatz, das dreimal die Woche subkutan injiziert wird. Mittlerweile sind leicht veränderte, sogenannte pegylierte Interferone erhältlich (das Interferon wird mit einem verzweigten Polyethylen-Glykol-(PEG)-Molekül versehen), die aufgrund einer längeren Halbwertszeit nur einmal pro Woche verabreicht werden müssen. Neben dem therapeutischen Einsatz der alpha-Interferone in der Therapie der Virushepatitis werden Interferone dieser Gruppe auch in der onkologischen Therapie eingesetzt und zwar zur Therapie der Haarzellen-Leukämie, dem kutanen T-Zell-Lymphom sowie dem Kaposi-Sarkom. Die antitumorale Wirksamkeit der alpha-Interferone beruht zum einen auf einer antiproliferativen Wirkung, d.h. die Tumorzellen werden in ihrer gesteigerten Teilungsaktivität gehemmt und zum anderen sowohl auf der Aktivierung von natürlichen Killerzellen, die Tumorzellen selbst abtöten können als auch in der Differenzierungsinduktion.
Interferon-beta
- "Fibroblasten-IFN", früher Typ I
- Struktur: Glykoprotein aus 166 Aminosäuren; nur eine Variante
- Bildung: IFN-beta wird von virusinfizierten Fibroblasten und vermutlich auch von allen anderen Zellen gebildet. Siehe Interferon-alpha.
- Antivirale Wirkung: Interferon-beta bindet an den gleichen Rezeptor wie Interferon-alpha. Siehe Interferon-alpha
- Einsatz als Medikament: Behandlung der Multiplen Sklerose und schwerer Viruserkrankungen.
Interferon-gamma
- "Immun-IFN", früher Typ II
- Struktur: IFN-gamma ist Glykoprotein aus 146 Aminosäuren und liegt in aktiver Form als Heterodimer vor.
- Bildung: TH1-Zellen (Subpopulationen sowohl CD4+ als auch CD8+, Teil der adaptiven Immunabwehr) bilden IFN-gamma nach Kontakt mit einem Makrophagen, welcher Bakterien phagozytiert hat.
- Aktivierende Wirkung auf Makrophagen:
- Bessere Verschmelzung von Phagosomen mit Lysosomen
- Produktion des bakterizidem Stickstoffmonoxid
- Bildung reaktiver Sauerstoffradikale
- Induktion antimikrobieller Peptide
- Einsatz als Medikament: Gegen Osteoporose, gegen Tumoren (mit z.Z. geringerem Erfolg)
Entwicklung
- 1957 Entdeckung durch den Briten Alick Isaacs und den Schweizer Jean Lindemann am National Institute for Medical Research in London.
- 1979 Im Labor von Charles Weissmann in Zürich gelingt die Übertragung von menschlichen Interferon-Genen in Bakterien. Damit wurde die Herstellung von reinem Interferon in beliebigen Mengen möglich
Weblink: http://www.biotechpropertyrights.uni-bremen.de/empirie/erfasste-sachverhalte/chronologien/interferon-beta/w00000729/w00000729.htm - Chronologie der Entwicklung
Zulassungen als Arzneimittel
| Datum | Handelsname | Wirkstoff | Hersteller | Indikation |
| 1983 | Fiblaferon® | IFN beta | Rentschler | Schwere Viruserkrankungen / 2003 SARS |
| 04/1987 | Roferon A® | IFN alpha-2a | Roche | Krebs |
| 12/1992 | Imukin® | IFN gamma-1b | Boehr. Ing. | Krebs |
| 11/1995 | Betaferon® | IFN beta-1b | Schering | Multiple Sklerose |
| 03/1997 | Avonex® | IFN beta-1a | Biogen | Multiple Sklerose |
| 05/1998 | Rebif® | IFN beta-1a | Serono | Multiple Sklerose |
| 02/1999 | Inferax® | IFN alphacon 1 | Yamanouchi | Hepatitis C |
| 03/2000 | Intron A® | IFN alpha-2b | Schering-Plough | Hepatitis B/C |
| 02/2002 | PegIntron® | pegyliertes IFN alpha-2b | Schering-Plough | Hepatitis C |
| 06/2002 | Pegasys® | pegyliertes IFN alpha-2a | Roche | Hepatitis B/C |
Interleukine[Bearbeiten]
Interleukinewerden in mehrere Untergruppen unterteilt, welche durch Zahlen gekennzeichnet werden (IL-1 bis IL-32; Stand Oktober 2005). Jedes Interleukin moduliert das Wachstum, die Differenzierung und die Aktivierung bestimmter Immunozyten.
Interleukin-1
IL-1 wird von Makrophagen gebildet und wirkt proinflammatorisch. Es lagert sich u.a. an Chondrozyten an und bewirkt die Freisetzung knorpelzerstörender Enzyme. Dadurch kommt es zum Abbau von Knorpelsubstanz und letztendlich zur Zerstörung der Gelenke. Im Bereich der Orthopädie wird seit etwa 1998 eine Therapie mit einem IL-1-Antagonisten betrieben, der aus körpereigenem Blut gewonnen wird und in angereichter Form in ein erkranktes Gelenk injiziert wird. Die bislang durchgeführten Studien deuten eine Therapieoption bei Frühformen der Arthrose an.
Bei schizophrenen Patienten konnten veränderte Interleukin-1 Werte im Blut, im Liquor sowie im präfrontalen Cortex festgestellt werden.
Interleukin-2
IL-2 ist therapeutisch eines der wichtigsten Interleukine. Es wird bei Immunreaktionen auslösenden, malignen Tumoren ausgeschüttet und bewirkt die Produktion von T-Helfer-Zellen. Außerdem interagiert es mit spezifischen Oberflächenrezeptoren auf Lymphozyten und aktiviert unspezifische zytotoxische Effektorzellen. Interleukin-2 ist ein Wachstumsfaktor für Lymphozyten und an der Reifung und Differenzierung von Thymozyten, B-Lymphozyten, Monozyten, Makrophagen und epidermalen dendritischen Zellen und NK-Zellen beteiligt.
Interleukin-3
IL-3 wirkt auf die Stammzellen im Knochenmark und wird zur Stimulation der Blutbildung nach einer Chemotherapie, nach Knochenmarks- oder Stammzelltransplantation eingesetzt.
Interleukin-4
IL-4 agiert (so wie IL-10 und IL-11) als sog. anti-inflammatorisches Zytokin, indem es überschießende Entzündungsreaktionen verhindert und somit wichtig für die Homöostase des Immunsystems ist. Außerdem stimuliert IL-4 die B-Zellaktivierung und die IgE-Produktion.
Interleukin-5
IL-5 wirkt positiv chemotaktisch auf eosinophile Granulozyten und steigert die Synthese und Sekretion von Immunglobulin A durch Plasmazellen.
Interleukin-6
IL-6 bewirkt in der Leber die vermehrte Synthese von Akute-Phase-Proteinen. Es werden sowohl pro- als auch antiinflammatorische Effekte diskutiert. Es wird vor allem von Monozyten/Makrophagen, aber auch von Epithel- und Endothelzellen sezerniert und besitzt eine prognostische Bedeutung in der Beurteilung von Trauma und Sepsis.
Interleukin-7
IL-7 wird von Stromazellen der lymphatischen Organe produziert und stimuliert das Wachstum von Vorläuferzellen der B- und T-Lymphozyten.
Interleukin-8
IL-8 ist ein Chemokin der CXC Familie und wird unter anderem durch Endothelzellen, Monozyten, Epithelzellen und Fibroblasten produziert. Ein wichtiger Angriffspunkt des Chemokins sind neutrophile Granulozyten. Die wesentlichen biologischen Wirkungen von IL-8 auf Granulozyten beinhalten die Förderung der Chemotaxis, die Stimulation der Expression von Adhäsionsmolekülen und die Aktivierung mit Freisetzung von Sauerstoffradikalen und Granula.
Interleukin-10
IL-10 agiert (so wie IL-4 und IL-11) als sog. anti-inflammatorisches Zytokin, indem es die Makrophagenfunktion hemmt und somit überschießende Entzündungsreaktionen verhindert. Gebildet wird es vor allem von TH2-Zellen sowie regulatorischen T-Zellen.
Interleukin-11
IL-11 agiert (so wie IL-4 und IL-10) als sog. anti-inflammatorisches Zytokin, indem es überschießende Entzündungsreaktionen verhindert und somit wichtig für die Homöostase des Immunsystems ist.
Interleukin-12
IL-12 besitzt eine zentrale Funktion in der Anstoßung und Fortdauer einer TH-1-Immunantwort und hat einen Einfluss den Verlauf von intrazellulären Infektionen [3]. Neuere Forschungsergebnisse lassen vermuten, dass ILn-12 auch Enzyme aktivieren kann, welche dann in der Lage sind, geschädigte Erbsubstanz schneller wieder zu reparieren [4]. Eine weitere nachgewiesene Wirkung von IL-12 besteht darin, dass es die Möglichkeit von T-Killerzellen fördert, in einen Tumor einzudringen und ihn zu zerstören.
Interleukin-13
IL-13 wird von T-Lymphozyten produziert und stimuliert die Bildung und Differenzierung von B-Lymphozyten. Weiterhin inhibiert IL-13 die Aktivierung von Makrophagen.
Interleukin-16
IL-16 scheint eine Rolle bei der Rheumatoiden Arthritis zu spielen.
Interleukin-18
IL-18 konnte in erhöhter Konzentration in der Synovia von Patienten mit rheumatoiden Arthritis nachgewiesen werden.
Interleukin-23
Bei vielen Autoimmunerkrankungen wie beispielsweise der rheumatoiden Arthritis, der Multiplen Sklerose, Morbus Crohn und der Psoriasis kann IL-23 die Bildung von T-Zellen stimulieren, die sich anschließend gegen den eigenen Körper richten [5]. Außerdem kann es die indirekt tumorzerstörende Wirkung von Interleukin-12 behindern.
Einsatz als Therapeutikum
Bei einer Immuntherapie oder Immunmodulation mit Interleukin (i.d.R. IL-2) wird versucht die Immunantwort des Organismus gegen maligne Tumoren oder eine Infektion (bspw. bei HIV) zu stimulieren.
Meist werden bei der Behandlung maligner Tumore (Nierenzellkarzinom, malignes Melanom) Kombinationspräparate von IL und anderen Mitteln eingesetzt, wie beispielsweise IFN und/oder Zytostatika. Die Nebenwirkungen bei einer Therapie mit IL können erheblich sein, beispielsweise Fieber, Müdigkeit, Exantheme, Herzrasen, Ödeme.
Häufiger und erfolgreich angewendet werden sogenannte "Anti-IL" bei Morbus Crohn und vor allem bei autoimmunbedingten rheumatischen Erkrankungen.
Tumornekrosefaktoren[Bearbeiten]
Zur Familie der Tumornekrosefaktoren (TNF) gehören u.a. TNF-alpha und TNF-beta. Der erste Tumornekrosefaktor (TNF-α) wurde 1893 indirekt von William Coley entdeckt.
TNF-α
TNF-α (Kachektin) wird von Makrophagen/Monozyten sowie Lymphozyten und Mastzellen gebildet und ist ein Mediator, der auf Entzündungsprozesse, Blutbildung, Immunsystem, Angiogenese und Tumore einwirkt. Dabei ist er in seiner Wirkungsweise dem IL-1 sehr ähnlich. Im Hypothalamus stimuliert es die Freisetzung des Corticotropin-Releasing-Hormon (CRH), löst Fieber aus und unterdrückt den Appetit (daher die von "Kachexie" abgeleitete Namensgebung). In der Leber setzt es das C-reaktive Protein (CRP) frei.
TNF-β
TNF-β (Lymphotoxin) wird nur von bestimmten T-Zellen sezerniert. TNF-β aktiviert dann Makrophagen, die infolge IL-1, IL-6 und TNF-α produzieren. TNF-β hat eine toxische Wirkung auf einige Tumorzelllinien.
Einsatz als Therapeutikum
Die Möglichkeiten Tumornekrosefaktoren therapeutisch zu verwerten sind vor allem durch die kurze Halbwertszeit dieser Stoffe beschränkt. TNF-α hemmende Medikamente werden vor allem in der Rheumatherapie eingesetzt. Diese Medikamente sind relativ neu und vielversprechend.
Reifung und Alterung des Immunsystems[Bearbeiten]
Im Thymus, der Reifungsstätte der T-Zellen, differenzieren sich T-Zellen in die verschiedenen Typen wie CD4- und CD8-Zellen. Anschließend werden sie mit körpereigenen Substanzen konfrontiert. Wenn eine T-Zelle einen dazu passenden Rezeptor trägt und an die körpereigene Struktur bindet, stirbt die T-Zelle ab (negative Selektion). Dadurch wird sichergestellt, dass gereifte T-Zellen im Körper nur fremdartige Moleküle attackieren. Alle Mechanismen, die dafür Sorge tragen, dass sich das Immunsystem nicht gegen den eigenen Organismus wendet, werden unter dem Oberbegriff der Selbsttoleranz zusammengefasst. Ebenso findet eine positive Selektion statt. Nur T-Lymphozyten, die MHC-Fremdantigen-Komplexe richtig erkennen überleben.
Der Organismus von Säuglingen ist erst ab dem ca. 6.-8. Lebensmonat in der Lage, wirkungsvoll T-Zellen zu differenzieren. Diaplazentar (IgG) und auch über die Muttermilch (IgA) werden Antikörpern auf das Kind übertragen, um es bis dahin besser vor Krankheiten zu schützen (Leihimmunität, Nestschutz). Die Leihuimmunität ist auch der Grund, warum Lebendimpfungen (die Impfstämme müssen sich dazu im Impfling vermehren können) erst nach dieser Frist wirksam sind.
Ab der Pubertät atrophiert der Thymus, das Thymusgewebe wird größtenteils durch Fett ersetzt.
Immunologische Konstellationen[Bearbeiten]
Die lokale Entzündungsreaktion[Bearbeiten]
Eine Entzündung ist eine Gewebsabwehrreaktion.
Ursachen: Eine Entzündung kann durch Mikroorganismen (bakteriell eher eitrige, d.h. granulozytäre Entzündung, viral eher seröse, lymphoplasmazelluläre Entzündung) und durch mechanische, thermische, chemische oder durch ionisierende Strahlen verursachte Schäden ausgelöst werden.
Ablauf:
- Schädigung
- Gefäßreaktion, erhöhte Gefäßpermeabilität (Schwellung), Thrombosierung (Auskopplung vom Blutkreislauf), Ausschüttung von Entzündungsmediatoren und Zytokinen (Chemotaxis), Änderung der Genexpressionsmuster (Transkriptionsfaktor NF-κB)
- Granulo-monozytäre Reaktion (angeborenes Immunsystem)
- Lympho-plasmazelluläre Reaktion (adaptives Immunsystem) und Bildung von Granulationsgewebe (Fibroblasteneinwanderung, Angiogenese)
- Kollagenfaserbildung, Vernarbung
Die 5 klassischen Entzündungszeichen sind die Rötung (rubor), die Schwellung (tumor), die Überwärmung (calor), der Schmerz (dolor) und die Funktionseinschränkung (functio laesa).
Die systemische Entzündungsreaktion[Bearbeiten]
Im Rahmen von größeren Gewebsschädigungen (z.B. Verletzungen, Operationen, Infektionen) kommt es zu einer unspezifischen Immunreaktion (Akute-Phase-Reaktion, SIRS). Endothelzellen, Fibroblasten und Entzündungszellen wie z.B. Makrophagen im geschädigten Gewebe setzen dabei Mediatoren frei, z.B. IL-1, IL-6, TNF-alpha, TGF-beta, IFN-gamma, EGF, LIF u.a., die über die Blutbahn die Leber erreichen. Dort stimulieren sie in Anwesenheit von Cortisol die Leber zur vermehrten Synthese der etwa 30 verschiedenen Akute-Phase-Proteine. Ihre Konzentration nimmt innerhalb von 6-48 Stunden nach dem schädigenden Ereignis auf das zwei- bis eintausendfache zu.
Funktionen der Akute-Phase-Reaktion:
- Lokalisierung der Entzündung
- Verhinderung der Ausbreitung
- Unterstützung des Immunsystems bei der Sanierung des Entzündungsherdes

Akute-Phase-Proteine
- Fibrinogen steigert die Gerinnungsneigung. Dadurch wird eine lokale Thrombusbildung im Entzündungsgebiet forciert und Erreger werden nicht weiter in die Blutbahn ausgeschwemmt.
- alpha1-Antitrypsin und alpha-Antichymotrypsin wirken den vermehrt freigesetzten Proteasen entgegen und reduzieren so die Entzündungsbedingte Gewebsschädigung.
- C-Reaktives-Protein bindet sich vermutlich an Erreger und dient der Opsonisierung und Aktivierung des Komplementsystems. Klinisch ist es der wichtigste Entzündungsparameter in der Labordiagnostik.
- saures Alpha1-Glykoprotein fördert Fibroblastenwachstum und interagiert mit Kollagen
- Haptoglobin ist für die Hämoglobinbindung und den -transport zuständig
- Coeruloplasmin hemmt die Bildung freier Sauerstoffradikale
- Komplement-C3 fördert die Opsonierung und Chemotaxis und ist für die Komplementkaskade wichtig.
- Plasminogen ist ein fibrinolytisches Peptid bzw. dessen Vorstufe.
- Transferrin und Albumin sind "Negativ-Akute-Phase-Proteine", d.h. ihre Serumkonzentration sinkt ab.
Autoimmunerkrankungen[Bearbeiten]
Bei Autoimmunerkrankungen ist das üblicherweise sehr gut ausbalancierte Gleichgewicht zwischen potentiell autoreaktiven T-Zellen und regulatorischen T-Zellen gestört. Das Immunsystem richtet sich gegen körpereigene Strukturen.
Einige Beispiele für Autoimmunerkrankungen sind:
- Diabetes Typ I - Reaktion gegen Insulin produzierende B-Inselzellen des Pankreas
- Rheumatoide Arthritis - Reaktion gegen Synovialschleimhaut
- Multiple Sklerose - Reaktion gegen die Myelinscheiden im zentralen Nervensystem
Allergisch-hyperergische Reaktionen[Bearbeiten]
Als eine Allergie (griechisch αλλεργία „die Fremdreaktion“, von άλλος „anders, fremd“ und έργον „die Arbeit, Reaktion“) wird eine überschießende und unerwünschte heftige Abwehrreaktion des Immunsystems auf bestimmte und normalerweise harmlose Umweltstoffe (Allergene) bezeichnet, auf die der Körper mit Entzündungszeichen und der Bildung von Antikörpern reagiert (Antigen(Allergen)-Antikörper-Reaktion).
Die konkrete Bezeichnung Allergie wurde 1906 von Freiherr Clemens von Pirquet, einem Wiener Kinderarzt, geprägt.
Überempfindlichkeitsreaktionen: Arten und Definitionen[Bearbeiten]
Überempfindlichkeitsreaktionen sind inadäquate immunologische Reaktionen gegenüber hamlosen "Fremd"-Substanzen. Man unterscheidet:
- Echte Allergie: Unter Beteiligung des Immunsystems, insbesondere der Antikörper.
- Pseudoallergie: Ohne Beteiligung des Immunsystems, aber unter dem Einfluss von Histamin und anderen Mediatoren, die auch bei Immunreaktionen auftreten, z. B. Histaminose nach Rotwein- oder Käsegenuss.
- Intoleranz (auch unscharf Unverträglichkeit genannt): Vergiftungsymptome bei an sich normaler Dosierung oder Konzentration eines Stoffes wegen unzureichender Verarbeitung zugeführter oder freigesetzter Substanzen, ohne Beteiligung von Immunsystem oder Mediatoren, aber vermutlich mit Komplementaktivierung und / oder übermäßig labilen Zellmembranen von Mastzellen und basophilen Granulozyten oder Stoffwechselstörungen der Arachidonsäure. Beispiele sind die Zöliakie/einheimische Sprue und die klinisch wichtige Analgetika-Intoleranz.
Handelt es sich bei einer Intoleranz ursächlich um ein falsch oder zu wenig gebildetes Enzym, so spricht man auch von einer Idiosynkrasie. Beispiel ist die Alkoholintoleranz durch ALDH-Mangel (Asiaten, sporadisch).
Klinische Einteilung der Überempfindlichkeitsreaktionen[Bearbeiten]
Die folgende Einteilung nach Coombs und Gell von 1963 lässt unterscheidet vier Typen. In der Realität bestehen vielfach Mischformen:
Typ I, Soforttyp
Anaphylaxie (häufigster Typ): Innerhalb von Sekunden oder Minuten vermitteln zellständige IgE-Antikörper die Freisetzung diverser Mediatoren wie Histamin, aber auch Prostaglandine und Leukotriene aus den basophilen Granulozyten und Mastzellen.
Typische Erkrankungen sind die Urtikaria, die allergische Konjunktivitis, der Heuschnupfen und das allergische Asthma; aber auch das angioneurotische Ödem und der anaphylaktische Schock sind Soforttyp-Reaktionen.
Eine etwas verzögerte zweite Reaktion kann nach bis zu sechs Stunden auftreten.
Typ II, Zytotoxischer Typ
Innerhalb von Stunden (bis zu zwölf) bilden zellständige Antigene (also aufgenommene Fremdsubstanzen wie gewisse Medikamente oder transfundiertes Blut) Immunkomplexe mit körpereigenen, im Blutstrom kreisenden IgG-Antikörpern; diese aktivieren zytotoxische Killerzellen und Komplement, daraufhin kommt es zur Zerstörung (Lyse) körpereigener Zellen.
Typische Erkrankungen sind die medikamentös-induzierte Thrombopenie und Agranulozytose (selten) sowie die hämolytische Anämie nach Transfusionszwischenfall (selten).
Typ III, Immunkomplex- oder Arthus-Typ
Innerhalb von Stunden bilden sich hier zellständige oder freie Antigen-Antikörper-Komplexe mit Stimulation der Komplementkaskade, der Phagozytose und Mediatorfreisetzung.
Typische Erkrankungen sind chronische Vaskulitiden, die so genannte Farmer-Lunge, die Serumkrankheit und die Aspergillose.
Typ IV, Spättyp, verzögerter Typ
Nach einem halben bis drei Tagen setzen sensibilisierte T-Lymphozyten chemotaktische Lymphokine frei, die lokal zur Entzündung führen. Der Typ IV ist die einzige zellvermittelte Reaktion.
Typische Erkrankungen/Phänomene sind die Kontaktallergie/-ekzem, die Abstoßungsreaktion nach Transplantation, das Arzneimittelexanthem, aber auch die Tuberkulinreaktion bei Verdacht auf Tuberkulose.
Quellen[Bearbeiten]
- ↑ Fuchs TA et al. “Novel cell death program leads to neutrophil extracellular traps”. J Cell Biol, Jan 8 2007. DOI:10.1083/jcb.200606027. PMID:17210947
- ↑ Puellmann K et al. “A variable immunoreceptor in a subpopulation of human neutrophils”. Proc Natl Acad Sci U S A, 103(39):14441-6, Sep 26 2006. Epub Sep 18 2006. DOI:10.1073/pnas.0603406103. PMID:16983085
- ↑ http://hepatitis-c.de/il12.htm
- ↑ Nature Cell Biology, Bd. 4, S. 26
- ↑ http://www.unipublic.unizh.ch/magazin/gesundheit/2005/1571.html
website: http://www.monozyten.de
