Medizinische Mikrobiologie: Mykologie
Allgemeine medizinische Mykologie[Bearbeiten]

Pilze (Fungi, Mycetes) sind heterotroph lebende, chlorophyllose, eukaryontische Lebewesen. Sie besitzen häufig eine Zellwand, die aus Zellulose, Chitin, Proteinen, Glucan- und Mannanpolymeren aufgebaut sein kann. Von den etwa 100.000 beschriebenen Pilzarten verursachen etwa 100 regelmäßig Mykosen und einige hundert sind als Erreger opportunistischer Pilzinfektionen bekannt.
Morphologie[Bearbeiten]
Es gibt prinzipiell zwei Wachstumsformen. Hyphomyzeten (Schimmelpilze, Dermatophyten) bilden sich verzweigende Pilzfäden, sog. Hyphen, die septiert oder unseptiert sein können. Die Gesamtheit des Hyphengeflechts nennt man Myzel. Das vegetative Myzel ist die Wachstumsform, das fruktitative Myzel dient der Fortpflanzung. Die Hyphomyzeten lassen sich in die (ungefärbt) transparenten Hyalohyphomyzeten und die melaninhaltigen, braunen bis schwarzen Phaeohyphomyzeten einteilen.
Neben dem Hyphenwachstum der Hyphomyzeten stellt die Zellsprossung den zweiten wichtigen Wachstumsmodus bei Pilzen dar. Einige Candida-Arten können ein Pseudomyzel durch Längenwachstum der aussprossenden Tochterzellen (Blastosporen) ausbilden, wobei zwischen den Zellen deutliche Einziehungen verbleiben (im Ggs. zum echten Myzel, wo zuerst die Zellwand und dann die Septen gebildet werden). Invasiv ins Gewebe wachsender C. albicans kann auch echte Myzelien bilden. Zusätzlich findet man bei einigen Hefepilzen dickwandige Dauersporen, sog. Chlamydosporen, deren Aussehen sich bei manchen Arten, z.B. C. albicans auch zur Spezies-Differenzierung heranziehen läßt.
Vermehrung[Bearbeiten]
Pilze können sich ungeschlechtlich (als Anamorph) und geschlechtlich (als Teleomorph) vermehren. Beides geschieht über die Bildung von Sporen. Bei Spezies, von denen nur die erste Form bekannt ist spricht man von Fungi imperfecti. Letzteres trifft auf die meisten pathogenen Pilze zu.
Die ungeschlechtlichen Sporen heißen Konidiosporen bzw. [[Konidien.
Einteilung der Pilze[Bearbeiten]
Pilze lassen sich taxonomisch nach dem Verwandtschaftsgrad einteilen. Für den klinischen Gebrauch hat sich die Einteilung der Pilze nach dem DHS-Schema (nach Rieth) eingebürgert in
- Dermatophyten
- Schimmelpilze und
- Hefen
Eine Zwischenstellung nehmen dimorphe Pilze ein, die sowohl als Hefe (Y-Form), als auch als Schimmel (M-Form) vorkommen können.
Krankheitsbilder[Bearbeiten]
Man unterscheidet 5 Mykopathien, d.h. durch Pilze verursachte Erkrankungen:
- Myzetismus - Pilzvergiftungen durch den Genuß von Giftpilzen (z.B. von Amanita phalloides).
- Mykotoxikosen - Vergiftungen durch mit Pilzgiften (z.B. Aflatoxin) verunreinigte Lebensmittel.
- Mykoallergosen - Allergische Erkrankungen durch Pilzbestandteile.
- Mykotisation - Lokal begrenzte, nicht-invasive Besiedelung von (pathologischen) Hohlräumen, z.B. das Aspergillom in einer Tbc-Kaverne.
- Mykosen - Invasives Wachstum von Pilzen im lebende Gewebe.
Einteilung der Mykosen[Bearbeiten]
Die Mykosen lassen sich nach der bevorzugten Lokalisation einteilen in (Sub)Kutane Mykosen, Schleimhautmykosen, opportunistische System- und Organmykosen und außereuropäische System- und Organmykosen durch obligat pathogene Pilze.
Opportunisten[Bearbeiten]
Klinische Konstellationen, die an eine opportunistische Mykose denken lassen sollten!:
- Disponierende Risikofaktoren: (Zelluläre) Immundefekte, Neutropenie, Immunsuppression (Kortikoidtherapie, Immunsuppressiva z.B. nach Transplantation), Malignome, Chemotherapie, schwere Allgemeinerkrankungen, Diabetes mellitus, Katheter u.a.m.
- Klinisches Bild mit uncharakteristischem, Antibiotika-refraktärem Fieber mit untypischen Befunden.
Candida albicans[Bearbeiten]
Candida albicans ist ein Pilz der Candidagattung, die zu den Hefepilzen gehören. 90% der Kandidosen (auch Candidiasis oder Soor) werden von Candida albicans verursacht und er ist der häufigste Erreger opportunistischer Mykosen.
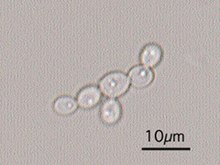
Morphologie und Eigenschaften: Candida albicans ist ein Gram-positiver, polymorpher Pilz, d.h. er bildet unterschiedliche Wachstumsformen aus. Die einzelnen Pilzzellen sind rundlich-oval und haben einen Durchmesser von ungefähr 4µm . Typisch für Candida albicans sind sowohl die Bildung von Pseudomyzelen (Fadenform) als auch die Bildung von echten Hyphen, d.h. septierten Myzelien (eher bei invasiven Wachstumsformen). Einzelne Myzelfäden können bereits mit bloßem Auge im Untersuchungsmaterial erkannt werden. Candida bildet auch elongierte Sprosszellen, sog. Blastokonidien. Auch Dauersporen, die sogenannten Chlamydosporen, sind ein wichtiges Unterscheidungsmerkmal von C. albicans zu anderen Hefen. Die Chlamydosporen bilden eine widerstandsfähige Zellwand und sind größer als Blastokonidien. C. albicans besitzt als diploider Organismus ein Genom mit einer Größe von 16 Megabasenpaaren, welches auf 2x8 Chromosomen verteilt ist. Bislang ist bei diesem Pilz kein sexuelles Stadium bekannt, so dass er zu den Fungi imperfecti zählt. Candida lässt sich gut unter Zugabe von Antibiotika (Unterdrückung von Bakterienkolonien) auf einfachen Nährböden anzüchten und bildet z.B. auf Sabourraud-Glucose-Agar cremefarbene, meist glatte Kolonien. Die Identifizierung gelingt bspw. mit Hilfe des Germinationsschlauch-Tests (GTT), biochemisch oder mittels Antigentest.
Vorkommen: Candida albicans ist bei Warmblütern häufig symptomlos auf den nasopharyngealen, intestinalen und urogenitalen Schleimhäuten zu finden, ebenso in den Interdigitalfalten. Etwa 75% der Gesunden sind Träger, im Darm ist er bei jedem zweiten Gesunden zu finden.
Krankheitsbilder: Als fakultativ pathogener Kommensale kann er unter geeigneten Bedingungen, bes. bei Störungen der zellulären Immunität (AIDS, Zytostatikatherapie, Antibiotikatherapie, Diabetes mellitus, Immundefekte...) eine endogene, opportunistische Mykose, die Kandidose (auch Candidose, Candidiasis, Candidamykose) hervorrufen. Die Candidamykose kann sich kutan (interdigital), mucokutan (Soor: Stomatitis candidomycetica, Soorösophagitis, Vaginitis usw.), Organbezogen (Organkandidose) oder systemisch als Candida-Sepsis manifestieren. Der Soor zeichnet sich durch weisse bis gelbliche, abwischbare Beläge auf schmerzhaft gerötetem und leicht blutendem Grund aus, die Umgebung ist meist nicht schmerzhaft.

Für die Existenz eines "Candida-Hypersensitivitäts-Syndroms" bzw. "Candidasyndroms" alias "Darmpilze" als mutmaßliche Ursache unterschiedlichster Beschwerden, die mit speziellen "Anti-Pilz-Diäten" (und Antimykotika) behandelt werden soll gibt es bisher keine wissenschaftliche Evidenz (Siehe Weblinks).
Diagnostik: Die Diagnose einer Candidiasis lässt sich mikroskopisch stellen, entweder durch den Nachweis aus Sterilkompartimenten oder bei Haut- oder Schleimhauterkrankung bioptisch-histologisch (der Abstrich reicht nicht aus, Normalflora!). Das Anlegen einer Kultur ist allerdings obligat. Die Identifizierung erfolgt z.B. über den Germinationsschlauchtest (GTT), biochemisch oder über Antigennachweis. Bildgebende Verfahren wie Gastroskopie, Sonographie, Röntgen und CT zeigen das Vorhandensein einer Infektion innerer Organe an. Systemische Infektionen mit Candida sind dann nur aus Blut-, Liquor- und Urinkulturen nachzuweisen. Falsch positive und - gerade bei der Sepsis - auch falsch negative Befunde sind nicht selten. Die Aussagekraft von Antikörpernachweisen im Venenblut ist umstritten, da Antikörper lange nach einer Infektion erhalten bleiben.
Therapie: An erster Stelle steht die Behandlung der Grunderkrankung und das Beseitigen disponierender Faktoren. Der Candida-Befall der Haut und Schleimhaut kann mit Nystatin, Amphotericin B oder Azolen behandelt werden, invasive Mykosen mit Amphotericin B (+ Nystatin) und Azolen.
 |
 |
 |
Weblinks:
Aspergillus sp.[Bearbeiten]
| Aspergillus sp. | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||
|
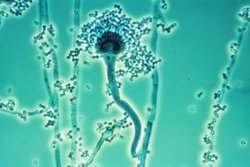
Aspergillus sp. ist eine Schimmelpilzgattung mit rund 200 Arten weltweit. Der Pilz tritt in zwei morphologischen Formen auf: In Schimmelform und in Hefenform.

Seine natürlichen Lebensräume sind Heu und Kompost. 1729 wurde Aspergillus vom italienischen Priester und Biologen P. Micheli zum erstenmal beschrieben. Das mikroskopische Bild des Pilzes erinnerte ihn an einem Aspergil (Weihwasserwedel), daher stammt der Name. Es ähnelt auch einem Gießkannenkopf, oder einem Aspergil, aus dem gerade Wasser austritt. Daher rührt auch der gelegentlich verwendete deutsche Name Gießkannenschimmel.
Morphologie und Eigenschaften:

Aspergilli sind aerobe Pilze mit Spezies-spezifischer Morphologie. Sie leben praktisch in allen sauerstoffreichen Umgebungen, gewöhnlich auf kohlenhydratreichen Substraten (Brot, Pistazien, Heu u.a.). Manche Aspergillus-Arten könne auch Ammoniak und Nitrate verwerten.
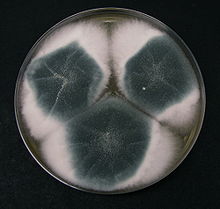
Wirtschaftliche Bedeutung: Aspergillus-Arten sind die wirtschaftlich wichtigsten Pilze. Sowohl primäre als auch sekundäre Stoffwechselprodukte werden verwendet. A. niger z.B. produzieren über 99% des weltweiten Zitronensäure-Bedarfes. Diese Art wird auch für die Produktion von Lysozym und Glucoseoxidase verwendet.
Krankheitsbilder: Aspergillus sp. können verschiedene Krankheitsbilder verursachen:
- Allergie: Die allergische bronchopulmonale Aspergillose bzw. die exogen-allergische Alveolitis durch A. fumigatus und A. clavatus
 |
 |
- Mykotoxikose: Vergiftungen durch Schimmelpilzgifte. Das Aflatoxin B1 von A. flavus kann beispielsweise Leberkarzinome auslösen.
- Nicht invasive Aspergillose: Das Aspergillom ("Pilzball") kann Nasennebenhöhlen, Emphysemblasen und Tbc-Kavernen ausfüllen.
- Invasive Aspergillose: Diese tritt vorwiegend bei Immunsupprimierten auf, pulmonal oder systemisch-disseminiert. Die Affinität zu Blutgefäßen führt gerne zu hämorrhagischen Nekrosen. Sie ist nach der Candidose die zweithäufigste invasive Mykose. In 80 % der Fälle wird A. fumigatus isoliert.
Diagnostik: Mikroskopie, Kultur von Proben (BAL, Biospie), Serologie (Antigen- und Antikörper), Röntgen Thorax
Therapie: Allergie: Expositionsvermeidung, medikamentös ähnl. Asthmatherapie; Aspergillom: Amphotericin B i.v. und Chirurgie; Invasive Aspergillose: Amphotericin B (evtl. plus Flucytosin), Azol-Antimykotika.
Weblinks: The Aspergillus Website
Cryptococcus neoformans[Bearbeiten]
| Cryptococcus neoformans | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||
|
Cryptococcus neoformans ist der wichtigste Erreger der Kryptokokkose. Es ist ein Hefe-ähnlicher, bekapselter Pilz mit weltweiter Verbreitung. Im Gegensatz zur Backhefe (Schlauchpilze) gehört der Kryptokokkose-Erreger zu den Basidienpilzen.
Morphologie und Eigenschaften: Cryptococcus neoformans-Spezies sind etwa 4µm große, Gram-positive Hefepilze, die im Präparat Sprossungen und charakteristische Größenunterschiede zeigen. Der Pilz ist von einer mehrere Mikrometer dicken Schleimkapsel umhüllt, die sich z.B. im Tuschepräparat darstellen lässt.
Das ungeschlechtliche Stadium von Cryptococcus neoformans, die Anamorphe, heißt Filobasidiella neoformans und wurde 1976 durch Kwon-Chung beschrieben.


Vorkommen und Übertragung: Reservoir des Pilzes sind vor allen Vögel. Die Übertragung erfolgt durch Einamtmung von erregerhaltigem Stäuben von Vogelkot.
Krankheitsbilder: Die Kryptokokkose ist insgesamt selten, wird als opportunistische Pilzerkrankung aber z.B. häufig bei AIDS-Patienten beobachtet. Sie kann sich pulmonal, zerebral und mukokutan manifestieren.
Therapie: Amphotericin B (ggf. plus Flucytosin), Azole
Pneumocystis jiroveci[Bearbeiten]
| Pneumocystis jiroveci | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
|


Morphologie, Eigenschaften und Lebenszyklus: Pneumocystis jiroveci ist ein 1,5 bis 2µm rundlicher Pilz. Nach der Einatmung von sporenhaltigen Zysten in die Lunge entwickeln sich darin je 8 amöboid bewegliche Trophozoiten, die nach kurzer Zeit schlüpfen und sich asexuell durch Teilung vermehren. Zwei dieser Trophozoiten können zu einer Zygote fusionieren (sexuelle Phase) und sich zu einer neuen Zyste entwickeln, in der durch Teilung wieder 8 neue Sporozoiten bilden.
Histologisch zeigen sich in der Grocottfärbung 4-7µm große, runde bis tassenförmige Zysten mit oder ohne kleine dunkle Punkte (Sporozoiten).
Im Labor kann er nicht auf Nährmedien gezüchtet werden. Der Erreger wird den Schlauchpilzen (Ascomycota) zugeordnet.
Vorkommen: Der Pilz wird bei vielen Tieren inklusive dem Menschen symptomlos in der Lunge gefunden.
Krankheitsbilder: P. jiroveci ist ein opportunistischer Erreger einer interstitiellen Pneumonie, die besonders bei Defekten der zellulären Immunität, z.B. bei AIDS auftritt.
Taxonomie: Früher wurde der P. jiroveci als P. carinii bezeichnet. Diese Bezeichnung ist heutzutage zwar noch verbreitet, aber formal nicht mehr zulässig. Es konnte gezeigt werden, dass der im Mensch vorkommende Erreger sich von dem in der Ratte entdeckten P. carinii unterscheidet.
Diagnose: Der Erreger kann nicht in vitro kultiviert werden. Der Nachweis erfolgt direkt mikroskopisch im Material aus der bronchoalveoläre Lavage (BAL) oder Lungenbiopsie, mit Immunfluoreszenz oder PCR.
Therapie: Cotrimoxazol oder Pentamidin
Zygomyzeten (Mucorales)[Bearbeiten]
| Mucorales | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||
| Systematik | ||||||||||||
|
Pilze der Ordnung Mucorales (Köpfchenschimmel) mit den Gattungen Absidia, Cunninghamella, Mucor, Rhizomucor und Rhizopus sind typische Opportunisten und Auslöser der eher seltenen Mucor-Mykosen (Zygomykosen). Die Mucorales können ein breites Spektrum anatomischer Lokalisationen befallen. Typische Manifestationen sind
- korneal (meist nach Verletzungen)
- rhinozerebral
- pulmonal
- enteral und
- kutan
 |
 |
Primärpathogene invasive Pilze[Bearbeiten]
Histoplasma capsulatum[Bearbeiten]
| Histoplasma capsulatum | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
|
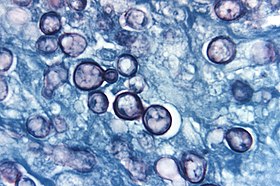
Morphologie unmd Eigenschaften: Histoplasma capsulatum ist ein temperaturabhängig dimorpher Pilz, der bei 25°C die Schimmelform, bei 37°C die Hefeform annimt. Der Pilz zeigt Mikro- und Makrokonidien. Die bei Körpertemperatur geformten ovoiden Hefezellen, die sich im Gewebe oft in Makrophagen finden, sind bei Histoplasma capsulatum var capsulatum kleiner (2-4µm) als bei Histoplasma capsulatum var duboisii (12-15µm).

Vorkommen: Histoplasma ist vor allem in den (sub)tropischen Gebieten der Erde zuhause, z.B. in den wärmeren Regionen der USA (Tennessee, Ohio, Mississippi), in Mittel- und Südamerika, in Afrika und Indonesien. Der Pilz findet sich im Boden, besonders gerne im Zusammenhang mit Vogel- oder Fledermauskot.
Krankheitsbilder:
H. capsulatum var capsulatum ist der Erreger der endemisch auftretenden Histoplasmose, einer systemischen Infektionskrankheit mit vorwiegendem Befall der Lunge, die auch bei Gesunden auftreten kann.
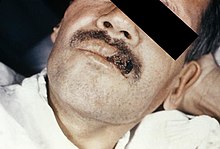
Der Erreger vermehrt sich nach Phagozytose im RES. Das klinisch Bild ist variabel und schließt akute, leichte pulmonale Infekte, chronische und disseminierte Verläufe mit ein, wobei die chronischen Verlaufsformen vorwiegend bei pulmonalen Grunderkrankungen und die disseminierten vor allem bei Immunkompromittierten beobachtet werden.
Var. duboisii befällt eher die Knochen und die Haut in Form der afrikanischen Histoplasmose.
Diagnostik: Probengewinnung und Kultur
Therapie: Amphotericin B oder Voriconazol
Coccidioides immitis[Bearbeiten]
| Coccidioides immitis | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||
| Systematik | ||||||||||||||||||
|
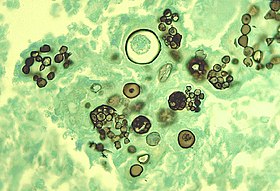
Morphologie und Eigenschaften: Coccidioides immitis ist ein atypischer, dimorpher Pilz, der in Kultur ein wolliges Myzel bildet und sich über asexuelle Arthrosporen vermehrt. Im Gewebe bildet der Pilz weder Hyphen noch Sprosszellen, sondern (deswegen atypisch) dickwandige, etwa 15-60µm große, kugelige Gebilde, sog. Sphaerulae, die bis zu 100 kugelig-ovale Endosporen enthalten. Aus freigesetzten Endosporen können wiederum Sphaerulae entstehen.

Vorkommen und Übertragung: Coccidioides immitis ist endemisch im Erdboden in ariden Landstrichen der USA (Kalifornien, Arizona, Texas, Neumexiko und Utah) zu finden.
Krankheitsbilder: Die Infektion mit Coccidioides immitis durch inhalierte Arthrosporen verläuft in 60% der Fälle inapparent. Die manifeste Erkrankung der Kokzidioidomykose äußert sich als Lungenentzündung mit grippeähnlichem Verlauf, Exanthem und Arthralgien („Wüstenrheumatismus“). Die Pilzinfektion kann chronisch-kavernös oder mit septisch-granulomatoiden Absiedelungen in allen Organen und hoher Letalität verlaufen.
Diagnostik: Erregernachweis im Sputum, Kultur (Cave: Hochinfektiöse Arthrosporen!), Serologie
Therapie: Azole per os, bei schweren Formen Amphotericin B oder Voriconazol
 |
Dermatophyten[Bearbeiten]
| Dermatophyten | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||||||
|
Dermatophyten sind keratinophile Fadenpilze, die im wesentlichen drei Gattungen angehören: Trichophyton, Mikrosporum und Epidermophyton. Vom Erscheinungsbild der Erkrankung kann allerdings nicht auf den verantwortlichen Dermatophyten rückgeschlossen werden.
Daneben gibt es noch einige Hefen, die zu Hauterkrankungen führen können, wie z.B. Malassezia spp..
 |
 |
 |
Trichophyton sp.[Bearbeiten]


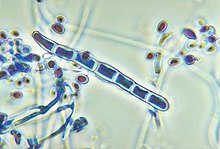
Morphologie und Eigenschaften: Trichophyton sp. gehört zu den Fadenpilzen (Schimmel).
Vorkommen und Übertragung: Trichophyton spp. besiedeln je nach Art Tiere, Menschen und den Erdboden. Die einzelnen Spezies sind z.T. weltweit verbreitet, z.T. auch nur regional endemisch. Die Übertragung erfolgt direkt von Mensch/Tier zu Mensch oder über unbelebte Gegenstände (Duschen, Umkleideräume).
Krankheitsbilder: Trichophyton ist ein bedeutender Erreger von Haut-, Haar- und Nagelmykosen und kann folgende Hautmykosen auslösen:
- Tinea capitis - T. tonsurans
- Tinea barbae (Bartflechte) - T. rubrum, T. mentagrophytes
- Tinea corporis (Ringelflechte) - T. mentagrophytes
- Tinea cruris - T. rubrum, T. mentagrophytes
- Tinea pedis (Sportlerfuß) - T. rubrum, T. mentagrophytes
- Onychomykose (Nagelmykose) - T. rubrum, T. mentagrophytes
Diagnose: Mikroskopischer Nachweis (Hautgeschabsel, Haare)
Therapie: Azole, Terbinafin
Prophylaxe: Kontaktvermeidung. Desinfektion von Duschen und Umkleiden.
 |
 |
 |
 |
Epidermophyton floccosum[Bearbeiten]

Morphologie und Eigenschaften: Epidermophyton floccosum ist ein Fadenpilz (Schimmelpilz) mit septierten hyalinen Hyphen.
Vorkommen und Übertragung: Die Pilz ist weltweit verbreitet. Die Übertragung erfolgt direkt von Mensch zu Mensch oder über unbelebte Gegenstände.
Krankheitsbilder: Alle Variationen der Tinea (außer Tinea capitis)
Diagnostik: Mikroskopie (Geschabsel, Haare), Kultur
Therapie: Azole lokal, z.B. Ciclopiroxolamin. In schweren Fällen Terbinafin oder Griseofulvin oral.
Prophylaxe: Kontaktvermeidung. Desinfektion von Duschen und Umkleiden.
Mikrosporum sp.[Bearbeiten]
 |
 |
Arten: M. audouinii, M. canis, M. gypseum
Morphologie und Eigenschaften: Mikrosporum ist ein Fadenpilz (Schimmelpilz)
Vorkommen und Übertragung: Mikrosporum ist weltweit verbreitet. Die Übertragung erfolgt von Mensch zu Mensch, die geophile Spezies M. gypseum führt bei andauernder Exposition zur Erkrankung (Gärtner).
Krankheitsbilder: Alle Formen von Tinea
Diagnostik: Mikroskopie (Geschabsel, Haare), Kultur
Therapie: Terbinafin lokal
Prophylaxe: Kontaktvermeidung. Desinfektion von Duschen und Umkleiden.
Malassezia spp.[Bearbeiten]
| Malassezia spp. | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||
|
Morphologie und Eigenschaften: Malassezia spp. sind lipophile Hefen. Mikroskopisch beobachtet man vor allem die hefenartigen Konidien, die oft ein größeres, rundes und ein kleineres, ebenfalls rundes oder zigarrenähnliches Ende besitzen.
Vorkommen und Übertragung: Der Hefepilz ist weltweit verbreitet und Bestandteil der normalen Hautflora (90 % der Erwachsenen).
Krankheitsbilder: Malassezia spp. können verschiedene Hauterkrankungen hervorrufen, so z.B. die Pityriasis versicolor oder Kleienpilzflechte (M. furfur, M. globosa, M. sympodialis). Der meist harmlose epidermal lokalisierte Pilz führt zu überpigmentierten, auf sonnengebräunter Haut zu unterpigmentierten solitären oder konfluiierenden Flecken. Weitere Hautaffektionen sind möglich, so z.B. die Follikulitis oder eine Seborrhoische Dermatitis (M. furfur). Weiterhin können Malassezia spp. Katheter-assoziierte Infektionen (besonders bei Lipidgabe) hervorrufen. Die zoophile und weniger lipophile Spezies M. pachydermatis kann ebenfalls an systemischen Infektionen beteiligt sein.
Diagnostik: Blutkultur, Kultur aus Hautgeschabsel oder Katheterspitze.
Therapie: Azole lokal oder systemisch
 |
 |
 |
Erreger subkutaner Mykosen[Bearbeiten]
Pilzinfektionen der Unterhaut sind hierzulande selten, in Entwicklungsländern häufiger und kommen durch Verletzungen zustande, bei denen Pilzsporen in die Wunde gelangen. Erkrankungen sind:
- Sporotrichose - Sporothrix schenckii
 |
 |
 |
- Chromomykose - Fonsecaea spp., Phialophora spp. u.a.
 |
 |
- Phaeohyphomykose - Cladosporium spp., Wangiella spp., Curvularia spp., Bipolaris spp., Exserohilum spp., Alternaria spp. u.a.
 |
 |
 |
 |
 |
 |
- Eumyzetome (Mykotische Myzetome) - Pseudoallescheria spp., Madurella spp., Acremonium spp., Exophiala spp. u.a. Die Erreger bilden schwarze mykotische Granula im befallenen Gewebe.
 |
 |
 |
Literatur und Weblinks[Bearbeiten]
- Robert-Koch-Institut zu Mykosen (Pilzinfektionen)
- Doctor Fungus

