Natur: Atom
- Demokrit
„Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter; in Wirklichkeit gibt es nur Atome und den leeren Raum.“

Allgemeines[Bearbeiten]
Die kleinsten Teilchen der Materie, die noch charakteristische chemische Eigenschaften haben, sind die Atome. Atome sind weiter spaltbar in Elementarteilchen. Es gibt mehr als 93 verschiedene Atomsorten (Elemente), die die verschiedensten Verbindungen (Moleküle) bilden können. Die kleinsten Teilchen der elektromagnetischen Strahlung sind die Photonen, die auch Wellencharakter haben.
Was sind Atome?[Bearbeiten]
- Siehe Atom
Das Atom ist der kleinste chemisch nicht weiter teilbare Baustein der Materie.
Im Laufe der Wissenschaftsgeschichte wurden unterschiedliche Atommodelle vorgeschlagen.
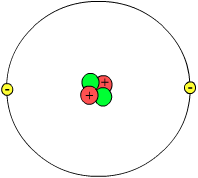
Die heutige Vorstellung kann man vereinfacht folgendermaßen zusammenfassen: Atome sind elektrisch neutral, jedoch werden oft auch Ionen unter dem Begriff „Atom“ gefasst. Atome bestehen aus einem Atomkern mit positiv geladenen Protonen und elektrisch neutralen Neutronen, sowie einer Atomhülle aus negativ geladenen Elektronen.
Erstaunliches[Bearbeiten]
Denkt man auf alltäglich Weise über Atome nach, dann fallen einem erstaunliche Dinge auf:
- Atome sind im Vergleich zu den Elementarteilchen sehr stabil.
- Atome können sich in Gasen ohne Reibung bewegen.
- Elektronen bewegen sich um den Atomkern, meist ohne Energie zu verlieren.
- Fermionen sind nicht beliebig kondensierbar, Photonen sehr wohl. Zu den Fermionen zählen beispielsweise die Elektronen, Protonen und Neutronen.
Der Physiker hat für all dies Erklärungen parat, dem physikalischen Laien erscheint manches schwer verdaulich.
Schema[Bearbeiten]
- Kern
- Protonen
- Neutronen
- Hülle
- Elektronen
Atome gleicher Anzahl der Protonen gehören zu demselben Element. Die Zahl der Protonen wird mit der sogenannten Kernladungszahl angegeben. Die Kernladungszahl und die physikalischen Eigenschaften der Atomhülle bestimmen das chemische Verhalten eines Atoms. Atome gleicher Kernladungszahl besitzen dieselbe Atomhülle und sind damit chemisch nicht unterscheidbar.
Beim Chloratom gibt es zwei verschiedene stabile Atomarten mit gleicher Protonen(=Kernladungs)zahl, aber unterschiedlicher Zahl der Neutronen im Kern. Chemisch sind diese beiden Isotope gleich. Physikalisch kann man sie unterscheiden. Aufmerksam wurde man auf diese Besonderheit des Chlors, da die Atommasse zwischen 35 und 36 liegt ( 35,453) und nicht wie bei den meisten anderen Elementen nahe an einer ganzen Zahl.
Nahezu die gesamte von uns wahrnehmbare, unbelebte und belebte Materie in unserer irdischen Umgebung besteht aus Atomen oder Ionen. Kosmologisch betrachtet stellt diese Materieform jedoch nur einen gewissen Anteil dar, neben dem Plasma, aus dem die Sterne bestehen, der Neutronenmaterie von Neutronensternen und eventuell einer noch nicht sicher nachgewiesenen Dunklen Materie bislang unbekannter Natur.
Aufbau[Bearbeiten]
Ein Atom besteht aus einer Hülle und einem im Vergleich zu seinem Gesamtvolumen winzigen Kern. Die Atomhülle (Elektronenhülle) hat mit einem Radius von etwa 10-10 m einen ungefähr zehntausendfach größeren Radius als der Atomkern (r = 10-14 m).
Zur Veranschaulichung: Würde man ein Atom auf die Größe einer Kathedrale aufblähen, so entspräche der Kern der Größe einer Fliege (wobei beinahe die gesamte Masse des Atoms auf diesen winzigen Kern entfällt). Der Atomkern nimmt nur etwa ein Billiardstel des Gesamtvolumens eines Atoms ein. Das Atom als Grundbaustein der Materie besteht somit fast ausschließlich aus leerem Raum.
Der Atomkern besteht aus den Protonen und – außer beim Wasserstoff-Isotop 11H – aus Neutronen. Die Atomhülle besteht aus Elektronen.
Im Atomkern konzentriert sich fast die gesamte Masse des Atoms. Die Elektronen tragen eine negative elektrische Ladung und die Protonen eine positive von gleichem Betrag, wodurch sie sich gegenseitig anziehen. Die Neutronen sind elektrisch neutral und haben eine geringfügig größere Masse als die Protonen.
Kenndaten[Bearbeiten]
Atome sind in erster Näherung kugelförmig und haben eine Größe von 0,1 bis 0,5 Nanometer, also 0,0000000001 m bis 0,0000000005 m. Innerhalb des Periodensystems nehmen die Atomradien von links nach rechts ab und von oben nach unten zu. Allerdings besteht kein linearer Zusammenhang zwischen der Protonenzahl (und damit der Ordnungszahl) und dem Atomradius.
Ihre Masse beträgt abhängig von der Massenzahl zwischen 10-24 und 10-22 g.
Kategorisierung und Ordnung[Bearbeiten]

Die Ladung des Atomkerns ist durch die Anzahl der Protonen bestimmt, deshalb bezeichnet man sie als Kernladungszahl. Da die chemischen Eigenschaften der Atome und damit auch viele physikalische Eigenschaften der aus ihnen aufgebauten Materie durch die Struktur der Atomhülle bestimmt werden, und diese wiederum praktisch vollständig von der Kernladung bestimmt wird, werden Atome mit der gleichen Anzahl an Protonen dem gleichen chemischen Element zugeordnet. Die Kernladungszahl bestimmt die Stellung des Elements im Periodensystem der chemischen Elemente. Daher nennt man sie auch Ordnungszahl.
Da Proton und Neutron annähernd gleich schwer sind, die Masse eines Elektrons jedoch nur etwa 1/2000 der Protonenmasse beträgt, ist die Masse eines Atoms näherungsweise durch die Gesamtzahl der Nukleonen (Protonen und Neutronen) gegeben. Daher bezeichnet man diese als Massenzahl. Allerdings ist für alle Atome mit mehreren Nukleonen die Masse wegen des Massendefekts etwas kleiner als die Summe der Massen der Nukleonen.
Atome mit der gleichen Protonenzahl, aber unterschiedlichen Neutronenzahlen nennt man Isotope, sie gehören dem gleichen chemischen Element an.
Bei den meisten chemischen Reaktionen spielt die Anzahl der Neutronen keine Rolle. Wichtig ist die Anzahl der Neutronen im Bereich der Strahlungslehre.
In der Kernphysik unterscheidet man Atomsorten nach der Zahl der Protonen und Neutronen, da diese eine unterschiedliche Radioaktivität aufweisen. Meist sind nur ein oder zwei Isotope eines Elements stabil, die anderen zerfallen radioaktiv. Von einigen Elementen beispielsweise dem Technetium gibt es auch überhaupt kein stabiles Isotop.
Das kleinste Atom ist das Wasserstoffatom mit nur einem Proton im Atomkern. Eines der schwersten natürlich vorkommenden Atome ist das Uran-Atom mit 92 Protonen im Atomkern. Das schwerste Atom, dessen Herstellung in entsprechenden Experimenten bisher gelungen ist, ist das Ununoctium-Atom mit 118 Protonen im Atomkern (Stand Aug. 2004). Es ist jedoch extrem kurzlebig.
Allgemeines[Bearbeiten]
Die Chemie beschäftigt sich mit den Atomen und ihren Verbindungen, den Molekülen. Dies setzt auch genaue Kenntnisse über die Struktur der Atomhülle voraus.
Die Physik beschäftigt sich unter anderem mit dem Aufbau der Atomhülle ( Atomphysik), dem Aufbau der Atomkerne aus Elementarteilchen ( Kernphysik) und weiter mit den Eigenschaften der Elementarteilchen ( Elementarteilchenphysik).
Geschichte der Idee vom Atom[Bearbeiten]
Die Geschichte der Idee des Atoms beginnt im antiken Griechenland um 400 vor Christus.
- um 400 vor Christus - Demokrit und das Teilchenmodell
- Demokrit, ein altgriechischer Gelehrter, äußerte als erster die Vermutung, dass die Welt aus unteilbaren Teilchen - (griechisch a-tomos = unteilbar) Atomen - bestände. Daneben gäbe es nur leeren Raum. Alle Eigenschaften der Stoffe ließen sich, nach Meinung Demokrits, auf die Abstoßung und Anziehung dieser kleinen Teilchen erklären. Diese Idee wurde von den Zeitgenossen Demokrits abgelehnt, da man damals die Welt als etwas Göttliches ansah. Demokrits philosophischer Kontrahent war vor allem Empedokles, der die Lehre von den vier Elementen Feuer, Erde, Luft und Wasser begründete. Demokrits Vorschlag blieb fast 2 Jahrtausende unbeachtet.
- um 1400 - Die Alchemisten - Gold kann nicht hergestellt werden
- Auch wenn die Alchemisten in ihren Versuchen, aus niederen Stoffen (wie etwa Blei) Gold herzustellen, scheiterten, leisteten sie Vorarbeit für die spätere experimentelle Physik und Chemie.

- 1803 - John Dalton - Atomtheorie der Elemente
- Der englische Chemiker John Dalton griff als erster wieder die Idee von Demokrit auf. Aus konstanten Mengenverhältnissen bei chemischen Reaktionen schließt Dalton darauf, dass immer eine bestimmte Anzahl von Atomen miteinander reagiert.
- 1896 entdeckt Henri Becquerel die Radioaktivität, und stellt fest, dass sich Atome umwandeln und zerfallen können.
- 1897 - Joseph John Thomson - Entdeckung des Elektrons
- Bei einem Versuch mit Strom stellte der britische Physiker Thomson fest, dass Strahlen in Vakuumröhren aus kleinen Teilchen bestehen. Damit war ein erster Bestandteil der Atome gefunden, obwohl man von der Existenz der Atome immer noch nicht überzeugt war. Eine Besonderheit war die Entdeckung vor allem deshalb, weil man dachte, Strom wäre eine Flüssigkeit.
- 1898 - Marie und Pierre Curie - Radioaktivität
- Immer mehr Forscher beschäftigten sich mit den kleinsten Teilchen. Die Curies untersuchten unter anderem Uran, das sie aus Pechblende gewannen. Die Uran-Atome zerfallen unter Abgabe von Wärme und Strahlen, die man als Radioaktivität (von radius = Strahl) bezeichnet. Marie Curie erkannte, dass sich Elemente bei diesem Zerfall verwandeln. (Die Radioaktivität wurde 1896 von Henri Becquerel entdeckt.)
- 1900 - Ludwig Boltzmann - Atomtheorie
- Boltzmann war ein theoretischer Physiker, der die Ideen von Demokrit umsetzte. Er berechnete aus der Idee der Atom-Existenz einige Eigenschaften von Gasen und Kristallen. Da er allerdings keinen experimentelle Beweis lieferte, waren damals seine Ideen umstritten.
- 1900 - Max Planck - Quanten
- Der Berliner Physiker Planck untersuchte die Schwarzkörperstrahlung. Bei der theoretischen, thermodynamischen Begründung seiner Formel führte er die sog. Quanten ein und wurde somit zum Begründer der Quantenphysik.
- 1905 - Albert Einstein - Erklärung der brownschen Bewegung
- In der dritten Arbeit des „ annus mirabilis“ erklärte Einstein die brownsche Bewegung mit Hilfe der Atomhypothese. Damit wurde zum ersten Mal ein beobachtbares physikalisches Phänomen direkt aus Boltzmanns Theorie hergeleitet.
- 1906 - Ernest Rutherford - Experimente
- Der Physiker Ernest Rutherford ging im Gegensatz zu Boltzmann und Planck experimentell auf die Suche nach den Atomen. 1906 entdeckte er mit dem rutherfordschen Experiment, dass Atome nicht massiv sind, ja sogar im Grunde fast gar keine Substanz besitzen. (Damit ist das Wort "Atom" für das, was es bezeichnet, im Grunde falsch. Es wurde aber beibehalten.) Aus dem Experiment leitete Rutherford bis 1911 die genaue Größe eines Atoms, also der Atomhülle und der Größe des Atomkerns ab. Ferner konnte er ermitteln, dass der Atomkern die positive Ladung, die Atomhülle eine entsprechende negative Ladung trägt. So entdeckte er das Proton.

- 1913 - Niels Bohr - Schalenmodell
- Aus dem rutherfordschem Atommodell entwickelte der dänische Physiker Niels Bohr ein planetenartiges Atommodell. Danach bewegen sich die Elektronen auf bestimmten Bahnen um den Kern, wie Planeten die Sonne umkreisen. Die Bahnen werden auch als Schalen bezeichnet. Das besondere daran war, dass die Abstände der Elektronen-Bahnen streng-mathematischen Gesetzmäßigkeiten folgen. Die Bahnen besitzen verschiedene Radien, und jede Bahn besitzt eine maximale Kapazität für Elektronen. Atome streben Bohr zufolge an, dass alle Bahnen komplett besetzt sind. Damit kann man sowohl viele chemische Reaktionen erklären als auch die Spektrallinien des Wasserstoffs. Da sich das Modell für komplexere Atome als unzureichend erwies, wurde es 1916 von Bohr und dem deutschen Physiker Arnold Sommerfeld insofern verbessert, als man nun für bestimmte Elektronen exzentrische, elliptische Bahnen annahm. Das bohr-sommerfeldsche Atommodell erklärt viele chemische und physikalische Eigenschaften von Atomen.
- 1929 - Erwin Schrödinger, Werner Heisenberg und andere - Das Orbitalmodell
- Aufbauend auf Schrödingers Wellenmechanik und Heisenbergs Matrizenmechanik wurde ein weiteres, bis heute modernes Atommodell entwickelt, das weitere Unklarheiten beseitigen konnte.
- 1929 - Ernest O. Lawrence - Der erste Teilchenbeschleuniger, das Zyklotron
- 1932 - Paul Dirac und David Anderson - Antimaterie
- Der theoretische Physiker Paul Dirac fand eine Formel, mit der sich die Beobachtungen der Atomphysik beschreiben lassen. Allerdings setzte diese Formel die Existenz von Anti-Teilchen voraus. Diese Idee stieß auf heftige Kritik, bis der amerikanische Physiker Anderson in der kosmischen Strahlung das Positron nachweisen konnte. Dieses Anti-Teilchen zum Elektron hat eine positiver Ladung aber die gleiche Masse wie ein Elektron. Treffen ein Teilchen und sein Anti-Teilchen zusammen, zerstrahlen sie sofort als Energie gemäß der Formel E = m*c2. 1932 wurde auch noch das Neutron von dem englischen Physiker James Chadwick entdeckt.
- 1933 - Irène und Frédéric Joliot-Curie - Energie wird zur Masse
- Eher zufällig beobachten die Eheleute Irène und Frédéric Joliot-Curie, dass sich nicht nur Masse in Energie umwandeln lässt. In einem Experiment verwandelte sich ein Lichtstrahl in ein Elektron und ein Positron (vgl. Paarbildung).
- 1938 - Otto Hahn und Lise Meitner - Die erste Kernspaltung
- Der deutsche Chemiker Hahn, ein Schüler Rutherfords, untersuchte weiter die Atomkerne. Dazu beschoss er Uran-Atome mit Neutronen und erhielt Cäsium und Rubidium oder Strontium und Xenon. Was eigentlich passierte, konnte er nicht erklären. Dies gelang jedoch seiner Mitarbeiterin Lise Meitner, die aufgrund ihrer jüdischen Religion vor den Nazis nach Schweden geflohen war. Sie stellte fest, dass die Summe der Kernteilchen (Protonen und Neutronen) bei den Produkten der des Urans entspricht. Hahn erhielt dafür den Nobelpreis, erwähnte seine Mitarbeiterin aber mit keinem Wort.
- 1938 - Hans Bethe - Kernfusion in der Sonne
- Neben zahlreichen Beiträgen zum Aufbau der Atome erforschte der in Straßburg geborene Bethe die Energieproduktion in Sternen. Er stellte fest, dass in unserer Sonne zwei Wasserstoff-Atomkerne miteinander verschmelzen, während in größeren und helleren Sternen Kohlenstoff-Kerne in die schwereren Stickstoff-Kerne verwandelt werden. Bethe arbeitete auch in Los Alamos mit, wurde aber nach dem Krieg ein engagierter Gegner von Massenvernichtungswaffen.
- 1942 - Enrico Fermi - Der erste Kernreaktor
- Der italienische Physiker Fermi erkannte die Möglichkeit, die Kernspaltung für eine Kettenreaktion zu nutzen. Die bei der Spaltung von Uran freiwerdenden Neutronen, konnten für die Spaltung weiterer Kerne verwendet werden. Damit legte Fermi die Grundlagen sowohl für die kriegerische Nutzung der Kernenergie in Atombomben, als auch friedliche Nutzung in Kernreaktoren. Fermi baute den ersten funktionierenden Kernreaktor.
- 1942 - Werner Heisenberg - Atomforschung für das nationalsozialistische Deutschland
- Mit Uranprojekt bezeichnet man allgemein die Versuche der deutschen Naturwissenschaft und Technik während des Zweiten Weltkrieges, die 1938 entdeckte Kernspaltung technisch nutzbar zu machen. Wesentliche Mitarbeiter des Projektes waren Paul Harteck, Kurt Diebner, Walther Gerlach, Otto Hahn, Werner Heisenberg und Carl Friedrich von Weizsäcker. Dieses Projekt wurde oft als deutsches Atombombenprojekt bezeichnet. Laut der offiziellen Geschichtsschreibung gab es allerdings nie konkrete Aktivitäten, eine Atombombe zu bauen.
- 1942 - Albert Einstein und Leo Szilard - Roosevelt soll die Atombombe bauen
- Eigentlich hat Einstein selber nicht zum Bau der Atombombe beigetragen. Er unterstützte aber einen Brief an den amerikanischen Präsidenten Roosevelt, dass die Atombombe unbedingt vor den Nazis entwickelt werden solle. Auch der ungarische Universalgelehrte Szilard erkannte die Gefahr, die von einer deutschen Atombombe ausging. Er lieferte zwar wichtige Ideen für den Bau der Atombombe, war aber an deren Entwicklung in Los Alamos nicht beteiligt. Auch später warnte Szilard noch vor dem Gebrauch der Atombombe.
- 1945 - J. Robert Oppenheimer - Die erste Atombombe
- Oppenheimer war der Organisator, der in Los Alamos viele führende Physiker und Ingenieure versammelte. So gelang innerhalb weniger Jahre der Bau einer Atombombe, das Manhattan-Projekt. Nach dem Einsatz der Atombombe in Hiroshima und Nagasaki wurde Oppenheimer zum Gegner von Atombomben.
- 1951 - Erwin Müller – das Feldionenmikroskop
- Müller gelingt mit der Konstruktion eines Feldionenmikroskopes erstmals die direkte Abbildung von Atomen auf einer Wolfram-Spitze.
- 1952 - Edward Teller - Die Wasserstoffbombe
- Der ungarische Physiker Teller war Mitarbeiter von Oppenheimer. Allerdings hatte er eine weitergehende Idee. Er wollte eine Bombe auf der Basis der Kernfusion bauen, die Bethe in der Sonne nachgewiesen hat. Aus Angst vor dem Kommunismus wurde Teller zu einem Rüstungsfanatiker und entwickelte die Wasserstoffbombe.
- 1960 - Donald A. Glaser - Die Blasenkammer
- Nach dem Ende des Zweiten Weltkrieges konzentrierte sich die Forschung auf den Aufbau der Elementarteilchen. Mit der Entwicklung der Blasenkammer durch Glaser hatte man nun eine Möglichkeit, die kleinsten Teilchen, die in Teilchenbeschleunigern entstanden, zu "sehen".
- 1964 - Murray Gell-Mann - Die Quarks
- Mit Hilfe der Blasenkammer konnte auf einmal eine riesige Anzahl an bisher unsichtbaren Teilchen sichtbar gemacht werden, die Widersprüche zu der bisherigen Physik darstellte. Um dies zu erklären, postulierte der Physiker Gell-Mann Grundbausteine, aus denen die Kernbausteine aufgebaut sein sollen. Mittlerweile gibt es sehr viele Indizien für die Existenz der Quarks, auch wenn sie einzeln nicht zu beobachten sind.
- 1978 - Der Fusionreaktor
- Um die riesigen Mengen an Energie zu nutzen, die bei einer Kernverschmelzung (Kernfusion) frei werden, versuchte man, die Fusionsenergie gezielt zu nutzen. Die Kernverschmelzung (Kernfusion) gelang erstmals mit Teilchenbeschleunigern. Derzeit laufen Versuche, Kernfusionsreaktoren herzustellen, bislang konnte aber nur für sehr kurze Zeit mehr Energie gewonnen werden, als in den Prozess hineingesteckt wurde
- 1995 - Eric Cornell, Wolfgang Ketterle und Carl Wieman - Das Bose-Einstein-Kondensat
- In einem ultrakalten Gas aus Rubidium-Atomen wird von Cornell, Ketterle und Wieman erstmals ein Bose-Einstein-Kondensat hergestellt, ein bereits von Einstein vorhergesagter Zustand der Materie.
- 2000 - CERN - Das Higgs-Boson
- Das Kernforschunngszentrum CERN in Genf forscht in ihrem Beschleuniger nach dem Higgs-Boson, das als Erlöser-Teilchen bezeichnet wird und dessen Existenz die bestehenden Theorien zur Elementarteilchenphysik bestätigen soll. Bisher gibt es keine eindeutigen experimentellen Belege für die Existenz des Higgs-Bosons.
- 2002 - Brookhaven - seltsame Materie
- Im Schwerionenbeschleunigerring RHIC (Relativistic Heavy Ion Collider) im amerikanischen Brookhaven prallen Goldionen hoher Energie aufeinander. Dabei sollen sie für extrem kurze Zeit und in einem sehr kleinen Raumbereich ein Quark-Gluon-Plasma erzeugen. Dies ist ein Zustand der Materie, der heute in der Natur nicht mehr vorkommt, aber vermutlich unmittelbar nach dem Urknall existierte.
Was sind Elemente ?[Bearbeiten]
- Siehe Elemente
Das einfachste Elemente ist der Wasserstoff, das schwerste natürlich vorkommende Element ist das Uran:


Was sind Moleküle?[Bearbeiten]
Ein Molekül ist ein Teilchen, das aus zwei oder mehreren zusammenhängenden Atomen besteht, welche durch Bindungen gekoppelt sind. Moleküle stellen die kleinsten Teilchen dar, die die Eigenschaften des zugrundeliegenden Stoffes haben. Es gibt Moleküle, die aus einem einzigen Element aufgebaut sind (O2, N2, P4 u.v.m), die meisten Moleküle sind aber Verbindungen aus verschiedenen Elementen. Ein einfaches Beispiel ist H2O: das Wasser, eine Verbindung aus Wasserstoff und Sauerstoff im Verhältnis 2 zu 1.
Bindungsart in Molekülen[Bearbeiten]
In Molekülen halten sich die verbundenen Atome über gemeinsame Elektronenpaare zusammen. Man nennt solche Bindungen auch Atombindung, Elektronenpaarbindung oder kovalente Bindung. Wenn auch die einzelnen Atome keine vollen Elementarladungen haben, also nicht als Ionen vorliegen, kann es durch unsymmetrisch verteilte Bindungselektronenpaare zu Teilladungen kommen. Man unterteilt deshalb die Atombindungen in:
- kovalente Bindung / unpolare Atombindung - die Differenz der Elektronegativität der Bindungspartner ist 0. Diese Art der Bindung kommt genau genommen nur bei Elementmolekülen, d. h. bei Molekülen, die nur aus einer Atomart zusammengesetzt sind, vor. Man fasst im weiteren Sinne allerdings auch Bindungen zwischen Atomen (z.B. zwischen C und H) als kovalente Bindungen auf, deren Differenz der Elektronegativität größer 0 und kleiner 0,4 ist.
- polare Bindung - Differenz der Elektronegativität der Bindungspartner ist größer als 0,4 und kleiner als 1,8.
Zwischenmolekulare Kräfte (sortiert nach abnehmender Stärke)[Bearbeiten]
Zwischen den Molekülen können verschiedene Kräfte wirken, die sich zum Beispiel auf die Siede- und Schmelzpunkte und die Löslichkeitseigenschaften auswirken können:
Darstellung[Bearbeiten]

Der Aufbau eines Moleküls kann auf verschiedene Arten beschrieben werden.
Die Summenformel eignet sich für einfache Moleküle, insbesondere anorganische Moleküle, z.B. H2O für Wasser oder NH3 für Ammoniak. Sie enthält die Atomsymbole der im Molekül enthaltenen Elementsorten, deren Anzahl über einen Index (die tiefgestellte Zahl) angegeben ist.
Die Wirkung von Intermolekularen Kräften ist auch bei kleineren Molekülen von der räumlichen Struktur der Moleküle abhängig. Zur Beschreibung dieser Struktur dient die VSEPR-Theorie.
Bei komplexeren Molekülen, wie sie vor allem in der organischen Chemie vorkommen, liefert eine Summenformel oft keine ausreichende Beschreibung, da es verschiedene Moleküle mit der gleichen Summenformel geben kann. Deshalb wird dazu die Strukturformel verwendet, die den Aufbau graphisch darstellt.
In einigen Fällen, spiegelbildlich gebauten Molekülen, den sogenannten Enantiomeren, gibt auch die Strukturformel nicht ausreichend Aufschluss über die nach außen wirksame Struktur. Hier werden Fischer- und Haworth-Projektion verwendet.
Bei hochkomplexen Molekülen wie Proteinen oder polymeren Zuckern spielt die räumliche Darstellung eine noch größere Rolle.
Man versucht, Kalottenmodelle für Moleküle zu entwerfen und räumliche Darstellungen über Farbgebung zu erreichen. Ein Beispiel für ein dreidimensionales Modell hochkomplizierter Biomoleküle liefert der Blutfarbstoff Hämoglobin:
Man spricht dann - je nach Ebene - von der Primärstruktur (bei Proteinen durch die Abfolge der Aminosäuren definiert), der Sekundärstruktur (Auffaltung zu einer Helix oder einem Faltblatt), der Tertiärstruktur (Auffaltung der Sekundärstruktur zu Kugeln oder Fasern ) und der Quartärstruktur.
Siehe auch:[Bearbeiten]
Was sind Elementarteilchen?[Bearbeiten]
Siehe Elementarteilchen

Einteilung[Bearbeiten]
- Fermionen (Materie)
- Leptonen
- Elektron
- Elektronneutrino
- Myon
- Myonneutrino
- Tau
- TauNeutrino
- Quarks
- up
- down
- charm
- strange
- top
- bottom
- Leptonen
- Bosonen
- Kräfte
- Photon
- W-Boson
- Z-Boson
- Gluon
- Masse
- Higgs-Boson (Graviton hypothetisch)
- Kräfte
|
|
|
||
|
e, ne, m, nm, t, nt |
|
|
|
Was sind Photonen?[Bearbeiten]
- Albert Einstein,1951
„Fünfzig Jahre intensiven Nachdenkens haben mich der Antwort auf die Frage ,Was sind Lichtquanten?" nicht näher gebracht. Natürlich bildet sich heute jeder Wicht ein, er wisse die Antwort. Doch da täuscht er sich.“

In der Physik bezeichnet man mit Photon (von Griechisch φως, phos = Licht) die elementare Anregung (Quant) des quantisierten elektromagnetischen Felds. Es ist eines der Studienobjekte der Quantenelektrodynamik, des ältesten Teils des Standardmodells der Teilchenphysik. Anschaulich gesprochen sind Photonen die „Bausteine“ elektromagnetischer Strahlung, so etwas wie Lichtteilchen. Allerdings darf dabei nicht vergessen werden, dass alle Elementarteilchen einschließlich der Photonen auch Welleneigenschaften besitzen (siehe auch: Welle-Teilchen-Dualismus).
Infobox[Bearbeiten]
- Klassifikation = Elementarteilchen,Boson,Eichboson
- Elektrische Ladung = 0
- Ruhemasse = 0
- Spinzahl = 1
Geschichte[Bearbeiten]
Seit der Antike gab es verschiedene, oft einander widersprechende Vorstellungen über die Natur des Lichtes. Im 19. Jahrhundert konkurrierten Wellen- und Teilchentheorien. Während viele Phänomene wie Interferenz- und Polarisationserscheinungen für eine Wellennatur des Lichts sprachen, gab es auch Indizien für einen Teilchencharakter. Ein historisch sehr wichtiges Experiment, welches auf eine Teilchennatur des Lichts hinwies, war im Jahre 1887 die Beobachtung des Photoelektrischen Effekts durch Heinrich Hertz und Wilhelm Hallwachs.
Die Quantisierung der elektromagnetischen Strahlung geht letztendlich auf die Erklärung der Schwarzkörperstrahlung durch Max Planck im Jahr 1900 zurück ( Plancksches Strahlungsgesetz). Planck selbst stellte sich allerdings nicht die elektromagnetische Strahlung an sich quantisiert vor, sondern erklärte die Quantisierung damit, dass die Oszillatoren in den Wänden der Schwarzkörperresonatoren nur diskrete Energiemengen mit dem elektromagnetischen Feld austauschen können.
Albert Einstein beschrieb 1905 in seiner Publikation zum photoelektrischen Effekt das Licht als aus Lichtquanten mit Partikeleigenschaften bestehend (für diese Arbeit wurde er 1921 mit dem Nobelpreis ausgezeichnet). Die formale Quantentheorie des Lichtes wurde erst seit 1925 beginnend mit Arbeiten von Max Born, Pascual Jordan und Werner Heisenberg entwickelt. Die bis heute gültige Theorie der elektromagnetischen Strahlung, welche auch die Lichtquanten beschreibt, die Quantenelektrodynamik (QED), geht in ihren Anfängen auf eine Arbeit von Paul Dirac im Jahr 1927 zurück, in der er die Wechselwirkung von quantisierter elektromagnetischer Strahlung mit einem Atom beschreibt. Die QED wurde in den 1940er Jahren entwickelt und 1965 mit der Verleihung des Nobelpreises für Physik an Richard P. Feynman, Julian Schwinger und Shinichiro Tomonaga gewürdigt.
Der Begriff Photon wurde 1926 durch den Chemiker Gilbert Newton Lewis geprägt, der darunter aber nicht das Lichtquant verstand. Er verwandte den Begriff im Rahmen eines von ihm vorgeschlagenen (und allgemein nicht anerkannten) Modells der Wechselwirkung von Atomen mit Licht.
Symbol[Bearbeiten]
Für das Photon wird im allgemeinen das Symbol (gamma) verwendet. In der Hochenergiephysik ist dieses Symbol allerdings reserviert für die hochenergetischen Photonen der Gammastrahlung (Gamma-Quanten) und die in diesem Zweig der Physik ebenfalls relevanten Röntgenphotonen erhalten das Symbol X (von Englisch: X-ray). Sehr oft wird ein Photon auch durch die enthaltene Energie mit oder dargestellt.
Eigenschaften[Bearbeiten]

Jegliche elektromagnetische Strahlung, von Radiowellen bis zur Gammastrahlung, ist in Photonen quantisiert. Das bedeutet, die kleinste Menge an elektromagnetischer Strahlung beliebiger Frequenz ist ein Photon. Photonen haben eine unendliche natürliche Lebensdauer, können aber bei einer Vielzahl physikalischer Prozesse erzeugt oder vernichtet werden. Photonen besitzen wahrscheinlich keine Ruhemasse. Die experimentell bestimmte und akzeptierte obere Schranke liegt bei 6 * 10-17 eV (Quelle: Particle Data Group). Ein freies Photon befindet sich nie in Ruhe, sondern bewegt sich immer mit der Lichtgeschwindigkeit. In optischen Medien ist die effektive Lichtgeschwindigkeit im Vergleich zur Vakuumlichtgeschwindigkeit aufgrund der Wechselwirkung der Photonen mit der Materie verringert. Da Photonen Energie besitzen, wechselwirken sie gemäß der Allgemeinen Relativitätstheorie mit der Gravitation.
Erzeugung und Detektion[Bearbeiten]
Photonen können auf vielerlei Arten erzeugt werden, insbesondere durch Übergänge ( Quantensprünge) von Elektronen zwischen verschiedenen Zuständen (z. B. verschiedenen Atom- oder Molekülorbitalen oder Energiebändern in einem Festkörper. Photonen können auch bei nuklearen Übergängen, Teilchen-Antiteilchen-Vernichtungsreaktionen, oder durch beliebige Fluktuationen in einem elektromagnetischen Feld erzeugt werden.
Zum Nachweis von Photonenströmen können z. B. Photomultiplier, Photoleiter oder Photodioden verwendet werden. CCDs, Vidicons, PSDs, Quadrantendioden oder Fotoplatten und -filme werden zur ortsauflösenden Detektion von Photonen benutzt. Im Infrarotbereich werden auch Bolometer eingesetzt. Photonen im Gammastrahlen-Bereich können durch Geigerzähler einzeln nachgewiesen werden. Photomultiplier und Lawinen-Photodioden können auch zur Einzelphotonendetektion im optischen Bereich verwendet werden, wobei Photomultiplier im Allgemeinen die niedrigere Dunkelzählrate besitzen, Avalanche-Photodioden aber noch bei niedrigeren Photonenenergien bis in den IR-Bereich einsetzbar sind.
Masse[Bearbeiten]
Die Ruhemasse eines Photons ist stets gleich Null. Diese Tatsache ergibt sich zum einen aus der unendlichen Reichweite der elektromagnetischen Wechselwirkung und zum anderen aus der speziellen Relativitätstheorie.
Ersteres Argument stützt sich darauf, dass alle Arten von Teilchen nach einer bestimmten Zeit zerfallen; dies geschieht umso schneller, je schwerer die Teilchen sind. Aufgrund dieses Zusammenhanges ist beispielsweise die Reichweite der starken Wechselwirkung so gering. Die Pionen, welche als Austauschteilchen der starken Kernkraft aufgefasst werden, sind sehr schwer und zerfallen daher bereits nach sehr kurzer Zeit. Daher wirkt die starke Wechselwirkung nur in einem Bereich, der der Größenordnung von Atomkernen entspricht. Da die elektromagnetische Wechselwirkung jedoch eine unendliche Reichweite hat, zerfallen Photonen niemals und können daher keine Ruhemasse tragen.
Die spezielle Relativitätstheorie hingegen verbietet nicht nur das Erreichen der Lichtgeschwindigkeit für jedwedes massebehaftete Objekt, sondern liefert auch den direkten mathematischen Nachweis. Die relativistische Gesamtenergie eines Teilchens lautet
Die Geschwindigkeit ist definiert als die Ableitung der Energie nach dem Impuls
wobei für Photonen v=c gilt. Diese Gleichung kann jedoch nur erfüllt sein, wenn der Term verschwindet, d. h. wenn die Ruhemasse m0 = 0 ist.
Allerdings kann Photonen eine Masse zugeordnet werden, da für die Energie eines Photons stets
gilt. Über die Beziehung der Energie zur Masse m = E/c² folgt
- .
Spin[Bearbeiten]
Photonen sind Spin-1 Teilchen und somit Bosonen. Es können also beliebig viele Photonen denselben quantenmechanischen Zustand besetzen, was zum Beispiel in einem Laser realisiert wird. Photonen vermitteln die elektromagnetische Wechselwirkung: Sie sind die Teilchen, die es anderen Teilchen erlauben, miteinander elektromagnetisch wechselzuwirken. Da die elektromagnetische Wechselwirkung eine sogenannte Eichtheorie ist, zählen die Photonen zu den Eichbosonen.
Photonen im Vakuum[Bearbeiten]
Im Vakuum bewegen sich Photonen mit der Vakuumlichtgeschwindigkeit = 299792458 ms−1. Die Dispersionsrelation, d. h. die Abhängigkeit der Energie von der Frequenz , ist linear, und die Proportionalitätskonstante ist das Plancksche Wirkungsquantum ,
Der Impuls eines Photons beträgt damit
Photonen in Medien[Bearbeiten]
In einem Material wechselwirken Photonen mit dem sie umgebenden Medium, woraus sich veränderte Eigenschaften ergeben. Das Photon kann absorbiert werden, wobei seine Energie natürlich nicht verschwindet, sondern in elementare Anregungen ( Quasiteilchen) des Mediums wie Phononen oder Exzitonen übergeht. Möglich ist auch, dass es sich durch ein Medium ausbreitet; zum Beispiel als gekoppeltes Phonon-Photon-Paar ( Polariton). Diese elementaren Anregungen in Materie haben üblicherweise keine lineare Dispersionsrelation, und ihre Ausbreitungsgeschwindigkeit ist niedriger als die Vakuumlichtgeschwindigkeit bis hin zu nur einigen Metern pro Sekunde für spezielle Materialien.
Wechselwirkung von Photonen mit Materie[Bearbeiten]
Photonen, die auf Materie treffen, lösen bei bestimmten Energien unterschiedliche Prozesse aus. Im folgenden sind für verschiedene Prozesse die Energiebereiche angegeben, in denen sie relevant sind.
- 1 eV bis 100 keV Photoeffekt,
- 100 keV bis 1 MeV Compton-Effekt,
- 1,022 bis 6 MeV Paarbildung
- 2,18 bis 16 MeV Kernphotoeffekt.
- höhere Energien: Photodesintegration
Diese Effekte tragen maßgeblich dazu bei, dass man diese Strahlung detektieren kann und sich bestimmte Stoffe mit bestimmten Effekten anhand der Gammaspektroskopie nachweisen lassen.
Literatur[Bearbeiten]
- C. Roychoudhuri and R. Roy (editors) The Nature of Light, What is a Photon?, Supplement to Optics & Photonics News, Vol. 3 No. 1, October 2003, ISSN 1047-6938
- Harry Paul Photonen, Januar 1999, ISBN 3519132222
- Klaus Hentschel: Einstein und die Lichtquantenhypothese. Naturwissenschaftliche Rundschau 58(6), S. 311 - 319 (2005), ISSN 0028-1050
Weblinks[Bearbeiten]
- Interaktive Darstellung von Absorption, Emission und der stimulierten Emission
- Photoeffekt, Photonenhypothese mit interaktiven Experimenten (Universität Ulm)
Siehe auch[Bearbeiten]
- Siehe Elektromagnetische Welle
- Siehe elektromagnetische Strahlung















