Pathologie: Endokrines Pankreas und APUD-Zell-System
Buch-Navigation
Langhansinselzellen des Pankreas[Bearbeiten]
Physiologie:
- A-Zellen -> Glucagon
- B-Zellen -> Insulin
- D-Zellen -> Somatostatinom
- PP-Zellen -> Pankreatisches Polpeptid
Endokrine Pankreasinsuffizienz[Bearbeiten]
Diabetes mellitus[Bearbeiten]
Etymol.: griech.: Honigsüßer Fluss
Störungen des Glucosestoffwechsels mit verminderter Insulinwirkung und erhöhten Blutzuckerspiegeln.
Klinik: Polydipsie, Polyurie, Müdigkeit, Abgeschlagenheit, Leistungsschwäche, Gewichtsabnahme, Typ 1-Erstmanifestation oft als Hypoglykämie oder diabetische Ketoazidose.
Akute Kompl.:
- Hypoglykämischer Schock - Klinik: Verwirrtheit, Bewußtseinstrübung
- Diabetische Ketoazidose (eher Typ 1) - Pg.: Übermäßige hepatische Ketonkörper-Bildung bei absolutem Inulinmangel und intrazellulärem Glucosedefizit. Klinik: Azetongeruch (obstartiger Fötor ex ore), KUSSMAUL-Atmung (tiefe Atemexkursionen) mit Hypokapnie, Azidose, Ketonkörper im Urin.
- Hyperglykämisches hyperosmolares Koma (eher Typ 2) - Pg.: Bei relativem Insulinmangel führen hohe Blutzuckerspiegel zur osmotischen Diurese. Klinik: Exsikkose, Volumenmangelschock, Koma.
- Lactatazidose (selten) - Ät.: Metformin (+ Alkohol, OP, Niereninsuffizienz, Sepsis).
- Bakterielle Infektionen (z.B. Furunkel, Karbunkel).
Spätfolgen:
- Makroangiopathie -> KHK, Apoplektischer Insult, pAVK.
- Mikroangiopathie -> Diabetische Retinopathie, Rubeosis iridis, Glomerulosklerose.
- Neuropathie -> Polyneuropathie (bes. viszeral, untere Extremität).
- Diabetischer Fuß durch PAVK und PNP
 |
Typ 1 Diabetes mellitus[Bearbeiten]
Ep.: 5 - 10 % der Diabetiker
Ät.: Autoimmunprozess. Assoziation mit HLA DR 3 und DR 4. Evtl. viral getriggert.
Mikro: Im akuten Stadium Insulitis (Lymphozytäre Infiltration der LANGERHANS-Inseln).
Pg.: Zerstörung der β-Zellen. Folge ist ein absoluter Insulinmangel, oft juvenil (auch late-onset-Formen).
Weblinks: OMIM - Diabetes mellitus, Type I
Typ 2 Diabetes mellitus[Bearbeiten]
Ep.: „Alterdiabetes“, Lifestyle-bedingt nimmt das Erstmanifestationsalter ab, auch übergewichtige Kinder können schon betroffen sein.
Ät.: Erblich, Übergewicht, Bewegungsmangel.
Pg.: Periphere Insulinresistenz mit anfangs Hyperinsulinämie und fehlenden postprandialen Insulinpeaks. Im Verlauf Ausbrennen der Inselzellen mit Hypoinsulinämie. Assoziiert mit weiteren Störungen (Metabolisches Syndrom).
Unterformen:
- Typ 2a: Normgewicht (10 %)
- Typ 2b: Übergewicht (90 %)
Weblinks: OMIM - Diabetes mellitus, Type II
Gestationsdiabetes[Bearbeiten]
Frühmanifestation eines Typ 2-Diabetes durch Progesteronwirkung, erbliche Insulindefizienzen (MODY, MIDD,...) u.a.
Sekundärer Diabetes mellitus[Bearbeiten]
Ät.: Z.n. Pankreatitis, Hämochromatose, Morbus CUSHING, Akromegalie, Hyperthyreose, Phäochromozytom, genetische Syndrome, Medikamente (Glukokortikosteroide, Katecholamine, β2-Sympathomimetika, Diuretika, Morphin).
Inselzelltumoren[Bearbeiten]
- A-Zellen: Glucagonom
- B-Zellen: Insulinom
- D-Zellen: Somatostatinom
Insulinom[Bearbeiten]
Ursprung: B-Zelle der Pankreasinseln
Lok.: Überwiegend im Pankreas, meist solitär.
Klinik: Spontane Hypoglykämien v.a. morgens (Nahrungskarenz) und nach körperlicher Belastung.
Verhalten: In 9/10 d. F. benigne. 1/10 maligne.
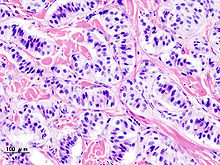 |
 |
 |
APUD-Zellsystem (Diffuses neuroendokrines System)[Bearbeiten]
Eigenschaften:
- System in verschiedenen Organen disseminiert liegender endokriner Zellen
- Abstammung von der Neuralleiste bzw. dem neuralen Ektoderm
- Mikroskopie: Fast leere Zellen mit großem, rundem, basalständigen Kern.
- APUD-Zellen können Amine oder deren Vorstufen aufnehmen und diese decarboxylieren (Amine Precursor Uptake and Decarboxylation), d.h. sie sind in der Lage Polypeptidhormone und biogene Amine zu bilden.
Übersicht über das APUD-System:
- APUD-I-Zellen (Ursprung: Neuralleiste):
- C-Zellen (Schilddrüse) -> Calcitonin
- Karotiskörper-Typ-1-Zellen
- Grenzstrang -> Acetylcholin
- Nebennierenmark -> Katecholamine
- Melanoblasten
- Endokrine Zellen des Urogenitaltraktes
- APUD-II-Zellen (Ursprung: Plakoden, spezialisiertes Ektoderm):
- Hypothalamus -> Oxytocin, Vasopressin, TRF, LHRH, SRH, CRF, SRIF
- Epiphyse -> LHRH
- Nebenschilddrüse -> Parathormon
- Adenohypophyse -> STH, Prolactin, FSH, LH, Corticotropin, MSH, TSH
- Plazenta -> Gonadotropin, Somatomammotropin
- APUD-III-Zellen (Ursprung: neuroendokrine Ektoblasten):
- Pankreas:
- B-Zellen -> Insulin
- A-Zellen -> Glucagon
- D-, D1-Zellen -> Somatostatin (STH)
- PP-Zellen -> Pankreatisches Polpeptid (PP)
- Magen:
- G-Zellen -> Gastrin
- ECL-Zellen
- A-Zellen
- D-Zellen
- EC1-Zellen
- Dünndarm:
- S-Zellen
- I-Zellen
- D-, D1-Zellen
- EC-, EC1-, EC2-Zellen
- K-Zellen
- N-Zellen
- Pankreas:
APUDom[Bearbeiten]
Von APUD-Zellen ausgehende neuroendokrine Tumoren.
Verhalten: Langsames Wachstum, Klinik abhängig vom synthetisierten Hormon.
Formen nach sekretorischem Produkt:
- G-Zellen: Gastrinom -> ZOLLINGER-ELLISON-Syndrom
- Serotoninom
- Vipom -> VERNER-MORRISON-Syndrom
- PP-om
- GIPom
- C-Zellen: Calcitoninom
- Corticotrophinom
- Sekretinom
- A-Zellen: Glucagonom
- B-Zellen: Insulinom
- D-Zellen: Somatostatinom
Formen nach Lokalisation:
- Inselzelltumor
- Extrapankreatische neuroendokrine Tumoren:
- APUDome jeglicher Coleur
- Karzinoid - Gut differenziert (typisches Karzinoid > atypisches Karzinoid), bildet häufig Serotonin u. a. Mediatoren.
- Neuroendokrin differenziertes Karzinom - Maligne, mäßig differenzierte Variante der Karzinoide
- Kleinzelliges Karzinom - Sehr undifferenziert.
Gastrinom[Bearbeiten]
Gastrin produzierendes APUDom
Lok.: 4/5 d. F. Pankreas, 1/5 d. F. restlicher Magen-Darm-Trakt.
Verhalten: In 2/3 d. F. Metastasierung
Klinik: ZOLLINGER-ELLISON-Syndrom: Hypergastrinämie -> Maximal stimulierte Magensäureproduktion
- -> Multiple teilw. therapieresistente Ulzera.
- -> Ansäuerung des Dünndarms -> Inaktivierung pankreatischer Enzyme -> Diarrhö, Bauchschmerzen, Malabsorption.
Karzinoide[Bearbeiten]
Lok: Appendix vermiformis (am häufigsten), Dünndarm, Colon, seltener Lunge, sehr selten in anderer Lokalisation.
Näheres siehe im Kapitel Darm und Lunge.
 |
 |
 |
Buch-Navigation
