Sensorische Systeme/Neurosensorische Implantate/Retinaimplantate
Retinaimplantate
[Bearbeiten]Seit dem späten 20. Jahrhundert ist die Wiederherstellung des Sehvermögens von Blinden durch künstliche Augenprothesen das Ziel zahlreicher Forschungsgruppen und einiger privater Unternehmen auf der ganzen Welt. Ähnlich wie bei Cochlea-Implantaten besteht das Schlüsselkonzept darin, das visuelle Nervensystem durch elektrische Impulse zu stimulieren und dabei die geschädigten oder degenerierten Photorezeptoren auf der menschlichen Netzhaut zu umgehen. In diesem Kapitel beschreiben wir die grundlegende Funktionalität eines Netzhaut-Implantats sowie die verschiedenen Ansätze, die derzeit untersucht und entwickelt werden. Die beiden häufigsten Ansätze für Netzhaut-Implantate werden "epiretinale" und "subretinale" Implantate genannt, welche sich auf beziehungsweise hinter der Netzhaut befinden. Wir werden keine nicht-Retina-bezogenen Ansätze zur Wiederherstellung des Sehvermögens behandeln, wie das BrainPort Vision System, das darauf abzielt, die Zunge durch visuellen Input zu stimulieren, Manschettenelektroden um den Sehnerv oder Stimulationsimplantate im primären visuellen Kortex.
Netzhautstruktur und –funktionalität
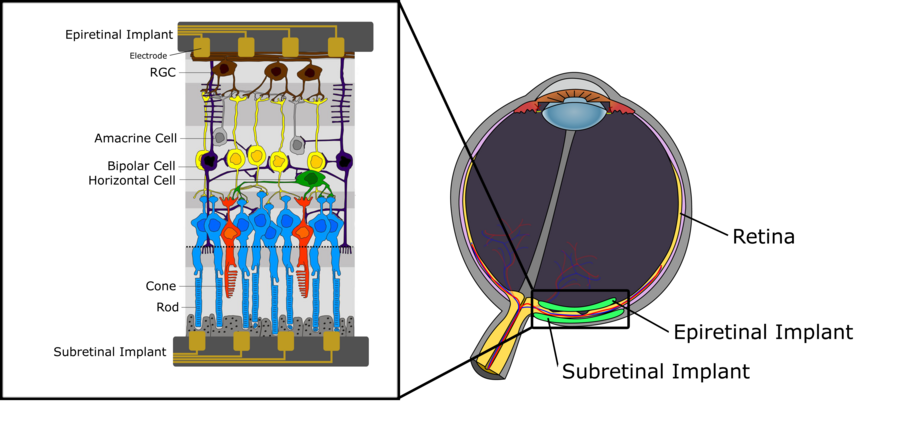
[Bearbeiten]Abbildung 1 zeigt schematisch die Nervenstruktur der menschlichen Netzhaut. Wir können zwischen drei Schichten von Zellen unterscheiden. Die erste, am weitesten entfernt von der Augenlinse gelegene, besteht aus den Photorezeptoren (Stäbchen und Zapfen), deren Aufgabe es ist, das einfallende Licht in elektrische Signale umzuwandeln, die sich dann weiter in die Zwischenschicht ausbreiten, die hauptsächlich aus bipolaren Zellen besteht. Diese bipolaren Zellen, die mit Photorezeptoren sowie horizontalen und amakrinen Zellen verbunden sind, leiten das elektrische Signal an sogenannte retinale Ganglionzellen weiter (RGC). Eine detaillierte Beschreibung der Funktionalität von Bipolarzellen, insbesondere hinsichtlich ihrer Unterteilung in ON- und OFF-Bipolarzellen, findet sich im Kapitel Visuelle Systeme. Die oberste Schicht der Retina, bestehend aus RGCs, sammelt die elektrischen Impulse aus den bipolaren Zellen und leitet sie über den Sehnerv an den Thalamus weiter. Von dort aus werden Signale an den primären visuellen Kortex weitergeleitet. Zur Signalverarbeitung in der menschlichen Netzhaut sind einige wichtige Aspekte zu nennen. Erstens erzeugen RGCs Aktionspotentiale, während bipolare Zellen sowie auch horizontale und amakrine Zellen abgestufte Potentiale, also in ihrer Grösse variierende Potentiale, erzeugen. Darüber hinaus ist die Dichte der einzelnen Zelltypen auf der Netzhaut nicht überall gleich. Während es im Bereich der Fovea eine extrem hohe Dichte an Stäbchen und Zapfen gibt, mit zusätzlich nur sehr wenigen Photorezeptoren, die über die Zwischenschicht mit RGCs verbunden sind, findet man in den peripheren Bereichen der Netzhaut eine wesentlich geringere Dichte an Photorezeptoren, wobei viele Photorezeptoren mit einer einzigen RGC verbunden sind. Letzteres hat auch direkte Auswirkungen auf die Grösse des rezeptiven Feldes einer einzelnen RGC. Aufgrund der geringeren Photorezeptordichte und der erhöhten Anzahl von Photorezeptoren, die mit der gleichen RGC verbunden sind, werden die rezeptiven Felder zu den äußeren Regionen der Netzhaut hin tendenziell rasch grösser.
Anwendungsfall für Implantate: Degenerative Netzhauterkrankungen
[Bearbeiten]Wie bereits erwähnt ist die Netzhaut ein lichtempfindliches Gewebe im posterioren Teil des Auges, das aus verschiedenen Schichten besteht, die verschiedene Zelltypen enthalten. Die Netzhaut ist in erster Linie an der visuellen Verarbeitung von Signalen beteiligt, die an den Photorezeptoren ihren Anfang nehmen und über die Axone der Ganglienzellen ins Gehirn gelangen. Wenn dieses geschichtete Gewebe degeneriert, kann es zu einem dauerhaften Sehverlust kommen [1]. Dies wird häufig durch degenerative Erkrankungen wie altersbedingte Makuladegeneration (AMD) und Retinitis Pigmentosa (RP) verursacht, die beiden häufigsten Netzhauterkrankungen, die nach und nach zu dauerhaften Sehstörungen und -verlusten führen. Derzeit gibt es keine Heilmittel für diese beiden Netzhauterkrankungen, sondern lediglich Therapien, die nur das Fortschreiten der Erkrankung verlangsamen können. Deshalb ist es erforderlich, nach Strategien zu suchen, die im Stande sind, das Sehvermögen der Patienten wiederherzustellen. Eines der Werkzeuge, die derzeit untersucht werden, ist die Netzhautprothesentechnologie, die lebensfähiges Netzhautgewebe zur Wiederherstellung des Sehvermögens anregt, was in einem späteren Abschnitt beschrieben wird [2].
Altersbedingte Makuladegeneration (AMD)
[Bearbeiten]Vorlage:Multiple image Wie der Name schon sagt, handelt es sich bei der Makuladegeneration um eine degenerative Erkrankung der Netzhaut, die vor allem bei älteren Menschen auftritt. Bei der AMD degenerieren die Zapfen-Photorezeptoren in der Makula fortschreitend, was zu verschwommenem Sehen im Zentrum des Gesichtsfeldes führt. Dies kann soweit voranschreiten, dass das Individuum in der Mitte des Gesichtsfeldes einen vollständigen Sehverlust hat, bekannt als blinde Flecken. Obwohl die AMD ein oder beide Augen betreffen kann, führt sie selten zu einer vollständigen Erblindung, da das periphere Sehen des Patienten intakt bleibt. Es gibt zwei Haupttypen von AMD: trocken und feucht. Die trockene AMD macht die meisten Fälle der Erkrankung aus und ist gekennzeichnet durch kleine gelbe Ablagerungen, sogenannte Drusen, die in der Makula zwischen dem retinalen Pigmentepithel und der Aderhaut auftreten. Das Fortschreiten dieser Form der AMD ist zunächst langsam mit sehr wenigen Symptomen und verstärkt sich erst, wenn eine Netzhautatrophie auftritt. Die feuchte Form der AMD ist gekennzeichnet durch choroidale Neovaskularisation, welche ein abnormales Wachstum von Blutgefässen darstellt. Die neugeformten Blutgefässe neigen zum Bruch, was zu Blut- und Proteinaustritt sowie Narbenbildung und letztlich zu einer dauerhaften Schädigung der Zapfen und damit zum Verlust des Sehvermögens führt. Der Verlauf der feuchten Form und der Sehverlust ist viel schneller als bei trockener AMD [3] .
Retinitis Pigmentosa (RP)
[Bearbeiten]Retinitis Pigmentosa ist eine vererbte degenerative Augenerkrankung, an der Stäbchen-Photorezeptorzellen beteiligt sind und die in jüngeren Menschen auftritt. Bei dieser Erkrankung nimmt die Funktionsfähigkeit der Stäbchen nach und nach ab und es kommt schließlich zu einem Sehverlust in der Peripherie sowie zu Nachtblindheit. Dieser Verlust tritt erst aussen auf und schreitet dann nach innen fort, wodurch beim Patienten ein Effekt des "Tunnelblicks" entsteht. Die Sehschwäche tritt symmetrisch auf, wobei beide Augen in ähnlichen Zeitabständen betroffen sind. Im Gegensatz zu AMD kann sich die Netzhauterkrankung über die Peripherie hinaus erstrecken und auch das zentrale Gesichtsfeld durch Degeneration von Zapfen-Photorezeptorzellen beeinflussen. Dies führt zu einem anhaltenden Sehverlust, der schließlich zur völligen Erblindung führen kann, wenn auch recht selten.
Retinitis Pigmentosa ist genetisch vererbt. Es gibt eine Vielzahl von Genmutationen, die zu einem Retinitis Pigmentosa-Phänotyp führen können, was zu einer Vielzahl von unterschiedlichen Vererbungsmustern führt. Wenn das Vererbungsmuster autosomal dominant ist, stehen die meisten Fälle mit Mutationen im Rhodopsin-Gen im Zusammenhang. Diese Mutation stört die Funktion von Rhodopsin, welches ein essentielles Protein in der Phototransduktionskaskade ist. Es gibt derzeit keine Heilung für Retinitis Pigmentosa [2] . Doch im Jahr 2008 haben Shigeru Sato und seine Kollegen ein extrazelluläre Matrix-ähnliches retinales Protein namens Pikachurin entdeckt, das aufgrund seiner Beteiligung an den Wechselwirkungen zwischen Photorezeptorzellen und Bipolarzellen möglicherweise zur Entwicklung einer neuen Therapie beitragen könnte [4] .
Mikroelektroden-Arrays für die Netzhautstimulation
[Bearbeiten]Wie bereits erwähnt, gibt es keine Heilung für die fortschreitende Sehbehinderung durch altersbedingte Makuladegeneration und Retinitis Pigmentosa. Bei beiden Erkrankungen überlebt jedoch ein erheblicher Teil der inneren Netzhautneurone auch Jahre nach Ausbruch der Erkrankung, obwohl ein erheblicher Verlust an Photorezeptorzellen vorliegt. Dies ermöglicht eine künstliche Stimulation der verbleibenden, noch funktionstüchtigen Netzhautzellen durch Elektroden, um die visuellen Informationen für den menschlichen Patienten wiederherzustellen. Mikroelektroden-Arrays verwenden Elektroden, um die Netzhaut extrazellulär durch eine enge Platzierung zu stimulieren, die es ermöglicht, eine elektrochemische Grenzfläche mit dem Array und der Kochsalzlösung um die Netzhaut herum zu bilden. Der Strom wird in die Array-Retina-Schnittstelle eingespeist und treibt schließlich die Depolarisierung der Membranen der Neuronen an, was zu Aktionspotentialen führt. Diese Stimulation kann kathodisch oder anodisch sein. Bei der kathodischen Stimulation entstehen negative Ladungen außerhalb der Membran, wodurch positive Ladungen intrazellulär angetrieben werden, was zu einem Depolarisationsgradienten führt, der in der Nähe der Elektrode am stärksten ist. Bei der anodischen Stimulation erfolgt eine Hyperpolarisation in den Bereichen, die den Elektroden am nächsten liegen und eine Depolarisation erfolgt in weiteren Entfernungen. Daher wird die kathodische Methode allgemein als effizienter für die Stimulation angesehen, da sie eine wesentlich geringere Stromeinspeisung erfordert. Die Phase der Stimulation ist nicht der einzige Faktor, der die Wirksamkeit der Stimulation beeinflusst. Die Wellenform, die eine Vielzahl von Formen annehmen kann, wie zum Beispiel monophasisch und biphasisch, spielt eine große Rolle bei der Sicherheit der Stimulation von Netzhautneuronen. Beispielsweise wurde bei Affen festgestellt, dass ein monophasischer Strom mit nur einer anodischen Phase zuvor lebensfähige Zellen schädigen könnte. Daher verwenden Implantate, die die Netzhaut stimulieren, eine ladungsausgeglichene biphasische Wellenform. Diese Wellenform nutzt eine kathodische Phase zur Stimulation und eine anodische Phase zur Entladung, wodurch die Ladungen auf der Membran ausgeglichen werden. Mit dieser Stimulationsfähigkeit kann eine Netzhautprothese hinter der Netzhaut implantiert werden und wird dann als subretinales Implantat bezeichnet. Damit kommen die Elektroden den geschädigten Photorezeptoren und den noch funktionstüchtigen Bipolarzellen, die hier das eigentliche Stimulationsziel sind, am nächsten. Wenn die Stimulationselektroden in die Aderhaut eindringen, die für die Blutversorgung der Netzhaut verantwortlich ist, werden die Implantate manchmal als "suprachoroidale" Implantate bezeichnet. Alternativ kann das Implantat auch auf die Netzhaut gesetzt werden, um die RGCs in der naheliegenden Ganglienzellschicht zu stimulieren. Diese Implantate werden als epiretinale Implantate bezeichnet. Beide Ansätze, also der subretinale und der epiretinale Ansatz, werden derzeit von mehreren Arbeitsgruppen untersucht. Beide haben Vorteile sowie Nachteile. Bevor wir sie gesondert behandeln, beschreiben wir einige wichtige Herausforderungen, die in beiden Fällen berücksichtigt werden müssen [2] .
Herausforderungen
[Bearbeiten]Herausforderungen in der Elektrodentechnologie
[Bearbeiten]Eine große Herausforderung für Netzhautimplantate stellt die extrem hohe räumliche Dichte der Nervenzellen in der menschlichen Netzhaut dar. In der menschlichen Netzhaut befinden sich etwa 125 Millionen Photorezeptoren (Stäbchen und Zapfen) und 1,5 Millionen Ganglienzellen, in der menschlichen Cochlea dagegen nur etwa 15000 Haarzellen [5] [6]. In der Fovea, wo die höchste Sehschärfe erreicht wird, befinden sich bis zu 150000 Zapfen innerhalb eines Quadratmillimeters. Zwar gibt es insgesamt deutlich weniger RGCs im Vergleich zu Photorezeptoren, aber ihre Dichte im Fovealbereich liegt nahe an der Dichte der Zapfen, was eine enorme Herausforderung darstellt, die Nervenzellen mit künstlichen Elektroden in ausreichender räumlicher Auflösung anzuvisieren. Nahezu alle aktuellen wissenschaftlichen Experimente mit Netzhaut-Implantaten verwenden Mikro-Elektroden-Arrays (MEAs), um die Netzhautzellen zu stimulieren. Hochauflösende MEAs erreichen einen Elektrodenabstand von etwa 50 Mikrometern, was zu einer Elektrodendichte von 400 Elektroden pro Quadratmillimeter führt. Daher ist im Fovealbereich mit herkömmlicher Elektrodentechnik eine 1:1-Zuordnung zwischen Elektroden und Photorezeptoren bzw. RGCs nicht möglich. Die räumliche Dichte sowohl der Photorezeptoren als auch der RGCs nimmt jedoch schnell in Richtung der äußeren Regionen der Netzhaut ab, so dass eine Eins-zu-Eins-Stimulation zwischen Elektroden und peripheren Nervenzellen besser möglich ist [7]. Eine weitere Herausforderung ist der Betrieb der Elektroden innerhalb sicherer Grenzen. Auferlegte Ladungsdichten über 0,1 mC/cm2 können das Nervengewebe schädigen [7]. Generell gilt: Je weiter eine Zelle von der Stimulationselektrode entfernt ist, desto größer ist die Stromamplitude, die zur Stimulation der Zelle benötigt wird. Je niedriger die Stimulationsschwelle, desto kleiner kann die Elektrode ausgelegt werden und desto kompakter können die Elektroden auf den MEAs platziert werden, was die räumliche Stimulationsauflösung erhöht. Die Stimulationsschwelle ist definiert als die minimale Stimulationsstärke, die notwendig ist, um eine Nervenreaktion in mindestens 50% der Stimulationsimpulse auszulösen. Aus diesen Gründen ist es ein vorrangiges Ziel bei der Gestaltung von Netzhaut-Implantaten, einen möglichst geringen Reizstrom zu verwenden und dennoch eine zuverlässige Stimulation (d.h. Erzeugung eines Aktionspotentials bei RGCs) der Zielzelle zu gewährleisten. Dies kann entweder dadurch erreicht werden, dass die Elektrode so nah wie möglich an dem Bereich der Zielzelle platziert wird, der am empfindlichsten auf einen angelegten elektrischen Feldimpuls reagiert, oder indem die Zellprojektionen, d.h. Dendriten und/oder Axone, auf der Elektrode wachsen, was eine Stimulation der Zelle mit sehr geringen Strömen ermöglicht, selbst wenn sich der Zellkörper weit entfernt befindet. Außerdem folgt ein auf der Netzhaut befestigtes Implantat automatisch den Bewegungen des Augapfels. Dies bringt zwar einige bedeutende Vorteile mit sich, bedeutet aber auch, dass jede Verbindung zum Implantat - zum Einstellen von Parametern, zum Auslesen von Daten oder zur Bereitstellung externer Energie für die Stimulation - ein Kabel erfordert, das sich mit dem Implantat bewegt. Da wir unsere Augen etwa dreimal pro Sekunde bewegen, ist das Kabel und die damit verbundenen Verbindungen starken mechanischen Belastungen ausgesetzt. Für ein Gerät, das ein Leben lang ohne externe Eingriffe funktionieren soll, stellt dies eine große Herausforderung an die verwendeten Materialien und Technologien dar.
Herausforderungen hinsichtlich der Biokompatibilität
[Bearbeiten]Neben den elektrischen Herausforderungen ist der Kontakt mit biologischem Gewebe eine zentrale Herausforderung bei einem Retina-Implantat. Wenn ein Fremdkörper, z.B. ein Implantat, in Kontakt mit physiologischen Substanzen kommt, wird eine Immunantwort ausgelöst. Diese Reaktion erfolgt typischerweise in Form einer Entzündung oder Isolierung der Substanz, die häufig zu Narbenbildung der beteiligten Gewebe führt. Dies ist vor allem bei Netzhautimplantaten ein Problem, da die Prothese durch das Gewebe an die entsprechende Stelle eingebracht werden muss. Wenn das Material zu scharf ist oder nicht sorgfältig platziert wird, kann es zu Verletzungen des Gewebes kommen, die die Immunantwort weiter verstärken. Zusätzlich können diese Reaktionen im Laufe der Zeit zu einem Verlust des elektrischen Signals führen, da das Immunsystem den stimulierten Bereich "einkapseln" kann, was die Langlebigkeit des Implantats negativ beeinflusst. Bis jetzt hat ein epiretinales Implantat, Argus II, es geschafft, Biokompatibilitätsprobleme zu umgehen, und hat nach 3 Jahren bei einem Patienten noch funktioniert. Dieses Implantat verwendet Silikon, ein Material, das eine gute Langzeit-Biokompatibilität aufweist, aber ein steifes Substrat ist, das es nicht erlaubt, die Konfiguration des Geräts leicht zu verändern. Andere Materialien wie Polyimid und Gold wurden auf ihre Funktionalität und Biokompatibilität untersucht. Polyimid ist ein vielversprechendes Polymer für zukünftige Implantate, da Implantate aus diesem Material in Kurzzeitstudien am menschlichen Auge funktionsfähig sind. Ein solches Material ist aufgrund seiner hohen Biokompatibilität und Flexibilität sowie seiner niedriger Kosten von Vorteil. Die Optimierung von Materialien, die für Netzhautimplantate geeignet sind, ist im Gange, da der technologische Fortschritt komplexere Mikroelektroden-Arrays hervorbringt, die andere Substrate für eine maximale Funktionalität erfordern [8] [9] .
Subretinale Implantate
[Bearbeiten]Wie der Name schon sagt, sind subretinale Implantate Sehprothesen hinter der Netzhaut. Das Implantat befindet sich daher am nächsten an den geschädigten Photorezeptoren, mit dem Ziel die Stäbchen und Zapfen zu umgehen und die bipolaren Zellen in der nächsten Nervenschicht der Netzhaut zu stimulieren. Der Hauptvorteil dieses Ansatzes liegt in der relativ geringen visuellen Signalverarbeitung zwischen den Photorezeptoren und den bipolaren Zellen, die vom Implantat imitiert werden müssen. Das heißt, dass die von einer Videokamera aufgenommenen Rohdaten direkt oder mit nur relativ rudimentärer Signalverarbeitung an die MEA weitergeleitet werden können, wodurch das Verfahren aus Sicht der Signalverarbeitung relativ einfach wird. Dieser Ansatz hat jedoch einige gravierende Nachteile. Die hohe räumliche Dichte der Photorezeptoren in der menschlichen Netzhaut stellt eine große Herausforderung bei der Entwicklung und Gestaltung einer MEA mit ausreichend hoher Stimulationsauflösung und damit geringem Elektrodenabstand dar. Darüber hinaus erschwert der gestapelte Aufbau der Nervenschichten in z-Richtung (mit der x-y-Ebene tangential zur Netzhautkrümmung) die Platzierung der Elektroden in der Nähe der bipolaren Zellen. Da sich das MAE hinter der Netzhaut befindet, besteht ein erheblicher räumlicher Abstand zwischen den Elektroden und den Zielzellen, der überwunden werden muss. Wie oben erwähnt, zwingt eine größerer Abstand von Elektrode zu Zielzelle den MAE, mit höheren Strömen zu arbeiten, wodurch die Elektrodengröße, die Anzahl der Zellen im Stimulationsbereich einer einzelnen Elektrode und die räumliche Trennung zwischen benachbarten Elektroden vergrößert wird. Dies alles führt zu einer verminderten Stimulationsauflösung und setzt die Netzhaut dem Risiko einer Gewebeschädigung durch zu hohe Ladungsdichten aus. Wie unten gezeigt, besteht eine Möglichkeit, große Entfernungen zwischen den Elektroden und den Zielzellen zu überwinden, darin, dass die Zellen ihre Projektionen über größere Entfernungen direkt auf der Elektrode wachsen lassen.
Ende 2010 veröffentlichte eine deutsche Forschungsgruppe in Zusammenarbeit mit der privaten deutschen Firma "Retina Implant AG" Ergebnisse aus Studien mit subretinalen Implantaten beim Menschen [10] . Ein drei mal drei Millimeter großes Mikrophotodiodenarray (MPDA) mit 1500 Pixeln, wobei jedes Pixel aus einer einzelnen lichtsensitiven Photodiode und einer Elektrode besteht, wurde hinter die Netzhaut von drei Patienten implantiert, die durch eine Makuladegeneration erblindet sind. Die Pixel lagen etwa 70 Mikrometer voneinander entfernt, was eine räumliche Auflösung von etwa 160 Elektroden pro Quadratmillimeter ergibt - oder, wie von den Autoren des Papers angegeben, einen visuellen Kegelwinkel von 15 Bogenminuten für jede Elektrode. Es ist zu beachten, dass im Gegensatz zu Implantaten, die externe Videokameras zur Erzeugung von visuellem Input verwenden, jedes Pixel des MPDA selbst eine lichtempfindliche Photodiode enthält, die den elektrischen Strom aus dem durch den Augapfel empfangenen Licht für seine eigene zugehörige Elektrode erzeugt. So entspricht jedes MPDA-Pixel in seiner vollen Funktionalität einem Photorezeptor. Das hat einen großen Vorteil: Da der MPDA hinter der menschlichen Netzhaut fixiert ist, wird er automatisch mitgezogen, wenn der Augapfel bewegt wird. Und da der MPDA selbst den visuellen Input zur Erzeugung der elektrischen Ströme für die Stimulationselektroden erhält, werden die Bewegungen des Kopfes oder des Augapfels natürlich und ohne künstliche Verarbeitung gehandhabt. Bei einem der Patienten wurde die MPDA direkt hinter der Makula platziert, was im Vergleich zu den beiden anderen Patienten, deren MPDA weiter vom Zentrum der Netzhaut entfernt implantiert wurde, zu besseren Ergebnissen in experimentellen Tests führte. Die Ergebnisse, die der Patient mit dem Implantat hinter der Makula erzielt hat, waren außergewöhnlich. Er konnte Buchstaben (5-8 cm groß) erkennen und Wörter lesen sowie schwarz-weiße Muster mit unterschiedlichen Ausrichtungen unterscheiden [10].
Die experimentellen Ergebnisse mit den MPDA-Implantaten haben auch auf ein weiteres visuelles Phänomen aufmerksam gemacht, das einen zusätzlichen Vorteil des MPDA-Ansatzes gegenüber Implantaten mit externen Bildgebungsgeräten aufzeigt: In geringem Zeitraum aufeinander folgende Stimulationen der Netzhautzellen führen schnell zu verminderten Reaktionen, was darauf hindeutet, dass die Netzhautneuronen nach wiederholter Stimulation innerhalb kurzer Zeit gehemmt werden. Dies bedeutet, dass ein visueller Input, der auf eine auf oder hinter der Netzhaut fixierte MEA projiziert wird, zu einem schnell verblassenden Bild führt, obwohl die elektrische Stimulation der Elektroden konstant bleibt. Dies liegt daran, dass die festen Elektroden auf der Netzhaut die gleichen Zellen auf der Netzhaut ständig stimulieren, wodurch die Zellen im Laufe der Zeit immer weniger empfindlich auf einen konstanten Reiz reagieren. Der Prozess ist jedoch reversibel und die Zellen gewinnen ihre ursprüngliche Empfindlichkeit zurück, sobald der Reiz wieder fehlt. Wie geht ein intaktes visionäres System mit diesem Effekt um? Warum sind gesunde Menschen in der Lage, ein Objekt über längere Zeit zu fixieren, ohne es auszublenden? Wie in
[11] erwähnt, passt sich das menschliche Auge kontinuierlich in kleinen, unmerklichen Augenbewegungen an, so dass im Laufe der Zeit der gleiche visuelle Reiz auf leicht unterschiedliche Netzhautpunkte projiziert wird, auch wenn wir dazu neigen, das Auge auf ein Zielobjekt zu fokussieren und zu fixieren. Damit wird das Phänomen der verblassenden Zellantwort erfolgreich umgangen. Da das Implantat sowohl als Photorezeptor als auch als Elektrodenstimulator dient, wie es bei der MPDA der Fall ist, können die natürlichen kleinen Augeneinstellungen problemlos genutzt werden, um diesen Effekt auf einfache Weise zu bewältigen. Andere Implantatansätze, die eine externe visuelle Eingabe (z.B. von Videokameras) verwenden, leiden unter dem Verblassen der projizierten Bilder, wenn kontinuierlich stimuliert wird. Schnelles, künstliches Zittern der Kamerabilder kann das Problem nicht lösen, da diese externe Bewegung möglicherweise nicht mit der Augenbewegung übereinstimmt und der visuelle Kortex dies daher einfach als eine wackelige oder verschwommene Szene anstelle der gewünschten gleichmäßigen Langzeitprojektion des Standbildes interpretiert. Ein weiterer Vorteil der subretinalen Implantate ist die genaue Korrelation zwischen den stimulierten Bereichen auf der Netzhaut und der wahrgenommenen Lage des Reizes im Gesichtsfeld des Menschen. Im Gegensatz zu RGCs, deren Lage auf der Netzhaut möglicherweise nicht direkt mit der Lage ihrer einzelnen rezeptiven Felder übereinstimmt, wird die Stimulation einer bipolaren Zelle genau an dem Punkt im Gesichtsfeld wahrgenommen, der der geometrischen Lage auf der Netzhaut entspricht, wo sich diese bipolare Zelle befindet. Ein klarer Nachteil von subretinalen Implantaten ist das invasive chirurgische Verfahren.
Epiretinale Implantate
[Bearbeiten]Epiretinale Implantate befinden sich auf der Netzhaut und damit am nächsten an den Ganglienzellen (RGCs) der Netzhaut. Aus diesem Grund zielen epiretinale Implantate darauf ab, die RGCs direkt zu stimulieren und dabei nicht nur die geschädigten Photorezeptoren, sondern auch jegliche neuronale Zwischenverarbeitung durch die bipolaren, horizontalen und amakrinen Zellen zu umgehen. Das hat einige Vorteile: Erstens ist der chirurgische Eingriff bei einem epiretinalen Implantat weit weniger kritisch als bei einem subretinalen Implantat, da die Prothese nicht auf der posterioren Seite des Auges implantiert werden muss. Außerdem gibt es viel weniger RGCs als Photorezeptoren oder bipolare Zellen, was eine grobkörnigere Stimulation mit größerem Abstand zwischen den Elektroden (zumindest in den Randbereichen der Netzhaut) erlaubt, wobei sogar eine höhere Elektrodendichte als die tatsächliche RGC-Dichte möglich ist, was für mehr Flexibilität und Genauigkeit bei der Stimulation der Zellen sorgt. Eine Studie zur epiretinalen Stimulation von peripheren Sonnenschirmzellen auf der Makakennetzhaut liefert quantitative Details [7]. Sonnenschirmzellen sind eine Art von RGCs, die den zweitdichtesten visuellen Weg in der Netzhaut bilden. Ihr Hauptzweck ist es, die Bewegung von Objekten im Gesichtsfeld zu kodieren und damit die Bewegung zu erfassen. Die Experimente wurden in vitro durchgeführt, indem das Netzhautgewebe der Makaken auf eine MEA mit 61 Elektroden (60 Mikrometer Elektrodenabstand) gelegt wurde. 25 einzelne Sonnenschirmzellen wurden elektronisch identifiziert und stimuliert, während Eigenschaften wie Stimulationsschwelle und bester Stimulationsort analysiert wurden. Der Schwellenstrom wurde als der niedrigste Strom definiert, der in 50% der Stimulusimpulse einen Spike in der Zielzelle auslöste (Pulsdauer: 50 Millisekunden) und wurde durch stufenweises Erhöhen der Stimulationsstärke bestimmt, bis eine ausreichende Spikereaktion registriert wurde. Es gilt dabei zwei Aspekte zu beachten: Erstens zeigen Sonnenschirmzellen als RGCs ein Aktionspotentialverhalten, im Gegensatz zu bipolaren Zellen, die mit abgestuften Potenzialen arbeiten. Zum anderen wurden die Elektroden am MEA sowohl für die Stimulationsimpulse als auch für die Aufzeichnung der Spikereaktion der Zielzellen verwendet. Auf dem 61-Elektroden MEA befanden sich 25 Sonnenschirmzellen. Das ergab eine Elektrodendichte, die signifikant höher war als die der Sonnenschirmzellen, wodurch sich mehrere Elektroden in den rezeptiven Feldern einer einzelnen Sonnenschirmzelle befanden. Neben der Messung der Stimulationsschwellen, die notwendig sind, um eine zuverlässige Zellantwort auszulösen, wurde auch der Ort der besten Stimulation bestimmt. Der Ort der besten Stimulation bezieht sich auf den Ort der Stimulationselektrode in Bezug auf die Zielzelle, wo die niedrigste Stimulationsschwelle erreicht wurde. Überraschenderweise stellte sich heraus, dass dies nicht auf dem Zellsoma, wie man es erwarten würde, sondern etwa 13 Mikrometer weiter unten auf dem Axonweg ist. Von da an zeigten die Experimente den zu erwartenden quadratischen Anstieg der Reizschwellenströme als Funktion der Distanz zwischen Elektrode und Soma. Die Studienergebnisse zeigten auch, dass alle Stimulationsschwellen weit unter den Sicherheitsgrenzen lagen (etwa 0,05 mC/cm2, im Gegensatz zu 0,1 mC/cm2 als (niedrige) Sicherheitsgrenze) und dass die Zellantwort auf einen Stimulationsimpuls schnell (durchschnittlich 0,2 ms Latenzzeit) und präzise (geringe Varianz der Latenzzeit) war. Die überlegene Elektrodendichte gegenüber der Sonnenschirmzellendichte ermöglichte zudem eine zuverlässige Adressierung der einzelnen Zellen durch die Stimulation der entsprechenden Elektrode, wobei gleichzeitig verhindert wurde, dass in benachbarten Zellen ebenfalls ein Spike hervorgerufen wird.
Überblick über alternative technische Ansätze
[Bearbeiten]In diesem Abschnitt geben wir einen kurzen Überblick über einige alternative Ansätze und Technologien, die derzeit erforscht werden.
Nanoröhrchen-Elektrode
[Bearbeiten]Klassische MEAs enthalten Elektroden aus Titannitrid oder Indiumzinnoxid, die das Implantat vor schwere Problemen hinsichtlich der Langzeit-Biokompatibilität stossen [12]. Eine vielversprechende Alternative zu metallischen Elektroden sind Kohlenstoff-Nanoröhrchen (CNT), die eine Reihe von sehr vorteilhaften Eigenschaften vereinen. Erstens sind sie vollständig biokompatibel, da sie aus reinem Kohlenstoff hergestellt werden. Zweitens sind sie aufgrund ihrer Robustheit für die Langzeitimplantation geeignet, eine wichtige Eigenschaft für visuelle Prothesen. Die gute elektrische Leitfähigkeit erlaubt es ihnen, als Elektroden zu arbeiten. Und schließlich führt ihre sehr poröse Beschaffenheit zu extrem großen Kontaktflächen, die die Neuronen ermutigen, auf den CNTs zu wachsen, was den Kontakt zwischen Neuronen und Elektroden verbessert und die Reizströme senkt, die notwendig sind, um eine Zellantwort auszulösen. Allerdings sind CNT-Elektroden erst in jüngster Zeit entstanden und es liegen nur wenige wissenschaftliche Ergebnisse vor.
Drahtlose Implantatansätze
[Bearbeiten]Eine der größten technischen Herausforderungen beim Netzhaut-Implantat liegt in der Verkabelung, die das MEA mit den externen Reizen, der Stromversorgung sowie den Steuersignalen verbindet. Die mechanische Beanspruchung der Verkabelung beeinflusst deren Langzeitstabilität und Langlebigkeit und stellt eine große Herausforderung an die verwendeten Materialien dar. Drahtlose Technologien könnten eine Möglichkeit sein, jegliche Verkabelung zwischen dem eigentlichen Netzhaut-Implantat und externen Geräten zu umgehen. Die Energie des durch das Auge einfallenden Lichts reicht nicht aus, um neuronale Reaktionen auszulösen. Damit ein drahtloses Implantat funktioniert, muss dem Implantat daher zusätzliche Energie zugeführt werden. Ein Ansatz der Stanford School of Medicine nutzt ein Infrarot-LCD-Display, um die von einer Videokamera aufgenommene Szene auf eine Brille zu projizieren, die Infrarotpulse auf den Chip auf der Netzhaut reflektiert. Der Chip verwendet außerdem eine wiederaufladbare Photovoltaik-Batterie, die die Energie liefert, die benötigt wird, um das IR-Licht in ausreichend starke Stimulationsimpulse umzuwandeln. Ähnlich wie beim subretinalen Ansatz kann das Auge auf natürliche Weise Objekte in der Szene fixieren und fokussieren, da sich das Auge frei bewegen kann und verschiedene Teile des IR-Bildes auf der Brille auf verschiedene Bereiche des Chips auf der Netzhaut projiziert werden können. Anstelle von Infrarotlicht können auch induktive Spulen verwendet werden, um elektrische Energie und Datensignale von externen Geräten an das Implantat auf der Netzhaut zu übertragen. Diese Technologie wurde erfolgreich in das EPIRET3-Netzhaut-Implantat implementiert und getestet [13]. Diese Tests waren jedoch eher ein Proof-of-Concept, da nur die Fähigkeit der Patienten, ein visuelles Signal beim Anlegen eines Reizes an die Elektroden zu spüren, getestet wurde.
Gerichtetes neuronales Wachstum
[Bearbeiten]Eine Möglichkeit, eine sehr präzise neuronale Stimulation mit extrem niedrigen Strömen und auch über größere Entfernungen zu ermöglichen, besteht darin, die Neuronen ihre Projektionen auf die Elektrode wachsen zu lassen. Durch das Auftragen der richtigen chemischen Lösung auf das Netzhautgewebe kann das Nervenwachstum gefördert werden. Dies kann durch Aufbringen einer Schicht Laminin auf die MEA-Oberfläche erreicht werden. Um die Bildung der neuronalen Pfade geometrisch zu kontrollieren, wird das Laminin nicht gleichmäßig über die MEA-Oberfläche aufgetragen, sondern in schmalen Pfaden, so wie sie die Neurone bilden sollten. Dieser Prozess des präzisen, strukturierten Auftragens des Laminins wird als "Mikrokontaktdruck" bezeichnet. Ein Bild, wie diese Laminin-Pfade aussehen, ist in Abbildung 5 dargestellt. Das mit dieser Methode erzielte erfolgreiche gerichtete neuronale Wachstum ermöglichte die Anwendung deutlich geringerer Reizströme im Vergleich zur klassischen Elektrodenstimulation, wobei diese Methode immer noch verlässlich neuronale Reaktionen auslöste [14]. Außerdem folgt die Stimulationsschwelle nicht mehr dem quadratischen Anstieg in Bezug auf den Elektroden-Soma-Abstand, sondern bleibt auch bei größeren Entfernungen (>200 Mikrometer) konstant auf dem gleichen niedrigen Niveau.
Mikroelektroden-Arrays zur Charakterisierung der Netzhautfunktion: Eine CMOS-basierte Technologie
[Bearbeiten]Wie bereits im Abschnitt Herausforderungen bei Netzhaut-Implantaten erläutert, haben viele Mikroelektroden-Arrays nur eine geringe Anzahl von Elektroden, was ihre Spezifität in Bezug auf die Stimulation von Neuronen in neuronalen Netzwerken beeinträchtigt. Dies ist ein limitierender Faktor, wenn es darum geht die Netzwerk-Dynamik und die Funktionalitäten neuronaler Populationen sehen zu können. Insbesondere gehen viele zelluläre Details wie z.B. die Ausbreitungsgeschwindigkeiten von Signalen und die axonale Informationsverarbeitung in Arrays mit geringerer Dichte verloren. Kürzlich haben Forscher die Vorteile der Komplementär-Oxid-Halbleiter(CMOS)-Technologie genutzt, um hochdichte Mikroelektroden-Arrays mit hoher räumlicher Auflösung zu erzeugen, die den Nachweis dieser zellulären Informationen sowie ein hohes Signal-Rausch-Verhältnis durch Platinschwarzabscheidung ermöglichen. Solche Arrays können 26400 Mikroelektroden über einem Sensor-Array von 3,85 x 2,10 mm2 haben. Bei einem Pitch von 17,5 μm beträgt die Elektrodendichte 3265 Elektroden pro μm2, mit 1024 Auslesekanälen [15] . Mit vielen Schaltern unter den Elektroden können verschiedene Elektrodenkonfigurationen zur Beurteilung der neuronalen Population auf dem Chip verwendet werden. Mit einem so empfindlichen und dichten Mikroelektrodenchip können Einzelzellenidentifikation, Netzwerkebenenanalyse und axonale Informationen aus neuronalen Zellen erfasst werden. Diese Technologie öffnet die Tür zu elektrophysiologischen Biomarkern, die für die Krankheitsmodellierung und für die Funktionalität des Gewebes bestimmt werden können, indem eine präparierte Netzhaut auf einem Mikroelektrodenarray plattiert und aufgezeichnet wird [16] .
Retina-Aufnahmen
[Bearbeiten]Lichtsignale werden in der Netzhaut interpretiert und in den Neuronen der Ganglienschicht, den so genannten retinalen Ganglienzellen (RGCs), gespeichert. Diese Zellen verarbeiten und senden diese Informationen dann über Aktionspotentiale weiter, die von Mikroelektroden-Arrays aufgezeichnet werden können, um die Schaltung der Netzhaut, die Entwicklung und die Kodierung einer visuellen Szene zu verstehen. Solche in-vitro-Experimente werden typischerweise durchgeführt, indem zunächst die Netzhaut aus ihrem nativen Gewebe isoliert, das Gewebe mit den Ganglienzellen der Netzhaut nach unten auf dem Array plattiert und mittels Lichtstimulation aufgezeichnet wird. Anschließend werden die Daten mittels Spike-Sortierung analysiert, welche später erklärt wird. Mithilfe verschiedener Lichtreize kann die Photorezeptorantwort und –funktionalität bewertet werden. Darüber hinaus können Forscher den Einfluss von retinalen Mutationen auf das RGC-Spiking-Verhalten untersuchen, um elektrophysiologische Biomarker zu bestimmen. In einem Experiment verwendeten die Forscher ein Mikroelektrodenarray für Wildtyp-Maus-Retinas und Mäuse mit einem FRMD7-Knockout. FMRD7 ist eine Mutation, die mit einer horizontalen, blickabhängigen schnellen Augenbewegung bei Betroffenen einhergeht. Die Daten aus den Aufnahmesitzungen auf dem Mikroelektrodenarray zeigten einen Verlust der Reaktion auf horizontal gerichtete selektive Zellen in der Netzhaut. Die Wildtyp-Mäuse zeigten keinen Verlust der Reaktion, weder auf horizontal noch auf vertikal gerichtete selektive Zellen. Ein solcher Befund deutet auf die Fähigkeit hin, mithilfe der Mikroelektroden-Array-Technologie elektrophysiologische Biomarker von Netzhauterkrankungen in der zukünftigen Forschung zu bestimmen [17] .
Spike-Sortierung
[Bearbeiten]Mit den neuesten Mikroelektroden-Technologien, die neuronale Aufnahmen von Tausenden von Elektroden ermöglichen, können große Mengen gleichzeitiger elektrophysiologischer Daten aus neuronalem Gewebe und Netzwerken analysiert werden, um relevante elektrische Informationen über das Nervensystem zu enthüllen. Beim Einsatz eines Mikroelektrodenarrays für die Neurowissenschaften werden elektrische Signale von Neuronen (Aktionspotentiale) extrazellulär erfasst. Die Amplitude des Aktionspotentials ist im Gegensatz zu Patch Clamp negativ. Diese extrazellulären Signaturen enthalten nicht nur Informationen über die Aktionspotenziale, sondern auch über synaptische Mechanismen (lokale Feldpotenziale), die durch Filterung und Analyse identifiziert werden können. Das Verfahren zur Analyse und Zuordnung dieser elektrophysiologischen Informationen zu einem einzelnen Neuron wird als Spike-Sortierung bezeichnet.


Der Hauptaspekt einer Aufzeichnung, die in einer Mikroelektrodenaufnahme analysiert wird, ist der Spike-Train. Ein Neuron kann durch seine Spiking-Aktivität identifiziert werden, da das Timing eines jeden Ereignisses von der Größe, Form und Position des Neurons relativ zur Elektrode abhängt. Bei der Aufnahme von Tausenden von Neuronen wird die Spike-Sortierung zu einer Herausforderung, ähnlich dem Cocktail-Party-Phänomen. Mit mehreren Neuronen in unmittelbarer Nähe zueinander ist es für eine Elektrode sehr einfach, Signale von mehreren Neuronen aufzunehmen. Daher muss die Spike-Sortierung ein einzelnes Neuron anhand seines elektrischen "Chatters" identifizieren, wenn auch viele Hintergrundgeräusche auftreten. Die Spike-Sortierung ist ein mehrstufiger Prozess, der die Rohdaten aus der neuronalen Population entnimmt und die Spikes trotz der Hintergrundgeräusche einem einzelnen Neuron zuordnet.
Die Spike-Sortierung kann folgende Schritte beinhalten: Vorverarbeitung von Rohdaten → Spike-Erkennung → Extraktion von Spikes und Ausrichtung → Feature-Extraktion → Clustering → Klassifizierung. In diesem allgemeinen Workflow übernimmt ein Spike-Sortier-Algorithmus die Rohdaten aus der neuronalen Population und verarbeitet sie zunächst, indem er den niederfrequenten Teil des Aktionspotenzials (Rauschen) herausfiltert. Spikes werden dann durch Setzen einer Spannungsschwelle erkannt. Danach müssen die extrahierten Spike-Wellenformen in Bezug auf ein allgemeines Merkmal des Aktionspotenzials, wie z.B. seine Position, mit der Zeit abgeglichen werden. Anschließend werden die Merkmale aus jeder einzelnen Wellenform mittels Hauptkomponentenanalyse oder Wavelets extrahiert, was notwendig ist, um die Daten auf die notwendigen Dimensionen zu reduzieren, die die gewünschten Informationen enthalten. Die Spikes werden dann gebündelt, um eine Vorlage für ein einzelnes Neuron zu erstellen. Dies geschieht für die einzelnen Neuronen in den Daten. Es gibt keinen "one size fits all" Spike-Sortier-Algorithmus, da Multielektroden-Aufnahmen zwischen verschiedenen Zelltypen, Spezies und der Art der Aufzeichnung unterschiedlich sein können. Daher müssen Algorithmen angepasst und optimiert werden, um Ergebnisse zu erzielen, die die Rohdaten exakt darstellen können. Sobald die Daten jedoch sortiert sind, kann ein Haufen von Informationen aus den Daten herausgelesen werden, wie z.B. Interspike-Intervalle und Refraktärzeiten. Ausserdem kann man Daten einzelner Neuronen gegeneinander aufzuzeichnen, um Unterschiede zu erkennen [18] .
- ↑ Larry Squire, et al. Fundamental Neuroscience 4th edition. publisher, 2012.
- ↑ 2,0 2,1 2,2 Lan Yue, James D. Weiland, Botond Roska, Mark S. Humayun. “Retinal stimulation strategies to restore vision: Fundamentals and Systems”. journal, 2016.
- ↑ Jackson, G.R., Owsley, C., Curcio, C.A. “Photoreceptor degeneration and dysfunction in aging and age-related maculopathy.”. journal, 2002.
- ↑ Shigeru Sato, Yoshihiro Omori, et al. “Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation”. journal, 2008.
- ↑ Jost B. Jonas, UlrikeSchneider, Gottfried O.H. Naumann. “Count and density of human retinal photoreceptors”. journal, 1992.
- ↑ Ashmore Jonathan. “Cochlear Outer Hair Cell Motility”. journal, 2008.
- ↑ 7,0 7,1 7,2 Chris Sekirnjak, PawelHottowy, Alexander Sher, Wladyslaw Dabrowski, Alan M. Litke, E.J. Chichilnisky. “High-Resolution Electrical Stimulation of Primate Retina for Epiretinal Implant Design”. journal, 2008.
- ↑ Jong-Mo Seo, et al. “Biocompatibility of polyimide microelectrode array for retinal stimulation”. journal, 2004.
- ↑ Eui Tae Kim, et al. “Feasibility of Microelectrode Array (MEA) Based on Silicone-Polyimide hybride for retina prosthesis”. journal, 2009.
- ↑ 10,0 10,1 Eui Ta Eberhart Zrenner, KarlUlrich Bartz-Schmidt, Heval Benav, Dorothea Besch, Anna Bruckmann, Veit-Peter Gabel, Florian Gekeler, Udo Greppmaier, Alex Harscher, Steffen Kibbel, Johannes Koch, Akos Kusnyerik, tobias Peters, Katarina Stingl, Helmut Sachs et al.e Kim, et al. “Subretinal electronic chips allow blind patients to read letters and combine them to words”. journal, 2010.
- ↑ Pritchard Roy. “Stabilized Images on the Retina”. journal, year.
- ↑ Asaf Shoval, ChrisopherAdams, Moshe David-Pur, Mark Shein, Yael Hanein, Evelyne Sernagor. “Carbon nanotube electrodes for effective interfacing with retinal tissue”. journal, 2009.
- ↑ Susanne Klauke, Michael Goertz, Stefan Rein, Dirk Hoehl, Uwe Thomas, Reinhard Eckhorn, Frank Bremmer, Thomas Wachtler. “Stimulation with a Wireless Intraocular Epiretinal Implant Elicits Visual Percepts in Blind Humans”. journal, 2011.
- ↑ Neville Z. Mehenti, GrehS. Tsien, Theodore Leng, Harvey A. Fishman, Stacey F. Bent. “A model retinal interface based on directed neuronal growth for single cell stimulation”. journal, 2006.
- ↑ Jan Muller, et al. “High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels”. journal, 2015.
- ↑ Fiscella M, et al. “Recording from defined populations of retinal ganglion cells using a high-density cmos-integrated microelectrode array with real-time switchable electrode selection”. journal, 2012.
- ↑ Fiscella M, Yonehara K, Drinnenberg A, Franke F, Müller J, Roska B and Hierlemann A. “Screening Transgenic Mouse Models of Human Eye Diseases with CMOS High-Density Microelectrode Arrays”. journal, 2016.
- ↑ Gaute T Einevoll, Felix Franke, Espen Hagen, Christophe Pouzat, and Kenneth D Harris. “Towards reliable spike-train recordings from thousands of neurons with multielectrodes”. journal, 2012.
