Natur und Technik für den Pflichtschulabschluss: Die Materie
Aggregatzustände[Bearbeiten]
Fest, flüssig, gasförmig[Bearbeiten]
-
Wasserdampf
-
Wassertropfen
-
Eisberg
Wasser kommt in der Natur in drei unterschiedlichen Formen vor. Es gibt das Wasser, das wir trinken, es gibt Wasser als Eis, wenn es sehr kalt ist, und auch als Wasserdampf, wenn wir das Wasser kochen. Das gleiche gilt für viele andere Stoffe. Alkohol und Benzin kann man auch kochen und einfrieren. Sogar Metalle, wie das Eisen, kann man schmelzen und, wenn die Temperatur extrem hoch ist, sogar „kochen“. Es gibt also drei unterschiedlichen Formen, in denen sich ein Stoff befinden kann: fest, flüssig und gasförmig. Diese drei unterschiedlichen Formen nennt man in der Physik Aggregatzustände.
Was ist aber der Unterschied zwischen diesen Zuständen?
Man kann Unterschiede in den Eigenschaften feststellen. Im festen Zustand kann man die Form eines Stoffes schwer und sein Volumen kaum verändern. Eine Flüssigkeit kann zwar leicht ihre Form verändern und nimmt die Form des Behälters an, in dem sie sich befindet, ihr Volumen aber ist auch kaum veränderbar. Das kann man mit Hilfe einer Spritze voll mit Wasser feststellen, wenn man die Öffnung schließt und den Hebel zu drücken versucht. Wenn die Spritze nur eine Flüssigkeit wie Wasser hat, kann man sie nicht zusammendrücken. Wenn die Spritze nur Luft hat, dann kann man sie leicht zusammendrücken. Bei Gasen ist das Volumen leicht veränderbar. Man kann kaum mehr über eine Form sprechen, das Gas verteilt sich überall im Raum.
| Aggregatzustand → | ↓ fest ↓ | ↓ flüssig ↓ | ↓ gasförmig ↓ | |
| Eigenschaften: | Form: | schwer veränderbar | Form des Behälters klare Grenze |
"freie" Form unklare Grenze |
| Volumen: | kaum veränderbar | kaum veränderbar | leicht veränderbar | |
| Teilchen: | Abstand: | Nah zueinander | Nah zueinander | sehr weit auseinander |
| Bewegung: | Schwingung feste Plätze |
keine feste Plätze begrenzte freie Bewegung |
freie Bewegung höchste Geschwindigkeit | |
| Zwischenkräfte: | anziehend ständig und stark |
anziehend vorläufig und stark |
kaum oder keine anziehende Kräfte | |
Diese Unterschiede kann man durch das sogenannte Teilchenmodell erklären. In diesem Modell nimmt man an, dass die Materie aus vielen kleinen Teilchen besteht.
Bei festen Körpern sind diese Teilchen ganz nah beieinander. Sie bleiben an einer festen Stelle, sind stark durch Kräfte zu den anderen Teilchen gebunden und schwingen.
Je wärmer der Körper ist, desto mehr schwingen die Teilchen. Irgendwann wird die Schwingung zu stark und die Teilchen verlassen ihre feste Plätze. Die Kräfte zu den anderen Teilchen sind immer noch stark, die Teilchen können sich aber untereinander fast frei bewegen. Das ist die flüssige Phase.
Wenn die Flüssigkeit noch wärmer wird, fliegen die Teilchen frei im Raum. Das ist der gasförmige Zustand. Es gibt kaum oder keine bindende Kraft zwischen den Teilchen mehr und sie sind weit weg voneinander.
-
Fester Körper: nah und schwingend
-
Gasförmig: große Abstände, freie Bewegung
-
Flüssigkeit: kleine Abstände, fast freie Bewegung
Aggregatzustandsänderungen[Bearbeiten]
Viele Stoffe werden flüssig, wenn sie aufgewärmt werden. Diese Aggregatzustandsänderung nennt man Schmelzen. Für das Schmelzen braucht man daher Energie.

Wenn wir eine Flüssigkeit weiter aufwärmen, dann wird sie gasförmig. Das erlebt man im Alltag, wenn man Wasser kocht. Das Wasser wird dann zum Wasserdampf. Diese Änderung braucht auch Energie und wird Verdampfen genannt.
Umgekehrt kann ein Gas flüssig werden. Wenn der Wasserdampf oder unserer Hauch an ein kaltes Fenster kommt, entsteht am Fenster flüssiges Wasser. Diesen Übergang nennt man Kondensieren. Beim Kondensieren wird Energie freigesetzt.
Wenn das Wasser weiter kälter wird, wird es zum Eis. Das gilt für viele andere Stoffe auch. Diese Änderung nennt man Erstarren. Beim Erstarren wird Energie wieder freigesetzt.
Es gibt allerdings noch zwei Aggregatzustandsänderungen, die in der Natur selten vorkommen. Fest zum Gas, was man Sublimieren nennt, und Gas zum Fest, was man Resublimieren nennt.
Die Temperatur, in der ein Stoff schmilzt, nennt man Schmelzpunkt, die Temperatur, in der ein Stoff verdampft, Siedepunkt. Der Schmelzpunkt fürs Wasser ist 0°C, sein Siedepunkt 100°C. Wenn die Temperatur höher als der Siedepunkt ist, dann haben wir nur gasförmigen Stoff.
Eine besondere Art von Änderung ist das Verdunsten. Nach dem Regen auf der Straße oder nach dem Wischen des Bodens im Haus bleibt das Wasser nicht lang am Boden. Das Wasser wird nicht vom Boden absorbiert. Man sagt, dass das Wasser „verdunstet“. In diesem Fall wird auch eine Flüssigkeit zum Gas. Es gibt aber einen Unterschied zum Verdampfen. Beim Verdampfen muss man das Wasser kochen, beim Verdunsten nicht. Verdunsten findet also bei Temperaturen statt, die niedriger als der Siedepunkt sind. Bei Temperaturen höher als der Siedepunkt kann der Stoff nur gasförmig sein.
Wie passiert das? Die Teilchen in jeder Flüssigkeit bewegen sich schneller, wenn die Temperatur höher wird. Nicht alle Teilchen aber haben die gleiche Geschwindigkeit. Manche sind langsamer, manche schneller. Manche sind sogar so schnell, dass sie die Flüssigkeit verlassen und in die Luft gelangen. Das nennt man Verdunsten. Verdunsten passiert bei allen Flüssigkeiten. Deshalb können wir sie auch riechen.
Brownsche Bewegung[Bearbeiten]

Eine Grundhypothese der Naturwissenschaften ist, dass die Materie aus sehr kleine Teilchen besteht. Diese Hypothese wurde schon seit Jahrtausenden formuliert, sie wurde allerdings erst im 19. Jahrhundert experimentell bestätigt. Der Botaniker Robert Brown hat im Jahr 1827 die unregelmäßige und abrupte Bewegung von kleinen Staubkörner in Flüssigkeiten und Gasen mit dem Mikroskop beobachtet. Die Bewegung wurde desto stärker, je höher die Temperatur war. Die Bewegung konnte nur dadurch erklärt werden, dass noch viel kleinere Teilchen auf die Staubkörner gestoßen waren. Durch die Messung der Bewegungsänderung konnten später andere Wissenschaftler herausfinden, wie klein diese kleine Teilchen sind. Sie sind so klein, dass wir sie auch mit dem stärksten Mikroskop nicht sehen können. Diese Teilchen haben wir Atome und Moleküle genannt.
Einfache Grundformeln[Bearbeiten]
Dichte[Bearbeiten]

Wenn man eine Münze in ein Glas Wasser wirft, sinkt die Münze. Viele würden sagen, dass die Münze schwerer ist und daher sinkt. Wird aber das Wasser im Glas und die Münze tatsächlich gewogen, wird festgestellt, dass die Münze doch leichter als das ganze Wasser im Glas ist. Noch krasser ist der Unterschied, wenn man die Münze in einen See wirft. Das ganze Wasser wiegt doch tausende von Tonnen, trotzdem sinkt die Münze.
Der Begriff des Gewichtes reicht daher nicht aus, um dieses Phänomen zu erklären. Wenn man eine 5 g schwere Münze und 5 g Wasser vergleicht, stellt man fest, dass das 5 g Wasser viel mehr Volumen hat, also viel mehr Platz einnimmt. Ein neuer Begriff ist hier notwendig, der Begriff der Dichte. Hier ist die Formel dafür:
Diese Buchstaben stehen für die folgenden physikalischen Größen: (rho) steht für die Dichte, m steht für die Masse, V steht fürs Volumen.
Hier sind die Einheiten für diese physikalischen Größen:
- Masse (m) wird in kg (Kilogramm), g, mg (Milligramm) usw. gemessen.
- Volumen (V) wird in (Kubikmeter oder Meter hoch 3), (Kubikdezimeter oder Dezimeter hoch 3), (Kubikzentimeter oder Zentimeter hoch 3), , usw. gemessen.
- Dichte (ρ) wird in (Kilogramm PRO Kubikmeter), , , usw. gemessen. (ein Liter ist ein )
In Physik benutzen wir den genaueren Begriff „Masse“ anstatt „Gewicht“. Wenn man ein kg Heu und ein kg Eisen vergleicht, stellt man fest, dass Heu viel mehr Volumen hat. Heu hat eine geringere Dichte. Also: bei gleicher Masse ist die Dichte desto kleiner, je größer das Volumen ist.


Wenn man ein Liter Eisen und ein Liter Wasser vergleicht, stellt man fest, dass Eisen viel schwerer ist, also mehr Masse hat. Eisen hat eine größere Dichte. Also: bei gleichem Volumen ist die Dichte desto größer, je größer die Masse ist.
Der Grund also, warum die Münze im Wasser sinkt, ist nicht weil sie schwerer ist. Der Grund liegt an der Dichte. Die Dichte der Münze (Masse PRO Volumeneinheit) ist größer als die Dichte des Wassers. Grob gesagt ist die Masse der Münze "enger verpackt" als die Masse im Wasser.[1][2]
Aus dem gleichen Grund schwimmt Öl oder Holz im Wasser. Die Dichte vom Öl oder Holz ist kleiner als die des Wassers. Im Bild mit dem Glas (Flüssigkeitssäule) schwimmt oben der Stoff mit der kleinsten Dichte (Spiritus), dann Öl, Wasser und ganz unten der Stoff mit der größten Dichte (Sirup).
Man könnte fragen, wieso ein Schiff im Wasser nicht sinkt, obwohl es aus Eisen besteht. Die Antwort liegt an der mittleren Dichte. Im Schiffsrumpf gibt es viel Luft, die eine viel kleinere Dichte als Wasser hat. Die gesamte Dichte des Schiffes ist daher kleiner als die des Wassers.
Genauso kann ein Heißluftballon fliegen. Die Dichte der heißen Luft ist so klein, dass die mittlere Dichte des Luftballons kleiner als die Dichte der Luft ist. So steigt der Luftballon auf in den Himmel.
- ↑ Das kann man mit der Bevölkerungsdichte vergleichen. Wenn sich alle Personen einer Klasse an einen kleinen Platz versammeln, dann ist die "Bevölkerungsdichte" an diesem Platz größer, als wenn sie sich auf der ganzen Fläche verteilen. Die "Bevölkerungsdichte" zeigt uns in diesem Fall, wie eng nebeneinander die Personen sind. Je mehr "Platz" für die Personen vorhanden ist, desto weniger "eng" ist es. Je mehr Personen an einem "Platz" sind, desto "enger" wird es. Entsprechend können wir die Dichte beschreiben.
- ↑ Die Sprache ist relativ offen. Daher können wir theoretisch im Alltag das Wort „schwerer“ sowohl für die Masse als auch für die Dichte benutzen. Im letzteren Fall würde „schwerer“ als Synonym für „dichter“ gelten und „leichter“ als Synonym für „dünner“. In Physik wollen wir allerdings genauer sein, daher vermeiden wir die Wörter „schwer“ und „leicht“, wenn es um die Dichte geht.
Druck[Bearbeiten]
-
Hammer
-
Nagel
Wenn man einen Nagel in die Wand einschlägt, dann dringt die Spitze Seite in die Wand ein. Ist die Kraft sehr klein, dann dringt er doch nicht ein. Der Vorgang hängt daher mit der Kraft zusammen. Je größer die Kraft, desto leichter dringt der Nagel ein. Daher könnte man denken, dass der Vorgang nur von der Kraft abhängt.
Leicht können wir zeigen, dass dies nicht stimmt. Wenn wir den Nagel mit Kopf an der Wand einschlagen, dann dringt der Nagel kaum oder gar nicht mehr ein, auch wenn die Kraft ziemlich groß ist. Die Kraft ist daher nicht das Einzige, was den Vorgang beeinflusst. Was ist der Unterschied zwischen Kopf und Spitze des Nagels? Die Fläche. An der Spitze ist die Fläche viel kleiner. Je kleiner die Fläche, desto einfacher dringt der Nagel ein.
Um diese Zusammenhänge zu beschreiben, brauchen wir ein neuer Begriff: den Druck. Die Formel für den Druck ist:
Diese Buchstaben stehen für die folgenden physikalischen Größen: p ist der Druck, F ist die Kraft, A ist die Fläche
Hier sind die Einheiten für diese physikalischen Größen:
- Der Druck (p) wird in Pascal (Pa), atm oder bar gemessen.
- Die Kraft (F) wird in Newton (N), kN usw. gemessen.
- Die Fläche (A) in (Quadratmeter oder Meter hoch 2), (Quadratdezimeter oder Dezimeter hoch 2) usw.

Sowohl die Kraft als auch die Fläche kommen in der Formel vor. Je größer die Kraft, desto größer der Druck. Je größer die Fläche, desto kleiner der Druck. Druck und Kraft ändern sich in die gleiche Richtung. Druck und Fläche ändern sich in die Gegenrichtung. Der Druck also beschreibt wie viel Kraft pro Flächeneinheit ausgeübt wird.
Das Experiment mit dem Nagelbrett macht den Zusammenhang noch klarer. Steigt eine Person auf einen Nagel auf, dann wird sie sich verletzen. Wird das Gewicht der Person auf mehrere Nageln verteilt, wie am Nagelbrett, dann spürt sie die Spitzen kaum und verletzt sie sich gar nicht.
Noch ein beeindruckendes Beispiel ist der Vergleich des Druckes zwischen dem Fuß eines Elefanten und dem Schuhabsatz einer Frau:
Die Fläche der vier Füße des Elefanten ist ca. 0,5 m², die Kraft ca. 50000 N (das entspricht ca. 5 t Gewicht auf der Erdoberfläche). Die Fläche der beiden Schuhabsätze einer Frau soll ca. 0,5 cm² sein, also 0,00005 m², die Kraft 500 N ( das entspricht ca. 50 kg Gewicht auf der Erdoberfläche). Die entsprechende Drucke sind dann:

für den Elefanten und
für die Frau.
Der Druck des Absatzes ist nach dieser Rechnung 100 mal so groß wie beim Elefanten!
Noch ein Beispiel ist der Rammbock, der bei Belagerung von Städten im Mittelalter benutzt wurde. Nur weil die Kraft von vielen Menschen an einem Punkt konzentriert wirkte, hat dieses Mittel Erfolg gehabt.
Die Atome[Bearbeiten]
Der Weg zur Entdeckung[Bearbeiten]
Sprache oder vom Verständnis her sein
In der Antike gab es schon philosophische Theorien, die versucht haben, die Beschaffenheit der Materie zu entschlüsseln. Heutzutage gilt die Theorie, dass die Materie aus kleinen Teilchen besteht, die sogenannten Atome. Das Wort Atom kommt aus dem Altgriechischen und wurde vom Philosophen Demokrit benutzt. Er hat gedacht, dass die Materie aus kleinen Teilen besteht (Atomismus), die nicht mehr teilbar sind. Das Wort Atom bedeutet auf Griechisch „nicht mehr zerschneidbar“. Um die gleichen Zeit haben die Inder die gleiche Idee gehabt und eine atomistische Theorie des Aufbaus der Materie entwickelt.
All diese Annahmen waren aber immer noch philosophische Theorien. Niemand hat versucht, sie mit Experimenten zu überprüfen. Die ersten empirischen Versuche (empirisch bedeutet hier: mit Hilfe von Experimenten) fanden nach dem Mittelalter statt.

Am Anfang hatten die Wissenschaftler nur grobe Werkzeuge. Antoine Lavoisier hat die Idee des chemischen Elements entwickelt, basierend auf seine Beobachtungen bei der Reaktionen zwischen verschiedenen Stoffen. John Dalton musste später wegen seiner Experimente annehmen, dass alle Atome eines Elements das gleiche Gewicht haben.
Je mehr die Wissenschaft sich entfaltet, desto genauer werden auch ihre Instrumente. Als Lavoisier, Dalton und andere Wissenschaftler ihre Atomhypothese entwickelten, haben andere Wissenschaftler das Mikroskop erfunden. Mit Hilfe des Mikroskops wurden mehrere Experimente durchführt und wurde festgestellt, dass die Materie aus Atomen besteht. Johann Loschmidt hat mit Hilfe einer Theorie über die Luft die Größe der Atome berechnet, Albert Einstein, Jean Perrin und andere Wissenschaftler haben mit Hilfe des Mikroskops diese Größe bestätigt.
Heutzutage gibt es Instrumente wie das Elektronenmikroskop. Ein Elektronenmikroskop funktioniert anders als ein gewöhnliches Mikroskop. Es benutzt sogenannte "Elektronen" statt Licht. Mit seiner Hilfe werden Atome genauer beobachtet. Allein für die Entwicklung eines solchen Geräts haben hunderte von Personen zusammengearbeitet. Wir können also verstehen, dass tausende von WissenschaftlerInnen, TechnikerInnen und ArbeiterInnen zum wissenschaftlichen Fortschritt und in diesem Fall zur Aufklärung der Struktur der Materie mitgewirkt haben.
Mit Hilfe von diesen und weiteren Instrumenten und Experimenten haben wir unsere Kenntnisse über die Struktur der Materie weiterentwickelt. Atome sind in der Tat für die meisten aber doch nicht für alle physikalischen Prozesse unteilbar. Es gibt noch kleinere Teilchen, das Atom hat daher eine eigene Struktur. Diese Teilchen gelten heutzutage als unteilbar, ob das so bleiben wird, können wir allerdings nicht wissen.
Die Atome und ihre Verbindungen[Bearbeiten]
Sprache oder vom Verständnis her sein

Nach der geltenden Theorie besteht die Natur aus kleinen Teilchen, den Atomen. Nicht alle Atome sind gleich. Es gibt Milliarden von Milliarden Atomen, man kann aber ungefähr 120 Atomsorten in der Natur finden. Man kann zwei Atome der gleichen Sorte grundsätzlich nicht voneinander unterscheiden. Diese Atomsorten nennt man chemischen Elemente. Atome können sich miteinander verbinden und die sogenannten Moleküle bilden. Ein Molekül besteht aus zwei oder mehreren Atomen (vielleicht sogar aus tausenden Atomen). Es gibt gewisse Regeln, wie die Atome sich miteinander verbinden, um Moleküle zu formen. Es gibt allerdings andere Formen von Atombindungen, wie die Metallbindung und die Ionenbindung. Diese Atombindungen bestehen in der Regel aus tausenden Atomen.
Für jedes chemisches Element gibt es ein Symbol. Manche bekannte chemische Elemente, also Atomsorten, und ihre Symbole sind: Wasserstoff (H), Sauerstoff (O), Stickstoff (N), Kohlenstoff (C), Helium (He), Eisen (Fe), Natrium (Na), Chlor (Cl), Kupfer (Cu), Calcium (Ca), Uran (U), Gold (Au), Neon (Ne). Manche bekannte Moleküle (und ihre Symbole) sind: Wasser (H2O), Zucker (C6H12O6, Glukose genannt), Kohlendioxid (CO2). Sehr bekannt ist auch das Kochsalz (NaCl), das ist aber eigentlich kein Molekül, sondern eine sogenannte Ionenbindung.

Ladungen
Atome können unter Bedingungen elektrisch geladen sein. Wie immer wieder in der Wissenschaft, sprechen wir über elektrische Ladungen, weil wir etwas in der Natur beobachten. Eine Beobachtung von elektrischen Ladungen finden z.B. statt, wenn wir einen Luftballon auf ein Stück Wolle reiben. Nach einer Weile können wir damit kleine Papierstücke oder die Haare sogar nach oben anziehen. Solche Ladungen können mehrere Atome zusammenhalten. Dadurch entstehen chemische Bindungen, also Moleküle. Die Atome können sich in vielen verschiedenen Wegen kombinieren. Daher gibt es unendlich viele unterschiedlichen Moleküle in der Natur, auch wenn die unterschiedlichen Atome nicht mehr als 120 sind.
Im Bild sehen wir etwas, dass als ein tatsächliches Bild einer Atombindung gelten könnte. Es wird ein sogenannter "Graphit Kristall" dargestellt. Graphit ist ein Stoff ausschließlich aus Kohlenstoff und kann beispielsweise bei Bleistiften benutzt werden, um zu schreiben. Das Bild wurde mit einem sogenannten Rastertunnelmikroskop aufgenommen. Das ist ein Gerät, das auch sehr kleine Sachen sozusagen "fotografieren" kann, sogar fast so klein wie ein Atom.
Chemische Reaktion[Bearbeiten]
Sprache oder vom Verständnis her sein



Die meisten Atomsorten sind unter der Bedingungen auf der Erdoberfläche nicht "stabil". Das bedeutet: Wenn die Temperatur und der Druck nicht sehr hoch sind, können die meisten Atomsorten nicht "allein bleiben". Sie "neigen" dazu, sich mit anderen Atomen zu verbinden. Die Atome in einer Verbindung können von der gleichen oder von einer anderen Atomsorte sein. So verbinden sich z. B. zwei Sauerstoffatome und bilden dadurch "molekularen" Sauerstoff (O2). Zwei Sauerstoff Atome können sich aber auch mit einem Kohlenstoffatom verbinden und dadurch Kohlendioxid (CO2) formen.
Moleküle sind zwar stabiler als Atome, sind aber selber nicht absolut stabil. Eine Änderung der Temperatur oder des Druckes, der Einfluss von anderen Molekülen und weitere Umstände können zu Änderungen der Moleküle führen. Unterschiedliche Moleküle können dann nach gewissen Regeln miteinander "chemisch" reagieren und neue Moleküle bilden. In einer chemische Reaktion nehmen ein oder mehrere Moleküle teil und wandeln sich zu anderen Molekülen. Energie wird benötigt oder freigelassen. Die Atome am Anfang der Reaktion sind aber genau die gleichen, wie am Ende der Reaktion. Zum Beispiel kann Wasserstoff mit Sauerstoff reagieren und dadurch entsteht Wasser:
2H2 + O2 → 2H2O
In dieser Reaktion wird Energie freigelassen (es brennt!). Wie man sieht, gibt es sowohl links als auch rechts der Reaktion nur Wasserstoff- und Sauerstoff-Atome und zwar in der gleichen Anzahl links und rechts (4 Atome Wasserstoff und 2 Atome Sauerstoff links und genau so viele rechts). Diese Reaktion kann z. B. in Gasschmelzschweißen oder bei Raketen benutzt werden.
Es gibt Millionen von Millionen unterschiedliche chemische Reaktionen. Hier ist noch ein etwas komplizierteres Beispiel:
Das ist die sogenannte "Zersetzung" der Essigsäure (CH3COOH) in "Methan" (CH4) und Kohlendioxid (CO2). Diese ist eine Reaktion, die Energie benötigt. Essigsäure ist der charakteristische Bestandteil des Essigs. Die Essigsäure ist ab ca. 17°C flüssig und kann in reiner Form beispielsweise Fleisch zersetzen (z. B. bei einer chemischen Verbrennung). Methan ist (wie auch Kohlendioxid) ein Gas und kann brennen. Methan ist unter anderem auch in Erdöl vorhanden. Wir sehen, das die Moleküle auf beiden Seiten der Reaktion völlig unterschiedliche Eigenschaften haben können. Die Atome auf beide Seiten der Reaktion sind allerdings genau die gleichen: Wir haben auf beide Seiten der Reaktion vier Wasserstoff, zwei Kohlenstoff und zwei Sauerstoffatome.
Definition des Atoms und des Moleküls[Bearbeiten]
Das Wort „Atom“ bedeutet auf Altgriechisch „nicht mehr zerschneidbar“. Tatsächlich gibt es in der Natur Teilchen, die man mit einem Messer nicht mehr schneiden kann. Diese sind allerdings in der Regel Moleküle. Die Moleküle bestehen selber aus Atomen. Die Atome sind kleiner als die Moleküle und sind tatsächlich mit einem Messer nicht mehr zerschneidbar.
Es gibt also zwei Arten von Teilchen, die nicht mehr mit einem Messer zerschneidbar sind, Atome und Moleküle.
- Die Atome sind die allerkleinsten Teilchen der Natur, die man nicht mit einem Messer schneiden kann. Sie bestehen nicht aus anderen ähnlichen Teilchen. Es gibt fast 120 verschiedene Sorten von Atomen, die sogenannten „chemische Elemente“. Sie sind die Bausteine der chemischen Verbindungen.
- Die Moleküle sind auch i.d.R. extrem kleine Teilchen und auch nicht mit einem Messer zerschneidbar. Sie bestehen allerdings aus anderen nicht zerschneidbaren Teilchen, nämlich den Atomen. Sie sind chemische Verbindungen, also feste Kombinationen von Atomen. Die Atome können sich in unendlich viele Wege kombinieren. Es kann daher unendlich viele unterschiedliche Moleküle geben.
Das Experiment von Rutherford[Bearbeiten]
Sprache oder vom Verständnis her sein

Am Anfang des 20. Jahrhunderts war die Struktur des Atoms noch nicht erforscht worden. Die vorherrschende Vorstellung war, dass die Masse und die positive Ladung gleichmäßig über das ganze Atom verteilt seien und die Elektronen darin wie Rosinen in einem Kuchen gleichmäßig verteilt wären, ein bisschen wie im Bild rechts oben. Der Wissenschaftler Ernest Rutherford hat ein Experiment geplant und durchgeführt, um diese Vorstellung zu überprüfen.
Um dieses Experiment zu verstehen, sollen wir erst ein einfacheres Experiment beschreiben. Stellen wir uns vor, dass irgendein Gegenstand auf einem Boden ohne Unregelmäßigkeiten liegt. Der Gegenstand ist allerdings unter einem undurchsichtige Platte versteckt. Wir wissen daher nicht, wie er aussieht. Um dies zu entdecken, können wir Murmeln benutzen. Wenn wir den Gegenstand auf dem Boden unterhalb der Platte mit den Murmeln "schießen", ändern diese ihre Bewegungsrichtung, je nachdem, ob sie den Gegenstand treffen und je nachdem welcher Form er hat. Wir können daher daraus schließen, wie groß der Gegenstand ist und welche Form er hat, ohne ihn überhaupt zu sehen.


In seinem Experiment hat Rutherford keine Murmel benutzt und es gab auch keine Platte. Er wollte die Atome beobachten. Diese sind sowieso so klein, dass sie nicht sichtbar sind, nicht mal mit dem stärksten Lichtmikroskop und damals gab es nichts anderes. Er hat also ein ganz dünnes Goldblatt benutzt und wollte die Atome in diesem Golblatt beobachten. Die Atome konnte er allerdings nicht mit Murmeln schießen. Murmeln sind weit zu groß dafür. Er müsste also etwas kleineres benutzen, zumindest in der Größe der Atome oder sogar kleiner.
Was Rutherford benutzt hat, war die sogenannte Alphastrahlung. Er wusste damals auch nicht, was diese Strahlung genau war. Er wusste nur, dass es etwas ganz klein war, das sich unglaublich schnell bewegte. Er wusste vielleicht, dass diese Strahlung Helium war und dass sie positiv geladen war. Später wurde entdeckt, dass es um Heliumkerne geht. Diese Heliumkerne stammten aus einer sogenannten "radioaktiven Quelle", genauer aus Radium Atome. Was Heliumkerne und Radium sind, ist sehr kompliziert und für das Verständnis des Experiments damals und hier nicht wichtig. Wir können uns einfach vorstellen, dass die Radium-Atome etwas wie ein Gewehr sind, die Heliumkerne etwas wie die Kugel, die das Gewehr schießt und das Goldblatt etwas wie ein Blatt Papier, das mit dem Gewehr geschossen wird.
Was wird erwartet, wenn ein Blatt Papier geschossen wird? Dass alle Kugel das Papier durchqueren und dass dadurch Löcher im Papierblatt entstehen. Rutherford und seine Kollegen waren von den Ergebnissen völlig verblüfft. Es gab absolut kein Loch und manche Kugel hatten ihre Richtung geändert! Manche wurden sogar fast völlig zurückgestoßen! Das war die absolute Überraschung.
Rutherford und seine Kollege haben das Experiment sehr geduldig wieder und wieder wiederholt und sind immer auf die gleichen Ergebnisse gekommen. Sie haben darüber ihre Köpfe zerbrochen und konnten am Ende ihre Beobachtungen nur durch die von ihnen vorgeschlagene Struktur des Atoms erklären (Rutherfordsches Atommodell).
Das Rutherfordsche Atommodell[Bearbeiten]

Ein Atom besteht aus einem relativ sehr kleinen Kern in der Mitte, der fast die ganze Masse des Atoms trägt, und die Atomhülle. Der Kern besteht aus positiv geladenen Protonen und neutralen Neutronen. In der "Atomhülle" um den Kern herum kreisen die negativ geladenen Elektronen. Man könnte sagen, dass der Raum des Atoms fast leer ist.[1]
Für ihre Bewegung brauchen die Elektronen viel mehr Platz als die Protonen und die Neutronen. Das Volumen des Atoms ist grob gesagt der Platz, wo sich in der Regel die Elektronen des Atoms bewegen. Die negative elektrische Ladung eines Elektrons gleicht allerdings die positive Ladung des Protons, auch wenn seine Masse so viel kleiner als die Masse des Protons ist. Ein Proton und ein Elektron zusammen gesehen besitzen so zu sagen null Ladung. Das Elektron dazu besitzt kaum oder kein Volumen. Seine Masse ist ca. 2000 mal als die des Protons und des Neutrons.
Wärmelehre[Bearbeiten]
Wärmeausdehnung und Anomalie des Wassers[Bearbeiten]
 |
|
|
In der Regel dehnen sich die Stoffe bei steigender Temperatur aus. Das kann bei technischen Konstruktionen zu Schaden führen, wie man im Bild sehen kann. In diesen Fällen hat man die Konstruktion bei einer niedrigeren Temperatur ohne Lücken zwischen den Baustoffen aufgebaut. Als die Temperatur am Ort höher wurde, haben sich die Stoffe ausgedehnt. Dadurch ist der Schaden (Bruch, Beugung) entstanden.
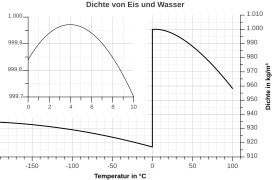
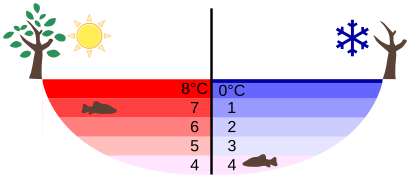
Wenn wir Wasser kochen, dehnt es sich auch aus. Wenn wir einen Topf bis am Rand voll mit Wasser erhitzen, wird Wasser bald überlaufen, bevor es zu kochen anfängt. Je wärmer das Wasser ist, desto mehr Volumen braucht es. Seine Dichte wird in diesem Fall dadurch kleiner. Wasser hat allerdings eine Besonderheit („Anomalie“ auf Griechisch).[2] Ab 4°C dehnt es sich wie die anderen Stoffe bei steigender Temperatur aus, wie schon beschrieben. Zwischen 0 und 4°C dehnt es sich aber bei fallender Temperatur aus. Wenn flüssiges Wasser bei 0°C Eis wird, dehnt es sich verhältnismäßig sehr stark aus. Das bedeutet, dass flüssiges Wasser bei 4°C seine größte Dichte und Eis immer eine kleinere Dichte als flüssiges Wasser hat. Das ist auch die Erklärung dafür, dass Eisberge schwimmen oder dass die Tiefe der Seen nur selten Eis wird. Aus diesem Grund können See- und Meeresorganismen im Winter im Wasser überleben. Wasser mit der größten Dichte (bei 4°C) ist flüssig und bleibt immer unterhalb vom kälteren Wasser und Eis. Die Organismen in den Seen erfrieren daher nicht.
Eis hat also eine kleinere Dichte und daher mehr Volumen als flüssiges Wasser mit der gleichen Masse. Das kann man im Alltag leicht feststellen. Wenn man eine geschlossene (Glas-)Flasche ganz voll mit Wasser in den Gefrierschrank stellt, wird die Flasche bald brechen. Das passiert, weil unter 4°C (und während das Wasser Eis wird) das Volumen des Wassers bei sinkender Temperatur mehr wird! Das Wasser in der Flasche dehnt sich aus und die Flasche bricht unter dem erhöhten inneren Druck.
- ↑ Andererseits könnte man auch sagen, dass der Raum voll ist, nämlich voll von mathematischen Wahrscheinlichkeitsgleichungen. Solche Gleichung werden in der Quantenmechanik beschrieben.
- ↑ „Anomalie“ bedeutet auf Griechisch Unregelmäßigkeit
Wärmetransport[Bearbeiten]
|
|
Wärmetransport:
|
In jeder Jahreszeit, können wir die Wärme der Sonne spüren, solang sie scheint und nicht von Wolken bedeckt wird. Die Sonnenstrahlung wärmt uns, auch wenn die Luft kalt ist und obwohl wir keinen direkten Kontakt zur Sonne haben. Die Sonnenstrahlung überträgt die Wärme der Sonne zu uns. Sie ist daher eine Art von Wärmestrahlung. Die Übertragung von Wärme ist eine Eigenschaft der elektromagnetischen Wellen. Eine relativ bekannte Art von Wärmestrahlung ist die Infrarotstrahlung (IR), die bei Wärmelampen, Mikrowellenherden und bei elektronischen Geräten angewandt wird. Die Wärmestrahlung ist die einzige Art von Wärmetransport, die sich in Vakuum ausbreitet. Wärmestrahlung ist also der Transport von Wärme aus der Ferne, auch in Vakuum, wie bei der Sonnenstrahlung.
Wenn wir andererseits ein Objekt anfassen, können wir spüren wie warm oder kalt es ist. Diese Form der Übertragung von Wärme, wenn zwei Körper in Berührung sind, wird „Wärmeleitung“ genannt. In diesem Fall bewegen sich die Teilchen des wärmeren Körpers schneller als die des kälteren. Durch Stöße werden dann die Teilchen des kälteren Körpers schneller (und des wärmeren langsamer). Der Transport von Wärme bei direktem Kontakt wird also Wärmeleitung genannt.
Wenn wir Wasser kochen, merken wir, dass das Wasser erst unten im Topf warm wird. Dieses warme Wasser hat eine kleinere Dichte und steigt daher auf. Dadurch wird das Wasser oben auch wärmer. Diese Art von Wärmetransport wird Wärmeströmung genannt. Sie kann bei sogenannten „Fluiden“ stattfinden, also bei Flüssigkeiten und Gasen. Wenn die Luft bspw. durch die Heizung wärmer wird, strömt sie nach oben und gleichzeitig kommt kältere Luft nach unten (wo sie dann von der Heizung durch Wärmeleitung auch aufgewärmt wird).
Wir haben also hier drei Formen des Wärmetransports (der Wärmeübertragung) erwähnt: die Wärmestrahlung, die Wärmeleitung und die Wärmeströmung.
Temperatur und Wärmeenergie[Bearbeiten]
Temperatur ist nicht gleich Wärme. Die Wärmeenergie eines physikalischen Körpers hängt von der Menge des Körpers ab, seine Temperatur allerdings nicht. 5000 Liter warmes Wasser können viel mehrere Personen als 2 Liter Wasser mit der gleichen Temperatur aufwärmen. Die Temperatur ist gleich, die Wärmeenergie nicht. Sowohl Temperatur als auch Wärmeenergie haben mit der mittleren Geschwindigkeit der Teilchen zu tun. Die Temperatur zeigt uns wie schnell sich die Teilchen in einem Stoff bewegen. Je schneller die Teilchen sind, desto höher ist die Temperatur.
Die Wärmeenergie eines Körpers ist, genau wie die Temperatur, mehr, wenn die mittlere Geschwindigkeit der Teilchen größer ist. Allerdings hängt sie auch mit der Menge der Teilchen zusammen. Die Wärmeenergie hängt dazu auch von der Zusammensetzung des Körpers ab, also von der Art der Teilchen in diesem Körper. Um die Wärmeenergie eines Körpers zu messen, wird daher seine Temperatur, seine Masse und seine Zusammensetzung benötigt.
|
| Elektronisches (digitales) Thermometer. Für seine Funktion werden Halbleiter benutzt. Bimetallisches Thermometer. Zwei Metallstreifen hier sind in einer Spirale zusammengeklebt. Ein Metall dehnt sich mit steigender Temperatur schneller als das andere aus. Dadurch ändert sich die Größe der Spirale und wird der Zeiger bewegt. Flüssigkeits- bzw. Quecksilberthermometer. Mit steigender Temperatur dehnt sich die Flüssigkeit (z. B. Quecksilber) im Glasrohr aus und steigt sie im Rohr auf. Bemerkung: Das Körperthermometer im Bild ("Quecksilber-Basalthermometer") hat eine kleinere Temperaturskala. Dadurch wird die Genauigkeit größer. |
Thermodynamisches Gleichgewicht[Bearbeiten]
Wenn das Kochherd sehr warm ist, dann spüren wir seine Wärme auch aus der Ferne. Wenn es aber kalt ist, dann spüren wir keine Wärme. Körper strahlen also desto mehr Wärmeenergie aus, je wärmer sie selbst sind. Diese Tatsache spielt beim sogenannten „thermodynamischen Gleichgewicht“ eine entscheidende Rolle.
Wenn Körper mehr Wärme aufnehmen als ausstrahlen, dann werden sie wärmer. Wenn sie mehr Wärme abgeben, dann werden sie kälter. Das thermodynamische Gleichgewicht entsteht, wenn ein Körper so viel Wärmeenergie ausstrahlt wie er aufnimmt. Dann wird die Temperatur des Körpers konstant bleiben.
Nehmen wir als Beispiel ein Zimmer im Winter, das geheizt wird. Wenn wir die Fenster weit offen lassen, dann wird es nicht viel wärmer. Das Zimmer verliert Wärme sowohl durch Wärmeströmung, als auch durch Wärmeleitung und Wärmestrahlung. Wenn wir die Fenster nur gekippt halten, dann wird der Verlust durch Wärmeströmung viel weniger. Dann wird das Zimmer etwas wärmer. Noch weniger Verlust findet statt, wenn wir die Fenster ganz zu machen. Dann wird das Zimmer noch wärmer. Wenn das Zimmer aber wärmer wird, verliert es mehr Wärmeenergie durch Wärmestrahlung, wie beim Beispiel mit dem Kochherd. Wenn die Fenster zu sind, verliert zwar das Zimmer weniger Energie durch Wärmeströmung, mehr aber durch Wärmestrahlung, genau weil es wärmer wird. Bleibt erreicht das Zimmer ein neues thermodynamisches Gleichgewicht, allerdings bei einer höheren Temperatur. Die Temperatur in diesem Zustand ist zwar höher, sie bleibt aber stabil. Das Zimmer wird nicht mehr wärmer, außer wenn wir dicke Vorhänge vor den Fenstern zuziehen. Dann wird die Temperatur noch mehr steigen, denn der Verlust durch Wärmestrahlung wird am Anfang mit den undurchsichtigen Vorhängen zu niedriger sein. Die Temperatur wird aber wieder nicht ewig steigen. Ein neues thermodynamisches Gleichgewicht wird bei einer noch höheren Temperatur erreicht. Ein thermodynamisches Gleichgewicht entsteht also, wenn ein Körper so viel Wärmeenergie aufnimmt wie er ausstrahlt. In diesem Fall bleibt die Temperatur des Körpers stabil.
Thermodynamisches Gleichgewicht und Treibhauseffekt[Bearbeiten]
Zwischen Erde und dem Weltall gibt es ein thermodynamisches Gleichgewicht. Die Erde nimmt von der Sonne Wärme auf und gibt dem Rest des Weltalls gleich so viel Wärme ab. Ohne Atmosphäre wäre die mittlere Temperatur auf der Erde ca. −18°C. Die Atmosphäre wirkt für die Erde, wie die Fenster für ein Zimmer. Genauso wie bei einem Zimmer, wenn die Fenster zu sind, verliert die Erde dank der Atmosphäre ihre Wärme langsamer. Dadurch wird die Erde wärmer. Andererseits verliert ein Objekt schneller Wärme, wenn es wärmer wird. Also bei einer höheren Temperatur wird die Erde genau so viel Wärme verlieren, wie sie bekommt. Dann entsteht wieder ein Gleichgewicht, allerdings bei einer höheren Temperatur. Das ist der sogenannte Treibhauseffekt. Mit den menschlichen Aktivitäten wird der Treibhauseffekt stärker. Das ist, als ob wir am Fenster eines Zimmers noch ganz dicke Vorhänge zuziehen. Das ist zwar für ein Zimmer im Winter gut, für das Überleben der Menschen aber sind zu hohen Temperaturen nicht geeignet. Eine grundsätzliche Änderung, was unseres Konsumverhalten und die Ausbeutung der Erde und anderer Menschen betrifft, ist notwendig, wenn wir länger auf unserem Planeten leben wollen.
Reibung[Bearbeiten]
Die Reibung ist eine Art von Kleben zwischen Oberflächen, das gegen das Gleiten wirkt. Wenn man eine Oberfläche mit einem starken Mikroskop beobachtet, sieht sie unregelmäßig aus. Auch Flächen, die mit bloßem Aug sehr glatt aussehen, wie ein Spiegel, sehen beim Mikroskop unregelmäßig aus, mit „Bergen“ und „Tälern“, etwa wie in unseren Bildern. Zwischen „Bergen“ einer Fläche und „Täler“ der anderen entstehen sogar Verbindungskräfte. Diese Tatsache führt dazu, dass eine externe Kraft notwendig ist, um das Gleiten eines Objektes erst einmal zu bewirken (Haftreibung). Eine Kraft ist auch notwendig, um einen Körper, der gleitet, auf Bewegung zu halten (Gleitreibung). Die Haftreibung ist also die Kraft, die gegen das Anfangen einer Bewegung wirkt, wenn wir einen Körper zu schieben versuchen. Die Haftreibung beschreibt also die Kraft bei einem bewegungslosen Objekt. Die Gleitreibung wirkt gegen das Gleiten des Objektes, also sie beschreibt die Kraft gegen die Bewegung, wenn ein Körper sich schon im Gleiten befindet.
Obwohl die Reibung als eine Kraft beschrieben wird, die gegen Bewegung (genauer: gegen das Gleiten) wirkt, ist sie für fast alle Bewegungen notwendig. Beispielsweise wären weder das Gehen noch das Rollen ohne Reibung möglich. Beim Rollen z.B. eines Fahrradrads gibt es erst einmal eine Haftreibung. Wenn diese zu niedrig ist, wie bei einer steilen Auffahrt bei relativ glatten Reifen, rollt das Rad „in der Luft“ und das Fahrrad bewegt sich nicht mehr vor- bzw. aufwärts. Die Rollreibung allerdings ist eine Kraft, die doch gegen das Rollen wirkt. Grob gesagt ist sie eine Art von „Kleben“ zwischen den Oberflächen, das das Rollen erschwert.

Die Reibung hängt von der senkrechten Kraft zwischen den Gleitflächen und von der Art der Oberflächen ab.
- Je stärker die Kraft ist, desto größer ist auch die Reibung. Wenn wir bei der Auffahrt mit dem Fahrrad mehr Gewicht auf das treibende Hinterrad stellen, dann sind die Chancen, dass dieses frei „spinnt“ geringer. Bei Rennautos benutzt man Spoilers, die diese Kraft erhöhen.
- Die Wirkung der Art der Oberflächen wird durch den sogenannten „Reibungskoeffizienten“ beschrieben. Dieser hat keine Einheiten (ist eine „Dimensionslose“ Zahl) und ist größer für die Haftreibung und kleiner für die Rollreibung.

Durch die Reibung entsteht Wärme. Das nutzen wir Menschen jedes mal aus, wenn es uns kalt wird. Dann reiben wir z.B. die Handflächen gegeneinander, um dadurch Wärme zu erzeugen. Bei vielen Tätigkeiten allerdings ist die Reibung und die dadurch entstehende Wärme nicht erwünscht, wie z.B. beim Kugellager eines Fahrrads. Wenn weniger Reibung erwünscht ist, benutzt man Schmier- bzw. Gleitmittel.
Das entsprechende der Reibung bei Bewegungen in Fluiden (also Gase und Flüssigkeiten) ist der Luftwiderstand und die Viskosität. Die Rolle des Luftwiderstands wird klar, wenn der Fall eines Blatts Papier und eines zusammengeknüllten Blatts Papier verglichen werden. Die Viskosität hat damit zu tun, wie „dickflüssig“ ein Fluid ist. Öl ist dickflüssiger als Wasser und daher ist das Fließen von Öl schwieriger als das Fließen von Wasser.