Medizinische Mikrobiologie: Gramnegative Kokken
Anaerobe Gram-negative Kokken
[Bearbeiten]Veillonella parvula
[Bearbeiten]Veillonella parvula sind anaerobe, Gram-negative Kokken, die zur Normalflora der Schleimhäute gehören.
Krankheitsbilder: Die Anaerobier können an Infektionen im Mund-Kiefer- und Genital-Becken-Bereich beteiligt sein.
Diagnostik: Prolongierte anaerobe Kultur.
Therapie: Clindamycin, Alternativen sind Metronidazol und Penicillin G.
Aerobe Gram-negative Kokken
[Bearbeiten]Neisseria gonorrhoeae (Gonokokken)
[Bearbeiten]Morphologie und Eigenschaften: Neisseria gonorrhoeae (syn. Gonokokken) sind Gram-negative, Semmel- oder Kaffeebohnenförmige, unbewegliche, strikt aerobe, Katalase- und Oxidase-positive Diplokokken. Sie sind gegenüber Umwelteinflüssen, insbesondere gegen Austrocknung sehr empfindlich. Im Gegensatz zu Neisseria meningitidis fehlt ihnen eine echte Kapsel. Die Membran der Gonokokken enthält jedoch sog. Lipooligosaccharide (LOS), von denen bestimmte Unterformen Sialinsäure binden können und damit eine kapselartige Struktur aufbauen, die die Antigenität, Serumresistenz und das extrazelluläre Überleben im Wirt ermöglicht. Auf Kochblut bilden Neisserien weißliche Kolonien.
Epidemiologie: Gonokokken sind weltweit verbreitet. Erregerreservoir ist ausschließlich der Mensch, der Infektionsgipfel liegt im jungen Erwachsenenalter. Die Inzidenz beträgt etwa 10/100.000, da die Infektion jedoch vor allem bei Frauen asymptomatisch bzw. uncharakteristisch verlaufen kann, muß von einer hohen Dunkelziffer ausgegangen werden. In Ländern mit schlechter Gesundheitsversorgung findet sich eine hohe Infektionsrate, weltweit wird von 25 Millionen Erkrankungen ausgegangen. Die Gonorrhoe ist neben der Infektion durch Chlamydia trachomatis die weltweit häufigste Geschlechtskrankheit.
Pathogenitäts- und Virulenzfaktoren:
- Lipoligosaccharide (LOS) auf der Bakterienoberfläche wirken schädigend auf die Epithelzelle, bedingen die Antigentät und bilden durch Bindung von Sialinsäure kapselartige Strukturen, die die Komplementwirkung hemmen. Im einzelnen bindet Sialinsäure (N-Acetyl-Neuraminsäure) Protein H, degradiert C3b und entgeht dadurch dem Tod durch den Komplement-MAK.
- Gonokokken besitzen außerdem aus dem sog. Pillin aufgebaute Pili für das Attachement an das Schleimhautepithel. Die Pili sind ebenfalls Antigen-variabel.
- Antigene Variation (Antigen-Shift) - Der direkte Kontakt mit den Wirtszellen erfolgt über sog. OPA-Proteine (OPA = opacity, da sie die Kolonien trübe erscheinen lassen). Gonokokken besitzen verschiedene OPA-Proteine im Genom, die meist nicht gleichzeitig exprimiert werden. Der Typ an exprimiertem OPA-Protein ist für den Organotropismus des Keimes ursächlich. Diese binden an CD66, Heparansulfat-Proteoglykan-Rezeptoren und CGM1 auf Fibroblasten, Epithelzellen und Makrophagen. Außerdem induzieren die OPA-Proteine die Phagozytose. Jedes OPA-Gen hat mehrere sich wiederholende Sequenzen (repeats) aus 5 Nucleotiden. Diese werden regelmäßig herausgeschnitten oder dupliziert, wodurch sich der reading-frame ändert und neue Varianten der OPA-Proteine entstehen. Stop-Codons entscheiden darüber, ob das Opaque-Antigen exprimiert wird oder nicht. Diesen Mechanismus nennt man Antigen-Shift, und er ist bei Neisserien sehr ausgeprägt.


- Da für Gonokokken die Eisenzufuhr essentiell ist, finden sich auf ihrer Oberfläche Transporter für Transferrin und Lactoferrin.
- Außerdem bilden Gonokokken eine sog. IgA1-Protease, welche sekretorische IgA-Antikörper spaltet.
- Gonokokken-Stämme bilden z.T. Penicillinase, meist Plasmid-kodiert.
Krankheitsbilder:
- Gonorrhoe (syn. Tripper): Die Gonorrhoe verläuft beim Mann meist als schmerzhafte und eitrige Urethritis. Steigt die Erkrankung auf, so kann es zur gonorrhoischen Prostatitis und Epididymitis kommen. Die Symptome können nach Wochen wieder verschwinden. In 10% bleibt die Infektion beim Mann asymptomatisch. Bei Frauen verläuft der Großteil der Infektionen ohne wesentliche Symptome. Bei den übrigen Patientinnen finden sich Ausfluss (Endozervizitis), schmerzhafte Miktionen und eitrige Sekretionen aus der Urethra. Steigt die Infektion auf, so können sich Endometritis, Adnexitis mit Sterilität, Tuboovarialabszesse und eine sog. pelvic inflammatory disease (PID) bzw. Peritonitis entwickeln. Außerdem kann es zur Infektion der Frucht und der Fruchtblase kommen (Chorionamnionitis) mit dem Risiko eines Abortes. Häufig liegen Koinfektionen vor z.B. mit C. trachomatis, Ureaplasmen, Mykoplasmen, Lues, Hiv oder H. ducreyi.
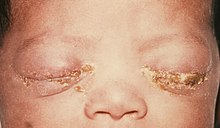
- Gonoblennorrhoe: Die eitrige Keratokonjunktivitis des Neugeborenen entsteht durch die perinatale Infektion unter der Geburt mit der Gefahr der Perforation und Erblindung. Daher wird seit dem 19. Jahrhundert die sog. Credé-Prophylaxe mit Silbernitrat bzw. heutzutage Erythromycin durchgeführt.
- Außerdem können Gonokokken die Konjunktiven, den Pharynx und den Mastdarm infizieren.
- Disseminierte Gonokokkeninfektionen sind möglich, z.B. Hautexantheme, eitrige Arthritis, selten Endokarditis, Pneumonie oder Meningitis.
Infektionsweg: Sexuell. Neugeborene infizieren sich unter der Geburt.
Inkubationszeit: Die Inkubationszeit beträgt beim Mann zwischen zwei und fünf Tagen, bei der Frau bis zu drei Wochen.
Pathogenese: Gonokokken heften sich über Pili an die Schleimhautzellen der Harnröhre bzw. des Cervix uteri an. Einige Gonokokken induzieren durch die Opa-Proteine eine Endozytose an Schleimhautzellen und werden auf der Lumen-abgewandten Seite wieder ausgeworfen (Transzytose). Die Erreger werden von Granulozyten phagozytiert und können meist auch abgetötet werden. Nur ein Teil der Bakterien überlebt intrazellulär. Die Gewebsschädigung erfolgt durch Induktion einer eitrigen Entzündung und Komplementaktivierung und dadurch bedingter Zerstörung des befallenen Epithels. Dabei scheint v.a. das Lipooligosaccharid der Bakterienzellwand eine Rolle zu spielen.
Diagnostik: Der Nachweis einer Gonokokkeninfektion wird meist mikroskopisch gestellt. Zur Sicherung der Diagnose erfolgt eine Erreger-Anzucht auf Selektivnährböden, z.B. Thayer-Martin-Medium. Da die Erreger sehr empfindlich gegen Austrocknen sind, müssen die Kulturmedien unmittelbar beimpft werden. Bei Frauen kann die Mikroskopie eines Cervix-Abstrichs negativ ausfallen, da sich die Erreger tief in den Krypten aufhalten können.
Therapie:
- Die Therapie erfolgt wegen Penicillin/Tetrazyklin-Resistenzen mit Fluorchinolonen bzw. Cephalosporinen parenteral 3a oder oral 2. Generation.
- Koinfektionen müssen mitbehandelt werden. Bei Chlamydien wird zusätzlich Doxycyclin eingesetzt.
- Wichtig ist die Mitbehandlung des Partners, um Kreuzinfektionen auszuschließen (Ping-Pong-Effekt).
Eine Meldepflicht besteht nicht.
Prophylaxe: Ein Impfstoff ist wegen der hohen Variabilität der Opa- und Pillin-Proteine nicht verfügbar. Credéprophylaxe mit Erythromycin bei allen Neugeborenen.
Historisches: Albert Neisser entdeckte die Gonokokken im Jahre 1879 im Urethralabstrich eines Patienten. Carl Siegmund Franz Credé führte 1881 die nach ihm benannte Credé-Prophylaxe ein. Ernst Bumm gelang 1885 erstmals die Anzucht von Gonokokken.
Weblinks: RKI - Gonorrhoe
Neisseria meningitidis (Meningokokken)
[Bearbeiten]| Neisseria meningitidis | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||
|

Morphologie und Eigenschaften: Meningokokken (Neisseria meningitidis) sind wie Gonokokken auch Gram-negative, Semmel- oder Kaffeebohnenförmige, unbewegliche, strikt aerobe, Katalase- und Oxidase-positive Diplokokken. Zusätzlich tragen sie eine Kapsel. Auf Kochblut bilden Neisserien weißliche Kolonien.
Epidemiologie: Etwa 10% der europäischen Bevölkerung tragen die Bakterien asymptomatisch im Nasenrachenraum. In Deutschland erkranken jedes Jahr etwa 700 bis 800 Menschen. Einige Fälle werden von Reisenden aus dem europäischen Ausland eingeschleppt. 40% aller Patienten sind Kinder unter vier Jahren, mit Abstand am häufigsten sind Säuglinge im ersten Lebensjahr betroffen. Auch heute noch sterben etwa 10% der Patienten.
Aufgrund des Kapsel-Oligosaccharidmusters werden 13 verschiedene Typen unterschieden, von denen nur 5 humanpathogen sind: Typ A, B, C, W135 und Y. In Deutschland werden etwa 70% der Erkrankungsfälle durch den Serotyp B verursacht, auf Typ C entfallen 20 bis 25%. Der in Deutschland vorherrschende Typ B besitzt eine identische Struktur wie das neurale Zelladhäsionsmolekül N-CAM (Kreuzantigenität), daher gibt es gegen diesen Serotyp keinen Impfstoff. In Entwicklungsländern herrscht Typ A vor.
Impfstoffe gibt es gegen den Typ C, der beispielsweise in England, Spanien oder auch in einigen Regionen Deutschlands gehäuft auftritt, und gegen die Typen A, Y und W135. Von Dezember bis Juni kommen Meningokokken-Epidemien verstärkt im afrikanischen "Meningitisgürtel" südlich der Sahara vom Sudan bis nach Gambia vor. Von November bis Mai treten sie auch gehäuft in Indien, vor allem Nordindien, und Nepal auf. Grundsätzlich kann jedes Land mit schwierigen Hygiene-Verhältnissen als mögliches Meningitis-Gebiet angesehen werden. Hier werden im Allgemeinen Erkrankungen mit Gruppe A oder C gesehen.
Übertragung: Tröpfcheninfektion von Mensch zu Mensch. Die Meningokokken heften sich mit Hilfe ihrer Pili an die Mucosa des Nasenrachenraumes, wo sie wochen- oder monatelang verbleiben können.
Pathogenitäts- und Virulenzfaktoren:
- Ähnlich wie bei Gonokokken:
- Pili
- LOS
- OPA-Proteine
- IgA-Protease
- Zusätzlich besitzen Meningokokken eine Kapsel, von denen die 5 Kapseltypen A, B, C, W135 und Y humanpathogen sind.
- Der Kapseltyp B besitzt eine identische Struktur wie N-CAM (cell adhesion molecule) -> „molecular mimicry“, Immuntoleranz, keine Impfung möglich.
Krankheitsbilder: Das Spektrum der Erkrankung reicht von leichten Verläufen mit spontaner Abheilung bis hin zu einem hochakuten Ausbruch, der trotz Behandlung in wenigen Stunden zum Tod führt. Die Meningitis beginnt mit starkem Krankheitsgefühl wie Abgeschlagenheit, hohem Fieber, Erbrechen, Schüttelfrost, Gelenk- und Muskelschmerzen, Krämpfen oder Bewusstseinsstörungen. Unscheinbare petechiale Blutungen können in der Frühphase wegweisend sein und sollten keinesfalls übersehen werden. Als typisches Zeichen einer schweren Hirnhautentzündung tritt die Nackensteifigkeit auf, die sich im Extremfall zum "Kissenbohren" auswächst: Wenn der Patient liegt, zeigt sich ein überstrecktes Hohlkreuz und der Kopf drückt sich in das Kissen. Bei Säuglingen kann neben dem fast immer auftretenden Fieber die Symptomatik zunächst sehr unspezifisch sein: Apathie oder Unruhe, Nahrungsverweigerung und Berührungsempfindlichkeit. Trotz Behandlung drohen Komplikationen und Spätfolgen wie Hörverlust oder Krampfleiden, jeder zehnte Patient stirbt.
Neben der Mengitis können eine Meningokokkensepis oder ein Waterhouse-Friderichsen-Syndrom (massive subkutane und innere Blutungen sowie Nekrosen) einen oft tödlichen Krankheitsverlauf herbeiführen.
Diagnostik: Klinische Diagnose: Meningismus (Photophobie, Kopfschmerzen, Übelkeit, Nackensteifigkeit), petechiale Blutungen u.a. Mit folgenden einfachen Tests läßt sich ein Meningismus nachweisen (Prinzip: Zug an den entzündeten Hirnrückenmarkshäuten löst Schmerzen aus.):
- Brudzinski-Zeichen: Ein Beugen des Kopfes führt zum reflektorischen Beugen/Anziehen der Knie.
- Kernig-Zeichen: Die Beugung im Hüftgelenk bei gestreckten Knien führt zum Anziehen der Knie.
- Laségue-Zeichen: Die Beugung im Hüftgelenk auf 70 bis 80° bei gestreckten Knien ist wegen Schmerzen nicht möglich.
Diagnostische Liquorpunktion zum Erregernachweis (nach Ausschluss Hirndruck), zusätzlich bei Meningitis immer Blutkultur und Rachenabstrich! Da Neisserien empfindlich sind, sollten sie rasch untersucht werden (Warmtransport).
Therapie:
- Die Meningitis ist ein infektiologischer Notfall. Daher sollte frühstmöglich eine kalkulierte Antibiotikatherapie mit parenteralen Cephalosporinen 3a, alternativ mit Flourchinolonen begonnen werden, auch wenn dadurch ein Erregernachweis unmöglich wird. Die diagnostische Liquorpunktion (nach cCT zum Hirndruckausschluss!) hat in diesem Fall die geringere Priorität. Bei sensiblen Meningokokken kann Penicillin G eingesetzt werden, allerdings nehmen hier die Resistenzen zu.
- Isolierung: Krankheitsverdächtige und Erkrankte müssen bis 24h nach Einleitung einer wirksamen Therapie isoliert werden. Kontaktpersonen ist eine Chemoprophylaxe zu empfehlen (Rifampicin, alternativ: Ciprofloxazin, Ceftriaxon).
Prophylaxe:
Es stehen drei aktive Impfstoffe zur Verfügung. Sie enthalten im Wesentlichen gereinigte Saccharidbruchstücke von Neisseria meningitidis. Der Polysaccharid-Impfstoff richtet sich gegen die Gruppen A und C (AC-Impfstoff), ein weiterer gegen die Gruppen A, C, W 135 und Y (ACWY-Impfstoff, beide schützen am besten ab einem Alter von zwei Jahren. Mit den neuen Konjugat-Impfstoffen können auch Kinder ab einem Alter von zwei Monaten gegen Meningokokken C geschützt werden. Beide Polysaccharid-Impfstoffe werden unter die Haut gespritzt. Der Impfschutz hält mindestens drei Jahre. Für Erwachsene und Kinder genügt eine einmalige Injektion. Der AC-Impfstoff kann ab einem Alter von 18 Monaten eingesetzt werden. Der ACWY-Impfstoff ist ab zwei Jahren wirksam. Bei jüngeren Kindern ist ein Schutz gegen die Gruppen C, W 135 und Y nicht gesichert und der Impfschutz hält höchstens zwei Jahre an. Um einen besseren Impfschutz zu erreichen, können Kinder unter zwei Jahren im Abstand von drei Monaten auch ein zweites Mal geimpft werden. Die Schutzwirkung der Impfung setzt etwa nach zwei Wochen ein. Bei bestehendem Infektionsrisiko ist nach drei Jahren eine Auffrischimpfung ratsam. Speziell für Kinder im Alter zwischen zwei Monaten und zwei Jahren sind C-Konjugat-Impfstoffe entwickelt worden. Sie können bei Bedarf aber auch bei älteren Kindern, Jugendlichen oder Erwachsenen eingesetzt werden. Sie schützen vor Infektionen des Meningokokken-Typs C, der in Deutschland etwa jede fünfte Erkrankung verursacht. Die Impfung mit dem Konjugatimpfstoff kann bei Bedarf ab dem dritten Lebensjahr mit einem Polysaccharidimpfstoff ergänzt werden. Die Meningokokken-Impfung kann meistens gleichzeitig mit anderen Schutzimpfungen vorgenommen werden. Zeitabstände zu anderen Impfungen sind nicht einzuhalten. Die Impfung wird allen Personen mit erhöhtem Infektionsrisiko empfohlen. Besonders gefährdet sind zum Beispiel Personen mit Immundefekten oder fehlender beziehungsweise funktionsuntüchtiger Milz. Auch Reisende in Gebiete, in denen Meningokokken-Infektionen häufig auftreten, tragen ein erhöhtes Infektionsrisiko, wenn sie sich dort länger aufhalten oder engen Kontakt zur Bevölkerung haben. Schüler und Studenten mit einem längeren Aufenthalt in Ländern wie England, Irland oder Spanien, in denen die Impfung gegen Meningokokken C allgemein oder gezielt für diese Altersgruppe empfohlen wird, sollten ebenfalls geimpft werden. Im Bundesland Sachsen gelten nach der dortigen Impfkommission (SIKO) ab Juli 2003 zusätzliche Empfehlungen für die Impfung mit konjugierten Meningokokken-C-Impfstoffen, danach sollten folgende Personengruppen geimpft werden:
- Alle Kinder ab dem 3. Lebensmonat und Jugendliche bis zum vollendeten 18. Lebensjahr (Kosten werden zurzeit nicht von den Krankenkassen übernommen)
- Enge Kontaktpersonen zu einem Kranken mit invasiver Meningokokken-C- Infektion, parallel zur Chemoprophylaxe mit Antibiotika.
Saudi-Arabien verlangt während der Mekka-Wallfahrten von Pilgern und Besuchern eine Impfbescheinigung, die maximal drei Jahre und minimal zehn Tage vor dem Eintreffen in Saudi-Arabien ausgestellt worden sein darf. Pflicht ist der Vierfach-Impfstoff A,C,W135,Y. Pilger, die aus Endemiegebieten einreisen, werden untersucht und bei Verdacht auf Meningitis beobachtet. Alle anderen Reisenden müssen nicht geimpft sein. Hinweis: Nur gegen die jeweils genannten Serogruppen wird ein Schutz aufgebaut. Die Impfungen bieten keinen Schutz gegen die in Mitteleuropa und Brasilien häufiger vorkommende Meningitis durch Meningokokken der Gruppe B.
Weblinks: RKI - Meningokokken-Erkrankungen
Moraxella catarrhalis
[Bearbeiten]| Moraxella catarrhalis | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | |||||||||||||||
|
Morphologie und Eigenschaften: Moraxella catarrhalis sind Gram-negative, aerobe, Oxidase-positive Diplokokken.
Vorkommen: Die Bakterien kommen als Kolonisationskeime vor allem im Kleinkindalter vor.
Krankheitsbilder: Respiratorische Infekte Bronchitis, Sinusitis, Otitis media, Laryngitis und bei vorbestehehender Lungenerkrankung Bronchopneumonien.
Therapie: "watchful waiting", die Erreger sind häufig β-Lactamase-positiv, sprechen aber i.d.R. auf Amoxicillin plus βLI, Makrolide und Cotrimoxazol an.

