Medizinische Mikrobiologie: Protozoen
Flagellaten
[Bearbeiten]Giardia lamblia
[Bearbeiten]Giardia lamblia syn. intestinalis ist ein einzelliger humanpathogener Parasit. Benannt wurde er nach Alfred Mathieu Giard und Vilem Dusan Lambl. Der Einzeller gelangt üblicherweise als Zyste in kontaminiertem Oberflächenwasser, oder seltener über Kontakte mit Fliegen in den menschlichen Darm. Giardia lamblia ist ein urtümlicher Einzeller, dessen Evolution unter Biologen noch viele offene Fragen aufwirft.
Morphologie und Eigenschaften: Giardia besitzt vier Geißeln, zwei davon entspringen inmitten der Zelle, zwei weitere seitlich. Seine Länge beträgt um die 20μm, außerdem besitzt es eine Haftscheibe, um sich im Darmepithel festzuhalten.
Besondere Merkmale von Giardia lamblia:
- Das Protozoon besitzt keine Mitochondrien und auch keine Peroxisomen, aber Erbgut, das Mitochondriengene enthält. Im Laufe der Evolution hat Giardia ihre Mitochondrien wieder verloren, so die gängige Hypothese.
- Das Genom ist sehr variabel. Es enthält 12 bis etwa 80 Millionen Basenpaare, die auf 8 bis 50 Chromosomen verteilt sind.
- Sexuelle Reifeteilung (Meiose) wird bei dem Urtierchen nie beobachtet, es wurden aber für diesen Prozess zuständige Gene gefunden.
- Im Jejunum liegen nur Trophozoiten vor, im Ileum nur noch Cysten. Fehlendes Cholesterin ist dafür verantwortlich, dass die Trophozoitenoberfläche nicht mehr gebildet werden kann. Dies führt zur sogenannten Encystierung.
Lebenszyklus: Trophozoiten sind die aktive Form des Einzellers im Darm und nur sie pflanzen sich fort. Sie haben eine ovale, langgestreckte Form und in jedem Individuum findet man zwei Zellkerne. Auffallend sind auch mehrere Geißeln und die Haftscheibe, mit der sie sich an das Darmepithel anheften können. Cysten sind die Übertragungsformen und sehr resistent gegenüber Umwelteinflüssen. Sie werden von infizierten Menschen ausgeschieden und können bis zu vier Monate lang im Oberflächenwasser überleben. Im Darm wandeln sich diese wieder in Trophozoiten um.
Krankheitsbild: Im Gegensatz zu Entamoeba histolytica ist Giardia lamblia nicht invasiv, die Schleimhautzellen werden nicht zerstört. Es kommt aber zu einer Einschränkung ihrer Funktion und zu einer Entzündung. Die Symptome einer Giardiasis (Lamblienruhr) sind Durchfall, Blähungen und selten Fieber, in schweren Fällen kommt es zum Malabsorptionssyndrom. In Kanada findet sich die landläufige Bezeichnung Biberfieber (beaver fever), da die Erreger vermeintlich durch Biberkot in das Wasser gelangen.
Ein Problem sind asymptomatische Träger. Diese scheiden unbemerkt monatelang Zysten aus, die bei unzureichender Hygiene andere Personen infizieren können. Das Immunsystem eliminiert die Trophozoiten normalerweise innerhalb weniger Wochen. Die Inkubationszeit beträgt eine bis etwa zehn Wochen.

Epidemiologie: Jedes Jahr erkranken rund 200 Millionen Menschen an Giardiasis und die Krankheit kann in Entwicklungsländern ein bedeutendes Problem darstellen. Die Zahl der Todesfälle, die auf Giardia lamblia zurückzuführen sind, ist jedoch, etwa im Vergleich zu der von Malaria, völlig unbedeutend.
Gardia lamblia wurde bisher in über 140 Ländern gefunden und ist somit weltweit verbreitet. In gemäßigten Zonen sind bis zu 25% der Kinder und 10% der erwachsenen Bevölkerung von ihr befallen. Noch höhere Durchseuchung findet man in den Tropen. In europäischen Ländern führt der Einzeller sehr selten zu Infektionen, aber unter Rückkehrern aus den Tropen beträgt die Prävalenz etwa 4%. Rinder und Schafe sind aber je nach Gegend bis zu 30% infiziert.
Therapie: Zur Behandlung eignet sich Metronidazol, Tinidazol oder Albendazol per os.
Prophylaxe: Trinkwasserhygiene, Händewaschen.
Meldepflicht: In Deutschland besteht eine Meldepflicht bei Infektion durch G. lamblia, nicht jedoch in Österreich und der Schweiz.
Literatur und Weblinks:
Trichomonas vaginalis
[Bearbeiten]| Trichomonas vaginalis | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||
|
Trichomonas vaginalis ist ein parasitisch im Urogenitaltrakt des Menschen lebendes Protozoon und Auslöser der Trichomoniasis.

Verbreitung und Übertragung: Der Parasit wird nur durch direkten Kontakt übertragen (Schleimhautkontakt von Mensch zu Mensch). Der Befall gilt daher als echte Geschlechtskrankheit. Trichomonas vaginalis kommt weltweit vor.
Morphologie und Eigenschaften: Trichomonas vaginalis ist unregelmäßig oval und verformbar. Die Länge beträgt bis zu 25µm. Eine Vermehrung findet durch Längsteilung statt. Der Erreger lebt u.a. von Lactobazillen.
Genom: Das Genom von T. vaginalis ist mit 160 Megabasen und 26.000 Genen außerordentlich groß. Der Erreger hat auf seinem evolutionären Weg vom Darm in den Urogenitaltrakt zahlreiche bakterielle Gene akquiriert und sein genetisches Material zusätzlich durch Amplifikationen stark vergrößert. Der Benefit bestand offensichtlich in einer Zunahme der Körpergröße und damit einer Zunahme der Haftfläche an der Schleimhaut.[1]
Lebenszyklus: Trichomonas vaginalis bilden keine Cysten oder Trophozoiten aus und wird nur direkt von Wirt zu Wirt übertragen.
Krankheitsbild: Bei den meisten Männern ist der Befall symptomlos. Vor allem nisten sich Trichomonaden in der Prostata, der Harnröhre und unter der Vorhaut ein. Gelegentlich kommt es zu einer schmerzhaften Urethritis. Selten werden die Samenblasen oder die Prostata befallen. Da bei Männern selten Symptome auftreten, wissen sie nichts von der Infektion und sind hauptsächliche Überträger der Parasiten. Trichomonaden sind außerhalb ihres Lebensraumes nicht lange lebensfähig.

Bei etwa 80 % der Frauen kommt es nach einer längeren Phase ohne Symptome ebenfalls zu Entzündungen in Form einer Trichomonadenkolpitis mit dünnflüssigem, gelblichem Fluor vaginalis, in dem sich neben den Trichomonaden auch Bakterien und Granulozyten finden. Bei Dreiviertel der Patienten ist die Harnröhre befallen. Dagegen sind Infektionen der Gebärmutter und der Harnblase selten. Auch zeitweilige Unfruchtbarkeit wurde beobachtet.
Ist eine Frau mit Trichomonaden infiziert, so erhöht sich ihr Risiko um etwa 50%, sich beim Geschlechtsverkehr mit HIV-1 zu infizieren (RR 1,52; 95%-CI 1,04–2,24). Ein Grund könnten vermehrte Schleimhautläsionen sein. [2]
Diagnostik: Mikroskopischer Nachweis von Trichomonaden im Vaginalabstrich.
Therapie: Metronidazol oder Tinidazol
Prophylaxe: Kondome
Weblinks: . “Trichomonaden-Genom sequenziert – Evolutionäre Herkunft aus dem Darm”. Deutsches Ärzteblatt, 15. Jan 2007.
Leishmania sp.
[Bearbeiten]| Leishmanien | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||
|
Leishmania sp. sind geißeltragenden Protozoen, die als obligat intrazelluläre Parasiten leben und einen Wirtswechsel zwischen Insekten (Phlebotomus sp.: Sandmücken, Schmetterlingsmücken) und Wirbeltieren (Schafe, Hunde, Menschen) vollziehen. Sie verursachen das Krankheitsbild der Leishmaniose.
Verbreitung: Leishmanien sind bis auf Australien auf der ganzen Welt verbreitet und gelten als Auslöser vieler Tierseuchen. Der Mensch wird von weniger Arten befallen, deren Verbreitungsgebiet in den Tropen liegt, besonders im östliche Afrika, aber auch im Mittelmeerraum.

Morphologie und Eigenschaften: Wie alle Flagellaten ändern Leishmanien ihre Form und die Position der Geißel je nach Wirt und Entwicklungsstadium (Nomenklatur wie bei Trypanosomen). Jedoch sind die Leishmanien im Durchschnitt etwas kleiner (Promastigot: 20µm, Amastigot: 2µm).
| Form | Position der Geißel |
|---|---|
| trypomastigot | hinter dem Kern |
| epimastigot | vor dem Kern |
| promastigot | vorderer Zellpol |
| amastigot | Geißel (fast) unsichtbar |
Lebenszyklus: Die Vermehrung der Leishmanien läuft in zwei Wirten ab. Die Sandmücke überträgt beim Stich promastigote Formen auf Wirbeltiere, wo sie von Makrophagen phagozytiert werden und sich in die amastigote (unbegeißelte) Form umwandeln. Die amastigoten Formen vermehren sich durch Teilung und werden nach der Zerstörung der Wirtszelle freigesetzt und können weitere Zellen befallen. Nimmt eine Sandmücke (Phlebotomus sp.) den Erreger aus dem Gewebe oder dem Blut auf, ist der Kreislauf geschlossen.
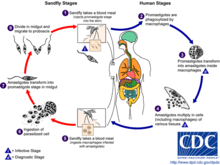
Im Mückendarm wandeln sich die Leishmanien wieder zur promastigoten Form um. Diese wandert über eine abermals amastigote Form im Darmepithel nun in die Speicheldrüse der Mücke und eine Infektion kann erneut erfolgen.

Krankheitsbilder: Bei den Krankheiten, die von Leishmania hervorgerufen werden (Leishmaniosen), unterscheidet man zwischen cutanen Formen ("Orientbeule") und viszeralen Formen ("Kala Azar"). Bei der Orientbeule siedeln sich die Leishmanien bevorzugt in Makrophagen unter und im Hautgewebe an. Diese verläuft meist nicht tödlich. Wenn sie jedoch in bestimmte Organe eindringen und dort Makrophagen befallen kann es zu Hepatosplenomegalie-Symptomen kommen, die meist tödlich verlaufen. Formen der Leishmaniose:

Viszerale Leishmaniose (Kala Azar)
Erreger: L. donovani, in Europa L. infantum Bei der viszeralen Leishmaniose (auch bekannt als Dum-Dum-Fieber oder Kala-Azar) werden die inneren Organe befallen. 1977 wurde in Indien (Nordbihar) eine große Epidemie mit ca. 70.000 erkrankten Personen beobachtet. Der Begriff Kala-Azar stammt aus dem Hindi und bedeutet "Schwarze Haut". Die viszerale Leishmaniose ist allerdings nicht auf Indien und China beschränkt. Sie tritt auch in Europa, z. B. im Mittelmeerraum, von Portugal bis in die Türkei auf und ist auch in Südamerika, dort besonders in Brasilien vertreten. Ohne Therapie enden ca. 3 % der Krankheitsfälle tödlich.
Kutane Leishmaniose (Hautleishmaniose, Orientbeule)
Erreger: L. tropica, L. major, L. aethiopica, L. mexicana oder L. brasiliense
Die kutane Leishmaniose (auch bekannt als Bagdad-, Orient- oder Aleppobeule) befällt im Gegensatz zur viszeralen Leishmaniose lediglich die Haut (lateinisch cutis = Haut) und verschont die inneren Organe. Die Vermehrung der Parasiten ist häufig auf den Ort beschränkt, an dem die Infektion stattfand.
Mukokutane Leishmaniose (Schleimhautleishmaniose, Espundia)
Erreger: L. brasiliense
Diagnostik:
- Viszerale Leishmaniose: Direktnachweis (Milz-, Leber-, Knochenmarkspunktion), Serologie
- (Muko)Kutane Leishmaniose: Direktnachweis, Serologie (unsicher), Intrakutantestung
Therapie: Antimonpräparate, Amphotericin B, Pentamidin, Paramomycin
Literatur und Weblinks:
- RKI - Leishmaniose
- http://www.leishmaniose.de
- http://www.parasitus.com/krankheiten/protozoen/leishmaniose/leishmaniose.html
- http://www.aerzte-ohne-grenzen.de/Medizin/Kala-Azar.php
Trypanosoma spp.
[Bearbeiten]| Trypanosoma spp. | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||
|
Trypanosomen (griech. Bohrkörper) sind eine Gruppe von geißeltragenden Protozoen (Flagellaten), die als Parasiten in vielen Warm- und Kaltblütlern vorkommen. Trypanosoma brucei rhodesiense und Trypanosoma brucei gambiense sind die Erreger der afrikanischen Schlafkrankheit, während Trypanosoma cruzei die Chagas-Krankheit hervorruft.
Verbreitung: Trypanosomen kommen weltweit vor, jedoch sind die medizinisch bedeutendsten Arten in den Tropen und Subtropen Afrikas, Mittel- und Südamerikas beheimatet. Jede Art hat ein begrenztes Spektrum an Zwischenwirten, daher können sie nur in den Lebensräumen ihres Wirtes existieren (z.B. im "Tse-Tse Gürtel" bei T. brucei).
Morphologie und Eigenschaften: Die Bezeichnung Trypanosoma (Bohrkörper) stammt von der Art der Bewegung der Flagellaten. Sie haben ein gedrungenes wurmartiges Aussehen. Trypanosoma ändern häufig ihre Gestalt, es variiert dabei vor allem die Position der Geißel zum Kern der Zelle und ihre Länge selbst.
Man kann daher mehrere Formen unterscheiden:
| Trypanosomenform | Position der Geißel | Länge (o. Geißel) |
|---|---|---|
| trypomastigot | hinter dem Kern | 30μm |
| epimastigot | vor dem Kern | < 30μm |
| promastigot | vorderer Zellpol | 40μm |
| amastigot | Geißel (fast) unsichtbar | < 30μm |
Lebenszyklus: Alle Trypanosomen machen einen Wirtswechsel durch zwischen Insekt und Wirbeltier. Bei manchen Arten findet jedoch nur eine mechanische Übertragung statt (T. evansi, T. equiperdum). Dabei sind die sich im Darmtrakt der Insekten entwickelnde Formen epimastigot oder promastigot, während sich im Wirbeltierwirt trypomastigote oder amastigote Formen ausbilden.
Krankheitsbilder: Trypanosomen sind Auslöser unterschiedlicher Krankheiten, die weiter unten ausführlich besprochen werden. Zwei Arten sind humanpathogen, sie besitzen mehrere Unterarten.
- Trypanosoma brucei
- T. brucei brucei (Nagana, nur bei Tieren)
- T. brucei gambiense (Afrikanische Schlafkrankheit)
- T. brucei rhodesiense (Ostafrikanische Schlafkrankheit)
- Trypanosoma cruzi (Chagas-Krankheit)
- T. cruzi cruzi
- T. cruzi marinkellei
Trypanosomen kommen vor allem in flüssigen Körpergeweben vor, insbesondere dem Blut, in der Lymphe, dem Knochenmark, der Rückenmarksflüssigkeit und im Gehirn. Sie können unter dem Mikroskop nativ und nach Giemsa-Färbung von Blut oder Liquor nachgewiesen werden.
Einige Trypanosomen entziehen sich recht erfolgreich der Immunabwehr, indem sie einen variablen Proteoglycan-Mantel besitzen, der ständig seine antigene Zusammensetzung ändert. Auch die Proteine sind durch Transspleißen hochvariabel. Dieser Mechanismus wurde bei vier Arten nachgewiesen (T. brucei, T. congolense, T. evansi, T. equiperdum). Andere Arten wie T. cruzi, verbergen sich durch das Eindringen in eine Wirtszelle.
Trypanosoma sp. und ihre Entdecker:
- Trypanosoma evansi, 1880 von Griffith Evans entdeckt, Erreger der Surra bei Pferd, Kamel und Elefant. Mechanische Übertragung bes. durch Tsetse und Tabaniden
- Trypanosoma equiperdum, entdeckt 1894 von Rouget als Erreger der Beschälseuche bei Pferden
- Trypanosoma brucei brucei, entdeckt 1894 von Sir David Bruce, Erreger der Nagana bei Tieren
- Trypanosoma brucei gambiense, entdeckt 1901 von Joseph Everett Dutton
- Trypanosoma brucei rhodesiense, eine Variante der Trypanosoma gambiense, Erreger der Schlafkrankheit
- Trypanosoma equinum, Voges 1901, entdeckt 1901 von Elmassian, Erreger der Mal de Caderas, einer nur bei Equides in Südamerikas vorkommenden Krankheit, der Kreuzlähme der Pferde.
- Trypanosoma rangeli, scheinbar nicht humanpathogen, ähnlich T.cruzi
- Trypanosoma theileri, entdeckt 1903 von Adolph Theiler, Erreger einer Rinderkrankheit
- Trypanosoma cruzi, entdeckt 1909 von Carlos Chagas, Erreger der Chagas-Krankheit
- Trypanosoma vivax, Erreger der Nagana bei Rindern und Schafen.
Literatur und Weblinks:
- August Stich, Dietmar Steverding: Die Rückkehr einer Seuche: Trypanosomen. Biologie in unserer Zeit 32(5), S. 294 - 302 (2002), ISSN 0045-205X
- Stevens JR, Noyes HA, Schofield CJ, Gibson W.: The molecular evolution of Trypanosomatidae. 2001
Trypanosoma brucei
[Bearbeiten]Trypanosoma brucei ist der Erreger der Schlafkrankheit (syn. Afrikanische Trypanosomiasis). Man unterscheidet 2 Unterarten:
- Trypanosoma brucei gambiense (Erreger der Westafrikanischen Schlafkrankheit)
- Trypanosoma brucei rhodesiense (Erreger der Ostafrikanischen Schlafkrankheit)
Das Erbgut der Erreger wurde im Juli 2005 durch Forscher sequenziert, wodurch sie sich neue Möglichkeiten der Krankheitsbekämpfung erhoffen.


Vorkommen und Übertragung: Als Erregerreservoir der Trypanosomen dienen Menschen, Rinder und Antilopen. Anders als bei der Malaria sind die Überträger der Schlafkrankheit tagaktive, stechende und blutsaugende Zungenfliegen (Tsetse-Fliegen, Glossina sp.). Es handelt sich dabei um kleinere bis mittelgroße Fliegen (7,3-13mm n. Meyers 1909) mit einem relativ schmalen Körper. Charakteristisch ist die Haltung der Flügel: Diese werden beim Sitzen in Ruhestellung, ähnlich wie wir es von einer Schere kennen, der Länge nach auf dem Hinterleib genau übereinandergelegt und bilden eine Zungenform (lat. Glossa), daher auch ihr Name. Durch diese Flügelhaltung kann die Tsetsefliege gut von anderen Stechfliegen unterschieden werden.
Man trifft Glossinen im tropischen Afrika vorwiegend in Feuchtgebieten (Flussläufe, Sümpfe) aber auch in trockenen Savannenlandschaften (z.B. Kalahari) an. Der Stich ist sehr schmerzhaft und kann auch durch die Bekleidung hindurch erfolgen. Die Erreger gelangen mit dem gerinnungsaktiven Fliegenspeichel in den Stichkanal. Durch einen Stich werden mehrere tausend Erreger übertragen. Bremsen und Stechfliegen könnten (in besonderen Fällen) möglicherweise eine Rolle durch mechanische Übertragung spielen. [3]
Infektionsrisiko: Nicht alle Tsetse-Fliegen sind Trypanosomen-Überträger, so dass nicht jeder Stich zwangsläufig zu einer Infektion führt. Das Infektionsrisiko bei einem Tsetsestich ist regional sehr unterschiedlich und liegt durchschnittlich in der Größenordnung 1:100, denn auch die Durchseuchungsrate der Tsetse-Fliege variiert stark. Das Risiko steigt damit proportional zur Zahl der Stiche. Die Infektion trifft überwiegend die einheimische Bevölkerung, seltener Touristen.
Epidemiologie: Die Schlafkrankheit kommt mit einem schwer erfassbaren regionalen Verteilungsmuster im gesamten Tropengürtel Afrikas vor. Insgesamt sind nach Schätzungen der WHO mehr als 500.000 Menschen von der Schlafkrankheit betroffen. Durch die instabile politische Situation in vielen Regionen (Flüchtlinge) hat die Erkrankungsrate in den letzten Jahren zugenommen.

Das Parasitenreservoir von T. b. gambiense besteht nach Dönges (1988) hauptsächlich aus den infizierten, eventuell auch nur latent infizierten Menschen, einigen Haustieren, besonders dem Hausschwein (auch bei Desowitz (1981)) und der Hamsterratte Cricetomys gambianus (Langschwanzmäuse). Piekarski (1962) nennt die Antilope unter den Wildtieren. Oft wird T. b. gambiense während des 1. Stadiums im Menschen nicht diagnostiziert und es folgt (oft erst nach Jahren) das schwerer zu behandelnde 2. Stadium.
T. b. rhodesiense fand sich weiterhin am häufigsten bei der Schirrantilope, gefolgt von dem Hausrind, der Kongoni, dem Afrikanischen Büffel, der Fleckenhyäne und dem Löwen (Dönges). In begrenzterem Umfang als bei T. b. gambiense ist auch hier der erkrankte Mensch ein Erregerreservoir. Piekarski nennt für beide Trypanosomenunterarten noch Ziegen und Schafe.
Welche Tierarten bei der Übertragung auf den Menschen die bedeutendste Rolle spielen, ist nicht abschließend geklärt, da ein kompliziertes Geflecht von anderen epidemiologischen Parametern beachtet werden muss (z.B. 31 Tsetse-Arten mit Vorlieben für bestimmte Wirtstiere, sowie Regenzeiten, soziale Faktoren, unterschiedliche Erregerstämme etc.). Das Infektionsrisiko ist deswegen lokal und regional sehr unterschiedlich. Die Parasitenreservoire sind zum großen Teil auch für jene Trypanosomen relevant, die bei afrikanischen Haus- und Nutztieren die sog. Nagana verursachen.
Symptomatik: Der Krankheitsverlauf ist abhängig vom auslösenden Erreger. Bei Infektion mit Trypanosoma brucei gambiense ist der Krankheitsverlauf langsamer, bei Infektion mit Trypanosoma brucei rhodesiense in der Regel schneller und ausgeprägter.
- Stadium I (Hämolymphatische Phase): In der ersten Woche nach der Infektion kann es an der Einstichstelle zu einer schmerzhaften Schwellung mit zentralem Bläschen, dem sog. "Trypanosomenschanker" kommen. Dieses Symptom tritt jedoch nur bei einem Teil der Infizierten (5-20%) auf. 1-3 Wochen nach der Infektion beginnt die eigentliche Parasitämie, die von Fieber, Schüttelfrost, Kopf- und Gliederschmerzen, Ödemen, Jucken, Exanthem und Lymphknotenschwellung begleitet wird. Hinzu treten Anämie und Thrombozytopenie, sowie erhöhte IgM-Spiegel.
- Stadium II (Meningoenzephalitische Phase): Ca. 4-6 Monate nach Infektion - bei T. b. rhodiense oft schon nach wenigen Wochen - dringen die Erreger in das Zentralnervensystem ein. Die Patienten leiden unter zunehmenden Verwirrungszuständen, Koordinations- und Schlafstörungen, Krampfanfällen, Apathie und Gewichtsverlust. Es können extrapyramidale Störungen oder ein Parkinson-ähnliches Krankheitsbild auftreten.
Im Endstadium fallen die Patienten in einen kontinuierlichen Dämmerzustand, der der Krankheit ihren Namen gegeben hat. Im Liquor ist eine Pleozytose nachweisbar. Nach einem Verlauf von Monaten bis Jahren endet die Krankheit tödlich.
Immunreaktion: Die Trypanosomen sind von Glykoproteinen, den so genannten "variable surface glycoproteins" (VSGs) umgeben. Die VSGs werden von den Einzellern im Rahmen der Vermehrung ständig variiert, um der Immunantwort des Wirts zu entgehen (Antigenvariation). Im Trypanosomen-Genom sind über 1000 verschiedene VSG-Gene codiert, die abwechselnd exprimiert werden. Das menschliche Immunsystem kann zwar Antikörper gegen die vorherrschenden Antigene produzieren, aber immer nur einen Teil der Erreger eliminieren, da bereits neue Varianten im Blutkreislauf zirkulieren.
Diagnostik: Im Stadium I werden die Erreger mikroskopisch im Blut ("dicker Tropfen") oder mittels Lymphknotenbiopsie nachgewiesen. Zum Ausschluss des Stadium II erfolgt bei Parasitennachweis zusätzlich eine Untersuchung des Liquor cerebrospinalis. Als immundiagnostische Verfahren werden ELISA, IFT und PHA eingesetzt.
Prophylaxe: Zur Zeit ist weder eine medikamentöse Prophylaxe der Schlafkrankheit noch eine vorbeugende Impfung verfügbar. In der Mitte des letzten Jahrhunderts wurde Pentamidin i.m. erfolgreich als Prophylaxe eingesetzt. Diese war für mindestens 6 Monate effektiv (T. b. gambiense). Die heute einzig mögliche Vorbeugung besteht in der Vermeidung von Insektenstichen. Touristen sollten sich mit Repellents, Moskitonetzen und langärmeliger Kleidung schützen. Wichtig könnte auch das Tragen von heller Kleidung sein, da die Tsetse-Fliege besonders von blau und schwarz angezogen wird. Diese Maßnahmen sind jedoch nur bedingt erfolgreich, da die aggressiven Tsetse-Fliegen schnell eine ungeschützte Stelle am Körper finden.
Therapie: Aufgrund der Toxizität der verfügbaren Medikamente wird die Schlafkrankheit in den meisten Fällen stationär behandelt. Im Stadium II werden Arsenverbindungen eingesetzt, die ausgeprägte Nebenwirkungen auslösen. Die Letalität kann hier bis zu 5% betragen.
- Stadium I: Gabe von Suramin (T. b. rhodesiense/gambiense) oder Pentamidin (T. b. gambiense). Beide Medikamente wirken nicht auf Erreger im Zentralnervensystem, da sie die Blut-Hirn-Schranke nicht überwinden.
- Stadium II: Gabe von Melarsoprol oder Eflornithin (T. b. gambiense). Beide Medikamente wirken gegen Erreger im ZNS, sind jedoch neurotoxisch.
Historie: Sir David Bruce erforschte als einer der Ersten die Epidemiologie der Krankheit in Afrika. Robert Koch erforschte die Wirkung von Atoxyl gegen die Erkrankung. Paul Ehrlich entwickelte daraus das Salvarsan. Ein wichtiges Medikament ist seit etwa 1920 Germanin (Suramin, Bayer 205 der Bayer AG).
Literatur und Weblinks:
- Johannes Dönges, Parasitologie, 1988, 2.Aufl., Georg Thieme Verlag Stuttgart/ New York , ISBN 3135799026
- Dr. Gerhard Piekarski, Medical Parasitology in Plates, 1962, Farbenfabriken Bayer AG, Leverkusen, Germany, Pharmaceutical Division
- Ein Kapitel in: Robert S. Desowitz, New Guinea Tapeworms and Jewish Grandmothers, tales of parasites and people, 1987, Norton Verlag, ISBN 0393304264, bes.zur Geschichte des Viktoriasees
- WHO - African trypanosomiasis (sleeping sickness)
- http://www.aerzte-ohne-grenzen.de/Medizin/Schlafkrankheit.php
Trypanosoma cruzei
[Bearbeiten] |
 |
Der Einzeller Trypanosoma cruzi ist der Erreger der Chagas-Krankheit (auch als Amerikanische oder Südamerikanische Trypanosomiasis bezeichnet), eine infektiöse Erkrankung und Parasitose.
Verbreitung: Die Chagas-Krankheit ist nur in Mittel- und Südamerika verbreitet und wird durch (vorwiegend nachtaktive) Raubwanzen übertragen. Die Raubwanzen infizieren sich auch gegenseitig durch Koprophagie und "Kannibalismus". Ein Erregerreservoir der Zoonose besteht u.a. bei Wildtieren (z.B. Gürteltieren, Opossums, Zweifinger-Faultiere), aber auch bei Hunden, Katzen und Ratten. Auch der infizierte Mensch ist ein wichtiges Parasitenreservoir. Insgesamt soll es mehr als 16 Millionen infizierte Menschen geben, in Bolivien könnte etwa ein Viertel der Bevölkerung betroffen sein.

Vektor: Trypanosoma cruzi wird durch Raubwanzen (Fam. Reduviidae) übertragen, welche umgangssprachlich auch assassin bug, kissing bug, vinchuca, barbeiro oder chipo heißen. Die Insekten sind 3 bis 4 Zentimeter groß und gehören den Gattungen Triatoma, Rhodnius oder Panstrongylus an (alle aus der Unterfamilie Triatominae), wobei Triatoma infestans der wichtigste Zwischenwirt darstellt. Alle Stadien (auch die Larven, s. Bild) sind empfänglich für T. cruzi.
Infektionswege: Die Raubwanze attackiert den Schlafenden (auch andere schlafende Säugetiere, Reptilien, Vögel), sticht ihn und saugt meist unbemerkt Blut mit Vorliebe in den dünneren Regionen der Haut z.B. an den Lippen oder am Auge. Währenddessen defäkiert das Insekt. Die Infektion des Menschen erfolgt nicht durch den Stich an sich, sondern durch Einreiben des erregerhaltigen Kotes einer infizierten Raubwanze in die frische Stichwunde durch den irritierten, aufwachenden Menschen selbst, oder auch durch Eindringen des Erregers in unverletzte Schleimhaut (bes. des Auges). Der Kot kann vermutlich jahrelang infektiös bleiben. Die diaplazentare Infektion des Fötus durch die Mutter ist möglich. Auch Muttermilch ist infektiös.

Verlauf: Die Chagas-Krankheit tritt beim Menschen in zwei Stadien auf:
- Das akute Stadium tritt kurz nach der Infektion auf. Es ist meistens gekennzeichnet durch leichtes Fieber und eine Schwellung um die Stichwunde: Ödem mit Entzundungserscheinungen, sog. Chagom. Da dieses oft im Gesicht auftritt (weiche Hautstellen), nennt man ein Chagom im Augenbereich Romana-Zeichen oder Romana´sches Zeichen.
- Das chronische Stadium tritt bei circa 10–30 % der akut Erkrankten erst nach einigen Jahren auf.
Von der chronischen Chagas-Krankheit werden vor allem das Nervensystem, das Herz und der Darm betroffen. Es können verschiedene neurologische Störungen, die bis zur Demenz gehen können, auftreten. Am Herzen kommt es zu einer Schädigung des Herzmuskels, die Jahrzehnte nach Infektion zum plötzlichen Herztod führen kann. Am Gastrointestinaltrakt kann es zu einer starken Dilatation des Darmes (Megacolon) und der Speiseröhre kommen.
Unbehandelt kann die Chagaskrankheit in bis zu 10 % der Fälle tödlich enden. Besonders gefährdet sind Säuglinge und Kleinkinder.
Diagnose: Der Erreger lässt sich besonders in der akuten Phase in den ersten Wochen mikroskopisch im Blut (Blutausstrich oder dicker Tropfen) nachweisen.
In der chronischen Krankheitsphase wird der Erreger mit Antikörpertests (z.B. IFT) nachgewiesen.
In Südamerika gibt es den Trypanosomentest in Form der sog. Xenodiagnose. Dazu lässt man laborgezüchtete Raubwanzen, die erregerfrei sind, auf der Haut des Patienten eine Blutmahlzeit nehmen. Nach zwei bis vier Wochen (nach unterschiedlichen Quellen) wird der Darm der Raubwanzen auf einen Erregerbefall untersucht.
Im Gehirn lässt sich die Auswirkung der Erkrankung mittels CT oder NMR nachweisen. Im Herzen kann man dazu die Echokardiografie nutzen.
Prophylaxe: Es gibt bisher keine Impfung. Zur Vorbeugung der Krankheit werden die Raubwanzen bekämpft. DDa die Raubwanzen auch gerne nahe den Schlafplätzen der Haustiere leben, sind jene Orte abzusondern. Ausreichend geschlossene Wohnungen sowie zeltartige, auch bodenseitig durchgehend geschlossene Moskitonetze mit dichtschließendem Reißverschluss bieten einen sehr guten Schutz, sofern man das Netz beim Schlafen nicht berührt. Notfalls muss das herkömmliche Moskitonetz bis unter die Matratze gesteckt werden. Die gefährdetsten Schlafplätze liegen in offenen, einfachen Häusern z.B. mit Wänden und Dächern aus Stroh und ähnlichem Flechtwerk. Viele unspezifische Insektizide oder Repellents sind bei Raubwanzen meist unwirksam.
Eine durchgehende Kontrolle von Blutspenden soll die Möglichkeit der Übertragung der Infektion bei Bluttransfusionen und Transplantationen verhindern. Dies geschieht in den entsprechenden Ländern jedoch nicht immer.

Therapie: Medikamente wie Nifurtimox und Benznidazol wirken vor allem in der akuten Phase der Erkrankung, die medikamentöse Therapie ist schwierig. Durch bessere Kontrolle der Erkrankungen bei Kindern sollen die schwerer zu behandelnden chronischen Formen vermieden werden. Die Zahl der Neuinfektionen ist nach den Statistiken der WHO allerdings wegen der Bekämpfung des Insekts sehr zurückgegangen. Wegen unterschiedlichster Verbreitungskarten, die im Internet angeboten werden, sollte vorsichtshalber im gesamten Verbreitungsgebiet der Krankheitsüberträger eine angemessene Prophylaxe getroffen werden, dazu könnten auch noch Gebiete in den USA gehören.
Geschichte: Die Ursache der Erkrankung wurde von dem brasilianischen Wissenschaftler Carlos Chagas 1909 aufgeklärt. Er arbeitete am Oswaldo-Cruz-Institut in Rio de Janeiro. Lange Zeit hielt Chagas den Stich fälschlicherweise für die Hauptinfektionsquelle.
Literatur und Weblinks:
- WHO - Chagas disease
- http://www.unibio.unam.mx/chagmex
- http://memorias.ioc.fiocruz.br/94sup1/
- http://chagaspace.org/eng/index.htm
Rhizopoden
[Bearbeiten]Entamoeba histolytica
[Bearbeiten]| Entamoeba histolytica | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||
| Systematik | ||||||||||||||||||
|
Entamoeba histolytica ist ein einzelliger Parasit, der v.a. den Menschen, experimentell aber auch andere Säugetiere befällt. Das Protozoon ist der Verursacher der Amöbenruhr.
Epidemiologie: Entamoeba histolytica ist weltweit verbreitet und besonders in Gebieten mit schlechten hygienischen Zuständen im Abwasser oder in verschmutzem Trinkwasser anzutreffen. Es werden einzelne Ausbrüche bei Katastrophen verzeichnet, da dort oft ungenügend sauberes Trinkwasser zur Verfügung steht. Auch Fehler im Abwassersystem können Amöbenruhr hervorrufen, so wurden beispielsweise bei der Weltausstellung 1933 in Chicago über 1000 Fälle mit 58 Toten beobachtet, verursacht durch ein Übertreten von Abwässern in die Trinkwasserversorgung.
Es wird geschätzt, dass weltweit etwa 500 Millionen Menschen infiziert sind und etwa 50.000-100.000 Menschen pro Jahr an der Infektion versterben.

(Noch weiter verbreitet ist Entamoeba dispar. Diese wurde früher als Stamm von E. histolytica betrachtet gilt jedoch aufgrund genetischer Unterschieden als eigene Art. Sie kann jedoch keine Magna-Formen ausbilden und ist von den Minuta-Formen der Histolytica-Amöben optisch nicht zu unterscheiden und ruft meist nur selbslimitierende Durchfälle hervor.)
Morhologie und Eigenschaften: E. histolytica haben die für Amöben typische sich ständig verändernde, polymorphe Gestalt. Die Fortbewegung geschieht über Pseudopodien (Scheinfüßchen), die aus der Zelle ausgestülpt werden. Es sind zwei Formen vorhanden. Die für die Krankheitssymptome verantwortliche Vegetativform bzw. die Trophozoiten, deren Minuta-Form bis zu 5μm, deren Magna-Form bis zu 50μm groß wird und die der Weiterverbreitung dienenden Zysten von etwa 15μm Durchmesser.

Lebenszyklus: Die Amöben gelangen als Zysten in den Dünndarm, dort schlüpft ein vier-kerniger Organismus, der sich in vier oder acht Trophozoiten teilt. Die Trophozoiten können im Darm parasitieren, aber auch in die Darmwand und die Blutbahn eindringen, zum anderen können sie encystieren und den Darm mit den Faeces verlassen (etwa 45 Millionen Zysten pro Tag), um einen neuen Wirt zu befallen. Große, mit Erythrozyten vollgestopfte Amöben nennt man wegen ihrer Größe Magna-Form.
Krankheitsbild: Die erste bedeutende wissenschaftliche Monographie über die Ruhr war Johann Georg Zimmermanns "Von der Ruhr unter dem Volke im Jahr 1765, und denen mit derselben eingedrungenen Vorurtheilen, nebst einigen allgemeinen Aussichten in die Heilung dieser Vorurtheile (Zürich 1767)".
Die Trophozoiten dringen in die Darmwand ein und gelangen mit dem Blutstrom in die inneren Organe, z.B. die Leber, wo sie Abszesse hervorrufen.
Die von E. histolytica hervorgerufene Krankheit bezeichnet man als Ruhr, genauer Amöbenruhr beziehungsweise Amöbiasis. Durch Gewebe auflösende (histolytische) Enzyme verursachen sie dabei eitrige Darmgeschwüre, die aufbrechen können. Die Folge können Unterleibsschmerzen, himbeergeleeartiger Durchfall, Bauchfellentzündungen und durch Streuung Abszesse der Leber und anderer Organe sein. Oft bricht die Krankheit erst Jahre oder Jahrzehnte nach der Infektion aus.
Diagnostik: Direktnachweis im Stuhl, bei extraintestinaler Amöbiasis helfen bildgebende Verfahren und serologische Methoden weiter.
Therapie: Metronidazol bei allen Manifestationsformen plus ein Medikament zur Sanierung des Darmlumens (Diloxanidfuroat, Paromomycin, Diiodohydroxyquin).
Literatur und Weblinks:
Sporozoen
[Bearbeiten]Cryptosporidium parvum
[Bearbeiten] |
 |
Crytosporidium parvum ist ein ovaler Dünndarmparasit, der die Zoonose Kryptosporidiose verursacht. Bei immunkompetenten Personen verläuft die Infektion meist als selbstlimitierende Durchfallerkrankung. Dagegen können Personen mit reduziertem Immunstatus chronische Diarrhöen und andere Organbeteiligungen (z.B. pulmonale Cryptosporidiose) erleiden. Die Infektion mit Oocysten erfolgt fäkal-oral oder über kontaminierte Nahrungsmittel/Trinkwasser.
Epidemiologie: Reservoir des Erregers sind Geflügel, Kälber (Ausscheidung von Oocysten in etwa 50%) und andere Tiere.C. parvum ist einer der infektiösesten und häufigsten Enteritis-Erreger beim Menschen. Die Durchseuchungsrate beträgt 10-20% bei Patienten mit AIDS-assoziierter Diarrhoe, 1,2-2% bei Immunkompetenten in den Industrienationen und 0,5-10% in Entwicklungsländern.
Diagnostik: Direkter Erregernachweis im Stuhl (die Kinyoun-Färbung, die säurefeste Organismen färbt ist besonders geeignet) oder Antigennachweis im Stuhl (z.B. mit Floureszenz-markierten Antikörpern). Am zuverlässigsten sind Biopsien des terminalen Ileums und histologische Standardfärbung.
Therapie: Keine spezifische Therapie bekannt
Toxoplasma gondii
[Bearbeiten]| Toxoplasma gondii | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||
| Systematik | ||||||||||||||
|
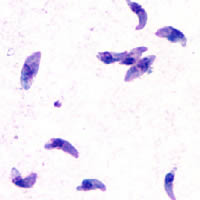
Toxoplasma gondii ist ein bogenförmiges Protozoon mit parasitischer Lebensweise. Sein Endwirt sind Katzen, als Zwischenwirt dienen andere Wirbeltiere.
Entdeckung und Forschungsgeschichte: Toxoplasma gondii wurde erstmalig 1908 in Tunesien als Parasit im Gundi (Ctenodactylus gundi) entdeckt und als Angehöriger der Sporozoen identifiziert. Aufgrund der Halbmondform wurde es von den Entdeckern Nicolle und Manceaux als Toxoplasma (griech. toxon: Bogen) und aufgrund des Wirtstieres als Toxoplasma gondii benannt. Erst viel später konnte es auch beim Menschen als Krankheitserreger gefunden werden, die von ihm ausgelöste Krankheit wurde Toxoplasmose genannt. 1948 entwickelten Sabin und Feldmann einen serologischen Test auf der Basis von Antikörpern, den sie Dye-Test nannten. Mit Hilfe dieser Methode konnte festgestellt werden, dass Toxoplasma gondii weltweit verbreitet ist und beim Menschen sehr häufig vorkommt.
Verbreitung: Der Parasit ist weltweit verbreitet, die Bevölkerung weist eine hohe Durchseuchung auf, da die Infektion meist ohne Symptome verläuft. Etwa 60% der Bevölkerung in Deutschland besitzt Antikörper gegen Toxoplasma gondii, war also bereits einmal mit dem Parasiten infiziert. Die Prävalenz steigt pro Lebensjahr um etwa 1%. Nach Schätzungen erleiden 7 von 1.000 Schwangeren eine Infektion. Nach der Infektion besteht eine lebenslange Immunität, wenn das Immunsystem nicht erkrankt ist.
Morphologie und Eigenschaften: Toxoplasma gondii variiert je nach Stadium sowohl in der Form als auch in der Größe. Die Zellen der freien und infektiösen Form sind in flüssigen Medien oder Frischpräparaten bogenförmig und erreichen Größen von 2 bis 5μm. Betrachtet man sie in Gewebeproben oder fixierten Schnitten, erscheinen sie dagegen eiförmig oval. Außerdem können sie sowohl einzeln als auch zu mehreren in sogenannten Pseudozysten im Gewebe vorkommen. Pseudozysten bestehen aus der Zellmembran der Wirtszelle und den sich darin ungehemmt teilenden und die Zelle aufblähenden Sporozoiten. Die Oozysten messen bis zu 11μm, die Gewebspseudozysten bis zu 300μm. Aus den Oozysten bilden sich zwei verschiedene Populationen von Sporozoiten: Die Tachyzoiten bilden sich nach dem Eindringen in den Zwischenwirt und vermehren sich dort rapide. Später treten Bradyzoiten auf, deren Vermehrung stark verlangsamt ist. Strukturell unterscheiden sich diese beiden Formen nicht.
Das Genom des Erregers umfasst etwa 4.000 Gene.
Virulenzfaktoren: 90% der Virulenz des Erregers können durch die Kinase ROP18 erklärt werden, die der Erreger produziert und mit der er den Wirtszellstoffwechsel zu seinen Gunsten beeinflusst.[4]
Entwicklungszyklus:
Die Oozysten werden vom Endwirt (Katzenartige) mit den Feces ausgeschieden und gelangen als infektiöse, sporulierte Oocysten in den Zwischenwirt. Sie enthalten zwei Sporocysten mit je vier Sporozoiten, die sehr lange (bis zu 5 Jahre) infektiös bleiben können und Frost überstehen, allerdings nicht sehr hitzeresistent sind. Im Zwischenwirt (Wirbeltiere und Vögel) schlüpfen die Sporocysten, die nun aktiv in kernhaltige Zellen des Zwischenwirtes eindringen, vor allem in lymphatischen Geweben (Lymphknoten, retikuloendotheliales System (RES)). .




Nun setzt eine besondere Art der Vermehrung durch ungeschlechtliche Teilung ein, die sog. Endodyogenie oder innere Knospung. Dabei bilden sich in der Mutterzelle zwei Tochterzellen, die durch Auflösung der Mutterzelle freigesetzt werden. Dieser Vorgang läuft nun so lange ab, bis die Wirtszelle komplett ausgefüllt ist und aufplatzt, so dass die Tachyzoiten (griech. tachys: schnell) frei werden. Dieser Vorgang wiederholt sich nun alle 6 Stunden. Die Tachyzoiten breiten sich im Blut aus (Parasitämie) und können auch die Plazentarschranke überwinden. Nachdem die Immunreaktion eingesetzt hat verlangsamt sich die Teilungsdauer und man spricht nun von Bradyzoiten (griech. bradys: langsam). Es bilden sich in den Zellen Gewebezysten, die vor allem in der Muskulatur, aber auch im Gehirn oder in der Retina des Auges latent bleiben. In dieser Form werden sie dann wiederum von der Katze, die den Zwischenwirt frisst aufgenommen. (Der Mensch ist somit für die Toxoplasmen ein Fehlwirt). Die Bradyzoiten werden nun im Darm frei und dringen in die Epithelzellen ein. Dort findet eine Schizogonie (ungeschlechtliche Fortpflanzung) statt, sodann werden fertige Oocysten in den Darm entlassen. Diese werden nun mit dem Kot ausgeschieden und reifen in der Außenwelt in 2 - 4 Tagen zu infektionsfähigen, sporulierten Oocysten heran. Sie sind bis zu 5 Jahre infektionsfähig. Falls die Oocysten nun von Katzen aufgenommen werden, so entwickeln sich Tachyzoiten, Bradyzoiten und Gewebecysten. Diese verbleiben jedoch nur zu einem geringen Teil im Gewebe und wandern in das Darmepithel der Katze ein wo sie erneut durch Schizogonie Oocysten ausbilden. Der Lebenszyklus wird in drei Phasen unterteilt: 1. die extraintestinale Phase, 2. die externe Phase und 3. die enteroepitheliale Phase.
Krankheitsbild: Beim Menschen ruft der Parasit die Krankheit Toxoplasmose hervor. Er kann T. gondii über halbrohes Fleisch oder über Schmierinfektion (Katzenkot) aufnehmen und übernimmt dann die Rolle des Zwischenwirtes, das heißt die Erreger durchdringen die Darmwand, um so in der Muskulatur und in anderen Organen Zysten zu bilden, die ein Leben lang im Gewebe überdauern. Die Inkubationszeit beträgt ein bis drei Wochen, die Infektion verläuft bei gesundem Immunsystem für ca. 90% der Betroffenen symptomlos. Es kann einige Monate lang zu grippalen Beschwerden wie Fieber, Gelenk- und Muskelschmerzen und Lymphknotenschwellungen kommen. Bei einem schubweisen Verlauf der Erkrankung kann sich die Ausbreitung über Wochen und Jahre hinziehen. Hierbei bleiben die Erreger im Organismus in Zysten eingeschlossen. Sie platzen zu beliebiger Zeit und gelangen so in das Blut- und Lymphsystem. Bei einer durchgestandenen Erkrankung ist eine Immunität anzunehmen.
Wenn die Erstinfektion der Mutter in der Schwangerschaft erfolgt, kann T. gondii beim Ungeborenen zu schweren Schäden führen. Dabei nimmt das Übertragungsrisiko mit der Dauer der Schwangerschaft zu, die Schwere der Schäden jedoch ab. Im ersten Trimenon entwickeln 70% der infizierten Kinder eine konnatale Toxoplasmose, die meist zum Abort führt. Im zweiten und dritten Trimenon entwickeln 30% bzw. 10% eine konnatale Toxoplasmose, die in 75% bzw. 90% in eine latente Toxoplasmose übergeht und zu erheblichen Beeinträchtigungen beim Kind führt. Die infizierten Kinder können epileptische Anfälle, kognitive Einschränkungen, Schäden an der Leber, Lunge, Gehirn, Augen, Herzmuskel und Hirnhaut aufweisen. 1/4 der vor der Geburt infizierten Kinder trägt geistige Behinderungen, Spastiken, Epilepsie, Hydrocephalus und Verkalkungen der Hirngefäße davon. Die typische Trias bestehend aus Hydrozephalus, intrazerebraler Verkalkung und Chorioretinitis wird jedoch nur bei 2% der Betroffenen ausgeprägt.
Unter Immunsuppression z.B. bei AIDS kann die Reaktivierung latenter Erreger zur Enzephalitis, Hirnabszessen und Sepsis führen.
Prophylaxe: Schwangeren ist zu empfehlen, sich auf Toxoplasmose-Antikörper untersuchen zu lassen. Fällt der Test negativ aus, das heißt hatte die Schwangere noch keinen Kontakt mit dem Erreger, dann sollte sie folgendes beachten: Kein Fleisch essen, das nicht durchgebraten ist und möglichst nicht mit Katzenkot umgehen und nicht im Garten arbeiten. Notfalls schützen Handschuhe oder Händewaschen vor den Mahlzeiten. Es ist sinnvoll, wenn eine andere Person das Katzenklo täglich reinigt, weil die Oozysten erst frühestens zwei Tage nach Ausscheidung infektiös werden.
Diagnostik: T. gondii gehört zu den Infektionen, auf die man bei Schwangeren routinemäßig testen sollte, ähnlich wie Röteln, Syphilis, Hepatitis B, Clamydien, HIV, evtl. Zytomegalie und Herpes. Die Untersuchung ist in Deutschland jedoch nicht Bestandteil der normalen Schwangerenvorsorge! Wenn schon früher einmal eine Infektion durch T. gondii nachgewiesen wurde, geht davon keine Gefahr mehr aus. Das ungeborene Kind ist dann während der Schwangerschaft durch die mütterlichen Antikörper vor einer Infektion geschützt.
Eine Infektion lässt sich am leichtesten durch serologisch-immunologische Testverfahren (ELISA, Immunofluoreszenztest) nachweisen, d.h. Nachweis von spezifischen Antikörpern im Blut. Dabei sprechen IgM-Antikörper für eine frische Infektion, IgM- und IgG-Antikörper zusammen für eine Infektion innerhalb der letzten eineinhalb Jahre. Liegen sowohl IgG- als auch IgM-Antikörper vor hilft ein sogenannter Aviditätstest beim Ausschluss einer frischen Infektion.
Es stehen auch molekularbiologische Untersuchungen (PCR) zur Verfügung. Sie eignen sich zur Untersuchung von Fruchtwasser zum Nachweis einer bereits erfolgten Übertragung auf das ungeborene Kind. Eine Schädigung des Kindes kann man durch Ultraschall diagnostizieren. Auch bei immungeschwächten Patienten eignet sich am ehesten die PCR oder Sichtbarmachung bereits entstandener größerer Läsionen mittels bildgebender Verfahren (CT, MRT).
Die Diagnose kann sehr schwierig werden, wenn sie im Nachhinein bei einem Neugeborenen gestellt werden muss, das erst spät Krankheitszeichen zeigt (beispielsweise Erblindung durch Chorioretinitis).
Therapie: Eine nachgewiesene Infektion in der Schwangerschaft muss behandelt werden. Je früher die Behandlung begonnen wird, umso geringer ist die Schädigung des Kindes (Senkung der Schäden bis zu 60%).
- Bis zur 16. Schwangerschaftswoche: Gabe von Spiramycin
- Ab der 16. Schwangerschaftswoche wird bis zur Entbindung eine Kombination aus Sulfadiazin, Pyrimethamin und Folinsäure in Zyklen von jeweils 4 Wochen Dauer mit darauf folgendem vierwöchigen freien Intervall empfohlen.
Rechtliches:
- Deutschland: Infektionsschutzgesetz - § 7 Abs. (3) - Unfallversicherungs-Einordnungsgesetz § 202 - Meldepflicht nur bei konnatalen Infektionen, Biostoffverordnung - Risikogruppe 2 (§10, §11, §13, §15), Mutterschutzgesetz - Allgemein.: Fälle von Konnataler Infektion sind dem Robert Koch Institut zu melden. Weiter sind erkannte Infektionen nach dem Arbeitsschutzgesetzt dem für den medizinischen Arbeitsschutz zuständigen oder dem Unfallversicherungsträger zu melden. Taxoplasma ist entsprechend Biostoffverordnung ein biologischer Arbeitsstoff der Risikogruppe 2. Nach dem Mutterschutzgesetz dürfen werdende oder stillende Mütter nicht mit möglichen Infektionsträgern arbeiten.
- Österreich: Infektionsschutzgesetz, Verordnung Biologische Arbeitsstoffe Risikogruppe 2, Mutterschutzgesetz, Mutter-Kind-Pass
- Schweiz: Infektionsschutzgesetz
Literatur und Weblinks:
- RKI - Toxoplasmose
- Groß, Uwe. “Toxoplasmose in der Schwangerschaft”. Deutsches Ärzteblatt, 98:A 3293–3300 [Heft 49], Dez 7 2001.
- Hu K et al. “Cytoskeletal components of an invasion machine--the apical complex of Toxoplasma gondii”. PLoS Pathog, 2(2):e13, Feb 2006 Epub: Feb 24 2006. DOI:10.1371/journal.ppat.0020013. PMID:16518471
Plasmodium sp.
[Bearbeiten]| Plasmodium sp. | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
|
Plasmodium ist eine Gattung von Parasiten aus der Haemosporiden-Familie Plasmodiidae. Vier bekannte Arten, Plasmodium ovale, Plasmodium vivax, Plasmodium malariae und Plasmodium falciparum sind als Erreger der Malaria berüchtigt. Seit einiger Zeit ist bekannt, dass es sich bei den Apicomplexa, zu denen die Plasmodien gehören, um Algen handelt, die sekundär die Fähigkeit zur Photosynthese verloren haben und zu einem parasitären Leben übergewechselt haben. Der Stoffwechsel der Leukoplasten gilt als interessantes Angriffsziel für neue Medikamente gegen Malaria und wird intensiv erforscht.
Morphologie und Eigenschaften: Plasmodien sind Einzeller, die im Gegensatz zu Bakterien keine Zellwand, dafür aber als Eukaryoten (Eucaryota) einen Zellkern besitzen. Sie sind kommaförmig und recht schlank, aufgrund ihrer Lebensweise nehmen sie je nach Wirt und Entwicklungsstadium unterschiedliche Gestalt an. Die kleinste Form, der Trophozoit, misst 3μm, die größte Form, der Leberschizont bis zu 70μm. Die verschiedenen Plasmodien-Spezies lassen sich morphologisch voneinander abgrenzen.
Verbreitung: Plasmodien finden sich heute vor allem im tropischen und subtropischen Raum; da die Entwicklung stark temperaturabhängig ist, kommen Plasmodien selbst dort nur bis in eine Höhe von unter 1500 Metern vor. Bis zum 19. Jahrhundert waren sie auch in Süddeuropa verbreitet, wurden jedoch durch Flussbegradigungen und Sumpftrockenlegungen ausgerottet. Es finden sich noch Restbestände im Zentralasiatischen Raum (Armenien, Algerien, Georgien, Kasachstan, Kirgisistan, Tadschikistan, Türkei, Turkmenistan und Usbekistan).
Lebenszyklus: Als Endwirt dienen Mücken, besonders der Gattung Anopheles. In ihnen findet die Vermehrung der Plasmodien statt, der Mensch dient als Zwischenwirt. Es gibt vier Arten der Plasmodien, die beim Menschen die Malaria auslösen; sie gehören zur Gattung Plasmodium.
Asexuelle Phase (Schizogonie) im Menschen
a) Exoerythrozytärer Zyklus:
Nachdem der Mensch von einer infizierten Anopheles-Mücke gestochen wurde, sondert sie mit ihrem gerinnungsaktiven Speichel Sporozoiten ab. Diese werden mit dem Blutstrom zur Leber getragen, wo sie in die Zellen des Lebergewebes eindringen und darin zum Leberschizont heranreifen. Dort findet eine asexuelle Vermehrung durch Teilung statt, die exoerythrozytäre Schizogonie genannt wird; dadurch entstehen bis zu 30.000 Merozoiten.




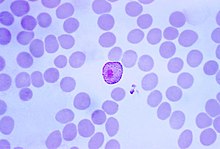

(Bei P. vivax und P. ovale verbleiben Hypnozoiten ungeteilt im Lebergewebe. In diesem Ruhezustand können sie über Monate bis Jahre verbleiben. Durch einen unbekannten Stimulus reifen sie zu Schizonten heran, was zu charakteristischen Rückfällen der Malaria tertiana führt.) Der Schizont platzt und die Merozoiten gelangen in die Blutbahn. Nach der einige Tage bis Wochen dauernden Produktion von Merozoiten beginnen einige zu geschlechtsreifen Zellen (Gametozyten) zu reifen. Diese finden sich nun gemeinsam mit den Merozoiten im Blut (Generationswechsel).
b) Erythrozytärer Zyklus: Die aus den Leberschizonten freigesetzten Merozoiten gehen in den Blutkreislauf über und befallen sodann die Erythrozyten. Sie dringen in diese ein (Trophozoiten), reifen heran und beginnen sich zu teilen (Schizonten). Aus dieser Teilung gehen acht bis sechzehn neue Merozoiten hervor, die durch Platzen des Erythrozyten freigesetzt werden und weitere Erythrozyten infizieren können. Bei den vier den Menschen befallenden Plasmodien, sieht die Teilungsdauer folgendermaßen aus:
| Plasmodium | Malariaform | Teilungsdauer / Fieberanfälle |
|---|---|---|
| P. ovale | Malaria tertiana | 48 Stunden |
| P. vivax | Malaria tertiana | 48 Stunden |
| P. malariae | Malaria quartana | 72 Stunden |
| P. falciparum | Tropica | unregelmäßig |
Sexuelle Phase (Sporogonie) in der Anopheles-Mücke
Durch die Fieberanfälle und das dadurch stärkere Schwitzen wird die Mücke eher zu einem bereits infizierten Träger geleitet, da die Mücke über einen guten Geruchssinn, sowie einen Temperatursinn verfügt. Beim erneuten Stich einer Mücke werden die Gametozyten in die Mücke aufgenommen. Sie entwickeln sich in ihrem Magen zu Gameten. Der Mikrogamet penetriert den Makrogameten und es entsteht eine Zygote, die sich verändert, eine längliche Form annimmt, motil wird und nun Ookinet heißt. Er lagert sich zwischen den Gewebeschichten des Mückenmagens an und verwandelt sich dort zur Oozyste. In ihr entstehen bis zu 1.000 neue Sporozoiten. Nach ihrer Freisetzung wandern sie in die Speicheldrüsen der Mücke und stehen nun zur Neuinfektion bereit. Der Zyklus in der Anopheles dauert abhängig von der Außentemperatur zwischen 8-16 Tagen. Dabei ist eine Mindesttemperatur von 15 °C erforderlich. Unterhalb dieser Temperatur kommt kein Zyklus mehr zu Stande.
Krankheitsbilder: Malaria (von ital. "mal'aria": "schlechte Luft") –auch Sumpffieber oder Wechselfieber genannt– ist eine Tropenkrankheit, die von einzelligen Parasiten der Gattung Plasmodium hervorgerufen wird. Die Krankheit wird in den Tropen und Subtropen durch den Stich einer weiblichen Stechmücke (Moskito) der Gattung Anopheles übertragen. Außerhalb dieser Gebiete lösen gelegentlich durch Flugreisende eingeschleppte Moskitos die so genannte "Flughafen-Malaria" aus. Hierbei sind alle Personen im direkten Umfeld von Flughäfen betroffen, z.B. Flughafenbedienstete oder Anwohner. Bis auf eine Übertragung durch Bluttransfusionen und Laborunfälle ist eine Mensch-zu-Mensch-Ansteckung nur gelegentlich von der Mutter auf das ungeborene Kind möglich, wenn die Plazenta (besonders während der Geburt) verletzt wird. Der Mensch und die Anopheles-Mücken stellen das einzige nennenswerte Erregerreservoir humanpathogener Plasmodien dar.
In der Gattung der Plasmodien sind nur die vier Erreger Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale und Plasmodium malariae für den Menschen gefährlich (humanpathogen). Hinsichtlich ihres Krankheitsverlaufes und ihrer geographischen Verbreitung unterscheiden sie sich erheblich. Plasmodium falciparum ist der klinisch bedeutsamste und bedrohlichste Erreger.

Die Symptome der Malaria sind hohes, wiederkehrendes bis periodisches Fieber, Schüttelfrost, Beschwerden des Magen-Darm-Trakts und Krämpfe. Besonders bei Kindern kann die Krankheit rasch zum Koma und Tod führen.
Geographische Verbeitung: Die geographische Verteilung gleicht der Verteilung der als Vektor geeigneten Anophelesarten, wobei zu beachten ist, dass das Vorkommen der Anopheles-Mücke auf niedrige Meereshöhen begrenzt ist, das heißt unter 2500m am Äquator und unter 1500m in den restlichen Gebieten der Erde. Durch die zunehmende Klimaerwärmung deutet sich mit der polwärtsgerichteten Ausbreitung der Überträgermücken eine weitere geographische Ausbreitung der Malaria an. Das Risiko in den einzelnen Endemiegebieten ist sehr unterschiedlich, was unter anderem saisonale und geographische Gründe hat. Im subsaharischen Afrika überwiegt P. falciparum deutlich vor allen anderen Plasmodienarten.

Auffallend ist, dass in Malariagebieten die Sichelzellenanämie relativ häufig vorkommt. Diese hämolytische Anämie ist durch eine Punktmutation der Hb-Kette bedingt und führt zur Hämoglobinpolymerisation besonders bei niedrigen Sauerstoffpartialdrücken und zum Aussicheln der Erythrozyten. Heterozygote Träger besitzen eine angeborene Resistenz gegen Malaria und somit einen Evolutionsvorteil gegenüber Personen ohne dieses Gen, die eher an Malaria sterben. In Afrika gibt es Regionen, in denen fast ein Drittel der Bevölkerung heterozygot für dieses Merkmal ist. In den anderen Weltgegenden kommt das Sichelzellengen praktisch nicht vor, da hier dieser Selektionsvorteil ohne Malaria nicht existiert.
Epidemiologie: Nach Angaben des Robert-Koch-Instituts in Berlin sterben weltweit jährlich 1,5 bis 2,7 Millionen Menschen an Malaria, etwa die Hälfte von ihnen sind Kinder unter fünf Jahren. 90% der Erkrankten leben auf dem afrikanischen Kontinent. Die Zahl der jährlichen Neuerkrankungen wird auf 300 bis 500 Millionen Fälle geschätzt.
In Deutschland werden jährlich ca. 900 Erkrankte (2004: 707 Fälle, 2003: 820; 2002: 859; 2001: 1.045) gemeldet, von denen 3-8 sterben (0,3-0,8 %). Der Großteil der Patienten war in afrikanischen Endemiegebieten unterwegs gewesen (ca. 87%).
Erreger:
| ||||||||||||||||||||
| (* bei unzureichender Malariaprophylaxe) |
Für den Menschen gefährlich sind die Erreger P. falciparum, P. vivax, P. ovale und P. malariae, die verschiedene Formen der Malaria auslösen können.
Darüber hinaus können auch P. semiovale und P. knowlesi in Einzelfällen eine Malaria hervorrufen. Bei Mehrfachinfektionen mit gleichen oder verschiedenen Plasmodien können die Fieberanfälle auch unregelmäßig sein. Das sonst typische Wechselfieber bleibt aus, es herrscht konstantes Fieber.
Pathogenese: Die mit Plasmodien infizierten, reifenden und platzenden Erythrozyten setzen mit den Merozoiten Toxine (z.B. Phospholipide) frei, welche zur Freisetzung von Zytokinen führen. Die Zytokine sind hauptsächlich für den Fieberanstieg und einer beobachteten Absenkung des Blutzuckerspiegels (Hypoglykämie) verantwortlich. Die mit einer Laktatazidose verbundene Hypoglykämie wird nicht nur durch die Wirkung der Zytokine hervorgerufen, sondern ist auch eine Folge des Stoffwechsels der Parasiten. Ebenso kommt es bei hoher Parasitenanzahl durch die Hämolyse, den verstärkten Abbau im RES und die Zytokin-bedingte Dämpfung der Erythropoese (bes. durch TNF-α) zu einer Anämie.
Darüber hinaus bestehen zwischen P. falciparum und den anderen Malariaerregern wichtige pathogenetische Unterschiede.
In den Erythrozyten produziert der Trophozoit Proteine, wie z.B. PfEMP1 (Plasmodium falciparum infected erythrocyte membrane protein 1), welches eine Bindung der infizierten Blutkörperchen an das Endothel der Blutgefäße bewirkt. Die damit verbundenen Mikrozirkulationsstörungen erklären zumindest teilweise den deutlich schwereren Verlauf der durch P. falciparum hervorgerufenen Malaria tropica. Dies hat im zentralen Nervensystem besonders dramatische Auswirkungen und die häufigen zentralen Komplikationen (Infarkte) der Malaria tropica zur Folge. Besonders kleine Kinder können in ein lebensbedrohliches Koma verfallen (cerebrale Malaria).
Die übrigen Plasmodienarten besitzen diese Eigenschaft nicht und sind daher weniger gefährlich. P. malariae unterscheidet sich von den anderen humanpathogenen Plasmodien dadurch, dass es vereinzelt auch andere höhere Primaten befällt.
Klinik: Auf Grund des unterschiedlichen Verlaufs der Erkrankung kann zwischen der Malaria tropica, der Malaria tertiana und der Malaria quartana unterschieden werden. Die durch Plasmodium falciparum ausgelöste Malaria tropica ist dabei die schwerste Verlaufsform der Malaria.
Malaria tropica
Die Malaria tropica wird durch den Erreger P. falciparum verursacht und ist die schwerste Verlaufsform der Malaria. Charakteristisch für die Malaria tropica sind die hohe Parasitämie, die teils ausgeprägte Anämie und die häufigen neurologischen Komplikationen. Es kann ein rhythmischer Fieberverlauf vorliegen. Ein Fehlen der Fieberrhythmik ist jedoch kein Ausschlusskriterium einer Malaria tropica.
Inkubationszeit: Zwischen dem Stich der Anopheles-Mücke und dem Krankheitsausbruch liegen im Mittel zwölf Tage. Erheblich kürzere Zeitintervalle treten bei einer Infektion mit erregerhaltigem Blut auf. Längere Inkubationszeiten sind unter Einnahme einer unzureichenden Chemoprophylaxe möglich.
Fieber: Das typische wechselnde Fieber mit Schüttelfrost beim Fieberanstieg und Schweißausbrüchen bei Entfieberung, wie es bei anderen Malariaformen auftritt, wird bei der Malaria tropica in der Regel nicht beobachtet. Daher kann man eine Malaria, insbesondere eine Malaria tropica nicht allein aufgrund der Tatsache ausschließen, dass keine typische Fieberrhythmik vorliegt. Ein hohes Fieber über 39,5°C tritt häufig bei Kindern auf und ist als prognostisch ungünstig zu beurteilen. Häufig kommt es zu zentralen Komplikationen und Koma.
Neurologische Komplikationen: Bewusstseinsstörungen, die bis zum Koma reichen können, stellen eine typische Komplikation der Malaria tropica dar. Dabei sind plötzliche Wechsel der Bewusstseinslage ohne Vorzeichen durchaus möglich. Es kann auch zu einer langsamen Eintrübung des Patienten kommen. Im Rahmen einer zerebralen Malaria können auch neurologische Herdsymptome wie Lähmungen und Krampfanfälle auftreten. Die normale neurologische Diagnostik führt hier kaum zu einer adäquaten Diagnose. Eine hohe Parasitenzahl im Blut dient als entscheidender Hinweis.
Bei Schwangeren und Kindern können Hypoglykämien auftreten, die allein oder mit der zentralen Problematik zum Koma führen.
Anämie: Anämien treten häufig bei schweren Infektionen auf. Eine besondere Risikogruppe für schwere Anämien stellen Säuglinge und Kleinkinder dar. Meist handelt es sich um eine hämolytische Anämie durch Zerstörung roter Blutkörperchen. Wie oben erwähnt besitzt auch die Hemmung der Erythropoese eine gewisse Bedeutung. Die Schwere der Anämie korreliert stark mit dem Ausmaß des Parasitenbefalls.
Hämoglobinurie: Der durch die massive Hämolyse angestiegene Hämoglobin-Spiegel im Blut führt zu einer Hämoglobinurie, die zu einem akuten Nierenversagen führen kann.
Veränderungen an anderen Organsystemen: Im Laufe der Erkrankung kann es zu einer Splenomegalie kommen. In seltenen Fällen führt das Gewebswachstum zu einer Spannung der Kapsel, so dass diese leicht einreißen kann (Milzruptur). Den Magen-Darm-Trakt betreffende Symptome wie Durchfälle sind häufig und differentialdiagnostisch von Bedeutung, da sie bei fehlendem oder schwach ausgeprägtem Fieber zur falschen Diagnose bakterielle Enteritis führen können.
In bis zu zehn Prozent der Fälle kann eine Lungenbeteiligung auftreten, die von leichten Symptomen bis zu einem Lungenödem reichen kann.
Nicht selten kommt es durch eine Durchblutungsstörung der Niere zu einem akuten Nierenversagen. Nach ausgeheilter Infektion erholt sich die Niere meist.
Malaria tertiana
Die Malaria tertiana wird durch die Erreger P. vivax oder P. ovale verursacht. Sie ist eine der gutartigen Verlaufsformen der Malariaerkrankung. Es treten im Vergleich zur Malaria tropica kaum Komplikationen auf. Das Hauptproblem besteht darin, die unspezifischen Vorsymptome von der bösartigen Malaria tropica abzugrenzen. Dies gelingt meist nur in der mikroskopischen Diagnostik.
Inkubationszeit: Die Inkubationszeit beträgt zwischen 12 und 18 Tagen, kann aber auch mehrere Monate dauern, wenn der Verlauf der Infektion durch die Chemoprophylaxe verlangsamt wird.
Fieber: Nach einer unspezifischen Prodromalphase von wenigen Tagen stellt sich normalerweise die typische Dreitagesrhythmik ein, die der Malaria tertiana ihren Namen gab. Zwischen zwei Fiebertagen liegt in der Regel ein fieberfreier Tag.
Die Fieberattacken gehorchen meist folgendem Schema:
- Froststadium (1 Stunde): Der Patient leidet unter Schüttelfrost und dem subjektivem Gefühl starker Kälte. In dieser Phase steigt die Temperatur steil an.
- Hitzestadium (4 Stunden): Die Haut brennt häufig quälend. Es treten schwere Übelkeit und Erbrechen auf. Die Temperatur kann über 40 °C betragen.
- Schweißstadium (3 Stunden): Unter starkem Schwitzen sinkt die Temperatur bis zum Normalwert von 37 °C.
Wie bei allen anderen Malariaformen gilt auch hier, dass das Fehlen der Fieberrhythmik keineswegs ausreicht, um die Krankheit auszuschließen.
Rezidive: Wie schon oben erwähnt, bilden sich im Lebenszyklus von P. vivax und P. ovale Ruheformen, die so genannten Hypnozoiten, aus. Sie können der Anlass dafür sein, dass es nach einer Ruhephase von Monaten bis Jahren zum erneuten Ausbruch der Krankheit kommt. Diesem muss nicht unbedingt eine anamnestisch bekannte Malariaerkrankung vorausgehen. Die Rezidive sind besonders tückisch, da oft weder vom Patient noch vom Arzt ein Zusammenhang zur Malaria hergestellt wird. Sie können jedoch in der Regel durch medikamentöse Maßnahmen (in erster Linie unter Einsatz von Primaquin) langfristig unterbunden werden.
Malaria quartana
Die Malaria quartana wird durch den Erreger P. malariae verursacht. Auch hier handelt es sich um eine benigne Form der Malaria. Eine charakteristische Komplikation ist das nephrotische Syndrom. Besonders an dieser Form ist, dass es selbst nach einer sehr langen Zeit (>50 Jahre) noch zu Rezidiven kommen kann. Auch die Inkubationszeit ist erheblich länger als bei den beiden anderen Formen.
Inkubationszeit: Die Inkubationszeit beträgt zwischen 16 und 50 Tagen. Somit ist sie erheblich länger als bei den übrigen Krankheitsformen.
Fieber: Die Prodromalphase ist genauso unspezifisch wie die der Malaria tertiana. Schon nach wenigen Tagen stellt sich die Vier-Tages-Rhythmik ein. Zwischen zwei Fiebertagen liegen zwei fieberfreie Tage. Die Stadienabfolge (Frost-Hitze-Schweiß) am Fiebertag entspricht der Malaria tertiana. Auch hier gilt: fehlende Fieberrhythmik schließt die Diagnose Malaria nicht aus.
Nierenbeteiligung:
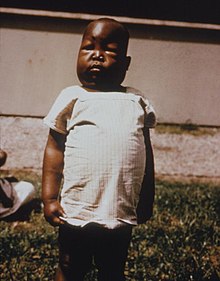
Im Verlauf der Malaria quartana kann es zu einer schweren Nierenbeteiligung kommen. Diese wird unter anderem als Malarianephrose bezeichnet. Es handelt sich hierbei um ein nephrotisches Syndrom mit erniedrigtem S-Albumin mit Ödemen und Aszites und erhöhtem Serumcholesterin. Epidemiologische Studien haben gezeigt, dass diese Komplikation gehäuft bei Kindern zwischen zwei und zehn Jahren im tropischen Afrika auftritt.
Rezidive: Das besondere an diesem Plasmodium sind die Rezidive nach besonders langem krankheitsfreiem Intervall (mehrere Jahre). Rezidive nach Krankheitsfreiheit von mehr als 50 Jahren wurden beschrieben. Die Rezidive kommen aber hier nicht durch Hypnozoiten in der Leber zustande (es gibt keine Hypnozoitformen des P. malariae), sondern durch eine fortdauernde subklinische Parasitämie. Diese ist so gering, dass er mikroskopisch meist nicht nachgewiesen werden kann. Dies ist besonders in der Transfusionsmedizin in Endemiegebieten von großer klinischer Bedeutung, da es auch bei negativ getestetem Spender zu einer Malariaübertragung kommen kann. Rezidive können jedoch in der Regel durch medikamentöse Maßnahmen langfristig unterbunden werden.
Malaria-Diagnostik: Die Diagnose Malaria sollte mit Hilfe labordiagnostischer Methoden abgesichert werden. Die in der Praxis wichtigste und kostengünstigste Methode bei Malariaverdacht ist die mikroskopische Untersuchung von normalen (Dünner Tropfen, Blutausstrich) bis zu 10-fach angereicherten Blutausstrichen (Dicker Tropfen) unter Verwendung der Giemsa-Färbung auf Plasmodien. Der Blutausstrcih hat den Vorteil, dass man sofort eine Diagnose stellen kann, der dicke Tropfen hat hingegen eine 10fach höhere Sensitivität, braucht aber etwas Zeit.
Eine Differenzierung der vier Plasmodien-Arten ist anhand morphologischer Kriterien möglich. Die ermittelte Parasiten- und Leukozytenzahl ist ein Maß der Schwere der Erkrankung. Ein negatives Ergebnis der mikroskopischen Untersuchung kann auf Grund der geringen Sensitivität dieser Methode eine Malaria jedoch nicht ausschließen.
Alternativ können die Erreger der Malaria immunologisch und molekularbiologisch nachgewiesen werden. Die zur Verfügung stehenden Malaria-Schnelltests (z.B. ICT Malaria P.F.®-Test, OptiMal®-Test) beruhen auf dem Nachweis parasitenspezifischer Antigene. Ein negatives Ergebnis kann jedoch auch bei diesen Tests eine Malaria nicht ausschließen. Das mit Abstand sensitivste Verfahren für die Malaria-Diagnostik ist die Polymerasekettenreaktion (PCR). Sie ist jedoch auf Grund des hohen Material- und Zeitaufwands für den Akutfall wenig geeignet.
Therapie: Seit dem 17. Jahrhundert wird die Chinarinde und das daraus gewonnene Chinin zur Therapie der Malaria verwendet - die Legende besagt, dass britische Kolonialisten daher regelmäßig stark chininhaltiges Tonic Water tranken und um den damals sehr bitteren Geschmack zu verbessern oft dieses mit Gin mischten und so den Gin Tonic erfanden. Seit Mitte des 20. Jahrhunderts hat sich die Anzahl der Therapiemöglichkeiten vervielfacht und es besteht die Möglichkeit einer medikamentösen Vorbeugung (Chemoprophylaxe). (s.u.)
Individualprophylaxe:
- Imfung: Es gibt zur Zeit noch keine Imfung gegen Malaria. Der beste Schutz ist der Verzicht auf Reisen in Gebiete, in denen Malaria übertragen wird (Endemiegebiete).
- Expositionsprophylaxe: Die Vermeidung von Insektenstichen ist das wichtigste Element der Malariavorbeugung in Endemiegebieten. Dazu zählt das Tragen hautbedeckender, langer Kleidung, der Aufenthalt in mückensicheren Räumen (insbesondere nachts; Klimaanlage, Fliegengitter, Moskitonetz) sowie die Behandlung von Haut und Kleidung mit moskitoabweisenden Mitteln, sog. Repellents (z.B. Autan®, DEET). Die zusätzliche Verwendung von Insektiziden in Sprays (allen voran Pyrethroide), Verdampfern, Räucherspiralen („mosquito coils“) und ähnlichem kann zusätzlichen Schutz bieten.
- Chemoprophylaxe und Stand-By-Therapie: Zusätzlich sollte durch vorbeugende Einnahme (Chemoprophylaxe) oder Mitführen (Stand-By-Therapie) von Malaria-Medikamenten das Risiko an einer schweren Malaria zu erkranken verringert werden. Siehe auch Empfehlungen der Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e.V.. Allerdings ist die Chemoprophylaxe ein zweischneidiges Schwert, da dadurch auch zunehmend resistente Plasmodien in den Endemiegebieten herangezüchtet werden und im Krankheitsfalle u.U. keine adäquate Therapie mehr möglich ist.
Das größte Problem bei der medikamentösen Vorbeugung und Behandlung ist eine zunehmende Resistenz des Erregers. Die Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e.V. empfiehlt derzeit (Stand 2005):
- in Gebieten mit hohem Malariarisiko und bekannter Chloroquin- und Mefloquin-Resistenz (z.B. Goldenes Dreieck): Aufenthalt >7 Tage: Prophylaxe mit Atovaquon-Proguanil oder Doxycyclin. Aufenthalt ≤7 Tage: Keine Prophylaxe, bei Erkrankung Notfalltherapie mit Artemether-Lumefantrin oder Atovaquon-Proguanil.
- in Gebieten mit hohem Malariarisiko und bekannter Chloroquinresistenz (z.B. Hochrisikogebiete Afrikas, Papua-Neuguinea, Salomonen, Brasilien (Bundesstaaten Rondônia, Roraima und Amapá)): Prophylaxe mit Atovaquon-Proguanil, Doxycyclin oder Mefloquin. Die im Jahr 2003 erschienene Allmalpro-Studie konnte bei der Chemoprophylaxe eine bessere Verträglichkeit von Atovaquon-Proguanil und Doxycyclin im Vergleich zu Mefloquin belegen.
- in Gebieten mit geringem Malariarisiko und bekannter Chloroquin- und Mefloquinresistenz (z.B. Südost-Asien ohne Hochrisikogebiete): Keine Prophylaxe, bei Erkrankung Notfalltherapie mit Artemether-Lumefantrin oder Atovaquon-Proguanil.
- in Gebieten mit geringem Malariarisiko und bekannter Chloroquinresistenz (z.B. Brasilien ohne Hochrisikogebiete, China, Taiwan, Vanuatu, Arabische Halbinsel, Indien, Irak, Iran, Afghanistan, Pakistan, Bangladesh, Sri Lanka, Indonesien, Philippinen): Keine Prophylaxe, bei Erkrankung Notfalltherapie mit Artemether-Lumefantrin, Atovaquon-Proguanil oder Mefloquin
- in Gebieten mit geringem Malariarisiko ohne bekannte Resistenzen (z.B. Mittelamerika, Haiti, Dominikanische Republik): Keine Prophylaxe, bei Erkrankung Notfalltherapie mit Chloroquin
Wirkstoffe: Neben den bereits genannten Substanzen stehen Chinin (zur Therapie, insbesondere bei der komplizierten Malaria tropica), Primaquin (Therapie der Malaria tertiana oder Malaria quartana; beugt Rezidiven vor; Verwendung zur Prophylaxe nur in Ausnahmefällen) und Proguanil (Prophylaxe; meist in Kombination mit Chloroquin; Verwendung nur noch in Ausnahmefällen) zur Verfügung. Vor allem in China, Südostasien und Afrika werden Artemisinin-haltige Präparate (einschließliche deren Abkömmlinge Artemether, Artesunat, Arteflene, Artemotil, Dihydroartemisinin und Arteether) eingesetzt. Diese im Rahmen einer Kombinationstherapie (Artemisinin-based combination therapy) eingesetzten Präparate werden von der WHO als Mittel der ersten Wahl für die Akutbehandlung der Malaria empfohlen. Artesunat wird seit neuestem auch von der AG Malaria der Paul-Ehrlich-Gesellschaft als Mittel der ersten Wahl zur Therapie der komplizierten Malaria tropica empfohlen. Die Stand-By-Therapeutika Halofantrin und Amodiaquin wurden in Europa wegen schwerer Nebenwirkungen mittlerweile vom Markt genommen, sind jedoch noch vereinzelt in Malariagebieten als Notfallmedikamente verfügbar. Halofantrin wurde mit Herzrhythmusstörungen in Verbindung gebracht, während unter der Therapie mit Amodiaquin vermehrt Leberschäden und Blutbildschäden (Agranulozytose, aplastische Anämie) auftraten. Insbesondere in Endemiegebieten ist die Kombination von Sulfadoxin-Pyrimethamin, die sowohl zur Therapie als auch zur Prophylaxe für einheimische schwangere Frauen in Endemiegebieten als „intermittent Preventive Treatment“ (IPT) angewendet wird, verfügbar. Diese Arzneistoffkombination wurde jedoch in Deutschland auf Grund schwerer Hautreaktionen (Stevens-Johnson-Syndrom) vom Markt genommen. Für weitere Details konsultiere man die Empfehlungen von Tropenmedizinern.
Vektorkontrolle: Als Vektorkontrolle (Bekämpfung des Überträgers) bezeichnet man den Versuch, Neuinfektionen durch gezielte Bekämpfung der Anopheles-Mücke zu verhindern. Zu diesem Zweck werden Insektizide in den Wohnstätten der Menschen versprüht oder es wird die Verwendung von insektizidimprägnierten Bettnetzen (IIB) propagiert.
In den 1950er und 1960er Jahren wurde unter Federführung der WHO versucht, die Malaria auszurotten. Ein wichtiger Bestandteil der Kampagne war das Besprühen der Innenwände aller Wohnungen und Häuser mit DDT. Nach anfänglichen Erfolgen wurde das Projekt Anfang der 1970er Jahre eingestellt, unter anderem weil durch die Selektion nur noch DDT-resistente Anopheles-Mücken überlebten und rasch vermehrten.
Der Einsatz von DDT in Wohnhäusern wird auch heute noch für vertretbar erachtet, da es dem Menschen sicher weniger schadet als dies eine Malaria-Infektion täte. Negative Auswirkungen auf die Umwelt sind wegen der im Vergleich zur Landwirtschaft geringen Aufwandmengen nicht zu befürchten. Vor einem Einsatz von DDT oder anderen Insektiziden sollte immer die Resistenzsituation der Anopheles-Mücken im betreffenden Gebiet geprüft werden. Heute ist die Herstellung und Verwendung von DDT weltweit nur noch zum Zwecke der Bekämpfung von Krankheitsüberträgern zugelassen.
Forschung und Ausblicke:Die Basensequenzen in den Genomen von P. falciparum und Anopheles gambiae wurden im Herbst 2002 vollständig entschlüsselt. Etwa zeitgleich wurden neue Malariatherapeutika, wie z.B. Atovaquon, Lumefantrin und die vom Naturstoff Artemisinin abgeleiten Artesunat und Artemether, auf den Markt gebracht. Erste Erfolg versprechende Ergebnisse der Behandlung Malariakranker mit Tafenoquin und dem Antibiotikum Fosmidomycin wurden ebenso vorgestellt.
Versuche, einen weltweit wirkenden Impfstoff gegen die Malaria zu entwickeln, schlugen trotz einiger anfänglicher Erfolge bisher fehl. Das größte Problem bei der Entwicklung eines wirksamen Impfstoffes ist die hohe Variabilität der Malaria-Antigene. Eine neue Hoffnung versprechen entschärfte lebende Erreger, denen das Gen UIS3 eliminiert wurde. Diese Sporozoiten wurden Mäusen gespritzt, wobei keinerlei Plasmodienformen entstanden, die von dem symptomlosen Leberstadium in die roten Blutkörperchen wechseln konnten. Das Ergebnis der Immunreaktion war eindrucksvoll. Keine einzige geimpfte Maus steckte sich nach einer Infektion mit normalen Plasmodien an, während in der Kontrollgruppe alle erkrankten.[5] Ein weiterer aussichtsreicher Kandidat ist RTS,S, der eine immunstimulierende Komponente eines Proteins des Hepatitis-B-Virus (RTS) mit einem Oberflächenprotein aus Sporozoiten (S) des P. falciparum trägt. Dadurch wird die - noch nicht vollständige - Immunantwort in einem frühen Stadium, das noch keine Krankheitssymptome hervorbringt, ausgelöst. Für einen kompletten Immunschutz ist geplant, den Impfstoff mit weiteren Antigenen des Malaria-Erregers zu kombinieren.[6] Ein interessanter alternativer Therapieansatz dürfte die Verwendung eines Antikörpers gegen Plasmodien sein.
Eine weitere Möglichkeit der Bekämpfung der Malaria ist die Ausrottung der Anopheles-Mücke. Der Versuch der Ausrottung der Anopheles-Mücken mit Hilfe von DDT wurde in den 1970er Jahren abgebrochen. Mit Hilfe anderer Insektizide, wie z.B. das pflanzliche Pyrethrum aus Chrysanthemenblüten, konnten nur örtlich und zeitlich begrenzte Teilerfolge erreicht werden. Ein hoffnungsvoller neuer Ansatz ist der Einsatz des biogenen Insektizids Bti bestehend aus dem Bacillus thuringiensis israeliensis. Dieses biologische Präparat, das über Züchtung millionenfach im Labor hergestellt werden kann, ist gegenüber Stechmücken ein erprobtes, hochwirksames Präparat, das bei richtiger Anwendung "Nicht-Ziel-Organismen" weitgehend schont. Bti wird in kristalliner Form in die aquatilen Lebensräume von Stechmücken ausgebracht. Die Anopheles-Larven nehmen die Bakterien bei der Nahrungsaufnahme in ihren Körper auf. Im Darm der Mücken schlüpfen die Bakterien aus ihrer schützenden Eiweißhülle und zerstören in kurzer Zeit durch die Bildung von Delta-Endotoxinen das Darmlumen und die Darmwände ihrer Wirtstiere. Die Stechmückenlarven stellen daraufhin ihre Nahrungsaufnahme ein und gehen noch im Larvalstadium zugrunde. Bti wird kommerziell angeboten. Das Insektizid ist in flüssiger, Tabletten-, Pulver- und in Granulatform erhältlich. Für den großflächigen Einsatz im Freiland hat sich die Verwendung von Granulat bewährt. Bei starker Durchseuchung der Gewässer wird die Ausbringung des Granulats durch Hubschrauber praktiziert.
Außerdem forscht die gemeinsame Abteilung der IAEA und FAO an einer neuartigen Methode zur Ausrottung der Anopheles-Mücke. In diesem Zusammenhang wird die Aussetzung steriler oder genetisch modifizierter Anopheles-Mücken diskutiert (Sterile Insect Technology).
Sozialmedizinische und epidemiologische Aspekte: Die Malaria wird auch als armutsbedingte Krankheit bezeichnet. Hinter dieser Bezeichnung steht das Kalkül, dass von der Krankheit hauptsächlich arme Menschen betroffen sind, die über wenig Kaufkraft verfügen und folglich keinen attraktiven Markt bilden. Für Pharmaunternehmen ist es daher ökonomisch sinnvoller, Mittel gegen medizinisch weniger "dringende" Krankheiten zu erforschen, deren Betroffene kaufkräftiger sind.
Norbert Blüm schreibt dazu in der Süddeutschen Zeitung vom 7. Oktober 2003: "Die Pharmaindustrie gibt weltweit doppelt so viel Forschungsmittel im Kampf gegen Haarausfall und Erektionsschwächen aus wie gegen Malaria, Gelbfieber und Bilharziose. Das ist marktwirtschaftlich konsequent, denn die Kunden mit Erektionsschwächen und Haarausfall haben in der Regel mehr Kaufkraft als die Malaria- und Gelbfieberkranken."[7]
Die Europäische Union will als Reaktion auf diesen Mechanismus die Entwicklung von Mitteln gegen armutsbedingte Krankheiten mit 600 Millionen Euro fördern.[8]
Andererseits ist es fraglich, ob gerade für Regionen, in denen die Malaria wie die Armut verbreitet sind, die Bekämpfung der Malaria durch Entwicklung eines Impfstoffes im Vordergrund stehen sollte. Der Parasitologe Paul Prociv weist darauf hin, dass Erwachsene in Malariagebieten durch ständige Reinfektion praktisch immun gegen die Krankheit sind. Vorrang hätte die Hebung der allgemeinen Gesundheitsfürsorge und Lebensumstände. Von einem Malariaimpfstoff würden hauptsächlich westliche Besucher der Tropen profitieren, die die Nebenwirkungen der herkömmlichen Malariavorsorge scheuen.[9]
Aufgrund der mangelnden finanziellen Unterstützung gab der reichste Mann der Welt, Bill Gates, Ende Oktober 2005 bekannt, dass er zur Förderung der Malariaforschung eine Summe von 258,3 Millionen Dollar zur Verfügung stellen werde. Seiner Meinung nach stelle "es für die Welt eine Schande dar, dass sich in den letzten 20 Jahren jene durch Malaria hervorgerufenen Todesfälle verdoppelten, zumal gegen jene Krankheit sehr stark vorgegangen werden könnte."[10]
Volkswirtschaftliche Auswirkung Nach dem Weltökonomen Prof. Dr. Jeffrey Sachs sind tropische Krankheiten, insbesondere aber Malaria, eine Hauptursache für die somit häufig unverschuldete wirtschaftliche Misere der ärmsten Länder der Erde: wo diese Krankheit wütet, also vor allem in den Tropen und Subtropen, herrscht auch Armut. So hatten Mitte der 1990er Jahre von Malaria heimgesuchte Länder ein durchschnittlichen Volkseinkommen von rund 1.500 Dollar pro Kopf, während nicht betroffene Länder mit durchschnittlich 8.200 Dollar über mehr als das Fünffache verfügten. Volkswirtschaften mit Malaria sind zwischen 1965 und 1990 durchschnittlich nur um 0,4 Prozent im Jahr gewachsen, die anderen dagegen um 2,3%. Der durch die Krankheit verursachte volkswirtschaftliche Schaden für Afrika allein wird umgerechnet auf rund 9,54 Milliarden Euro pro Jahr geschätzt.
Nach Studien von Sachs liegt die durch Malaria verursachte Lähmung der Volkswirtschaften der betroffenen Länder nicht nur an den direkten Kosten für Medikamente und medizinische Behandlung. In Ländern mit Malaria sterben die Menschen im Durchschnitt früher als andernorts, deshalb wird dort weniger in Bildung investiert. Die hohe Kindersterblichkeit führt wiederum zu steigenden Geburtenraten. Zudem meiden ausländische Investoren solche Länder ebenso wie Touristen und Handelsunternehmen.
Mittlerweile hat AIDS die ungünstige Situation für diese Länder noch dramatisch verschärft.
Historie: Die frühesten Berichte von Malariaepidemien sind uns von den Alten Ägyptern (u.a. aus dem Papyrus Ebers) erhalten. Aber auch in rund 3000 Jahre alten indischen Schriften taucht das Wechselfieber auf. Die Chinesen hatten vor über 2000 Jahren sogar schon ein Gegenmittel. Sie nutzten die Pflanze Qinghao, ein Beifuß-Gewächs. In der Neuzeit konnten Forscher tatsächlich einen wirksamen Stoff aus dieser Pflanze isolieren: das Artemisinin.
In der Antike verbreitete sich die Malaria rund um das Mittelmeer. Hippokrates erkannte, dass Menschen aus Sumpfgebieten besonders häufig betroffen waren, jedoch vermutete er, dass das Trinken von abgestandenem Sumpfwasser die Körpersäfte (vgl. Humoralpathologie) in ein Ungleichgewicht bringt. Von unsichtbaren Krankheitserregern wusste man damals noch nichts.
Auch das Römische Reich wurde regelmäßig von schweren Malariaepidemien heimgesucht. Einige Historiker gehen sogar davon aus, dass sie einen der entscheidenden Faktoren für den Untergang des Römischen Reiches darstellen. Erst unlängst wurde bei Rom ein Kindermassengrab mit über 50 Leichen entdeckt, das auf das Jahr 50 datiert wurde. Aus den Knochenresten dieser Kinderskelette konnte die DNA von P. falciparum isoliert werden.
Im Mittelalter bis zur Mitte des 20. Jahrhunderts war die Malaria nicht nur in Süd-, sonder auch in Mitteleuropa verbreitet. Zum Beispiel war es in Norddeutschland als Marschenfieber bekannt. Berühmte europäische Malariapatienten waren Friedrich Schiller und Oliver Cromwell. Erst durch die Trockenlegung von Sumpfgebieten und durch den systematischen Einsatz von Insektiziden konnte die Malaria in den 1960er Jahren in Europa ausgerottet werden.
Aus Nord- und Südamerika sind die ersten Malariafälle erst im 16. Jahrhundert dokumentiert. Man geht heute davon aus, dass sie durch die Europäer bzw. durch den von ihnen organisierten Sklavenhandel dort eingeschleppt worden ist. Doch ausgerechnet von dort kam ein Heilmittel, das heute noch Verwendung findet. Peruanische Arbeiter bekämpften Fieber erfolgreich mit der Rinde eines Baumes aus der Familie der Rötegewächse, zu denen auch die Kaffeepflanze gehört. Mitglieder des Jesuitenordens beobachteten diese Wirkung und brachten das Mittel in Pulverform erstmals 1640 nach Europa, wo es auch "Jesuitenpulver" genannt wurde. Der Baum wurde später als "Chinarinde" (Cinchonia) bekannt, das Medikament als "Chinin".
Chinin hat einen äußerst bitteren Geschmack und ist hellbraun bis beige. Es wird als Aromastoff für Tonicwater und Bitter Lemon verwendet. Bis heute hält sich die Legende, regelmäßiges Trinken von Gin Tonic schütze vor Malaria. Jedoch ist heutzutage die Chininkonzentration in einem Gin-Tonic-Drink viel zu gering.
Der Malariaerreger wurde am 6. November 1880 vom Franzosen Alphonse Laveran entdeckt, der in Constantine (Algerien) am Militärkrankenhaus arbeitete. Er erhielt dafür 1907 den Nobelpreis für Medizin.
Ronald Ross, Chirurg und General aus England, fand 17 Jahre später bei seiner Arbeit während des Baus des Sueskanals den Zusammenhang zwischen dem Malariaerreger und dem Stich der Anophelesmücke heraus und erhielt dafür nicht ganz unumstritten den Nobelpreis für Medizin 1902. Den Zusammenhang zwischen Mücken und Malaria hatten im übrigen schon die alten Ägypter 3000 v. Ch. erkannt. Sie wurde als Fluch der Götter bzw. des Nils angesehen.
In den 1950er Jahren begann die WHO das Global Eradication of Malaria Program. Neuansteckungen durch Mückenstiche sollten durch Besprühen der Innenwände der Häuser mit DDT-Lösung verhindert werden. Parallel dazu sollten die bereits Erkrankten mit Chloroquin behandelt werden, um auch die eigentlichen Erreger, die Plasmodien, zu bekämpfen.
Die Kampagne war zunächst äußerst erfolgreich. In Holland, Italien, Polen, Ungarn, Portugal, Spanien, Bulgarien, Rumänien und Jugoslawien wurde Malaria bis Ende der 1960er Jahre dauerhaft ausgerottet. In Europa waren allerdings nicht allein DDT, sondern auch die Trockenlegung von Feuchtgebieten, ein funktionierendes Abwassersystem und vor allem eine effiziente Gesundheitsfürsorge ausschlaggebend.
Auch in vielen Ländern Asiens sowie Süd- und Mittelamerikas konnte die Zahl der Neuansteckungen mit Malaria dramatisch gesenkt werden. Hier wurden häufig nach ersten Erfolgen Geld und medizinisches Personal aus den Anti-Malaria-Kampagnen abgezogen und anderweitig eingesetzt. Dadurch blieben neue Malariafälle unentdeckt oder konnten nicht ausreichend behandelt werden. Im Lauf der Jahre traten DDT-Resistenzen bei verschiedenen Arten der Anophelesmücke auf. Der notwendige Ersatz von DDT durch andere Insektizide wurde meist unterlassen, da diese um den Faktor 4 bis 10 teurer gewesen wären. Zudem waren auch die Plasmodien teilweise gegen Chloroquin resistent geworden.
In Indien konnte durch das Bekämpfungsprogramm die Zahl der jährlichen Malaria-Neuinfektionen von 100 Millionen (1952) auf 50.000 (1961) gesenkt werden. Zwischen 1961 und 1968 verdreifachten sich die Infektionsfälle in Indien wieder. Im Jahre 1970 wurden eine halbe Million Neuerkrankungen gezählt, 1977 erkrankten infolge einer Epidemie 30 Millionen Inder an Malaria.
Ein weiteres Beispiel ist Ceylon (Sri Lanka): 1948 waren dort 2,8 Millionen Menschen an Malaria erkrankt, weshalb sich die Regierung entschloss, ein DDT-Sprüh-Programm zu beginnen. Bis 1963 sank die Zahl der Malariaerkrankungen in Ceylon auf 17 Fälle. Man schloß daraus, dass die Krankheit besiegt sei und beendete das Versprühen von DDT. Ein Jahr danach zählte man schon 150 Fälle von Malaria und bis 1969 erhöhte sich die Zahl auf 2,5 Millionen Fälle jährlich. Durch die Wiederaufnahme des Sprühprogramms konnte die Zahl der Krankheitsfälle bis 1972 noch einmal auf 150.000 gesenkt werden. Trotz andauernden massiven DDT-Einsatzes erkrankten in Ceylon 1975 wieder etwa 400.000 Menschen an Malaria.
Die WHO stellte ihr Programm zur Ausrottung der Malaria 1972 offiziell als gescheitert ein.
Literatur und Weblinks:
Deutsche Werke:
- J. Knobloch, Malaria, Uni-Med, Bremen (2002); ISBN 3895996238
- Waldemar Malinowski, Impfungen für Auslandsreisende und Malariaprophylaxe, Wuv (2001); ISBN 3850765385
Englische Werke:
- D. Sullivan, S. Krishna, Malaria, Springer, Berlin (2005); ISBN 3540253637
- Peter Perlmann, Marita Troye-Blomberg, Malaria Immunology, Karger (2002); ISBN 3805573766
- D. Warrell, H. Gilles, Essential Malariology, Arnold, London (2002); ISBN 0340740647
Wissenschaftliche Publikationen:
- B.M. Greenwood, K. Bojang, C.J.M. Whitty, G.A.T. Targett: Malaria. The Lancet 365, S. 1487-1498 (2005)
- August Stich, Katja Fischer, Michael Lanzer: Eine Seuche auf dem Vormarsch: Die Überlebensstrategie des Malariaerregers, Biologie in unserer Zeit 30(4), S. 194 - 201 (2000); ISSN 0045-205X
- Jochen Wiesner, Regina Ortmann, Hassan Jomaa, Martin Schlitzer: Neue Antimalaria-Wirkstoffe, Angewandte Chemie 115(43), S. 5432 - 5451 (2003); ISSN 0044-8249
- I. Stock, Therapie der Malaria, Medizinische Monatsschrift für Pharmazeuten 27(8), S. 260 - 272 (2004); ISSN 0342-9601
- H. Idel, Malaria: Prophylaxe und reisemedizinische Bedeutung, Bundesgesundheitsblatt 42(5), S. 402 - 407 (1999); ISSN 1436-990
- Helge Kampen, Vektor-übertragene Infektionskrankheiten auf dem Vormarsch? Wie Umweltveränderungen Krankheitsüberträgern und -erregern den Weg bereiten, Naturwissenschaftliche Rundschau 58(4), S. 181 - 189 (2005); ISSN 0028-1050
- Margot Kathrin Dalitz, Autochthone Malaria im mitteldeutschen Raum, Dissertation, Martin-Luther-Universität Halle-Wittenberg (2005) Web
Weblinks:
- RKI - Malaria
- AWMF - Diagnostik und Therapie der Malaria (Nov 2005)
- http://www.dtg.org/1.0.html - Empfehlungen zur Malariaprophylaxe
- http://www.who.int/malaria/docs/TreatmentGuidelines2006.pdf
- http://www.meb.uni-bonn.de/hygiene/malaria - Malariaverbreitung mit spezifischen Länderinformationen
- http://plasmodb.org/ - Genomdatenbank der Plasmodien
- http://sites.huji.ac.il/malaria/ - Biochemie der Plasmodien
- http://www.sueddeutsche.de/wissen/artikel/92/45047 - SZ über Artemisia annua
- http://www.gigers.com/matthias/malaria/history.htm - Geschichte der Malaria und historische Behandlungsmethoden
- http://e-learning.studmed.unibe.ch/Malaria
Quellen
[Bearbeiten]- ↑ Carlton JM et al. “Draft genome sequence of the sexually transmitted pathogen Trichomonas vaginalis”. Science, 315(5809):207-12, Jan 12 2007. DOI:10.1126/science.1132894. PMID:17218520
- ↑ McClelland RS et al. “Infection with Trichomonas vaginalis Increases the Risk of HIV-1 Acquisition”. J Infect Dis, 195(5):698-702, Mar 1 2007 Epub 2007 Jan 22. DOI:10.1086/427262. PMID:17262712 PDF
- ↑ Cherenet T, Sani RA, Panandam JM, Nadzr S, Speybroeck N, van den Bossche P.: Seasonal prevalence of bovine trypanosomosis in a tsetse-infested zone and a tsetse-free zone of the Amhara Region, north-west Ethiopia. Onderstepoort J Vet Res. 2004 Dec;71(4):307-12.
- ↑ Taylor S et al. “A Secreted Serine-Threonine Kinase Determines Virulence in the Eukaryotic Pathogen Toxoplasma gondii”. Science, 314(5806):1776-80, Dec 15 2006. DOI:10.1126/science.1133643. PMID:17170305 - . “Pathogenität von Toxoplasma gondii geklärt”. Deutsches Ärzteblatt, Dez 15 2006.
- ↑ Spektrum der Wissenschaft 5/2005, S. 20 ff.: Neue Hoffnung auf Malaria-Impfstoff.
- ↑ Spektrum der Wissenschaft 1/2006, S. 10: Endlich ein Malaria-Impfstoff?.
- ↑ http://www.sueddeutsche.de/deutschland/artikel/188/19169/
- ↑ Pressemitteilung der EU-Kommission vom 31. Juli 2003
- ↑ http://www.indian-skeptic.org/tmp/malaria.html
- ↑ http://www.stock-world.de/news/article.m?news_id=1900758

