Organische Chemie für Schüler/ Vertiefung
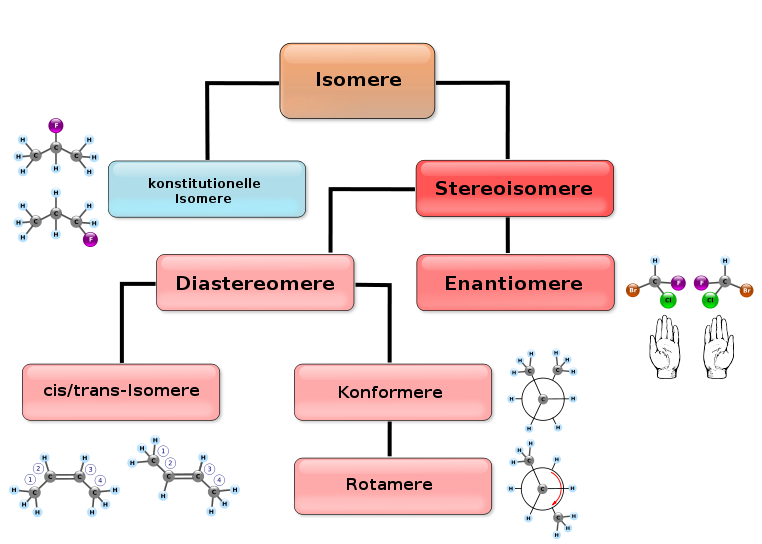
Weitere Isomerieformen
[Bearbeiten]Man unterscheidet zwischen zwei Arten von Isomerie: Struktur- (bzw. Konstitutionsisomerie) und Stereoisomerie:
Konstitutionsisomerie
[Bearbeiten]
|
|
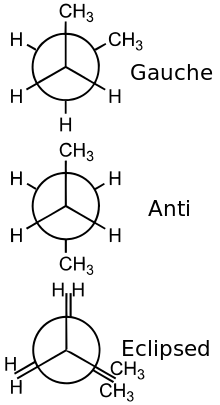
Stereoisomerie
[Bearbeiten] |

|
| cis-2-Penten | trans-2-Penten |
 |

|
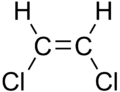
| cis-1,2-Dichloroethen | trans-1,2-Dichloroethen |
 |

|
| cis-Butendisäure (Maleinsäure) |
trans-Butendisäure (Fumarsäure) |
| (S)-Weinsäure (D-(−)-Weinsäure) |
(R)-Weinsäure (L-(+)-Weinsäure) |
meso-Weinsäure |
|---|---|---|

|

| |
|
DL-Weinsäure (racemisch) | ||

- Zusatzinformationen
Zwischenmolekulare Kräfte beeinflussen Schmelz- und Siedepunkte
[Bearbeiten]- a) Allgemeine Vorgänge beim Schmelzen und Sieden
Im Anfangsunterricht Chemie des ersten Jahres hast Du gelernt dass alle Stoffe aus winzigen Atomen oder Molekülen bestehen, welche ständig zittern. Diese Brown’sche Molekularbewegung. ist von der Temperatur abhängig. Die folgende Skizze verdeutlicht noch einmal, was passiert, wenn man gefrorenes Wasser bis zum Sieden kocht.
Mit anderen Worten: Wird der Schmelzpunkt (=Smp) überschritten, lösen sich die Teilchen vom Eisblock ab, weil sie sich zu stark bewegen und sich nicht mehr gegenseitig stark genug anziehen. Der Feststoff schmilzt. Bei weiterer Erwärmung benötigen die Teilchen immer mehr Platz, bis sie schließlich am Siedepunkt (=Sdp) in die Gasphase übergehen (dort ist noch genügend Platz vorhanden).
Der Schmelz- und der Siedepunkt sind demzufolge eine Stoffeigenschaft, die von den Kräften zwischen den Atomen bzw. den Zwischenmolekularen Kräften abhängig ist. Jeder Stoff hat andere Schmelz- und Siedepunkte. Man kann dadurch Stoffe erkennen und zuordnen:
| Wasser | Alkohol | Eisen | Zink | Quecksilber | Helium | Wasserstoff | Sauerstoff | |
|---|---|---|---|---|---|---|---|---|
| Smp. | 0°C | -117°C | 1535°C | 419°C | -39°C | -272°C | -259°C | -219°C |
| Sdp. | 100°C | 79°C | 2870°C | 906°C | 357°C | -269°C | -253°C | -183°C |
- b) Mögliche Kräfte zwischen Molekülen
Im dritten Jahr Chemieunterricht hast gelernt, welche verschiedenen Arten der zwischenmolekularen Kräfte es gibt. Hier eine kurze Wiederholung.
Ionenladungen
[Bearbeiten]Positive und negative Ionen ziehen sich stark an. Demzufolge haben ionogene Verbindungen auch die höchsten Schmelz- und Siedepunkte
Dipol-Dipol-Kräfte
[Bearbeiten]Dipole sind schwache Ladungen innerhalb von Molekülen und kommen durch ungleiche Ladungsverteilungen zustande. Diese ungleichen Ladungsverteilungen haben ihre Ursache in den verschiedenen Elektronegativitäten der Elemente. Dipolmoleküle bilden lockere Verbände - so genannte Molekülaggregate. Die Anziehungskräfte zwischen Dipolen sind viel geringer als die zwischen Ionen und wirken nur über kurze Entfernungen.
Bsp.: CO2 hat eine mehr als doppelt so hohen Molekülmasse wie H2O. Sein Siedepunkt liegt bei -78°C. Also müsste Wasser unterhalb (!) dieser Temperatur bereits Sieden. Da die Moleküle des Wassers aber wunderbare Dipolmoleküle sind, die sich gegenseitig prima anziehen, muss wesentlich mehr Energie zum Sieden des Wassers aufgebracht werden. Es muss also demzufolge mehr Energie aufgebracht werden, diesen „Zusammenhalt“ zu spalten, damit die Moleküle in die Gasphase übertreten können. Puh, noch mal Glück gehabt, weil sonst garantiert kein Leben auf Wasserbasis entstanden wäre ;-)
Liegen Dipol-Dipol-Wechselwirkungen vor, so erhöhen sich Schmelz- und Siedepunkt.
Wasserstoffbrückenbindungen (=WBBs)
[Bearbeiten]

Zwischen den Wasserstoffatomen und freien Elektronenpaaren bilden sich so genannte Wasserstoffbrückenbindungen. Sie führen zu einer schwachen Anziehung zwischen den Molekülen.
WBBs bilden sich beispielsweise auch zwischen Wasserstoff und Stickstoff oder Halogenmolekülen.
Van der Waalskräfte (VdW-Kräfte)
[Bearbeiten]Die Ladungen einer Atombindung in Molekülen sind wegen der Bewegung der Elektronen nicht in jedem Moment symmetrisch verteilt. Dadurch entstehen momentane, kurzzeitige Dipole, die allerdings nur sehr schwach sind und auch schnell wieder verschwinden, bzw. sich verschieben.
Sie treten nur bei Atomen und apolaren Molekülen auf. (Zum Vergleich: WBBs sind permanente Dipole).
- Die Stärke der VdW-Kräfte hängt ab von
- Anzahl der e- im Atom. Je mehr e- vorhanden sind, desto stärker kann die asymmetrische Verteilung sein, desto stärker sind folglich die Dipole.
- Zahl der Atome im Molekül (je höher die Molekülmasse, desto stärker die VdW-Kräfte)
- Zahl der Berührungsstellen zwischen zwei (oder mehr) Molekülen
- Das Zustandekommen von Van-der-Waals-Bindung ist sehr vom Abstand der Moleküle abhängig. Zwei Atome beziehungsweise Moleküle müssen sich also sehr nahe kommen, bevor es zu einer Wechselwirkung kommt.
- Diese Annäherung ist umso schwieriger, je verzweigter die Moleküle sind.
Warum liegen bei längeren Alkanketten höhere Siedepunkte vor?
[Bearbeiten]Da Alkane weder Ionenbindungen, Dipol-Dipol-Bindungen noch WBBs ausbilden, nehmen nur die VdW-Kräfte Einfluss auf ihren Siedepunkt.
Wie man leicht sieht, besteht bei langkettigen Molekülen auch verstärkt die Möglichkeit VdW-Bindungen auszubilden. Sie sind zwar nur kurzzeitig, haben aber dennoch Einfluss auf Schmelz- und Siedepunkte.
- Abstufung der verschiedenen Bindungsenergien zwischen Atomen
- Van der Waals-Kräfte < Dipol-Dipol-Kräfte < WBB < Ionenbindung < Atombindung
- Zunahme der Bindungsenergie
- Zunahme der Bindungsstärke
Bedenke: Je stärker die Bindung zwischen Atomen oder Molekülen ist, desto mehr Energie wird benötigt, diese Bindung wieder aufzuspalten.
Bei der Bildung einer Bindung ist es genau umgekehrt. Der entsprechende Betrag Energie wird bei der Bindungsbildung frei.
- Aufgaben
- a) Wo liegen stärkere zwischenmolekulare Kräfte vor: H2S oder H2O? b) Wie kannst Du Deine Feststellung beweisen?
- Erkläre die unterschiedlichen Schmelz- und Siedepunkte von n-Butan und iso-Butan.
- Welcher Zusammenhang besteht zwischen Viskosität und Van der Waals Kräften?
- Aceton hat eine Viskosität von nur 0,33. Kannst Du Ursachen erkennen, die mit seinem Aufbau zu tun haben?
- Erkläre mit Hilfe von Zeichnungen Van der Waals-Kräfte und ihre Wirkung besonders auf Flüssigkeiten langkettiger Kohlenwasserstoffe
- Zusatzinformationen
Van-der-Waals-Bindung Johannes Diderik van der Waals Wasserstoffbrückenbindung Dipol-Dipol-Kräfte
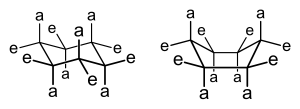
Mehr zum Cyclohexan und seinem Bau
[Bearbeiten]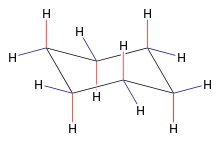
- farblose Flüssigkeit
- Sdp.: 81 °C (n-Hexan 69 °C)
- typische Alkaneigenschaften
- typische Alkanreaktionen (z.B. radikalische Substitution SR)allerdings nur ein Monosubstitutionsprodukt
- Der Cyclohexanring ist nicht planar gebaut.
Cracken von langkettigen Kohlenwasserstoffen
[Bearbeiten]Die wichtigsten Rohstoffe, welche aus Erdöl gewonnen werden sind v.a. Treibstoffe wie Benzin und Diesel sowie kurzkettige (C2-C4) Kohlenwasserstoffe zur Kunststoffproduktion.
Da die Zusammensetzung von Erdöl unterschiedlich ist und der prozentuale Anteil an Benzin, Diesel und kurzkettigen Kohlenwasserstoffen in Erdöl (natürlich) nicht den menschlichen Bedürfnissen entspricht, benötigt man ein Verfahren, um aus den kaum nutzbaren langkettigen Kohlenwasserstoffketten kurzkettige, dringend benötigte herzustellen.
Ein Verfahren dazu ist das so genannte Cracken. Im Grunde wird eine lange Kohlenwasserstoffkette dabei in mehrere Kürzere durch Erhitzen auf ca. 800°C (oder durch einen Katalysator bei ca. 450°C) „zerschnitten“.
Dies funktioniert deshalb so einfach, da die Kohlenstoffatome bei solche hohen Temperaturen derart stark schwingen, so dass die Ketten „reißen“.
Zu beachten ist, dass an den Bruchstellen von langkettigen Alkanen jeweils CH2- Glieder vorliegen. Daraus folgt, dass die neuen Kettenenden der entstehenden Bruchstücke allerdings nicht immer CH3-Enden haben können! (da ja Wasserstoffatome fehlen)[1]. Als Konsequenz entstehen beim Cracken immer erstmal Alkene.
- Beispiel
- Cracken von Octan in Butan und Buten
- Zusatzinformationen
Die Genfer Nomenklatur von organischen Verbindungen (IUPAC) - Teil 2
[Bearbeiten]- Für Teil 1 siehe Kapitel 4: Kohlenstoff als Bindungspartner
Nomenklatur mit Alkohole-Substituenten
[Bearbeiten]- Bei Alkoholen wird das Hydroxid als Alkanderivate behandelt. Dem Namen des Alkans wird die Endung -ol angehängt. Den Platz der Hydroxidgruppe erhält wie üblich eine möglichst geringe Nummer. Wichtig: Die Namen und Ziffern der Alkylsubstituenten werden denen der Alkanolsubstituenten vorangestellt:
-
Pentan-1-ol (bzw. 1 Pentanol)
-
3-Methyl-1-Pentaol
-
Cyclohexanol
- Hydroxidgruppen, Halogengruppen sowie Alkylgruppen können entsprechend ihrer Stellung die Hauptkette als primäre, sekundäre oder tertiäre kennzeichnen. Entscheidend ist dabei immer, wie viele weitere Kohlenstoffe an dem C zu finden sind, welches die Hydroxigruppe bindet.
- Entsprechend der Anzahl der OH-Gruppen unterscheidet man einwertige, zweiwertige, dreiwertige (usw.) also mehrwertige Alkohole
-
Glycerin (dreiwertig)
-
Glycol (zweiwertig)

- Liegen die Hydroxygruppen am Benzol (C6H6) vor, so spricht man von Phenolen. Kommen zusätzlich Alkylgruppen vor, so werden sie im Namen wieder vorangestellt.
- Bei der Benennung von Verbindungen mit Alkoholsubstituenten und Mehrfachbindungen, werden zuerst die Alkoholsubstituenten genannt.
- b) Nomenklatur mit Halogen-Substituenten
- Die Nomenklatur entspricht den Regeln der üblichen Nomenklatur der Alkane (d.h. zuerst längste Kette suchen, alphabetisches Sortieren der Reste usw...)
- Der Name des Halogens (Fluor, Chlor, Brom, Iod) wird vor den Namen (evtl. mit di, tri, tetra usw...) vorangestellt. Die Nummer wird entsprechend den Regeln zur Bestimmung von Verzweigungen bei Alkanen angegeben. Also z.B. „2 Chlor-Propan“
- Bei Halogensubstituenten und Verzweigungen (z. B. Ethyl- und Chlor-Verzweigungen in einem Molekül) wird das Halogen als „funktionelle Gruppe“ zuerst genannt.
Nomenklatur mit Ether & Ester Substituenten
[Bearbeiten]- Grundsätzlich gibt es hier eine neue und eine ältere (aber noch häufig verwendete Methode. Da Ester durch die Reaktion von Alkohol mit Säuren entstehen, bilden sich die Namen entsprechend: Rest des Alkohols + Rest der Säure + oat (früher: Säurename + Restname + Ether)
- Auch hier gibt es zwei entsprechende Methoden. Heute werden Ether als Alkoxyalkane bezeichnet. Dabei wird der längere Alkyl-Rest als Stamm und der kürzere Rest als Alkoxy-Substituent benannt. (früher: Name aus den beiden Alkyl-Resten + -ether)
Effekte in Molekülen
[Bearbeiten]Induktive Effekte sind Polarisationseffekte, die durch elektronenanziehende oder -abstoßende Atome oder Atomgruppen bewirkt werden und über 2-3 π-Bindungen hinweg übertragen werden können. Man unterschiedet den +I-Effekt (elektronenschiebend) vom -I-Effekt (elektronenziehend).
Welcher I-Effekt vorliegt hängt von dem betrachteten „Schlüsselatom“ ab. Hat dieses Atom eine negative Partialladung so ist es Elektronen abstoßend. Bei einer positiven Partialladung ist es Elektronen anziehend.
Die "Schlüsselatome" werden oft auch als π-Akzeptoren (elektronenanziehend) oder π-Donatoren (elektronenabstoßend) bezeichnet z.B.
Je weiter die Nachbaratome vom Schlüsselatom entfernt sind, desto mehr schwächt sich die Wirkung des induktiven Effektes des Fluoratoms ab. Am stärksten wirkt er bei C1.
Erklärungen für I-Effekte
[Bearbeiten]Da Elektronen freibeweglich sind, liegt im Grunde immer eine asymmetrische Verteilung von Elektronen zwischen zwei Atomen vor. Betrachtet man jetzt das Fluoratom und das C1-Atom, dann werden rein statistisch betrachtet die Elektronen zum Fluoratom hingezogen, da es elektronegativer (und somit elektronenanziehender) ist. Das elektronenanziehendere Fluor übt also einen -I-Effekt aus (sprich: negativer induktiver Effekt).
Dadurch wird die Elektronendichte bei dem anderen C1-Atom verringert! Es ist im Vergleich zu seinem Nachbarkohlenstoffatom C2 also auch minimal elektronegativer geworden. Ein Ausgleich kann geschehen, indem sich die Elektronen zwischen dem C1- und dem C2-Atom zum C1-Atom leicht verschieben. Dieser Effekt wird sogar noch weiter durch die Kohlenstoffkette wirken, schwächt sich aber dabei sehr schnell ab.
Generell kann man also sagen, dass der Fluorsubstituent das C1-Atom positiviert hat. Einen elektrophilen Angriff wird also eher am anderen Ende der Kohlenstoffkette stattfinden. Das C1-Atom eignet sich eher für einen nukleophilen Angriff.
- Übersicht über das zunehmende Vermögen Elektronen anzuziehen
(CH3)3C– <(CH3)2CH– < C2H5– <CH3– <H < –C6 H5 (Ring) < MeO– <HO– < I– < Br– <Cl– <–NO2 < F–
- elektronenschiebend (+I-Effekt) → Effekt bei H = 0 → elektronenziehend (-I-Effekt)
- Zusatzinformationen
I-Effekt Mesomerer Effekt (nur LK)
- Weiterer Einfluss des Induktiven Effekts
- Einfluss auf die Lage der Zweit-Substituenten am Benzol (nur LK)
- Einfluss auf die Säurestärke eines Moleküls (Säuren mit einem elektronenanziehenden Substituenten spalten das Protons leichter ab, elektronenschiebendende Substituenten führen hingegen zu einer geringen Säurestärke (+I-Effekt)
Regioselektivität bei der elektrophilen Addition
[Bearbeiten]Additionen von Verbindungen des Typs H–X bringen in der Regel mehrere Produkte hervor. Es entstehen Produktgemische. Allerdings sind die prozentualen Anteile meist deutlich verschieden:
Die beiden in Frage kommenden Kohlenstoffe des Ausgangsstoffes (=Edukt) unterschieden sich durch ihre Substituenten. Eines trägt nur Wasserstoffe, das andere keinen Wasserstoff. Stattdessen ist es mit zwei Kohlenstoffen verbunden.
Man erkennt sofort, dass das Proton des H–Cl das weniger substituierte Kohlenstoffatom Angriff und an diesem gebunden wird. Ursache ist der Induktive Effekt[2] der Kohlenstoffatome, die sozusagen (sehr minimal) Elektronen schiebend die Kernladung des angegriffenen Kohlenstoffs erhöhen.
Regel von Markovnikov
[Bearbeiten]Alkene, die ähnlich durch unsymmetrische Stoffe (z.B. H-Cl, H-F, H-Br. H-OH, Alkohole usw.) substituiert werden, liefern bei der Addition Produktgemische. Dabei wird das Produkt bevorzugt entstehen, bei dem sich der elektrophilere Teil (z.B. das Halogenion) des angreifenden Stoffes an dem Kohlenstoff, das die meisten Wasserstoff-Atome besitzt, anlagert.
Aber was ist die Ursache?
[Bearbeiten]Der Grund ist, dass das Elektrophil an die Doppelbindung so addiert, dass das stabilere Carbenium-Ion als Übergangszustand gebildet wird. Denn dieser Übergangszustand ist sehr instabil. Durch den I-Effekt wird es stabilisiert.
- Zusatzinformationen
Induktiver Effekt Markownikow-Regel
Versuche zur Löslichkeit organischer Stoffe
[Bearbeiten]Gesetzmäßigkeiten bei Lösungsvorgängen.
[Bearbeiten]Erstelle eine Tabelle nach folgendem Muster und vergleiche die Löslichkeit der folgenden Stoffe in den verschiedenen Lösungsmitteln. Achte bei den organischen Lösungsmitteln darauf, die RG nicht mehr als ca. 2cm hoch zu füllen (und dann logischerweise nur wenig Lösungsstoffe zu verwenden!)
Notiere das Lösungsvermögen mit (+; +/- ; -) in der Tabelle
| Kochsalz | Schwefel | (Hart)paraffin | Wasser | Spiritus | Benzin | Pflanzenöl | Kunststoff | |
| Wasser | x | |||||||
|---|---|---|---|---|---|---|---|---|
| Spiritus | x | |||||||
| Benzin | x |
- Erkläre mit Hilfe von Zeichnungen die Regeln zu den Gesetzmäßigkeiten bei Lösungsvorgängen.
- Ist Spiritus eher polar oder apolar? Erkläre mit einer Zeichnung.
2. Bestimmen des Charakters - hydrophil oder lipophil?
[Bearbeiten]In ein Reagenzglas gibt man eine winzige Menge (1 Korn!) des Farbstoffes Sudanrot und füllt mit ca. 5ml Wasser auf. Nach dem Beobachten gibt man eine halb so große Menge Benzin hinzu und schüttelt.
- Was ist zu beobachten? Wie kann die Beobachtung erklärt werden?
- Warum spricht man von 2 Phasen?
- Mit Methylenblau macht man die gegenteilige Beobachtung. Erkläre
- Gibt man Sudanrot und Methylenblau gemeinsam mit Wasser und Benzin in ein Reaktionsgefäß, so lässt sich ein Vorgang beobachten. Erkläre.
3. Löslichkeit von Gasen
[Bearbeiten]Etwas Universalindikator (oder Lackmus) wird in ein Becherglas mit (wenig!) Wasser gegeben. Nun wird solange Kohlenstoffdioxid zugefügt, bis ein Farbumschlag auftritt.
- Erkläre die Hintergründe.
- Wie schätzt Du die Eigenschaften von Kohlenstoffdioxid bezüglich seiner Wasserlöslichkeit ein?
- Nenne die Alltagsanwendung zu diesem Versuch
- Welche Beobachtung aus dem Tierreich zeigt uns, dass sich auch Sauerstoff in Wasser löst?
- Zusatzaufgaben
- Vervollständige: Organische Stoffe sind meist ________________ (bzw. ________________), d.h. sie lösen sich nicht in _____________ auf, sondern in ______________ Stoffen, wie Benzin. ________________ Stoffe hingegen, wie z.B. Wasser oder Salze, sind ________________und lösen sich gut in wässrigen (also ________________) Lösungsmitteln.
- Warum ist Spiritus ein gutes Lösungsmittel für Nikotin verschmierte Möbel?
- Flecken mit Verschmierungen der Fahrradkette sollte man nicht versuchen in der Waschmaschine zu reinigen, sondern eher mit Fleckenwasser direkt entfernen. a) Was ist Fleckenwasser? b) Welchen Nachteil hätte das Waschen in der Maschine?
- ↑ bei komplexen Verfahren können zusätzliche Wasserstoffe natürlich später an die Doppelbindungen addiert werden
- ↑ Der Induktive Effekt (I-Effekt), der sowohl als +I-Effekt (=elektronenschiebend) als auch als -I-Effekt (=elektronenziehend) auftritt, wird durch funktionelle Gruppen oder auch einzelne Atome ausgelöst.