Anorganische Chemie für Schüler/ Ionen, Salze, Fällungsreaktionen und Ionenbindung
Leitfähigkeitsmessung von Lösungen
Ganz am Anfang dieses Kurses haben wir die Leitfähigkeit von Elementen gemessen. Metalle hatten wir damals festgestellt leiten den elektrischen Strom in der Regel gut. Was ist aber mit Lösungen?
Versuchsbeschreibung
In Wasser werden verschiedene Salze (NaCl, KCl, Na2SO4) sowie Harnstoff und Zucker gegeben. Es sollte immer die gleiche Flüssigkeitsmenge zugegeben werden und auch die gleiche Menge Feststoff. Die Leitfähigkeit wird dann gemessen.
Beobachtung
| wässrige Lösung von | Wasser | NaCl | KCl | Na2SO4 | Harnstoff | Zucker |
| Leitfähigkeit | sehr gering | ++ | ++ | + | sehr gering | sehr gering |
| mögliche Werte bei 3V | 0,03 mA | 1500mA | 1400mA | 800mA | 0,03 mA | 0,03 mA |
Wenn man nicht immer die gleiche Salzmenge zugibt, sieht man, dass je mehr Salz in das Wasser zugegeben wird, desto höher die Leitfähigkeit der Lösung ist.
Weißt Du eigentlich (noch), was Leitfähigkeit ist?
Unsere Apparatur misst eigentlich die Stromstärke [I]. Sie gibt an, wie viele Elektronen durch die Lösung vom Minuspol zum Pluspol wandern.
Aber wie aber gelangen die Elektronen vom Minuspol (Pol erfragen!) zum Pluspol?
Dabei kann man sich vorstellen, dass sie die Elektronen „tragen“, wie ein Wanderer einen Rucksack trägt. Da das altgriechische Wort für Wanderer ionos lautet, nennen die Chemiker alle geladenen Teilchen Ionen.
- Leitungswasser leitet übrigens auch minimal den elektrischen Strom, da in ihm winzige Mengen von Mineralsalzen enthalten sind.
- Zucker und Harnstoff sind keine Salze, deshalb erhöhen sie die Leitfähigkeit des Wassers nicht.
Welche geladenen Teilchen sind in der Lösung enthalten?
- Im Kochsalz NaCl sind geladene Na und Cl Ionen vorhanden.
Sind die geladenen Teilchen schon im Feststoff NaCl vorhanden?
Versuchsbeschreibung
Messung der Leitfähigkeit von festen Salzen
Beobachtung
Die festen Salze leiten den elektrischen Strom gar nicht!
Schlussfolgerung
Salze sind aus Ionen aufgebaut. In der Lösung (sowie in geschmolzener Form) sind die Ionen frei beweglich und können Ladungen;transportieren, im Feststoff nicht! Das heißt nicht, dass im Feststoff keine Ionen vorhanden sind - sie sind halt nur nicht beweglich!
Salzkristalle leiten den e- Strom nicht.
Definition: Ionen sind elektrisch geladene Atome oder Moleküle.
Ionen mit positiver Ladung werden Kationen genannt, Ionen mit negativer Ladung Anionen.Ionenwanderung
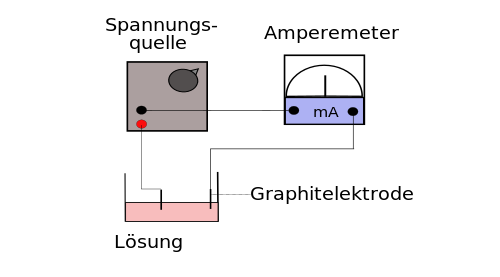
Versuchsbeschreibung
Das mit Natriumchloridlösung getränkte Filterpapier, wird an den Enden mit einem gefaltetem Kupferblech und einer Krokodilklemme an die Gleichspannungsquelle angeschlossen. Auf der Filterpapiermitte werden die Probesubstanzen aufgelegt (Kupfersulfat, Kaliumdichromat und Kaliumpermanganat - Kristalle). Versuche die mittlere Ionenwanderungsgeschwindigkeit zu bestimmen.

Beobachtung
zum Pluspol sieht man eine orange und violette Färbung, zum Minuspol eine blaue.
Schlussfolgerung
Unter dem Einfluss des elektrischen Feldes wandern die positiv geladenen (Kationen) Kupferionen zum Minuspol (Kathode), die negativ geladenen Chromationen (Anionen) wandern zum Pluspol (Anode).
Edelgaskonfiguration
Siehe Kapitel Edelgase!
Wdh.: Edelgase sind die Elemente der 8. Hauptgruppe.
Eine Elektronenwolke kann genau 2n2 Elektronen aufnehmen. (n= Periodennummer = Anzahl an Elektronenwolken)
Elemente der 1. Periode haben mit 2 e- Edelgaskonfiguration
Elemente der 2. Periode haben mit 8 e- Edelgaskonfiguration
Elemente der 3. Periode haben mit 18 e- Edelgaskonfiguration
Zusatzinformationen:
Welche Ionen sind in Natriumchlorid zu finden?
Bildung des Na- Ions
hat 1 Außenelektron.
Dieses Außenelektron wird abgegeben. Dem verbleibenden Teilchen fehlt es nun, dadurch ist es positiv geladen.

Wie kommt es zur positiven Ladung?
In der atomaren Form liegen je 11 negative und 11 positive Ladungen vor. Entfernt man ein negatives Elektron, dann bleibt eine positive Ladung „über“.
Das Ion ist also einfach positiv geladen
| Hinweis: | In Reaktionsgleichungen werden keine Elektronen „abgezogen“ oder „subtrahiert“. Für die Gleichung wird stattdessen von eine „Aufspaltung“ in Elektron und Ion ausgegangen. |
Bildung des Cl- Ions
hat 7 Außenelektronen.
Eine Außenelektron wird aufgenommen. das neue Teilchen hat nun ein Elektron mehr und somit eine negative Ladung mehr als vorher. Dadurch ist es negativ geladen.

Wie kommt es zur negativen Ladung?
In der atomaren Form liegen je 17 negative und 17 positive Ladungen vor. Fügt man nun ein negatives Elektron hinzu, dann liegt eine negative Ladung im Überschuss vor.
Das Ion ist also einfach negativ geladen.
Zusatzinformation:
Fast jedes Element kann sowohl atomar, als auch in ionischer Form auftreten. Salze sind aus Ionen aufgebaut.
Aufgaben:
Welche Ionen bildet:
- a) LiF
- b) MgO
- c) HCl [1]
- d) CaF2
Erklärung nach den Besetzungsregeln des Orbitalmodells

Exkurs: Folie: Hinweis auf vollbesetzte Energieniveaus der Edelgase
Nach Möglichkeit „streben“ Elemente vollbesetzte Energieniveaus an!
Welche Ladung kann ein Natriumion tragen, damit es nur vollbesetzte Energieniveaus hat?
- +1
| Natriumatom | Natriumion |
| 11 Elektronen davon 1 Valenzelektron | 10 Elektronen, davon 8 VE |
| keine voll besetzt E-Wolke | voll besetzte Valenz-Schale |
| chemisch eher instabil und reaktiv | stabilerer Zustand (energetisch günstiger) |
| wenig reaktiv |

Welche Ladung kann ein Chloridion tragen, damit es nur vollbesetzte Energieniveaus hat?
- -1
| Chloratom | Chloridion |
| 17 Elektronen davon 7 Valenzelektron | 18 Elektronen, davon 8 VE |
| keine voll besetzt E-Wolke | voll besetzte Valenz-Schale |
| chemisch sehr reaktiv | stabilerer Zustand (energetisch günstiger) |
| wenig reaktiv |
Eigenschaften der Salze
Der Schmelzpunkt von Salzen ist sehr hoch.
In Salzen liegen also Ionen vor. Diese haben eine positive oder negative Ladung. Natriumchlorid besteht aus positiven Natriumionen und negativen Chloridionen. Positive und negative Ionen ziehen sich gegenseitig an. Besonders im Feststoff ist diese Anziehung besonders stark. Aus dem Kapitel über die Eigenbewegung der Teilchen weißt Du schon, dass alle Teilchen schwingen. Also auch Ionen!
Was passiert nun beim Schmelzen eines Salzes?
- Ionen beginnen zu schwingen und brechen dadurch den „Ionenverbund“ aus positiven und negativen Ionen auf. Ionen werden frei beweglich, das Salz schmilzt.
- Beim Schmelzen von Salzen werden dabei also die Ionen voneinander getrennt. Durch Zufügen von Energie erhöht sich dabei die Eigenschwingung der Ionen. Überschreitet die Energie den Schmelzpunkt, ist die Schwingung so groß, dass der Verband aus Ionen „zusammenbricht“.
- Insgesamt kann man sagen, dass bei Salzen der Schmelzpunkt. sehr hoch ist, da die Ionen sich durch die Ionenladung gegenseitig zusammenhalten und man „mehr“ Wärmeenergie zufügen muss, um den Verbund zu lösen, als bei Verbindungen, die keine Ladungen enthalten (z.B. Zucker).
Charakteristische Eigenschaften von Salzen:
- Salze sind aus Ionen aufgebaut
- Salzschmelzen und wässrige Lösungen leiten den elektrischen Strom ( freie bewegliche Ionen)
- Salzkristalle leiten den elektrischen Strom nicht!
- Salze sind bei Raumtemperatur Feststoffe. Sie haben einen hohen Schmelzpunkt
- Salzkristalle sind hart und spröde
- Sie bestehen immer aus einem oder mehreren Metallion und einem oder mehreren Säurerestion
- Nach „außen“ hin sind Salze ungeladen
Salzgewinnung:
- Salze sind für den Menschen unentbehrlich. Das wichtigste ist dabei das Kochsalz (Natriumchlorid). Es wurde im Mittelalter auch das „weiße Gold genannt“. Salz war stets ein wichtiges Handelsgut. Es fand sogar mehrfache Erwähnung in der Bibel. Viele Städte tragen das Wort Salz (oder das Keltische Wort Hall) im Namen. (z.B. Halle, Reichenhall, Hallein, Hall, Schwäbisch Hall, Salzburg, Salzgitter, Bad Salzuffeln, Salzdettford, Bad Salzschlirf).
- Menschen gewinnen Salz entweder durch Meerwasserentsalzung, Salzstöcke oder aus Solen. Städte, die im Mittelalter über Salzlager verfügten waren in der Regel dadurch sehr reich.
- Gebrauch von Salzen: Kochsalz, Soda (für Seifensiedereien, Glashütten), Waschstoff, Chlorherstellung (Bleich- und Desinfektionsmittel, für die PVC-Herstellung), Streusalz...
Zusatzinformationen:
Kochsalz „NaCl”
- Als Speisesalz wird Natriumchlorid zur Würzung von fast allen Speisen (wenn auch in sehr unterschiedlichen Mengen) benutzt. Es ist für den Menschen lebenswichtig.
- Große Mengen an Salz werden als Streusalz (Auftausalz) im Winter verwendet. Der Effekt der Schmelzpunkterniedrigung wird im Labor auch bei der Bereitung von Kältemischungen genutzt.
- Natriumchlorid ist ein wichtiger Rohstoff für die chemische Industrie, insbesondere zur Gewinnung von Chlor und Natriumhydroxid in der Chlor-Alkali-Elektrolyse.
- Als Regeneriersalz für Geschirrspülmaschinen und bei Wasseraufbereitungsanlagen.
- Eine 0,9%ige Lösung von Natriumchlorid in Wasser wird in der Medizin als physiologische Kochsalzlösung zur Auffüllung des Blutvolumens verwendet; sie ist isoosmotisch mit dem Blutplasma.
- Zur Konservierung von Lebensmittel, z.B. Pökelfleisch, Einlegen von Fisch usw.
Wie bestimmt man Ionenladungen?
In der Chemie verwendet man meist drei Typen von Stoffen
a) Elemente (stehen im PSE). Ihre Formel ist immer so, wie sie dort stehen (z.B. Mg oder Fe), bis auf die Ausnahmen Wasserstoff, Stickstoff, Sauerstoff und 7.HG. Diese liegen immer als 2fach Molekülelement vor (z.B. H2, O2, N2, F2, Cl2 ...)
b) Molekülverbindungen aus mehren Elementen (z.B. H2O, CO2 oder NH3 ), Ihre Formel muss man kennen (also lernen - sind ja aber auch meist bekannt - sind die üblichen)
c) Salze und Oxide (Oxide werden als oft Salze behandelt, haben aber statt des Säurerestes der Salze das „O“.
z.B.: Salze: KCl, Na2SO4, Ca3(PO4)2
- Oxide: CuO, Fe2O3, Na2O
Aufgaben:
Schüler Ionen zeichnen und Ladung bestimmen lassen. Dabei werden von Wasserstoff bis Calcium alle an einzelne Schüler verteilt. In Vierergruppen werden die Ionen dann an die Tafel geschrieben und ins Heft schnell abgeschrieben. Die Sonderrolle des Wasserstoffs wird in der Folgestunde besprochen.
Zum Ende der Stunde werden allgemeine Regeln abgeleitet:
Regeln:
- Oberstes Gebot: Die Anzahl an Valenzelektronen des ungeladenen Atoms bestimmt die Ionenladung. Ziel ist es dabei i.d.R. Edelgaskonfiguration zu erhalten
- Die Ladung einatomiger Ionen entspricht bei Elementen der 1.- 3. Hauptgruppe der Hauptgruppennummer.
- Die Elemente der 1. Hg bilden 1fach positive Ionen (z.B.: Li Li+ + e-)
- Die Elemente der 2. Hg bilden 2fach positive Ionen (z.B.: Ca Ca2+ + 2e-)
- Die Elemente der 3. Hg bilden 3fach positive Ionen (z.B.: Al Al3+ + 3e-)
- Bei den restlichen Elementen kann sie der Anzahl an Elektronen entsprechen, die zum Erreichen von vollständig besetzten Energiestufen aufgenommen (oder abgegeben werden) müssen:
- Bsp. Sauerstoff hat 6 VE zur vollbesetzten Energiestufe fehlen 2 e- O2- - Ion
- Elemente der 7. Hg bilden oft 1fach negative Ionen (wenn sie überhaupt Ionen bilden) (z.B.: Cl Cl- + e-)
- Elemente der 6. Hg bilden oft 2fach negative Ionen (wenn sie überhaupt Ionen bilden) (z.B.: O O2- +2e-)
- Elemente der 5. Hg bilden oft 3fach negative Ionen (wenn sie überhaupt Ionen bilden) (z.B.: N N3- + 3e-)
-
- Metalle bilden positive geladene Ionen (= Kationen), Nichtmetalle bilden (wenn sie Ionen bilden) negativ geladene Ionen (=Anionen)
- Nebengruppenelemente (Fe, Cu, Zn) bilden „Kationen“ verschiedener Ladungen
- Edelgase bilden keine Ionen
- Aufgaben
- Ionen entstehen durch...
- Na+ -Ionen unterschieden sich von Na-Atomen durch...
- Welche Eigenschaften haben Ionen
- Erkläre den Begriff Ionenbindung
- Wie bestimmt man die Ladung eines Säurerestes?
- Welche Voraussetzungen müssen gegeben sein, damit Ionen den Strom leiten?
- Schlage Im Periodensystem nach, wie sich die Atom- und Ionenradien bei drei von Dir gewählten Elementen unterscheiden
- Bestimme die Ionenladungen der folgenden Ionen:
- Na, Cl, Mg, Li, Sr, Be, S, O, Al, Os, C, H , K, Ca, Ba, Br, I, F, Ne
Welche Ionenladung hat das Wasserstoffion?
Wasserstoff hat nur ein einziges Elektron. Es kann zum Erreichen der vollbesetzten Außenelektronenwolke ein e- aufnehmen oder abgeben.

Die Ionenbindung
Vom Magnetismus aus dem Physikunterricht kennst Du die Anziehung der unterschiedlichen Pole und die Abstoßung von gleichsinnigen Polen. In der Chemie hast Du nun positive und negative elektrostatische Ladungen bei Ionen kennen gelernt. Auch diese ziehen sich bei unterschiedlichem Vorzeichen an und stoßen sich bei gleichem Vorzeichen ab.
Zusammensetzung der Salze
Bei festen Salzen sind sich immer (positive) Metallionen mit (negativen) Säurerestionen miteinander verbunden. Im gelösten Zustand enthält die Lösung beide Ionensorten, welche sich in der Lösung frei bewegen. Dieses kennzeichnet man durch ein „(aq)“ am Ion. (z.B. Li+(aq))
| Metallion | Säurerestion | |||
| Lithium: | Li+ | Cl- | Chlorid | |
| Kalium: | K+ | F- | Fluorid | |
| Natrium: | Na+ | Br- | Bromid | |
| Magnesium: | Mg2+ | I- | Iodid | |
| Calcium: | Ca2+ | S2- | Sulfid | |
| Barium: | Ba2+ | (NO3)- | Nitrat | |
| Aluminium: | Al3+ | (SO4)2- | Sulfat | |
| Kupfer: | Cu2+ | (SO3)2- | Sulfit | |
| Silber: | Ag+ | (CO3)2- | Carbonat | |
| Eisen: | Fe2+ / Fe3+ | (PO4)3- | Phosphat | |
Liste einiger wichtiger Anionen
| Ion | Name | Ion | Name | Ion | Name |
| SO42- | Sulfat | NO3- | Nitrat | ClO4- | Perchlorat |
| HSO4- | Hydrogensulfat | NO2- | Nitrit | ClO3- | Chlorat |
| SO32- | Sulfit | S2- | Sulfid | NH4+ | Ammonium |
| MnO4- | Permanganat | S2O32- | Thiosulfat | PO43- | Phosphat |
| CrO42- | Chromat | CO32- | Carbonat | HPO42- | Hydrogenphosphat |
| Cr2O72- | Dichromat | HCO3- | Hydrogencarbonat | H2PO4- | Dihydrogenphosphat |
Aufgaben:
- Trage alle Ionenladungen der Säurereste auf dem Säurezettel des letzten Jahres ein!
- Bestimme die Ionenladungen der folgenden Ionen:
- Na, Cl, Mg, Li, Sr, Be, S, O, Al, Os, C, H, K, Ca, Ba, Br, I, F, Ne
- Wie lautet die richtige Formel für folgende Salze:
- Natriumchlorid (= Kochsalz):
- Bariumsulfat:
- Magnesiumcarbonat:
- Natriumsulfat:
- Lithiumnitrat:
- Kaliumbromid:
- Calciumphosphat:
- Aluminiumsulfat:
Übungen
Schreibe hinter jedes Symbol die passende Ionenladung und kombiniere anschließend die Ionen zu nach „außen“ hin ungeladenen Salzen. Schreibe unter die Salzformel den passenden Namen
| Name des Metallion | Name des Nichtmetalls/Nichtmellverbindung | ||||||
| F | Cl | S | O | NO3 | SO4 | PO4 | |
| K | |||||||
| Li | |||||||
| Na | |||||||
| Ca | |||||||
| Al | |||||||
| Fe2+ | |||||||
| Fe3+ | |||||||
| Pb | |||||||
| Cr | |||||||
| Cu | |||||||
Nomenklatur bei Salzen
Salze werden nach mit dem Atomnamen des Metallions und dem Säurerest benannt. Die Wertigkeit des Metallions kann dabei durch eine griechische Zahl angegeben werden. Bsp.: Eisen (III) Chlorid
| Zahlenwert | Vorsilbe |
| 1 | mono |
| 2 | di |
| 3 | tri |
| 4 | tetra |
| 5 | penta |
| 6 | hexa |
| 7 | hepta |
| 8 | octa |
| 9 | nona |
| 10 | deca |
Zusammenfassung Ionen
- Vervollständige die Sätze
- Ionen entstehen durch ...
- Ionen unterschieden sich von Atomen durch ...
- Salze sind so aufgebaut, dass ...
- Ionen haben die Eigenschaften ...
- Ionenladungen bestimmt man ...
- Die Ladung eines Säurerestes kann man bestimmen, indem…
- Welche Voraussetzungen müssen gegeben sein, damit Ionen den Strom leiten?
Übungstest zum Thema „Salze und Ionen“ I
| guter Leiter? j/n | Stoff | Erklärung |
| Zuckerlösung | ||
| Magnesiumchloridlösung | ||
| Natriumsulfatkristall | ||
| Kochsalzschmelze | ||
| Silberchlorid in Wasser | ||
| Wasser aus der Leitung | ||
| Metallstab | ||
| Kohlenstoffdioxid |
| Natriumion: | Nitration: | Sulfation: | Carbonation: | |||
| Berilliumion: | Chloridion: | Sulfidion: | Fluoridion: | |||
| Magnesiumion: | Phosphation: | Oxidion: | Silberion: |
| F | Cl | S | SO4 | CO3 | PO4 | |
| K | ||||||
| Li | ||||||
| Ca | ||||||
| Al | ||||||
| Ba | ||||||
| Ag |
- Welche der in der Tabelle sind gute Leiter für elektrischen Strom? (je 0,5P 4P)
- Definiere den Begriff „Ion“! (2P)
- Welche Unterschiede bestehen zwischen Natrium als Element und dem Natriumion? (4P)
- Unterstreiche bei den Begriffen Anionen in rot und Kationen in grün und notiere dann die entsprechende Formel mit ihrer Ionenladung. (Begriffe je Ion 0,25P + je Formel 0,25P 6 P)
- Bestimme die Ionenladungen der Ionen in der Tabelle rechts und erstelle dann die Summenformel, welche sie im entsprechenden Salzkristall haben. Zum Schluss markiere die schwerlöslichen Salze! (je 0,25P 9P)
- Nenne die allgemeine Regel, nach der Salze aufgebaut sind und beschreibe dann die genaue Anordnung. Gehe dabei auch auf den vorliegenden Bindungstyp ein. (4P)
- Wenn man in Trinkwasser Silbernitratlösung tropft, kommt es zu einer leichten Trübung. Beschreibe die Reaktion genau und benenne den sich bildenden Stoff. (Rückseite) (6P)
4 Möglichkeiten der Salzbildung
Salze lassen sich auf mehreren Wegen bilden. Diese sind auch in der Natur so zu finden.
1. Salzbildung durch Neutralisation
Diesen Weg kennst Du schon aus dem Kapitel „Neutralisation“.
Versuchsbeschreibung
Zu Schwefelsäure wird erst etwas Universalindikator und dann tropfenweise Kalilauge zugefügt. Die neutrale Lösung wird eingedampft.
Beobachtung
Lösung wird warm, nach dem Eindampfen liegt ein weißer Feststoff vor.
| Bsp.: | H2SO4 | + | 2 KOH | K2SO4 | + | 2 H2O | + | E | ||
| Säure | + | Lauge | Salz | + | Wasser | + | Energie |
2. Salzbildung aus Metalloxid und Säure
Versuchsbeschreibung
| a) | Etwa 4 cm Magnesiumband wird mit einer Tiegelzange in die Bunsenbrennerflamme gehalten. Gib das Reaktionsprodukt in ein Reagenzglas. (Hinweis: Nicht in die Flamme schauen!) |
| b) | Salzbildung: In das Reagenzglas wird verdünnte HCl gegeben (etwa 2cm hoch).Dampfe anschließend die Lösung ein. Benutze dabei unbedingt die Schutzbrille! |
Beobachtung
| a) | Mg verbrennt mit sehr heller Flamme. Das Reaktionsprodukt ist ein weißes Pulver. Das Oxid löst sich in der Säure, beim Eindampfen erhält man einen farblosen Feststoff. |
Schlussfolgerung
| a) | 2 Mg | + | O2 | 2 MgO | (Magnesiumoxid) | |||||
| b) | MgO | + | 2 HCl | H2O | + | MgCl2 | (Magnesiumchlorid) | |||
| Metalloxid | + | Säure | Salz | + | Wasser | + | Energie |
3. Salzbildung aus Nichtmetalloxid und Lauge
Versuchsbeschreibung
| a) | Herstellung von frischem Kalkwasser Überschichte 2 Spatelspitzen CaO mit Wasser und schüttle kräftig. Filtriere die entstandeneLösung. [genaue Anleitung und Demonstration!] |
| b) | Salzbildung: Blase mit Hilfe einer Pipette mehrmals ausgeatmete Luft in die Lösung. |
| Beobachtung |
Schlussfolgerung |
| a) Nur ein Teil des CaO löst sich in Wasser | a) CaO + H2O Ca(OH)2 (Kalkwasser) |
| b) Die Lösung färbt sich milchig-trüb | b) Ca(OH)2 + CO2 CaCO3 + H2O + E |
Calciumcarbonat (Kalk) ist ein schwerlösliches Salz. Es löst sich nur in geringem Maße[2]
Anmerkung: Im Grunde entsprechen die Wege 2. und 3. dem ersten, da in Nichtmetalloxide mit Wasser Säuren bildet und Metalloxide mit Wasser Laugen entstehen lassen.
4. Salzbildung aus den Elementen
Versuchsbeschreibung
ca. 5 g Magnesium (alternativ Zink) werden mit ca. 3 g Iod (I2) vorsichtig vermischt. Das fertige Gemisch wird dann auf ein Uhrgläschengebracht und im Abzug vorsichtig mit wenigen Tropfen Wasser aus der Spritzflasche benetzt.
Alternativ kann der Versuch im Reagenzglas durchgeführt werden. Dann kann nach Reaktionsende deutlich mehr Wasser zugefügt werden, in dem sich das Salz löst. Das Wasser wird ab dekantiert und anschließend eingedampft.
 |
 |
Beobachtung
Heftige Reaktion, Bildung eines hellen Feststoffs, violette Ioddämpfe, Der Feststoff löst sich in Wasser. Nach dem Eindampfen der Lösung ist er am RG-Boden sichtbar.
Schlussfolgerung
Bei der Reaktion von Mg und I2 entsteht (festes) Magnesiumiodid. Dieses ist aus Ionen aufgebaut (Salz!) Bei der Reaktion hat ein Magnesiumatom Elektronen an 2 Iodatome abgegeben:
Schlussfolgerung
Es ist das Salz Magnesiumiodid entstanden
| Mg | Mg2+ + 2 e- | ||||
| I2 + 2 e- | 2 I- |
Mg + I2 Mg2+ + I2- + E
Aufgaben
- Vervollständige die Gleichungen:
| Metalloxid + Säure: | |||||||
| Calciumoxid | + | Salzsäure | |||||
| CaO | + | __HCl | + | ||||
| Calciumoxid | + | Phosphorsäure | |||||
| CaO | + | __H3PO4 | + | ||||
| Nichtmetalloxid + Lauge: | |||||||
| Schwefeldioxid | + | Barytwasser | |||||
| SO2 | + | __Ba(OH)2 | + | ||||
| Kohlendioxid | + | Natronlauge | |||||
| CO2 | + | __NaOH | + | ||||
| Metall + Nichtmetall: | |||||||
| Magnesium | + | Brom | |||||
| Mg | + | __Br2 | + | ||||
| Eisen | + | Chlor | (es entsteht | Eisen | (III)clorid) | ||
| __Fe | + | __Cl2 | + | ||||
- Wiederhole die Edelgasregel
- Wenn Du eine Energiebetrachtung zu allen Salzbildungen durchführst, was fällt dann auf?
Salzbildung II: Die Bildung von Zinksulfid aus den Elementen
Versuchsbeschreibung
Zur Vereinigung von Zink und Schwefel werden beide Elemente miteinander vermischt und auf einem Drahtnetz mit einem glühenden Draht entzündet. ([2 : 1], kleine Mengen, Abzug, Schutzbrille!])

Beobachtung
Sehr heftige Reaktion, Rauchentwicklung
Schlussfolgerung
Es fand eine Salzbildung statt. Die Reaktion ist stark exotherm. Der neue Stoff heißt Zinksulfid.
Zum Aufstellen der Reaktionsgleichung muss man wissen, dass Zn zwei Valenzelektronen besitzt.
| Zn | Zn2+ + 2 e- | ||||
| S + 2 e- | S2- |
Zn + S Zn2+ + S2- + E
Elektrolyse einer (wässrigen) Kupferchloridlösung
Eine Elektrolyse ist eine Aufspaltung einer Verbindung mit Hilfe von elektrischem Strom. Viele Elektrolysen sind in der Technik sehr wichtig: Die reine Form der Metalle Aluminium und Magnesium können nur elektrolytisch hergestellt werden.
Versuchsbeschreibung
In diesem Versuch soll durch Elektrizität Kupferchlorid gespalten werden. Eines der Produkte ist dabei sehr nützlich! Dazu werden in eine Kupferchloridlösung zwei Kohlenstoffelektroden getaucht und eine Spannung von 5V angelegt.

| Beobachtung |
Schlussfolgerung |
| An der Anode entsteht ein dunkelbrauner Feststoff | Kathode: Kupferabscheidung |
| An der Kathode entsteht ein stechend riechendes Gas | Anode: Chlorentwicklung |
Detailzeichnung:
- Pol (Kathode):
| 1.Schritt: | Cl- | [Cl] | + | e- | ||||
| 2. Schritt: | 2 [Cl] | Cl2 | ||||||
| 2Cl- | Cl2 | + | 2e- |
+ Pol (Anode):
| Cu2+ | + | 2e- | Cu |
Gesamtreaktionsgleichung:
| 2Cl- | + | Cu2+ | Cl2 | + | Cu |
| Kathode: | Kupferionen | (= Kationen) | + | Elektronen | Kupferatome | ||
| Anode: | Chloridionen | (= Anionen) | Chloratome | + | Elektronen | ||
| ( Chlormoleküle) |
Aufgaben:
Stelle die Reaktionsgleichung einer Magnesiumchlorid-Lösung Elektrolyse auf. Welche Produkte entstehen?
Übung - Verkupfern eine Schlüssels
Als Verkupfern bezeichnet man das Überziehen metallischer Gegenstände mit Kupfer. Der Vorgang ist eine Sonderform der Elektrolyse. Allerdings steht nicht die Zersetzung des Salzes im Vordergrund, sondern vielmehr das entstehende Produkt Kupfer. Bei geeigneten Bedingungen legt es sich auf dem metallischen Gegenstand, der als Minuspol dient ab.
Versuchsbeschreibung
Elektrolyse einer Kupferionenlösung:

Problem: Wie kann das Kupfer gut am Feststoff haften? Möglichst dichter und geschlossener Kupferüberzug Reinigung
Beobachtung
An der Anode entsteht ein dunkelbrauner Feststoff An der Kathode entsteht ein stechend riechendes Gas.
Schlussfolgerung
Am Schlüssel setzt sich schon nach kurzer Zeit ein rotbrauner Belag ab, der Anfangs schwarz erscheint. Es handelt sich um Kupfer. (siehe auch vorheriger Versuch)
| Gesamtreaktionsgleichung: | 2Cl- + Cu2+ Cl2 + Cu |
Zusatzinformationen:
Andere Möglichkeiten zum Verkupfern:
Max von Laue - Versuch
Max von Laue studierte an der Universität Straßburg Physik und beschäftigte sich nach seinem Umzug nach Göttingen schwerpunktmäßig mit der Optik. 1903 promovierte er bei Max Planck in Berlin. Nach seiner Habilitation 1906 beschäftigte er sich mit der Relativitätstheorie Albert Einsteins und entwickelte 1907 mit optischen Experimenten wichtige Beweise für die Richtigkeit des Einsteinschen Additionstheorems. 1909 kam er als Privatdozent an das Institut für theoretische Physik der Universität München.
Im Jahr 1912 entdeckte er zusammen mit Friedrich und Knipping die Beugung von Röntgenstrahlen an Kristallen. Damit waren sowohl der Wellencharakter der Röntgenstrahlung als auch die Gitterstruktur der Kristalle nachgewiesen. Für seine Arbeit erhielt von Laue 1914 den Nobelpreis für Physik.
Der Laue - Versuch:

Versuchsbeschreibung
Ein Salzkristall wird mit Röntgenstrahlung bestrahlt. Dahinter befindet sich eine Fotoplatte, welche für Röntgenstrahlen empfindlich ist[3] .
Beobachtung
Laue bemerkte charakteristische Schwärzungen. Er untersuchte daraufhin
verschiedene Salze und stelle fest, dass es scheinbar drei Typen von Mustern gab, die besonders häufig auftreten.
Schlussfolgerung
Im festen Zustand liegt in Salzen ein Ionengitter vor. Dabei sind Ionen im richtigen stöchiometrischen Verhältnis so „gepackt“, dass jedes Kation die gleiche Anzahl an Anionen als Nachbarn hat (und umgekehrt). Ein positives Ion hat also nur negative Ionen als Nachbar und umgekehrt. Die Anzahl ist dabei immer gleich! Diese Zahl nannte er Koordinationszahl. Die Koordinationszahl gibt die Anzahl der unmittelbaren Nachbarn an, welche für die jeweiligen Salze typisch ist!
Es gibt dabei v.a. drei wichtige Typen, die besonders häufig auftreten. Laue benannte sie nach den Salzen, wo er dies zuerst bemerkte:
NaCl: Natriumchlorid-Typ KZ = 6 (also 6 Nachbarn pro Ion) bildet einen Oktaeder
CsCl: Cäsiumchlorid-Typ KZ = 8 (also 8 Nachbarn pro Ion) bildet einen Würfel
ZnS : Zinksulfid-Typ KZ = 4 (also nur 4 Nachbarn pro Ion) bildet einen Tetraede
Aber warum ist die Summenformel dann NaCl?
Wenn aber jedes Ion so viele Nachbarn hat, warum ist dann die Summenformel nicht NaxClx? Das wäre doch viel zu chaotisch und kompliziert! Die Summenformel gibt also nur das Verhältnis der Ionen an.
Bsp.: Na+Cl- : Verhältnis Na+ : Cl- = 1:1
Räumliche Struktur des Natriumchlorids
| Das Natriumchlorid-Ionengitter | Natriumchlorid hat die Koordinationszahl 6 |
 |
 |
Die Koordinationszahl
Die Anordnung der Ionen im Kristall ist regelmäßig. Betrachtet man z.B. einen Natriumchloridkristall, sieht man:
- jedes Na+-Ion ist von 6 Cl--Ionen umgeben
- jedes Cl--Ion ist von 6 Na+-Ionen umgeben
Man sagt daher die Koordinationszahl (KZ) beim Kochsalz ist 6
Wovon hängt die Koordinationszahl ab?
- Je größer ein Anion ist, desto mehr Kationen könnten darum angeordnet werden.
- Die Formel gibt an wie sich die Zahlen von Anionen und Kationen in der Verbindung zueinander verhalten.
Beispiele für Ionenradien:
| Ion | (Na+) | (Cs+) | (Zn2+) | (Cl-) | (S2-) | |
| Radius | 97 pm | 169 pm | 74 pm | 181 pm | 184 pm |
| Koordinationszahl | Anordnung der Ionen | Gittertyp | |
| < 0,42 | 4 | tetraedrisch | ZnS-Typ |
| 0,42 bis 0,73 | 6 | oktaedrisch | NaCl-Typ |
| > 0,73 | 8 | würfelförmig | CsCl-Typ |
Aufgabe:
Ermittle die Koordinationszahlen den und Gittertyp von Lithiumbromid.
r = 68 pm, r = 195 pm
Wovon hängt der Ionenradius ab?
| a) | Von Periode zu Periode nehmen die Ionenradien zu, da mit jeder Periode auch eine neue Elektronenwolke vorhanden ist |
| der Radius nimmt zu | |
| b) | Von der Anzahl an Valenzelektronen. Es gilt folgende Regel: Kationen sind kleiner als die Anionen der selben Periode. |
| Erklärung: | Von Element zu Element nimmt innerhalb einer Periode die Kernladungszahl (= Protonenzahl) zu. Das heißt, die Außenelektronen werden immer stärker durch mehr und mehr Protonen angezogen. Der Radius nimmt leicht ab. |
- bei Kationen, also positiv geladene Ionen, ist der Ionenradius kleiner als der Atomradius. Je größer die positive Ladung ist, desto kleiner wird der Ionenradius.
- bei Anionen, also negativ geladene Ionen, ist der Ionenradius größer als der Atomradius. Je größer die negative Ladung ist, desto größer wird der Ionenradius.
Grobe Regel: Bei der Kationenbildung nimmt der Ionenradius ab, bei der Anionenbildung hingegen nur unmerklich zu
Zusatzinformationen:
Ionenbindung und das Ionengitter
Definition:
Eine Ionenbindung ist die Verbindung von unterschiedlich geladenen Ionen. Die Ionen ziehen sich dabei durch elektrostatische Anziehung an und „halten“ so zusammen. Diese Ionenbindung kann z.B. durch einen Elektronenübergang von einem Atom auf ein Zweites entstehen (z.B. bei der Salzbildung). Dabei werden jeweils soviel Elektronen aufgenommen (bzw. abgegeben), bis beide Partner Edelgaskonfiguration erreichen.
Regeln:
- Ein Ion kann aus einem oder mehreren Atomen bestehen (Na+ , Cl-, NO3-).
- Metallatome bilden Kationen. Diese sind positiv geladen und kleiner als das ursprüngliche Atom, da in ihrer Elektronenwolke ein Elektron fehlt. Nichtmetallatome bilden Anionen. Sie sind negativ geladen und ungefähr so groß wie das ursprüngliche Atom, da sich die Anzahl ihrer Elektronenwolken nicht ändert.

- Chlor: Chlorid (Cl-)
- Schwefel: Sulfid (S2-)
- Eine aus Ionen aufgebaute Verbindung besteht aus zahlreichen Anionen und Kationen, die im festen Zustand zu einem Ionengitter (Kristall) geordnet sind. Die elektrostatische Anziehung hält den Kristall zusammen.
- Die Koordinationszahl gibt die Zahl der unmittelbaren Nachbarn an. (Bsp. NaCl: KZ = 6)
- Die Formel (z.B.: NaCl) gibt das einfachste ganzzahlige Verhältnis zwischen den Ionen an. Insgesamt ist der Kristall elektrisch neutral.
- Bei der Bildung eines Ionengitters wird Gitterenergie frei. Das Ionengitter ist demnach ein von den Ionen „angestrebter“ Zustand. (Man glaubt es kaum, aber der geordnete Zustand ist der, der am wenigsten Energie benötigt!)
- Zum Auflösen eines Ionengitters wird demzufolge wieder die Gitterenergie benötigt, die bei der Bildung frei wurde. (Um also „Unordnung“ zu erzeugen, muss Energie „rein gesteckt“ werden.)
- Beim Schmelzen von Salzen werden die Ionen des Ionengitters voneinander getrennt. Durch Zufügen von Energie erhöht sich dabei die Eigenschwingung der Ionen. Überschreitet die Energie den Schmelzpunkt (= Betrag der Gitterenergie), ist die Schwingung so groß, dass das Ionengitter „zusammenbricht“.
Da die Ionen sich durch die Ionenladung gegenseitig zusammenhalten, muss sehr viel Energie aufgebracht werden, um das Ionengitter zu zerstören.
Bei Salzen ist der Schmelzpunkt sehr hoch
Bei der Bildung eines Ions aus einem Atom wird Energie benötigt:
Ionisierungsenergie (ΔHI): Energie, die benötigt wird, um aus einer Elektronenwolke eines Atoms ein Elektron zu entfernen.
Elektronenaffinität (ΔHEA): Energie, die benötigt/frei wird, um einem Atom ein Elektron zuzufügen.
Das Coulomb’sche Gesetz
Das Coulombsche Gesetz wurde von dem französischen Physiker Charles Augustin de Coulomb (1736-1806) im Jahre 1785 aufgestellt.
| Ec | = | |||
| Ec | ~ |
Ec = Coulomb’sche Energie (hier: Energie, die bei der Gitterbildung frei wird)
d = Abstand zw. Ionen - Mittelpunkten (= Kernen)
(eine Konstante, unveränderbar!)
Allgemein beschreibt das Gesetz die elektrostatische Kraft zwischen zwei Punktladungen. Es besagt, dass diese Kraft proportional zum Produkt dieser beiden Ladungen und umgekehrt proportional zum Quadrat ihres Abstandes ist. Zwei Ladungen mit gleichem Vorzeichen (gleichnamige) stoßen sich ab, solche mit verschiedenem Vorzeichen (ungleichnamige) ziehen sich an. Das coulombsche Gesetz bildet die Basis der Elektrostatik.
Annahmen:
- Wenn die Ladungen zweier Ionen das gleiche Vorzeichen haben, ist Ec positiv es ist Energie notwendig, um die Ionen zusammen zu bringen.
- Ist eine Ionenladung aber negativ, ist das Vorzeichen negativ es wird Energie frei
- Ist der Kation - Anion Abstand sehr klein, wird besonders viel Energie frei. Je geringer der Abstand zwischen den Ionen ist, desto mehr Energie muss aufgebracht werden, um das Ionengitter aufzubrechen (Schmelzen).
Wovon hängt die Anziehung also ab?
Von der Anzahl der Ladungen und von den Ionenradien.
Berechne, bei welchem Salz die Gitterenergie größer ist: Li+Cl- oder Ag+Cl-
d LiCl = (60+181) = 241 * 10-12 m dAgCl = (115+181) = 296 * 10-12 m
- die Energie wird bei AgCl proportional höher sein
Dies ist die Erklärung für die Tatsache, dass AgCl ist ein schwerlösliches Salz ist
Wärme und Kälteeffekte beim Lösen von Salzen
Versuchsbeschreibung
Lösen verschiedener Salze mit gleichzeitiger Temperaturmessung (vorher Wassertemperatur messen!). Nach Lösen des Salzes wird die
Temperatur erneut gemessen.
| Salze: | T | ΔT |
| KCl | -7K | |
| CuSO4 | -2K | |
| CaCl2 * 6H2O | 1K | |
| CaCl2 | -7K | |
| NaCl | 0K | |
| CaO | +2K |
Schlussfolgerung
Alle Feststoffe die aus Ionen aufgebaut sind, werden als Salz bezeichnet. Im festen Zustand bildet das Salz ein Ionengitter. Wird ein Salz in Wasser gelöst, gehen die Ionen vom unbeweglichen Gitterzustand in den Freibeweglichen über.
Die geschieht in zwei Schritten:
- Aufbrechen des Ionengitters und freisetzen der Ionen. (Energie wir benötigt, da Ladungen getrennt (auseinander gezogen) werden müssen).
- An die freien Ionen lagern sich aufgrund elektrostatischer Anziehung Wassermoleküle an (Hydratisierung oder Hydrathüllenbildung). Dabei wird Energie freigesetzt.

„Bananenmodell“ der Hydratisierung:
Ist der absolute Wert der Hydratationsenergie größer als der der Gitterenergie, kommt es zu einem Temperaturanstieg. Im anderen Fall löst sich das Salz unter Abkühlung.

Fällungsreaktionen - Ionen umhüllen sich mit Wasser
Was ist ein schwerlösliches Salz?
1.
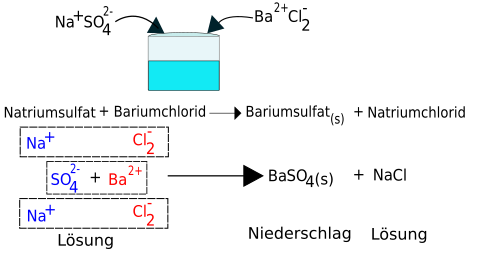
Durch das Verwenden von spezifischen Fällungsreaktionen ist es möglich, einzelne Bestandteile einer Lösung zu identifizieren, also nachzuweisen. Dies ist sehr wichtig zum Nachweis von geringen Ionen Konzentrationen im Analyselabor. Eine mögliche Anwendung ist die Untersuchung von Trinkwasser oder Lebensmitteln. Fällungsreaktionen können auch zum Ausfällen von störenden Ionen verwendet werden, z.B. bei der Reinigung von Klärwasser in der chemischen Stufe der Kläranlage verwendet werden.
Transfer: Erkläre mit einer Zeichnung, welcher Feststoff als schwerlösliches Salz ausfällt, wenn man die Salze AgNO3 und NaCl zusammen in einer Lösung mit Wasser auflöst.
Fällungsreaktionen als chemische Nachweise
Versuchsbeschreibung
Kippe die folgenden Lösungen zusammen und untersuche das Ergebnis
Beobachtung
In einigen Fällen kommt es zu einer Trübung
| KCl | K2SO4 | AgNO3 | CuSO4 | BaCl2 | K2CrO4 | KNO3 | |
| KCl | x | - | AgCl | - | - | - | - |
| K2SO4 | x | - | BaSO4 | - | - | ||
| AgNO3 | x | AgCl | Ag2(CrO4) | - | |||
| CuSO4 | x | BaSO4 | Cu(CrO4) | - | |||
| BaCl2 | x | Ba(CrO4) (gelb) | - | ||||
| K2CrO4 | x | - | |||||
| KNO3 | x |
Schlussfolgerung
Am ehesten kann man Fällungen mit einer Analogie erklären: Die 10 Klasse fährt im engen Bus ins Schwimmbad. Im Bus sind alle eng zusammen (=Feststoff), im Wasser bewegen sich die Schüler dann wild hin und her. Treffen aber zwei „Verliebte“ aufeinander, so lassen sie sich nicht mehr los und sind untrennbar verbunden ;-)
Nachweis von...
Chlorid-Ionen
Zugabe von Ag+ - Ionen Lösung (z.B. AgNO3)
| Na+(aq) + Cl-(aq) + Ag+(aq) + NO3-(aq) | Ag+Cl-(s) | + | Na+(aq) + NO3-(aq) | |
| Nachweis | (Test NaNO3 ist löslich) | |||
| weißer Niederschlag |
- Die tiefgestellten Indizes stehen für:
- (aq)= in Wasser gelöst
- (s)= solid = Feststoff
- (l)=liquid =Flüssigkeit
- (g)= gasförmig
- Der Pfeil bedeutet, dass dieser Feststoff ausfällt, d.h. sich am Boden abscheidet.
- Vereinfachte Gleichung: Ag+(aq) + Cl-(aq) Ag+Cl-(s)
- Info: Auch Br--Ionen und I--Ionen bilden mit Silber schwerlösliche Niederschläge.
- Zum Nachweis von Silberionen verfährt man entsprechend umgekehrt
Sulfat-Ionen
Zugabe von Ba2+ Ionenlösung (mit etwas Salzsäure Auflösen von anderen Niederschlägen)
| Ba2+(aq) + SO42-(aq) | Ba2+SO42-(s) | |
| Nachweis | ||
| weißer Niederschlag |
Fe3+-Ionen
Zugabe von Thiocyanatlösung
| Fe3+(aq) + 3 SCN-(aq) | Fe3+SCN-3 | |
| Nachweis | ||
| tief rot |
Cu2+-Ionen
Zugabe von Ammoniakwasser
| Bei Zugabe von Ammoniakwasser zu Cu2+-haltigen Lösungen entsteht eine | tiefblaue Farbe |
| (Kupfertetraminkomplex) |
CO32--Ionen
Zugabe von einer Säure
| 2 HCl(l) + CO32-(aq) | H2CO3 + 2 Cl- | |
| CO2 + H2 | ||
| Nachweis | ||
| Lösung schäumt stark auf CO2 |
Schlussfolgerung
Ionen sind für den Menschen in der Regel unsichtbar. Um sie nachzuweisen muss man sie zu einer „sichtbaren“ Form reagieren lassen. Bei vielen Nachweisreaktionen entstehen schwerlösliche oder farbige Verbindungen (Fällungs- oder Farbreaktionen) oder Gase mit auffälligenEigenschaften.
Übung: Wozu dienen Fällungsreaktionen? - Wasseruntersuchungen
Problemstellung:
Ein Labor hat 4 Wasserproben (3 Mineralwasser und ein destilliertes Wasser) auf ihren Ionengehalt untersucht und leider zur Befestigung der Etiketten einen schlechten Klebstoff verwendet. Die Schilder sind abgefallen. Ist jetzt noch möglich, die einzelnen Wasserproben den Laborergebnissen zuzuordnen?
Versuch: Analyse dreier Mineralwasser
Drei Flaschen Mineralwasser und destilliertes Wasser werden in gleichen Bechergläsern präsentiert. Die Schüler sollen dann eine Zuordnung zu den Originalquellen versuchen. Versuch: Nachweis von Chlorid und Sulfationen in:
- Mineralwasser 1
- Mineralwasser 2
- Mineralwasser 3
- Dest. Wasser
Beobachtung
Unterschiedliche Trübungen, je nach Ionengehalt. Zuordnung möglich
Schlussfolgerung & Auswertung:
- Welche zwei schwerlöslichen Salze haben wir gebildet?
- Kann man mit unseren Erfahrungen jetzt den Chloridgehalt von Leitungswasser bestimmen?
- Warum kann die ursprünglich „mindergiftige“ Bariumionenlösung unbeschadet in den Ausguss? - Bariumsulfat ist ein Mineral (Barit) ( sehr schlechte Löslichkeit, noch nicht mal in HCl )
- Einige Wasser tragen die Aufschrift: „Enteisent“. Wie ist es möglich ein Ion gezielt zu entfernen.
- Warum entfernt man nicht auf dem selben Wege Chloridionen aus dem Wasser?
- Beim Erhitzen von Wasser werden (durch komplizierte Reaktionen) Carbonate freigesetzt. Diese reagieren mit Calciumionen zu einem schwerlöslichen Salz. Wie heißt es und was für Folgen hat dies?
Kalk - ein besonderes Salz
nach:
Kalziumkarbonat ist eine chemische Verbindung mit der Summenformel CaCO3. In der Natur bildet dieses Mineral drei Calciumcarbonat-Gesteine, die zwar chemisch identisch sind, sich aber sonst in mancherlei Hinsicht unterscheiden.
- Kreide ist ein feines, mikrokristallines Sedimentgestein, das durch Ablagerung der Schalen von fossilen Kleinlebewesen (wie Coccolithen und Kammerlinge) entstanden ist. Kreide wird an zahlreichen Standorten entlang des europäischen Kreidegürtels abgebaut, von Großbritannien über Frankreich bis hin zur Insel Rügen in Norddeutschland.
- Kalkstein ist ebenfalls biologischen Ursprungs, aber stärker verfestigt als Kreide. Die eigentlichen Gesteinsbildner waren Schnecken und Muscheln sowie gesteinsbildende Korallen und Schwämme. Die Größe der Karbonatkristalle liegt zwischen derjenigen von Kreide und Marmor. Große Kalkstein-Vorkommen befinden sich im französischen Orgon sowie in Burgberg (Deutschland). Kalkgesteine finden sich auch auf der Schwäbischen und Fränkischen Alb, sowie in den Kalkalpen.
- Marmor ist ein grobkristallines, metamorphes Gestein, das entsteht, wenn Kreide oder Kalkstein unter dem Einfluss hoher Temperaturen und Drücke umkristallisiert werden. Große Marmor-Vorkommen finden sich in Nordamerika und in Europa beispielsweise in Österreich, Norwegen oder im italienischen Carrara, der Heimat des reinweißen "Statuario", aus dem Michelangelo seine Skulpturen schuf.
Obgleich mehr als vier Prozent der Erdkruste aus Kalziumkarbonat-Gesteinen besteht, sind nur wenige Lagerstätten für die Gewinnung von Füllstoffen geeignet. Reinheit, Weißgrad, Mächtigkeit und Homogenität sind nur einige der Parameter, die Geologen bei der Prospektion von Kalziumkarbonat-Vorkommen in aller Welt erfassen.
Der technische Kalkkreislauf
Durch technische Vorgänge kann Calciumcarbonat (Kalk) in Kalkmörtel umgewandelt werden. Bei der Verwendung härtet dieser durch die Reaktion mit Kohlenstoffdioxid (aus der Luft) wieder zu Calciumcarbonat aus. Dabei bilden sich lange Kalknadeln, welche die Baustoffe (wie Ziegel) gut miteinander verbinden).
Versuchsbeschreibung
a) Marmor/ Calciumcarbonat wird in Wasser gegeben. Es erfolgt ein Indikatortest!
b) Dann wird er in der Brennerflamme mehrere Minuten gebrannt und anschließend in Wasser gegeben. Führe einen Indikatortest durch!
Beobachtung
a) Keine Änderung der Indikatorfarbe
b) Es ist eine Lauge entstanden
Schlussfolgerung
Durch das Brennen ist Calciumoxid entstanden, welches mit Wasser Kalkwasser bildet. Kalkwasser ist eine Lauge - Vorsicht!

a) Gebrannter Kalk
Ab einer Temperatur von etwa 800 °C wird Kalkstein zersetzt. CO2 wird ausgetrieben und es entsteht der gebrannte Kalk:
Calciumcarbonat + E Calciumoxid + Kohlenstoffdioxid
CaCO3 + E CaO + CO2
Vorsicht: Gebrannter (ungelöschter) Kalk und gelöschter Kalk sind stark ätzend! Kontakt mit den Augen kann zur Erblindung führen! Gewöhnlicher Kalk ist dagegen harmlos.
b) Gelöschter Kalk
Wird gebrannter Kalk mit Wasser versetzt, entsteht unter Volumenvergrößerung und starker Wärmeentwicklung gelöschter Kalk, das zum Kalken von Wänden und als Zusatz zu Kalkmörtel verwendet wird.
Calciumoxid + Kohlenstoffdioxid Calciumhydroxid + E
CaO + CO2 Ca(OH)2 + E
c) Abbinden des Mörtel: An der Luft bindet gelöschter Kalk mit Hilfe von Kohlenstoffdioxid wieder zu Calciumcarbonat ab, womit sich der Kreislauf schließt. Der Vorgang des Abbindens kann durch den geringen CO2 Gehlat der Luft jahrelang dauern. In einigen alten dicken Maurn alter Burgen ist der Mörtel teilweise heute noch nicht abgebunden
Calciumhydroxid + Kohlenstoffdioxid Calciumcarbonat + Wasser + E Ca(OH)2 + CO2 CaCO3 + H2O + E
Zusatzinformationen:
Zement
Zement (lat. caementum: Bruchstein, Baustein) verbindet ähnlich wie Kalkmörtel Baustoffe wie z.B. Ziegelsteine. Zement ist besonders fest und hält sehr lange. Obwohl er nicht völlig unanfällig gegen Verwitterung ist, so halten Bauten mit Zement und Beton (einem Produkt aus Zement) sehr lange.
Zur Herstellung wird ein Gemisch aus Ton und Kalk fein gemahlen (manchmal nimmt man Mergel, welches ein natürliches Gemisch beider Stoffe ist). Das Gemisch wird in einen Drehrohofen bei 1450°C erhitzt/ gebrannt. Es entsteht dabei der Zement.
Kommt Zement mit Wasser in Berührung, bindet er ab. Dabei reagieren Calcium-Aluminium-Silikate, die beim Brennen entstanden sind mit Wasser. Es entstehen kleinste Kristalle, die sich ineinander „verfilzen“. Da das Abbinden mit Wasser funktioniert, kann er sogar unter Wasser abbinden -was besonders beim Brückenbau in Flüssen von großer Bedeutung ist.
Diese Verfestigung tritt auch noch ein, wenn die 6-8 fache Menge Sand und Kies zugefügt werden. Eine solche Mischung bezeichnet man als Beton. (Stahlbeton mit Stahlstäben).

Zusatzinformationen:
Wiederholungsfragen Ionen
Ionen & Salze
| Cl | Br | O | SO3 | |
| Li | ||||
| Ba | ||||
| Mg | ||||
| Al |
- Bestimme die Ionenladung der Ionen in der Tabelle rechts und erstelle die Summenformel, welche sie im entsprechenden Salzkristall haben:
- Nenne typische Eigenschaften von Salzen!
- Was ist ein Ion?
- Nenne verschiedene Möglichkeiten Natriumchlorid zu bilden. Schlage jeweils einen geeigneten Aufbau vor.
- Nenne die Regeln, nach denen man die Ionenladung eines Ions bestimmen kann.
- Beschreibe den Versuch zur Ionenwanderung. Welche Beobachtung kann man bei Kupfersalzen, bei Kaliumpermanganat und bei Kaliumdichromat machen. Erkläre diese Beobachtungen!
- Beschreibe den Versuchsaufbau der Elektrolyse von Kupferchlorid. Welche Beobachtungen kann man machen? Erkläre diese.
- Betrachte die Bildung von Natriumchlorid unter energetischem Aspekt im Detail. Welche Einzelschritte laufen ab?
- Sind diese Endo- oder Exotherm? Versuche dies jeweils anhand einer Modellvorstellung zu erklären.
- Warum ist die Reaktion insgesamt Exotherm?
- Definiere die Begriffe Ionisierungsenergie und Elektroaffinitätsenergie.
- Warum hat Natriumchlorid die Summenformel NaCl?
- Was versteht man unter dem Begriff „Koordinationszahl“?
- Wovon hängt die Koordinationszahl ab?
- Nenne und erkläre die Coulomb’sche Formel!
- Erkläre den Vorgang des Schmelzens. Wovon ist der Schmelzpunkt abhängig?
- Warum leiten Ionen den elektrischen Strom? Beschreibe einen entsprechenden Versuch!
- Welche Ionen sind in Natriumchlorid zu finden? Welche in Berylliumsulfat?
- Ionen entstehen durch...
- Ionen unterschieden sich von Atomen durch...
- Beschreibe den Aufbau der Salze. Nenne Möglichkeiten sie chemisch zu bilden.
- Welche Eigenschaften haben Ionen?
- Wie bestimmt man die Ladung eines Säurerestes? Welche Ladung hat der Säurerest der Chromsäure H2Cr2O7 und der Kieselsäure H2SiO3?
- Welche Voraussetzungen müssen gegeben sein, damit Ionen den Strom leiten?
- Stelle die folgende Reaktionsgleichungen auf: (Tipp: Bilde Ionen aus der Schwefelsäure)
- a) Schwefelsäure + Wasser
- b) Schwefelsäure + Magnesium
- Bestimme die Ionenladung der folgenden Ionen und erstelle die Summenformel, welche sie im entsprechenden Salzkristall haben.
- Wozu dienen Fällungsreaktionen? Nenne Beispiele!
- Erkläre das allgemeine Prinzip eines Nachweises. Nenne mindestens 6 chemische Nachweise!
- Erkläre den Begriff Ionenbindung. Wodurch werden die Ionen zusammengehalten?
- Warum hat Natriumchlorid die Summenformel NaCl? Wäre Na1000Cl1000 nicht passender?
- Erkläre den Vorgang des Schmelzens eines Salzes. Wovon ist der Schmelzpunkt abhängig?
Übungstest zum Thema „Salze und Ionen“ II
Ionenwanderung: in welche Richtung „laufen“ folgende Ionen: (1P + 2P Begr. 3P)

Begründung:
Berechnung die molare Masse von Na und Na+ aus den Massen von Protonen, Neutronen und Elektronen)
Nach einer Messung der Atom- und Ionenradien von Natrium und Chlor hat man versehentlich die Daten vertauscht.
Kannst Du sie wieder zuordnen?
(Hinweis: Atomradius bzw. Ionenradius = Entfernung von der Atomkernmitte bis zur 95% - „Grenze“ der Elektronenwolke) (Zuordnung je 0,5P; Begründung 4P 6P)
Messung 1) 186 pm sowie 97 pm
a) Natriumatom: .........
b) Natriumion: .........
Messung 2) 180 pm sowie 181 pm
c) Chloratom: .........
d) Chloridion: .........
Begründe Deine Meinung:

Summe:
Energiebilanz der Salzbildung
Die Salzbildung ist immer exotherm. Eine besonders exotherme Reaktion ist die Bildung von Natriumchlorid:
Versuchsbeschreibung
Reaktion von Natrium und Chlor.
Beobachtung
Es entsteht ein weißer Feststoff. Die Reaktion ist stark exotherm.
Schlussfolgerung
Es ist Natriumchlorid entstanden. Große Energiemengen wurden frei.
| Na | Na+ + e- | ||||
| Cl2 + 2 e- | 2 Cl- |
2 Na + Cl2 2 NaCl + E
Teilschritte der NaCl - Bildung
Die Bildung von NaCl läuft in mehreren Schritten ab. Um die Heftigkeit der Reaktion besser zu verstehen, zerlegen wir sie mal in Einzelschritte:
Welche Teilschritte müssen ablaufen, damit Natrium und Chlor zu Natriumchlorid reagieren?
1a) Na Na+
| (1) Sublimation: | (festes) Natrium(s) wird zu (gasförmigem) Natrium(g). | |
| Dazu wird Energie benötigt Sublimationsenergie ist endotherm >0
| ||
| (2) Ionisierung: | Natrium(g) wird unter Elektronenabgabe zum Na+-Ion | |
| Dazu wird Energie benötigt Ionisierungsenergie ist endotherm >0
|
1b) ½ Cl2 Cl-
| (1) Dissoziation: | Chlor wird in zwei Atome gespalten (Cl2 Cl + Cl) | |
| Dazu wird Energie benötigt Dissoziationsenergie ist endotherm >0
| ||
| (2) Elektronenaffinität: | Das Chloratom wird unter Elektronenaufnahme zum Chloridion | |
| Dabei wird Energie frei Elektronenaffinitätenergie ist exotherm <0
|
2) Gitterbildung

Die Verbindung der Ionen zu einem stabilen Verband/ Gitter setzt eine hohe Gitterenergie frei. Die freiwerdende Gitterenergie beruht auf der starken Anziehungskraft zwischen den entgegengesetzt geladenen Ionen. Die „Triebkraft“ der Salzbildung ist also hohe freiwerdende Gitterenergie nicht das Erreichen des Edelgaszustandes[4] .
Den Zusammenhang kann man sich durch folgende Anschauung verdeutlichen. Um zwei Magneten zu trennen, benötigt man Energie. Fügt man sie wieder zusammen, wird genau diese Energie wieder frei.
Vorzeichen der beteiligten Energien:
| Sublimation: | Endotherm, da ein fester Zusammenhalt gelöste werden muss | |
| Ionisierung: | Endotherm, da dem Natriumatom ein Elektron „genommen“ wird | |
(Ionisierungsenergie: Energie, die zum Ablösen eines Elektrons benötigt wird)
| ||
| Dissoziation: | Endotherm, da die beiden Atome des Moleküls „getrennt“ werden | |
| Elektronenaufnahme: | Exotherm, da Elektronen zugefügt werden. | |
| Ist eigentlich logisch, denn wenn die Ionisierung endotherm ist, dann muss der gegenteilige Prozess exotherm sein! | ||
(Die Elektronenaffinität ist die Energie, die bei der Aufnahme eines e- frei wird)
|
Gesamtbildungsenergie
| Na(s) | Na(g) | ΔHs | = | ||||
| Na(g) | Na+ + e- | ΔI | = | ||||
| ½ Cl2 | Cl | ΔHB | = | ||||
| Cl + e- | Cl- | ΔHEA | = | ||||
| Na+ + Cl- | Na+Cl- | ΔHG | = |
Na + ½ Cl2 Na+Cl-(s) ΔHR =
Berechnung der Bildungsenergie von NaCl:
Größe der Gitterenergie
Die Gitterenergie ist umso grösser, je kleiner die Ionen und je höher deren Ladung ist.
Die Bildung von Zinksulfid in Teilschritten
Die Bildung von Atomen
| Zn | (fest, Atomverband) | Zn (gasförmig) | Sublimationsenthalpie | (> 0) | |
| S | (fest, Atomverband) | S (gasförmig) | Sublimationsenthalpie | (> 0) |
[Wiederholung: Dissoziationsenthalpie Cl2 Cl]
Die Bildung von Ionen
| Zn | Zn2+ | + 2 e- | Ionisierungsenergie | (< 0) | ||
| S | + 2 e- | S2- | Elektronenaffinität | (> 0) |
Die Bildung des Ionengitters
| Zn2+ | + | S2- | Zn2+S2- | Gitterenergie | (<< 0!) |
- ↑ Schüler stoßen von selbst darauf, dass es nur ein Proton ist!
- ↑ D.h. in Wasser wird nicht genügend Energie aufgebracht, das Ionengitter zu „zerstören“. Das Salz löst sich nicht (nur in sehr geringen Mengen), solange nicht mehr Energie zugeführt wird.
- ↑ Auch wenn Menschen die Röntgenstrahlen nicht sehen können, so ist die Photoplatte dafür doch sensibel. Röntgenstrahlen schwärzen die Stellen, auf die sie treffen (denn es ist ja erstmal ein Negativ!). Nach der Entwicklung sind diese Stellen dann hell (siehe auch Abbildung)
- ↑ Die Edelgasregel ist allerdings ein geeignetes Hilfsmittel bei der Aufstellung der Ionen die an der Salzbildung beteiligt sind.





























