Natur und Technik für den Pflichtschulabschluss: Ionenbindung
Typische Vertreter dieser Bindungsart sind die Salze. In so einer Bindung verbinden sich in der Regel ein Metall mit einem Nichtmetall. Sie bilden zusammen kein Molekül sondern ein sogenanntes Ionengitter. In einem Gitter befinden sich mehrere Atome von unterschiedlichen Elementen. Sie sind abwechselnd in allen drei Richtungen eingeordnet. Die Atome des Metalls verlieren ein bis drei Elektronen und werden dadurch positiv geladene Atome (Kationen). Diese Elektronen werden von den Atomen des Nichtmetalls aufgenommen, diese Atome werden dadurch negativ geladene Atome (Anionen). Da in dieser Bindungsart Ionen entstehen, wird sie Ionenbindung genannt.
Chlor beispielsweise formt zusammen mit Natrium das uns bekannte Kochsalz (NaCl), das ist eine Ionenbindung. In dieser Bindung nimmt jedes Chloratom ein Elektron und wird zu einem Anion (Cl−). Natrium verliert sein einziges äußeres Elektron und wird zum Kation (Na+). Schauen wir den ganzen Prozess Schritt zum Schritt an:
-
Natrium hat nur ein Elektron an der äußersten Schale (rot ganz oben)
-
Chlor hingegen sieben.
-
Natrium verliert sein Elektron und wird dadurch positiv geladen (Na+).
-
Chlor nimmt dieses Elektron auf und wird dadurch negativ (Cl−)
-
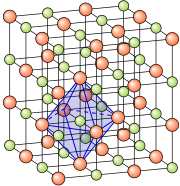
Das passiert mit vielen Atomen. Am Ende entsteht ein Kristallgitter.
Unterschiedlich geladene Ionen (positive Natrium-Ionen und negative Chlor-Ionen) ziehen sich an und formen daher ein Kristallgitter.





