Organische Chemie: Kohlenwasserstoffe
Die Stoffgruppe der Kohlenwasserstoffe ist die einfachste unter den Stoffgruppen der organischen Chemie, da alle Verbindungen dieser Stoffgruppe lediglich aus den Elementen Wasserstoff und Kohlenstoff aufgebaut sind. Dennoch sind die Verbindungen sehr vielzählig und vielfältig.
Vielen Verbindungen dieser Stoffgruppe begegnet man im täglichen Leben. Am bekanntesten sind die fossilen Brennstoffe. Weitere allgemein bekannte Verbindungen sind das durch seine klimaschädigende Wirkung in Verruf geratene Gas Methan und das zum Beispiel bei Gaskochern verwendete Gas Butan.
Die Kohlenwasserstoffe werden aufgeteilt in die Untergruppen der:
- Alkane (Einfachbindung der Kohlenstoffatome)
- Alkene (Zweifachbindung der Kohlenstoffatome)
- Alkine (Dreifachbindung der Kohlenstoffatome)
- Aromaten,
die in diesem Kapitel mit Ausnahme der Aromaten vorgestellt werden.
Um komplexere Verbindungen verstehen zu können, ist ein Verständnis der Kohlenwasserstoffe wichtig. Die Kohlenwasserstoffe sind also Grundlage der organischen Chemie.
Homologe Reihe der Alkane
[Bearbeiten]

Der Einstieg in die organische Chemie bildet meistens das Methan. Es ist eines der einfachsten organischen Stoffe und im täglichen Leben vielen Menschen bekannt.
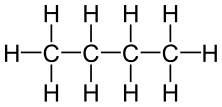
Methan wird zur homologen Reihe der Alkane gezählt. Diese Reihe der Alkane ist sehr umfangreich: Vaseline wird genauso wie Butan, Propan oder Paraffin zur homologen Reihe der Alkane gezählt. Die folgende Tabelle gibt einen Überblick über die ersten fünf Alkane.
| Name | Methan | Ethan | Propan | Butan | Pentan |
| Summenformel | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
| Strukturformel | 
|

|

|
|

|
Vergleicht man die Alkane oben in der Tabelle, so stellt man folgendes fest:
- Alle Alkane sind nur aus den Elementen Kohlenstoff und Wasserstoff aufgebaut.
- Alle C-Atome der Alkane sind über Einfachbindungen miteinander verbunden.
- Alle Bindungen der C-Atome sind "belegt", d.h. jedes C-Atom ist mit vier weiteren Atomen verbunden. (Deshalb, und weil es nur Einfachbindungen gibt, spricht man von den sogenannten gesättigten Kohlenwasserstoffen.)
Benennung der Alkane
[Bearbeiten]Die Alkane sehen am Anfang wohl recht kompliziert aus, was vielleicht an den eigenartigen Namen liegt. Die Benennung der Alkane folgt aber einer einfachen Regel:
- Entsprechend der Anzahl der C-Atome wählt man die entsprechende Vorsilbe aus der Tabelle unten. Dies gilt aber erst ab einer C-Atom-Anzahl von fünf.
| Anzahl der C-Atome | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Vorsilbe | meth- | eth- | prop- | but- | pent- | hex- | hept- | oct- | non- | dec- |
- Da es sich um einen gesättigten Kohlenwasserstoff handelt, bekommt die Vorsilbe die Endung -an angehängt. (Wie sich im weiteren Verlauf des Kapitels zeigen wird, gibt es noch einige andere Endungen, die Vorsilben sind aber immer die gleichen!)
Beispiel: Das Alkan C9H20 sei zu benennen. Da es neun C-Atome besitzt, nimmt man die Vorsilbe Non- und hängt die Endung -an an: Nonan.
Zu wissen, wie die Vorsilben für die ersten zehn Alkane heißen, reicht meist vollkommen aus.
Was ist eine homologe Reihe?
[Bearbeiten]In der Tabelle oben folgt auf das Methan (CH4) das Ethan (C2H6). Das Ethan ist um eine CH2-Gruppe gewachsen. Die allgemeine Formel zur Berechnung der Anzahl der Wasserstoffatome auf n Kohlenstoffatome lautet demnach: 2n+2. Man kann also voraussagen, wie die Summenformel eines Alkans mit zum Beispiel fünf C-Atomen lautet: C5H12. In solch einem Fall spricht man dann von einer homologen Reihe.
Hinweis: Es existieren auch ringförmige Alkane. Diese erhalten bei der Benennung die Vorsilbe Cyclo- (zum Beispiel C6H12: Cyclohexan). Auch bei den ringförmigen Alkanen ist die Summenformel mit der Formel CnH2n voraussagbar und daher bilden sie auch eine homologe Reihe.
Eine homologe Reihe ist eine Gruppe von Stoffen, deren Summenformel immer voraussagbar ist und die sich in ihren Eigenschaften ähneln.
Die allgemeine Summenformel lautet bei Alkanen: CnH2n+2. Die allgemeine Summenformel bei ringförmigen Alkanen lautet: CnH2n. Sie erhalten außerdem die Vorsilbe Cyclo-.

Eigenschaften der Alkane
[Bearbeiten]Siede- und Schmelztemperatur
[Bearbeiten]Abbildung 3 zeigt Siede- und Schmelztemperatur der homologen Reihe der Alkane in Abhängigkeit der Anzahl der C-Atome. Es zeigt, dass Siede- und Schmelztemperatur mit Längenzuwachs der Kohlenstoffkette immer weiter zunehmen. Alkane mit 1 ≤ n ≤ 4 sind daher unter Raumtemperatur (20° C) gasförmig, Alkane mit 5 ≤ n ≤ 16 flüssig und alle Alkane mit n > 16 fest. Der Steigende Schmelz- und Siedepunkt resultiert hier aus den größeren Van-der-Waals-Kräften, die zwischen den Molekülen wirken.
Van-der-Waals Kräfte
[Bearbeiten]
Die Elektronen eines Atoms bewegen sich stetig um dessen Kern. Dabei kann es vorkommen, dass sich in einem kurzen Moment die Elektronenkonzentration auf eine Seite des Atoms verlagert und das Atom nach außen hin kurzzeitig wie ein polarisiertes Teilchen wirkt. Trifft nun in genau diesem Moment ein weiteres Atom auf das polarisierte, so ziehen diese sich kurzzeitig auf Grund ihrer Ladungsungleichheit an.
Die Stärke der Van-der-Waals Kräfte hängt von der Größe der Oberfläche des Atoms bzw. Moleküls ab. Unterscheidet man beispielsweise den Siedepunkt von Sauerstoff (−182,97 °C) und Chlor (−34,04 °C), so stellt man fest, dass dieser bei Sauerstoff viel niedriger ist. Dies liegt daran, dass ein Chlormolekül mehr Außenelektronen besitzt als ein Sauerstoffmolekül und damit die Oberfläche des Moleküls größer ist, was wirksamere und damit stärkere Van-der-Waals Kräfte zur Folge hat.
Aus diesem Grund sind einfache Alkane (wie Methan oder Ethan) gasförmig, größere Alkane (wie Octan) bereits flüssig und sehr langkettige Alkane (wie Eikosan) fest.
Betrachtet man die unter Standardbedingungen flüssigen Alkane näher, so fällt außerdem auf, dass mit steigender Kettenlänge die flüssigen Alkane immer zähflüssiger bzw. viskoser werden. Man spricht dabei von steigender Viskosität.
Zwischen Molekülen wirken die sogenannten Van-der-Waals Kräfte. Van-der-Waals Kräfte beruhen auf den zufälligen Elektronenbewegungen und der damit einhergehende Möglichkeit der kurzzeitigen Polarisierung von Teilchen (auf Grund von Elektronenkonzentrationsverschiebungen um den Atomkern), was zur Folge hat, dass diese sich auf Grund der Ladungsungleichheit anziehen. Je größer die Oberfläche eines Atoms bzw. Moleküls desto stärker wirken die Kräfte.
Löseverhalten
[Bearbeiten]Versucht man Pentan in Wasser zu lösen, bemerkt man schnell, dass sich die beiden Stoffe nicht vermischen. Versucht man aber das selbe Pentan mit Benzin zu vermischen, ist man dagegen erfolgreich. Dies hat mit den unterschiedlichen Wechselwirkungen zwischen den H2O-Molekülen des Wassers (Dipol-Dipol-Kräfte) und den Molekülen des verwendeten Alkans (Van-der-Waals Kräfte) zu tun. Wasser ist eine polare Atombindung, was die Bildung von Dipolen, die sich über Wasserstoffbrückenbindungen anziehen, zur Folge hat. Alkane dagegen sind völlig unpolar und werden nur durch die, im Vergleich zu den Wasserstoffbrückenbindungen, relativ schwachen Van-der-Waals Kräfte untereinander angezogen. Aus diesem Grund bilden sich bei dem Versuch einer Mischung von Alkanen in polaren Lösungsmitteln (wie dem Wasser) immer zwei separate Schichten.
Für diese Löseverhalten gibt es bestimmte Fachbegriffe:
- Polare Verbindungen sind hydrophil aber lipophob, also wasserlöslich und fettabweisend.
- Unpolare Verbindungen hingegen sind hydrophob und lipophil, also wasserabweisend und fettlösend.
Alkane sind unpolare Verbindung die lipophile und hydrophobe Eigenschaften aufweisen. Sie eignen sich daher als Lösungsmittel für andere unpolare Stoffverbindungen.
Die Viskosität ist ein Maß für die Zähflüssigkeit eines flüssigen Stoffes. Je größer die Viskosität ist, desto zähflüssiger ist die entsprechende Flüssigkeit. Die Ursache der Viskosität sind die Van-der-Waals Kräfte.
Homologe Reihe der Alkene
[Bearbeiten]
Die homologe Reihe der Alkene zählt wie die homologe Reihe der Alkane auch zu der Gruppe der Kohlenwasserstoffe. Im Vergleich zu den Alkanen besitzt ein Alken allerdings an einer beliebigen Stelle eine -Doppelbindung. Das einfachste Alken ist demnach das Ethen, darauf folgt das Propen und das Buten:
| Name | Ethen | Propen | Buten |
| Summenformel | C2H4 | C3H6 | C4H8 |
| Strukturformel | 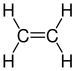
|
... | ... |
| Siedepunkt | −140 °C | −48 °C | −6 °C |
Bei den Alkenen spricht man von ungesättigten Kohlenwasserstoffen, da die C-Atome der -Doppelbindung nicht die größtmögliche Anzahl an H-Atome binden und deswegen die freien Elektronen eine Atombindung eingehen. Daher sind die Alkene weniger stabil (den Beweis hierfür liefert die Verbrennung von Ethan und Ethen: bei letzteren wird mehr Energie bzw. Wärme frei). Die Namen der Alkene leiten sich von den Namen der Alkane ab. Die Endsilbe -en weist daraufhin, dass es sich um ungesättigte Kohlenwasserstoffe handelt.

Da es sich um eine homologe Reihe handelt sind, wie auch bei den Alkanen, die Summenformel eines beliebigen Alkens mit der Formel CnH2n und bestimmte Eigenschaften (wie Aggregatzustand und Standardbedingungen, siehe Siedepunkte in Tabelle oben) voraussagbar.
Tropische Früchte wie Ananas oder Bananen werden unreif eingeflogen und hier mit dem Gas Ethen besprüht. Das Ethen ist ein Botenstoff, der die Reifung der Früchte vorantreibt.
Reife Früchte sondern das Gas in besonders hohen Mengen aus, was unreife Früchte zum Reifen bringt (grüne Tomaten zwischen roten nachreifen lassen).
Gewinnung von Ethen
[Bearbeiten]Das Alken Ethen kann durch ganz unterschiedliche Verfahren technisch hergestellt werden. Ethen ist Ausgangsstoff wichtiger Verbindungen und dient vor allem zur Herstellung von Kunststoffen.

Cracken
[Bearbeiten]Durch Einwirkung von sehr hohem Druck und hoher Temperatur werden die Einfachbindungen eines Alkanmoleküls getrennt und die zwei frei werdenden Elektronen gehen eine Elektronenpaarbindung ein. Es entsteht die -Doppelbindung. Abbildung 7 veranschaulicht diesen Prozess. Dieser Vorgang muss genau abgestimmt sein, damit keine (ungewollten) anderen Reaktionsprodukte auftreten.
Gewinnung aus Ethan
[Bearbeiten]Durch Abspaltung von zwei H-Molekülen eins Ethanmoleküls entsteht Ethen. Man spricht hierbei von Dehydrierung. Da ständig Energie in Form von Wärme zugeführt werden muss, handelt es sich um eine endotherme Reaktion, was wiederum ein Zeichen für den höheren Energiegehalt und damit höhere Instabilität der -Doppelbindung ist.
Reaktionen der Alkene
[Bearbeiten]Unter Hitze- und Luftausschluss zerfällt Ethen in das Alkan Methan und reinen Kohlenstoff.
Die oben gezeigte Reaktion der Dehydrierung ist auch umkehrbar. Ethen reagiert mit Wasserstoff unter hohem Druck und Anwesenheit eines Katalysators (zum Beispiel Platin) zu Ethan. Man spricht hier von der sogenannten Additionsreaktion.
Neben der Additionsreaktion mit H2 gehen Alkene auch Additionsreaktionen mit Wasser und Halogenen ein. Der Additionsreaktion von Alkenen mit Halogenen ist ein eigenes Kapitel gewidmet. Siehe Reaktionsmechanismen von Kohlenwasserstoffen: Die Additionsreaktion
Homologe Reihe der Alkine
[Bearbeiten]
Durch weiteres Dehydrieren eines Alkens werden zwei weitere Wasserstoffatome abgespalten. Es entsteht ein Molekül mit der allgemeinen Summenformel CnH2n-2 und einer CC-Dreifachbindung. Diese Moleküle werden zur homologen Reihe der Alkine zusammengefasst.
| Name | Ethin | Propin | (1-)Butin |
| Summenformel | C2H2 | C3H4 | C4H6 |
| Strukturformel | 
|

| |
| Siedepunkt | −84 °C (Sublimation) | −23 °C | 8 °C |
Wie die Alkene sind auch Alkine ungesättigte Kohlenwasserstoffe. Sie sind im Vergleich zu den Alkenen noch energiereicher.
Herstellung von Ethin aus Ethen
[Bearbeiten]Spaltet man dem Ethen zwei weitere Wasserstoffatome ab, so entsteht das Gas Ethin (auch als Acetylen bzw. Azetylen bezeichnet).
Wiederum handelt es sich um eine endotherme Reaktion, was darauf hinweist, dass es sich bei dem entstandenen Molekül um ein sehr energiereiches handelt.
Isomerie
[Bearbeiten]Moleküle,die die gleiche Summenformel aufweisen,aber unterschiedliche Strukturformeln haben, nennt man Isomere. Die betreffenden Moleküle und ihre Isomere besitzen aufgrund der gleichen Summenformel auch dieselbe Masse, jedoch variieren die Siede-und Schmelzpunkte der entsprechenden Moleküle untereinander. Diese Erscheinung ist als Isomerie bekannt.









