Organische Chemie für Schüler/ Carbonylverbindungen
Darstellung von Aldehyden und Ketonen aus Alkoholen[Bearbeiten]
a) Die Reaktion von Kupferoxid mit Ethanol
V: Frisch oxidiertes (noch heißes) CuO wird in Ethanol/ Spiritus gegeben
B: Das schwarze Kupferoxid wird wieder rötlich/ kupferfarben, aromatischer Geruch
S: Es hat sich Kupfer gebildet → es fand eine Reduktion von CuO statt. Reduktionen laufen aber immer zusammen mit Oxidationen ab (=Redoxreaktionen). Wer wurde also oxidiert?
→ Ethanol muss oxidiert worden sein.
- Ethanol und Kupfer(II)-Oxid reagiert zu Ethanal und elementarem Kupfer und Wasser
Kupferoxid wird zu Kupfer reduziert, d.h. die Fläche des schwarzen Blechs, das mit Alkohol in Berührung kommt wird wieder blank. Die bei dieser Reduktion aufgenommenen Elektronen werden vom Ethanol abgegeben, welches so zu Ethanal oxidiert.
Bestimmen von Oxidationszahlen in organischen Molekülen[Bearbeiten]
- Zur Bestimmung von Oxidationszahlen werden in organischen Verbindungen zuerst alle Bindungen hinsichtlich der Elektronegativitätsdifferenzen untersucht und dann dem jeweils elektronegativeren Bindungspartner die Bindungselektronen „zugeteilt“.
- Die Anzahl der Bindungselektronen, die nach der vorherigen Zuordnung „noch mit einem Atom in Kontakt“ sind, wird gezählt und mit der Stellung (also der Haupt-gruppennummer) im PSE verglichen. Im Falle des oberen Kohlenstoffs (siehe Bei-spiel) sind ihm 5 Elektronen zugeordnet, d.h, im Vergleich zur Stellung im PSE (4. HG) hat er ein (negatives) Elektron zuviel → die Oxidationszahl ist -I.
- Aufgaben
- Bestimme nach dieser Methode alle Oxidationszahlen in CO2, C6H12O6, Isobutanol, einer Aminosäure Deiner Wahl.
- Zusatzinformationen
Die Reaktion von Butanol mit Kaliumdichromat (theoretischer Versuch)[Bearbeiten]
Material: 3 Reagenzgläser oder Erlenmeyerkolben, 1-Butanol, 2-Butanol, 2-Methyl-2-Propanol (tertiärer Alkohol), schwefelsaure Kaliumdichromatlösung Tipp: Alkohole auf ca. 40°C im Wasserbad vorwärmen.
Vom Butanol gibt es drei verschiedene Isomere. Man bezeichnet sie als primäres, sekundäres und tertiäres Butanol. Reagieren sie bei Redoxreaktionen unterschiedlich?
Darstellung von Aldehyden aus primären Alkoholen[Bearbeiten]
V1: In einem Erlenmeyerkolben werden 10ml 1-Butanol (=primäres Butanol) mit 3ml schwefelsaurer Kaliumdichromatlösung versetzt. Dann wird das Gemisch leicht erwärmt.
B1: Farbumschlag von orange nach grün
Darstellung von Ketonen aus sekundären Alkoholen[Bearbeiten]
V2: In einem Erlenmeyerkolben werden 10ml Butan-2-ol (=sekundäres Butanol) mit 3ml schwefelsaurer Kaliumdichromatlösung versetzt. Dann wird das Gemisch leicht erwärmt.
B2: Farbumschlag von orange nach grün, anderer Geruch als bei V1
Darstellung mit tertiären Alkoholen[Bearbeiten]
V3: In einem Erlenmeyerkolben werden 10 ml 2-Iso-Butanol (=tertiäres Butanol) mit 3 ml schwefelsaurer Kaliumdichromatlösung versetzt. Dann wird das Gemisch leicht erwärmt.
B3: kein Farbumschlag → keine Reaktion!
Schlussfolgerungen V1-V3:
Primäre und sekundäre Alkohole reagieren mit Kaliumdichromat (K2Cr2O7). Es bildet sich dabei das grüne Cr-(III). Unter diesen Reaktionsbedingungen findet keine Reaktion bei tertiären Alkoholen statt.
S1: Die orange Reagenzlösung färbt sich auf Grund der entstehenden Cr3+‑Ionen grün
Der primäre Alkohol wird zum Aldehyd oxidiert.
- Ein Alkohol reagiert mit Kaliumdichromat und Oxoniumionen zu einem Aldehyd, Chrom-(III)-Ionen und Wasser.
S2: Die Reagenzlösung färbt sich auf Grund der entstehenden Cr3+‑Ionen grün
Der sekundäre Alkohol wird zum Keton oxidiert.
- Reduktion
- Oxidation
Aldehyde und Ketone können durch „Dehydrierung“ von Alkoholen erhalten werden (so kamen sie früher zu ihrem Namen: Alcoholus dehydrogenatus = Aldehyd).
Tertiäre Alkohole lassen sich nicht auf diesem Wege oxidieren.[Bearbeiten]
- Zusatzinformationen'
Auch tertiäre Alkohole können oxidiert werden - aber nur mit etwas mehr Gewalt. Dabei müssen dann C–C-Bindungen gespalten werden. Es entstehen Kohlenstoffdioxid und Wasser.
Wiederholung: Schritte zum Erstellen der Redoxreationsgleichungen[Bearbeiten]
Die folgenden Schritte sollen für Dich ein Rezept darstellen, nach dem Du vorgehen kannst, wenn Du in Zukunft Reaktionsgleichungen für Redoxreaktionen aufstellst. Bei einfachen Aufgaben kannst Du den Schritt 5 & 6 überspringen.
Eine kleine Warnung für alle Schnellrechner: Überspringst Du einen Schritt, wird das Ergebnis in der Regel falsch sein!
- Unvollständige Gleichung aus dem Experiment aufstellen (Ausgangsstoffe → Produkten)
- Oxidationszahlen ermitteln (Oxidation und Reduktion bestimmen)
- Teilgleichungen aufstellen
- Anzahl der jeweils aufgenommenen oder abgegebenen e- ermitteln
- Ladungsausgleich - in alkalischer Lösung mit (OH)- (=Hydroxidionen) - in saurer Lösung durch (H3O)+ (=Oxoniumionen)- (in manchen Büchern wird auch mit O2- ausgeglichen)
- Stoffbilanz mit Wasser
- Elektronenanzahl der Teilgleichungen untereinander durch Multiplikation ausgleichen
- Teilgleichungen „addieren“ und so die gesamt Gleichung aufstellen. Fast fertig!
- Überlegen, ob Energie benötigt oder freigesetzt wird
- Überprüfung der Gleichung durch Probe (Dazu zählt man wie oft jedes Element und jede Ladung auf beiden Seiten vorkommt - die Zahlen müssen immer gleich sein!)
Tipps:
- Nur Wasserstoff, Stickstoff, Sauerstoff und die Elemente der 7. HG kommen als zweiatomiges Element vor: → H2, N2, O2, F2, Cl2, Br2, I2 (es gibt also niemals Fe2 oder Al4 als Element!)
- Überlege Dir immer gut, ob die Formel, die Du gerade erstellt hast, überhaupt logisch ist und sie Dir bekannt vorkommt. Ein einfaches Zusammenzählen aller Atome ist nämlich nur sehr selten die richtige Lösung: z.B. verbrennt CH4 + O2 nicht zu CH4O2, sondern zu CO2 + H2O (Kohlenstoffdioxid und Wasser).
- Zusatzinformationen
Schrittweise Lösung der Redoxreaktion am Beispiel: Ethanol wird zu Ethanal oxidiert[Bearbeiten]
- Ausgangsstoffe und Endstoffe aufstellen: (CrVI2O7)2-, Ethanol → Ethanal, Cr3+
- Oxidationszahlen bestimmen
- Teilgleichungen aufstellen, Oxidations- und Reduktionsschritt bestimmen
red: (CrVI2O7)2- → 2 CrIII 3+ O
ox: H3C–H2C-I-O-H → H3C–CI H - Elektronenanzahl der jeweils aufgenommenen oder abgegebenen e- ermitteln
red: (CrVI2O7)2- + 3e- → 2 CrIII 3+ O
ox: H3C–H2C-I–O-H → H3C–CI + 2e- H - Ladungssumme ausgleichen (beachten: saures Milieu (H3O+/H2O) oder alkalisch (OH-/H2O)?)
red: (CrVI2O7)2- + 6e- + 14H3O+→ 2 CrIII 3+ O
ox: H3C–H2C-I–O-H + 2H2O → H3C–CI + 2e- + 2H3O+ H - Stoffbilanz mit Wasser red: (CrVI2O7)2- + 6e- + 14H3O+ → 2 CrIII 3+ + 21H2O
ox: H3C–H2C-I–O-H + 2H2O → H3C–CI + 2e- + 2H3O+ H - Elektronenzahlen der Teilgleichungen untereinander ausgleichen
red: (CrVI2O7)2- + 6e- + 14H3O+ → 2 CrIII 3+ + 21H2O
ox: 3 H3C–H2C-I–O-H + 2H2O → 3H3C–CI + 6e- + 6H3O+ |·3 \ H - Teilgleichungen addieren (e-, H2O, H3O+ „kürzen“) O
(Cr2O7)2- + 8H3O+ + 3H3C–H2C–OH + → 2Cr3+ + 15H2O + 3H3C–C H - Überlegen, ob Energie benötigt oder freigesetzt wird: Die Reaktion ist minimal exotherm
- Probe Cr: 2/2, H: 24 + 18/ 30 + 12 (Summe: 42), O: 7+8+3/ 15+3 (Summe: 18)
Was sind Aldehyde?[Bearbeiten]
Aldehyde ( auch Alkanale genannt) sind Verbindungen, welche als funktionelle Gruppe mindestens eine endständige Carbonylgruppe besitzen. Diese wird dann auch als Aldehydgruppe bezeichnet. Natürlich existieren auch Mehrfachaldehyde - diese tragen Aldehydgruppen z.B. an zwei offenen Enden der Kohlenstoffkette.
Der Name „Aldehyd“ leitet sich als Kurzform von lateinisch alcohol(us) und dehydrogenatus ab (dehydrierter Alkohol).
Die Aldehydgruppe am Beispiel des einfachsten Aldehyds:[Bearbeiten]

Durch ihre funktionelle Gruppe sind Aldehyde recht reaktiv.
- Doppelbindungen sind reaktiver als Einfachbindungen. Bei Aldehyden ist die polare Doppelbindung (durch das elektronegative Sauerstoffatom) besonders reaktiv für Additionsreaktionen. Die Polarisierung der Doppelbindung aktiviert also die Doppelbindung noch stärker. Sie ist somit ein guter Ansatzpunkt für nukleophile Additionen
- Die Polarisierung der Doppelbindung wirkt sich ebenfalls auf die C-H Bindung aus (-I-Effekt). Die Folge ist eine Zunahme der Azidität. (Ein Elektronenmangel am Kohlenstoff wird teilweise durch eine Verlagerung der C-H Bindung kompensiert. Dadurch wird die C-H Bindung stärker polarisiert und somit geschwächt: → Ein Proton (H+) kann leichter abgegeben werden.→ Aldehyde reagieren leicht sauer!
- Bei Aldehyden gibt es oft eine Keto- und Enolform (Keto-Enol-Isomerie)[1].
Nomenklatur
Aldehyde werden durch den Namen des Alkans und der Endung -al bezeichnet[2] (Methan → Methanal, Ethan → Ethanal usw.).
Da viele Aldehyde den Menschen bereits lange bekannt sind, haben sie zusätzlich oft noch ihre historisch entstandenen Trivialnamen. Man sollte die ersten drei zumindest mal gehört haben, da sie scheinbar unausrottbar sind ;-)
Diese Trivialnamen leiten sich von der weiteroxidierten Form des Aldehyds (der Carbonsäure) ab. Für Methanal ist die oxidierte Form Methansäure (lat. acidum formicum) → Formaldehyd
Für Ethanal ist die oxidierte Form Ethansäure (lat. acidum aceticum → Acetaldehyd usw.
| IUPAC-Bezeichnung | Trivialnamen | Siedepunkt in °C | Summenformel[3] |
|---|---|---|---|
| Methanal | Formaldehyd | -19,5 | CH2O |
| Ethanal | Acetaldehyd | 21 | CH3CHO |
| Propanal | Propionaldehyd / Propylaldehyd | 48 | C2H5CHO |
| Butanal | Butyraldehyd | 75 | C3H7CHO |
| Pentanal | Valeraldehyd / Amylaldehyd | 103 | C4H9CHO |
| Hexanal | Capronaldehyd / Hexaldehyd | 131 | C5H11CHO |
| Heptanal | Oeanantaldehyd / Heptaldehyd | 153 | C6H13CHO |
| Octanal | Caprylaldehyd / Octylaldehyd | 171 | C7H15CHO |
| Nonanal | Pelargonaldehyd / Nonylaldehyd | 193 | C8H17CHO |
Verwendung und Vorkommen von Aldehyden
- Vor allem Formaldehyd (=Methanal) wird als Ausgangsstoff in der chemischen Industrie häufig verwendet (Ausgangsstoff u.a. für die Herstellung von Kunststoffen, Lösungsmitteln, Farbstoffen, Parfums und Medikamenten).
- Da es giftig ist und außerdem im Verdacht steht krebserzeugend zu sein, wird es als reines Produkt nicht mehr verwendet. Man findet es teilweise auch heute noch in Desinfektionsmitteln (die so genannte Formalinlösung) und als Flüssigkeit in organischen, biologischen Präparaten.
- Die Giftigkeit des Formaldehyds kommt u.a. dadurch zustande, dass es ein starkes Reduktionsmittel ist.
- Teilweise findet man Formaldehyd auch in neu erworbenen Kleidungsstücken! Es soll einem Befall mit Schädlingen in Lagerhäusern der wärmeren Zonen vorbeugen. Aus diesem Grunde ist es immer empfehlenswert neue Kleidung vor dem Tragen gut zu waschen (v.a. billige Kleidungsstücke!).
- Aldehyde spielen im menschlichen Stoffwechsel eine wichtige Rolle als Zwischenprodukt. Ethanal entsteht z.B. im Verlauf der Abbaureaktion in der Leber. Es ist maßgeblich für den „Kater“ verantwortlich.
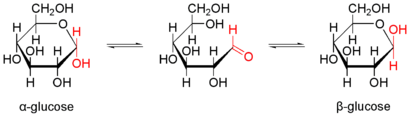
Letztlich muss noch erwähnt werden, dass einige Zucker Aldehyde oder Ketone sind:

Reaktionen der Aldehyde[Bearbeiten]
a) Nukleophile Additionen an Aldehyden[Bearbeiten]
- Ein nukleophiles Teilchen mit seinen freien Elektronenpaaren (z.B. ein Molekül wie H2O) wird durch die C=O Doppelbindung angezogen und bindet an den Kern des Kohlenstoffatoms (da dieser elektropositiver ist). Der Sauerstoff bekommt durch das Anbinden eine negative Ladung. Liegen freie Protonen vor (also bei Reaktionen in Wasser oder im sauren Milieu) findet dann eine Verbindung zwischen dem negativen Sauerstoff und einem Proton statt (OH-Bildung aus der Carbonylgruppe).
- Oxidation von Aldehyden zur entsprechenden Carbonsäure (wichtige Nachweisreaktion).
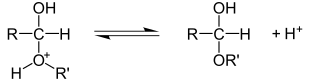
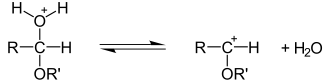
b) Addition von Wasser an Aldehyde und Ketone - Hydratbildung[Bearbeiten]
Mischt man Aldehyde (z.B. Ethanal) mit Wasser, bilden sich so genannte Aldehydhydrate. Diese Reaktion gelingt besser, wenn sie im leicht Sauren stattfindet:

Nach der Protonierung der Carbonylgruppe greift das Wassermolekül als Nucleophil mit dem freien Elektronenpaar seines Sauerstoffatoms den elektrophilen Carbonylkohlenstoff an. Ein Proton wird abschließend wieder abgespalten.
c) Addition von Alkohol an Aldehyde und Ketone - Halbacetalbildung[Bearbeiten]
Die Reaktion funktioniert im Grunde wie die Vorherige, nur dass statt Wasser ein Alkohol verwendet wird.
d) Addition von Halbacetalen an Aldehyde und Ketone - Acetalbildung[Bearbeiten]
- Halbacetal + Alkohol → Acetal + Wasser
Beispiel: Ringschluss bei Zuckermolekülen (Zucker sind Aldehyde!)
e) Aldolreaktion[Bearbeiten]
Gibt man zu Aldehyden eine Base, so reagiert diese durch Abspaltung in der Regel mit dem aziden Wasserstoff zu Wasser.


Das gebildete Aldol ist also ein Kondensationsprodukt aus Alkohol und Aldehyd. Dies ist eine Möglichkeit neue C–C Bindungen zu bilden, bzw. Moleküle zu verknüpfen.
- Nachweise von Aldehyden
- Tollensprobe
- Fehlingprobe
- Schiffsche Probe
- Zusatzinformationen
Oxidation von Glycerin[Bearbeiten]
Es gibt zwei Möglichkeiten:
- Aldehydbildung
- Glycerin reagiert mit Kupfer(II)-oxid zu 2,3-Di-Hydroxy-1-Propanal und Kupfer
- Ketonbildung
- Glycerin reagiert mit Kupfer(II)-oxid zu 1,3-Di-Hydroxy-2-Propanon und Kupfer
Die sich dahinter verbergende Reaktion ist eine Redoxreaktion.
Was sind Ketone?[Bearbeiten]

In Ketonen liegt ebenfalls eine Carbonylgruppe vor. Der Sauerstoff ist wieder mit einer Doppelbindung an einen Kohlenstoff gebunden. Der Kohlenstoff ist allerdings sekundär, d.h. er hat zwei Kohlenstoffnachbarn.
Ketone entstehen durch Oxidation sekundärer Alkohole. Sie werden auch Alkanone genannt. Das einfachste Keton ist Propanon (=Aceton).
Die Verwendung der Ketone entspricht ungefähr der Verwendung der Aldehyde (für chemische Industrie, Medizin-, Kosmetik- und Parfüm-Industrie).
- Nomenklatur
Ketone haben den Alkanen entsprechende Namen mit der Endung -on.
(Propan → Propanon usw.)
- Eigenschaften
- Ketone geringer Kettenlänge sind leicht polar und somit in Wasser löslich.
- kurzkettige Ketone sind dünnflüssige, farblose Flüssigkeiten.
- eine weitergehende Oxidation von Ketonen zur Carbonsäure ist nicht möglich. Dies ist der chemische Unterscheidungshinweis zu den Aldehyden (welche die Carbonsäuren bilden können).
- Wenn Ketone oxidieren, dann nur unter Aufbrechen einzelner C–C Bindungen zu Kohlenstoffdioxid und Wasser.
- Das C, welches mit der Ketongruppe verbunden ist, wird durch seine Nachbarn mit einem +I-Effekt stabilisiert.
- Ketone zeigen eine niedrigere Reaktionsfreudigkeit im Vergleich zu den Aldehyden.
- Ketone riechen in der Regel angenehmen und fruchtig.
- Herstellung
- Neben der Oxidation von sekundären Alkoholen ist die wichtigste Herstellungsmethode für aromatische Ketone die Friedel-Crafts-Acylierung. (LK)
- Reaktionen
- Auch Ketone (so wie Aldehyde) zeigen Additions- und Kondensationsreaktionen.
- Gleichgewichtsreaktion der Ketone mit ihrer tautomeren Form, den Enolen (Keto-Enol-Tautomerie) (LK)
- Wichtige Vertreter der Ketone
Aceton, Cyclohexanon, Absinthol, Himbeerketon, Mycosporin
- Zusatzinformationen
Reaktionen von Aldehyden und Ketonen mit Kaliumpermanganat[Bearbeiten]
Material: Ethanol, Propanon, schwefelsaure Kaliumpermanganatlösung.
V: Im Reagenzglas gibt man zu wenig Ethanal bzw. Propanon schwefelsaure Kaliumpermanganatlösung, leicht erwärmen.
B: Essiggeruch, es entsteht zuerst ein brauner Niederschlag, dann eine farblose Lösung.
S: Der Ansatz mit Ethanal entfärbt sich unter Bildung von Essigsäure und anfänglichem braunen MnO2 Niederschlag. Dann bilden sich farblose Mn2+-Ionen.
Aldehyde lassen sich im Gegensatz zu Ketonen mit schwefelsaurer Kaliumpermanganatlösung zu Carbonsäuren oxidieren.
- Aufgaben
- Propanon geht unter diesen Bedingungen keine Redoxreaktion ein. Warum eigentlich nicht?
Nachweisreaktionen für Aldehyde[Bearbeiten]
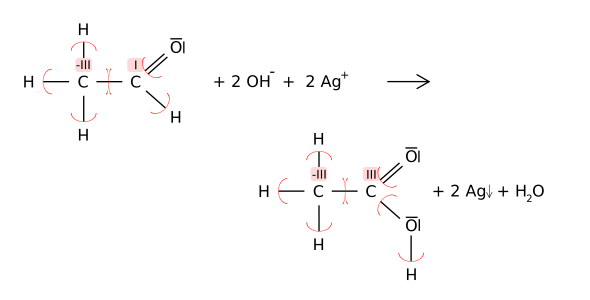
a) Silberspiegelprobe (Tollensreaktion)[Bearbeiten]
V: Herstellen der Nachweisreagenz (Tollensreagenz): In ein fettfreies RG werden einige Tropfen AgNO3-Lösung und soviel verdünnte Ammoniaklösung getropft, bis sich der anfangs gebildete weiße Niederschlag wieder auflöst. Evtl. kann noch etwas OH- zugefügt werden.
Zu dieser klaren Lösung werden 2ml eines Aldehyds (z.B. Ethanal, für einen schönen Silberspiegel kann man auch eine Spatelspitze Glucose in 1ml Wasser nehmen) zugegeben.
Beide Lösungen werden vermischt und in ein Becherglas mit fast kochendem Wasser gestellt (T>70°C). Das RG nicht bewegen!
B: An der Glaswand bildet sich nach ca. 5min. ein Silberspiegel.
S: Die Silberanionen werden durch das Aldhyd (bzw. der „Aldehydform“ der offenen Form der Glucose) zu elementarem Silber reduziert. Das Aldehyd reagiert zur Carbonsäure (aus Glucose entsteht Gluconat.[4]).
Die Funktionsweise[5] der Tollensreaktion am Beispiel des Ethanals (Redoxreaktion)[Bearbeiten]
- Zusatzinformationen
b) Die Fehlingprobe[Bearbeiten]
V: In je einem RG wird 1ml Propanal bzw. Aceton gefüllt. Man gibt 2ml Fehling I und 2ml Fehling II - Lösung hinzu. (1:1) hinzu und erhitzt unter dauerndem Schütteln bis zum Sieden.
Hinweis: Fehling 1: verdünnte CuSO4 Lösung
(z.B. 7g Kupfersulfatpentahydrat auf 100 ml Wasser)
Fehling 2: alkalische Kaliumnatriumtartrat-Lösung (10g NaOH in 50 ml Wasser auflösen und darin 34g Kaliumnatrium-tartrat-tetrahydrat (KNaC4H4O6 · 4 H2O) auflösen und dann auf 100ml auffüllen).
Vorsicht beim Erhitzen. Siedeverzug und Entzündungsgefahr!
B: Propanol und Fehlingreagenz färbt sich nach dem Erhitzen von tiefblaue (klare Lösung) zu ziegelrot (trübe Lösung).
Aceton und Fehlingreagenz regaieren nicht!
S: Cu2+ Ionen sind blau gefärbt. Cu+ Ionen liegen im Tartratkomplex[6] in einer roten Farbe vor. (freie Cu+ Ionen sind eher grün!). → es findet also eine Redoxreaktion statt:
Die Aldehydgruppe reduziert das Cu(II)-Ion der Fehlingschen Lösung zu rotem Cu(I)-oxid[7]. Mit Ketonen ist diese Reaktion nicht möglich, da diese nicht weiter oxidiert werden können.
Oxidation:
- Eine Aldehydgruppe wird im basischen zur Carbonsäure oxidiert.
Reduktion:
- Kupfer(II)-ionen und Hydroxidionen reagieren zu Kupfer(I)-hydroxid, das weiter zu Kupfer(I)-oxid dehydratisiert.
Redoxreaktion:
- Kupfer(II)-ionen und Aldehydgruppen reagieren im basischen Milieu zu Kupfer(I)-oxid, Carboxylaten und Wasser
Da man sich im alkalischen Milieu befindet, kommt es zu einer Abgabe des Protons der Carbonsäure (=Protolyse).
- Da die Reaktion in alkalischer Umgebung stattfindet, wird die entstehende Carboxygruppe durch Hydroxidionen zur Carboxylatgruppe im Sinne einer Säure-Base-Reaktion deprotoniert
Die Fehlingreaktion funktioniert auch mit Alkoholen, da auch diese oxidiert werden können und so Elektronen für eine Kupferionenreduktion bereitstellen können.
- Zusatzinformation
c) Schiffsche Probe und Unterscheidung von Methanal, Ethanal und Propanon (LK)[Bearbeiten]
siehe Schiffsche Probe
Aceton[Bearbeiten]
Propanon ist das einfachste Keton. Es liegt bei Raumtemperatur als farblose, aromatisch riechende und leicht flüchtige Flüssigkeit vor. Es hat eine sehr geringe Viskosität - es ist also sehr dünnflüssig.
Sein Trivialname ist Aceton. Viele organische Stoffe, welche häufig verwendet werden haben Trivialnamen - welche vor allem im Laboralltag und in der Bevölkerung recht üblich sind.
- Verwendung
- als Lösungsmittel für fettlösliche Stoffe
- als Reingungsmittel (z.B. früher in Nagellackentferner)
- als Ausgangsstoff für andere chemische Synthesen
- Lösungs- und Extraktionsmittel für Harze, Fette und Öle
- Aceton löst ein Vielfaches seines eigenen Volumens an Acetylen
- Ausgangsstoff u.a. für die Aldoladditionen und Aldolkondensationen
- zusammen mit Wasserstoffperoxid ist Aceton eines der Ausgangsstoffe für die Herstellung des Sprengstoffes Acetonperoxid.
- In den USA und anderen Ländern wird Aceton in geringer Menge (1:2000 - 1:5000) Autokraftstoffen (Benzin und Diesel) zugefügt.
- Weitere Eigenschaften
- Die Dämpfe sind leicht entzündlich und bildet mit Luft ein explosives Gemisch. Die hohe Flüchtigkeit ist auf den niedrigen Siedepunkt zurückzuführen (56°C).
- Aceton kann in jedem Verhältnis mit Wasser gemischt werden. Weiterhin ist es mit den meisten organischen Lösungsmitteln ebenfalls mischbar.
- Das Acetonmolekül zeigt Keto-Enol-Tautomerie
- sein pKs-Wert beträgt 20.
- In alkalischer Umgebung bildet zwei Acetonmoleküle Dimere (Diacetonalkohol).
- Zusatzinformationen
Wiederholungsfragen[Bearbeiten]
- Nukleophile Substitution
- Nenne gute Nukleophile.
- Stelle SN1 und SN2 an selbst gewählten Beispielen gegenüber. nenne dann jeweils eine Beispielreaktion. Formuliere in Worten die Unterschiede.
- Vervollständige für SN2: Die Bindung zur ________________ wird in dem Maße gelöst wie sich die Bindung zum ___________________ bildet.
- Wann spricht man bei der nukleophilen Substitution von einer bimolekularen Reaktion?
- Erstelle den Mechanismus: (CH3)3COH + H-Cl → (CH3)3C-Cl + H-OH
- Erstelle zu SN1 und SN2 jeweils ein vollständiges Energiediagramm.
- Carbonylverbindungen
- Was sind Carbonylverbindungen? Welche Gruppen kennst Du? Nenne Eigenschaften.
- Nenne Verwendungszwecke für Ketone und Aldehyde.
- Welches sind typische Reaktionen von Aldehyden/ Ketonen?
- Wiederhole die Regeln der Nomenklatur. Welche Besonderheiten gibt es bei Alkoholen, Aldehyden und Ketonen zu beachten?
- Kennst Du Trivialnamen? Schreibe die Konstitutionsformeln von Formaldehyd, Acetaldehyd und Aceton auf.
- Benenne die folgenden Verbindungen:
- Welche drei prinzipiellen reaktiven Positionen gibt es prinzipiell in Aldehyden und Ketonen?
- Vervollständige die Tabelle.
- Stelle die vollständige Oxidation eines beliebigen primären Alkohols mit der eines sekundären (in allen Schritten, also mit allen Produkten, wie z.B. Aldehyd, Keton, Carbonsäure, CO2) gegenüber
- Wiederhole die Dir aus dem Unterricht bekannten Redoxreaktionen.
- Beschreibe die Reaktion von Kupferoxid mit Ethanol.
- Wie oxidieren tertiäre Alkohole? Nenne alle Produkte!
- Nenne Möglichkeiten primäre Alkohole von sekundären im Labor zu unterschieden. Begründe. mit den passenden Reaktionsgleichungen.
- Alkoholstoffwechsel der Leber:
| Name | funktionelle Gruppe | Endung | Bezeichnung als zus. Substituent |
|---|---|---|---|
| -COOH | |||
| Aldehyd | |||
| -on | |||
| Hydroxy | |||
| Amin | Amino |
- Wiederhole die Regeln zur Bestimmung von Oxidationszahlen, vor allem an organischen Verbindungen. Erstelle dann eine Tabelle mit den Oxidationszahlen der folgenden Verbindungen.
| Methan | Propan | Butan | Propen |
| Methanol | Propanol | Butanol | tert.-Butanol |
| Methanal | Propanal | Butanal | Aceton |
| Propanon | Butanon | Dimethylketon | |
| Methansäure | Propansäure | Butansäure | Essigsäure |
Im menschlichen Körper wird in der Leber Ethanol durch das Enzym Alkoholdehydrogenase im Zusammenspiel mit dem Coenzym Nicotinamidadenindinucleotid (NAD) oxidiert.
a) Bestimme das fehlende Produkt. Tipp: Es ist leicht giftig und verursacht Kopfschmerzen.
- CH3–CH2–OH + NAD -ADH→ ? + NADH
b) Das Produkt aus a) wird in einem weiteren Schritt weiter oxidiert und dann letztlich ausgeatmet. Erstelle auch diese Reaktionsgleichung.
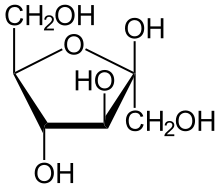
- Zucker können sowohl in der kettenförmigen Form, als auch in Ringform auftreten. Wie wirkt sich dies auf Nachweise aus? Glucose zeigt eine positive Fehlingprobe. Was erwartest Du für Fructose? Erkläre anhand der Formel.
- Was sind Ether? Nenne Eigenschaften und Verwendung.
- Wiederhole die anderen Reaktionsmechanismen.
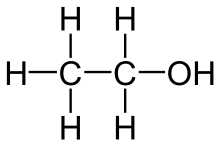
- Erkläre, wie sich Siedepunkte von Alkanen, Alkanolen und Alkanalen gleicher Kohlenstoffkettenlänge verhalten?
- Vergleiche entsprechend die Löslichkeit von Alkanen, Alkanolen und Alkanalen in Wasser. Erkläre dabei auch, welche Vorgänge beim Lösungsvorgang eine Rolle spielen - und inwiefern die Verbindungen diese Vorgänge ermöglichen.
- ↑ Siehe auch Keto-Enol-Tautomerie
- ↑ also im Grunde entsprechend den Alkoholen
- ↑ Die allgemeine Summenformel ist CnH2n+1CHO
- ↑ Zusatzinformationen Silberspiegelprobe: Beim Zutropfen des Ammoniaks ist der entstehende braune Niederschlag Silberhydroxid (AgOH). Er verschwindet unter Bildung des Silberdiamminkomplexes ([Ag(NH3)2]+).
- ↑ Hier ist die vereinfachte Form dargestellt. In Wirklichkeit liegt als Edukt der Silnberaminkomplex vor [Ag(NH3)2]+
- ↑ Tartrate sind die Salze der Weinsäure. Siehe auch Kapitel Carbonsäuren.
- ↑ Bemerkung: Die Gelbfärbung zu Beginn der Reaktion kommt vom bereits gebildeten Cu(I)-Oxid