Praktikum Organische Chemie/ Trennung und Isolierung niedermolekularer organischer Verbindungen/ Trennungen durch Säulenchromatographie
Trennungen durch Säulenchromatographie
[Bearbeiten]Diese Methoden können wie bei der Schichtchromatographie beschrieben, nach dem Prinzip der Verteilung oder der Adsorption durchgeführt werden. Im organischen Praktikum hat die Adsorptions-Säulenchromatographie die größere Bedeutung; daher soll hier nur auf diese Methode eingegangen werden. In diesem Fall ist ein pulverförmiges Adsorbens die stationäre Phase in einer Trennsäule. Lösungsmittel bilden die mobile Phase, welche durch die mit dem Adsorbens beschickte Säule wandert (Bild 8-1).

Bild 8-1.
Chromatographie in der Schwerkraftsäule
[Bearbeiten]Bei dieser ältesten und apparativ einfachsten Methode wird ein senkrecht angeordnetes Chromatographierohr verwendet, das meistens aus Glas angefertigt ist (Bild 8-2).
Bild 8-2. Glassäulen zur Chromatographie.
Die mobile Phase bewegt sich durch die bloße Schwerkraft von oben nach unten. Die mit unterschiedlicher Stärke an das Adsorbens gebundenen (retentierten) Substanzen werden von der mobilen Phase transportiert und treten – mit dem Lösungsmittel (Eluens, Elutionsmittel) verdünnt - am Ende der Säule aus; sie werden eluiert. Diese Technik wird daher auch Elutionsverfahren genannt.
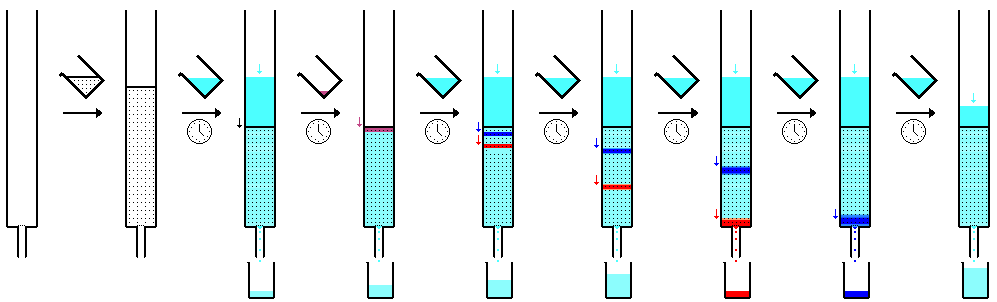
Bild 8-3. Arbeitsschritte bei der Chromatographie in einer Schwerkraftsäule (schematisch).
Um ein gutes Ergebnis der Trennung zu erhalten, muss die Trennsäule mit Sorgfalt "gepackt", d.h. mit dem Adsorbens gefüllt werden. Dies erreicht man durch "Einschlämmen". Je größer die Dimensionen der Säule sind, desto schwieriger wird es, gleichmäßige Packungen der Trennsäulen zu erhalten. Anfänger müssen diese Technik üben!
a) Füllung des Chromatographierohrs (Einschlämmen)
[Bearbeiten]Für Praktika der organischen Chemie geeignet sind Chromatographierohre von ca. 40 cm effektiver Länge und einem Innendurchmesser von ca. 1,6 cm. Die Säule wird mit zwei Klammern vertikal an einem Stativ befestigt. Unter den Auslauf stellt man einen Erlenmeyer-Kolben. Bei geschlossenem Hahn füllt man das Rohr bis zu etwa einem Viertel mit einem Lösungsmittel, welches in der eluotropen Reihe (siehe Kapitel Adsorptions-Schichtchromatographie) weit oben steht, z.B. Petrolether. Mit Hilfe eines langen Glasstabs oder Glasrohrs stößt man einen Bausch aus Watte in die Verjüngung des Auslaufs und entfernt durch Stoßen etwa gebildete Luftblasen. Man bereitet aus dem Adsorbens, meistens Kieselgel (ca. 40 g), und dem Lösungsmittel (z.B. Petrolether, ca. 120 ml) in einem Erlenmeyer-Kolben (ca. 300 ml) durch Umschütteln eine blasenfreie Suspension und gießt diese durch einen Pulvertrichter möglichst schwungvoll in die Trennsäule. Der Absetzvorgang wird durch Klopfen mit einer Reagenzglasklammer unterstützt. Überschüssiges Lösungsmittel lässt man durch Öffnen des Hahns abtropfen. Die im Erlenmeyerkolben zurückgebliebene Suspension wird mit Lösungsmittel vollständig in die Säule gespült. Es ist darauf zu achten, dass stets eine Lösungsmittelschicht über der Füllung steht; die Säule darf nicht "trockenlaufen". Nachdem sich das Adsorbens abgesetzt hat (einige Zeit warten!), lässt man ca. 1 cm hoch Seesand einrieseln. Vor Aufgabe der zu trennenden Substanzmischung lässt man die überstehende Flüssigkeit durch Öffnen des Hahns so weit ab, dass der Seesand nur noch mit einer dünnen Lösungsmittelschicht bedeckt ist.
Das spezifisch schwere Adsorbens Aluminiumoxid (siehe unten) kann man auch direkt langsam(!) in die mit der mobilen Phase gefüllte Trennsäule einrieseln lassen, wobei aber darauf zu achten ist, dass jedesmal die Luftblasen entweichen können, bevor neues Sorbens nachgefüllt wird.
b) Ermittlung des Elutionsmittels (Eluens)
[Bearbeiten]Vor der Säulenchromatographie untersucht man das zu trennende Gemisch mittels Dünnschichtchromatographie (DC, siehe Kapitel #) und ermittelt aus der eluotropen Reihe eine geeignete mobile Phase. Oft verwendet man auch Mischungen von Lösungsmitteln verschiedener Polarität, z. B. Petrolether/Ethylacetat, in verschiedenen Verhältnissen. Bei diesen Tests ist zu beachten, dass die Retention der Substanzen im DC von der in der Säule verschieden sein kann, da die Adsorbentien für die beiden Techniken nicht ganz gleich sind. Die Trennleistung (performance) im DC ist höher. Für die Säulenchromatographie stellt man meistens eine geringere Polarität ein.
c) Trennprozess
[Bearbeiten]Von dem zu trennenden Substanzgemisch wird bei Raumtemperatur(!) eine möglichst konzentrierte Lösung hergestellt, welche mit Hilfe einer Pipette vorsichtig(!) auf die Säulenfüllung ("am Kopf" der Säule) gegeben wird. Die Säulenfüllung soll dabei nicht aufgewirbelt werden. Das Lösungsmittel sollte nicht zu "polar" sein (siehe eluotrope Reihe und DC-Test). Durch vorsichtiges Öffnen des Hahns am Chromatographierohr lässt man die Lösung einsickern. Sobald dies erfolgt ist, gibt man mittels Pipette ca. 1 ml Lösungsmittel auf die Säule und lässt wiederum einsickern. Dieses "Nachwaschen" mit Lösungsmittel wird insgesamt dreimal durchgeführt. Anschließend setzt man den Tropftrichter mit dem Elutionsmittel auf und beginnt mit dem Eluieren.
Falls das Substanzgemisch nur in polaren Solventien löslich ist, kann man folgendermaßen verfahren: Man löst in einem geeigneten Solvens - ohne auf die eventuell hohe Polarität Rücksicht zu nehmen - und gibt zu der Lösung eine kleine Menge Adsorbens. Im Rotationsverdampfer entfernt man das Lösungsmittel, bis man ein trockenes Pulver erhält. Dieses mit der Analysensubstanz beladene Sorbens gibt man vorsichtig auf die gepackte Säule.
Man öffnet nun den Hahn am unteren Ende der Chromatographiesäule. Das Eluat soll mit 1-2 Tropfen pro Sekunde austreten. Es wird in einem Rundkolben (250 ml), dessen Gewicht man bestimmt hat, aufgefangen. Man eluiert durch Auftropfen der mobilen Phase. Von Zeit zu Zeit prüft man das Eluat durch Dünnschichtchromatographie. Sobald die zweite Substanz nachweisbar ist, wechselt man den Auffangkolben und fängt eine neue "Fraktion" auf. Die Elution wird abgebrochen, wenn im DC kein Fleck mehr erscheint.
Wenn die mobile Phase bei der Elution nicht verändert wird, d.h. dieselbe bleibt, bezeichnet man dieses Verfahren als
- Isokratische Elution.
In der Regel wird man jedoch die Polarität der mobilen Phase sukzessive erhöhen, damit auch stärker retentierte Komponenten rascher desorbiert werden. Dies nennt man
- Gradienten-Elution:
Dies kann stufenweise (diskontinuierlich) oder kontinuierlich erfolgen (Bild 8-4).

Bild 8-4. Stufengradient (links) und kontinuierlich steigende Gradienten (rechts).
Im Forschungslabor wird man die Fraktionen nicht "von Hand" sammeln, sondern einen Fraktionssammler verwenden.
Zum Schluss überprüft man dünnschichtchromatographisch die einzelnen Fraktionen und vereinigt solche mit gleicher Zusammensetzung. Das Elutionsmittel wird abdestilliert, vorzugsweise im Rotationsverdampfer. Der Rückstand wird spektroskopisch untersucht (NMR, IR, MS) und in der Regel umkristallisiert oder im Kugelrohr destilliert.
Kieselgel zur Säulenchromatographie
[Bearbeiten]Die meisten chromatographischen Trennungen in der Schwerkraftsäule dürften heute an Kieselgel durchgeführt werden. Dieses ist im Handel in verschiedenen Qualitäten erhältlich, die sich in der Korngröße, der wirksamen Oberfläche und der Größe der Poren unterscheiden. Das Adsorbens zur Chromatographie wird durch Klassieren gewonnen; die mittlere Korngröße liegt zwischen 0,05 und 0,5 mm. Für einfache Trennungen kann ein Material mit der Korngröße 0,06-0,2 mm (meistens in μm angegeben: 60-200 μm) verwendet werden. Beim Packen der Trennsäule ist die Kenntnis der Schüttdichte nützlich: sie beträgt ca. 0,5 g/ml. Je enger die Verteilung der Korngrößen ist, desto teurer ist das Adsorbens.
Kieselgel-Körner sind porös. Die mittlere Porengröße wird meistens in Angström-Einheiten angegeben und reicht typischerweise von ca. 40 Ä bis 120 Ä . Viel verwendet wird im Labor Material mit 60 Ä , welches als Kieselgel 60 gehandelt wird. Kieselgele besitzen erstaunlich große Oberflächen, typisch zwischen 200 und 800 m2 pro Gramm!
Die adsorptiven Eigenschaften der Kieselgele hängen in hohem Maße auch von ihrer Vorbehandlung ab. Es wird angenommen, dass die Adsorption auf den Si-OH Gruppen an der Oberfläche beruht, und unterscheidet "freie" OH-Gruppen (A), "gebundene" OH-Gruppen (B) und "reaktive" OH-Gruppen (C). Letztere sollen besonders aktiv sein.

Bild 8-5. Schematisches Modell einer Kieselgel-Oberfläche.
Das Verhalten des Kieselgels bei der Adsorption kann durch Erhitzen des Materials beeinflusst werden. Das physikalisch adsorbierte Wasser kann durch Erwärmen auf Temperaturen unterhalb 150 °C entfernt werden. Hochaktives Kieselgel erhält man durch längeres Erhitzen im Trockenschrank auf 150 bis 200 °C. Bei höheren Temperaturen (> 200 °C) werden Hydroxylgruppen an der Oberfläche unter Abspaltung von Wasser in Siloxan-Gruppen (Si-O-Si) umgewandelt; diese sind weniger aktiv.
Wer also bei der Adsorptionschromatographie möglichst reproduzierbare Ergebnisse anstrebt, sollte das Kieselgel vor der Verwendung bei 150-200°C "trocknen" und anschließend im Exsikkator abkühlen lassen, damit es keine Feuchtigkeit aus der Luft aufnehmen kann.
Aluminiumoxid zur Säulenchromatographie
[Bearbeiten]In den Anfängen der Säulenchromatographie war Aluminiumoxid das bevorzugte Adsorbens. Viele Erkenntnisse über die Methode wurden daher bei Studien mit diesem Material gewonnen. Heute dürften aber die meisten chromatographischen Trennungen an Kieselgel durchgeführt werden.
Beim Arbeiten mit Aluminiumoxid muss berücksichtigt werden, dass dieses in verschiedenen "Aktivitäten" eingesetzt werden kann. Die höchste Aktivitätsstufe (siehe Kapitel 2, Trennungen durch Adsorption) wird nur für die Reinigung von Lösungsmitteln eingesetzt. Zur Chromatographie ist dieses Material selten geeignet, da die zu trennenden Substanzen daran zu stark gebunden werden. In manchen Fällen hat man sogar chemische Reaktionen mit dem hochaktiven Aluminiumoxid festgestellt, die bei einer Trennung selbstverständlich nicht erwünscht sind.
Zur Säulenchromatographie desaktiviert man hochaktives Aluminiumoxid, indem man dieses mit einer definierten Menge Wasser behandelt. Die Wassermoleküle werden an der Oberfläche adsorbiert. Dies führt zu Adsorbentien verschiedener "Aktivitätsstufen", die mit Hilfe des Brockmann-Tests definiert wurden. Für die Säulenchromatographie verwendet man in der Regel die Aktivitätsstufen II oder III. Die für die Trennung passende Aktivitätsstufe muss für jede Substanz(mischung) empirisch ermittelt werden. Wie bei Kieselgel ist zu beachten, dass dünnschichtchromatographische Vorversuche an Aluminiumoxid-Schichten zu etwas anderen Ergebnissen führen können. Abgesehen von der verschiedenen Korngröße lässt es sich nicht vermeiden, dass Aluminiumoxid-Schichten beim Auftüpfeln der Substanzen und in der Trennkammer mit feuchter Luft in Berührung kommen. Dadurch ist das Adsorbens der DC-Schicht weniger aktiv als das in der Trennsäule.
Einstellung der Aktivitätsstufen
[Bearbeiten]Hochaktives Aluminiumoxid ist in sorgfältig verschlossenen Flaschen käuflich. Lässt man dieses Material (Aktivitätsstufe I, oder Super I) an der Luft stehen, wird es durch Adsorption von Feuchtigkeit desaktiviert. Daher müssen die geöffneten Flaschen rasch wieder verschlossen werden. Durch Feuchtigkeit desaktiviertes Aluminiumoxid erhitzt man im Trockenschrank auf 350 °C und lässt es anschließend im Exsikkator erkalten.
Um höhere Aktivitätsstufen herzustellen, versetzt man dieses Pulver in einer Flasche mit einer definierten Menge Wasser. Zunächst bilden sich Klumpen. Man verschließt die Flasche sorgfältig, schüttelt durch und lässt sie stehen, bis sich das Wasser gleichmäßig verteilt hat. Die benötigten Mengen Wasser sind in Bild 8-6 angegeben.

Bild 8-6. Desaktivierung von Aluminiumoxid der Aktivitätsstufe I.
Aktivitätstest nach Brockmann und Schodder[1]
Die Aktivitätsstufe des Aluminiumoxids wird durch Chromatographie von sechs Testsubstanzen aus der Klasse der Azofarbstoffe ermittelt (Bild 8-7. In kleinen Trennsäulen (Teströhrchen) werden je zwei in dieser Reihe (Bild 8-7) aufeinanderfolgende Farbstoffe in Petrolether/Benzol-Lösung (heute durch Petrolether/Toluol ersetzt) aufgebracht und mit diesem Lösungsmittelgemisch eluiert.
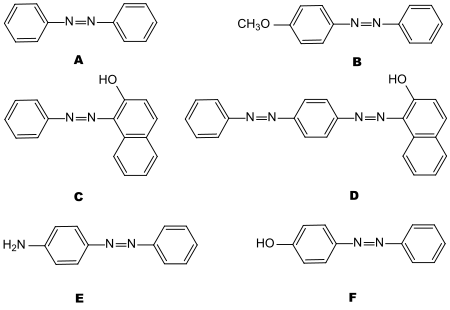
Bild 8-7. Azofarbstoffe zum Brockmann-Test: Azobenzol (A), 4-Methoxyazobenzol (B), Sudangelb (C), Sodanrot (D), 4-Aminoazobenzol (E) und 4-Hydroxyazobenzol (F).

Bild 8-8. Tests der Aktivität von Aluminiumoxiden zur Chromatographie.
Trockensäulen-Chromatographie
[Bearbeiten]Wie oben beschrieben, ist es im Labor Standard geworden, vor der Chromatographie das Sorbens mit einem Lösungsmittel in die Säule "einzuschlämmen“. Durch die industrielle Optimierung der Sorbentien ist es jedoch möglich geworden, darauf zu verzichten.
Wie der Begriff "Trockensäulen-Chromatographie“ (TSC) zum Ausdruck bringt, wird bei diesem Verfahren die Trennsäule mit einem pulverförmigen, trockenes Sorbens gefüllt. Meistens wird spezielles Kieselgel („zur Trockensäulen-Chromatographie“) verwendet. Die Packung wird durch Klopfen oder Vibration verdichtet. Darauf lässt man die Mischung der zu trennenden Substanzen einsickern, welche gegebenenfalls mit etwas Lösungsmittel verdünnt wurde. In der Regel „entwickelt“ man nur so lange, bis das Solvens am Säulenende angekommen ist, d.h. die ganze Säule befeuchtet hat. Anschließend lässt man das Lösungsmittel im Abzug verdunsten. Die Zonen werden markiert und mit einem Spatel oder Löffel aus der Säule herausgeholt. Um dies zu erleichtern, ist eine zerlegbare Trennsäule zu empfehlen. Sie besteht aus einem Glasrohr mit zwei Normschliffhülsen an den Enden („Zechmeister-Rohr“). Das Rohr wird auf ein kurzes Filterrohr aufgesetzt, in das eine Glasfritte eingeschmolzen ist. Dieses trägt am unteren Ende einen Auslass zum Druckausgleich und einen Hahn.[2]

Anstelle der Glassäule kann auch ein Schlauch aus dünner, durchsichtiger, nicht quellbarer Plastikfolie (Polyamid) verwendet werden, der an einem Ende wie eine Wurst abgebunden wird. Das Sorbens wird eingefüllt und mittels Vibrator zu einer „Wurst“ verdichtet. Die „Wurst" kann nun senkrecht in ein Stativ eingespannt werden. Mit einer Nadel werden unten einige Löcher eingestochen, durch welche das Lösungsmittel austreten kann.[3]
Nachdem die „Entwicklung“ abgeschlossen ist, zerlegt man die „Wurst“ mit einem Messer in verschiedene Abschnitte und extrahiert aus den Sektionen die Substanzen mit einem polaren Lösungsmittel. Ist das Sorbens mit Fluoreszenzindikator versetzt, kann man oft unter einer UV-Leuchte die Trennung kontrollieren.
Die TSC kann als Brücke zwischen Dünnschichtchromatographie und der klassischen Säulenchromatographie betrachtet werden. Sie ist vor allem zur Vortrennung von Gemischen geeignet, falls sich Komponenten in ihrer Polarität stärker unterscheiden.[4][5]
Auch für die TSC wurden verschiedene Varianten propagiert.[6][7] So wurde das Sorbens (Kieselgel 60) trocken in einen zylindrischen Glastrichter mit poröser Glasfritte eingebracht. Der Trichter wird mit einem konischen Gummiadapter auf eine Saugflasche gesetzt. Die Elution wird durch vorsichtiges Ansaugen in einem leichten Vakuum erreicht.[8]
Niederdruck-Chromatographie (Flash-Chromatographie)
[Bearbeiten]In der Schwerkraftsäule können Substanzen getrennt werden, die große Unterschiede in ihrem Retentionsverhalten (z. B. den Rf-Werten) aufweisen. Für Vortrennungen ist die relativ billige Methode besonders gut geeignet.
Schwierigere Trennungen werden mit Adsorbentien kleinerer und einheitlicherer Korngröße vorgenommen, die selbstverständlich teurer sind. Wird eine Säule mit diesen Materialien gepackt, reicht die Schwerkraft zum Transport der mobilen Phase nicht mehr aus, um die Trennung in akzeptablen Zeiten durchführen zu können. Daher muss die Flüssigkeit unter Druck durch die Trennsäule gepresst werden.
Im einfachsten Fall kann man Stickstoff aus einer Gasflasche auf die Trennsäule drücken lassen. In den meisten Laboratorien steht heute ohnehin eine Stickstoffleitung am Arbeitsplatz zur Verfügung. Das Verfahren wurde vermutlich erstmals von W. C. Still publiziert und „Flash-Chromatography“ genannt.[9]
Da der Druck des Stickstoffs relativ niedrig ist (bis ca. 1 bar), können die Trennungen relativ gefahrlos in Glasapparaturen durchgeführt werden. Dadurch hat sich die Methode in organischen Laboratorien rasch verbreitet. In 10-15 Minuten sollen sich Substanzen in Mengen zwischen 10 mg und 10 Gramm trennen lassen.
Als Sorbens wird meistens Kieselgel der Korngröße 40-63 μm verwendet.
Literatur
[Bearbeiten]- G. Schwedt, Chromatographische Trennmethoden, 2. Auflage, Georg Thieme Verlag, Stuttgart, 1986.
- R. J. Gritter, J. M. Bobbitt und A. E. Schwarting, Einführung in die Chromatographie, Springer Verlag, Berlin - Heidelberg 1987.
- G. Hesse, Chromatographisches Praktikum, 2. Aufl. Akademische Verlagsgesellschaft, Frankfurt/Main, 1968.
Versuche
[Bearbeiten]Einzelnachweise
[Bearbeiten]- ↑ H. Brockmann, H. Schodder, Ber. Dtsch. Chem. Ges. 74, 73 (1941).
- ↑ K. Kubeczka, Chromatographia 6, 106-108 (1973).
- ↑ Informationsschrift der Firma Woelm, Eschwege.
- ↑ K. Kubeczka, Vortrennung ätherischer Öle und ähnlich komplexer Stoffgemische für die GC-Analyse durch modifizierte Trockensäulen-Chromatographie, Chromatographia 6, 106-108 (1973).
- ↑ B. Engelbrecht, Trockensäulen-Chromatographie (TSC), eine einfache und preiswerte Trenntechnik als Brücke zwischen DC und Säulenchromatographie, GIT-Verlag, Giebeler, 1979.
- ↑ Lawrence M. Harwood, Dry-Column Flash Chromatography, Aldrichimica Acta 18, 25 (1985).
- ↑ D. S. Pedersen, C. Rosenbohm, Dry Column Vacuum Chromatography, Synthesis 2001, 2431-2434.
- ↑ Alan J. Shusterman, Patrik G. McDougal, Arthur Glasfeld, Dry-Column Flash Chromatography, J. Chem. Educ.74, 1222-1223 (1997).
- ↑ W. C. Still, M. Kahn, A. Mitra, J. Org. Chem. 43, 2923 (1978).
