Anorganische Chemie für Schüler/ Radioaktivität
Informationen zur Radioaktivität
Nach Radioaktivität
Unter Radioaktivität oder radioaktivem Zerfall versteht man die spontane Umwandlung instabiler Atomkerne unter Energieabgabe. Die freiwerdende Energie wird in Form energiereicher Teilchen oder Strahlung abgegeben, die entweder als Alphateilchen, Betateilchen oder Gammastrahlung bzw. Röntgenstrahlen bezeichnet werden.
Radioaktive Stoffe sind sehr schwere Elemente, welche eine hohe Anzahl an Protonen und somit in ihrem Atomkern eine hohe Spannung haben, da alle Protonen sich gegenseitig mit ihren positiven Ladungen abstoßen. Man spricht auch vom radioaktiven Zerfall der Atomkerne.
Bei einem solchen Zerfall kann sich die Protonenzahl des Atoms ändern (d. h. es findet eine Umwandlung in ein anderes chemisches Element statt). Es kann sich aber auch nur die Massenzahl ändern (d. h. Umwandlung in ein anderes Isotop desselben Elements). Die Stärke der Radioaktivität wird durch den physikalischen Begriff der „Aktivität” beschrieben und in der Einheit Becquerel angegeben.
Die Halbwertszeit ist der Zeitraum, nach dem durchschnittlich die Hälfte der instabilen Atomkerne einer Menge zerfallen sind. Sie kann nur Sekundenbruchteile, aber auch einige Milliarden Jahre betragen. Derartige Nuklide sind beispielsweise Uran-238 und Uran-235, Thorium oder Kalium-40. Je kürzer die Halbwertszeit, desto größer die Radioaktivität. Mathematisch wird der Zerfall durch das Zerfallsgesetz beschrieben.
Die Entdeckung der Radioaktivität
Der französische Physiker Antoine Henri Becquerel stellte 1896 fest, dass das Element Uran lichtempfindlichen Film schwärzen kann, selbst wenn er nicht vom Uran berührt wird.
Die polnische Chemikerin Marie Curie und ihr Ehemann Pierre Curie waren 1898 auf der Suche nach einem neuen Element, welches sie aus der Pechblende zu isolieren versuchten. Marie entdeckte bei ihren Forschungen neben dem Radium dann auch das Polonium, welches sie nach ihrer Heimat nannte. Sie bewies also, dass Radioaktivität eine Elementeigenschaft ist und bei verschiedenen Elementen auftritt. Gerhard Carl Schmidt aus Erlangen machte zur gleichen Zeit ähnliche Entdeckungen.
1899 war ein wichtiges Jahr. Die Briten Ernest Rutherford und Frederick Soddy entdeckten das radioaktive Gas Radon, der Franzose André Louis Debierne fand das strahlende Actinium.
Schon bald wusste man, dass die Radioaktivität eine sehr große Energiequelle ist. Die Curies berechneten die beim radioaktiven Zerfall von Radium frei werdende Wärmeenergie auf etwa 420 Joule/ (Gramm Radium · Stunde). Bemerkenswert fanden sie daran, dass diese Energie in Wärme umgewandelt werden kann und diese über Jahre unvermindert anhält. (Zum Vergleich: 1 g Kohlenstoff setzt 33 600 Joule frei).
Was die Curies nicht ahnten, war allerdings die stark schädigende Wirkung der Radioaktivität. Da sie beide viele Jahre schutzlos mit radioaktiven Stoffen arbeiteten, waren sie hochgradig verstrahlt und starben beide an den Folgen der Strahlenkrankheit.
Schreibweise der Reaktionsschemata
Beim radioaktiven Zerfall ist nur der Atomkern beteiligt, nicht aber die Elektronenhülle. In den Reaktionsschemata werden daher auch nur die Atomkerne berücksichtigt.
Ein Atomkern ist durch die Kernladungszahl (Ordnungszahl) Z und die Massenzahl (Nukleonenzahl) A gekennzeichnet
- Nukleonenzahl (A) = Protonenzahl (Z) plus Neutronenzahl (N): A = Z + N
Ein Atomkern X wird daher wie folgt gekennzeichnet:
- , z. B. ; die Kernladungszahl kann fortgelassen werden, da sie durch das Elementsymbol gegeben ist: .
- Neutronen werden mit 1n oder n bezeichnet, Elektronen mit e-, einzelne Protonen mit p+ (sofern sie nicht als H+ bezeichnet werden).
Strahlungsarten
Schon Rutherford bestätigte, dass es mehrere Strahlungsarten geben muss:
- positiv geladene Alphateilchen, die Papier nicht durchdringen können
- negativ geladene Betateilchen, welche kleiner sind und die Haut von Menschen durchdringen
- ungeladene Gammastrahlung
Aufgaben zum Verständnis:
- Was versteht man unter Radioaktivität? Erkläre und nenne Beispiele!
- Welche Arten von Strahlung gibt es? Welche Gefahren gehen davon aus?
- Wie erklärst Du Dir den radioaktiven Zerfall?
Was ist Radioaktivität?
Wiederhole zuerst die Begriffe Ordnungszahl, Kernladungszahl und Massenzahl sowie das Modell zur Anziehung von geladenen Teilchen![1]
Versuch von Henri Becquerel (1896)
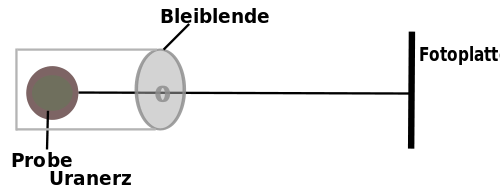
Einige Elemente geben eine unsichtbare Strahlung ab, welche Metalle (Hinweis Rutherford: sehr dünne Folien schon) nicht durchdringt, aber Fotoplatten schwärzt. Sie wird als Radioaktivität bezeichnet (griech.: „radius“ = Strahl).
Versuch zur Untersuchung der Strahlungsarten
Die Strahlung von 3 Proben wird durch eine Metallplatte gebündelt und durch ein Magnetfeld geleitet. Die Ablenkung im Magnetfeld wird gemessen.
Die Proben: a) , b) , c)

- Erklärung:
- Richtung der magnetischen Feldlinien: in die Bildebene hinein.
- α-Strahlen [a)] werden nach oben abgelenkt ( Rechte-Hand-Regel).
- β-Strahlen [b)] werden nach unten abgelenkt.
- γ-Strahlen [c)] werden nicht abgelenkt.
- α-Strahlen bestehen aus positiv geladenen Heliumkernen: (v = 10000-30000 km/s),
- Beispiel für Alpha-Zerfall:
- (Heliumkern)
- β-Strahlen bestehen aus Elektronen: (v = 130 000 km/s),
- Beispiel für Beta-Zerfall:
- γ-Strahlen sind energiereiche, hochfrequente elektromagnetische Wellen, die den Röntgenstrahlen sehr ähnlich sind
- Gammastrahlen werden meistens beim Alpha- oder Betazerfall zusätzlich emittiert.
- Beispiel:
Zerfallsarten
α-Zerfall (Abstrahlung von He - Kernen)
Abnahme von 2 Protonen und 2 Neutronen des strahlenden Nuklids
- (Halbwertszeit 1,4·1017 s)
- (Halbwertszeit 1,2·107 s)
Allgemein:
β-Zerfall (Abstrahlung von Elektronen)
Bei Nukliden mit zu hohem Neutronen / Protonen - Verhältnis bewirkt die β-Emission eine Abnahme der Neutronenzahl um 1 und eine Zunahme der Protonenzahl um 1 (Umwandlung eines Neutrons in ein Proton und ein Elektron). Das Elektron stammt also nicht aus der Elektronenhülle, sondern aus dem Atomkern durch die Umwandlung eines Neutrons.
- (Halbwertszeit 2,1·106 s)
- (Halbwertszeit 1,8·1011 s) (Zerfallsreaktion zur C-14 - Altersbestimmung)
Allgemein:
γ-Strahlen
Die Emission von Gammastrahlen allein ist nicht mit einer Änderung der Zusammensetzung des Atomkerns verbunden. Außer beim Alpha- und Betazerfall werden Gammastrahlen auch beim Übergang eines Atomkerns von einem energetisch angeregten Zustand in einen energetisch niedrigeren emittiert.
Beispiel:
Neutronenstrahlen
sind energiereiche Neutronen
C14 - Methode zur Altersbestimmung
Die Halbwertszeit ist der Zeitraum, in dem die Hälfte aller ursprünglich vorhandenen Atome zerfallen ist. Sie ist für jedes Isotop verschieden und von äußeren Bedingungen unabhängig.
Durch natürliche Radioaktivität existiert das Kohlenstoffisotop 14C. Es wird von allen Lebewesen mit der Nahrung aufgenommen, solange diese leben. Nach dem Tode kann man durch den „Restgehalt“ an 14C bestimmen, wann das Lebewesen lebte.
Halbwertszeit 14C = 5730 Jahre
- Von 100% 14C sind nach 5730 Jahren nur noch 50% vorhanden.
- Von 100% 14C sind nach 11460 Jahren nur noch 25% vorhanden...
Massendefekt
Die Summe der Massen aller Elementarteilchen eines Atoms ist verschieden von der effektiven Atommasse. Die Differenz wird als Massendefekt bezeichnet.
Beispiel:
Summe der Protonen-, Elektronen- und Neutronenmassen:
Atommasse:
Massendefekt:
Nach E = m · c² lässt sich aus dem Massendefekt die Bindungsenergie der Kernbausteine berechnen:
- pro Chloratom oder
- pro Nukleon des Chlors (1/35 von ).
- Mit
ist die Kernbindungsenergie 8,5 MeV pro Nukleon des Chlor-35. Die Kernbindungsenergie in 1 g beträgt 229.000 kWh !
Die Atombombe
Am 6. August 1945 wurde die japanische Stadt Hiroshima zerstört. Drei Tage später die Stadt Nagasaki, welches die damalige japanische Regierung zum Aufgeben und letztlich zum Ende des 2. Weltkriegs führte. Einer solchen Sprengkraft hatte kein Land der Welt etwas entgegenzusetzen.
Atombomben zählen zusammen mit Wasserstoff- und Neutronenbomben zu den Kernwaffen. Durch Atomspaltungen werden gewaltige Energiemengen frei, welche ein unvorstellbares Zerstörungspotential haben.
Bereits die ersten Kernwaffen mit nur 1%-iger Effizienz erreichten Explosionsenergien, die mehr als zehntausend Tonnen konventionellen Sprengstoffs entsprachen. Damit setzten sie genug Energie frei, um die japanischen Städte Hiroshima und Nagasaki fast vollständig zu zerstören und Hunderttausende von Menschen zu töten. Während des Kalten Krieges entwickelten vor allem die USA und die Sowjetunion Kernwaffen mit teilweise mehr als zehn Millionen Tonnen TNT-Äquivalent.
Die stärkste jemals explodierte Bombe war die sowjetische Zar-Bombe. Sie wurde am 30. Oktober 1961 bei einem atmosphärischen Kernwaffentest gezündet und setzte eine Energie von etwa 57.000 Kilotonnen (= 57 Megatonnen) TNT-Äquivalent frei. Zum Vergleich: die Hiroshima-Bombe hatte eine Sprengkraft von 13 Kilotonnen TNT. Eine Bombe mit derartiger Kraft hätte im Kriegseinsatz ganze Ballungsgebiete verwüstet. Die Temperatur, die bei einer nuklearen Explosion erzeugt wird, beträgt zwischen 200.000.000 °C und 300.000.000 °C.
Durch ihre große Zerstörungskraft, aber mehr noch durch die bei der Explosion freigesetzten radioaktiven Rückstände stellen Kernwaffen eine ernste existenzielle Bedrohung für die Menschheit und das Leben auf der Erde dar.
Die Entwicklung der ersten Kernwaffen
Allgemein bekannt für ihre Arbeit bei der Entwicklung von Kernwaffen sind Robert Oppenheimer und Edward Teller. Der erste Wissenschaftler, der ernsthaft über den tatsächlichen Bau einer Kernwaffe nachdachte, war jedoch der Physiker Leó Szilárd.
Bereits im September 1933 dachte er an die Möglichkeit, mittels Beschuss durch Neutronen Atomkerne zu einer Kettenreaktion anzuregen. Diese Idee war zu jener Zeit noch sehr umstritten, später auf diesem Gebiet sehr erfolgreiche Forscher wie Ernest Rutherford, Enrico Fermi und Otto Hahn glaubten damals noch nicht daran, dass Atomkerne sich überhaupt spalten lassen.
Nach einigen Jahren der Grundlagenforschung (u. a. von Otto Hahn, Fritz Straßmann, Frédéric Joliot-Curie, Enrico Fermi) war es im Frühsommer 1939 soweit, dass die notwendigen theoretischen Grundlagen veröffentlicht waren, um bei ausreichender Verfügbarkeit von spaltbarem Uran eine Kernwaffe zu bauen.
Schon vor dem Beginn des Zweiten Weltkrieges am 1. September 1939 richteten die drei in den Vereinigten Staaten lebenden Physiker und Leó Szilárd, Albert Einstein und Eugene Paul Wigner im August 1939 einen Brief an den damaligen US-Präsidenten Franklin D. Roosevelt, um ihn vor der Möglichkeit der Entwicklung einer Atombombe in Deutschland zu warnen und ihn im Gegenzug zu der Entwicklung einer eigenen Atombombe anzuregen.
Als die amerikanische Regierung davon überzeugt wurde, dass die Entwicklung einer Atombombe grundsätzlich möglich ist, und dass auch der Kriegsgegner Deutschland diese Möglichkeit besitzt, wurden die Forschungen intensiviert und führten schließlich zum amerikanischen Manhattan-Projekt, welches von Dr. J. Robert Oppenheimer geleitet wurde.
In Deutschland arbeiteten während des Zweiten Weltkrieges Wissenschaftler wie u. a. Werner Heisenberg, Carl Friedrich von Weizsäcker, Walther Gerlach, Kurt Diebner und Otto Hahn an der Entwicklung einer Atombombe.
- ↑ Was passiert, wenn Du Plastikfolie und Papier aneinander reibst? (Papier und Folie ziehen sich an, da sie gegensätzliche Ladungen haben. Folie und Folie hingegen stoßen sich ab ( gleichsinnige Ladungen)





























