Anorganische Chemie für Schüler/ Reaktionskinetik
Einleitung - Was ist eine chemische Reaktion?
Zu Beginn etwas rotes Feuer:
V: Kaliumchlorat, Zucker und Strontiumnitrat werden vermischt und mit etwas Schwefelsäure zur Reaktion gebracht.
B: rote Stichflamme.
S: Spontan ablaufende Reaktion.
Was sind die Grundlagen der Reaktion?
Der Kennzeichen einer chemischen Reaktion
Definition Mittelstufenunterricht: „Bei chemischen Reaktionen finden eine Stoffumwandlung und eine Energieumwandlung statt“.
Definition Oberstufe: Chemische Reaktionen erkennt man z.B. durch:
- Elektronenübertragung(Redoxreaktionen, Elektrolysen)
- Protonenübertragung(Protolyse, Säure-Base-Reaktion)
- Spaltung von Stoffen(Cracken, Explosion z.B. TNT)
- Umlagerung von Gitterbausteinen(z.B. monokliner - rhombischer Schwefel / Graphit - Diamant)
- Beispiel
- Fällungsreaktion von AgCl:
Bisher fand immer eine Untersuchung der beteiligten Stoffe und der beteiligten Energie statt. Aber man kann eine Reaktion auch unter weiteren Aspekten betrachten. In diesem Kurs werden Reaktionsgeschwindigkeiten ebenfalls beobachtet und analysiert.
Schnelle Reaktionen: Knallgasprobe, Ausfällung von AgCl
Langsame Reaktionen: Rosten von Eisen, alkoholische Gärung, Assimilation grüner Pflanzen
- Das Problem ist dabei jeweils
- Wie kann man die Reaktionsgeschwindigkeit messen?
- Verbrennen von Papier und beobachten
- Was hat sich geändert in dieser Zeit → Stoffmenge / Konzentration
- Aufgaben
- Erkläre/ definiere die folgenden Begriffe:
- Chemische Reaktion und ihre Erkennungsmerkmale
- Aktivierungsenergie und Reaktionsenergie (ab jetzt Reaktionsenthalpie genannt)
- Endotherme sowie exotherme Reaktionen sowie Energiediagramm
- Standard- und Normalbedingungen
- Reaktionsgeschwindigkeit
- Oxidation, Reduktion, Redoxreaktion
- angeregter Zustand sowie Lichtemission
- Energieformen
Energiebeteiligung bei chemischen Reaktionen
Bei jeder chemischen Reaktion spielt die Umwandlung von Energie eine Rolle. Entweder wird Energie freigesetzt, die z.B. vorher in den Ausgangsstoffen enthalten war, oder Energie wird zum Ablauf der Reaktion benötigt und somit dem System entzogen.
a) Energiediagramm (exotherme Reaktion)
 Aktivierungsenergie (ΔHA), notwendig zum Auslösen der Reaktion
Aktivierungsenergie (ΔHA), notwendig zum Auslösen der Reaktion
Reaktionsenthalpie (ΔHR), Energieüberschuss, der bei exothermen Reaktionen frei wird
Gesamt freiwerdende Energie (ΔHG)
Chemische Reaktionen, die unter Energieabgabe ablaufen heißen exotherme Reaktionen. Die freiwerdende Energie kann dabei als Wärme, Licht oder in anderen Formen vorliegen. Sie wird auch als Reaktionsenthalpie (ΔH) bezeichnet.
Chemische Reaktionen, bei denen ständig Energie zugeführt werden muss, damit sie überhaupt ablaufen, nennt man endotherme Reaktionen.
b) Energiediagramm (endotherme Reaktion)
- Zusatzinformationen
Das freiwillige Ablaufen einer chemischen Reaktion wird durch die Gibbs-Helmholtz-Gleichung vorausgesagt. Sie bestimmt die freie Enthalpie (ΔG), welche nicht mit der Reaktionsenthalpie (ΔH) verwechselt werden sollte. ΔS gibt in dieser Gleichung übrigens die natürliche „Unordnung“ an, die Entropie.
Wenn ΔG < 0 ist, kann die Reaktion freiwillig ablaufen. Solche Reaktionen nennt man exergonisch. Dies ist besonders bei exothermen Reaktionen der Fall, da sie einen negativen Wert für ΔH haben. Endergonische Reaktionen hingegen laufen nicht freiwillig ab.
Freie Enthalpie Enthalpie Gibbs-Helmholtz-Gleichung Reaktionsenthalpie Normalbedingungen Standardbedingungen
Was ist die Reaktionsgeschwindigkeit?
Es gibt Reaktionen, die laufen schnell ab:
V: Fällungsreaktion von Silbernitrat mit Salzsäure
Reaktionen, die langsam ablaufen: V: RG mit Thiosulfat und HCl (untergehende Sonne - in kleinem Becherglas mit Kreuz):
Schülerversuch: Untersuchung der Reaktion von Thiosulfationen mit Säure
V: Es werden 1g Natriumthiosulfat in 100ml Wasser aufgelöst. Diese wird auf 4 kleine 100ml Bechergläser verteilt.
Die Reaktionen beginnen jeweils, wenn etwas HCl zu den einzelnen Lösungen zugefügt wird. Ein Kreidekreuz auf dem Experimentiertisch dient als optisches Merkmal für den Schlusspunkt der Messung.
BG1: 20ml Natriumthiosulfatlösung werden mit HCl versetzt
BG2: 20ml Natriumthiosulfatlösung + 20ml Wasser werden mit HCl versetzt
BG3: 20ml Natriumthiosulfatlösung + 40ml Wasser werden mit HCl versetzt
BG4: 20ml Natriumthiosulfatlösung werden auf das doppelte der Raumtemperatur erhöht und mit HCl versetzt
| Beobachtung | Schlussfolgerung | |
|---|---|---|
| Konzentrationsabhängigkeit | Eine Verringerung der Konzentration um die Hälfte verlangsamt die Reaktionsdauer ca. um die Hälte | Je höher die Konzentration, desto eher kommt es zu wirksamen Zusammenstößen zwischen den Thiosulfationen und den Oxoniumionen. die Reaktionsgeschwindigkeit nimmt zu. |
| Temperaturabhängigkeit | Eine Erhöhung der Lösungstemperatur beschleunigt die Reaktionsdauer ca. auf ca. das Doppelte. | Je höher die Temperatur, desto stärker ist die Eigenbewegung der Teilchen der Lösung (in diesem Fall der S2O32- und der H3O+-Moleküle). Je stärker ihre Eigenbewegung ist, desto eher kommt es zu wirksamen Zusammenstößen zwischen ihnen. die Reaktionsgeschwindigkeit nimmt zu. |
Messung der Reaktionsgeschwindigkeit
V: Beispielversuch: Verbrennen von Papier - Messung des entstehenden Kohlenstoffdioxids
Geschwindigkeit der Papierverbrennung
Bestimmung der Reaktionsgeschwindigkeit grafisch:
Steigungsdreieck anlegen, abmessen und ausrechnen. Je kleiner das Steigungsdreieck dabei wird desto genauer wird dabei die momentane Geschwindigkeit bestimmt. Die Steigung entspricht der Tangente.
Bei abnehmender Konzentration bekommt der Quotient ein negatives Vorzeichen.
Die momentane Geschwindigkeit:
Exkurs: Geschwindigkeit und ihre Messung in der Physik:
a) gleichförmige Bewegung:
Geschwindigkeit = Weg / ZeitV = Δs / Δt
Geradensteigung m = Δy/ Δx
b) ungleichförmige Bewegung:
ΔS verändert sich bei konstantem Δt
mittlere Geschwindigkeit = V = Δs / Δt
momentane Geschwindigkeit: lim (t->0) Δs / Δt = ds/dt
In der Chemie haben wir es mit Reaktionen zu tun.
→ Was könnte hier als Zeichen für die Reaktionsgeschwindigkeit ändern ?
- Gut geeignet
- Reaktionen, bei denen ein Gas entsteht
- Reaktionen mit Farbänderungen
Die Beeinflussung der Reaktionsgeschwindigkeit
a) Einfluss des Verteilungsgrades auf die Reaktionsgeschwindigkeit
V: Gleiche Volumina von Alkohol (Spiritus) wird in einer kleinen (oder einem engen Becherglas) und einer großen Verbrennungsschale (bzw. auf dem Lehrertisch) entzündet.
B: Der Alkohol im engen Becherglas brennt deutlich länger.
Warum brennt der Alkohol im Glas länger?
→ Die Kontaktfläche an der die Verbrennung stattfindet, ist im 2. Versuch größer.
Die Kontaktoberfläche Ethanol/Luft ist für die Reaktionsgeschwindigkeit entscheidend.
S: Die Reaktionsgeschwindigkeit dieser Verbrennung ist von Größe der Flüssigkeitsoberfläche abhängig, an der Luft und Alkohol in Kontakt stehen.
(Grund: O2 kann nur an der Oberfläche mit dem Ethanol reagieren)
- Aufgaben
- Welcher wichtige Umwelteinfluss könnte die Reaktionsgeschwindigkeit noch beeinflussen?
- Temperatur
- Zeichne Kurven der Reaktionsgeschwindigkeit beider Verbrennungen in ein Diagramm
b) Einfluss der Temperatur:
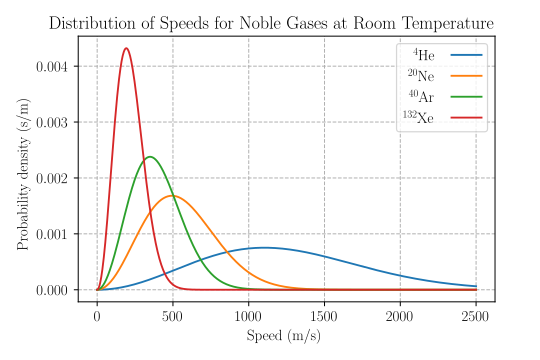
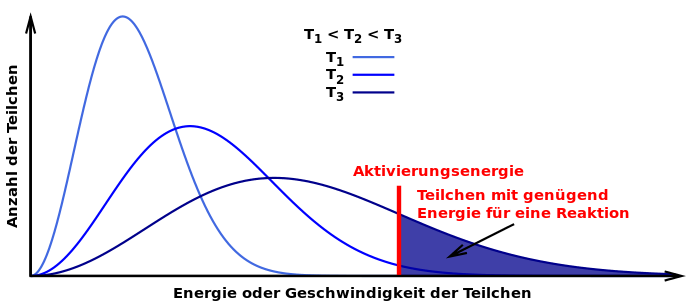
Die Ursachen beschreibt die Maxell-Boltzmann-Verteilung
- Aufgaben
- Die Reaktion von jeweils einem Mol Wasserstoff und Sauerstoff (Knallgasreaktion) dauert bei Raumtemperatur ca. 108 Jahre, bei 730 °C ca. 10-5 s. Erkläre den Unterschied.
Erklärung für die Temperaturabhängigkeit chemischer Reaktionen
Kinetische Energie in Abhängigkeit von der Temperatur
Mit zunehmender Temperatur nimmt bei chemischen Reaktionen die Anzahl der Teilchen mit höherem Energiegehalt (=höherer kinetischer Geschwindigkeit) zu. Dadurch nimmt die Anzahl der Zusammenstöße zu. Außerdem sind die Zusammenstöße „stärker“ (also energiereicher).
Bei geringen Temperaturen sind die Zusammenstöße hingegen weniger häufig und oft reicht auch die Energie der Zusammenstöße für einen Wirksame Reaktion nicht aus. So lässt sich ein Gemisch aus Wasserstoff und Sauerstoff lange aufbewahren, ohne dass eine Reaktion stattfindet.
Aktivierungsenergie
Damit im eben genannten Beispiel von Wasserstoff und Sauerstoff eine Reaktion stattfindet, muss ein Energiebetrag beim Zusammentreffen von Teilchen erreicht, bzw. überschritten werden, damit überhaupt eine Reaktion stattfinden kann.
c) Einfluss der Konzentration auf die Reaktionsgeschwindigkeit
- Abnahme der Reaktionsgeschwindigkeit, bei Abnahme der Konzentration (1/2)
Messung der Zunahme des Volumens in Abhängigkeit von der Zeit
V1: H2O2 und Bromwasser reagieren lassen:
50 ml H2O + 40 mL Bromwasser (Tipp: muss riechen!) dazu 20 mL 5%ige H2O2-Lösung zugeben und sofort in 10 s Abständen messen:
V2: Mg + HCl:[1]
Reagenzglas mit seitlichem Ausgang (!) mit 10ml 2mol HCl und 3g Mg-Band (ca. 5cm) mit Schlauch und Kolbenprober
| Zeit t [s] | Volumen Vol [ml] |
|---|---|
Auftragung der Kurve:
- Auswertung
- Die Gasentwicklung verläuft am Anfang schneller als am Ende.
- Die Reaktionsgeschwindigkeit ist also nicht konstant, sondern ändert sich mit der Zeit.
Reaktionsgleichung:
Die mittlere Reaktionsgeschwindigkeit
In der Chemie interessiert uns in erster Linie die mittlere Reaktionsgeschwindigkeit.
Diese ergibt sich als:
Umrechnung auf die umgesetzte Teilchenzahl: 1 mol eines Gases nimmt unter Normalbedingungen (0°C, 101325 Pa = 1013,25 mbar) ein Volumen von 22,41 L ein.
Also ergibt sich für die mittlere Reaktionsgeschwindigkeit:
In unserem Versuch liegt eine heterogene Reaktion mit unterschiedliche Phasen vor!
Homogene Reaktionen laufen jedoch in einer Phase ab. (Beispiel?)
Bei homogenen Reaktionen steht die Teilchenzahl in direktem Zusammenhang mit der Konzentration:
Konzentration:
Für die mittlere Reaktionsgeschwindigkeit gilt hier also:
Man kann sie erfassen als Zunahme der Konzentration der Produkte, dann hat sie ein positives Vorzeichen, oder als Abnahme der Konzentration der Edukte, dann hat sie ein negatives Vorzeichen.
Momentane Reaktionsgeschwindigkeit:
Die in einem genügend kleinen Zeitraum gemessene mittlere Reaktionsgeschwindigkeit nennt man momentane Reaktionsgeschwindigkeit. Geschwindigkeit zu genau einem Zeitpunkt.
Zusammenfassung
- Bei Reaktionen reagieren immer Edukte zu Produkten.
- Die Reaktionsgeschwindigkeit misst man also durch die Entstehung der Produkte oder das „Verschwinden“ der Edukte.
- Misst man das Verschwinden der Edukte, so erhält die Reaktionsgeschwindigkeit definitionsgemäß ein negatives Vorzeichen.
- Von Interesse ist für Chemiker besonders die mittlere Reaktionsgeschwindigkeit: vv = ∆V / ∆t
- Messen lässt sich praktischerweise das Entstehen oder Verschwinden eines Volumens (bei Gasreaktionen) oder die Zunahme oder Abnahme der Stoffmenge (n) eines Teilchens, da die Stoffmenge zum Volumen in direkt proportionaler Beziehung steht: n = V0 / Vm (Vm =22,4 l/mol)
- Für solche Reaktionen ist die Reaktionsgeschwindigkeit : vn = ∆ n/ ∆ t
- Als dritte Methode kann die Reaktionsgeschwindigkeit durch die Änderung von Stoffmengenkonzentration (c) gemessen werden (leicht in wässrigen Systemen durch z.B. passende Ionennachweise). Bei solchen Reaktionen ist die Konzentration der Stoffmenge direkt proportional: c = v/V(Lsg.), wobei V(Lsg) als konstant angenommen werden kann. Die Reaktionsgeschwindigkeit ist also vc = ∆ c/ ∆ t.
- Aufgaben
- Nenne Möglichkeiten Reaktionsgeschwindigkeiten zu messen.
- Wovon hängt die Reaktionsgeschwindigkeit ab.
- Eine Zinkgranalie und die gleiche Masse an Zinkpulver reagieren Salzsäurea)
- a)Stelle die Reaktionsgleichung auf
- b) Was für ein Reaktionstyp liegt vor?
- c) Wie unterscheiden sich die Reaktionsgeschwindigkeiten
- Erkläre den Zusammenhang zwischen Oberfläche (Verteilungsgrad) und der Reaktionsgeschwindigkeit.
- Magnesium reagiert mit Salzsäure. Nach 1 min. misst man ein Wasserstoffvolumen von 30 mL.
- a) Stelle die Reaktionsgleichung auf und benenne alle Stoffe
- b) Bestimme die mittlere Reaktionsgeschwindigkeit vr in mol/s
- Salzsäure reagiert auch mit Calciumcarbonat. Es bildet sich wiederum ein Gas. Nach 2min. wird eine Massenabnahme von 0,960 g gemessen. Berechne die mittlere Änderung der Stoffmenge des Kohlenstoffdioxids. M(CO2) = 44 g/mol
- Die Wasserstoffperoxidkonzentration einer wässrigen Wasserstoffperoxidlösung nimmt bei der folgenden Reaktion ab:
- Es liegen folgende Konzentrationen vor:
- c0 (H2O2) = 0,98 mol/l
- c1 (H2O2) = 0,74 mol/l
- Berechnen Sie den zugehörigen Zeitabschnitt, wenn die mittlere Reaktionsgeschwindigkeit vr = -7,48 mol/l·s im betrachteten Zeitabschnitt ist.
Erklärung für die Konzentrationsabhängigkeit chemischer Reaktionen
Voraussetzungen für das Zustandekommen einer Reaktion - die Stoßtheorie
Damit Teilchen miteinander reagieren können, müssen diese
- zusammenstoßen
- eine genügend hohe Geschwindigkeit haben, um sich auch zu treffen (sie müssen also genug kinetische Energie haben)
- die richtige räumliche Orientierung haben
| A |
A |
A | |
| Teilchenzahl | A: 1 B: 2 |
A: 2 B: 2 |
A: 2 B: 3 |
|---|---|---|---|
| erfolgversprechende Zusammenstoßmöglichkeiten | 1 . 2 = 2 | 2 . 2 = 4 | 2 . 3 = 6 |
- Beispiel
(geschwindigkeitsbestimmender Schritt einer Reaktion)
Ist das Zusammentreffen beider Reaktionspartner wichtig, so ergibt sich:
- bimolekulare Reaktion
Erhöht man jetzt die Konzentration, also die Dichte der Teilchen, so erhöht sich auch die Reaktionsgeschwindigkeit.
Herleitung über die Stoßzahl s:
s ~ N(A) · N(B) mit N = n · NA
→ s ~ n(A) · NA · n(B) · NAmit c = n/V <=> n= cV
→ s ~ c(A) · V · NA · c(B) · V · NAmit V, NA = konst
→ s ~ c(A) · c(B)
→ v ~ c(A) · c(B)
→ v = k · c(A) · c(B)
Weitergehendes Beispiel:
Reaktion A + B → C + D
AABB: 4 Möglichkeiten für Zusammenstöße
AAAABB: 8 Möglichkeiten für Zusammenstöße
AAAABBBB: 16 Möglichkeiten für Zusammenstöße
Die Reaktionsgeschwindigkeit ist damit proportional dem Produkt der Konzentrationen der Stoffe A und B.
- k = Geschwindigkeitskonstante
- charakteristisch für eine Reaktion
- abhängig von der Temperatur)
- Zusatzinformationen
Kinetik
Die Reaktionsgeschwindigkeit ist abhängig von:
- den chemischen Eigenschaften der Reaktionspartner
- dem Verteilungsgrad (bzw. Oberfläche) und der Durchmischung der Reaktionspartner
- der Konzentration
Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration
- bimolekulare Reaktion:
- monomolekulare Reaktion:
- bimolekulare Reaktionen mit Gasen (ausgedrückt über Partialdruck p)
- da p ~ c
- ↑ 37%ige Salzsäure hat eine Konzentration von 12 Mol/L