Medizinische Mikrobiologie: Helminthen
Annelida (Ringelwürmer)
[Bearbeiten]Hirudo medicinalis (Blutegel)
[Bearbeiten]Der medizinische Blutegel (Hirudo medicinalis) ist ein blutsaugender Ektoparasit, der seit Jahrhunderten in der Medizin zur Aderlass- und Gerinnungstherapie Verwendung findet.
Verbreitung: Blutegel sind weltweit verbreitet in Feuchtgebieten. Sie sind gute Schwimmer und benötigen sauberes Wasser als Lebensraum. Außerhalb des Wassers bewegt sich der Blutegel mit Hilfe von zwei Saugnäpfen an den Körperenden schreitend fort. Durch den übertriebenen Einsatz medizinischer Blutegel in der ersten Hälfte des 19. Jahrhunderts wurden die Blutegelbestände vielerorts radikal dezimiert. Allein Frankreich importierte zwischen 1827 und 1838 etwa 350 Millionen Blutegel. In England und Deutschland sahen die Zahlen ähnlich aus. Mittlerweile sind medizinische Blutegel in Europa nur noch in wenigen Gebieten in ihrer natürlichen Umgebung zu finden und stehen beispielsweise in Deutschland unter Naturschutz. Der Bedarf an medizinischen Blutegeln wird seither durch Zuchtstationen gedeckt.
Morphologie und Eigenschaften: Blutegel leiten sich von den Ringelwürmern (Annelida) ab, die inneren Segmentgrenzen sind jedoch aufgelöst und äußerlich wegen einer Sekundärringelung auch nicht erkennbar. Egel haben eine feste Anzahl von Segmenten, nämlich 32. Die sehr muskulösen und drüsenreichen Saugnäpfe sind Zusammenschlüsse von mehreren Segmenten. Die Coelomsäcke, die bei Ringelwürmern in jedem Segment vorkommen, sind fast ganz reduziert. Übrig bleibt nur ein Kanalsystem. Der Darm bildet große Blindsäcke aus, in denen Blut gespeichert und verdaut wird. Das deutliche Zeichen der Gürtelwürmer, das Clitellum, ist nur während der Fortpflanzung zu sehen. Der Kopf besitzt drei Kieferplatten mit randständig kleinen, scharfen Zähnen
Erwachsene Tiere sind ausgestreckt etwa 5-10cm lang und bei hellem Licht ist eine Rückenzeichnung zu erkennen. Hirudo medicinalis hat eine bräunliche bis olivgrüne Farbe, rötliche Streifen auf dem Rücken und schwarze Flecken auf dem Bauch. Der Ungarische Blutegel (Hirudo verbana) besitzt einen grünen Bauch.
Blutegel sind langlebig: Sie werden erst mit drei Jahren geschlechtsreif und werden über 30 Jahre alt.
Ernährung: Wie der Name schon andeutet ernährt sich der medizinische Blutegel von Tierblut. Während einer Mahlzeit dickt der eingesaugte Blut ein, das Wasser wird über die Haut ausgeschieden. Das aufgenommene Blut wird im Körper des Egels mit Hilfe von Bakterien konserviert und reicht für ein bis zwei Jahre, in denen der Blutegel keine Nahrung mehr aufnehmen muss.
Blutegel saugen sich an der Haut von Tieren fest, um dann meist schmerzfrei die Haut zu durchbeißen. Mit ihren Beißwerkzeugen durchdringen sie selbst dickes Rinderfell in wenigen Sekunden. Anschließend kann ein Egel in etwa 30 Minuten Blut bis zum Fünffachen seines Körpergewichts saugen. Dabei sondert er über den Speichel etwa 20 verschiedene Substanzen in die Wunde ab, darunter die medizinisch relevanten Blutgerinnungshemmer Heparin und Hirudin und weitere Stoffe wie Hyaluronidase und antiphlogistische Substanzen. Nach Erreichen der Sättigung fällt der Blutegel von selbst ab.
Lebenszyklus: Blutegel sind Zwitter, benötigen jedoch einen Partner und andererseits Säugetierblut, um sich fortzupflanzen. Nach der Paarung werden bis zu 20 Eier außerhalb vom Wasser abgelegt und in Kokons eingesponnen. Nach dem Schlüpfen ernähren sich die jungen Egel von kleinen Wirbellosen, die sie fressen oder aussaugen, sie saugen jedoch auch an Fröschen.
Medizinische Anwendung: Blutegel werden vor allem in der Naturheilkunde angewendet, z.B. bei Arthrose, Varizen, Kopfschmerzen und Dysmenorrhoe. In der Chirurgie verwendet man sie z.B. zur Therapie von Lymphödemen und nach Lappentransplantationen.
Die Egel werden mit einem Spatel auf die entsprechende Hautstelle aufgesetzt. Der Biss ist kaum schmerzhaft. Die Bluegel fallen nach ein bis drei Stunden ab und die Bißstellen bluten noch 8 bis 24 Stunden nach.
Unerwünschte Reaktionen wie Hautrötungen oder Wundinfektionen treten etwa in 1% der Behandlungen auf.
Literatur und Weblinks:
- http://www.aerztezeitung.de/docs/2006/01/19/009a1101.asp?cat=
- http://www.aerztezeitung.de/docs/2001/09/24/170a0104.asp?cat=
Trematoda (Saugwürmer)
[Bearbeiten]Die humanpathogenen Saugwürmer zeichen sich dadurch aus, dass sie meist eine Schnecke als Zwischenwirt haben (manche haben auch noch einen zweiten Zwischenwirt) und im Endwirt meist die Bauchorgane (Leber, Gallenwege, Darm), z.T. auch die Beckenorgane (Harnblasenbilharziose) befallen.
Schistosoma spp. (Pärchenegel)
[Bearbeiten]| Schistosoma spp. | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||||||||
|
Die Pärchenegel Schistosoma sind eine Gattung parasitisch lebender Saugwürmer, die vor allem in den Tropen und Subtropen vorkommen. Weltweit sind bis jetzt 83 Arten bekannt. Benannt wurden sie 1852 ursprünglich als Bilharzia nach Theodor Bilharz, heute ist nur noch der Name Schistosoma üblich.
Morphologie und Eigenschaften: Die Pärchenegel zeichnen sich durch einige morphologische und physiologische Besonderheiten aus, die sie von allen übrigen Saugwürmern unterscheiden. So handelt es sich etwa um die einzigen getrenntgeschlechtlichen Vertreter unter den Saugwürmern und der sonst übliche zweite Zwischenwirt fehlt. Darüberhinaus sind die Pärchenegel im Endwirt im Venensystem lokalisiert - anders als die übrigen Saugwurmfamilien, deren Vertreter meist in Darm oder Leber zu finden sind. Männchen und Weibchen der Pärchenegel unterscheiden sich in Größe und Gestalt (Geschlechtsdimorphismus): Das längere Weibchen lebt nach der Kopulation in der Bauchfalte des Männchens (Dauerkopula), wobei das Vorder- und Hinterende aus dieser hervorragen. Die Bauchfalte des Männchens wird auch als Canalis gynaecophorus bezeichnet.
Epidemiologie: Die humanpathogenen Vertreter der Pärchenegel sind hauptsächlich in den tropischen Regionen der Welt zu finden. Schistosoma mansoni, der wichtigste Erreger der Bilharziose ist überall dort auf dem afrikanischen Kontinent vertreten, wo der wichtigste Zwischenwirt Biomphalaria pfeifferi vertreten ist. Diese Posthornschnecke ist vor allem in stehenden und langsam fließenden Gewässern zu finden. Schistosoma mansoni gelangte im 19. Jhd. durch den Sklavenhandel nach Südamerika. Auf dem afrikanischen Kontinent kommt weiterhin die wichtige humanpathogene Art Schistosoma haematobium vor. In China, Japan und einigen anderen Ländern Ostasiens findet sich Schistosoma japonicum als humanpathogener Vertreter. In Europa und Nordamerika sind lediglich einige Gattungen vertreten, die bei Entenvögeln parasitieren. Diese Vertreter haben zwar keine medizinische Relevanz für den Menschen - das zweite freischwimmende Larvenstadium, die Cercarie, kann allerdings in betroffenen Badeseen in die Haut des Menschen eindringen, wo sie abstirbt und unangenehmen Juckreiz auslöst (Badedermatitis bzw. Cercariendermatitis).
Es wird geschätzt, dass ca. 250–300 Millionen Menschen von dem Parasiten befallen und 600 Millionen gefährdet sind.
Lebenszyklus: Schistosomen parasitieren bei Säugetieren, Vögeln und Krokodilen (Griphobilharzia) im Gefäßsystem. Die mit dem Harn oder Stuhl des Endwirtes ins Wasser gelangten Eier enthalten eine Wimpernlarve (Miracidium), welche schlüpft und aktiv in den ersten Zwischenwirt (in der Regel eine Posthornschnecke) eindringt. Dort entwickelt sie sich zur sogenannten Muttersporozyste, die wiederum Tochtersporozysten bildet, welche in die Mitteldarmdrüse der Schnecke einwandern. Dort produzieren die Tochtersporozysten die charakteristischen Gabelschwanzcercarien. Letztere verlassen die Schnecke mit deren Ausscheidungen und befinden sich nun wieder frei im Wasser. Im Wasser müssen die Cercarien einen geeigneten Endwirt finden.


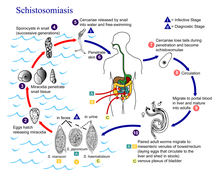

Bei Kontakt mit dem Endwirt dringt die Cercarie durch die Haut in das Gefäßsystem ein und wirft dabei den Gabelschwanz ab. Unter starkem Längenwachstum und Umstrukturierung des Tegumentes wandelt sich die Larve zu einem jungen, aber noch nicht geschlechtsreifen Wurm, den man als Schistosomulum bezeichnet. Die Schistosomulae halten sich zunächst in der Lunge auf und wandern zur Paarung in die Pfortader, wo durch Aufnahme eines Weibchens (7-25mm Länge) in die Bauchfalte des relativ dicken Männchens (6-20mm Länge) die Verpaarung erfolgt. Diese Kopula hält ein Leben lang an, was den Pärchenegeln ihren Namen eingebracht hat.
Die geschlechtsreifen Tiere siedeln sich im Venensystem ihrer Endwirte an, wobei der Ansiedlungsort artspezifisch ist (in der Regel Mesenterialvenen oder Harnblasenvenen). Die adulten Pärchenegel ernähren sich im Endwirt von Bestandteilen des Blutes, darunter Erythrozyten sowie Blutserum.
Das Weibchen gibt täglich je nach Art hunderte bis tausende befruchteten Eier ab. Durch Entzündungsreaktionen in den Venen, in denen die adulten Pärchenegel leben, werden die Gefäße und das umliegende Gewebe arrodiert und die Eier gelangen in den Darm oder die Harnblase. Etwa die Hälfte der Eier wird mit dem Blutstrom verdriftet und gelangt in unterschiedliche Organe des Körpers, wo sie zu lokalen Entzündungen führen.
Die adulten Tiere leben etwa 2 bis 5 Jahre, in Einzelfällen über Jahrzehnte im Endwirt.
Arten und Zwischenwirte: Im folgenden sind einige Arten mit der dazugehörigen Wirts-Schneckengattung darunter aufgeführt.
- Schistosoma mansoni: Biomphalaria glabrata, Biomphalaria alexandrina, Biomphalaria sudanica, Biomphalaria pfeifferi, Biomphalaria straminea, Planorbis boissyi, Australorbis glabratus
- Schistosoma haematobium: Bulinus truncatus, Bulinus globosus (= Physopsis globosa), Physopsis africana, Planorbarius sp.
- Schistosoma intercalatum: Indoplanorbis sp., Bulinus forskali
- Schistosoma japonicum: Oncomelania hupensis, Schistosomophora sp., Katayama sp.
- Schistosoma mekongi: Tricula aperta
 |
 |
 |
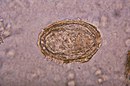
Krankheitsbilder: Schistosoma spp. verursachen die Schistosomiasis, auch Bilharziose genannt. Nach der Penetrationsphase mit Juckreiz an der Stelle des Hautinvasion beginnt die akute Phase mit Exanthem, Fieber, Schüttelfrost, Husten, Kopfschmerzen, Hepatosplenomagalie und Lymphadenopathie. Die Erkrankung kann bei Überleben des Erregers chronifizieren und verläuft je nach den befallenen Organen. Schistosoma haematobium ist der Erreger der Blasenbilharziose, bei der vornehmlich die ableitenden Harnwege und die Harnblase befallen sind und Blasenkarzinome entstehen können. Im Gegensatz dazu befallen S. mansoni, S. intercalatum, S. japonicum und S. mekongi eher den Darm.
Diagnostik: Nachweis der Eiern im Stuhl oder Urin, Biopsie, Serologie, Sonographie
Therapie: Zur Therapie werden recht nebenwirkungsarme Medikamente verwandt, sehr gebräuchlich ist eine Ein-Tages-Behandlung mit dem Wirkstoff Praziquantel (z.B. Biltricide®).
Fasciola hepatica (Großer Leberegel) und Fasciola gigantea (Riesenleberegel)
[Bearbeiten]| Fasciola hepatica | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||||||
|
Der Große Leberegel (Fasciola hepatica) ist ein weltweit vorkommender Parasit (Saugwurm) von bis zu 3cm Länge und lorbeerblattähnlicher Form, der als Endwirt Pflanzenfresser wie Rinder oder Schafe befällt, aber auch Schweine, andere pflanzenfressende Tiere und Menschen. Die Infektion bei Schafen erfolgt hauptsächlich im Sommer und Herbst auf der Weide. Fasciola gigantica führt in Asien und Afrika zur Erkrankung. Die WHO (1995) schätzt die Zahl der mit Fasciola spp. Infizierten auf 2,4 Millionen.
Lebenszyklus: Ein erwachsener Leberegel legt im Gallengangsystem des Endwirtes Eier ab, die mit dem Kot in die Umwelt gelangen. Diese Eier überleben dort 2 bis 6 Monate. In Tümpeln und anderen Wasseransammlungen findet die Entwicklung zur Wimpernlarve (Miracidium) statt, die schwimmend ihren Zwischenwirt findet, die amphibische Zwergschlammschnecke (Lymnaea truncatula, auch Leberegelschnecke genannt, unter 1cm Länge). In Australien ist der Zwischenwirt Lymnaea tomentosa, in Nordamerika Fossaria modicella und Fossaria bulimoides. Als weitere Gattungen werden von G. Piekarski Galba und Radix genannt (Siehe vorerst: Lungenschnecken).

In der Schnecke entwickelt sich die Larve zur Sporozyste weiter, in der sich mehrere Redien bilden, die wiederum Tochterredien bilden, bis sich aus diesen Cerkarien (Schwanzlarven) entwickelt haben. Dieser Vorgang dauert ca. 2 Monate und bringt bis zu 2.000 Zerkarien hervor.
Diese verlassen aktiv die Schnecke und heften sich dicht unter der Wasseroberfläche an Pflanzen o.ä. an. Danach verlieren sie ihren Antriebsschwanz und werden zur infektiösen Metacercarie. In diesem Stadium ist der Leberegel äußerst robust und kann selbst tiefste Temperaturen unter -15 °C wochen- bis monatelang überleben.
Von diesen Pflanzen gelangen sie wiederum in den Endwirt und können dort heranwachsen. Seltene Infektionen beim Menschen in Europa sind durch Genuss roher Brunnenkresse, seltener auch Löwenzahn sowie Fallobst, besonders aus verseuchtem Weideland bekannt.
Die Parasiten durchdringen die Darmwand und wandern im Verlauf von ein bis zwei Monaten über die Peritonelhöhle in die Leber ein. Nach weiteren ein bis zwei Monaten haben sie ihr Ziel, die Gallenwege erreicht.
Krankheitsbilder: Die Infektion mit den Gallengangsparasiten kann inapparent verlaufen oder die sogenannte Fasciolose hervorrufen. Die Erkrankung macht sich ein bis zwei Monate nach Infektion durch Leberschwellung und Bauchschmerzen bemerkbar gepaart mit Fieber und einer eosinophilen Entzündung (Wanderphase). In der chronischen Phase kann es zu verschiedenen hepatocholangitischen Beschwerden kommen. Durch Irrläufer können auch andere Organe befallen werden und Symptome hervorrufen.
Im Nahen Osten verursacht eine Gewohnheit, rohe Schafs- und Ziegenleber zu genießen ein spezielles Krankheitsbild, genannt "Halzoun".
Diagnostik: Nachweis der Eier im Stuhl oder Duodenalsekret, frühestens ein viertel Jahr nach Infektion. Serologischer Antikörpernachweis.
Therapie: Triclabendazol
Fasciolopsis buski (Riesendarmegel)
[Bearbeiten]| Fasciolopsis buski | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||||||||||||
|
Epidemiologie: Fasciolopsis buski ist vor allem in asiatischen Ländern zu finden wie z.B. dem zentralen und südlichen China, Taiwan, Vietnam, Thailand, Indien, Borneo u.a. Regionen Südostasiens. Millionen Menschen sind in diesen Ländern infiziert, vor allem in ländlichen Gebieten.
Lebenszyklus: Fasciolopsis buski kann bis zu 80mm groß werden. Er ist ein gefährlicher Parasit von Tier und Mensch und gilt als Erreger der Fasciolopsiasis. Das Schwein gilt in manchen Gegenden der Welt als natürliches Reservoir für diesen Parasiten. Auch Hunde und Kaninchen können von ihm infiziert werden.

Zwischenwirte
Als Zwischenwirte für den Riesendarmegel treten Lungenschnecken besonders der Arten Segmentina nitidella, Segmentina hemisphaerula und Hippeutis schmackerie sowie der Gattungen Gyraulus, Lymnaea, Planorbis und Indoplanorbis auf . Auch die Gattung Pila (Apfelschnecken) wird von einer Quelle genannt.
Infektion des Menschen
Der Mensch nimmt den Darmegel oral meist als Metacercarien auf, die sich in stehenden Gewässern auf zur menschlichen Ernährung bestimmten Wasserpflanzen oder Sumpfpflanzen befinden. Dazu zählen besonders die Wassernuss, die Wasserkastanie, die Lotuswurzel, der Wasserspinat sowie der Mandschurische Wildreis (Zizania latifolia), dessen verpilzte Stengel auch roh als Gemüse gegessen werden
Krankheitsbild: Nach einer Inkubationszeit von bis zu 3 Monaten kommt es bei einer Fasziolopsiasis zu gastrointestinalen Symptomen wie Bauchschmerzen, Übelkeit, Obstipation (evtl. mechanischer Ileus) oder Diarrhoe, sowie zu allergischen Reaktionen. Gelegentlich führt diese Erkrankung auch zu Todesfällen.

Diagnostik: Nachweis der Wurmeier im Stuhl.
Therapie: Eine Behandlung ist mit Praziquantel möglich. Alternativ geht Niclosamid.
Prophylaxe:
- Erhitzen von Wasserpflanzen vor dem Verzehr
- Erhitzen von Trinkwasser aus Oberflächengewässern
- Kontrolle der Abwässer von Mensch und Tier
- Kontrolle der Zwischenwirte (Schnecken)
Dicrocoelium dendriticum (Kleiner Leberegel)
[Bearbeiten]| Dicrocoelium dendriticum | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||||||
|
Der Kleine Leberegel (Dicrocoelium dendriticum) ist ein Parasit, der einen Entwicklungszyklus über zwei Zwischenwirte (Landschnecke und Ameise) zum Endwirt vollzieht.
Epidemiologie: Der Parasit kommt weltweit vor.
Lebenszyklus: Die Wimpernlarven (Miracidien) des kleinen Leberegels schlüpfen aus den Eiern, welche von Landschnecken wie der Zebraschnecke (Zebrina dendrita), der Heid- oder Vielfraßschnecke, die die Eier mit der Nahrung aufgenommen haben, gefressen wurden.
Innerhalb der Schnecke durchbohrt die Larve den Darm, baut ihre Neodermis auf und wird zur Sporocyste. Diese vermehrt sich auf vegetativem Weg zu Tochtersporocysten, welche ihrerseits vegetativ Cerkarien hervorbringen. Diese begeben sich nun in das Atemsystem der Schnecke, wodurch dieses gereizt wird und die Schnecke kleine Schleimbällchen ausscheidet, in denen nun die Cerkarien sitzen.
Diese Schleimbällchen werden von Ameisen (Formica spp. und Lasius spp.) gefressen, welche einen weiteren Zwischenwirt darstellen. Hier entwickelt sich die Zerkarie zur Metacercarie.
Manche der Metacercarien gelangen ins Ganglion und encystieren diese werden als "Gehirnwurm" bezeichnet. Dies bewirkt eine Verhaltensanomalie der Ameise, die nun bei Einbruch der Dämmerung nicht anders kann, als auf einen Grashalm zu klettern und sich dort festzubeissen.
Wenn die Ameise von einem Pflanzenfresser mit dem Grashalm gefressen wird ist der Parasit wieder in seinem Endwirt gelandet.
Krankheitsbild: Menschen können sich selten durch die zufällige Aufnahme von mit Metazerkarien tragenden Ameisen infizieren. Krankheitszeichen der Dicrocoeliose sind Bauch- und Leber- und cholestatische Beschwerden.
Diagnostik: Eier-Nachweis im Stuhl
Therapie: Die Parasiten können mit Praziquantel behandelt werden.
Clonorchis sinensis (Chinesischer Leberegel)
[Bearbeiten]| Clonorchis sinensis | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||||||||||
|
Der Chinesische Leberegel (Clonorchis sinensis) ist ein zur Gruppe der Saugwürmer gehörender Parasit. Endwirte sind fischfressende Säugetiere (Katzen) und der Mensch.
Epidemiologie: Der Parasit ist Ostasien zuhause (China, Taiwan, Hongkong, Vietnam, Japan, Korea). Der Lebenszyklus ist an Süßwasser gebunden. Weltweit sind nach Schätzungen 20 bis 30 Millionen Personen infiziert. Trotz ihrer geringen Bekanntheit gilt die Clonorchiose als weltweit dritthäufigste Wurmerkrankung.
Morphologie und Eigenschaften: Der erwachsene Egel ist abgeflacht, 10 bis 25mm lang und 3 bis 5mm breit. Er besitzt zwei Saugnäpfe (oral und ventral). Clonorchis bedeutet "zweigförmiger Hoden" und beschreibt die durch das transparente Parenchym sichtbare Struktur der inneren Organe. Die Würmer sind Zwitter.

Lebenszyklus: Der Lebenszyklus beginnt mit der Absetzung der Eier im Fäzes des Wirtes. Der erste Zwischenwirt ist eine Wasserschneckenart (Bithynia siamensis), in der das Miracidium (Flimmerlave) nach Aufnahme schlüpft. Innerhalb der Schnecke wandelt sich das Miracidium in eine Sporocyste (Brutschlauch) um, die intern durch Knospung Redien (Stablarven) produziert. Die Redien ihrerseits entwickeln sich -immer noch innerhalb der Schnecke- weiter und setzen durch weitere ungeschlechtliche Fortplanzung Cercarien (Schwanzlarven) frei. Diese entweichen ins Wasser und durchbohren die Haut eines Fisches. In dessen Muskulatur bilden sie Metacercarialcysten. Durch den Verzehr von ungekochtem Fisch kann sich der Mensch infizieren. Die Metacercarien penetrieren den Dünndarm und wandern in die Leber. Dort halten sie sich in den Gallenwegen auf und reifen zum erwachsenen Egel. Nach 3-4 Wochen beginnt der Wurm Eier zu legen, die über die Galle in den Stuhl gelangen.
Erkrankung: Der Mensch infiziert sich mit der Clonorchiose über rohe oder unzureichend gegarte Fische, die von Clonorchis sinensis befallen sind. Symptome sind Fieber, Leber- und Gallenwegsentzündungen mit Hepatomegalie, Oberbauchschmerzen, Diarrhoe und Leukozytose. Die Infektion begünstigt weiterhin die Entstehung von Gallengangskarzinomen.
Diagnostik: Nachweis der Eier im Stuhl oder Duodenalsaft, Serologie.
Therapie: mit Praziquantel, alternativ Albendazol
Literatur und Weblinks:
Opisthorchis felineus (Katzenleberegel)
[Bearbeiten]| Opisthorchis felineus | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||||||||||||||
|
Der Katzenleberegel (Opisthorchis felineus) ist ein Parasit, der fischfressende Säugetiere befällt, darunter Katze, Fischotter, Fuchs und auch den Menschen.
Verbreitung: Der Katzenleberegel ist in Russland und Osteuropa (über 2 Millionen Infizierte) vor allem an stehenden und langsam fließenden Gewässern anzutreffen. In manchen Gebieten kommt er endemisch vor mit einer Durchseuchungsrate der Bevölkerung bis zu 80%.
Morphologie: Wie alle Saugwürmer, ist Opisthorchis felineus oval und recht breit und erreicht ein Länge von bis zu 13 Millimeter.

Lebenszyklus: Die Eier müssen nach dem Ausscheiden ins Wasser gelangen und sind dort bereits embryoniert. Sie sinken zu Boden und werden von einer Vorderkiemenschnecke (Bithynia leacti) aufgenommen. In der Schnecke machen sie eine Redien-Entwicklung durch. Danach werden noch unreife Cercarien gebildet, die einige Zeit in der Schnecke verbleiben ehe sie diese verlassen. Im Wasser nehmen sie eine Schwebestellung ein. Der Körper hängt dabei wie ein Pendel am ruhenden Schwanz. In dieser Position schnellen sie auf und ab und locken so Fische (meist Karpfenartige) an. Diese Fische werden nun zum zweiten Zwischenwirt. Dort kapseln sie sich im Bindegewebe der Haut und im Muskelgewebe ein. Wird der Fisch nun vom Endwirt aufgenommen, kann die Metacercarie im Darm frei werden und über den Zwölffingerdarm durch den Ductus cholchedochus in Leber, Gallen- und Pankreasgänge wandern.
Krankheitsbild: Symptome der Opisthorchiose treten oft erst bei Infektion mit mehr als hundert Egeln auf. Die Gallengänge werden verdickt, es kommt zum fibrotischen Umbau im Bereich der Vena portae. Hepatomegalie, Cholangitiden, Gallensteine und Verschlussikterus können auftreten. Die Entstehung von Gallengangskarzinomen wird begünstigt.
Diagnostik: Nachweis der Eier im Stuhl oder Duodenalsaft, serologische Antikörperbestimmung.
Therapie: Praziquantel
Prophylaxe: Die encystierten Metacercarien sind recht widerstandsfähig gegenüber Pökeln, Marinieren oder Trocknen und überleben sogar bei Kühlschranktemperaturen. Daher ist Durchkochen des Fisches unabdingbar in Risikogebieten.
Cestoda (Bandwürmer)
[Bearbeiten]Taenia saginata (Rinderbandwurm)
[Bearbeiten]| Taenia saginata | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||
|
Der Rinderbandwurm Taenia saginata, besser als Rinderfinnenbandwurm bezeichnet, ist ein im Darm des Menschen parasitierender Wurm, der Rinder als Zwischenwirt nutzt.
Verbreitung: Der Rinderbandwurm wurde weltweit mit der Rinderzucht verbreitet, kommt heute allerdings meist in den Ländern südlich der Sahara und jenen des Nahen Ostens vor. Der Mensch stellt den einzigen Endwirt dar. In Europa sind bis zu 1,5% der Rinder befallen. Ungeklärte Abwässer, die in Flüsse gelangen, "wilde Toiletten" in der Nähe von Weideplätzen und die direkte Übertragung der Eier von Mensch zu Rind in Betrieben sind Quellen von Infektionen.
Morphologie und Eigenschaften: Der Körper des Rinderbandwurms trägt alle typischen Merkmale der Bandwürmer, er erreicht eine Länge von bis zu 10 Metern und einer Breite von bis zu 7 Millimetern. Eine Besonderheit des Rinderbandwurmes ist das Fehlen von Hakenkränzen als Haftorgan am Scolex (Kopf), der ansonsten mit vier Saugnäpfen ausgestattet ist.

Lebenszyklus: Der Lebenszyklus des Rinderbandwurmes umfasst wie bei allen Bandwürmern ein Finnenstadium, das hier im Rind zu finden ist. Der menschliche Endwirt scheidet pro Tag bis zu neun vom Bandwurm abgestossene Körpersegmente, sog. Proglottiden aus. Diese verstreuen durch aktive Kriechbewegungen die Eier über weite Strecken. Die Eier werden von Rindern aufgenommen, aus denen im Dünndarm Onkosphären schlüpfen, die die Darmwand penetrieren und über den Blutweg die quergestreifte und Herzmuskulatur erreichen, in der sie sich innerhalb von 3-4 Monaten zu infektionstüchtige Finnen (Cysticercus bovis) entwickeln. Die Finnen verbleiben nun im Rind und werden, falls sie bei einer in den meisten Ländern gesetzlich vorgeschriebenen Fleischbeschau durch den Veterinärmediziner nicht entdeckt werden, vom Menschen aufgenommen. Eine Wurminfektion tritt allerdings nur dann auf, wenn das Fleisch ungenügend gekocht oder roh gegessen wird.
Krankheitsbild:
 |
 |
Die Infektion (Taeniasis) verläuft oft subklinisch, selten treten Kopfschmerzen, leichte Bauchschmerzen, Malabsorptionssyndrom, Gewichtsverlust, Passagestörungen, Hungergefühl oder wechselnder Appetit und Unwohlsein auf. Im Rind selbst rufen die Finnen ebenfalls keine Symptome hervor.
Diagnostik: Stuhluntersuchung auf Proglottiden, ELISA, PCR
Therapie: Niclosamid, alternativ Praziquantel
Prophylaxe: Fleisch sollte ausreichend durchgekocht werden. Lebensmittelkontrolle und Fleischbeschau.
Taenia solium (Schweinebandwurm)
[Bearbeiten]| Taenia solium | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||
|
Der Schweinebandwurm (Taenia solium, syn.: Schweinefinnenbandwurm) ist ein parasitisch im Darm des Menschen lebender Wurm. Als Zwischenwirt dienen Schweine. Experimentell lassen sich auch andere Säugetiere infizieren. Auch der Mensch kann als Fehlzwischenwirt dienen.
Verbreitung: Der Schweinebandwurm wurde wie der Rinderbandwurm weltweit mit dem Menschen als seinem Hauptwirt verbreitet. Der Mensch infiziert sich, indem er Fleisch isst, welches mit den Larven (Finnen) des Bandwurmes belastet ist.
Morphologie und Eigenschaften: Der Körper des Schweinebandwurmes trägt alle typischen Merkmale der Bandwürmer, er erreicht eine Länge von bis zu 4 m und eine Breite von bis zu 7 mm.

Lebenszyklus:
Der Lebenszyklus des Schweinebandwurmes umfasst wie bei allen Bandwürmern ein Finnenstadium, das in diesem Fall im Schwein zu finden ist. Der Hauptwirt scheidet pro Tag bis zu neun Proglottiden aus. Die Eier werden vom Schwein in großen Mengen aufgenommen und siedeln sich vor allem in der Muskulatur (Zwerchfell, Zunge, Herz) an. Die Finnen verbleiben im Schwein und werden durch ungenügendes Kochen des Fleisches auf den Menschen übertragen. Anders als beim Rinderbandwurm kann der Mensch auch als Zwischenwirt dienen, wenn er die Eier aufnimmt.

Krankheitsbild: Die Infektion mit dem adulten Bandwurm verläuft meist symptomlos. Falls der Mensch als Fehlzwischenwirt infiziert wird, siedeln sich die Finnen in verschiedenen Organen an, z.B. in der Unterhaut, im Gehirn und im Auge und verursachen die Zystizerkose.
Diagnostik: Stuhluntersuchung auf Proglottiden, ELISA, PCR
Therapie: Praziquantel, alternativ Niclosamid
Prophylaxe: In Europa sind Schweinebandwürmer vor allem durch die Fleischbeschau eliminiert worden, da die Finnen recht auffällig sind und gehäuft auftreten. Problematische Gebiete sind vor allem Mexiko, wo das Finnenstadium häufig im Menschen angetroffen wird (bis zu 3,6 % der Bevölkerung sind in Mexiko Stadt betroffen). Fleisch sollte durchgekocht werden.
Echinococcus multilocularis (Fuchsbandwurm)
[Bearbeiten]| Echinococcus multilocularis | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||||
|
Der Fuchsbandwurm (Echinococcus multilocularis) parasitiert vor allem im Rotfuchs, Polarfuchs und Marderhund, seltener im Haushund oder in der Hauskatze. Als Zwischenwirt dienen kleine Säugetiere, wie Rötelmaus oder Feldmaus. Der Fuchsbandwurm ist der Auslöser der alveolären Echinokokkose, einer lebensgefährlichen Wurmerkrankung.
Morphologie und Eigenschaften: Als kleinerer Vertreter der Bandwürmer erreicht der Fuchsbandwurm eine Länge von nur rund drei Millimetern bei einem Durchmesser von rund einem Millimeter. Der Kopf (Scolex) besitzt Saugnäpfe und Haken, um sich an der Darmwand des Wirtes festzusetzen. Diese sind in zwei Reihen zu je 13 bis 18 Häkchen angeordnet, wobei die vorderen größer als die dahinterliegenden sind.
Der Körper von Echinococcus multilocularis ist in drei bis vier segmentähnliche Körperabschnitte (Proglottiden) unterteilt, wobei das letzte stark vergrößert ist und fast die Hälfte der gesamten Länge des Wurmes ausmacht. In den Proglottien liegt jeweils ein Satz von Geschlechtsorganen vor, in denen Spermien und später Eier produziert werden. Etwa in der Mitte der Proglottiden liegt der deutlich erkennbare Genitalporus.
Verbreitung: Die Verbreitungsgebiete erstrecken sich vor allem auf die gemäßigten bis kalt-gemäßigten Klimazonen Mitteleuropas und Nordamerikas. Die Echinokokkose kommt in den meisten Gebieten endemisch vor, breitet sich jedoch zusehends auf ganz Mitteleuropa aus, da immer mehr Rotfüchse in die Städte abwandern und sich der Fuchsbandwurm dort vor allem unter der Nagetierpopulation ausbreiten kann. Die Befallsdichte schwankt erheblich, in manchen Regionen sind bis zu 70% der Füchse befallen (Südwestdeutschland), in anderen nur bis zu 5 %.
Vor allem in Sibirien und Alaska mit den Inseln des Beringmeers sowie in der Schweiz (Schwerpunkt Kanton Thurgau) und in Deutschland im Bereich der Schwäbischen Alb häufen sich die Vorkommen. Zumindest in Europa kommt es aufgrund dieser inselhaften Verbreitung so gut wie gar nicht zu einer Überlappung mit dem Verbreitungsgebiet für den Hundebandwurm (Echinococcus granulosus). Ein Grund für diese Verteilung ist noch nicht bekannt.
Epidemiologie: Die Anzahl der Übertragungen auf den Menschen ist offensichtlich sehr gering. In ganz Europa sind im Zeitraum von 1982 bis 2000 lediglich 559 Fälle der alveolären Echinokokkose bekannt, wobei allerdings berücksichtigt werden muss, dass die tatsächliche Zahl der Fälle aufgrund der erst im Jahre 2000 begonnenen zentralen Erfassung nicht genau angegeben werden kann. Obwohl die Zahl der mit dem Bandwurm infizierten Füchse in Endemiegebieten relativ hoch ist, wurde kein eindeutiger Zusammenhang zwischen einer hohen Population von befallenen Füchsen und erhöhten Infektionsraten beim Menschen festgestellt. Daher wurde selbst in Gebieten, in denen bis zu 60% der Füchse befallen waren, kein größerer Anstieg der an Echinokokkose erkrankten Menschen festgestellt.

Lebenszyklus: Der erwachsene Wurm, der sich im Darm des Endwirtes niedergelassen hat scheidet bis zu 200 Eier (Oncosphären) pro Tag aus. Die Eier sind sehr kältebeständig und können monatelang infektiös bleiben. Das Ei wird zunächst von einem Zwischenwirt (Nager) aufgenommen. Im Magen löst sich die Eikapsel auf und die so genannte Hexacanthenlarve durchdringt die Darmwand und gelangt so in die Blutbahn oder in die Lymphe.
Die Larve setzt sich vor allem im Lebergewebe fest, kann aber auch Lunge, Herz und Milz befallen und bildet eine Hydatide genannte, knospende Larvenstruktur. Sie bildet Ausläufer, die malignomartig in das umliegende Gewebe vorwachsen (multilocularis). Es bildet sich ein großes schwammiges Gewebe (Metacestode), in dessen Wand sich die knospenden Protoscolices bilden, Bandwurmfinnen mit eingestülptem Kopf. Sie wird aus diesem Grunde als Hydatide des alveolären Typs von der Hydatide des cystischen Typs des Hundebandwurms abgegrenzt, bei dem durch eine Knospung in den Innenraum große Hydatidenblasen gebildet werden.
Der Zwischenwirt wird vom Endwirt (Hund, Fuchs, Katze) erbeutet oder als Aas gefressen. Das um die Hydatide liegende Gewebe wird verdaut und die freigewordenen Bandwürmer setzen sich mit ihren Haken im Dünndarm fest und ernähren sich über ihre Außenhaut, die syncytiale Neodermis. Sie besteht aus dem „Nahrungsbrei“, der im Dünndarm vorhanden ist und aus dem der Wurm die Nährstoffe resorbiert. Der Stoffwechsel verläuft über anaerobe Glykolyse. Es können tausende Würmer im Endwirt vorkommen, ohne diesen ernsthaft zu beeinträchtigen. Bei starkem Befall verteilen sich die Tiere gleichmäßig über den gesamten Dünndarm, bei wenigen Tieren bleibt in der Regel das erste Dünndarmdrittel frei.

Krankheitsbild beim Menschen: Fuchsbandwürmer sind selbst bei hohem Aufkommen im Endwirt für diesen kaum schädlich, für den Menschen als (Fehl-)Zwischenwirt hat eine Infektion jedoch meist verheerende Folgen. In den Organen eines infizierten Menschen, vornehmlich in der Leber, aber auch Lunge und Gehirn findet eine Finnenentwicklung statt, die das Krankheitsbild der alveolären Echinokokkose hervorruft. Dabei entsteht ein Netzwerk von Röhren in den befallenen Organen. Sie enthalten die Finnen von Echinococcus multilocularis in Form von Anhäufungen mikroskopisch kleiner, von Bindegewebe umschlossenen Bläschen (Alveolen). Man spricht daher von einer alveolären Echinokokkose im Gegensatz zur zystischen Echinokokkose bei Infektion durch den Hundebandwurm. Das Finnengewebe breitet sich malignomartig aus, wodurch die betroffenen Organe weitgehend zerstört werden. Die Erkrankung wird meist erst zehn bis zwanzig Jahre nach der Infektion bemerkt.
Diagnostik: Eine Abgrenzung gegen Malignome ist mittels Antikörpernachweis im Blut möglich.
Therapie: Durch die unscharfe Abgrenzung zu gesunden Organbereichen ist eine Operation bei fortgeschrittener Erkrankung kaum durchführbar. Ohne komplette Resektion oder die jahrelange Einnahme von Antiheminthika sterben die meisten Patienten an Leberversagen.
Prophylaxe: Die Hauptzahl der Fälle wurde bei Personen beobachtet, die entweder beruflich oder privat mit Landwirtschaft und Waldbau zu tun hatten. In 70% der gemeldeten Fälle sind Hunde- oder Katzenbesitzer betroffen. Es wird daher davon ausgegangen, dass bei den meisten Fällen erst eine Dauerexposition zur Infektion führen kann und keine einmalige Aufnahme der Bandwurmeier.
Früchten und Beeren aus Bodennähe (weniger als 60 bis 80cm über dem Boden) oder Pilzen können möglicherweise Bandwurmeier anhaften. Bei Risikostudien wurde jedoch kein Zusammenhang zwischen dem erhöhten Verzehr von Beeren oder Pilzen und erhöhten Infektionsraten festgestellt. Bisweilen wird immer noch empfohlen, bodennah gesammelte Früchte und Beeren nicht ungewaschen zu essen. Tiefgefrieren der Früchte reicht nicht aus, da die Eier erst bei -80 °C absterben. Die Früchte sollten, wenn die Möglichkeit besteht, gekocht werden. Beim Umgang mit mäusefangenden Haustieren, wie Hunden oder Katzen, ist Hygiene der beste Infektionsschutz für den Menschen. Hiervon geht vermutlich das größte Infektionsrisiko aus, da in 70% der 559 zwischen 1982 und 2000 untersuchten Fälle Katzen oder Hundehalter betroffen waren. Nach der Berührung des Fells mit den Händen, zum Beispiel durch Streicheln, sollten diese nicht ungewaschen zum Mund geführt werden, insbesondere wenn das Fell in der Afterregion berührt wurde. Hunde und Katzen, die in der Nähe von Fuchs-Populationen gehalten werden, sollten regelmäßig entwurmt werden.
Auch vom Kot eines vom Fuchsbandwurm befallenen Tieres geht eine Gefahr aus, da darin befindliche Bandwurmeier einerseits per Kontaktinfektion bzw. Schmierinfektion zunächst vielleicht z.B. auf Haustiere und dann auf den Menschen übertragen werden können. Der trockene Tierkot könnte andererseits unbemerkt eingeatmet werden und damit auch die in ihm befindlichen Bandwurmeier. Diese sind sehr umweltresistent und bleiben in der Natur auch bei extremen Temperaturen bis zu 190 Tage lebensfähig. Lediglich große, trockene Hitze kann den Bandwurmeiern schaden.
Rechtliches: In Deutschland besteht seit 2001 eine Meldepflicht für Echinokokkose. Nicht aber in der Schweiz und Österreich.
Literatur und Weblinks:
- Eckert J. (1996): "Der gefährliche Fuchsbandwurm, (Echinococcus multilocularis) und die alveoläre Echinokkose des Menschen in Mitteleuropa"; Berliner & Münchner Tierärztliche Wochenschrift 109, 202-210
- Eckert, J., Ewald, D., Siegenthaler, M., Brossard, M., Zanoni, R.G. & Kappeler, A., 1995: "Der "Kleine Fuchsbandwurm, (Echinococcus multilocularis) in der Schweiz - Epidemiologische Situation bei Füchsen und Bedeutung für den Menschen." Bulletin des Bundesamtes für Gesundheitswesen 25: 468-476.
- RKI - Echinokokkose
- http://www.eurechinoreg.org/ - Zentrale Meldestelle in Europa
- http://www.echinococcus.de/ - Konsiliarlabor in Deutschland
- http://www.lwf.bayern.de/imperia/md/content/lwf-internet/veroeffentlichungen/lwf-akuell/39/lwf-aktuell_39-14.pdf - Bayerische Landesanstalt für Wald und Forstwirtschaft
- http://www.uni-ulm.de/reisemedizin/
- http://de.groups.yahoo.com/group/Fuchsbandwurm-Selbsthilfeforum/ - Forum
- http://www.lfas.bayern.de/arbeitsmedizin/hinweise_betriebsaerzte/biolog_arbeitsstoffe/echinococcus/Echinokokkose.pdf - Bayerisches Landesamtes für Arbeitsschutz, Arbeitsmedizin und Sicherheitstechnik (LfAS)
- http://www.uni-ulm.de/echinokokkose/EchiDaten.html - Fallmeldungen in Deutschland
Echinococcus granulosus (Hundebandwurm)
[Bearbeiten]| Echinococcus granulosus | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||
|
Die durch den dreigliedrigen Hundebandwurm (Echinococcus granulosus) verursachte Erkrankung wird als zystische Echinokokkose bezeichnet. Für den Hundebandwurm sind Hund, Wolf und Dingo die definitiven Endwirte. Als Zwischenwirte fungieren besonders Schafe, aber auch Ziegen, Rinder, Schweine und Pferde oder gelegentlich der Mensch. Die Erkrankung ist nach dem Infektionsschutzgesetz in Deutschland meldepflichtig.
Verbreitung: Der weltweit mit verschiedenen regionalen Häufungen verbreitete Hundebandwurm kommt in Europa vor allem in Mittelmeerländern vor, in Deutschland ist er dagegen relativ selten. Die beobachteten importierten Erkrankungsfälle (Ausländer, deutsche Touristen) stammen überwiegend aus den südlichen Ländern des Mittelmeerraumes.
Übertragung: Die Übertragung des Hundebandwurms erfolgt meist per Kontaktinfektion bzw. Schmierinfektion vom Hundekot, dem Fell oder der Schnauze über die danach kontaminierten Hände mit dem Mund. Auch indirekte Ansteckungen sind zu Beispiel durch Nahrungsmittel oder Trinkwasser möglich, die mit Echinococcus-Eiern verunreinigt sind.
Krankheitsbild: Die Dauer der Inkubationszeit ist sehr unterschiedlich. Der Zeitraum kann sich über Monate bis Jahre erstrecken. Grundsätzlich kann jeder – Erwachsene wie Kinder - von der zystischen Echinokokkose betroffen sein, am häufigsten tritt sie aber zwischen dem dritten und dem fünften Lebensjahrzehnt auf.
Beim Hundebandwurm entwickeln sich die Finnen in einer flüssigkeitsgefüllten, ein- oder mehrkammerigen Blase. Der Organismus reagiert auf diesen Fremdkörper, indem eine Schicht aus Bindegewebe um ihn herum bildet, so dass er vor allem im Lebergewebe eine recht feste Bindegewebskapsel (Brutkapseln) entsteht.
Von der innen gelegenen Keimschicht ausgehend bilden sich nach etwa einem halben Jahr viele kleine Bläschen, welche die Vorstufen der fertigen Bandwürmer enthalten, die sich nach dem Schlüpfen frei in der Flüssigkeit bewegen. Diese Hydatiden haben einen Durchmesser von wenigen Millimetern bis zu 30 cm.
Die Erkrankung befällt vor allem Leber (50-70%), Lunge (15-30%) selten auch Milz, Nieren, Gehirn und andere Organe, wobei in aller Regel immer nur ein Organ betroffen ist.
Die Mortalitätsrate dieser Erkrankung liegt in Deutschland bei 2- % und in der Schweiz bei etwa 3 Prozent.
Symptome: Die Infektion mit dem Hundebandwurm verläuft meist lange Zeit asymptomatisch. Die Leberechinokokkose verursacht häufig erst bei einer sehr großer Zyste klinische Symptome durch Kompression von Blutgefäßen oder Gallenwegen. Bei Spannung der Leberkapsel können mehr oder minder starke Bauchschmerzen auftreten. Manchmal kommt es bei ausgedehntem Befall auch zu einem Ikterus.
Bei der Lungenechinokokkose ist ein Platzen (Ruptur) der in der dünnerwandigen Lungenzysten von Schmerzen, Husten und Atembeschwerden begleitet. Bei einem Befall des zentralen Nervensystems verursachen die Echinokokkosezysten in Abhängigkeit ihrer Lage im Hirn oder Rückenmark neurologische Herdsymptome.
Beim Platzen einer Zyste kann es zum allergischen Schock und metastatischen Streuung der Finnen kommen. In seltenen Fällen kann ein solches Ereignis aber auch eine Spontanheilung zur Folge haben.
Komplikationen: Gelegentlich können in der Leber Gewebezerstörungen und unstillbare Blutungen auftreten. Die Kompression der Portalvenen kann zum Aszites führen. Beim Absterben von Parasiten hinterlassen diese in der Regel Zerfallshöhlen, in die anschließend auch Einblutungen stattfinden können.
Diagnostik: Die Erkrankung kann mit bildgebenden Verfahren wie Sonographie, Röntgen und Computertomographie (CT) nachgewiesen und mit serologischen Methoden (IFT, PHA) gesichert werden. Eine serologische Unterscheidung von E. granulosus und E. multilocularis (Fuchsbandwurm) ist mittels ELISA möglich.
Differentialdiagnose: Zur eindeutigen Diagnose sollten andere raumfordernde Rundherde, wie z.B. bei Befall der Leber ein Amöbenabszeß, dysontogenetische Zysten, Tumore oder bakterielle Abszesse ausgeschlossen werden.
Therapie: Für eine sachgerechte und auf den individuellen Patienten zugeschnittene Behandlung der zystischen Echinokokkose bedarf es der interdisziplinären Zusammenarbeit zwischen Chirurgen, Radiologen, Gastroenterologen und Mikrobiologen.
Meist wird eine radikale operative Behandlung angestrebt, bei der peinlich darauf geachtet werden muß, die Finne unverletzt und in toto zu entfernen, damit es nicht während und nach der Operation zu einer Streuung bzw. zum anaphylaktischen Schock kommt. Für den Fall, dass der Parasit nicht vollständig entfernt werden kann oder der Patient inoperabel ist, bleibt nur noch die Langzeittherapie mit z.B. Mebendazol und Albendazol. Beim Hundebandwurm ist eine vollständige medikamentöse Abtötung des Erregers möglich.
Gut zugängliche Zysten des Hundebandwurms sollten unter prä- und postoperativer Chemotherapie vorsichtig entfernt werden. Die Leber wird dabei in mit 20%iger Kochsalzlösung getränkte Tücher eingewickelt. Gegebenenfalls kann die Zyste vor der chirurgischen Entfernung zur Sicherheit nach dem PAIR-Verfahren (puncture - aspiration - injection - reaspiration ) entleert und gespült werden.
Prognose: Die Prognose ist besser als bei der alveolären Echinokokkose.
Prophylaxe: Hunde und Katzen sollten regelmäßig entwurmt werden. Besonders angezeigt sind solche Vorbeugungsmaßnahmen, wenn besagte Haustiere auf Reisen in Mittelmeerländer mitgenommen oder solche von dort mitgebracht wurden.
Nematoden (Fadenwürmer)
[Bearbeiten]Enterobius vermicularis (Madenwurm)
[Bearbeiten]| Enterobius vermicularis | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||
|
Der Madenwurm (Enterobius vermicularis syn. Oxyuris vermicularis) ist ein parasitischer Fadenwurm, der weltweit, vor allem aber in den gemäßigten Klimazonen verbreitet ist. Die Art Vermicularis befällt Menschen, seltener Affen (in Tiergärten). 500 Millionen Infektionen sind weltweit pro Jahr zu verzeichnen, und zwar in sämtlichen Ländern und in allen sozialen Gruppen.
Etwa 50% aller Menschen wird mindestens einmal im Leben befallen. Der Wurmbefall selbst wird als Enterobiasis oder Oxyuriasis bezeichnet.
Morphologie und Eigenschaften: Die Würmer sind länglich und weiß. Die Weibchen werden bis zu 13mm lang, während die Männchen nur bis zu 3mm messen. Die Dicke ist unter 1mm. Das Weibchen ist aufgrund seiner Größe und seines spitzen Hinterendes vom Männchen unterscheidbar. Es kommen bis zu 3 Larvenstadien vor.

Lebenszyklus: Die Eier werden peroral aufgenommen. Schon nach 6 Stunden entwickeln sich die ersten Larven. Diese wandern vom Dünndarm (wo sie sich bis zu 3 mal häuten) zum bevorzugten Aufenthaltsort rund um das Zäkum. Die Weibchen wandern nachts Richtung After und legen ihre Eier an den Anusfalten ab (5.000 - 17.000). Über den fäkal-oralen Weg oder Schmierinfektion wird die Infektion weitergegeben. Anders als viele andere Darmparasiten dringt der Madenwurm nicht in den Blutkreislauf oder in extraintestinale Organe ein. Er hat auch keine Zwischenwirte.
Krankheitsbild: Meist kommt es zu einem symptomarmen Wurmbefall. Wenn die Weibchen die Eier ablegen, kann es zu starkem Juckreiz im Analbereich und damit zu Schlafstörungenen kommen. Kratzen aufgrund des Juckreizes kann zu Hautabschürfungen (Exkoreationen) führen; diese können sich (als Superinfektion) sekundär bakteriell infizieren. Ein massiver Befall kann zu Bauchschmerzen und Gewichtsabnahme, Übelkeit oder Symptomen einer chronischen Blinddarmreizung führen. Selten wird bei Mädchen/Frauen der Genitaltrakt befallen (Vulvovaginitis).

Diagnostik: Zur Diagnostik wird mithilfe eines durchsichtigen Klebestreifens ein Abdruck der Analregion gemacht. Die Klebeseite nimmt die abgelegten Eier auf. Unter dem Mikroskop können bei schwacher Vergrößerung die Eier aufgrund ihrer charakteristischen Form erkannt werden: einseitig abgeflacht, oval, mit einer Größe von 25 x 55 µm. Da Madenwurmeier auf der Haut der Perianalregion abgesetzt werden, ist die Untersuchung einer Stuhlprobe nicht sinnvoll!
Therapie: Dem noch mangelhaft ausgebildeten Hygieneverhalten von Kindern entsprechend kann sich ein Madenwurmbefall auf ganze Schulklassen oder Familien ausdehnen. Deshalb ist es auch von entscheidender Bedeutung, zumindest alle Familienmitglieder einer betroffenen Person auch bei Beschwerdefreiheit und fehlendem Wurm(eier)nachweis (am besten mit Mebendazol oder Pyrantelpamoat als gewichtsabhängige Einmalgabe) zu behandeln.
Literatur und Weblinks:
- http://www.aok.de/bund/tools/medicity/diagnose.php?icd=823
- http://www.kiel.de/Aemter_30_bis_52/50/Infektionsschutz_Umwelthygiene/download/Infoblatt_Oxyuriose.pdf - Gesundheitsamt Kiel
Trichuris trichiura (Peitschenwurm)
[Bearbeiten]| Trichuris trichiura | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||||
|
Verbreitung: Der Peitschenwurm (Trichuris trichiura) ist weltweit verbreitet, jedoch am häufigsten in den Tropen und Subtropen anzutreffen. Es sind rund 750 Millionen Menschen weltweit infiziert.

Morphologie und Eigenschaften: Der Wurm wird bis zu 50mm lang, wobei das fadenförmige Vorderende fast zwei Drittel der Gesamtlänge des Wurmes einnimmt. Daran anschließend ist das Hinterende mit Darm und Geschlechtsorganen, welches ein stark verdicktes Aussehen hat. Dadurch sieht der Wurm peitschenähnlich aus.
Lebenszyklus: Der adulte Wurm setzt sich im Übergangsbereich zwischen Dünn- und Dickdarm fest, wo er vom Inhalt der Darmschleimhautzellen lebt, dessen Wände er auflöst. Die Eier gelangen mit den Fäces ins Freie. Es dauert 3 bis 4 Monate bis sie reif und infektiös sind. Infiziert man sich, so schlüpft im Körper eine Larve die sich im selben Areal wie der adulte Wurm festsetzt und sich mehrmals häutet.

Krankheitsbild: Bei starkem Befall mit über 100 Würmern führt die Trichuriasis zu Diarrhoe, Blutungen und selten zu einem Darmvorfall.
Therapie: mit Mebendazol oder Albendazol.
Prophylaxe: Hygiene. Vermeidung der Kopfdüngung von Gemüsen, wie Salat.
Forschung: Bei bestimmten Autoimmun-Krankheiten werden positive Wirkungen der Eier des Peitschenwurms vermutet. Gegenwärtig laufen Studien mit Einnahme der Eier des Peitschenwurms (Trichuris suis ova) u.a. an der Charité. Bei Entwurmungskuren in Südamerika war nach erfolgreicher Behandlung ein starker Anstieg von allergischen Reaktionen beobachtet worden, woraus eine das Immunsystem dämpfende Eigenschaft der Peitschenwurm-Eier geschlussfolgert wurde, waraus ein Ansatz für klinische Phase II-Studien entwickelt wurde.
Ascaris lumbricoides (Spulwurm)
[Bearbeiten]| Ascaris lumbricoides | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||||
|
Verbreitung: Die erste Erwähnung des Spulwurms (Ascaris lumbricoides) findet sich im Papyrus Ebers, das um 1540 v.Chr. verfasst wurde. Damit ist er einer der am längsten bekannten Fadenwürmer, die als Parasiten bei Mensch und Tier auftreten. Er ist weltweit verbreitet und an genügend Bodenfeuchtigkeit gebunden. Durch seine sehr widerstandsfähigen Eier, die bis zu vier Jahre infektiös bleiben und auch von den meisten Chemikalien nicht abgetötet werden, kann er sich lange in bestimmten Gebieten halten. Es sind etwa 22% der Weltbevölkerung infiziert.
Morphologie und Eigenschaften: Die bis zu 35cm (Männchen messen bis zu 30cm) großen Würmer haben ein rosafarbenes, regenwurmartiges Aussehen, daher auch der lateinische Name lumbricoides von Lumbricidae (Familie der Regenwürmer). Ihre Mundöffnung ist dreilippig und mit bloßem Auge kann man die Ausscheidungskanäle als weiße Linien wahrnehmen. Die Männchen unterscheiden sich von den Weibchen durch ihr meist eingerolltes Schwanzende und durch die herausragenden Spicula.
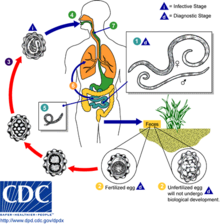
Lebenszyklus: Die von erwachsenen Weibchen im Darm abgelegten Eier gelangen mit dem Kot in die Umwelt. Dort findet noch im Ei bei ausreichender Feuchtigkeit und Temperaturen von 8 bis 35°C innerhalb von 12 Tagen (unter Laborbedingungen, im Freien wesentlich länger) die Entwicklung über ein Larvenstadium hin zur zweiten Larve statt. Diese wird vom Menschen oder Tier aufgenommen und schlüpft im Dünndarm. Von hier aus bohrt sie sich durch die Darmwand und wandert über den Blutstrom zur Leber, wo sie sich wieder häutet und eine dritte Larve heranwächst. Diese gelangt nun zum Herzen und über den Lungenkreislauf in die Alveolen, dort häutet sie sich abermals und wird zur vierten Larve, welche nun über die Bronchien und Luftröhre zum Kehlkopf wandert. Von dort aus wird sie entweder abgehustet oder geschluckt. Die Dauer dieser Phase beträgt 30 bis 35 Tage. Nun kehrt die Larve wieder zum Dünndarm zurück, wo sie zum erwachsenen Tier auswächst. Die Weibchen legen am Tag bis zu 200.000 Eier. Im Eierstock selbst sind bis zu 27 Millionen Eier angelegt. Die Lebensdauer des Parasiten beträgt bis zu eineinhalb Jahren.
Bei Haustieren besteht daneben die Möglichkeit einer somatischen Wanderung. Die Larven des 2. Stadiums können hierbei aus dem Bereich der Bronchien in den Blutkreislauf übertreten oder direkt die Pleurahöhle besiedeln. Die hämatogen verschleppten Larven können sämtliche Organe des befallenen Tieres befallen, werden dort eingekapselt und bleiben über mehrere Jahre infektiös. Bei einer eventuell auftretenden Trächtigkeit des Tieres bilden diese Larvenstadien die Hauptquelle für die noch im Uterus erfolgende Infektion des Fötus.
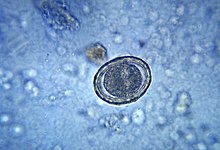
Krankheitsbild: Die Larven erzeugen gelegentlich allergische Reaktionen. Bei der Lungendurchwanderung kommt es zur Ascaris-Pneumonie mit Husten, Fieber, starker Verschleimung und asthmaähnlichen Anfällen. Im Gastrointestinaltrakt rufen sie Koliken und Erbrechen hervor, wobei die adulten Würmer die Bauchspeicheldrüsengänge, den Darm oder die Gallengänge obliterieren können. Teilweise kommt es zur Maldigestion, speziell der Laktose. Bei Sensibilisierung kommt es zu heftigen allergischen Reaktionen.
Diagnostik: Die Diagnose des Spulwurmbefalls erfolgt am effektivsten durch eine Stuhluntersuchung mittels des Flotationsverfahrens. Hierbei werden die dickschaligen, 70 bis 80µm großen Eier nachgewiesen. Weiterhin ist der serologische Nachweis einer larvalen Spulwurminfektion mittels ELISA möglich.
Therapie: Entwurmung mit Mebendazol. Alterrnativen sind Pyrantel oder Albendazol.
Prophylaxe: Eine sehr effektive Maßnahme besteht im konsequenten Händewaschen vor jeder Nahrungsaufnahme. Der Verzehr kopfgedüngter Gemüse sollte vermieden, Fäkalien unter hygienischen Gesichtspunkten beseitigt werden. In der Familie gehaltene Kleintiere bedürfen einer regelmäßigen (vierteljährliche) Entwurmung.
Trichinella spp.
[Bearbeiten]| Trichinella spp. | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||||||||||||
|
Trichinen (Trichinella) sind eine Gattung der Fadenwürmer (Stamm Nematoda) mit parasitischer Lebensweise. Säugetiere, Vögel und Menschen dienen als Zwischen- und Endwirt. Hauptüberträger für den Menschen sind Hausschweine bzw. deren rohes Fleisch (Mett). Bei Befall spricht man von Trichinose, wobei der Mensch ein Fehlwirt darstellt. Durch Trichinen verursachte Erkrankungen beim Menschen sind meldepflichtig.
Verbreitung: Die Trichine ist durch mehrere Arten weltweit verbreitet. Vor Einführung des "Reichsfleischbeschaugesetzes" unter der Federführung von Rudolf Virchow um 1900 gab es in Deutschland nach Schätzungen etwa 15.000 Erkrankungen jährlich. Durch die Fleischbeschau sank diese Zahl in 50 Jahren auf nahezu Null. Zuletzt im Dezember 1998 wurden rund 50 Erkrankungen in Nordrhein-Westfalen beschrieben, die sich auf den Verzehr von rohen Schweinefleischwaren zurückführen ließen.
In den westlichen Ländern tritt die Trichine vorwiegend im "silvatischen Zyklus" auf, bei dem Füchse und Nager die Würmer verbreiten. In nördlicheren Gebieten kann dies durch Bären, Schlittenhunde und Robben geschehen. Ein "urbaner Zyklus" ist ebenfalls vorhanden, dieser geschieht vor allem über Ratten und Schweine. Zu menschlichen Infektionen kommt es vor allem in Ländern ohne Fleischbeschau. Vereinzelte Infektionen in Deutschland werden durch individuell gezogene Schweine verursacht, die keiner Fleischbeschau unterzogen werden. Allerdings ist es im Frühjahr 2006 auch nach dem Verzehr von Schweinen aus nicht individueller Haltung im Kreis Uecker-Randow zu einer Erkrankung von 2 Personen trotz der von der EU vorgeschriebenen, modernen Fleischbeschaumethode (Verdauungsmethode) gekommen. Zur Infektion kann es außerdem durch den Genuss von nicht ausreichend erhitztem Perlfleisch kommen.
Morphologie und Eigenschaften: Die adulten Tiere erreichen eine Länge von 1,5mm, deutlich kann man das verdickte Hinterende erkennen, das den Darm beherbergt. Die Larven kapseln sich im Muskelgewebe ein und bilden dort einen "Ammenzellnährkomplex", eine Kapsel, die reichlich mit Blutgefäßen versorgt wird und dadurch die Larve am Leben erhält. Sie erreicht eine Größe von rund 1mm und ist dann infektiös.
Lebenszyklus von Trichinella spiralis: Bei Trichinen dient zunächst jeder Wirt als Zwischenwirt, da die Larven zuerst im Darm zu Würmern heranreifen. Mit dem infizierten Fleisch werden die eingekapselten Larven aufgenommen, die Kapseln im Dünndarm aufgelöst und die Larven somit freigesetzt. Die Würmer bohren sich in das Dünndarmepithel ein und entwickeln sich innerhalb von 30 Stunden zum adulten Tier, danach findet eine Paarung statt. Dort angesiedelt bringen die Weibchen lebendgebärend bis zu 1.500 Larven zur Welt. Die Larven bohren sich nun durch den Dünndarm und erreichen so die Lymphe oder den Blutstrom. Sie treiben durch den Kreislauf und lassen sich vor allem im quergestreiften Muskelgewebe nieder. Bevorzugt werden hierbei Zwerchfell, Augen, Zunge und Extremitäten besiedelt. Nun beginnt die Bildung des erwähnten Ammenzellnährkomplexes. Diese Kapsel bleibt infektiös, solange der Parasit lebt. Ab dem fünften Monat findet im menschlichen Gewebe jedoch eine Verkalkung statt, die zum Absterben der Ammenzelle und der Larve führt.



Krankheitsbild: Die von Trichinen beim Menschen hervorgerufene, meldepflichtige Erkrankung wird als Trichinellose bezeichnet. Bei einer Inkubationszeit von 8 bis 15 Tagen entwickeln sich aus den zunächst im Dünndarm befindlichen Larven adulte Würmer, die sich später im Muskelgewebe einnisten und sich dort verkapseln. Dabei treten neben oft asymptomatischen Krankheitsverläufen auch allgemeine Schwäche, Bauchschmerzen, Übelkeit, Erbrechen und Durchfall auf, nach 1 bis 3 Wochen dann Fieber, Muskelschmerzen und Ödeme im Augenbereich. Diese Symptome halten meist bis zu einem Jahr an und verschwinden danach ohne bleibende Folgen. Wenn als Komplikation der Herzmuskel befallen wird, kann diese Wurminfektion sogar tödlich enden.
Prophylaxe: Wichtigste vorbeugende Maßnahme ist die gesetzlich vorgeschriebene Trichinenschau, bei der die Kapseln der Larven gezielt erkannt werden. Man kann eine Abtötung der Larven mit Kochen erreichen, dabei muss das Fleisch mindestens 65°C erreichen, des Weiteren gilt das Gefrieren als Abtötungsmaßnahme. Jedoch kann die im hohen Norden verbreitete Art T. nativa selbst tiefen Temperaturen lange widerstehen. Räuchern, Pökeln, Salzen und Trocknen sind laut Angaben des Robert-Koch-Instituts keine ausreichend wirksamen Maßnahmen zur Larvenabtötung. Vorsicht ist bei Import von Fleisch aus dem Nicht-EU-Ausland geboten, da in manchen Ländern bei Wild, Haus- und Einzelschlachtungen keine obligatorische Fleischbeschau stattfindet. Gegebenenfalls ist eine Beschau durch das Veterinäramt bei der jeweiligen Verwaltungsbehörde nachzuholen und auch zu empfehlen.
In letzter Zeit sind bei Wildschweinen jedoch eine weitere Form von Trichinen (Trichinella pseudospiralis) aufgetaucht. Diese ist durch herkömmliche Vorbeugemaßnahmen nicht zu erkennen. Sie sind im Gegensatz zu den gewöhnlichen Trichinen im Larvenstadium nicht eingekapselt und deshalb bei der Fleischbeschau, die sich auf das Aufspüren eben dieser Kapseln stützt, nicht zu erkennen.[1]
Historie: Der Verursacher der Trichinose ist seit 1835 bekannt, doch blieb der Übertragungsweg unklar. Erst 1846 wies der bedeutende amerikanische Wissenschaftler Joseph Leidy, der sowohl als der Begründer der amerikanischen Parasitologie wie auch der amerikanischen Wirbeltierpaläontolgie gilt, zweifelsfrei nach, dass der Parasit über den Verzehr von nicht ausreichend gegartem Fleisch aufgenommen wird. Doch erst zwei Jahrzehnte später wurde seine Erkenntnisse von der Forschung allgemein akzeptiert.
Literatur und Weblinks:
Filarien
[Bearbeiten]| Filarioidea | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||||||||
|
In der Überfamilie Filarioidea, zu deutsch Filarien (lat. filum, "Faden") sind Fadenwürmer der Familien Filariidae und Onchocercidae zusammengenommen. Diese kommen in tropischen Regionen vor. Einige Spezies sind als Erreger von Parasitosen beim Menschen oder bei Haustieren bedeutsam.
Morphologie und Eigenschaften: Filarien sind fadenförmige Würmer, deren Körperlänge je nach Art zwischen 2 und 50cm schwankt. Die Larvenstadien, die als Mikrofilarien bezeichnet werden, sind kleiner als ein Millimeter.
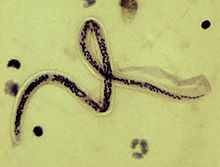
Lebenszyklus: Die Entwicklung der Mikrofilarien zur infektiösen Larve geschieht über zwei Häutungen im Zwischenwirt, einer jeweils spezifischen, blutsaugenden Mücken- oder Bremsenart. Nach der Übertragung auf den Endwirt (u.a. Mensch) wandern diese zur endgültigen Lokalisation und werden nach zwei weiteren Häutungen zur sog. Adultfilarie. Die Mikrofilarien werden von den Weibchen lebend geboren oder als embryonierte Eier abgesetzt. Sie erscheinen in der Haut oder im Blut, von wo sie wiederum bei der nächsten Blutmahlzeit zum Zwischenwirt übertragen werden.
Humanpathogene Filarien:
- Brugia malayi - Überträger: Stechmücken (Culiciden)
- Loa loa - Überträger: Bremsen (Tabanidae)
- Mansonella spp.
- Onchocerca volvulus - Überträger: Gnitzen (Culicoides parensis)
- Wuchereria bancrofti - Überträger: Stechmücken (Culiciden)
Therapie: Die Behandlung erfolgt mit Diethylcarbamazin, alternativ mit Ivermectin oder Albendazol.
Brugia malayi
[Bearbeiten]
Brugia malayi ist ein tropischer Fadenwurm aus der Gruppe der Filarien (Familie Filariidae). Er parasitiert beim Menschen und kann das Krankheitsbild der Elephantiasis verursachen. Etwa 6 Millionen Menschen gelten als infiziert.

Verbreitung: Brugia malayi kommt in Ost- und Südasien vor. Reservoir sind neben dem Mensch auch Katzen, Hunde und Affen.
Morphologie und Eigenschaften: Die erwachsenen Würmer sind fadenförmig und werden 2,5cm (m) bzw. 6cm (w) lang.
Lebenzyklus Die Übertragung erfolgt durch Mücken der Arten Aedes, Culex, Anopheles und Mansonia. Die Entwicklung infektiöser Larven in den Mücken erfordert hohe Temperaturen und Luftfeuchtigkeit. Nach Infektion siedeln sich die Filarien in Lymphbahnen an. Die Adultwürmer setzen nach etwa 3 Monaten Mikrofilarien ab. Dies geschieht in den Nachtstunden, zwischen 22 und 2 Uhr sind die Mikrofilarien im Blut nachweisbar. Über Aufnahme der Mikrofilarien durch einen erneuten Mückenstich schließt sich der Kreis. Die erwachsenen Würmer können einige Jahre leben.
Krankheitsbild: Elephantiasis
Loa loa
[Bearbeiten]
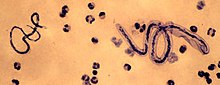
Loa loa (Familie Onchocercidae), auch als Wanderfilarie oder Augenwurm bekannt, ist ein tropischer Fadenwurm, der beim Menschen im Unterhautfettgewebe, gelegentlich auch im Auge parasitiert und das Krankheitsbild Loiasis hervorruft.
Verbreitung: Das Vorkommen ist auf West- und Zentralafrika beschränkt, vor allem auf die beiden Kongos, Gabun, Tschad, den Sudan, die Zentralafrikanische Republik, Kamerun, Nigeria und Nord-Angola.
Morphologie: Das Weibchen wird etwa 50 bis 70mm, das Männchen 30mm lang.
Lebenszyklus: Zwischenwirte sind Bremsen der Arten Chrysops dimitiata und Chrysops silacea. Beim Stich (nur die weiblichen Bremsen saugen Blut) gelangen die Filarien in die Haut. Die Entwicklung zum ausgewachsenen Wurm dauert mehrere Jahre.
Krankheitsbild: Loa loa ruft die Loiasis (auch Loaose, Kamerunbeule oder Calabar-Schwellung) hervor. Die Übertragung erfolgt durch Bremsen. Lange nach der ursprünglichen Infektion, oft Jahre später, kommt es zu allergisch verursachten Schwellungen der Haut, die einen Durchmesser von 10cm erreichen können und starken Juckreiz entwickeln. Nach einigen Tagen klingt die Schwellung ab und tritt typischerweise an anderer Stelle wieder auf. Das rührt daher, dass der Wurm in der Haut nicht eingekapselt wird, sondern umherwandert (daher auch Wanderfilarie). In eher seltenen Fällen kriecht er auch unter der Bindehaut über den Augapfel und wird dann sichtbar. Die Erkrankung ist in der Regel nicht gefährlich, aber sehr unangenehm und kann wegen der langen Lebensdauer der Würmer von bis über zehn Jahren ein chronisches Problem darstellen. Spätkomplikationen können Herzklappen- und Nierenschäden sowie Meningitiden sein.
Therapie: Die medikamentöse Behandlung erfolgt mit Diethylcarbamazin.
Wuchereria bancrofti
[Bearbeiten]
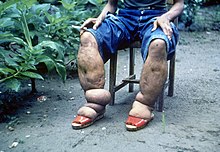
Wuchereria bancrofti ist ein Vertreter der Fadenwürmer, der parasitisch in den Lymphgefäßen des Menschen lebt. Seinen Namen erhielt das Tier von dem portugiesisch-brasilianischen Arzt Otto Wucherer.
Verbreitung: Wuchereria bancrofti ist hauptsächlich in China, Amerika, Asien, Afrika und im Pazifik verbreitet. Die Filarien kommen dort in den tropischen Regionen vor.
Morphologie: Das Weibchen erreicht eine Länge von bis zu 10cm bei einer Dicke von nur bis zu 0,3 Millimeter.
Lebenszyklus: Übertragen werden die Würmer durch Mücken, vor allem die Stechmücken der Gattungen Culex, Anopheles und Aedes. Die Larven werden in die Stichwunde der Tiere eingespritzt oder wandern aktiv in die Wunde und werden dann meist passiv in die Kapillaren der Lymphgefäße gespült. Die ausgewachsenen Würmer können mehrere Jahre im Lymphsystem leben und produzieren in dieser Zeit Unmengen neuer Wurmlarven.
Krankheitsbild: Filariosen, bekannt als Elephantiasis tropica. Dabei handelt es sich um Schwellungen, die durch Lymphgefäßobstruktion in peripheren Lymphgefäßen entstehen, hervorgerufen durch sich entwickelnde Larven in den Gefäßen. Sichtbares Zeichen dieser Krankheit sind extreme Wucherungen des Bindegewebes in den Armen und Beinen, an den Genitalien und den Brüsten. Akute Symptome treten erst bis zu 16 Monate nach der Infektion auf, diese dauern jedoch Tage bis Wochen lang an.
Mansonella spp.
[Bearbeiten] |
 |
 |
Onchocerca volvulus
[Bearbeiten] |
Quellen
[Bearbeiten]

