Natur und Technik für den Pflichtschulabschluss: Chemische Bindungen
Chemische Reaktionen
[Bearbeiten]Chemische und biochemische Reaktion
[Bearbeiten]
H2CO3 → H2O + CO2
Chemie ist ein Bereich der Wissenschaft, der sich mit sogenannten chemischen Reaktionen beschäftigt. Eine chemische Reaktion ist ein Vorgang, während dem ein oder mehrere Teilchen (Moleküle oder Atome) reagieren und sich in andere Teilchen verwandeln (die aus den selben Atomen wie am Anfang allerdings in anderen Kombinationen bestehen). In diesem Prozess kann Energie freigegeben oder verbraucht werden. In physikalischen Prozessen hingegen ändern sich die Moleküle nicht.
Ein Beispiel eines physikalischen Prozesses ist eine Aggregatzustandsänderung. Eis oder Schnee schmilzt zum flüssigen Wasser. In diesem Vorgang ändert sich sowohl die Farbe (Schnee ist weiß, flüssiges Wasser durchsichtig) als auch der Aggregatzustand (am Anfang fest, dann flüssig). Das Molekül aber ändert sich nicht. In allen Fällen haben wir Wassermoleküle (H2O).
Nehmen wir das Beispiel eines gespritzten Getränks. In diesem gibt es Kohlensäure (H2CO3). Schüttelt man das Getränk ein bisschen, dann entstehen im Getränk Luftblasen. Diese beinhalten Kohlenstoffdioxid CO2. Durch das Schütteln findet folgende chemische Reaktion statt:
H2CO3 → H2O + CO2
Bei diesem Vorgang ändern sich sowohl der Aggregatzustand (H2CO3 besteht nur in im Wasser gelöster flüssiger Form; CO2 ist ein Gas; H2O ist auch flüssig) als auch die Moleküle. Wir haben nicht mehr den gleichen Stoff. Links haben wir Kohlensäure, rechts Wasser und Kohlenstoffdioxid. Es geht daher um eine chemische Reaktion und nicht um einen physikalischen Vorgang.
Bei der Reaktion können wir beobachten: Die Moleküle ändern sich, die Atome aber bleiben gleich. Links haben wir 2 Wasserstoffatome, ein Kohlenstoffatom und drei Sauerstoffatome. Genau das gleiche gilt auch für die rechte Seite der Reaktion. Hier ist also noch einmal die Definition einer chemischen Reaktion:
Eine chemische Reaktion ist ein Vorgang, bei dem ein oder mehrere Moleküle reagieren und sich in andere Moleküle verwandeln. Die teilnehmenden Atome bleiben vor und nach der Reaktion gleich. Nur ihre Kombination ändert sich.
Die Definition einer biochemischen Reaktion ist dann leicht. Die Vorsilbe „bio“ kommt aus dem griechischen Wort „βίος“, was das Leben bedeutet.
Eine biochemische Reaktion ist eine chemische Reaktion, die in der Natur vor allem oder nur in einem lebendigen Wesen stattfindet.
Die wichtigsten Elemente für die biochemischen Reaktionen sind Kohlenstoff C, Wasserstoff H, Sauerstoff O und Stickstoff N. Viele Moleküle in lebendigen Organismen bestehen fast ausschließlich aus diesen Elementen. Die Reaktion mit der Kohlensäure, die wir gerade gesehen haben, ist keine biochemische Reaktion. Sie findet ganz leicht auch außerhalb eines lebendigen Organismus statt. Die Reaktion von ADP zu ATP und umgekehrt kann man zwar in einem Labor außerhalb eines lebendigen Organismus durchführen, findet aber in der Natur fast ausschließlich in Organismen statt [1]. Die ist daher ein biochemische Reaktion.
Das wichtigste Molekül für alle Organismen, das Wassermolekül, entsteht dennoch nicht durch eine biochemische Reaktion. Es ist wichtig, weil Organismen vorwiegend aus Wasser bestehen[2], aber auch weil fast alle biochemischen Reaktionen das Wasser brauchen, um überhaupt stattfinden zu können.
Photosynthese
[Bearbeiten]
Die Photosynthese ist eine biochemische Reaktion, die in den Chloroplasten[3] in den pflanzlichen Zellen stattfindet. In dieser reagiert Kohlenstoffdioxid aus der Luft mit Wasser aus dem Boden und dadurch entsteht Zucker und Sauerstoff, der in die Luft freigesetzt wird. Für die Reaktion ist die Energie des Sonnenlichts notwendig. Diese Energie wird in den Zuckermoleküle gespeichert und später von allen Organismen zusammen mit dem Sauerstoff als Energiequelle benutzt. Die Formel dieser biochemischen Reaktion lautet:
CO2 + H2O → <CH2O> + O2
Chemische Bindungen
[Bearbeiten]Elemente reagieren in gewissen einfachen Mengenverhältnissen miteinander. Die Forscher haben dazu entdeckt, dass in der Regel die Elemente in der Natur nicht als einzelne Atome vorkommen, sondern in der Form von Verbindungen. Wasserstoff und Sauerstoff beispielsweise kommen in der Luft als Moleküle von jeweils zwei Atome vor (H2 und O2). Zwei Atome Wasserstoff verbinden sich mit einem Atom Sauerstoff und bilden dadurch das Molekül des Wassers (H2O). Solche Moleküle sind stabil im Gegensatz zu den einzelnen Atomen, die sofort eine Bindung machen, wenn sie sich allein befinden. Es gibt allerdings verschiedene Arten von Bindungen: die Ionenbindung, die kovalente Bindung und die Metallbindung. Die Eigenschaften der Verbindungen können sehr unterschiedlich von den Eigenschaften der Teilelemente sein. Wasserstoff und Sauerstoff beispielsweise sind beide Gase, ihre Verbindung aber (Wasser) ist doch flüssig.
Im Gegensatz zu den anderen Elementen sind die Atome der Edelgase stabil. Daher treten Edelgase in der Natur als Einzelatome auf und formen kaum Verbindungen.
Ionenbindung
[Bearbeiten]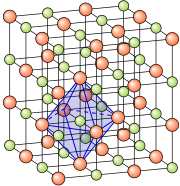
Typische Vertreter dieser Bindungsart sind die Salze. In so einer Bindung verbinden sich in der Regel ein Metall mit einem Nichtmetall. Sie bilden zusammen kein Molekül sondern ein sogenanntes Ionengitter. In einem Gitter befinden sich mehrere Atome von unterschiedlichen Elementen. Sie sind abwechselnd in allen drei Richtungen eingeordnet. Die Atome des Metalls verlieren ein bis drei Elektronen und werden dadurch positiv geladene Atome (Kationen). Diese Elektronen werden von den Atomen des Nichtmetalls aufgenommen, diese Atome werden dadurch negativ geladene Atome (Anionen). Da in dieser Bindungsart Ionen entstehen, wird sie Ionenbindung genannt.
Chlor beispielsweise formt zusammen mit Natrium das uns bekannte Kochsalz (NaCl), das ist eine Ionenbindung. In dieser Bindung nimmt jedes Chloratom ein Elektron und wird zu einem Anion (Cl−). Natrium verliert sein einziges äußeres Elektron und wird zum Kation (Na+). Schauen wir den ganzen Prozess Schritt zum Schritt an:
-
Natrium hat nur ein Elektron an der äußersten Schale (rot ganz oben)
-
Chlor hingegen sieben.
-
Natrium verliert sein Elektron und wird dadurch positiv geladen (Na+).
-
Chlor nimmt dieses Elektron auf und wird dadurch negativ (Cl−)
-
Das passiert mit vielen Atomen. Am Ende entsteht ein Kristallgitter.
Unterschiedlich geladene Ionen (positive Natrium-Ionen und negative Chlor-Ionen) ziehen sich an und formen daher ein Kristallgitter.
Kovalente Bindung
[Bearbeiten]
Eine kovalente Bindung ist typisch zwischen Nichtmetallen. Wie schon erwähnt, sind die Atome der meisten Nichtmetalle instabil. Chlor, ein Nichtmetall, formt zusammen mit Natrium, ein Metall, den Kochsalz (NaCl), der ein löslicher fester Körper ist, eine Ionenbindung. Chlor allein dennoch befindet sich in der Natur in der Form eines Gases. Dieses Gas besteht aus zwei Chloratomen (Cl2). In diesem Fall gibt es eine Bindung zwischen nur zwei Atome und nicht zwischen mehrere Atome, die ein Gitter bilden, wie in der Ionenbindung. Die kovalente Bindung von Chlor ist deshalb stabil, weil jedes Chloratom dem anderen ein Elektron „leiht“. Dadurch entsteht ein Elektronenpaar, das beiden Atomen gehört.
Diese Idee der Elektronenpaare ist zwar ungenau, hilft aber bei der Darstellung der Bindungen. Elemente, die zur Gruppe VIIA des Periodensystems gehören, „brauchen“ ein Elektron, um stabil zu werden, der Gruppe VIA zwei Elektronen, der Gruppe VA drei Elektronen. Elemente der Gruppe IA des Periodensystems müssen ein Elektron „geben“, um stabil zu sein, der Gruppe IIA zwei Elektronen, der Gruppe IIIA drei Elektronen. Wenn sich ein Metall der Gruppe IIA mit einem Nichtmetall der Gruppe VIIA verbindet, ist das Verhältnis eins zu zwei. Es gilt sozusagen eine Acht-Regel. Was bedeutet das?
Wieder gibt es eine Darstellung dafür, die zwar ungenau aber verständlicher ist. Die Elektronen in den Atomen sind in sogenannten Schalen eingeordnet. Die äußerste Schale kann acht Elektronen aufnehmen (Ausnahme: Wasserstoff und Helium, da sind 2 Elektronen möglich). Wenn ein Atom 7 Elektronen in seiner äußersten Schale hat, dann braucht es ein Elektron, um stabil zu werden. Wenn ein Atom 1 Elektron in seiner äußersten Schale hat, dann muss es ein Elektron abgeben. Diese Vorstellung funktioniert zwar bei der Ionenbindung einfacher, bei der kovalenten aber nicht so ganz (und bei der Metallbindung erst gar nicht). Sie ist aber auch bei der kovalenten Bindung hilfreich. Die Idee dieser Darstellung, ist durch zahlreichen Beobachtungen in der Natur und Experimente entstanden.
Nehmen wir Chlor als Beispiel. Chlor gehört dem VIIA Gruppe, hat also 7 Elektronen in der äußersten Schale[4]. Wenn Chlor sein Molekül (Cl2) bildet, kann man sich vorstellen, dass jedes Chloratom ein Elektron „ausleiht“. Das entstehende Elektronenpaar teilen beide Atome untereinander. Dadurch hat jedes Atom quasi 8 Elektronen in der äußersten Schale. Für die Darstellung allerdings werden andere Symbole benutzt: ![]() . Der Strich zwischen den beiden Chloratome bedeutet in dieser Darstellung, dass sie ein Elektronenpaar teilen.
. Der Strich zwischen den beiden Chloratome bedeutet in dieser Darstellung, dass sie ein Elektronenpaar teilen.
Nehmen wir jetzt Sauerstoff als Beispiel. Sauerstoff gehört dem VIA Gruppe, hat also 6 Elektronen an der äußersten Schale. Der Sauerstoffmolekül, den wir atmen, besteht aus zwei Sauerstoffatomen. Jedes Atom „leiht“ zwei seine Elektronen. Dadurch entstehen zwei Elektronenpaare, die von beiden Atomen „geteilt“ werden. Somit hat jedes Atom 8 Elektronen an der äußersten Schale und wird dadurch stabil: ![]() . Jeder Strich zwischen den Atomen steht für ein Elektronenpaar. Die Atome teilen daher zwei Elektronenpaare.
. Jeder Strich zwischen den Atomen steht für ein Elektronenpaar. Die Atome teilen daher zwei Elektronenpaare.
Im Wassermolekül mit einem Sauerstoffatom und zwei Wasserstoffatome „leiht“ das Sauerstoffatom jedem Wasserstoffatom ein Elektron und jedes Wasserstoffatom sein einziges Elektron. Dadurch entstehen zwei Elektronenpaare und die äußersten Schalen von allen drei Atomen sind „ausgefüllt“. Hier muss erinnert werden, dass Wasserstoff (und Helium) ausnahmsweise zwei Elektronen an seiner äußersten (und einzige) Schale haben kann.
 |
 |
Sauerstoff allerdings gibt es auch in der Form von Ozon. Ozon besteht aus drei Sauerstoffatomen. Jedes Atom könnte den anderen zwei jeweils ein Elektron „ausleihen“. Dadurch würde ein dreieckiges Molekül entstehen („zyklisches Ozon“). Dieses ist allerdings ein vereinfachtes Bild. Zyklisches Ozon existiert kaum, vielleicht sogar nur theoretisch. Die Gesetze, die die Bildung von Verbindungen zwischen Atomen beschreiben, sind komplizierter. In der Tat hat Ozon die Form eines sogenannten „Dipols“.
Metallbindung
[Bearbeiten]
Eine Metallbindung entsteht, wenn einige Metallatome in Verbindung sind. Diese Art Bindung kann nicht mit dem Schalenmodell erklärt werden. In diesem Fall soll man sich vorstellen, dass mehrere Atome verbunden sind und mancher ihre äußeren Elektronen einer gemeinsamen „Elektronenwolke“ „ausleihen“, die dann allen Atomen gehört. Die Elektronen der „Wolke“ können sich quasi „frei“ bewegen (nicht aber ganz frei).
Den elektrischen Strom haben wir als Bewegung einer elektrischen Ladung definiert. In einem Metallkabel bewegen sich die sozusagen „freie“ Elektronen der „Elektronenwolke“. Allerdings wird diese Bewegung beispielsweise von den Kernen der Metallatome „verhindert“. Dadurch entsteht im Kabel elektrischer Widerstand. Das passt zur Definition des Widerstands: elektrischer Widerstand ist alles, was gegen die Bewegung der elektrischen Ladungen wirkt.
Es muss nochmal betont werden. Diese Beschreibungen der Atombindungen sind nur Modelle. Wie die Bindungen tatsächlich funktionieren, wird nach der heute geltenden Theorie beschrieben, nämlich der Quantenmechanik. Diese allerdings ist eine sehr abstrakte mathematische Theorie, die nicht vorstellbar ist. Man kann kein Atom „sehen“ und letztendlich auch nicht „vorstellen“, da in dieser Theorie von Wahrscheinlichkeitswellen gesprochen wird, was ein sehr abstrakter Konzept ist. Man braucht allerdings Bilder, um irgendwie eine Ahnung zu haben, wie das Ganze funktioniert. Nur in diesem Sinn kann man von „Elektronenpaaren“, „Ionenkristallen“ oder „Elektronenwolken“ sprechen.
- ↑ ADP und ATP sind sogenannte Nucleotide, also Moleküle die für den DNA wichtig sind. Sie spielen allerdings die Rolle der Energiewährung in der Zelle.
- ↑ Der menschliche Körper besteht aus ca. 70% Wasser.
- ↑ Ein Chloroplast ist ein Zellorganelle, in der das Sonnenlicht empfangen wird und seine Energie in anderen Molekülen gespeichert. Chloroplasten befinden sich fast ausschließlich in pflanzlichen Zellen.
- ↑ Der Name der Gruppe, zu dem ein Element gehört, zeigt, wie viele Elektronen dieses Element in seiner äußersten Schale hat. Die Elemente der Gruppe VIIA z. B. (Fluor, Chlor, Brom, Iod, Astat, Tenness) haben alle 7 Elektronen in der äußersten Schale.








