Organische Chemie für Schüler/ Seifen und Waschmittel
Seifen
[Bearbeiten]Bereits im 5. Jahrhundert vor Christus wurden Pottasche (K2CO3) und Soda (Na2CO3) im Vorderen Orient zur Reinigung benutzt. Die Römer reinigten verschmutzte Wolle mit sich zersetzendem Urin.
Seifen sind im Grunde die Natrium- oder Kaliumsalze von Fettsäureresten. Das heißt, Fettsäuren bei denen das Proton durch ein Na+ oder K+ ersetzt wurde. Solche Seifen werden heutzutage allerdings kaum noch verwendet, da sie erstens alkalisch sind und so Haut und Textilgewebe schädigen und andererseits Rückstände auf Kleidungsstücken hinterlassen (so genannte unlösliche Kalkseifen).
Seife ist leicht biologisch abbaubar.
Zusatzinformationen:
Rezept zum historischen Seifensieden:
[Bearbeiten]V: In Becherglas oder besser einen Erlenmeyerkolben (wegen der Spritzgefahr!) wird etwas Pflanzenfett (3g) und 50 ml 30% Natronlauge gegeben und erhitzt. Dabei muss die ganze Zeit gerührt werden. Damit es nicht so spritzt, kann ein Deckel eines Konservenglases aufgebohrt werden und so durch das Loch gerührt werden.
Vorsicht, die Spritzer sind kochende Natronlauge. Diese führt bei Kontakt mit dem Auge zur Blindheit! Schutzbrille tragen! Im Notfall sofort mit viel Wasser auswaschen, den Lehrer informieren und sofort zum Arzt fahren.
B: An der Schaumbildung der Lösung erkennt man die zunehmende Seifenbildung. Beim Abkühlen wird die Seife dann als Feststoff sichtbar. (zur Beschleunigung kann auch alles in eine kalte Porzellanschale oder ein kühles Becherglas geschüttet werden.)
S: Aus dem Fett ist durch die Reaktion mit Lauge wieder Fettsäure und Glycerin entstanden. Die chemische Reaktion wird auch Verseifung genannt. Es handelt sich um die Rückreaktion der Veresterung. Da dazu das chemische Gleichgewicht auf die „andere“ Seite gebracht werden muss, ist in diesem Fall Wasser kein guter Partner für das Fett. Aus diesem Grunde verwendet man Natronlauge.
Herstellung von Allseife
[Bearbeiten]Seifen sind Salze von Fettsäuren, sie werden durch Spaltung der Fette mit Laugen gewonnen. (auch andere Verfahren möglich).
a) Ein einfaches Rezept zur Seifenherstellung
[Bearbeiten]- 40 mL Wasser
- 4 g NaOH
- 28,2 g Ölsäure oder Margarine
NaOH im H2O auflösen, erwärmen der Ölsäure, dann Zugabe NaOH. Rühren bei geringer Hitze, bis die Seife fest wird (evtl. Zugabe von Kochsalz). (Achtung, bei mehr als 100°C spritzt die Lauge!). Abschließend mit der Hand ein Seifenstück formen.
b) Ein etwas besseres Waschmittel
[Bearbeiten]10 g Fett oder Speiseöl werden mit 5 mL Ethanol in einer Abdampfschale mit kleiner Flamme auf ca. 70°C erwärmt (Schutzbrille! - Vorsicht, Alkoholdämpfe sind hochentzündlich!).
In einem zweiten Gefäß werden in 10 mL Wasser 2 Natriumhydroxidpastillen aufgelöst und ebenfalls erwärmt. Die zweite Lösung wird dann innerhalb von ca. 10 min unter Rühren zur Fettlösung hinzu gegeben und weiter erhitzt (bis zu 15min!) - doch Vorsicht - verklumpt das Gemisch, besteht die Gefahr des Anbrennens. Eventuell etwas heißes Wasser zugeben.
Die Reaktion ist dann beendet, wenn das weiße Produkt gut sichtbar ist und eine Probe davon sich bereits in einem Reagenzglas in Wasser auflöst.
c) Untersuchung von Seife
[Bearbeiten]V: Die hergestellte Seife oder auch eine Kern- oder Schmierseife wird mit Indikatorpapier untersucht.
B: Blaufärben
S: Echte Seifen reagieren alkalisch
Zur Wiederholung: Veresterung im Detail
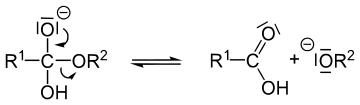
[Bearbeiten]Die Verseifung als Umkehrung der Veresterung
[Bearbeiten]Die Verseifung ist in den ersten beiden Schritten eine Gleichgewichtsreaktion, im dritten und letzten Schritt aber nicht! Sie läuft im alkalischen Millieu ab:
Zur Seifenherstellung werden anstelle herkömmlicher Ester meist Fette, also Triglycerin-Säureester verwendet. Der genaue Meschanismus verläuft entsprechend (siehe nächste Seite).
Erinnere Dich: Bei Fetten sind an jedem Glycerinmolekül drei Fettsäuren verestert. Die drei fettsäuren müssen dabei nicht gleich sein. Durch geschicktes Mischen verschiedener Fettsäuren (und Öle) lassen sich so die Eigenschaften der Seife beeinflussen (grober oder feiner Schaum, der mehr oder weniger lange hält, Waschwirkung usw.).
Mechanismus der Verseifung von Tri-Glycerin-Carbonsäureestern
[Bearbeiten]Die Verseifung findet in drei Schritten statt.
Bei den Schritten 1 und 2 liegt eine Gleichgewichtsreaktion vor. Es handelt sich bei der Rückreaktion der Verseifung um eine Veresterung!
Verseifung und Veresterung sind Konkurrenzreaktionen
[Bearbeiten]Information zum vierten Schritt „Ausfällen durch Na+-Zugabe“:
Die Fettsäurereste liegen nun als Anion vor und an die lagert sich im festen Zustand in der Regel ein Kation an. Bei der Seifenbildung ist die Reihenfolge im Grunde umgekehrt.
Beim Kochen der Lauge, kommen nach und nach die Na+ - Kationen an die gelösten Fettsäureanionen, binden über eine Ionenbindung und die Seife flockt so als Feststoff aus. Im Grunde ist dies wie die Bildung eines schwerlöslichen Salzes.
Aus diesem Grunde muss man ein Natriumsalz hinzugeben, da man sonst keinen Feststoff erhält.
Was sind Seifen?
[Bearbeiten]Seifen gehören zur Gruppe der Tenside (von lat. Spannen), sie sind Moleküle, welche eine hydrophilen und einen hydrophoben Rest aufweisen und so als „Emulgator“ Fette und Wasser mischen können. Dies geschieht, indem sie die Oberflächenspannung einer Flüssigkeit oder die Grenzflächenspannung zwischen den zwei eigentlich nichtmischbaren Phasen herabsetzen.
Alle Tensidmoleküle haben einen unpolaren und einen polaren Teil. Der unpolare Teil ist eine Kohlenstoffkette:

| Tenside | Beispiele für den polaren Teil |
|---|---|
| nichtionische Tenside | -OH (Alkohol), -O- (Ether) |
| anionische Tenside | -(COO)- (Carboxylat)
-(SO3)- (Sulfonat), -(SO4)2- (Sulfat) |
| kationische Tenside | quartäre Ammonium-Einheit |
| amphotere Tenside | Haben zwei funktionelle Gruppen: z.B. -COO- und eine quartäre Ammonium-Einheit |
Drei Möglichkeiten Tenside herzustellen:
[Bearbeiten]a) Seifensieden (v.a. historisch):
Bei diesem Vorgang werden Fette durch Laugen gespalten. Es entstehen wieder Fettsäuren und Glycerin. Die Fettsäuren reagieren allerdings durch die Lauge sofort weiter zu Wasser und Fettsäureanionen (Fettsäureresten). Diese Reaktion ist die Umkehrung (bzw. die Rückreaktion) der Veresterung. Sie wird Verseifung genannt.
Im Anschluss findet ein „Aussalzen“ statt. Dazu wird z.B. Kochsalz hinzugefügt. Die Natriumionen des Salzes reagieren mit den Fettsäureanionen und flocken als Feststoff aus.
Je mehr Glycerin zu diese Zeitpunkt noch in der Seife enthalten ist, desto „weicher“ ist das Produkt.
Kernseifen werden vor allem als feste Reinigungsseifen und in Zahnpasta verwendet. Schmierseifen werden zum Teil noch in Scheuermitteln verwendet.
b) Neutralisation von Fettsäuren mit Laugen (v.a. historisch):
Im Grunde nur der letzte Schritt. Zu den durch Lauge gebildeten Fettsäurenanionen wird Natrium- oder Kaliumsalz zugefügt.
c) Heutzutage besteht eine dritte Möglichkeit: Hydrolyse von Fetten
Dazu werden Fette in heißem Wasserdampf in Glycerin und Fettsäuren gespalten. Dies ist im Grunde die genaue Rückreaktion der Veresterung, ausgelöst durch eine Temperaturerhöhung (siehe K13 - Prinzip von le Chatelier)
Zusatzinformationen: Tenside
Wirkung von Tensiden
[Bearbeiten]a) Die Oberflächenspannung von Wasser:
[Bearbeiten]V: Stecknadel oder Büroklammer auf Wasser schwimmen lassen, Seife / Spüli zugeben
B: Die Stecknadel (Büroklammer) sinkt.
S: Tenside setzen die Grenzflächenspannung des Wassers herab.
b) Was sind Tenside?
[Bearbeiten]Tenside sind Stoffe, welche ein hydrophobes (wasserabweisendes) und einen hydrophiles (wasserliebendes) Molekülende haben (auch amphiphil genannt). Sie wirken grenzflächenaktiv und waschaktiv. Tenside setzen die Oberflächenspannung des Wassers herab.
Zu den Tensiden gehören z.B. die Anionen der Fettsäuren:
z.B. die Fettsäure „Stearinsäure“:
Ihr Anion mit einem Natriumion verbunden, ein typisches Tensid: Natriumstearat:
c) Was machen Tenside in Wasser?
[Bearbeiten]
In Wasser ordnen sich die einzelnen Tensidmoleküle in kleine kugelförmige Aggregate an (mit dem polaren, hydrophilen Ende nach außen und dem hydrophoben Ende nach innen). Diese Aggregate werden auch „Mizellen“ genannt. Man kann durch sie den Tyndall Effekt erklären. Leuchtet man in eine Seifenlösung, so reflektieren die Mizellen einen Teil des Lichts.
Tenside im Wassertropfen

Gleiches passiert übrigens an der Wasseroberfläche. Die Tenside bilden eine dünne Schicht und verringern so die Oberflächenspannung des Wassers (dabei ragen die hydrophilen Enden in das Wasser, die hydrophoben Enden hingegen in die der Luft).

Ist die Konzentration an Tensiden groß, dann kann Luft eingeschlossen werden. Es kommt zur Schaumbildung.
d) Was machen Tenside in Fetten/ Ölen?
[Bearbeiten]
In Fetten und Ölen passiert der umgekehrte Vorgang. Das hydrophobe Ende zeigt ins Fett, das hydrophile Köpfchen mit seiner Ladung nach außen.
e) Wirkung als Emulgator
[Bearbeiten]
Befinden sich in einem Gefäß Fette und Wasser, bzw. allgemein hydrophile und lipophile Substanzen, so können diese durch Tenside verbunden werden. Das lipophile Tensidende steckt dann im Fett, das hydrophile verbindet sich hingegen mit dem Wasser. Eine Emulsion ist entstanden.
f) Waschwirkung
[Bearbeiten]
Beim Waschen entsteht im Grunde eine solche Emulsion. Die Tenside dringen in Fettflecken ein und sprengen diese sozusagen auf. Die losgelösten Fettteilchen bilden dann kleine Tensid-Fett-Kügelchen und bleiben so in der Flüssigkeit, d.h. sie verschmutzen kein anderes Gewebe mehr.
Struktur und Einteilung der Tenside
[Bearbeiten]Die Einteilung der Tenside in Gruppen erfolgt nach der Ladung der polaren Gruppe:
a) Anionische Tenside
[Bearbeiten]- klassische Kern- und Schmierseifen → Alkylsulfate und Alkylsulfonate
b) Kationische Tenside:
[Bearbeiten]
v.a. quartäre Ammoniumsalze, z.B.:
- Didecyldimethylammoniumchloridn = 15 bis 17Verwendungin Weichspülern
- Diesterquat n = 14 bis 16
c) Nichtionische Tenside
[Bearbeiten]Alkohol oder Esterreste als polare Gruppen
- Alkylpolyglykolether n= 9 bis 17m = 3 bis 15
- Alkylpolyglucosidn = 7 bis 13m = 1 bis 3
d) Amphotere / zwitterionische Tenside
[Bearbeiten]Besitzen anionische und kationische Endgruppen:
- Betain n = 11 bis 17
Verwendung in Weichspülern Verwendung in kosmetischen Produkten
h) Tyndall Effekt:
[Bearbeiten]V: In zwei Bechergläser, bzw. zwei Glasküvetten wird eine stark verdünnte Seifenlösung gefüllt. Im optimalen Fall sollte man beide Lösungen nicht mehr voneinander unterschieden können.
Eine Unterscheidung kann nun durch einen Diaprojektor gelingen: Der Lichtstrahl wird nacheinander durch beide Gefäße geleitet.
B: In der Seifenlösung wird der Lichtstrahl viel besser sichtbar.
S: Es kommt zur Streuung des Lichts. Dies ist auf eine Brechung des Lichts durch eine Zusammenlagerung von Seifenmolekülen zu Molekülverbänden.
Versuch zur Grenzflächenaktivität von Tensiden
[Bearbeiten]Als Grenzfläche bezeichnet man die Berührungszone zwischen zwei Systemen verschiedener Aggregatzustände oder zwischen zwei nicht mischbaren Systemen des gleichen Aggregatzustandes. Die einzelnen Systeme heißen Phasen.
Phasengrenzflächen gegenüber Luft hingegen heißen „Oberflächen“.
V: Eine Glasscheibe wird mit Stearin benetzt. Dazu wird ein Löffel Stearinsäure (Pulver) auf heißes Wasser geben und so geschmolzen. Die Phase lässt man abkühlen und gießt sie dann auf eine auf eine Scheibe.
Die Scheibe wird nun von beiden Seiten mit Wasser benetzt.
B: Oberfläche der Scheibe: schlecht benetzbar, Wassertropfen perlt ab Unterseite der Scheibe: gut benetzbar.
S: Stearinsäure ist ein Tensid. In der Schmelze orientieren sich die Stearinsäuremoleküle mit dem hydrophilen Ende zum Wasser hin.
Stearinsäure ist grenzflächenaktiv, d.h. sie „vermittelt“ zwischen Phasen unterschiedlicher Polarität. Stearinsäure ist amphiphil = ein Tensid!
V2: Eine Büroklammer wird auf Wasser gelegt, so dass sie schwimmt. Dann wird etwas Spülmittel oder Seife hinzugegeben.
B: Die Büroklammer sinkt sofort:
S: Die Oberflächenspannung des Wasser sinkt, sie reicht nicht mehr aus, eine Büroklammer zu tragen.
Zusatzinformationen:
- Tyndall-Effekt
- Amphotere Tenside
- Kationische Tenside
- Waschmittel
- Oberflächenspannung
- Grenzflächenspannung
- Dispersion (Chemie)
- Detergentien
- Shampoo
- Spülmittel
Versuche mit Seifen
[Bearbeiten]Verhalten von Seifen gegenüber Säuren
[Bearbeiten]V: Wenige mL Kernseifenlösung werden im Reagenzglas mit einigen Tropfen verdünnter Schwefelsäure gemischt.
B: Die Lösung wird trüber
S: Es bilden sich aus den Seifenanionen wieder Fettsäuren:
- R-COO- + H3O+ → R-COOH + H2O
Bildung von (sonst unerwünschten) Kalkseifen
[Bearbeiten]V: Zu etwas Seifenlösung wird hartes Wasser (oder normales Leitungswasser mit Calciumchloridlösung „härter“ machen“) zugefügt. Zusatzversuch: Schütteln!
B: Die Lösung wird trüber. Durch ein Schütteln kommt es zu einer vergleichsweise geringen Schaumbildung.
S: Es entstehen schwerlösliche „Kalkseifen“, also feste Verbindungen aus den Fettsäureanionen und Calciumionen:
- 2 R-COO- + Ca2+ → (RCOO)2Ca(s)
In Gegenden mit hartem Leitungswasser bilden sich so beim Waschen grauen Schlieren auf der Kleidung. Ein großer Teil des Waschmittels ist so unwirksam, so dass man für eine gute Waschwirkung wesentlich mehr Waschmittel verwenden muss.
Durch die geringe Konzentration an freien Fettsäureanionen, kommt es zu keiner bleibenden Schaumbildung.
Seifen sind Emulgatoren:
[Bearbeiten]Zwei Reagenzgläser werden mit Speiseöl und Wasser zur Hälfte vorsichtig gefüllt. In eines der beiden Reagenzgläser wird etwas Seifenlösung zugefügt. Beide werden beobachtet, dann wird geschüttelt und dann ca. 5 min gewartet und erneut beobachtet.
B: Es bilden sich die typischen zwei Phasen, die sich nach dem Schütteln auch schnell wieder entmischen. In dem Reagenzglas, welches die Seife enthält findet die Entmischung nicht so deutlich statt. Es bildet sich vorübergehend eine trübe, einheitliche Phase.
S: Die Trübungen kommen durch noch nicht vollständige Entmischung und durch Lufteinschlüsse zustande. Die Seifenanionen bilden zusätzlich kleine Öltröpfchen, in denen sie mit ihrem lipophilem Ende stecken. Nach außen ragen die hydrophilen Reste, welche sich durch die Ionenladung gegenseitig abstoßen. Stattdessen lagern sich feine Wasserteilchen an. Es bildet sich so mit dem Wasser eine Emulsion.
Schmutztragevermögen
[Bearbeiten]In zwei Reagenzgläser wird einmal Wasser bzw. Seifenlösung gefüllt. Zu beiden wird eine kleine Spatelspitze Ruß (Kohlenstoffpulver) zugefügt. Die Lösungen werden vorsichtig vermischt und dann filtriert.
B: Zu erwarten wären zwei wasserklare Filtrate. Allerdings ist das Filtrat der Seifenlösung deutlich dunkler
S: Die Rußmoleküle werden von den Seifenanionen mit ihrem lipophilem Ende besetzt und so fein verteilt, dass sie letztlich, umgeben von Wasser, durch die Poren des Filterpapiers laufen können (=dispergierende Wirkung von Seifen).
Inhaltstoffe einer handelsüblichen Hautseife
[Bearbeiten]Am Beispiel einer „pH-Haut neutralen“ Seife (pH = 5,5)
- Weizenstärke (Triticum vulgare)
- Di-Natriumsulfobernsteinsäuremonolaurylester (engl.: Disodium Lauryl Sulfosuccinate)
- Kokosfettsäure-2-sulfoethylester (engl. Sodium CocoylIsethionate)
- Stearinsäure
- Palmitinsäure
- Paraffin
- Glycerinmonostearat (engl. Glyceryl Stearat)
- Cetylpalmitat, Cetylalkohol (gleicher Stoff!)
- Wasser
- Lecithin
- Milchsäure (Engl. Lactic Acid)
- Titandioxid
- Panthenol
- Polyethylenglycol (PEG 14 M)
- Duftstoffe
- EDTA Dinatriumsalz
- Aloe vera Konzentrat (Aloe barbadensis)
Zusatzinformationen:
- Stearinsäure
- Palmitinsäure
- Paraffin
- Cetylalkohol
- Titandioxid
- Dexpanthenol
- Lecithin
- Polyethylenglycol
- EDTA
- Echte Aloe
Waschmittel
[Bearbeiten]a) Versuche
V1: pH-Messung
Vergleiche den pH-Wert von verschiedenen Voll- und Feinwaschmitteln
V2) Bleichmittel:
Man gibt ein RG etwas Tinte und in ein anderes eine schwach konzentrierte, angesäuerte Kaliumpermaganatlösung. Zu beiden wird Vollwaschmittel zugefügt.
B: In beiden Reagenzgläsern kommt es zu einer Entfärbung.
S: Die Entfärbung beruht auf dem Vorhandensein von Perboraten, welche das Permanganation zu dem farblosen Mn2+ reduzieren, bzw, die Tinte oxidativ zerstören.
V3) Lehrerversuch: Boratnachweis (1. Weißmacher in Waschmitteln)

In zwei Reagenzgläser gibt man ca. 5mL Methanol (evtl. ist auch Ethanol möglich) und eine Spatelspitze Feinwasch- bzw. Vollwaschmittel. Zu beiden Reagenzgläsern wird etwas Schwefelsäure zugegeben. Dann erhitzt man vorsichtig und entzündet die entweichenden Dämpfe. Vorsicht!
B. Bei einigen Waschmitteln erkennt man eine grüne Farbe
S: Die in Vollwaschmitteln enthaltenen 1. Weißmacher sind oxidierende Borverbindungen (Perborate). Sie bilden mit Methanol den schon bekannten Borsäuretrimethylester, welcher mit grüner Flamme verbrennt. (Siehe auch Methanolnachweis)
V4) Optische Aufheller (2. Weißmacher in Waschmitteln)
Mit etwas Waschmittellösung und einem Pinsel wird auf ein rundes Filterpapier geschrieben. Nach dem Trocknen kann man die Schrift mithilfe einer UV-Lampe wieder sichtbar machen.
V5) Komplexbildner
Eine FeCl3 - Lösung wird mit K(SCN)-Lösung (=Kaliumthiocyanat) vermischt. Dann wird ein wenig Waschmittellösung zugefügt.
B: Die übliche tiefrote Farbe des Eisen(III)-thiocyanat-Komplexes verschwindet.
S: schnell, da Waschmittel Komplexbildner (z.B. das bekannte EDTA) enthalten. Diese Komplexbildner gehen mit den Eisenionen unserer Lösung einen Komplex ein, so dass unser Komplex sein Metallion verliert und farblos wird. Die Komplexbildner sollen üblicherweise Magnsium und Calciumionen aus dem Waschwasser entfernen, um es weicher zu machen (=„Enthärtung“).
b) Was sind Waschmittel?
[Bearbeiten]Waschmittel sind hoch spezialisierte Gemische, welche zum Waschen verwendet werden.
Sie sind meist flüssig, können auch in Pulverform (oder gepresst in Tabs) vorkommen. Sie werden im Allgemeinen zum Reinigen von Textilien verwendet.
Man unterscheidet dabei, je nach Verwendungszweck, mehrere Typen:
- Vollwaschmittel (=Kochwaschmittel), sind vor allem für weiße und stark verschmutzte Wäsche geeignet. Sie enthalten in der Regel Bleichmittel, Temperaturbereich: 30°C-95°C.
- Color- oder Buntwaschmittel sind logischerweise für farbige Wäsche geeignet und enthalten keine Bleichmittel, Temperaturbereich: 30°C-60°C. Sie werden mittlerweile häufiger verwendet als Vollwaschmittel und sind dank neuer Inhaltsstoffe eine gute Alternative.
- Feinwaschmittel werden für besonders delikate und empfindliche Textilien und für die Handwäsche verwendet. Ihr Temperaturbereich liegt bei max. 40°C, da empfindliche Textilien sonst schaden nehmen- Demzufolge enthalten sie weder Bleichmittel noch optische Aufheller, aber um ihre Waschwirkung zu verstärken Enzyme und Seife. Höhere Temperaturen würden die enthaltenen Enzyme denaturieren.
- Spezialwaschmittel für Wolle, Seide, Daunen, Membrantextilien.
c) Allgemeine Inhaltsstoffe von Waschmitteln
[Bearbeiten]Weniger als 5% enthalten:
reine SeifenWaschaktive Substanz, für die Entfernung von in Wasser nichtlöslichen (lipophilen) Stoffen aus dem Gewebe. Seifen verhindern auch zu starkes Schäumen
PolycarboxylateVerhindern Kalkablagerungen in der Wäsche und schützen vor dem grauer werden der weißen Wäschestücke.
Phosphonate (org. Verbindungen der Phosphorsäure) Soweit noch enthalten, verhindern sie die Reaktion der Inhaltsstoffe untereinander und binden zusätzlich Schwermetalle in Form schwerlöslicher Salze.
Schmutzträger Sie halten den abgelösten Schmutz im Wasser, so dass er sich nicht wieder in das Gewebe einfügen kann.
Zu 5-15% enthalten:
Anionische Tenside: Waschaktive Substanzen, lösen Schmutz von den Fasern des Nichtionische TensideGewebes, binden diesen und verhindern so sein erneutes festsetzen
Oxidierende Bleichmittel Entfernen Flecken durch deren Oxidation (klappt gut mit Saft-, Obst-, Tee- und Rotweinflecken)
Zu 15-30% enthalten:
Wasserenthärter: Erzeugen weiches Wasser durch Binden von im Wasser enthaltenen Magnesium- und v.a. Calciumionen und verhindern so die Bildung von Calciumcarbonat und Magnesiumcarbonat (sowie der beiden Hydrogencarbonate). Diese Salze sind für die so genannte Kalkbildung beim Erhitzen von Wasser zuständig. So können Tenside ihre Wirkung besser entfalten. Vor allem Zeolith A und auch Schichtsilikate werden verwendet. So genannte Builder unterstützen diese dabei. Abgesehen vom Waschen, sind Waschmaschinen durch Enthärter auch besser vor erzeugen weiches Wasser Kalkablagerungen geschützt.
Eiweiß zersetzende: Zersetzen Eiweißflecken, indem sie Eiweiße in Aminosäure spalten.
Enzyme und so für die Entfernung von eiweiß- und stärkehaltigen Flecken sorgen (Amylasen spalten Stärke, Lipasen spalten Fette, Proteasen spalten Eiweiße, Cellulasen spalten Zellulose)
Weitere Inhaltsstoffe:
- Bleichmittelverstärker
- Soda (Na2CO3): Unterstützt die Waschwirkung und enthärtet ebenfalls das Wasser
- Silikate: Verstärken die Tensidwirkung, machen die Wäsche etwas „weicher“,Schützen auch das Metall der Waschmaschine vor Korrosion.
- Optische Aufheller: Machen weiß noch weißer, indem sie einen leichten Blauton hinzufügen, der grau und Gelbtöne optisch „neutralisiert“
- Duftstoffe: Damit man es auch gerne kauft
d) Spezielle Inhaltsstoffe von Vollwaschmitteln
[Bearbeiten]
Bleichmittel Sie oxidieren nicht entfernbare, farbige Verschmutzungen (Obst-, Wein- oder Blutflecken), häufig kommt dabei Peroxide in Form von Natriumperborat(dimeren) zum Einsatz.
Farbige Substanzen haben häufig ausgeprägte Doppelbindungselektronensysteme. Bei Oxidationen werden diese teilweise aufgelöst und der Stoff verliert seine Farbigkeit. Da es eine simple Oxidation ist, wird die Reaktionsgeschwindigkeit durch Wärme erhöht (RGT-Regel). Deshalb sind Bleichmittel bei höheren Temperaturen effektiver.
Bleichaktivatoren sorgen dafür, dass die Bleichmittel auch bei niedrigen Temperaturen noch wirksam sind.
Optische Aufheller sind leicht bläulich fluoreszierende Farbstoffe, die durch ihre Fluoreszenz gelbe Schlieren weißer erscheinen lassen.
Stabilisatoren verhindern den nach einiger Zeit sonst einsetzenden Zerfall der Inhaltsstoffe, v.a. der recht reaktiven Bleichmittel der Bleichmittel.
Konservierungsstoffe verhindern v.a. in flüssigen Vollwaschmitteln den Bakterienbefall.
e) Spezielle Inhaltsstoffe von Buntwaschmitteln
[Bearbeiten]Farbübertragungsinhibitoren Sie dienen dem Schutz der Textilienfarben.
Nicht enthalten sind logischerweise Bleichmittel, da sonst die Farben schnell verblassen würden.
Zusatzinformationen:
Aufgaben
[Bearbeiten]- Warum sind Seifen eigentlich Salze? (und was waren eigentlich Salze?)
- Worauf beruht die Waschwirkung einer Seife?
- Was sind Tenside und wie unterscheiden sie sich von den klassischen Kernseifen?
- In Regionen mit hartem Wasser, sieht man v.a. auf dunkler Kleidung häufig weiße, waschmittelähnliche Flecken auf der Kleidung. Diese sind kaum auszubürsten. a) Um was handelt es sich und wie lautet die chemische Formel einer solchen Verbindung?b) Wieso treten diese Verunreinigungen auf?c) Warum hilft es in einem solchen Fall (manchmal) mehr, bzw. weniger Waschmittel zu verwenden?
Wiederholungsfragen
[Bearbeiten]- Was sind Seifen?
Was sind Tenside und wozu benötigt man sie?
- Aus Fetten kann man Seife gewinnen. Beschreibe die praktische Vorgehensweise und erkläre dann den Mechanismus genau
- Warum ist der erste Übergangszustand der Verseifung nicht stabil?
- Wie steht die Verseifung mit der Veresterung in Beziehung? Erkläre reversible und irreversible Schritte
- Was sind Tenside? Wie unterscheiden sie sich von Seifen?
- Wie kommt es zur Bildung von Mizellen. Welcher Bezug besteht zur Schaumbildung
- Welche Wirkung haben Seifen in Wasser (bzw. in Öl)?
- Warum sind Tenside Emulgatoren? Wie kommt es zu dieser Wirkung - skizziere.
- Erkläre die Waschwirkung eines Tensids
- Auch bei Seifen kann man einen Tyndal Effekt beobachten. Erkläre wie und weshalb
- Was sind Kalkseifen? Was sind Kernseifen?
- Wie unterschieden sich Waschmittel von Seifen?
- Warum sollte man Buntwäsche nicht mit einem Vollwaschmittel waschen? Welche Alternativen gibt es?
- Welchen pH-Wert haben Seifen bzw. Waschmittel?
- Warum interessiert die Menschen überhaupt der pH-Wert von Seifen?
- Vollwaschmittel entfärben Kaliumpermaganatlösung. Erkläre
- Nach seinem großen Filmerfolg kann Borat nun auch in Waschmittel nachgewiesen werden. Erkläre wie
- Nenne mindestens 10 Inhaltsstoffe von Waschmitteln und erkläre kurz ihre Funktion/ Wirkung
- In einigen Waschmitteln sind Enzyme enthalten. Erkläre warum und was man bei der Wäsche beachten sollte