Organische Chemie für Schüler/ Fette
Bauprinzip und Funktion von Fetten (Lipiden)
[Bearbeiten]
Lipide: Die Dreifachester von Glycerin mit drei meist verschiedenen unverzweigten Monocarbonsäuren (Fettsäuren) werden als Fette bezeichnet. So kommt auch der Name der Verbindungsklasse „Triacylglycerine“ (bzw. Triglyceride) zustande.
- Reine Fette, welche nur aus Glycerin und Fettsäuren entstanden sind, werden gelegentlich auch als Neutralfette bezeichnet (Glyceride). Fettähnliche Verbindungen als Lipoide.
- In der Natur dienen Fette als Polsterstoff für Organe und Muskeln, Wärmeisolierungsstoff und vor allem als Energiespeicher- und Reservestoff (39 kJ/g). Sie haben einen hohen physiologischen Brennwert
- Natürliche Fette sind Mischungen verschiedener Glyceride. Die einzelnen Fettsäuren sind in den Glyceriden regellos verteilt.
- Eigenschaften sind durch den Fettsäureanteil bestimmt.
- Vorkommen in vielen natürlichen Lebensmitteln, z.B. Milchprodukte, Pflanzensamen, Nüsse, Raps, Fleisch- und Wurstwaren usw.
Chemischer Aufbau der Neutralfette aus Glycerin und Fettsäuren
[Bearbeiten]Fette sind Ester des dreiwertigen Alkohols Glycerin mit langkettigen Monocarbonsäuren (=Fettsäuren). Erinnere Dich an das Kapitel Veresterung und das Entstehen von Estern:
Allgemein Veresterung: R1-Hydroxylgruppe + Carboxylgruppe-R2 → R1-R2-Ester + H2O
Bei der Bildung von Fetten liegt nun mit Glycerin ein Dreifachalkohol vor:
 bei R1 = R2 = R3: reine Triglyceride (Ausnahmen in der Natur)
bei R1 = R2 = R3: reine Triglyceride (Ausnahmen in der Natur)
Symbolische Schreibweise für Fette
[Bearbeiten]-
Symbolische Schreibweise für Fette, auch „Skelettformel“ genannt
Fettsäuren sind Bestandteile von Fetten
[Bearbeiten]Fettsäure (FS): unverzweigte Monocarbonsäuren, die Anzahl der C-Atome ist in der Regel geradzahlig, es gibt gesättigte und ungesättigte Fettsäuren (also ohne und mit Mehrfachbindungen)!
Beispiele für gesättigte Fettsäuren
[Bearbeiten]Beispiele für ungesättigte Fettsäuren
[Bearbeiten]Ungesättigte Fettsäuren sind oft pflanzlicher Herkunft. Sie sind für die Ernährung wertvoller und werden nicht so leicht in Körperfett umgewandelt. Einige ungesättigte Fettsäuren sind essentielle Nahrungsbestandteile, sie werden auch als Vitamin F zusammengefasst.
- Ölsäure: CH3(CH2)7CH=CH(CH2)7COOH C17H33COOH

- Linolsäure (=9,12-Octadecandiensäure): CH3(CH2)4CH=CH-CH2-CH=CH(CH2)7COOH C17H31COOH

- Linolensäure (=Octadecatriensäure): CH3CH2CH=CH-CH2-CH=CH-CH2-CH=CH(CH2)7COOH C17H29COOH

Bei natürlich vorkommenden ungesättigten Fettsäuren liegt an Doppelbindungen immer die cis-Konfiguration vor
z.B. Ölsäure: starrer Knick an der Doppelbindung

Vergleich der Schmelz- und Siedebereiche von Fetten und Ölen
[Bearbeiten]Fett enthält ungesättigte cis-Fettsäuren es werden die Fette und die Fettsäuren sich nicht dicht aneinander (parallel) anlagern können die VdW-Kräfte sind nur gering nur geringe Energie ist notwendig die VdW-Kräfte zu überwinden, um die Fette voneinander zu trennen und den Aggregatzustand zu ändern
→ Smp. und Sdp. sind gering.
→ Deshalb haben cis-Fette auch tiefere Schmelzbereiche als die entsprechende trans-Verbindungen
Nachweis der ungesättigten Fettsäuren
[Bearbeiten]→ Baeyersche Probe (Zugabe von leicht alkalischer Permanganatlösung → Entfärbung) → Entfärbung von Bromwasser (Additionsreaktion von Brom an die Doppelbindung)
Iodzahl
[Bearbeiten]Die Menge (Masse) an Iod in g, die von 100 g Fett gebunden wird ist ein typisches Merkmal zur Unterscheidung von Fetten. Ihre Maßeinheit ist [g Iod / pro 100g Fett].
Vergleiche: Iodzahl Butter: 30 - 40: tierisches Fett → geringer Anteil ungesättigter FettsäurenIodzahl Sonnenblumenöl 125 - 136: pflanzliches Fett → hoher Gehalt an ungesättigten Fettsäuren → Anlagerung mehrerer Jodmoleküle
Eigenschaften der Neutralfette
[Bearbeiten]- unlöslich in H2O, löslich in unpolaren Lösungsmitteln → hydrophob = lipophil
- Schmelzbereich statt eines Schmelzpunktes, weil sie in der Regel Gemische sind
- die Konsistenz und die Viskosität von Fetten ist abhängig von a) der Kettenlänge der Fettsäuren und b) dem Gehalt an ungesättigten Fettsäuren (beide Faktoren bestimmen somit über den Aggregatzustand eines Fettes bei Raumtemperatur)
- enthalten Triglyceride bloß gesättigte Fettsäuren mit Kettenlängen > C10, so sind sie bei Raumtemperatur Feststoffe
- Öle sind Triglyceride die mehr als 2/3 ein- oder mehrfach ungesättigte Fettsäuren besitzen
- Öle neigen an Luft zur Autooxidation ( → polymerisieren zu festem Harz)
Chemischer Fettabbau
[Bearbeiten]Durch Verseifung können Fette wieder in Glycerin und die enthaltenen Fettsäuren gespalten werden. (Erinnere Dich, die Verseifung ist die Umkehrreaktion der Veresterung). Dazu kann man einfach Fette mit Alkalilauge erhitzen. Es setzt eine hydrolytische Spaltung der Esterbindungen ein. Es entstehen Glycerin und Alkalisalze der Fettsäuren[1] (= Seifen)
Beispiel: Tripalmitinglycerinester + 3 Kalilauge → 3 Kaliumpalmitat + Glycerin → 3 C15H31COO-/K+
Verseifungszahl
[Bearbeiten]Die Menge (Masse) an KOH in mg, die zur Verseifung von 1000 mg Fett notwendig ist, ist ein Maß für die durchschnittliche Kettenlänge der im Fett enthaltenen Fettsäuren.
Biologischer Fettabbau (durch das Enzym Lipase)
[Bearbeiten]- Fett + Lipase → Glycerin + 3 Fettsäure
- Glycerin → wird für Biosynthesen + weiterverwendet
- Fettsäure → Abbau zu C2-Einheiten → wird für Biosynthesen + weiterverwendet
Bei Energiemangel: oxidativer Abbau (zu CO2 und H2O) zur Energiegewinnung (Umgangssprachlich auch „Fettverbrennung“ genannt)
Versuche mit Fetten
[Bearbeiten]1. Lösungsmittelversuche:
[Bearbeiten]V: Versuche im Reagenzglas verschiedene Fette und Öle in Wasser, Spiritus und Benzin zu lösen. a) Beobachte (wenn vorhanden) auch die Phasengrenze.
b) Was passiert, wenn Du das Reagenzglas leicht bzw. stark schüttelst?
c) Was ist eine Emulsion?
2. Bayersche Probe:
[Bearbeiten]V: Gib zu pflanzlichen Ölen eine leicht alkalische, schwach gefärbte Kaliumpermanganatlösung. Beobachte.
a) Warum kommt es zur Entfärbung
b) Welches Ergebnis erwartest Du bei dem gleichen Versuch, wenn statt Kaliumpermanganat Brom (bzw. Bromwasser) zugegeben wird?
3. Nachweise für Fette I: Die Fettfleckprobe
[Bearbeiten]V: In der Lebensmittelchemie gibt es einen einfachen Test, welcher eine ungefähre Aussage zum Fettgehalt von Lebensmitteln macht. Dazu markiert man einen 2cm, großen Bleistiftkreis auf Papier oder Filterpapier und zerreibt dann Lebensmittel darauf, lässt dies trocknen und hält es dann gegen eine Lichtquelle (z.B. Fenster).
4. Nachweise für Fette II: Die Sudan III Probe
[Bearbeiten]V: Zu Fetten oder Ölen wird etwas Spiritus und Sudan (III) Lösung zugefügt.
5. Nachweise für Fette III: Doppelbindungsnachweis durch Iod (im Abzug durchführen)
[Bearbeiten]a) RG1: In ein Reagenzglas wird etwas festes Iod und eine geringe Menge Essigsäure (ca. 5ml) gegeben. Man wartet, bis sich die Kristalle aufgelöst haben.
b) RG2: In einem zweiten Reagenzglas wird 1ml Olivenöl mit ca. 4ml Essigsäure versetzt. Das zweite Reagenzglas wird nun kurzzeitig vorsichtig erhitzt (Vorsicht - Entzündungsgefahr).
c) Aus dem ersten Reagenzglas werden vorsichtig einige Tropfen der Iod-Essigsäurelösung zur zweiten Lösung gegeben. Nach jedem Tropfen wird geschüttelt. Beobachte genau
6. Oxidative Fettumwandlung (Ranzigwerden)
[Bearbeiten]Vorversuch: Stelle „altes Fritteusenfett“ her, indem Du Pflanzenöl im Verbrennungsschälchen (kein Glaskolben!) ca. 5 min im Abzug erwärmst - Vorsicht, auf Selbstentzündung achten. Vorher also dringend eine Abdeckung, z.B. ein noch intaktes Drahtnetz bereitlegen.
V: Gib zu altem jeweils 5g Fritteusenöl, neuem Sonnenblumenöl und bei Bedarf auch anderen Fettsorten je 20ml Benzin und einige Tropfen Phenolphtalein.
In so zubereiteten Lösungen tropfst Du nun aus einer Maßpipette (oder wenn vorhanden einer Bürette) solange Natronlauge zu, bis sich der Indikator rosa färbt. Das zugegebene Volumen an Lauge wird notiert.
a) Warum ist der „Laugenverbrauch“ bei dem benutzten Fritteusenöl so hoch? Stelle Vermutungen über die Gründe an.
b) Welche Aussagen bezüglich der gesundheitlichen Wirkung solcher Öle kann man treffen?
Vergleich der Entfärbungsreaktionen
[Bearbeiten]V: a) Elektrophile Addition von Br2 an eine Doppelbindung
b) Bayer-Probe (oxidative Spaltung von Doppelbindungen) → Aldehyde – Dicarbonsäuren kürzerer Kettenlänge
| Entf. v. Bromwasser | Bayer-Probe | |
| Leinöl | ||
| Olivenöl | ||
| Palmin | ||
| Schweineschmalz | ||
| ... |
Fetthärtung und Margarineherstellung
[Bearbeiten]Margarine besteht aus gehärteten und ungehärteten Pflanzenölen und Wasser. Normalerweise ist sie als Emulsion weiß, industrieller Margarine werden aber Karotine zugefügt, damit sie eine „gesündere“ gelbliche Farbe hat.
Margarine enthält vor allem gehärtete Fette, also Fettsäuren, an deren Mehrfachbindungen Wasserstoffe addiert wurden. Dabei entstehen auch so genannte Transfettsäuren, welche unter Umständen das Infarktrisiko erhöhen. Bei Palm- oder Kokosfett- bzw. Reformmargarinen wird auf gehärtete Fette verzichtet, somit können auch nicht die gesundheitlich bedenkliche Transfettsäuren enthalten sein.
Der Energiegehalt von Margarine ist mit ca. 750 Kilokalorien pro 100 Gramm genauso hoch wie der von Butter.
„Margarine für die menschliche Ernährung“
[Bearbeiten]In Dürre- und Kriegszeiten hatten die Menschen Europas besonderen Bedarf an Fetten. Fette sind aber teuer gewesen und als Öle auch schwer zu transportieren (die meisten natürlichen Fette sind bei Raumtemperatur flüssig). Es gab also das Problem, flüssige Öle in feste Fette zu überführen.
Napoleon III rief 1864 zu einem Wettbewerb auf, der zum Ziel hatte, einen Ersatz für die teure Butter zu finden. Der Franzose Mège-Mourès fand 1869 die Butter-Alternative: Margarine aus Wasser, Milch und Rindertalg (und etwas Lab). Er nannte sein Produkt Oleomargarin (von lat. oleum = Öl und griech. margaros = Perlmuschel aufgrund der Farbe des Produkts)
Schon 1871 kam es durch die holländischen Familien Juergens und van den Bergh zu ersten Fabriken in Kleve und Goch am Niederrhein. Anstelle von Milch wurde nun auch Schweineschmalz, Walöl, Palmöl, Erdnuss- und Kokosnussfett verwendet.
Fetthärtung durch Hydrierung nach W. Normann, 1902
[Bearbeiten]Eine Hydrierung ist die Addition von Wasserstoff an Mehrfachbindungen. Dazu muss das Wasserstoffmolekül (H2) erst in zwei einzelne Atome gespalten werden, was sehr viel Energie[2] voraussetzt, so dass Hydrierungen in der Regel nicht ohne Katalysator stattfinden.
Aufgrund der hohen Stabilität des Wasserstoffmoleküls benötigt man für die Durchführung der Hydrierung in der Regel einen Katalysator.
Wilhelm Normann hydrierte 1901 erstmals ungesättigte Fettsäuren und lieferte so einen wesentlichen Beitrag zur preiswerten Margarineherstellung. Durch dieses Verfahren werden an die Doppelbindungen der flüssigen Öle Wasserstoffe angelagert. Man spricht auch vom „sättigen“ der Doppelbindungen. Die Moleküle werden dadurch gradliniger und es bilden sich stärkere Van der Waals-Kräfte aus. Die Folge ist eine höhere Anziehungskraft unter den Molekülen, was ihre Eigenbewegung einschränkt, so dass es somit zu einem Anheben des Schmelz- und Siedepunktes kommt. Man erhält mithin bei Raumtemperatur in der Regel ein festes Fett.
Zum Ablauf der Reaktion ist eine Nickelkatalysator notwendig und eine Temperatur von 120-180°C. Wasserstoffgas muss im Überschuss mit einem Druck von mindestens 5bar zugefügt werden.
Fetthärtung findet durch katalytische Hydrierung der Doppelbindungen mit einen Ni-Katalysator bei ca. 180°C, 5bar Druck statt
Zusatzinformationen:
- Margarine
- Hydrierung (Fetthärtung und Margarineherstellung)
LK: Bau und Bedeutung von Lipoiden
[Bearbeiten]Phospholipide (Phosphatide) → abgewandelte Triglyceride, z.B. Lecithine (am Aufbau des Nervengewebes beteiligt)
Wichtige Kennzahlen der Fette
[Bearbeiten]- Jodzahl: Menge Jod in g, die von 100 g Fett addiert werden. Maß für den Gehalt an Doppelbindungen.
- Die Jodzahl gibt an, wie viel g Iod von 100 g des untersuchten Fettes gebunden werden.
- Säurezahl: Verbrauch an mg KOH für die Neutralisation der Fettsäuren in 1g Fett. Maß für den Gehalt an freien Fettsäuren.
- Maß für die Konzentration freier Fettsäuren, das angibt, wie viel mg KOH zur Neutralisation von einem g Fett benötigt werden.
- Verseifungszahl: Verbrauch an mg KOH für die quantitative Hydrolyse von 1g Fett.
- Maß für die durchschnittliche Kettenlänge der Carbonsäuren im Ester.
1) Bsp.: Die Jodzahl eines Fettes beträgt 33. Welche Stoffmenge an Glycerintrioleat würde dies entsprechen?
Glycerintrioleat: M(C57H104O6) = 885,445 g/mol
Jod: M(I2) = 253,8 g/mol
Jodzahl 33 → Verbrauch an Jod: m(I2) = 33 g / pro 100 g Fett
n(Trioleat) = 1/3 n(I2) = 0,043 mol
m(Trioleat) = n(Trioleat) * M(Trioleat) = 0,043 mol * 885,445 g/mol
m(Trioleat) = 38,37 g
1b) Welcher Stoffmenge (mol) an Triglycerid der Ölsäure entsprechen diese Jodzahlen?
| Jodzahl | |
|---|---|
| Butter | 33-43 |
| Rapsöl | 97-108 |
| Sonnenblumenöl | 125-136 |
Lösung:
M (C57H104O6) = 885,445 g/mol
M (I2) = 253,8 g/mol
Jodzahl 33 → 0,13 mol I2
→ 0,13/3 mol Trioleat = 0,043 mol
→ 38,37 g Trioleat
| Jodzahl | Trioleat [mmol] | Trioleat [g] | ||
|---|---|---|---|---|
| Butter | 33-43 | 43-56 | 38-50 | |
| Rapsöl | 97-108 | 127-142 | 113-165 | |
| Sonnenblumenöl | 125-136 | 164-179 | 145-158 |
Die Zellmembran als Beispiel für eine Lipiddoppelschicht
[Bearbeiten]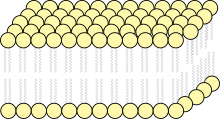
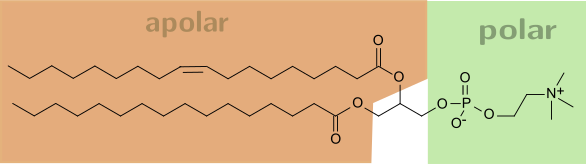
- enthält als Bauelemente (Phospho-)Lipide und Proteine und häufig geringe Mengen von Kohlenhydraten. Als Phospholipid kommt oft Lecithin zum Einsatz
- Begrenzt das Zellplasma, die Vakuole und auch Zellorganellen
- Bilden Doppellipidschicht aus, deren polare, hydrophile Enden dem wässrigen Umgebungsmilieu entgegenragen, während die apolaren, lipophilen Schwänze einander zugekehrt sind,
- 6 bis 9nm dick
- Membranen lassen Stoffe (z.B. Wasser und Salze) hindurch. Kleinere Moleküle oft passiv, größere aktiv ( selektiv permeabel)
- Die Außenseite der Zellmembran ist mit verschiedenen Rezeptoren sowie Oberflächenproteinen besetzt.
- Alle Lipide sind gut in Fett und organischen Lösungsmitteln löslich, aber unlöslich in Wasser
Lecithin - Ein Membranlipid
[Bearbeiten]
/D.1ester-lipide-palmitinsäure
Membranen bestehen aus einer Lipiddoppelschicht und enthalten Proteine
[Bearbeiten]Dabei unterschiedet man zwei Arten von Proteinen (= Eiweißen): a) Periphere Proteine (=Oberflächenproteine) haften elektrostatisch von außen an der Membran b) Integrale Proteinen sind in die Lipiddoppelschicht eingebunden und zum Teil auch von außen sichtbar. Sie können als Transportproteine (auch Tunnelproteine genannt) einen feinen Kanal bilden, der Ein- bzw. Austritt kleiner Moleküle und von Wasser ermöglicht
Die Umwandlungs- und Bewegungsvorgänge der Membran werden als Membranfluss bezeichnet, da alle Bestandteile zum selben System gehören und frei beweglich sind. Membranen sind nicht statisch und haben keine feste Struktur, sie können sich gegeneinander verschieben.
Wiederholungsfragen
[Bearbeiten]- Wie sind Fette aufgebaut? In welche Gruppen kann man sie unterteilen?
- Welche Bedeutung kommt dabei dem Glycerin zu?
- Was ist der unterschied zwischen Fetten und Fettsäuren?
- Nenne drei ungesättigte und drei gesättigte Fettsäuren. Jeweils eine davon mit der Summenformel!
- Wie unterscheiden sich gesättigte und ungesättigte Fettsäuren? Wie können sie im Labor unterschieden werden? Nenne zwei Nachweise mit entsprechendem Mechanismus.
- Warum spricht man bei Fetten in der Regel nicht vom Schmelzpunkt, sondern vom Schmelzbereich?
- Wovon sind Konsistenz und Viskosität der Fette abhängig? Wie nennt man flüssige Fette?
- Wie funktioniert der sagenumwobene Fettflecktest?
- Kann man mit Iodlösung eine Reaktion bei Fetten hervorrufen? Nach welchem Mechanismus wird eine eventuelle Reaktion stattfinden?
- Was versteht man unter Fetthärtung? Beschreibe dazu auch die Margarineherstellung
- Welche Kennzahlen gibt es für Fette? Wozu dienen sie?
- In welcher Verbindung stehen Zellmembranen mit Fetten? Erläutere den Aufbau einer Biomembran und begründe
- Was sind Seifen? Wie stellt man sie her? Erläutere den genauen Mechanismus
- Welcher Zusammenhang besteht zur Veresterung?
- Was ist der „Tyndal Effekt“?
- ↑ Salze bestehen aus einem Metallion (welches von der Base kommt) und einem Säurerest: R-COO- Na+
- ↑ Dissoziations-Enthalpie (ΔH0) H2→ 2H = 434 kJ/mol