Organische Chemie für Schüler/ Kunststoffe
Was sind Kunststoffe?
[Bearbeiten]Betrachte einmal verschiedene Kunststoffarten. Obwohl wir alle Kunststoffe mit den Oberbegriffen Kunststoff und Plastik beschreiben, gibt es doch offensichtlich große Unterschiede.
Wofür werden Kunststoffe benötigt? Wo tauchen sie in unserem Leben auf?
- Brainstorming
- Verpackungsmaterial
- Textilfasern
- Wärmeisolierung
- Rohre
- Bodenbeläge
- Lacke
- Klebstoffe
- Kosmetika
- Kabel
- Gebäude
- Reifen
- Kunststoffe dienen z.B.
- als Verpackungsmaterial
- als Textilfasern (Kunstfasern)
- zur Wärmeisolierung
- als Ausgangsstoff für Rohre
- als Bodenbeläge
- als Lack- und Farbenbestandteile
- als Klebstoff
- als Inhaltsstoffe in Kosmetika
- als Isolierungsmaterial
- für Reifen
- als Polster
- für Autoarmaturen
- Kanister und Tanks
- usw...
Zusatzinformationen Kunststoff Polymerchemie
Untersuchung von Kunststoffen
[Bearbeiten]- Material
- Polyamid (PA)
- Kupferdraht
- Polyethylen (PE)
- Polystyrol (PS)
- Plexiglas (PMMA)
V1: Schmelzen und Verbrennen von Kunststoffen
Der Bunsenbrenner wird mit einem Winkel von 45° eingespannt, Alufolie unter gelegt und dann die folgenden Substanzen in und außerhalb der Flamme untersucht.
Besonderes Augenmerk ist dabei auf Entzündbarkeit sowie die selbstständige Brennbarkeit zu legen. Auch die viskosen Eigenschaften der geschmolzenen Kunststoffe sollen notiert werden. In die Dämpfe kann etwas feuchtes Indikatorpapier gehalten werden.
ACHTUNG: Die Verbrennung von PVC und auch die Beilstein-Probe (s. u. V3) erzeugen Dioxine und Furane. Sie sind daher in einigen Bundesländern bereits verboten und sollten nicht mehr durchgeführt werden!
V2: Identifizieren eines unbekannten Kunststoffs
Durch Vergleich soll ein unbekannter Kunststoff mit den Ergebnissen der aus V1 bekannten Eigenschaften identifiziert werden.
V3: Beilsteinprobe
Ein Kupferdraht wird in der Bunsenbrennerflamme ausgeglüht und dann mit etwas PVC bzw. PE benetzt. Er wird erneut in die Flamme gehalten. (Erinnere Dich an die Beilstein-Probe auf Halogene.)
V4: Dichte
Teste die Dichte von Kunststoffen in Wasser
Zusatzinformationen Beilsteinprobe
Unterscheidung von Kunststoffen
[Bearbeiten]| Versuch | Beobachtung | Schlussfolgerung |
|---|---|---|
| Schwimmverhalten: | ||
| Polyethylen | schwimmt | → < 1,0 g/cm3 |
| PVC | schwimmt nicht | → > 1,0 g/cm3 |
| Brennverhalten: | ||
| PE |
|
|
| PVC |
|
|
| Zersetzungsprodukte:
Erhitzen im RG und dabei die Zersetzungsgase mit feuchtem Indikatorpapier untersuchen |
||
| PE | keine Verfärbung | Keine Säurebildung |
| PVC | Rotfärbung | Verbrennungsgase sind sauer:
|
Aufgaben:
- Nenne Vorteile sowie Nachteile von Kunststoffen und deren Gebrauch
Allgemeines zu Kunststoffen: Was sind Kunststoffe?
[Bearbeiten]Kunststoffe bestehen vor allem aus den Elementen Kohlenstoff und Wasserstoff. Auch wenn es nicht so scheint, so sind sie doch Kohlenwasserstoffe. Sie sind aus einzelnen kleinen Bestandteilen, den Monomeren, durch Verkettung der einzelnen Monomermoleküle zu sehr langen Ketten zusammengefügt (so genannten Makromolekülen bzw. Polymere). (Altgriechisch: mono = 1, makro = groß, polys = viel, meros = Teil)
Die ersten Kunststoffe waren:
- 1869 Celluloid (für Kämme, Puppen, Filme)
- 1885 (Bakelit) Kunsthorn (Knöpfe, Schnalle, Füllhalter)
Gemeinsame Eigenschaften von Kunststoffen:
[Bearbeiten]Meist haben Polymere eine geringe Dichte, nur schlechte Leitfähigkeit für Wärme und Strom sowie hohe Beständigkeit gegen Säuren & Laugen und Verwitterung. D.h. Kunststoffe sind in der Regel sehr lange haltbar. Ein Becher aus Kunststoff verwittert in 10 000 Jahren nicht! Wie beseitigt man also auf ökologischem Wege Kunststoffe?
Kunststoffschäume wie z.B. Schaumstoff sind sehr gute Schall- und Wärmeisolatoren.
In der Regel sind Kunststoffe nicht temperaturbeständig. Sie schmelzen oder verkohlen bei höheren Temperaturen. Beim Verbrennen entstehen z.T. giftige Gase (Dioxine). Viele Kunststoffe sind eher wenig kratzfest, und oft brüchig (besonders, wenn sie länger dem Sonnenlicht ausgesetzt sind). Sie neigen zur elektrostatischen Aufladung (besonders Folien).
Grundsätzlicher Aufbau von Kunststoffen
[Bearbeiten]Kunststoffe bestehen aus langen, ineinander verschlungener Molekülketten. Deren Anzahl kann in die Millionen gehen (→Polymere). Aufgrund der Größe der einzelnen Moleküle spricht man auch von Makromolekülen. Betrachtet man die Makromoleküle genauer, erkennt man dass es sich immer wieder um stets wiederholenden Grundeinheiten (so genannte Monomere) handelt, welche zu Ketten verbunden sind (Vergleichbar mit einer Perlenkette).
Beispiel: Polypropylen ist ein Kunststoff aus sich vielfach wiederholenden Propyleneinheiten
- Monomer = Einzelbaustein: ⎕
- Polymer = Makromoleküle bestehend aus vielen durch Atombindungen (=kovalent) verknüpften Monomeren: ⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕
Man unterscheidet dabei zwischen:
- „Homopolymer“ = nur eine Monomerensorte
- „Copolymer“(Heteropolymer) = verschiedene Monomerensorten (alternierend oder statistisch)
- Pfropfpolymere: Untergruppe der Copolymere. Merkmal: die Seitenketten der Polymerkette sind aus anderen Monomeren aufgebaut.
Eine bekannte Verwendung von Copolymeren ist der Einsatz in Bausteinen für Kinder. Sie bestehen in der Regel aus Acrylnitril, 1,3 Butadien und Styrol (ABS-Kunststoff). Sie sind leicht färbbar und durch ihre Härte nahezu unzerbrechlich. Weitere ABS-Kunststoffe findet man in Staubsaugergehäusen und im Autobau der Automobilindustrie.
SBR-Kunststoffe (aus Styrol und Butadien - das R steht für "Rubber") werden als Synthesekautschuk für Schläuche, Autoreifen usw. verwendet.
Aufgaben:
- Können Kunststoffe brennen? Begründe mit ihrem Aufbau!
- Welche Eigenschaften sprechen für den Kunststoffeinsatz im Auto (in der Küche)?
- Ordne den 3 Kunststoffgruppen Verwendungsbeispiele zu!
Einteilung der Kunststoffe
[Bearbeiten]Es gibt mehrere Möglichkeiten Kunststoffe einzuteilen. Nach der Zusammensetzung bzw. nach den Eigenschaften.
Einteilung von Kunststoffen nach den Eigenschaften:
[Bearbeiten]- Thermoplaste (= Plastomere) sind durch Hitze verformbar
- Duroplaste (= Duromere) sind hart
- Elastomere (= Elastoplaste) sind elastisch und gummiartig
a) Thermoplaste
[Bearbeiten]
Sie gehören in die Gruppe der “Plaste” (wie die Duroplaste).
Die Polymere der Thermoplaste sind meist lang und linear, also wenig verzweigt. Die Moleküle liegen entweder als Knäul oder parallel angeordnet (wie Streichhölzer in einer Packung) vor. Ein Polymermolekül kann dabei 10-6 - 10-3 mm lang und 104 - 106 u schwer sein.
Die namensgebende Besonderheit der Thermoplaste ist, das sie bei Hitze verformt werden können. Da die Polymerketten allerdings nicht alle identisch sind, hat man unterschiedliche Atomgewichte und somit verschiedene Wechselwirkungen der Atome untereinander (im Grunde liegt ein Gemisch vor). Als Konsequenz haben die Polymerketten unterschiedliche Schmelz- und Siedepunkte, so dass der ganze Kunststoff eher Schmelz- und Siedebereiche, anstelle von exakten Schmelz- und Siedepunkten hat. Sind die Temperaturen nicht zu hoch, werden die Polymere übrigens beim Schmelzen nicht verändert, d.h. nach dem Abkühlen liegt wieder der gleiche Kunststoff vor, nur in einer anderen Form. Thermoplaste sind recht schwer entzündbar. Sie sind geruchs- und geschmacksneutral.
Bekannte Vertreter der Thermoplaste sind: Polyethylen, Polyvinylchlorid, Polystyrol, Polyamid
b) Duroplaste
[Bearbeiten]
Die Polymere der Duroplaste sind untereinander dreidimensional engmaschig vernetzt. Dadurch haben sie eine hohe Härte und Festigkeit[1] („Duro“ = hart). (D Makromolekülen, die untereinander durch Atombindungen vereinigt sind! Es liegt pro Kunststoff nur ein einziges (!) Molekül vor.
Duroplastische Kunststoffe werden auch bei hohen Temperaturen nicht weich. Sie schmelzen auch bei Hitze nicht, da die dreidimensionale Vernetzung erhalten bleibt. Sie bleiben so lange harte & spröde bis sie verkohlen.
Duroplaste sind schwer entflammbar, hart und kaum Verformbar, geruchs- und geschmacksneutral.
Bekannte Vertreter der Duroplaste sind „Phenoplast“ und „Aminoplast“.
- Phenoplast
- hart, durch Füllstoffe (Holzmehl u.a.) spröde und zäh
- meist in dunklen Farben
- für Elektroartikel (Stecker usw.), Dosen
- früher als Kraftfahrzeugkarosserie (Trabant)
- Aminoplast
- hart, meist schlagfest, farblos oder gefärbt
- für Geschirr, Spielwaren, Wärme- und Schallisolation
c) Elastomere
[Bearbeiten]Elastomere sind elastisch wie Gummi. Man kann sie auseinanderziehen oder auch zusammendrücken. Sie nehmen schnell wieder ihre ursprüngliche Form an. Man spricht auch vom „Gedächtnis“ des Kunststoffes. Wenn Du Dir jetzt einen Softball oder einen Schwamm vorstellst, siehst Du einen Elastomer.
Die Polymerketten der Elsastomere sind zwar untereinander vernetzt und vor allem verknäult, aber nicht so stark wie bei den Duroplasten. Vielmehr liegt eine weitmaschige Vernetzung vor, wodurch die gummielastisch werden. Zieht man an Elastomeren, so werden die Polymerknäule auseinandergezogen, wobei die Makromoleküle aneinandergleiten. Sowie der Zug aufhört, verknäulen sich die Moleküle wieder zu ihrer ursprünglichen Form. Genau wie die Duroplaste sind sie nicht schmelzbar. Sie sind aber im Vergleich leichter zu entzünden.
Elastomere können aus Rohkautschuk hergestellt werden. Dazu muss der Rohkautschuk durch eine Reaktion (Vulkanisation, bei der sich Schwefelbrücken ausbilden) bearbeitet werden. Wird keine Vulkanisation durchgeführt, bleiben die Polymere brüchig.
- Vertreter
- (alles Gummi- und gummiähnliche Stoffe)
- Polyurethan
- Polyester (Kunstfasern → für Textilien geeignet)
- Polyurethan
- den Polyamiden ähnlich
- meist schaumstoffartig
- Grundstoff für viele Klebstoffe
- Grundstoff für einige Textilifasern
Zusatzinformationen:
Aufgaben
- Eine Bleistiftlinie soll Polymerkohlenstoffkette darstellen. Wie würdest Du dann den Aufbau der Thermoplaste mit Linien zu zeichnen?
- Wie würdest Du nun einen Duroplasten zeichnen? Bedenke dabei die Art der Verknüpfungen. Wo werden Duroplaste verwendet?
- Wie würdest Du den Aufbau von Elastomeren skizzieren? Wo werden sie verwendet?
- Gerade bei Elastomeren spricht man vom Gedächtnis der Kunststoffe. Begründe warum, anhand eines Softballs.
- Welches Atomgewicht hat ein Moleküls, welches 1500mal aus Ethen besteht. Wie heißt es?
- Wo finden thermisch verformbare Kunststoffe ihre Anwendung? Bedenke auch deren Herstellungsprozess.
- Bei Thermoplaste liegt kein einheitlicher Schmelzpunkt vor? Warum nicht?
- Welchen Vorteil hat eine gute Hitzebeständigkeit (vor allem bei Duroplasten) (Tipp: Geschirr).
Gummi - ein natürlicher Elastomer
[Bearbeiten]Die Milch des Gummibaums ist ein natürliches Gemisch (mit ca. 40% Kautschuk) und wird beim Aushärten mit Sauerstoff zum natürlichen Kunststoff Latex. Mit Hilfe von Säure wird die Milch zu Rohkautschuk verarbeitet und bei Bedarf gleich, oder später mit Schwefel erhitzt (=vulkanisiert). Dabei binden sich Schwefelatome mit dem Rohkautschuk. Das entstehende Produkt ist Gummi.
Der Anteil des Schwefels bestimmt dabei die Weichheit:
- < 2% Schwefel → Weichgummi
- 2%-30% → Gummi
- > 30% Schwefel → Hartgummi (z.B. für Autoreifen).

Zusatzinformationen
Einteilung von Kunststoffen nach der Herkunft der Ausgangsstoffe:
[Bearbeiten]Zur Geschichte der Kunststoffe
[Bearbeiten]Erste Kunststoffe: Zellulosenitrat (auch Nitrocellulose bzw. Celluloid genannt)
[Bearbeiten]
Herstellung durch Nitrieren von Cellulose
Zusatzinformationen
Erste Kunststoffe: Bakelit (Phenol-Formaldehyd-Kunstharz)
[Bearbeiten]Herstellung
[Bearbeiten]Struktur
[Bearbeiten]Zusatzinformationen
Ausgangsstoffe der Polymerisation und die daraus gebildeten Kunststoffe
[Bearbeiten]Bei der Synthese von Kunststoffen werden viele kleine Monomere zu ketten- oder netzförmigen Polymeren verkettet. Tausende von Molekülen des Ausgangsstoffes werden dabei zu einer Kette zusammengesetzt.
Kunststoffgewinnung (I) aus Naturstoffen
[Bearbeiten]a) Regenerierte bzw. umgewandelte Naturstoffe (makromolekular)
[Bearbeiten](1) halbsynthetische Zellulusefasern
Baumwolle: 90% lange Zellulosefasern
aber: Rohstoffbedarf der Textilindustrie hoch → Verwendung auch kurzkettiger Zellulose
Ausgangsstoff: kurzkettige Zellulose aus Holz
Endstoff: Reyon („Kunstseide“), langfaserig, spinnbar(bzw. Cellophan (flexibler durch Glycerin)
z.B. Viskoseverfahren
Cellulose + 20%ige NaOH + CS2 → zähflüssige Viskose
Säurebad: langkettige Zellulose
Formeln nur für LK:
- Bildung eines Xanthogenats
- regenerierte Cellulose (=spinnbares Reyon)
(2) Vulkanisierter Gummi - Naturkautschuk (zuerst von Goodyear 1839)
Ausgangsstoff: Naturkautschuk (natürliches Polymer aus Isopren)
(Südamerika: Kautschukbaum – Hevea brasiliensis → Latex = Milchsaft ( Kautschukemulsion)
Kunststoffsynthese (II) durch Polymerisation
[Bearbeiten]
Die Polymerisation (der Monomere) kann durch Radikale ausgelöst werden. Dabei bindet ein Radikal an ein ungesättigtes Molekül (z.B. Styrol). Dieses wird selbst zum Radikal und bindet an ein weiteres Molekül, usw...
Bei der eigentlichen Reaktion lagern sich immer ungesättigte Monomere (meist Alkene) unter Öffnung der Doppelbindung zusammen. Das Produkt wird dann entsprechend seiner Monomere benannt (Ethen reagiert zu Polyethen).
Ein so entstandener Polymer besteht aus Tausenden von Monomeren. Man nennt solche Moleküle auch Makromoleküle. Da alle gebildeten Polymerketten eine verschiedene Länge haben, sind die Moleküle eines Kunststoffes also nicht nicht alle gleich groß. Die Folge sind uneinheitliche Molekülmassen und somit keine exakten Schmelz- und Siedepunkte (sondern eher Schmelz- und Siedebereiche).
(Vergleich des Prinzips der freien Hand mit Tanzpaaren paarweise → Aufbruch zur Kette durch einen einzelnen Tänzer )
Radikalische Polymerisation I: Bildung von Polyethylen
[Bearbeiten]Radikalische Polymerisation II: Bildung von Polystyrol (Styropor) aus Styrol
[Bearbeiten]Polystyrol (PS bzw. Polystyren) ist ein meist transparenter Thermoplast mit großer Verbreitung. Er wird als Schaumstoff bzw. Verpackungsstoff verwendet. Er ist gegen Säuren und Laugen unempfindlich, gegenüber apolaren Lösungsmitteln wie z.B. Benzin nicht.
Styropor als Isolierungsmaterial
[Bearbeiten]Abbruchreaktionen: Der Abbruch der radikalischen Kettenreaktion kann durch Vereinigung zweier Radikale (Rekombination) oder durch Bildung von Alkan und Alken durch Übergang eines Wasserstoffatoms erfolgen.
Zusatzinformationen Polystyrol (siehe auch Beständigkeit) Schaumstoff
Kationische und anionische Polymerisation
[Bearbeiten]Neben der Radikalischen Polymerisation ist auch eine Polymerisation durch starke Ionen möglich. Als Kation kann dabei als Startion H+ dienen, also starkes Anion (C4H9)-.
Die Ionen (je nach Mechanismus als Kation oder als Anion - niemals liegen beide vor!) greifen nun jeweils die Mehrfachbindung an, um so die Kettenreaktion zu starten.
Der Kettenabbruch erfolgt entweder durch Zusammentreffen von
a) Kation und einem in der Reaktion entstandenem Anion.
b) Anion und einem in der Reaktion entstandenem Kation.
Zusatzinformation: Polymerisation#Kationische und Anionische Polymerisation
Technisch wichtige Polymere
[Bearbeiten]| Monomer | Abkürzung | Polymer |
|---|---|---|
| Ethen | PE | Polyethen |
| Propen | PP | Polypropen |
| Styrol | PS | Polystyrol (Styropor) |
| Vinylchlorid | PVC | Polyvinylchlorid |
| Methacrylsäureester | PMMA | Polymethacrylsäureester(=Plexiglas, Acrylglas) |
| Tetrafluorethen | PTFE | Polytetrafluorethen |
Kunststoffsynthese (III) durch Polykondensation
[Bearbeiten]Erinnere Dich: Bei der Esterbildung reagieren immer eine Säure und ein Alkohol miteinander. Dabei spaltet sich Wasser ab (=Kondensation).
Da es allerdings auch Mehrfachalkohole (z.B. Glycerin) bzw. Dicarbonsäuren gibt, kann man sozusagen, die Veresterung an beiden Enden der Moleküle durchführen. Es kommt dabei zur Kettenbildung unter vielfacher Wasserabspaltung (=Polykondensation).
Die Reaktion kann anstelle von Diolen auch mit Diaminen durchgeführt werden.
Zwei Typen der Polykondensation im Vergleich
[Bearbeiten]Polyester
[Bearbeiten]Polyester sind Polykondensate. Sie sind Kunststoffe, welche durch eine Verersterung von
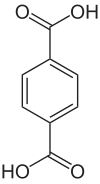
Ethandiol (oder anderer mehrwertiger Alkohole) mit kurzkettigen Dicarbonsäure (z.B. Ethandisäure) in entstehen. Da es sich um eine Verersterung handelt, tritt dabei Wasser aus.
Polyester sind im Gegensatz zu den Ausgangsstoffen hydrophob, da die hydrophilen Gruppen -COOH sowie -OH sich bei der Veresterung verbinden und so ein Großteil des Dipolcharakters verloren geht. Durch diese Wasser abweisende Eigenschaft, trocknen Polyester (z.B. als Kunstfaser in Kleidung) besonders schnell. Der Nachteil ist, dass Polyester allerdings auch keine Körperfeuchtigkeit aufnehmen. In reiner Polyesterkleidung schwitzt man also stärker. Das Tragen ist deshalb auch nicht so angenehm. Die Lösung sind Mischgewebe in denen Polyester mit z.B. Baumwolle vermischt sind. Solche Kleidungsstücke sind in der Regel hautfreundlich, trockenen schneller (obwohl sie auch Schweiß aufnehmen). Außerdem sind sie nach dem Waschen meist knitterfreier.
Zusatzinformation:
Bekannte Polykondensationsprodukte: Die Polyamide - Nylon und Perlon
[Bearbeiten]V: Nylonherstellung
Material: Schutzbrille, Handschuhe, 2 Bechergläser (200 sowie 50/100ml), Glasstab.
Ca. 0,55 g 1,6-Diaminohexan werden in ein Becherglas zu 45 mL Wasser und 2 NaOH-Plätzchen gelöst. Zum Auflösen mit einem Glasstab 2 min. rühren. Einen Tropfen Phenolphtalein zufügen (erhöht die Sichtbarkeit!)
In einem zweiten (100 mL bzw. 50 mL) Becherglas werden vorsichtig mit dem Gemisch aus 1 mL Sebacinsäuredichlorid (bzw. Hexandicarbonsäure-dichlorid) und 15 mL Heptan vermischt. Dieses zweite Gemisch kommt über das erste (Überschichtung). Zum Überschichten kann ein Glastrichter verwendet werden. Nun wartet man ca. 3 min.
Das Produkt entsteht nun an der Phasengrenze als "Haut" und kann mit einer Pinzette herausgezogen und anschließend um einen Holzstab oder ein Reagenzglas gewickelt werden.
Wenn man keine Lust mehr zum Drehen hat, kann man das Gemisch auch mit dem Holzstab umrühren, so dass die Reaktion wesentlich schneller abläuft. Es entsteht ein Klumpen. Die Entfärbung des Phenolphtaleins zeigt das Ende der Reaktion an.
Zusatzinformationen:
- Technische Synthese von Nylon 66 aus AH-Salz: Adipinsäure + Hexamethylendiamin
- Perlon (= Nylon 6) aus H2N-(CH2)5-COOH über Caprolactam
- Kevlar: ...-CO-C6H4-NH-[-CO-C6H4-NH-]n-CO-C6H4-NH-... aus p-Aminobenzoesäure
Bekannte Polykondensationsprodukte: Polyester
[Bearbeiten]V1: 1ml Glycerin und 3,5 g Bernsteinsäure (Butandisäure) werden bei kleiner Flamme vorsichtig in einem Reagenzglas (fast waagerecht halten und leicht schwenken!) erhitzt.
Zum Überprüfen weiterer Produkte wird dabei ein angefeuchtetes Indikatorpapier an die Öffnung des RG gehalten. Die ursprünglich dünnflüssige Masse wird nach einiger Zeit dickflüssig. Beim Abkühlen wird sie fest.
Man kann auch anstelle der Bernsteinsäure auch andere Dicarbonsäuren verwenden:
Polyester aus Benzol-1.2-dicarbonsäure (=Phthalsäure)
3 g Phthalsäureanhydrid und z.B. 3 mL Propantriol in ein RG geben, 20 min über kleiner Flamme erhitzen → Glyptal, Lackrohstoff
Polyester aus Glycerin und Citronensäure
1,9 g Citronensäure (bzw. 2,1 g Citronensäuremonohydrat) und 6 Tropfen Glycerin werden vermischt und entsprechend den vorherigen Versuchen 2 min. erwärmt.
Es entsteht ein linearer Polyester (lineare Polyester bilden Thermoplaste)
Zusatzinformationen:
- Polyethylenterephthalat (PET)
Windelversuch
[Bearbeiten]Babywindeln müssen sehr viel Flüssigkeit aufnehmen. Normale Watte kann ca. 50% ihres Eigengewichtes an Wasser tragen, danach tropft es heraus. Auch durch Druck, z.B. durch Sitzen auf der Watte, kann Flüssigkeit austreten.
Aus diesem Grunde ist heute ein wichtiger Bestandteil von vielen Windel ein „Superabsorber“ aus vernetzten Polyacrylfasern. Die schwach durch Butan-1,4-diol vernetzten Polyacrylsäuren quellen bei Kontakt mit Wasser zu einem Gel auf. In diesem Zustand befinden sich zwischen den Fasern große Lücken, in die die Wassermoleküle eingelagert werden. Selbst unter Druck bleibt das Wasser so chemisch gebunden. 1g Gel kann dabei bis zur 20-30fachen Menge seines Eigengewichtes fest binden.
Tipps für die Versuche:
- Gewogen wird in Bechergläsern, so dass kein Wasser in die Waage fließt!
- Kein Superabsorber einatmen, in die Augen oder in das Waschbecken!
V1: Eine Windeleinlage wird von den Klebebändern befreit und in ca. 4 Längstreifen geschnitten. Diese wird gewogen und dann in Wasser getaucht und erneut gewogen. Zum Vergleich wird der Versuch mit einem gleichschweren Papiertaschentuch wiederholt. Ein Auspressen beider Streifen kann abschließend versucht werden.
V2: Ein Streifen einer Windel wird über einem Blatt Papier zwischen den Fingern zerrieben und dann das gewonnene Pulver durch ein Teesieb von den überflüssigen Zellstofffasern befreit.
Die so gereinigten Superabsorberkörner werden in ein Reagenzglas gefüllt und mit einem Folienstift der Stand markiert. Nun wird solange Wasser zugefügt, wie es vom Absorber gehalten wird.
Hilfen zur Auswertung der Versuche:
Propensäure (=Acrylsäure) ist eine mittelstarke Carbonsäure mit stechend riechendem Geruch. Reagiert sie mit einem Radikal (Startersubstanz z.B. ein Peroxid vom Typ: R-O-O-R‘), bildet sich Polyacrylsäure.
1. Nach welchem Reaktionsmechanismus reagieren beide Stoffe zu Polyacrylsäure? Formuliere den Mechanismus inklusive des Kettenabbruchs.
Tipp: notiere die Acrylsäure in der folgenden Form: 
2. Gibt man zu Polyacrylsäure (=Polypropensäure) nun Butan-1,4-diol hinzu, so werden die Polyacrylsäurefasern untereinander vernetzt, so dass eine Netzstruktur entsteht. Bei diesem Vorgang wird Wasser frei. Je mehr Butan-1,4-diol dabei reagiert, desto stärker ist logischerweise die Vernetzung.
a) Stelle den Mechanismus zur Bildung des vernetzen Superabsorbers auf (Formelausschnitte reichen!). Wie nennt man diese Reaktion?
b) Wie kann man sich und die Wasseraufnahmefähigkeit des Superabsorbers erklären?
c) Inwiefern hat der Vernetzungsgrad Einfluss auf die Wasserabsorbtionsfähigkeit des Produktes?
Kunststoffsynthese (IV) durch Polyaddition
[Bearbeiten]Die Polyaddition ist wie die Polymerisation eine ständig fortlaufenden Reaktion. Allerdings kommen keine Radikale zum Einsatz. Als Ausgangsstoffe (Edukte) werden mindestens zwei verschiedene Moleküle verwendet (so genannte bifunktionelle Moleküle). Es entstehen keine Nebenprodukte (wie z.B. das Wasser bei der (Polykondensation).
Das wichtigste Kennzeichen ist dabei der Übergang von Wasserstoffatomen von einem Monomer zum anderen.
Durch Polyaddition werden z.B. Polyurethane hergestellt. Diese finden als Schaumstoffe in Verpackungsstoffen, Schuhsohlen sowie Matratzen und Kissen wieder. Das Aufschäumen kommt dabei durch den Einschluss von Kohlenstoffdioxid, welches sich bei der Reaktion eines Ausgangsstoffes mit Wasser bildet.
So können sie auch in Hauswände zur Wärmeisolierung gespritzt werden - die Zugabe von Wasser startet dann den Schaumvorgang.
Beispiel: Bildung von Polyurethan
[Bearbeiten]Polyurethan entsteht durch eine Polyaddition eines Diisocyanats (Cyanat: N=C=O-H, bzw. N≡C-O-H) mit einem Diol (Zweifachalkohol). Das Kohlenstoffatom ist durch die elektronenziehende Wirkung des Stickstoffes positiviert, so dass es Elektronen vom Sauerstoff des Alkohols an sich zieht, so dass die OH-Gruppe schließlich ihr Proton an den Stickstoff abgibt.

Es bildet sich ein Polymer. Aber, wie kommt es zum Aufschäumen? In einer Nebenreaktion entsteht Kohlenstoffdioxid durch die Reaktion von Diisocyanat mit Wasser. Das entstehende Kohlenstoffdioxid lässt den Kunststoff aufquellen:
O=C=N–R1–N=C=O + H2O –→ H2N–R1–N=C=O + CO2 ↑
Versuch: Herstellung eines Polyurethanhartschaums
[Bearbeiten]Im Abzug arbeiten, Schutzbrille und Schutzhandschuhe benutzen!
In einen Plastikbecher (z.B. Getränkebecher oder Joghurtbecher wird der Boden gut mit Desmophen® (Polyol) und dem Aktivator bedeckt. Dann wird ungefähr die gleiche Menge Desmodur® (Isoycanat) sowie zwei Spritzer Wasser hinzugefügt.
Mit einem Holz- oder Glasstab wird gerührt, bis eine Reaktion einsetzt. Das Volumen des sich bildenden Schaumstoffs ist bis zu 30mal so größer, als das der Edukte.
Zusatzinformationen
Vergleich der Polymertypen nach ihren Eigenschaften
[Bearbeiten]| Duroplaste sind nicht verformbar, thermisch nicht verformbar | eng vernetzte Kohlenstoffketten | Silikonkautschuk | Polyurethane | |
| Elastomere sind elastische Kunststoffe, welche auf Zug oder Druck hin sich verformen. | weitmaschige vernetzte Kohlenstoffketten | Synthetischer Kautschuk | Phenolharzes, Melaminharze, Polyesterharze, Silikone, | Polyurethane, Epoxidharze |
| Thermoplaste sind beim Erwärmen verformbar | lineare oder verzweigte Kohlenstoffketten | Polyethen (PE), Polypropylen (PP), Polystyrol (PS), Polyvinylchlorid (PVC) | Polyamiden, Polyester, Polycarbonate, | (lineare) Polyurethane |
Vergleich der „Plaste“ (Thermoplast & Duroplast)
[Bearbeiten]Verwendung der Plaste:
- Tonbänder, Kassetten, Disketten, Speichermedien
- Kunststoffbrillengläser
- Medizin (Zahnprothese, Sehnenersatz, Knochenersatz...)
| Thermoplast | Duroplast |
|---|---|
| * erweicht beim Erwärmen | * zersetzt sich beim Erwärmen |
| * ist plastisch verformbar | * ist nicht plastisch verformbar |
Kunststoffrecycling
[Bearbeiten]Versuch zum CD Recycling
a) CD Recycling
[Bearbeiten]Material: Schere, 2 Glasschalen, Plätzchenform, Pinzette, Schlifffett, sonstiges Labormaterial, Alufolie
Schutzvorkehrungen beachten: Abzug, Kittel, Handschuhe, Schutzbrille!
- V:
- Eine CD mit 40ml konzentrierte Salpetersäure übergießen. (Vorsicht nitrose Gase entstehen!)
- Nach 2min hat sich die obere Lackschicht gelöst. Reste evtl. mit einer Pinzette, einem Glasstab oder einem Kunststoffspatel entfernen. Man erkennt die freie Aluminiumschicht.
- Zugabe von 40ml konzentrierter Salzsäure. Die Aluminiumschicht wird so abgelöst. Zurück bleibt die Polycarbonat Scheibe
- Die Scheibe in ein zweites Gefäß geben und unter fließend Wasser reinigen.
- Ein Teil der Polycarbonatscheibe wird mit einer Schere in ca. 1cm2 große Schnipsel geschnitten.
- Man erhitzt auf einer heißen Platte (Keramik- oder Ceranplatte) bedeckt diese mit Aluminiumfolie und schmilzt die Polycarbonatschnipsel in einer (vorher mit Schlifffett gefetteten) Plätzchenform aus Metall (max. 1cm hoch befüllen).
- Wenn man möchte, kann man das noch heiße Polycarbonat mit Thymolblau oder Methylrot färben.
Chemiefasern
[Bearbeiten]Man unterscheidet:
Natürliche „Chemiefasern“: Aramid, Elastan, Elastodien, Fluoro, Modacryl, Polyacryl, Polyamid, Polyester, Polyethylen, Polypropylen, Polyvinylalkohol, Polyvinylchlorid, Polyvinylidenchlorid,
Synthetische „Chemiefasern“
zellulosische Chemiefasern:
- Viskose
- Modal
- Cupro
- Acetat
- Triacetat
- Alginat
- Gummi
- ↑ Vergleiche: auch bei Diamanten sind die Kohlenstoffe untereinander stark vernetzt.