Physikalische Grundlagen der Nuklearmedizin/ Atom-und Kernstruktur
Einleitung
[Bearbeiten]Der Großteil der Inhalte dieses Kapitels entspricht dem Stoff des Fachs Physik an Gymnasien. Um die Grundlage für die nachfolgenden Kapitel zu bilden, wird dieser Stoff hier nochmals behandelt. Dieses Kapitel soll also vorrangig dazu dienen, bereits Erlerntes wieder aufzufrischen.
Atomstruktur
[Bearbeiten]Das Atom ist ein grundlegender Baustein der gesamten Materie. Ein einfaches Modell des Atoms besagt, dass es aus zwei Komponenten besteht: Einem Atomkern, welcher von einer Hülle aus Elektronen (siehe auch Elektronenhülle) umgeben ist.
Der Atomkern ist elektrisch positiv geladen, die Elektronen sind hingegen negativ geladen. Weil sich positive und negative Ladungen gegenseitig anziehen, ist die Elektronenhülle an den Kern gebunden.
Diese Situation hat eine gewisse Ähnlichkeit mit der „Hülle“ aus Planeten, die unsere Sonne umkreisen und durch die Schwerkraft an sie gebunden sind.
Der Radius eines Atoms beträgt ungefähr 10-10 Meter, während der Radius eines Atomkerns circa 10-14 Meter beträgt. Der Kern ist also etwa zehntausend mal kleiner als die Hülle. Analog dazu kann man sich einen Golfball in der Mitte eines Fußballstadions vorstellen. Der Golfball ist der Atomkern, das Stadion das Atom, und die Elektronen schwirren irgendwo im Bereich der Zuschauerplätze um das Stadion herum. Das bedeutet, dass das Atom hauptsächlich aus leerem Raum besteht. Jedoch ist die Situation weitaus komplexer als dieses einfache Modell, und wir werden uns später mit den physikalischen Kräften beschäftigen, welche das Atom zusammenhalten.
Chemische Phänomene sind die Wechselwirkungen zwischen den Elektronen verschiedener Atome. Verbinden sich zum Beispiel zwei Wasserstoffatome zu einem Wasserstoffmolekül so sind nur die Elektronen an der Bindung beteiligt, die Kerne bleiben von der Bindung weitgehend unbehelligt und tragen auch nicht zu ihr bei. Radioaktivität entsteht dagegen durch Veränderungen innerhalb eines Kerns (siehe auch Radioaktivität). An ihr sind die Elektronen daher üblicherweise nicht beteiligt. (Eine Ausnahme ist der Zusammenstoß eines Elektrons mit einem Kern, den wir später unter Begriff Elektroneneinfang behandeln werden.)
Der Atomkern
[Bearbeiten]Eine einfache Beschreibung des Atomkerns besagt, dass er aus Protonen und Neutronen zusammengesetzt ist. Diese zwei Bausteine werden kollektiv Nukleonen genannt, was bedeutet, dass sie Bausteine des Atomkerns (Latein. nucleus „Kern“) sind.
Wenn man die Massen der Nukleonen vergleicht, hat ein Proton etwa gleich viel Masse wie ein Neutron, aber beide sind 2000 mal schwerer als ein Elektron. Also ist der Großteil der Masse eines Atoms in seinem kleinen Kern konzentriert.
Elektrisch gesehen ist das Proton positiv geladen und das Neutron hat keine Ladung. Insgesamt ist ein Atom für sich gesehen elektrisch neutral (wobei freie Atome praktisch nur in Edelgasen vorkommen). Die Anzahl Protonen im Kern muss daher gleich der Anzahl der Elektronen, die den Atomkern umkreisen, sein.
Klassifikation der Atomkerne
[Bearbeiten]Der Begriff Ordnungszahl (oder auch Kernladungszahl) ist in der Kernphysik als die Anzahl der Protonen im Atomkern definiert und hat das Symbol Z. Da es in einem Atom gleich viele Elektronen wie Protonen gibt, ist die Ordnungszahl gleich der Anzahl Elektronen im Atom. Ebenfalls werden in der Chemie die Elemente nach dieser Zahl im Periodensystem geordnet.
Hier klicken um eine interaktive Website mit Details zum Periodensystem der Elemente in englischer Sprache zu betrachten
Die Massenzahl ist definiert als die Anzahl Nukleonen, also der Anzahl Protonen plus der Anzahl Neutronen. Sie hat das Symbol A.
Es ist möglich, dass Atomkerne eines bestimmten Elements zwar die gleiche Anzahl Protonen haben (was ja ein Element definiert), aber nicht unbedingt die gleiche Anzahl Neutronen, das heißt, dass sie dieselbe Ordnungszahl haben, aber nicht unbedingt die gleiche Massenzahl. Solche Atome nennt man Isotope. Alle Elemente haben Isotope und die Anzahl reicht von drei Wasserstoffisotopen bis zu über 30 Isotopen für Cäsium und Barium. Die Chemie bezeichnet die verschiedenen Elemente auf eine relativ einfache Art mit Symbolen wie H für Wasserstoff (engl. hydrogen) oder He für Helium. Das Klassifikationsschema zur Identifikation unterschiedlicher Isotope basiert darauf, vor das Elementsymbol die hochgestellte Massenzahl und die tiefgestellte Kernladungszahl zu schreiben; die Kernladungszahl kann auch weggelassen werden, weil sie durch das Elementsymbol bereits festgelegt ist. Man verwendet also folgende Schreibweise, um ein Isotop vollständig zu identifizieren:
wobei X das Elementsymbol des chemischen Elementes bezeichnet.
Wir nehmen den Wasserstoff als Beispiel. Wie bereits gesagt, hat er drei Isotope:
- Das häufigste Isotop besteht aus einem einzigen Proton, welches von einem Elektron umkreist wird,
- das zweite Isotop hat im Atomkern ein zusätzliches Neutron,
- und das dritte hat zwei Neutronen im Kern.
Eine einfache Illustration dieser drei Isotope ist in der Abbildung unten gezeigt. Sie ist jedoch nicht maßstabsgetreu, man beachte die obige Bemerkung bezüglich der Größe des Kerns im Vergleich zur Größe des Atoms. Nichtsdestotrotz ist diese Abbildung nützlich, um zu zeigen wie Isotope klassifiziert und benannt werden.
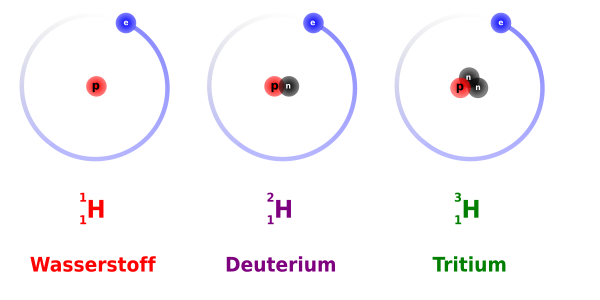
Das erste Isotop, bekannt als Wasserstoff, hat die Massenzahl 1, die Ordnungszahl 1 und wird folgendermaßen geschrieben:
Das zweite Isotop, genannt Deuterium, hat die Massenzahl 2, die Ordnungszahl 1 und wird so geschrieben:
Und als dritten im Bunde haben wir ein Isotop namens Tritium mit (Massenzahl 3, Ordnungszahl 1):
Genau nach dem selben Schema bezeichnet man alle anderen Isotope. Der Leser sollte nun in der Lage sein, zu erkennen, dass das Uranisotop 92 Protonen, 92 Elektronen und 236 - 92 = 144 Neutronen hat.
Zum Abschluss dieser Klassifikation müssen wir noch eine weitere Notation erklären. Man bezeichnet Isotope auch mit dem ausgeschriebenen Namen ihres Elements gefolgt von ihrer Massenzahl. Zum Beispiel können wir Deuterium ebenso gut als Wasserstoff-2 und als Uran-236 bezeichnen.
Bevor wir das Thema der Klassifikationsschemata abschließen, wollen wir uns noch mit den Unterschieden zwischen Chemie und Kernphysik beschäftigen. Man erinnert sich, dass ein Wassermolekül aus zwei an ein Sauerstoffatom gebundenen Wasserstoffatomen besteht. Die chemische Bindung zwischen diesen Atomen entsteht, indem die Elektronenhüllen der Atome miteinander wechselwirken. Theoretisch könnten wir ein Glas Wasser herstellen, wenn wir Sauerstoff und Wasserstoffatome millionenfach zu solchen Molekülen zusammenfügten. Wir könnten auf dieselbe Art und Weise auch ein Glas mit schwerem Wasser herstellen, indem wir Deuterium anstelle von Wasserstoff verwenden. Chemisch betrachtet wäre das zweite Wasserglas dem ersten sehr ähnlich. Aus der Sicht des Physikers fiele jedoch sofort auf, dass das zweite Glas schwerer ist als das erste, da der Deuteriumkern zweimal so schwer wie der Wasserstoffkern ist. Deshalb wird diese Art von Wasser in der Tat auch schweres Wasser genannt.
Vereinfacht gesagt, befasst sich der Chemiker mit der Veränderung und Interaktion von Elektronenhüllen als Voraussetzung für den Aufbau komplexer Moleküle, während sich der Kernphysiker eher für die Eigenschaften der Atomkerne interessiert.
Atommasseneinheit
[Bearbeiten]Die SI-Einheit der Masse ist das Kilogramm. Zur Beschreibung der Eigenschaften von Atomen und Kernen ist es jedoch zu groß. Daher verwendet man die Atomare Masseneinheit (amu), die der Einheit Dalton entspricht. Sie kann als ein Zwölftel der Masse eines Kohlenstoffatoms (12C) definiert werden und entspricht damit ungefähr der Masse eines Protons oder Neutrons. Ihr Zahlenwert in Kilogramm ist 1,6605387313 · 10 -27. Dies ist ein Millionstel Millionstel Millionstel Millionstel Tausendstel Kilogramm.
Die Massen des Protons mp und des Neutrons mn sind:
und
wobei ein Elektron lediglich eine Masse von nur 0,00055 amu besitzt.
Bindungsenergie
[Bearbeiten]Wir müssen uns nun mit der Stabilität der Kerne auseinandersetzen. Bisher wissen wir, dass ein Kern ein winzig kleines Gebiet im Zentrum eines Atoms füllt und aus neutralen und positiv geladenen Teilchen besteht. Bei großen Kernen wie zum Beispiel Uran (Z=92) befindet sich also eine große Anzahl von Protonen im einem winzigen Gebiet im Zentrum des Atoms. Man kann sich daher fragen warum ein Kern mit so einer großen Anzahl von positiven Ladungen auf so engem Raum nicht auseinander fliegt. Wie kann ein Kern bei so einer starken Abstoßung zwischen seinen Komponenten stabil sein? Sollten die negativ geladenen Elektronen in der Atomhülle nicht die Protonen vom Kern wegziehen?
Betrachten wir zum Beispiel den Kern Helium-4 (4He). Er besteht aus zwei Protonen und zwei Neutronen, so dass wir uns aus dem bisher Gelernten seine Masse wie folgt berechnen würden:
plus die
Somit würden wir eine
erwarten.
Die experimentell bestimmte Masse von 4He ist etwas geringer - nämlich nur 4,00260 amu. Es gibt also einen Unterschied von 0,03038 amu zwischen unserer Erwartung und der tatsächlich gemessenen Masse. Man kann diesen Unterschied von lediglich 0,75% als vernachlässigbar ansehen. Jedoch sollte man bedenken, dass dieser Massenunterschied immerhin der Masse von 55 Elektronen entspricht und somit Anlass zur Verwunderung bietet.
Man kann sich die fehlende Masse als eine Form von umgewandelter Energie vorstellen, welche den Kern zusammenhält. Diese nennt man Bindungsenergie.
Wie das Kilogramm als Einheit der Masse im Bezug auf Kerne, ist auch das Joule als Einheit zu groß, um die Energien zu beschreiben, die den Kern zusammenhalten. Die Einheit um Energien in der atomaren Größenordnung zu messen ist das Elektronenvolt (eV).
Ein Elektronenvolt ist definiert als die Menge an Energie, die ein Teilchen mit der Ladung 1 e (Elementarladung) gewinnt, wenn es durch ein Potential von einem Volt beschleunigt wird. Diese Definition ist für uns hier von geringem Nutzen und wird lediglich aus Gründen der Vollständigkeit mit angegeben. Man denke hierüber nicht zu viel nach, sondern nehme nur zur Kenntnis, dass es sich um eine Einheit zur Darstellung sehr kleiner Energien handelt, die jedoch nichtsdestoweniger auf atomaren Skalen sehr nützlich ist. Für nukleare Bindungsenergien ist sie jedoch ein wenig zu klein, daher wird häufig das Megaelektronenvolt (MeV) verwendet.
Albert Einstein beschrieb die Äquivalenz von Masse und Energie auf atomaren Skalen durch folgende Gleichung:
mit der Lichtgeschwindigkeit c
Man kann berechnen, dass einer Masse von 1 amu eine Energie von 931.48 MeV entspricht. Daher entspricht die oben gefundene Differenz zwischen der berechneten und gemessenen Masse eines 4He Atoms von 0,03038 amu einer Energie von 28 MeV. Dies entspricht ca. 7 MeV für jeden der vier Nukleonen im Kern.
Stabilität der Kerne
[Bearbeiten]Bei den meisten stabilen Isotopen liegt die Bindungsenergie pro Nukleon zwischen 7 und 9 MeV. Da diese Bindungsenergie von der Anzahl der Nukleonen im Kern abhängt, also der Massenzahl A, und die elektrostatische Abstoßung vom Quadrat der Kernladungszahl Z2, kann man schließen, dass für stabile Kerne Z2 von A abhängig seien muss.
Erhöht man die Anzahl der Protonen im Kern, so erhöht sich auch die elektrostatische Abstoßung der Protonen untereinander, daher muss die Anzahl der Neutronen überproportional ansteigen um diesen Effekt durch Erhöhung der Bindungsenergie ausgleichen zu können, damit der Kern stabil gebunden bleiben kann.
Wie wir schon früher bemerkt haben gibt es eine Reihe von Isotopen für jedes Element im Periodensystem. Für jedes Element, findet man, dass das stabilste Isotop eine bestimmte Anzahl von Neutronen im Kern hat. Trägt man die Anzahl der Protonen im Kern gegen die der Neutronen für diese stabilsten Isotope auf so erhält man die Nukleare Stabilitätskurve:

Man sieht, dass die Anzahl der Protonen für kleine Kerne der Anzahl der Neutronen entspricht. Jedoch steigt die Anzahl der Neutronen mit zunehmender Größe des Kerns stärker an als die Anzahl der Protonen, so dass die Stabilität größerer Kerne gewährleistet ist. Anders ausgedrückt müssen mehr Neutronen vorhanden sein um durch ihre Bindungsenergie der elektrostatischen Abstoßung der Protonen entgegen zu wirken.
Radioaktivität
[Bearbeiten]Es gibt etwa 2450 bekannte Isotope von etwa einhundert Elementen im Periodensystem. Man kann sich leicht die Größe der Liste der Isotope im Vergleich zu der des Periodensystems vorstellen. Die instabilen Isotope liegen oberhalb oder unterhalb der Stabilitätskurve. Diese instabilen Isotope entwickeln sich zur Stabilitätskurve hin, indem sie sich durch einen Prozess namens Spaltung teilen oder indem sie Teilchen und/oder Energie in Form von Strahlung aussenden. Alle diese Prozesse werden unter dem Begriff Radioaktivität zusammengefasst.
Es macht Sinn sich ein wenig näher mit dem Thema Radioaktivität zu beschäftigen. Was soll denn zum Beispiel die Stabilität von Atomkernen mit einem Radio zu tun haben? Aus historischer Sicht führe man sich vor Augen, dass man um 1900 als man diese Strahlungen entdeckte nicht genau wusste womit man es zu tun hatte. Als Leute wie Henri Becquerel und Marie Curie anfangs an seltsamen Aussendungen natürlicher Materialien arbeiteten glaubte man, dass diese Strahlungen etwas mit einem anderen damals noch nicht recht verstandenem Phänomen, dem der Radiokommunikation, zu tun hätten. Es scheint daher verständlich, dass einige Leute damals annahmen, das diese Phänomene irgendwie verwandt waren und die Materialien die Strahlung aussandten die Bezeichnung radioaktiv erhielten. (Anm. d. Ü: γ-Strahlung ist genauso wie Radiowellen elektromagnetische Strahlung, Radioaktivität umfasst jedoch noch viele weitere Strahlungen außer der elektromagnetischen.)
Heute wissen wir, dass diese Phänomene nicht direkt verwandt sind, behalten jedoch den Begriff Radioaktivität bei. Es sollte jedoch bis hierhin klar geworden sein, dass sich der Begriff Radioaktivität auf Teilchen oder Energie bezieht, die von instabilen Isotopen emittiert werden. Instabile Isotope, z.B. solche mit zu wenigen Protonen um stabil zu bleiben heißen radioaktive Isotope oder Radioisotope. Der Begriff Radionuklid wird auch gelegentlich verwendet.
Man findet nur etwa 300 der 2450 Isotope in der Natur. Alle anderen wurden von Menschen künstlich erzeugt. Die 2150 künstlichen Isotope wurden seit 1900, die meisten von ihnen sogar nach 1950 erstmalig erzeugt. Siehe auch Interaktive Tabelle der medizinisch verwendeten Radioisotope
Wir werden auf die Produktion von Radioisotopen im letzten Kapitel dieses Wikibooks zurückkommen und werden uns nun die Arten der Strahlung näher anschauen, die von Radioisotopen emittiert werden.
Weiterführende Links (englisch)
[Bearbeiten]- Marie and Pierre Curie and the Discovery of Polonium and Radium - an historical essay from The Nobel Foundation.
- Natural Radioactivity - an overview of radioactivity in nature - includes sections on primordial radionuclides, cosmic radiation, human produced radionuclides, as well as natural radioactivity in soil, in the ocean, in the human body and in building materials - from the University of Michigan Student Chapter of the Health Physics Society.
- The Particle Adventure - an interactive tour of the inner workings of the atom which explains the modern tools physicists use to probe nuclear and sub-nuclear matter and how physicists measure the results of their experiments using detectors - from the Particle Data Group at the Lawrence Berkeley National Lab, USA and mirrored at CERN, Geneva.
- www.t-pse.de/index-en.html - a smart, interactive Periodic Table of the Elements for offline and online use; also available in German (www.t-pse.de) and French (www.t-pse.de/index-fr.html)
- WebElements - an excellent web-based Periodic Table of the Elements which includes a vast array of data about each element - originally from Mark Winter at the University of Sheffield, England.














