Schilddrüse: Krankheit
Zurück zur Schilddrüse
| ICD-10-GM 2007 |
|---|
| E00-E07 - Krankheiten der Schilddrüse |
Allgemeines
[Bearbeiten]Schilddrüsenkrankheiten treten mit ungefähr 3:1 häufiger bei Frauen als bei Männeren auf. Dies gilt nicht nur für die Jodmangelkrankheiten wie den Kropf und die Autonomen Knoten , sondern auch für die Autoimmunerkrankungen der Schilddrüse. In Ländern mit einer ausreichenden Jodversorgung sind Krankheiten der Schilddrüse weitaus seltener als in Jodmangelgebieten.
Häufige Krankheiten
[Bearbeiten]Die häufigsten Krankheiten der Schilddrüse sind:
- Jodmangelstruma = Kropf
- ohne Knoten, diffus
- mit Knoten
- Überfunktion der Schilddrüse
- Morbus Basedow
- Autonome Adenome
- Entzündungen der Schilddrüse
- Unterfunktion der Schilddrüse
- Schilddrüsenkrebs
- Kretinismus
Daneben gibt es einige seltene Schilddrüsenkrankheiten.
Iodmangel
[Bearbeiten]Allgemeines zum Thema Iodmangel
[Bearbeiten]Iodmangel entsteht, wenn der Körper über die Nahrung oder das Trinkwasser zu wenig des Spurenelements Iod aufnimmt. Iod wird nahezu ausschließlich zum Aufbau der Schilddrüsenhormone benötigt; ein Erwachsener benötigt täglich mindestens ca. 150 µg. Die Schilddrüse kann bei guter Versorgung 10 mg Iod bevorraten, das entspricht dem Iodbedarf für drei Monate. Die Deutsche Gesellschaft für Ernährung empfiehlt zur Sicherheit höhere Tagesdosen (Stand: 2005):
| Personengruppe | Empfohlene tägliche Aufnahme |
|---|---|
| Säuglinge | 50 - 80 µg |
| Kinder bis zum 9. Lebensjahr | 100 - 140 µg |
| Jugendliche und Erwachsene | 180 - 200 µg |
| Schwangere Frauen | 230 µg |
| Stillende Mütter | 260 µg |
Die Schilddrüse kann etwa 40 % des verzehrten Iods aus dem Blut aufnehmen und anreichern. Der Rest wird über den Darm und die Nieren ausgeschieden. Die Iodmenge, die täglich über den Urin ausgeschieden wird, ist ein gutes Maß für die Iodversorgung des Organismus. Der Messwert der täglichen Iodausscheidung wird auf Kreatinin bezogen, ein Stoffwechsel-Abfallprodukt, welches ebenfalls über den Urin ausgeschieden wird; so kann man einen altersunabhängigen Parameter erhalten. Der Sollwert beträgt nach Empfehlung der DGE 150 µg/g Kreatinin.
Die Weltgesundheitsorganisation (WHO) teilt den Iodmangel folgendermaßen ein:
| WHO-Grad des Iodmangels | Iodausscheidung |
|---|---|
| Kein Iodmangel | > 150 µg Iod / g Kreatinin im Urin |
| 0 | 100 - 150 µg/g |
| I | 50 - 100 µg/g |
| II | 180 - 200 µg |
| III | 25 - 50 µg/g |
| IV | < 25 µg/g |
Ursachen
[Bearbeiten]In Mitteleuropa enthalten die landwirtschaftlich genützten Böden vergleichsweise wenig Iodid (Salzverbindungen des Iods). Dies gilt nicht nur für die Alpenregion, auch die Böden der Küstenebenen (Dänemark, Niederlande) sind relativ iodarm.
Europäischer FOREGS-Atlas, 2005 (Forum of the European Geological Surveys Directors, Text/PDF, Karte).
Die Böden der humiden Klimazonen sind deswegen so arm an Iod, weil dieses im Laufe der Erdgeschichte ausgewaschen wurde. Der Iodgehalt in der sekundären Umwelt (Wasser, Ackerböden) ist vielen Einflussfaktoren unterworfen. Meeresferne, gebirgige Regionen sind eher von Iodmangel betroffen als das Flachland
Symptome
[Bearbeiten]Geringer Iodmangel verursacht zunächst keine Symptome. In der Embryonalentwicklung und in den ersten drei Lebensjahren kann es aber zu einer Beeinträchtigung der Hirnentwicklung mit resultierenden Entwicklungsverzögerungen (Motorik, Sprache, Verhalten, Aufmerksamkeit und Intelligenz) kommen. Der über Jahrzehnte beständige Wachstumsreiz auf das Schilddrüsengewebe kann einen Kropf verursachen, Schilddrüsenknoten oder krankhaft erhöhte Hormonproduktion.
Ausgeprägter Iodmangel kann eine Unterproduktion von Schilddrüsenhormon verursachen, allerdings kommt dies in Mitteleuropa aufgrund der gestiegenen Iodaufnahme praktisch nicht mehr vor. Hauptursache für Unterfunktionen ist heute die Hashimoto-Thyreoiditis, die nicht auf Iodmangel beruht, sondern von einer Überversorgung mit Iod tendenziell begünstigt wird. Früher drohten bei mangelversorgten Müttern auch Fehlgeburten und Fehlbildungen des Kindes. Kleinkinder konnten unbehandelt an schweren Entwicklungsstörungen leiden ( Kretinismus).
Vorbeugung
[Bearbeiten]Bereits im alten China empfahlen Ärzte den Verzehr von Meeresalgen und Schwämmen. In Meersalz ist entgegen der geläufigen Vorstellung kaum Iod enthalten. Seit dem 19. Jahrhundert ist reines Iodid verfügbar. In Fleischwaren, Milchprodukten, Brot, Fertiggerichten, Kantinenessen und handelsüblichem Kochsalz wird es zur Steigerung der Iodversorgung auf freiwilliger Basis zugesetzt. Iodsalz enthält in Deutschland 20 µg Iod pro g Salz in Form von Kaliumiodat; in der Schweiz liegt die Konzentration nicht höher als in Deutschland - jedoch der Anteil des Iodsalzes bei den gewerblichen Lebensmitteln (Schweiz: um 70%, Deutschland: um 30%). Die haushaltsübliche Iodsalzmenge erhöht die Iodversorgung der Konsumenten um ca. 20 µg täglich, hinzu kommt das Iod in Fertignahrungsmitteln. Außerdem wird in mehreren Ländern, unter anderem in Deutschland, das Tierfutter iodiert. Grenzwerte legt die EU fest.
In Gebieten, in denen eine Salziodierung nicht möglich ist, kann im Ein- oder Zweijahresrythmus mit einer mit Iod angereicherten Ölkapsel supplementiert werden. Dies ist meist in Entwicklungsländern der Fall, wenn die Salzversorgung dezentralisiert ist, oder die Salzgewinnung privat erfolgt.
Eine gesetzlich vorgeschriebene Iodprophylaxe gibt es
- in der Schweiz,
- in Österreich,
- den USA
sowie bis zur Wiedervereinigung in der DDR. Im vereinigten Deutschland setzt der Gesetzgeber auf Freiwilligkeit.
Situation in Deutschland
[Bearbeiten]Zahlreiche epidemiologische Arbeiten der letzten Jahrzehnte belegen den natürlichen Iodmangel in Deutschland. Die größte Studie (ca. 6000 Personen) wurde von Hampel et al. 1993-1994 erhoben und 1995 vorgelegt. Die durchschnittliche Urin-Iodausscheidung betrug 72 µg Iod pro g Kreatinin.
- Nur 9 % der Probanden war ausreichend (> 150 µg/g) mit Iod versorgt.
- 17 % hatten einen Iodmangel Grad 0 (WHO),
- 25 % Grad I,
- 17 % Grad II und
- 2 % Grad III.
Bewohner der Küstenregionen hatten keine höhere Iodausscheidung als die Einwohner der Mittelgebirge und des Voralpenlandes.
Die Iodmangelsituation führte noch Ende der 90er Jahre in Deutschland zu ca. 100.000 Schilddrüsen-Operationen jährlich. Iodsalz war zwar schon seit 1959 verfügbar, jedoch bis 1981 zunächst nur für Krankenbehandlungen zugelassen. Erst 1989 wurde es in die Zusatzstoffzulassungsverordnung aufgenommen und in den folgenden Jahren auch die Deklarationspflichten für die Produzenten reduziert.
Durch die Öffentlichkeitsarbeit der Bundeszentrale für gesundheitliche Aufklärung und des industriefinanzierten Arbeitskreises Jodmangel und die zunehmende Verwendung von Iod-angereichertem Speisesalz in Haushalten (83 %), in Großküchen und in der Nahrungsmittelindustrie (29 %) hat sich seither die Iodausscheidung nach neueren Studien deutlich erhöht, vor allem bei Kindern. Flächendeckende Daten liegen noch nicht vor, doch ist wegen der Freiwilligkeit dieser Maßnahmen mit hohen regionalen und individuellen Schwankungen zu rechnen. Auch die neuesten Studien zeigen immer noch einen hohen Anteil von unterversorgten Personen. Die Messungen von Hampel et al. 2001 an 3000 Schulkindern aus 128 Städten in Deutschland ergaben z.B. eine mittlere Iodausscheidung von 148 µg/g, jedoch hatten 27 % noch immer einen Iodmangel Grad I oder schlechter. Ein Bericht der WHO gruppiert Deutschland im Jahr 2003 als "optimal versorgt" (bis auf Schwangere und Stillende). Nach Vorgabe der WHO sollten alle 5 Jahre flächendeckende Daten zur Iodversorgung erhoben werden. Dies ist in Deutschland 1996 und 2006 erfolgt.
Zur aktuellen epidemiologischen Situation der Iodversorgung von Kindern und Jugendlichen liegen Ergebnisse aus dem Kinder- und Jugendgesundheitssurvey des Robert Koch-Instituts vor: mediane Iodurie von 117 µg/l. http://www.kiggs.de/experten/downloads/Basispublikation/Thamm_Jod.pdf. Die Situation der Anwendung von Schilddrüsenpräparaten von Erwachsenen und zu Serumspiegeln der Schilddrüsenhormone wird in einer GBE-Publikation aus den bevölkerungsrepräsentativen Daten der RKI-Gesundheitssurveys dargestellt.
Folgen des Iodmangels
[Bearbeiten]Ein chronischer Iodmangel führt an der Schilddrüse zunächst zu einer Größenzunahme ( Hyperplasie später Hypertrophie ) Dies macht sich als "Kropf" (Struma) bemerkbar. Die Iodmangelstruma war in früheren Jahrhunderten geradezu das Kennzeichen ganzer Bevölkerungen, z.B. in Bayern, der Schweiz oder Österreich. Besteht der Iodmangel längere Zeit, kann sich eine sogenannte Knotenstruma mit autonomen Adenomen entwickeln. Wird die Iodmangelsituation dann plötzlich behoben (z.B. durch vermehrte Iodzufuhr mit der Ernährung oder durch Gabe von stark iodhaltigen Röntgenkontrastmitteln), kann sich durch überschießende Hormonproduktion durch die autonomen Areale eine Schilddrüsenüberfunktion entwickeln.
Die Hormone T3 und T4sind von entscheidender Bedeutung für die frühkindliche Entwicklung des Gehirns. Ein bei Geburt bestehender ausgeprägter Mangel an diesen Hormonen führt zur mehr oder minder schweren geistigen Schäden (bis zum Kretinismus). Deswegen wird routinemäßig jedes Neugeborene auf das Vorliegen einer Hypothyreose (Schilddrüsenunterfunktion) untersucht um diese möglichst bald zu behandeln. Wird die Behandlung nur um wenige Wochen verzögert, kann dies eine geistige Behinderung zur Folge haben, die eine spätere höhere Schulbildung nicht mehr möglich macht. Die häufigste Ursache für die Hypothyreose beim Neugeborenen ist die unzureichende Iodzufuhr während der Schwangerschaft. Daher ist die ausreichende Iodzufuhr gerade in der Schwangerschaft von besonderer Bedeutung. Eine zusammenfassende Analyse aus 10 verschiedenen Studien zeigte, das ein chronischer Iodmangel zu einer mittleren Intelligenzquotient-Minderung um 13,5 Punkte führte.
Bleichrodt N, Born MP. A meta-analysis of research on iodine and its relationship to cognitive development. In: Stanbury JB (ed.): The damaged brain of iodine deficiency. New York, Cognizant Communication, 1994:195–200. Dass chronischer Iodmangel bei Kindern zu Intelligenzminderung führt wurde durch Studien aus allen Teilen der Welt belegt.
- Pineda-Lucatero A, Avila-Jiménez L, Ramos-Hernández RI, Magos C, Martínez H. Iodine deficiency and its association with intelligence quotient in schoolchildren from Colima, Mexico. Public Health Nutr. 2008 Jan 21:1-9 PMID 18205986
- Qian M, Wang D, Watkins WE, Gebski V, Yan YQ, Li M, Chen ZP. The effects of iodine on intelligence in children: a meta-analysis of studies conducted in China. Asia Pac J Clin Nutr. 2005;14(1):32-42. PMID 15734706
- Santiago-Fernandez P, Torres-Barahona R, Muela-Martínez JA, Rojo-Martínez G, García-Fuentes E, Garriga MJ, León AG, Soriguer F. Intelligence quotient and iodine intake: a cross-sectional study in children. J Clin Endocrinol Metab. 2004;89(8):3851-7. PMID 15292317.
Iodmangel gilt als the world's greatest single cause of preventable brain damage and mental retardation (die weltgrößte vermeidbare Ursache von geistiger Behinderung).
Delange F. Iodine deficiency as a cause of brain damage. Postgrad Med J. 2001;77(906):217-20. PMID 11264481
Probleme
[Bearbeiten]Daten aus den Ländern mit gesetzlich verpflichtender Salziodierung wie Österreich zeigten, dass es während der ersten Jahre nach der Einführung bei höherer Iodierung zu einer Verstärkung von Autoimmunerkrankungen der Schilddrüse (Morbus Basedow) kommen kann (http://steiermark.orf.at/stories/147669/), anschließend zu einer Verminderung (Baltisberger BL, et al.: Decrease of incidence of toxic nodular goitre in a region of Switzerland after full correction of mild iodine deficiency. Eur J Endocrinol 132 (1995):546-549 Abstract). Eine optimale Prophylaxe sollte deshalb bedarfsgerecht, d.h. unter Vermeidung eines Überangebots, erfolgen und sorgfältig epidemiologisch überwacht werden. Patienten mit solchen Erkrankungen sollten frühzeitig identifiziert und behandelt werden.
Kritiker der Iodierung wie der Journalist Udo Pollmer weisen darauf hin, dass die Hersteller für mögliche Schäden bei Konsumenten nach dem Produkthaftungsrecht haften (http://das-eule.de/1296.html). Sie kritisieren dabei nicht den hohen Iodgehalt von Meeresfisch, sondern die Tierfutteriodierung, die den Iodgehalt von Milchprodukten von Milch und Eiern in einigen Ländern stärker erhöht hat, ohne dass die Verbraucher darüber aufgeklärt wurden. Um gesundheitlichen Schäden vorzubeugen, hat die Europäische Behörde für Lebensmittelsicherheit empfohlen, die erlaubte Iodierung des Tierfutters, also letztlich auch die der Menschen, einzuschränken (http://www.efsa.europa.eu/de/science/feedap/feedap_opinions/808.html). Daraufhin wurden per EU-Verordnung Nr.1459/2005 die Obergrenzen für die Jodierung des Tierfutters für Hühner und Kühe halbiert. Die EU hat hierbei versucht, die gesamte Iodaufnahme des Menschen, der am Ende der Nahrungskette steht, zu berücksichtigen. Allerdings sind bei voller Ausreizung des aktuellen Grenzwerts (5mg/kg) und ausschließlicher Kraftfutterfütterung immer noch Dosen von 400 - 1200 µg/l in Kuhmilch möglich (http://idw-online.de/pages/de/news150087 ), was einem Vielfachen der empfohlenen Tagesdosis entspricht. In Deutschland beträgt der Iodgehalt des Kraftfutters nur 1 mg/kg bei durchschnittlich 50 % Kraftfutter-Anteil (mit resultierendem durchschnittlichem Milch-Iodgehalt von 100 µg/l) (Flachowsky G, et al.: Zur Jodanreicherung in Lebensmitteln tierischer Herkunft. Ernährungs-Umschau 53 (200):17ff).
Die Stiftung Warentest bestimmte in einem großen Milchtest (Heft 11/2007) auch den Milch-Iodgehalt: Er lag zwischen 30 und 180 µg/l; Bio-Milchen lagen dabei im unteren Drittel dieser Spanne.
Quellen
[Bearbeiten]Weblinks
[Bearbeiten]- Arbeitskreis Jodmangel
- Iodine Status Worldwide. WHO 2004 (englisch, PDF)
- Zur Jodanreicherung in Lebensmitteln tierischer Herkunft, Ernährungsumschau 2006
- Karte zur Tierfutterjodierung in Europa
- Standpunkt des Bundesinstituts für Risikobewertung zur Iodprophylaxe, 2004 (PDF)
- Standpunkt der Dtsch. Ges. für Ernährung, 2003
- Bericht des Robert-Koch-Instituts über Schilddrüsenerkrankungen in Deutschland
Kropf (Struma)
[Bearbeiten]
Eine Vergrößerung der Schilddrüse wird als Kropf oder Struma bezeichnet.
Man kann den Kropf dann noch näher eingrenzen:
- Euthyreote Struma ( Kropf mit normaler Schilddrüsenhormonfunktion)
- Knotenkropf
- Hyperthyreote Struma ( Kropf mit Überfunktion der Schilddrüse)
Die Mehrzahl der Strumen sind euthyreot.
In der medizinischen Fachsprache sind folgende Begriffe üblich:
- Struma diffusa - Vergrößerung der Schilddrüse ohne Knoten
- Struma nodosa - Vergrößerung der Schilddrüse mit Knoten

Ein etwas grober Medizinermerksatz lautet: Ist der Hals dicker als der Kopf, dann handelt es sich um einen Kropf.
Allgemeines
[Bearbeiten]Die Struma (lateinisch struma „Drüsenschwellung“; Mehrzahl Strumae oder eingedeutscht Strumen) oder der Kropf bezeichnet eine sichtbare Vergrößerung der Schilddrüse. Der untere Halsbereich verdickt sich dabei. Die Schilddrüse hat bei der Frau im Mittel ein normales Volumen von bis zu 18 ml, beim Mann bis zu 25 ml. Bei hohem Jodangebot in der Nahrung ist sie kleiner, da hier nicht soviel jodverarbeitende Zellen notwendig sind. Sie kann sich bei einem Iodmangel um ein Mehrfaches vergrößern.
Ursachen
[Bearbeiten]Die Schilddrüse nimmt das aus der Nahrung angebotene Iod auf, speichert es und verbraucht es bei der Produktion der Schilddrüsenhormone Thyroxin und Triiodthyronin.

Bei Iodmangel wächst die Schilddrüse, um ihre Leistung erhöhen zu können. Sie kann dann bis zu 98 % des vom Körper aufgenommenen Jods aus dem Blut verwerten. Dies ist zunächst eine biologisch sinnvolle Anpassung an eine iodärmere Umgebung, bekommt aber Krankheitswert, wenn Funktionsbeeinträchtigungen und Beschwerden im Halsbereich hinzukommen.
Als Folge des Jodmangels entstehen in der vergrößerten Schilddrüse auch Zysten, sowie kalte und heiße Knoten. Ob der Jodmangel auch die Krebshäufigkeit erhöht ist statistisch unsicher. Sicherlich ist der Effekt nur gering, da der Schilddrüsenkrebs auch in Jodmangelgebieten nur selten ist.
Ein Kropf kann außerdem entstehen durch Schilddrüsenüberfunktion (Hyperthyreose) und Unterfunktion (Hypothyreose) verschiedener Ursache. Die genaue Klärung der Ursache muss einer Therapie immer vorausgehen, da bei Autoimmunerkrankungen eine zusätzliche Gabe von Iod nicht sinnvoll ist.
Eine Struma kann auch während der Schwangerschaft auftreten. Die Schilddrüse produziert während der Schwangerschaft vermehrt Thyroxin. Diese Mehrleistung kann manchmal als Kropf bei Schwangeren sichtbar werden. Meist verschwindet er einige Zeit nach der Entbindung wieder.
Haben sich in einem Kropf bereits Zysten oder Knoten gebildet, bilden sich diese in der Regel nicht mehr zurück.
Vorbeugung des Kropfes
[Bearbeiten]Zur Vorbeugung des Kropfes werden seit langem das Speisesalz und seit ein paar Jahren auch andere Lebensmittel in den Industrieländern mit Iod versetzt. Dadurch ist die Häufigkeit der Strumen stark zurückgegangen.
Allerdings ist ein Iodüberschuss bei Vorliegen autoimmuner Schilddrüsenerkrankungen (z. B. Morbus Basedow, Hashimoto-Thyreoiditis) zu vermeiden, was die Versorgung mit Lebensmitteln bei diesem Personenkreis schwierig macht, zumal auch über das Tierfutter Milch, Eier, Fleisch in unbekannter Menge Iod enthalten. Eine Pflicht zur Deklaration mit genauen Mengenangaben würde dieses Problem mindern.
Behandlung
[Bearbeiten]Zur Vorbeugung eines Kropfes wird bei Iodmangel Iodsalz oder Iodtabletten gegeben. Eine zusätzliche Verkleinerung der Schilddrüse kann man mit der Gabe des Schilddrüsenhormons Thyroxin erreichen. Man muß dabei allerdings darauf achten, daß man keine Überfunktion erzeugt.
Ist die Schilddrüse bereits knotig umgebaut, erreicht man meist weder durch die Jod noch durch die Hormongabe eine Verkleinerung des Organes.
Bei autonomen Knoten und beim Morbus Basedow ist die Jodgabe kontraindiziert.
Eine operativ Entfernung des Kropfes ist nur beim Verdacht auf Bösartigkeit und bei mechanischen Problemen beispielsweise der Einengung der Luftröhre notwendig.
Literatur
[Bearbeiten]- A five-year follow-up study of goiter and thyroid nodules in three regions withdifferent iodine intakes in China.
- Autor/-en: Yu, X; Fan, C; Shan, Z; Teng, X; Guan, H; Li, Y; Teng, D; Jin, Y; Chong, W; Yang, F; Dai, H; Yu, Y; Li, J; Chen, Y; Zhao, D; Shi, X; Hu, F; Mao, J; Gu, X; Yang, R; Tong, Y; Wang, W; Gao, T; Li, C; Teng, W
- Quelle: J Endocrinol Invest. 2008 Mar;31(3):243-50.
- Autor/-en: Yu, X; Fan, C; Shan, Z; Teng, X; Guan, H; Li, Y; Teng, D; Jin, Y; Chong, W; Yang, F; Dai, H; Yu, Y; Li, J; Chen, Y; Zhao, D; Shi, X; Hu, F; Mao, J; Gu, X; Yang, R; Tong, Y; Wang, W; Gao, T; Li, C; Teng, W
Gute Arbeit über die Auswirkungen des Jodmangels an der Schilddrüse
- Medizinische Klinik
- Volume 100, Number 9, 542-546, DOI: 10.1007/s00063-005-1074-5
- Die LISA-Studie—eine randomisierte, doppelblinde, vierarmige, plazebokontrollierte, multizentrische Studie an 1 000 Patienten über die medikamentöse Therapie der Struma in Deutschland
- Martin Grussendorf, Renate Vaupel, Christoph Reiners, Karl Wegscheider and
- http://clinicaltrials.gov/ct2/show/NCT00277589
- Leider ohne Veröffentlichung der Ergebnisse
- Die LISA-Studie—eine randomisierte, doppelblinde, vierarmige, plazebokontrollierte, multizentrische Studie an 1 000 Patienten über die medikamentöse Therapie der Struma in Deutschland
- Volume 100, Number 9, 542-546, DOI: 10.1007/s00063-005-1074-5
- Endoscopic Minimally Invasive Thyroidectomy (eMIT): A Prospective Proof-of-Concept Study in Humans.
- Wilhelm T, Metzig A.
- World J Surg. 2010 Nov 19. [Epub ahead of print]
- Wilhelm T, Metzig A.
- Tumour Biol. 2010 Nov 16. [Epub ahead of print]
- Papillary thyroid carcinoma shows elevated levels of 2-hydroxyglutarate.
- Rakheja D, Boriack RL, Mitui M, Khokhar S, Holt SA, Kapur P.
- Papillary thyroid carcinoma shows elevated levels of 2-hydroxyglutarate.
- Korean J Radiol. 2010 Nov;11(6):594-602. Epub 2010 Oct 29.
- Role of Duplex Power Doppler Ultrasound in Differentiation between Malignant and Benign Thyroid Nodules.
- Algin O, Algin E, Gokalp G, Ocakoğlu G, Erdoğan C, Saraydaroglu O, Tuncel E.
- Role of Duplex Power Doppler Ultrasound in Differentiation between Malignant and Benign Thyroid Nodules.
- Med Clin North Am. 2010 Sep;94(5):1003-15.
- The patient with a thyroid nodule.
- Miller MC.
- The patient with a thyroid nodule.
- Benign predominantly solid thyroid nodules: prospective study of efficacy of sonographically guided radiofrequency ablation versus control condition.
- Baek JH, Kim YS, Lee D, Huh JY, Lee JH.
- AJR Am J Roentgenol. 2010 Apr;194(4):1137-42.
- Baek JH, Kim YS, Lee D, Huh JY, Lee JH.
- Utility of contrast-enhanced ultrasound for evaluation of thyroid nodules.
- Zhang B, Jiang YX, Liu JB, Yang M, Dai Q, Zhu QL, Gao P.
- Thyroid. 2010 Jan;20(1):51-7.
- Zhang B, Jiang YX, Liu JB, Yang M, Dai Q, Zhu QL, Gao P.
- Radiofrequency ablation (RFA) of benign thyroid nodules in patients with incompletely resolved clinical problems after ethanol ablation (EA).
- Lee JH, Kim YS, Lee D, Choi H, Yoo H, Baek JH.
- World J Surg. 2010 Jul;34(7):1488-93.
- Lee JH, Kim YS, Lee D, Choi H, Yoo H, Baek JH.
Weblinks
[Bearbeiten]- Informationen und Forum zu Schilddrüsenerkrankungen und NMUs
- http://edoc.hu-berlin.de/dissertationen/bittermann-heike-1999-10-22/HTML/bittermann.html
- Jodversorgung deutscher Wehrpflichtiger im Alter von 17,5 bis 21 Jahren
Knoten
[Bearbeiten]Was sind überhaupt Schilddrüsenknoten?
Der Begriff Knoten ist eine unscharfe Definition. Seine ursprüngliche Bedeutung ist eine tastbare Verhärtung der Schilddrüse. Dieser Begriff wurde dann durch andere Untersuchungsverfahren abgeändert,
- jede Lücke im Szintigramm wird als kalter Knoten bezeichnet
- jede vermehrte umschriebene Anreicherung im Szintigramm wird als heißer Knoten bezeichnet
- jeder umschriebene inhomogene Gewebsbezirk im Ultraschall wir als Knoten bezeichnet
Statt Knoten wäre oft die Bezeichnung "Bezirk" oder "Bereich" im Ultraschall und Szintigramm besser.
Schilddrüsenknoten sind in Jodmangelgebieten häufig und zum größten Teil gutartig.
Kriterien für gutartige Knoten
[Bearbeiten]- Familiäre Vorgeschichte einer Hashimoto Thyreoiditis
- Familiäre Vorgeschichte von gutartigen Knoten oder Kropf
- Zeichen der Schilddrüsenunter- oder überfunktion
- schmerzhafte Knoten
- ein weicher, glatter und verschieblicher Knoten
- mehrere ähnlich große Knoten in derselben Schilddrüse
- warme Knoten im Szintigramm
- Zysten im Ultraschall
- Im MIBI Szintigramm nicht speichernd
Kriterien für krebsverdächtige Knoten
[Bearbeiten]Die Liste enthält einige wichtige Kriterien, die einen Krebsverdacht begründen, die aber natürlich nicht immer zutreffen !!
- schnell wachsend I
- derb tastbar
- unregelmäßige Oberfläche
- nicht verschieblich
- szintigrafisch kalt
- im MIBI Szintigramm speichernd
- sonografisch echoarm
- solitär
- tastbare Lymphknoten
- Schilddrüsenkrebs in der Familie
- Alter < 20
- Alter > 70
- Männliches Geschlecht
- Neu aufgetretene Schluckbeschwerden
- Neu aufgetretene Heiserkeit
- Vorgeschichte mit Bestrahlungen im Kopf-Nackenbereich während der Kindheit
- In der Vorgeschichte bereits Schilddrüsenkrebs
- Menschen, die im Fallout Gebiet von Tschernobyl leben oder lebten.
- Tc-99m-MIBI-Tumorszintigraphie der Schilddrüse
- Sie kann bei negativem szintigraphischem Befund mit sehr hoher Wahrscheinlichkeit ein Malignom ausschließen.
Kalte Knoten
[Bearbeiten]
Der Begriff kalter Knoten kommt aus der Befundung von Schilddrüsen Szintigrammen. Jeder Bereich der im Szintigramm nicht anreichert wird zunächst als kalter Knoten bezeichnet. Dahinter kann sich dann auch eine einfache Zyste verbergen.
Beispiel
[Bearbeiten]- Beispiel eines kaltes Knotens am unteren Pol der linken schilddrüse.
Krebs oder nicht ?
[Bearbeiten]Die wichtigste Frage bei einem kalten Knoten ist die Frage: Kann der Knoten ein Krebsknoten sein oder nicht. Dies kann man vor allem an Hand der Kriterien für bösartige Knoten beantworten ( siehe oben). Wichtig sind sonografische Größenmessungen im Verlauf. Eine Zytologie ( Zelluntersuchung ) oder Histologie ( Gewebsuntersuchung) aus dem Knoten kann bei dieser Fragestellung weiter helfen. Auch wenn die Wahrscheinlichkeit eines Krebsknotens bei einem kalten Knoten höher ist als bei einem heißen Knoten, so sind immer noch 90 % aller kalten Knoten gutartig ( abhängig von der untersuchten Patientengruppe) .
Heiße Knoten
[Bearbeiten]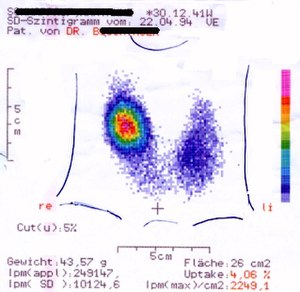
Der Begriff heißer Knoten kommt aus der Befundung von Schilddrüsenszintigrammen. Jeder Bereich der im Szintigramm vermehrt anreichert wird zunächst als heißer Bezirk bezeichnet. Meist verbirgt sich dahinter ein gutartiges, vermehrt Schilddrüsenhormon produzierendes autonomes Adenom.
- Siehe

Dieser Knoten wurde mit Alkohol verödet und war nach der Behandlung szintigrafisch verschwunden. Im Ultraschall war er noch als kleiner Narbenknoten nachweisbar. Die restliche Schilddrüse wurde wieder aktiv.
Die lokale Verödung von heißen Schilddrüsenknoten ist eine elegante Methode zur Behandlung solitärer autonomer Adenome. Im Gegensatz zur Radiojodtherapie wird die restliche Schilddrüse geschont. Leider gibt es kein Adressverzeichnis der Doktoren, die die Methode beherrschen. Auch wird sie nur schlecht vergütet. Deswegen kommt sie nur selten zur Anwendung.
Die Ampullen des 95 % Alkohols gibt es von der Firma Braun zu 10 Stück mit 20 ml Inhalt . 10 Ampullen kosten circa 35 Euro.
Wachstumsdynamik heißer Knoten
[Bearbeiten]Gibt es heiße Knoten, die unkontrolliert aktiv sind und an Hand des TSH Spiegel noch nicht erkennbar sind ?
Die Frage ist für einen einzelnen heißen Knoten leicht zu beantworten: Es hängt einfach von der Größe und Aktivität des heißen Knotens ab.
Ist der Knoten noch sehr klein ( unter 1 cm ), dann sind die Blutwerte noch normal.
Wird der Knoten langsam größer, dann bremst er die restliche SD und der TSH Spiegel sinkt ab. Die T3 und T4 Werte sind zu diesem Zeitpunkt noch normal. Woher die Hypophyse weiß, daß der Knoten vorhanden ist und die TSH Produktion reduziert, das ist bis heute nicht klar. Wahrscheinlich sind die T3, T4 Spiegel über den ganzen Tag betrachtet, eben doch schon etwas zu hoch.
Wird der Knoten noch größer ( so etwa ab 2 - 3 cm ) , dann kann die Hypophyse Ihre Produktion nicht mehr weiter drosseln , die restliche SD ist fast stillgelegt und der heiße Knoten produziert jetzt auch eindeutig meßbar zuviel T3 und T4 . Dann muß man den Knoten auch dringend behandeln.
Der zeitliche Verlauf des Wachstums ist dabei sehr langsam und zieht sich meist über mehrere Jahre hin.
Literatur
[Bearbeiten]- Abklärung des euthyreoten Schilddrüsenknotens: Wann punktieren? Stellenwert der Sonographie.
- DMW Deutsche Medizinische Wochenschrift 2009; 134 (49): S. 2498-2503
- Chirurgisches Forum 2008
- Deutsche Gesellschaft für Chirurgie, 2008, Volume 37, IX., 139-141, DOI: 10.1007/978-3-540-78833-1_51
- Thermoablationsverfahren an der Schilddrüse — Vergleich der Laserinduzierten Thermotherapie (LITT) und der Radiofrequenzinduzierten Thermotherapie (RFITT) als neue Therapiesysteme zur lokalen Behandlung von nodulären Schilddrüsenveränderungen
- Thomas Schumann, K. S. Lehmann, U. Zurbuchen, H. J. Buhr and J. P. Ritz
- Thermoablationsverfahren an der Schilddrüse — Vergleich der Laserinduzierten Thermotherapie (LITT) und der Radiofrequenzinduzierten Thermotherapie (RFITT) als neue Therapiesysteme zur lokalen Behandlung von nodulären Schilddrüsenveränderungen
- Deutsche Gesellschaft für Chirurgie, 2008, Volume 37, IX., 139-141, DOI: 10.1007/978-3-540-78833-1_51
- Wale A, Miles KA, Young B, et al.
- Combined 99mTc-methoxyisobutylisonitrile scintigraphy and fine-needle aspiration cytology offers
- an accurate and potentially cost-effective investigative strategy
- for the assessment of solitary or dominant thyroid nodules.
- Eur J Nucl Med Mol Imaging 2014; 41: 105–15
- Wienhold R, Scholz M, Adler JB, Günster C, Paschke R:
- The management of thyroid nodules—a retrospective analysis of health insurance data.
- Dtsch Arztebl Int 2013; 110(49): 827–34.
- The management of thyroid nodules—a retrospective analysis of health insurance data.
- Gharib H, Papini E, Paschke R, et al.:
- American Association of Clinical Endicrinologists, AME and European Thyroid Association
- medical guidelines for clinical practice for the diagnosis and management of thyroid nodules.
- J Endocrinol Invest 2010 33: 287–91
Links
[Bearbeiten]- http://www.sonoweb.de/kasu0401.htm
- Schönes Beispiel eine kalten Knotens mit Krebsverdacht
- http://www.laekh.de/upload/Hess._Aerzteblatt/2003/2003_06/2003_06_06.pdf
- gute Zusammenfassung des Themas
- http://www.meb.uni-bonn.de/nuclearmedizin/sdambulanz/mibi/mibi.html
- Kurze Erklärung der MIBI Szintigrafie
Zysten
[Bearbeiten]Die meisten Zysten der Schilddrüse sind harmlos und lassen sich leicht im Ultraschall erkennen und kontrollieren. Man kann Zysten leicht punktieren. Sie laufen aber nicht selten wieder voll.
Entzündungen (Thyreoiditis)
[Bearbeiten]Siehe http://www.schilddruesenpraxis.de/lex_entzuendung.html
Chronische Autoimmunthyreoiditis Hashimoto
[Bearbeiten]siehe weiter unten
Chronisch atrophische Thyreoiditis (Ord-Thyreoiditis)
[Bearbeiten]Morbus Basedow
[Bearbeiten]siehe weiter unten
Infektiöse Thyreoiditis
[Bearbeiten]Viral - bakteriell
Die bakterielle Thyreoiditis ist sehr selten. Die virale Thyreoiditis ist möglicherweise häufiger, es wird aber nur sehr selten der Beweis einer viralen Entzündung gebracht werden. So verläuft manche virale Entzündung unter dem Aspekt einer unspezifischen ungeklärten Schilddrüsenentzündung.
Subakute granulomatöse Thyreoiditis de Quervain
[Bearbeiten]Die subakute Thyreoiditis wurde erstmals 1904 von Fritz de Quervain beschrieben.
Ihre Ursache ist bis heute noch ungeklärt, vermutet wird eine vorausgehende Virusinfektion. Bei dieser Erkrankung bilden sich im Gewebe "Riesenzellen", was ihr deshalb auch den Namen Riesenzellenthyreoditis einbrachte. Symptom ist vor allem der bis ins Ohr, Ober- und Unterkiefer ausstrahlende Schmerz. Die Schmerzen im Halsbereich wechseln häufig von einer Seite auf die andere. Zusätzlich leiden die Patienten an allgemeinem Krankheitsgefühl, Fieber, Abgeschlagenheit und Leistungsschwäche, wie bei einem schweren viralen Infekt. Dabei geht der subakuten Thyreoiditis meist mit einem zeitlichen Abstand von einigen Wochen ein Atemwegsinfekt voraus. Durch die Entzündungsreaktion kommt es zu einer Schädigung der Thyreozyten. Als Folge werden die Schilddrüsenhormonspeicher ins Blut entleert. Im Blut steigt die Schilddrüsenhormonkonzentration deutlich an. Beschwerden im Sinne einer Hyperthyreose sind die Folge. Nach dieser vorübergehenden Phase folgt eine Hypothyreose, da das beschädigte Schilddrüsengewebe nicht mehr in der Lage ist, neue Schilddrüsenhormone zu produzieren. Die Erkrankung dauert meist 1 bis 4 Monate, selten auch mal bis zu 6 Monate. Durch eine entsprechende Therapie können die Symptome schnell abgemildert werden. Während eine ursachenspezifische Therapie nicht bekannt ist, sind die Symptome durch Gabe von Salicylsäure oder Diclofenac bei einer leichten bzw. von Glukokortikoiden bei einer schweren Thyreoiditis angehbar. Eine Behandlung der hormonellen Überfunktion ist wirkungslos. Nach Ausheilung behält die Schilddrüse in der Regel ihre normale Funktion. Manchmal entwickelt sich eine Unterfunktion, die durch die Gabe von Schilddrüsenhormon (L-Thyroxin) behandelt werden kann.
Postpartale Thyreoiditis
[Bearbeiten]Medikamentös induzierte Thyreoiditiden
[Bearbeiten]invasiv-fibrosierende Thyreoiditis Riedel
[Bearbeiten]Sehr selten , schwer zu behandeln. Siehe [2]
Paraneoplastische Thyreoiditis
[Bearbeiten]Iatrogene Thyreoiditis
[Bearbeiten]Stichwort Interferon
Hashimotothyreoiditis
[Bearbeiten]Allgemeines
[Bearbeiten]| ICD-10-Codes Hashimoto-Thyreoiditis | ||
|---|---|---|
|
Bei der Hashimoto-Thyreoiditis (auch lymphozytäre oder autoimmune Thyreoiditis) handelt es sich um eine Autoimmunerkrankung, die zu einer chronischen Entzündung der Schilddrüse führt. Bei dieser Erkrankung kommt es infolge eines fehlgeleiteten Immunprozesses zur Zerstörung des Schilddrüsengewebes durch T-Lymphozyten. Darüber hinaus ist eine Antikörperbildung gegen schilddrüsenspezifische Antigene nachweisbar. Diese Krankheit wurde nach dem japanischen Arzt Hakaru Hashimoto (1881-1934) benannt, der sie 1912 als erster beschrieb.
Literatur:
- Hashimoto, H. (1912)
- Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa).
- Archiv für klinische Chirurgie, Berlin 97: 219-248.
- Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa).
Es sind können 2 verschiedene Verlaufsformen unterscheiden werden:
- die Hashimoto-Thyreoiditis i.e.S. (Autoimmunthyreopathie Typ 1A und 2A), mit einer Vergrößerung der Schilddrüse.
- die Ord-Thyreoiditis (Autoimmunthyreopathie Typ 1B und 2B), mit einer Verkleinerung (Atrophie) der Schilddrüse. Sie wurde nach William Miller Ord benannt, der sie erstmals im Jahre 1878 beschrieb.
Literatur:
- Ord, W.M. (1878)
- On myxedema, a term proposed to be applied to an essential condition in the "cretinoid" affection occasionally observed in middle-aged women.
- Medico-Chir Trans 61: Seite 57.
- On myxedema, a term proposed to be applied to an essential condition in the "cretinoid" affection occasionally observed in middle-aged women.
Da sich die Symptome, Diagnostik, Therapie und Prognose der beiden Formen nicht wesentlich unterscheiden und beide Formen jeweils ineinander übergehen können, werden sie heute in der Regel unter dem Begriff der Hashimoto-Thyreoiditis zusammengefasst. Bei beiden Verlaufsformen, sowohl atrophe und hypertrophe Form, kommt es auf Dauer zu einer Schilddrüsenunterfunktion, wobei sich am Beginn der Erkrankung – bedingt durch die Zerstörung des Schilddrüsen-Gewebes – auch Phasen der Überfunktion zeigen können (sog. "Leck-Hyperthyreose", im Extremfall Hashitoxikose). Die Krankheit gilt als nicht heilbar.
Häufigkeit
[Bearbeiten]Die Hashimoto-Thyreoiditis ist eine der häufigsten Autoimmunerkrankungen des Menschen und die häufigste Ursache der primären Schilddrüsenunterfunktion. Eine US-Erhebung (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?itool=abstractplus&db=pubmed&cmd=Retrieve&dopt=abstractplus&list_uids=11836274) ergab bei 10 % der Probanden einer Bevölkerungsstichprobe erhöhte Antikörper und 5 % Hypothyreosen (0.3 % klinisch manifest). Eine neuere Studie (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?itool=abstractplus&db=pubmed&cmd=Retrieve&dopt=abstractplus&list_uids=15731735) ergab 10 % klinische und subklinische Hypothyreosen. Für Westeuropa liegen ähnliche Daten vor (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Retrieve&dopt=AbstractPlus&list_uids=2004476&query_hl=11&itool=pubmed_docsum, http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Retrieve&dopt=AbstractPlus&list_uids=15731735&query_hl=14&itool=pubmed_docsum). Lehrbüchern zufolge liegt die Erkankungshäufigkeit der mit einer Hashimoto-Thyreoiditis häufig einhergehenden Schilddrüsen-Unterfunktion in Westeuropa bei 1-2 %; subklinische Verläufe sind jedoch häufiger und liegen im Bereich von 6-8% (Classen, Diehl, Kochsiek. Innere Medizin, 5. Auflage. Verlag Urban & Fischer). Frauen erkranken deutlich öfter als Männer (Verhältnis ca. 8 : 1 bis 10 : 1). Die Veranlagung für Hashimoto wird vererbt (d.h. es finden sich familiäre Häufungen), es kommt jedoch nicht zwangsläufig in jedem Fall zum Ausbruch der Krankheit. Bisherige Beobachtungen zeigen, dass die Hashimoto-Thyreoiditis häufig im Zusammenhang mit hormonellen Umstellungen (Pubertät, Entbindung, Wechseljahre), aber auch infolge von Belastungssituationen ausbrechen kann.
Ursachen
[Bearbeiten]Die genauen Wirkfaktoren, die zum Ausbruch einer Hashimoto-Thyreoiditis führen können, sind noch nicht hinreichend geklärt. Zur Debatte stehen neben einer familiären (genetischen) Vorbelastung (z.B. X-Chromosome Inactivation) auch Stress, schwer verlaufende Viruserkrankungen (wie Pfeiffer-Drüsenfieber), Dysfunktionen der Nebennierenrinde und Umweltauswirkungen nicht abschließend. Heftig debattiert wird z.Z. über die Bedeutung einer übermäßigen Iodzufuhr für den Ausbruch der Krankheit. Während als relativ sicher gelten kann, dass sie, genau wie Morbus Basedow, durch hohe Ioddosen (Iodexzess) ausgelöst werden kann (z.B. durch iodhaltige Kontrastmittel), werden die möglichen Gefahren, die von einer Iodierung der Nahrungsmittel (als Folge der Futtermitteliodierung bei Nutztieren und der Kochsalziodierung) ausgehen, kontrovers diskutiert.
Symptome und Krankheitsverlauf
[Bearbeiten]Aufgrund der möglichen anfänglichen Schilddrüsenüberfunktionen können für eine gewisse Zeit folgende Symptome im Vordergrund stehen:
- Nervosität
- Reizbarkeit
- Rastlosigkeit
- Zittern der Hände
- Schlafstörungen
- Schwitzen
- feuchtwarme Haut
- Heißhunger und Durst
- Gewichtsverlust trotz guten Appetits
- Störungen im Menstruationszyklus (unregelmäßige oder verstärkte Blutungen, Ausbleiben der Regelblutung)
Langfristig werden diese dann von Symptomen der Schilddrüsenunterfunktion abgelöst:
- Niedrige Körpertemperatur
- Erhöhte Kälteempfindlichkeit
- Ödeme (Schwellungen durch Wassereinlagerungen, besonders an Lidern, Gesicht, Extremitäten --> prätibiales Ödem)
- Kloß im Hals, Druckgefühl am oder im Hals, Strangulationsgefühl (auch nur phasenweise),
- Häufiges Räuspern und Hüsteln, heisere oder belegte Stimme (Stimmbandödem)
- Depressive Verstimmung, Motivationslosigkeit, Antriebslosigkeit
- Muskelschwäche
- Muskelverhärtungen
- trockene, rissige Haut und damit verbundener Juckreiz
- trockene Schleimhäute
- brüchige Haare und Fingernägel, Haarausfall
- schnelle und starke (fast unkontrollierbare) Gewichtszunahme
- Verdauungsstörungen
- verringerte Libido
- veränderter Zyklus (bei Frauen)
- Gelenkschmerzen
- Konzentrations- u. Gedächtnisstörungen
- Müdigkeit
Der Krankheitsverlauf ist bei einem Großteil der Erkrankten leicht, doch sind auch mittlere und schwere Verläufe bekannt. Die Symptome sind vielfältig und – gerade am Beginn der Erkrankung - schwer zu fassen. Dazu kommt, dass die Vielzahl und Variabilität der Symptome und der schleichende Verlauf es sowohl für den Patienten wie auch den behandelnden Arzt schwierig machen, sie zuzuordnen.
Neben körperlichen können auch eine Reihe psychischer Symptome in Erscheinung treten. Nicht selten werden Patienten wegen der unklaren Symptomlage als Hypochonder abgestempelt oder ihre Beschwerden als psychosomatisch eingestuft, ohne dass eine ausreichende Abklärung einer möglichen Schilddrüsen-Funktionsstörung erfolgt.
Unterfunktions-Symptome können bereits bei subklinischen (noch als euthyreot geltenden) Wertekonstellationen auftreten, weil der individuelle Wertespielraum in der Regel sehr viel kleiner ist als das auf statistischen Auswertungen beruhende, interindividuelle Referenzwertspektrum. Selbst subklinische Wertekonstellationen können daher bereits eine Minderung der Lebensqualität nach sich ziehen.
In extrem selten Fällen geht mit der Krankheit die Hashimoto-Enzephalopathie einher mit Symptomen wie epileptischen Anfällen, psychiatrischen Symptomen oder Halluzinationen.
Erkennung
[Bearbeiten]Diagnostisch relevant sind:
- TPO-AK (Antikörper gegen Thyreoperoxidase)
- TG-AK (Antikörper gegen Thyreoglobulin)
Im weit überwiegenden Teil der Fälle sind die Anti-TPO erhöht (mit oder ohne Erhöhung der Anti-TG). In einem weitaus geringeren Teil der Fälle sind nur die Anti-TG erhöht. Es existieren darüber hinaus - wenn auch selten - Fälle, in denen eine Hashimoto-Thyreoiditis vorliegt, ohne dass die genannten Antikörper erhöht sind.
Für die Stoffwechsellage der Schilddrüse sind folgende Werte relevant:
- TSH (Thyroidaea-Stimulierendes Hormon) ,
- T3 (Triiodthyronin --> Hormon der Schilddrüse, wird aus T4 gebildet), bzw. freies T3 = fT3 (Anmerkung: Freie Werte sind – v.a. bei Frauen - wesentlich aussagekräftiger als der gesamt-T-Wert, da die Gesamt-T-Werte im Gegensatz zu den "freien" Werten starken Wechselwirkungen mit den weiblichen Hormonen unterliegen und durch diese verfälscht werden können)
- T4 (Levothyroxin = L-Thyroxin = Tetraiodthyronin = Tetrajodthyronin --> Hormon der Schilddrüse), bzw. freies T4 = fT4 (Anmerkung: Freie Werte sind – v.a. bei Frauen - wesentlich aussagekräftiger als der gesamt-T-Wert, da die Gesamt-T-Werte im Gegensatz zu den "freien" Werten starken Wechselwirkungen mit den weiblichen Hormonen unterliegen und durch diese verfälscht werden können)
Eine Schilddrüsendiagnostik, die sich ausschließlich auf den TSH stützt, ist zur Erkennung einer Hashimoto-Thyreoidis meist nicht aussagekräftig genug. Denn auch normwertiges TSH und normwertige freie T-Werte sind keine Ausschlusskriterien für das Vorhandensein einer Hashimoto-Thyreoiditis.
Sehr wichtig zur Diagnosestellung ist zudem das Bild der Schilddrüse im Ultraschall, das typischerweise inhomogen und echoarm ist und damit auf den laufenden Zerstörungssprozess hinweist. Zudem kann die im Doppler-Sonogramm erkennbare verstärkte Durchblutung des Schilddrüsengewebes ein Hinweis auf das Vorhandensein eines Entzündungsherdes sein. Auch die Größe der Schilddrüse kann im Sonogramm beurteilt werden. Da die hypertrophe Form der HT mit einer Struma einhergehen kann, sind Größen über ca. 20 ml (Frauen) bzw. ca. 28 ml (Männer) Gesamtvolumen (Hashimoto-Thyreoiditis i.e.S.) als auffällig anzusehen. Kleine Schilddrüsen mit einer Größe unter 8 ml (Frauen) bzw. 12 ml (Männer) sind hingegen typisch für die atrophische Verlaufsform (Ord-Thyreoiditis), wobei einschränkend angemerkt werden muss, dass diese Größenangaben - je nach Autor - stark schwanken und Gegenstand der Diskussion sind. Hierzulande ist diese sogenannte atrophische Verlaufsform mit schrumpfender Schilddrüse häufiger als die hypertrophe Form mit Kropfbildung (Struma).
Insbesondere in der Anfangsphase der Erkrankung kann die Unterscheidung zwischen einer Hashimoto-Thyreoiditis und Morbus Basedow (eine Autoimmunerkrankung, die zur Überproduktion von Schilddrüsenhormonen führt) schwierig sein, da auch bei Hashimoto anfängliche Überfunktionsschübe auftreten können. Meist kann dann eine Szintigraphie Klarheit bringen.
Endgültige Sicherheit bringt die histologische (feingeweblich, mikroskopische) Untersuchung des Schilddrüsengewebes, man erkennt bei der Hashimoto-Thyreoiditis im Gegensatz zur gesunden Schilddrüse neben anderen Kriterien vor allem ein dichtes Infiltrat von Lymphozyten und auch Lymphfollikel (siehe Abbildung), die ein Ausdruck der entzündlichen Vorgänge sind.
Behandlung
[Bearbeiten]Die Hashimoto-Thyreoiditis selbst ist zum gegenwärtigen Zeitpunkt nicht heilbar; die Unterfunktion der Schilddrüse kann (muss) jedoch therapiert werden. Die Therapie erfolgt durch (einschleichende) Substitution von Hormonen, die der Körper aufgrund der chronischen Entzündung der Schilddrüse nicht mehr selber in ausreichendem Maße oder gar nicht mehr herstellen kann.
Die Substitution erfolgt durch die Gabe von Schilddrüsen-Hormonen. Dafür stehen unterschiedliche Präparate zur Verfügung:
- Thyroxin (=T4, Levothyroxin)
- Kombination von T4 und T3, wobei diese entweder als Kombinationspräparat mit festem T4/T3-Verhältnis oder als frei dosierbare Einzelpräparate verwendet werden.
Iod hingegen sollte bei einer Hashimoto-Thyreoiditis nicht zusätzlich eingenommen werden, da Iodüberschuss die Entzündung der Schilddrüse fördern kann.
Die Blutwerte TSH, fT3 und fT4 sollten regelmäßig überprüft werden, da sich im Laufe der Erkrankung Veränderungen einstellen, die eine Dosisanpassung erfordern. Zusätzlich sollte die Schilddrüse in regelmäßigen Abständen (alle 6-12 Monate) durch eine Sonographie auf ihrer Struktur hin geprüft werden.
Die erfolgreiche Einstellung dauert meist mehrere Monate. Bei der Behandlung ist sehr viel Geduld erforderlich. Je länger eine Unterfunktion andauert und je schwerer sie ist, umso langwieriger ist es in der Regel, einen befriedigenden Hormonstatus und Wohlbefinden zu erreichen. Auch Schwankungen oder Schübe können zum Krankheitsbild gehören und stellen erhöhte Anforderungen an Patient, Arzt und Umfeld.
Die zusätzliche Gabe von Selen ist noch nicht als wirksam anerkannt. Einzelne Studien scheinen eine positive Wirkung des Spurenelements auf Immunthyroiditiden zu belegen [3] [4].
Die genannten Behandlungsalternativen greifen jedoch nicht in allen Fällen. Die davon betroffenen Patienten sind aufgrund anhaltender Symptome dauerhaft in ihrer Lebensqualität beeinträchtigt.
Sonstiges
[Bearbeiten]Vorsorglich ist Erkrankten daher zu empfehlen, Iod in hohen Dosen zu meiden, da es die Aktivität der Schilddrüse erhöht, was die Angriffe des Autoimmunsystems verstärken kann. Iod- und Iodkombinationspräparate (u.a. als Nahrungsergänzungsmittel erhältlich) müssen also gemieden werden. Auch auf iodiertes Speisesalz, Meeresalgenprodukte, Seefisch und größere Mengen sonstiger iodreicher Lebensmittel sollte vorsichtshalber weitgehend verzichtet werden. Übliche Iodkonzentrationen in Lebensmitteln verursachen aber in der Regel keine unmittelbaren Probleme, wobei individuell höhere Empfindlichkeiten gegenüber Iod möglich sind.
Da eine Schilddrüsenunterfunktion manchmal mit einem Mangel an Spurenelementen, Selen, Eisen, Magnesium und Vitaminen (z.B. B6, B12) einhergehen kann, kann sich eine diesbezügliche Abklärung lohnen. Ebenso ist vor Beginn der Hormon-Substitution eine Abklärung erforderlich, ob eine Erkrankung der Nebennierenrinde vorliegt.
Mögliche Begleiterkrankungen
[Bearbeiten]Hashimoto-Patienten haben - gegenüber nicht-autoimmun Erkrankten - eine erhöhte Wahrscheinlichkeit, an weiteren Leiden mit möglichem oder gesichertem autoimmunologischem Hintergrund zu erkranken. Hierzu zählen unter anderem: Morbus Addison (sog. Schmidt-Syndrom), perniziöse Anämie, Diabetes vom Typ I, Sarkoidose, Morbus Crohn, Colitis ulcerosa, Vitiligo, Lichen sclerosus, Rosacea, Lupus erythematodes.
Bleibt die Hashimoto Thyreoiditis lange unerkannt, können unter anderem die Nebennieren geschwächt werden. Vor der Behandlung mit Schilddrüsenhormonen sollten deshalb immer die entsprechenden Werte im Blut kontrolliert und nötigenfalls Cortison verabreicht werden.
Zudem scheint ein Zusammenhang zu bestehen zwischen Hashimoto und unerfülltem Kinderwunsch:
- Bei erhöhtem TSH-Wert kann es durch die Ähnlichkeit des PRH (Prolaktin Releasing Hormone) mit dem Thyrotropin (TSH) zu einer Überproduktion des Prolaktins kommen, was wiederum den Eisprung verhindert.
- Da die Schilddrüse wesentlichen Anteil an der Steuerung der Sexualhormone hat, kann eine Schädigung der Schilddrüse durch Hashimoto zu einer Störung des Hormonhaushaltes führen. Eine optimal angepasste Einnahme von Schilddrüsenhormonen ist deshalb sehr wichtig. Einige Patientinnen machen sehr gute Erfahrungen mit natürlichen Schilddrüsenhormonen (aus Schweineschilddrüsen gewonnen, z.B. Armour Thyroid, etc.).
- Auch ist bei etwa 50% der Hashimoto-Frauen die Anzahl der natürlichen Abwehrzellen des Immunsystems erhöht, und es bestehen weitere Anzeichen für ein überreaktives Immunsystem. Es wird vermutet, dass die Eizellen deshalb Schwierigkeiten bei der Einnistung haben sowie ein erhöhtes Fehlgeburtsrisiko besteht.
Literatur
[Bearbeiten]- Mary Shomon: Die gesunde Schilddrüse, Was Sie unbedingt wissen sollten über Gewichtsprobleme, Depressionen, Haarausfall und andere Beschwerden im Zusammenhang mit Hashimoto Thyreoiditis. (Originaltitel: Living well with Hypothyroidism), Goldmann Verlag, 2002, ISBN 3442163889
- Leveke Brakebusch, Armin Heufelder: Leben mit Hashimoto Thyreoiditis. Ein Ratgeber. 2. Auflage (August 2005), Zuckschwerdt Verlag, ISBN 3886038831
- P.-M. Schumm-Draeger: Schilddrüsendiagnostik und -Therapie. Bayer. Ärzteblatt 4/2005
- Terry F. Davies (2003): Ord-Hashimoto's Disease: Renaming a Common Disorder - Again. Thyroid 13 (4) 317
Weblinks
[Bearbeiten]- Selbsthilfe-Netzwerk für Deutschland, Österreich und Schweiz
- Selbsthilfegruppe für autoimmune Schilddrüsen-Erkrankungen Österreich
- Die Schmetterlinge e. V.
- Schilddrüsenliga Deutschland e. V.
- www.schilddruesenspezialisten.de Authentische Erfahrungsberichte von Betroffenen, eine Arztliste, FAQ u. v. m
- Gute Zusammenfassung der Infos zum Thema Hashimoto
en:Hashimoto's thyroiditis
Überfunktion der Schilddrüsen
[Bearbeiten]Eine Hyperthyreose ist eine Schilddrüsenüberfunktion. Die Schilddrüse produziert zu viel der Hormone Thyroxin und Trijodthyronin. Das Gegenteil, ein Mangel an Schilddrüsenhormonen wird dagegen als Hypothyreose bezeichnet. Hyper heißt dabei zuviel und hypo heißt dabei zuwenig. Diese beiden Vorsilben kann man leicht verwechseln. Eine Sonderform der Hyperthyreose ist die Thyreotoxikose, wörtlich übersetzt ist das eine Vergiftung des Körpers mit Schilddrüsenhormon, d.h. also eine schwere Schilddrüsenüberfunktion.
Schweregrade
[Bearbeiten]Eine subklinische Hyperthyreose sind veränderte Laborwerte, die noch nicht mit Symptomen einhergehen.
Im Gegensatz dazu kann die latente Hyperthyreose mit Symptomen einhergehen oder asymptomatisch sein. Sie ist dadurch gekennzeichnet, daß die TSH-Aktivität im Blutserum erniedigt ist, die peripheren Schilddrüsenhormone Thyroxin (T4) und Trijodthyronin (T3) aber noch normal sind. Bei der manifesten Hyperthyreose sind dagegen sowohl die TSH-Aktivität als auch die Plasmaspiegel der peripheren Schilddrüsenhormone pathologisch.
Eine Hyperthyreose mit klinischen Beschwerden ist immer behandlungsbedürftig. Die schwerste und lebensbedrohliche Form ist die thyreotoxische Krise.
Ursachen der Schilddrüsenüberfunktion
[Bearbeiten]Englisches Wort für Hyperthyreose : hyperthyroidism
häufig:
[Bearbeiten]- Morbus Basedow: ein Autoimmunprozess - immunogene Form der Hyperthyreose, durch stimulierende TSH-Rezeptor-Autoantikörper verursacht,
- Autonome Knoten: Knoten, die von der Steuerung durch TSH unabhängig Jod aufnehmen und Hormon bilden, aber nicht bedarfsgerecht abgeben
- Hashimoto-Thyreoiditis: ein anfangs vermehrter Hormonaustritt infolge Zellzerstörung bei Entzündungen ("Freisetzungshyperthyreose").
selten:
[Bearbeiten]- eine periphere Überempfindlichkeit gegenüber Schilddrüsenhormon,
- eine Hyperthyreosis factitia bei Überdosierung von T4 oder T3;
- übermäßige Einnahme von Schilddrüsenhormonen ( iatrogene Hyperhyreose )
- eine postpartale Hyperthyreose bei postpartaler Thyreoiditis
sehr selten:
[Bearbeiten]- ein TSH produzierender Hypophysentumor (leicht erkennbar an einer erhöhten TSH-Konzentration bei hohem FT3-Spiegel),
- extrathyreoidale SD Hormonproduktion ( zb Zungengrundstruma mit heißem Knoten )
- eine paraneoplastisch vermehrte Produktion stimulierender Substanzen,
- erhöhte Hormonproduktion durch große Tumormasse eines differenzierten Schilddrüsenkarzinoms.
- Jodexzeß
- Thyreoidea- Hormon-Rezeptor-ß (THRB, THR1, ERBA2) - Resistenz
Latente Hyperthyreose
[Bearbeiten]TSH-Suppression, FT3 und FT4 normal
Nichtthyreoidale Ursachen für eine Laborkonstellation der latenten Hyperthyreose
[Bearbeiten]- Schwere andere Erkrankungen (Nonthyroidal illness, NTI):
- Organinsuffizienzen,
- Tumoren,
- Hunger,
- Anorexie,
- Alkoholismus,
- Cushing-Syndrom,
- Hypophysenvorderlappeninsuffizienz,
- Nebennierenrindeninsuffizienz,
- "Critical illness"
- Medikamente:
- Schilddrüsenhormone,
- Jodid,
- Glukokortikoide,
- Dopamin und -agonisten,
- Somatostatin und -analoga,
- Neuroleptika,
- Phenytoin,
- Kalziumantagonisten,
- Salizylate,
- Heparin
- Fortgeschrittenes Alter
- Depression
- Labortechnische Störeinflüsse
Thyreoidale Ursachen für eine Laborkonstellation der latenten Hyperthyreose
[Bearbeiten]- Behandelte Hyperthyreosen jeder Genese (während und öfter persistierend auch nach Therapie)
- Latente Hyperthyreose jeder Genese (Alle mit Hyperthyreosen einhergehenden Thyreopathien sind möglich)
- Asymptomatische latente Hyperthyreose (inzidentelle biochemische Aktivität)
- symptomatische latente Hyperthyreose
Literatur:
[Bearbeiten]- Latente Hyperthyreosen
- U. Tuschy, M. Derwahl, U. Deuß, R. Hampel, W. Meng, A. Meyer, J.Rendl, B. Saller
- UNI-MED Verlag AG, D-28323 Bremen
- U. Tuschy, M. Derwahl, U. Deuß, R. Hampel, W. Meng, A. Meyer, J.Rendl, B. Saller
Symptome der Überfunktion
[Bearbeiten]- Herzrasen : Ruhe-Puls über 90/min
- evtl. Hochdruck, Herzrhythmusstörungen
- evtl. erhöhte Blutdruckamplitude
- (Hoher systolischer Blutdruck, niedriger diastolischer Blutdruck)
- Unruhe, Hyperaktivität
- Gewichtsabnahme trotz übermäßigem Appetit
- vermehrtes Schwitzen, Überempfindlichkeit gegen Wärme
- Ist die Haut warm und feucht? Liegt eine vermehrte Zittrigkeit vor?
- evtl. Durchfall, Haarausfall etc.
- evtl. Schlaflosigkeit
- depressive Verstimmung bis zur Depression
- Reizbarkeit
- Augenerkrankungen (typisch für Morbus Basedow):
- Hervortretende Augen (Exophtalmus), trockene, brennende Augen, einseitig oder beidseitig (endokrine Orbitopathie)
Anamnesefragen
[Bearbeiten]- Ist Ihnen häufig warm, schwitzen Sie leicht?
- Sind Sie nervös und unruhig, leicht reizbar?
- Leiden Sie unter Konzentrationsstörungen?
- Haben sie einen schnellen Pulsschlag oder manchmal Herzrasen?
- Haben Sie aus unerklärlichen Gründen an Gewicht verloren?
- Haben Sie Schlafstörungen?
- Haben Sie häufig Stuhlgang, teilweise durchfallartig?
- Können Sie schlecht schlucken, haben Sie ein Engegefühl im Hals?
Diagnose
[Bearbeiten]- Bestimmung der Schilddrüsenhormonwerte T3, T4 und TSH und TRAK im Blut
- Ultraschall der Schilddrüse
- Szintigrafie der Schilddrüse
Beispiel einer typischen Hyperthyreose bei Morbus Basedow
[Bearbeiten]- FT4 5,5 ng/dl (normal 0,71 - 1,85)
- FT3 22,5 pg/ml (normal 1,64 - 3,45)
- TSH < 0,03 mU/l (normal 0,3 - 4,00)
- TRAK 20 mU/l (normal < 1)
In 90 % der Fälle sind die Auto-Antikörper TRAK bei Basedow positiv (diagnostischer Beweis). Bei autonomen Adenomen (heiße Knoten) sind die TRAK meist negativ und die Schilddrüse ist auch im Ultraschall oder der Szintigraphie sichtbar anders verändert, als bei Basedow.
Behandlung
[Bearbeiten]- Schilddrüsenbremsende Medikamente z. B. Thiamazol
- Betablocker
- Radiojodbehandlung
- Operative Entfernung der Schilddrüse
- Einzelne heiße Knoten können durch eine gezielte Alkoholverödung behandelt werden.
Weblinks
[Bearbeiten]Thyreotoxische Krise
[Bearbeiten]| ICD-10-Code | ||
|---|---|---|
|
Eine thyreotoxische Krise ist eine lebensbedrohliche Verschlimmerung einer Schilddrüsenüberfunktion. Meist entwickelt sich die Krise ziemlich akut.
Einteilung
[Bearbeiten]Grad 1
- Herz
- Tachykardie, oft absolute Arrhythmie
- Extreme Sinustachykardie (>150/min) oder Tachyarrhythmie bei bestehendem Vorhofflimmern
- Herzinsuffizienz durch Tachykardie
- Tachykardie, oft absolute Arrhythmie
- Hyperthermie
- hohes Fieber (38-41°C) mit Schwitzen
- Gastrointestinale Symptome
- Nausea
- Erbrechen
- profuse Durchfälle
- Exsikkose, Dehydratation
- Neurologische Symptome:
- Tremor,
- Unruhe, Agitiertheit
- Muskelschwäche vor allem der proximalen Muskulatur und des Schultergürtels und/oder Bulbärparalyse
Grad 2
- Zusätzlich zu Grad 1
- Bewußtseinsstörungen (Somnolenz,Stupor),
- Desorientiertheit und psychotische Symptome
Grad 3
- Zusätzlich zu Grad 1
- Koma
- Grad 3a:
- jünger als 50 Jahre
- Grad 3b:
- älter als 50 Jahre
- Grad 3a:
- Koma
Diagnose
[Bearbeiten]- TSH niedrig
- T3 und T4 erhöht
Diagnostisches Punktesystem bei thyreotoxischer Krise
[Bearbeiten]Körpertemperatur (°C) Punkte ---------------------------- 37,2–37,7 5 37,8–38,2 10 38,3–38,8 15 38,9–39,4 20 39,5–39,9 25 > 40 30 ---------------------------- Herzfrequenz Punkte ---------------------------- 99–109 5 110–119 10 120–129 15 130–139 20 >140 25 ---------------------------- ZNS Symptome Punkte ---------------------------- mild (Agitiert) 10 mässig 20 (Delirium, Psychose, Lethargie) schwer 30 (Krampfanfall, Koma) ---------------------------- Herzinsuffizienz Punkte ---------------------------- mild 5 (Knöchelödeme) mässig 10 (bilaterale Rasselgeräusche) schwer 15 (Lungenödem) Vorhofflimmern 10 ---------------------------- GI/Leber Symptome Punkte ---------------------------- mässig 10 (Diarrhoe, Übelkeit, Erbrechen,Abdominalschmerzen) schwer (Ikterus) 20 ---------------------------- Auslösende Faktoren Punkte ---------------------------- keine bekannt 0 bekannt 10
Der Gesamtpunktwert wird durch Addition der Punktwerte der einzelnen Rubriken ermittelt.
- Werte >45 sprechen für eine hohe Diagnosewahrscheinlichkeit
- Werte 25 - 44 sprechen für eine mittelere Diagnosewahrscheinlichkeit
- Werte < 25 sprechen für eine niedrige Diagnosewahrscheinlichkeit
(modifiziert nach Burch / Wartofsky )
Differentialdiagnose
[Bearbeiten]- hochfieberhafter Infekt + Hyperthyreose
- Entzugsdelir + Hyperthyreose
- Sepsis + Hyperthyreose
Therapie
[Bearbeiten]- Ein Patient mit einer thyreotoxischen Krise gehört auf eine Intensivstation
- intravenöse thyreostatische Therapie (Thiamazol ((Favistan)) 80 mg 3x/die)
- diese hohe Thiamazolgabe nur bei gesicherter thyreotoxischer Krise !!
- Kaliumperchlorat (1.200 - 2.000 mg/Tag)
- nur bei gesicherter Diagnose
- unselektiver β-Blocker (Propranolol,3 x 80 mg p.o./die)
- alternativ Metoprolol iv nach Herzfrequenz und Blutdruck
- alternativ Esmolol iv
- Esmolol 0,5 - 1 mg Bolus iv, dann 5 - 15 mikrog/kg/min
- Digitalis: bei Tachyarrhythmia absoluta
- Prednisolon intravenös (50 mg 3x/die)
- über einen zentralen Venenkatheter Flüssigkeits- und Kalorienzufuhr (3 l/die, 2500 Kcal/die)
- engmaschige Elektrolytkontrolle und Bilanzierung
- Paracetamol: Fiebersenkung
- Sedativa (z.B. Diazepam): Ruhigstellung
Reduktion und Umsetzung der Therapie auf Tabletten nach klinischem Bild und Laborkontrollen.
Literatur
[Bearbeiten]- Thyreotoxische Krise - : ein Update KARGER S. ; FÜHRER D. ; Deutsche medizinische Wochenschrift 2008, vol. 133,no10, pp. 479-484
- Cooper DS. Hyperthyroidism. Lancet 2003;362:459–68.
- Davies TF. New thinking on the immunology of Grave’s disease. Thyroid Today 1992;15:1–11.
- Klein I, Ojamaa K. Thyroid hormone and the cardiovascular system: from theory to practice. J Clin Endocrinol Metab 1994;78:1026–7.
- Ross DS. Hyperthyroidism, thyroid hormone therapy, and bone. Thyroid 1994;4:319–26.
- O’Brien T, Katz K, Hodge D, Nguyen TT, Kottke BA, Hay ID. The effect of the treatment of hypothyroidism and hyperthyroidism on plasma lipids and apolipoproteins AI, AII and E. Clin Endocrinol 1997;46:17–20.
- Burch HB, Wartofsky L. Life-threatening thyrotoxicosis. Thyroid storm. Endocrinol Metab Clin North Am 1993;22: 263–77.
- Cooper DS. Antithyroid drugs. N Engl J Med 1984;311: 1353–62.
- Roti E, Robuschi G, Gardini E, Montermini M, Salvi M, Manfredi A, et al. Comparison of methimazole, methimazole and sodium ipodate, and methimazole and saturated solution of potassium iodide in the early treatment of hyperthyroid Graves’ disease. Clin Endocrinol (Oxf) 1988;28:305–14.
- Geffner DL, Hershman JM. Beta-adrenergic blockade for the treatment of hyperthyroidism. Am J Med 1992;93:61–8.
- Torring O, Tallstedt L, Wallin G, Lundell G, Ljunggren JG, Taube A, et al. Graves’ hyperthyroidism. Treatment with antithyroid drugs, surgery, or radioiodine. A prospective,randomised study. Thyroid Study Group. J Clin Endocrinol Metab 1996;81:2986–93.
- Franklyn, The management of hyperthyroidism, New Engl J Med, 1994 330: 1731-1738
- Feely et al., Propranolol dosage in thyrotoxicosis, J Clin Endocrinol Metab, 1980 51:658-661
- Newman et al., Amiodarone and the thyroid : a practical guide to the management of thyroid dysfunction induced by amiodarone therapy, Heart 1998 79:121-127
- Daniels, Amiodarone-induced thyrotoxicosis, J Clin Endocrinol Metab, 2001 86(1) 3-8
- McKenna, Graves` disease, The Lancet, 2001 357: 1793-1796
- Martino et al., The effects of amiodarone on the thyroid, Endocrine Rev., 2001 22:240-254
- Bogazzi et al., Color flow doppler sonography rapidly differentiates type I and type II amiodaroneinduced thyrotoxicosis, Thyroid 1997 7: 541-545
- Chopra and Baber, Use of oral cholecystographic agents in the treatment of amiodarone-induced hyperthyroidism, J Clin Endocrinol Metab, 2001 86(10): 4707-4710
- Ligtenberg et al., Plasmapheresis in thyrotoxicosis, Ann Int Med 1999, 131: 71-72
- Aghini-Lombardi, Treatment of amiodarone iodine-induced thyrotoxicosis with plasmapheresis and methimazole, J Endocrinol Invest, 1993 16(10): 823-826
- Binimelis et al., Massive thyroxine intoxication : evaluation of plasma extraction, Int Care Med, 1987 13(1) :33-38
- Amaras and Marel, Failure of plasmapheresis, corticosteroids and thionamides to ameliorate a case of
protracted amiodarone-induced thyroiditis, Clin Endocrinol, 1996 45(3): 365-368
- Gough and Meyer-Witting, Surgery and anaesthesia for amiodarone-associated thyrotoxicosis, Aust N Z J Surg, 2000 70:155-156
- Claxton et al., Refractory amiodarone-associated thyrotoxicosis : an indication for thyroidectomy, Aust N Z J Surg, 2000 70:174-178
- Burger A.G., Philippe J. :Thyroid emergencies. Bailliere Clinical Endocrinology and Metabolism, 6,77-93,1992.
- Hehrmann R.: Thyrotoxic crisis. Pitfalls in diagnosis- intensive therapy. Fortschr Med.,114, 114- 117,1996.
- Die thyreotoxische Krise und das Myxödemkoma Zeitschrift Intensivmedizin und Notfallmedizin Heft Volume 41, Number 8 / November 2004 Seiten 573-582 S. Zierhut und C. Girlich
- Herrmann, J.: Neuere Aspekte in der Therapie der thyreotoxischen Krise (Übersicht). Dtsch. Med.Wochenschr. 103, 166 (1978)
- Pickardt, C. R., Gröschel, G., Horn, K., Rinke, H., Schramm, W., Unterholzner, H.: Plasmapherese an Hohlfasermembranen in der Behandlung der thyreotoxischen Krise. Verh. Dtsch. Ges. Inn. Med. 86 (1980)
- Das kann eine thyreotoxische Krise sein! BARWITZ Harald J. K. ; MMW. Fortschritte der Medizin ISSN 1438-3276 2002, vol. 144, no6, pp. 38-40
- B. Mödl, A. Wirtzfeld, R. Terfloth, H.J. Hetzer, M.M. Linder, A. Witzfeld: Thyreotoxische Krise mit Multiorganversagen, Intensivmed (1999), 36: 454-461
Links
[Bearbeiten]- http://www.medicalforum.ch/pdf/pdf_d/2005/2005-37/2005-37-075.PDF
- Fallbericht aus der Schweiz
- http://www.praxis.ch/pdf/2001/PX_19/Px_2001_90_853.pdf
- Fallbericht 2 aus der Schweiz
Basedowsche Krankheit (Graves Disease)
[Bearbeiten]| ICD-10-Codes Morbus Basedow | ||
|---|---|---|
|
Morbus Basedow oder Basedowsche Erkrankung (lateinisch „Morbus“ = die Krankheit) ist im deutschen Sprachraum benannt nach dem deutschen Erstbeschreiber (1840) Carl von Basedow. Im englischsprachigen Raum wird sie nach dem Erstbeschreiber Dr. Graves (1835) Graves Disease genannt, weitere Bezeichnungen sind Autoimmunthyreopathie Typ 3, Immunthyreopathie oder Immunhyperthyreose.

Allgemeines
[Bearbeiten]Es handelt sich um eine Autoimmunerkrankung, die im Allgemeinen eine mäßige Vergrößerung (Struma Kropf) und Überfunktion der Schilddrüse zur Folge hat. Die vom Körper gegen das Schilddrüsengewebe gebildeten Antikörper binden an den Rezeptor für Thyreotropin (TSH), ein Hormon welches von der Hypophyse (Hirnanhangdrüse) zur Stimulierung und somit zur Regelung der Schilddrüsenfunktion gebildet wird.
Diese Antikörper heißen TSH-Rezeptor-Antikörper (TRAK) und stimulieren nun ständig die hormonbildenden Zellen (Hyperthyreose). Positive TRAK beweisen einen Morbus Basedow. Gleichzeitig sinkt im Allgemeinen der Anteil des von der Hypophyse produzierten TSHs stark ab, weil die Hypophyse im Rahmen des Regelkreises von Hypophyse und Schilddrüse die Information bekommt, weniger TSH zu produzieren, weil bereits ausreichend Hormone gebildet werden (nur leider in einem pathologischen Zusammenhang, doch dies wird nicht differenziert).
Die Diagnose gelingt in vielen Fällen allein durch eine Blutuntersuchung. Erniedrigte (oft nicht messbare) TSH Werte und erhöhte Hormonwerte (idealerweise sollen die freien Hormone untersucht werden, also fT3 oder fT4) sowie das Vorhandensein von TRAK sind beweisend für einen Morbus Basedow. Als ergänzende Untersuchung wird oft eine Sonographie der Schilddrüse und gelegentlich auch eine Szintigraphie durchgeführt.
Frauen erkranken sieben Mal häufiger als Männer. Dabei liegt der Krankheitsbeginn bei ihnen häufig in Zeiten des hormonellen Umbruches (Pubertät, Schwangerschaft, Klimakterium). Insgesamt sind ca. 6 % der Bevölkerung betroffen. Es existiert eine genetische Anlage für die Krankheit. Weitere Ursachen der Erkrankung sind nach wie vor nicht geklärt.
Ursachen
[Bearbeiten]Wie bei vielen Autoimmunerkrankungen sind auch bei Morbus Basedow die genauen Ursachen der Krankheit nicht bekannt. Es wird davon ausgegangen, dass – neben der genetischen Veranlagung – ein oder mehrere Faktoren zum Ausbruch der Krankheit führen:
- Psychische Belastung (Stress). Stress als akuter Auslöser ist durch zahlreiche anekdotische Berichte belegt (unter anderem durch Erfahrungsberichte von Ferdinand Sauerbruch im 1. Weltkrieg und während seiner Zeit an der Charité in Berlin). Auch aktuelle Berichte liegen vor. Nach einer Studie im Fachblatt "Thyroid" stieg nach dem Krieg auf dem Balkan in den 1990ern die Zahl der Morbus Basedow Neuerkrankungen in Serbien deutlich an.
- Infektion durch Bakterien (Yersinien) oder Viren. Dieser Auslöser wird allerdings zunehmend kontrovers diskutiert.
- zu hohe Iodaufnahme zum Beispiel im Rahmen der Iodmangelprophylaxe, Kontrastmittelinjektionen oder Einnahme von stark iodhaltigen Medikamenten, wie z. B. Amiodaron. Allerdings führt eine hohe Jodaufnahme bei gesunden Menschen nur selten zu einem Morbus Basedow.
Symptome
[Bearbeiten]Die Symptome der Basedowschen Erkrankung bestehen aus den Symptomen der Schilddrüsenüberfunktion und denen der Immunerkrankung. Typisch für die Basedow-Erkrankung gilt die sog. Merseburger Trias (benannt nach dem Geburtsort Basedows, Merseburg):
- Struma (Kropf), eine Vergrößerung der Schilddrüse
- Tachykardie (Pulsbeschleunigung)
- Exophthalmus (Hervortreten des Augapfels)
Diese Trias sieht man heute nur noch selten, da die meisten Fälle von Basedow schon frühzeitig erkannt werden, so daß die Augensymptome nur noch selten zu finden sind.
Symptome der Schilddrüsenüberfunktion
[Bearbeiten]- Erhöhter Puls, Herzrasen, Herzrhythmusstörungen (vor allem Vorhofflimmern)
- hoher Blutdruck
- Nervosität, Reizbarkeit, Ruhelosigkeit
- Schlafstörungen
- Zittern der Hände, plötzliche Grobmotorik
- Wärmeintoleranz
- Schwitzen
- Gewichtsverlust trotz hoher Nahrungsaufnahme
- Durchfall
- Hunger
- Durst
- Zyklusstörungen
- Angst-/ Panikattacken
- häufiger nächtlicher Harndrang
Mögliche Symptome der Immunerkrankung
[Bearbeiten]- Augenerkrankung (Endokrine Orbitopathie)
- Gelenkschmerzen
- Rückenschmerzen
- Muskelschmerzen
- Haarausfall
- Ödeme an den Unterschenkeln (prätibiales Myxödem), welches sich durch eine gelbliche, bzw. blaurote und grobporige Schwellung an der Tibia (Schienbein) kennzeichnet.
Symptome der endokrinen Orbitopathie
[Bearbeiten]
Die bei Morbus Basedow sehr häufig vorkommende Augenerkrankung äußert sich in folgenden Symptomen
- Hervortreten der Augen
- Ungenügender Lidschluss
- Trockenheit
- erhöhte Lichtempfindlichkeit
- Druck- und Fremdkörpergefühl
- Rötung
- Vermehrtes Auftreten von Bindehautentzündungen
- Brennen und Tränen der Augen
- das Sehen von Doppelbildern
Beim letztgenanntem Symptom ist ein Augenarztbesuch nicht mehr aufzuschieben, denn die im Rahmen des Immunprozesses ablaufenden Veränderungen in der Augenhöhle führen nicht nur zu Fehlstellungen (Schielen), sondern können auch auf den Sehnerv drücken und zu bleibenden Schäden führen (eingeschränkte Sehfunktion!)
Therapie
[Bearbeiten]Bei der Therapie des Morbus Basedow handelt es sich immer nur um die Behandlung der Symptome. Eine Behandlung der Ursachen ist bislang nicht möglich.
Folgende Therapieformen werden zur Zeit eingesetzt:
Medikamentös
[Bearbeiten]Durch die Gabe von Thyreostatika (Thiamazol, Carbimazol, Propylthiouracil)wird der Iodeinbau in die Schilddrüse und damit die Hormonproduktion gehemmt. Die Therapiedauer beträgt 6 bis 12 Monate. Hierbei wird die Dosierung die Thyreostatika langsam so weit reduziert, bis normale Schilddrüsenhormonwerte im Blut nachzuweisen sind (Euthyreose). Danach wird das Medikament abgesetzt (Auslassversuch). Zum Teil kommt es hiernach zu einer spontanen (Selbst-)„Heilung“. Die Rezidivrate ist jedoch sehr hoch (insbesondere bei Patienten mit hohen TRAK Werten) und wird in der Literatur mit 40 - 60 % angegeben. Aufgrund der möglichen Nebenwirkungen der Thyreostatika (u. a. Verminderung der weißen Blutkörperchen, Erhöhung der Leberwerte) sollten diese nicht in zu hoher Dossis eingesetzt werden. Bei Vorliegen eines Rezidives ist eine weitere medikamentöse Therapie nicht mehr erfolgversprechend, so dass eine definitve Therapie (Radioiodtherapie oder Operation) empfohlen wird.
Radioiodtherapie
[Bearbeiten]Durch Gabe von radioaktivem Iod-131 werden die Zellen der Schilddrüse bei der Radioiodtherapie so geschädigt, dass sie innerhalb von 2-6 Monaten nach der Therapie die Produktion von Schilddrüsenhormonen einstellen. Je nach verabreichter Dosis ist eine nachfolgende Unterfunktion wahrscheinlich und Ziel der Therapie. Die lebenslange Einnahme von Schilddrüsenhormonen (als Tabletten oder Tropfen) ist dann notwendig. Im Gegensatz zu den Thyreostatika können diese relativ problemlos über lange Zeit eingenommen werden.
Operativ
[Bearbeiten]
Das Schilddrüsengewebe wird bei einer Schilddrüsenresektion bis auf einen minimalen Rest operativ entfernt. Die Nebenschilddrüsen, die für den Kalziumhaushalt des Körpers überlebenswichtig sind, müssen erhalten bleiben. Womit auch schon ein mögliches Operationsrisiko erwähnt wurde, nämlich die Beschädigung respektive versehentliche Mitentfernung der Nebenschilddrüsen (relativ seltenes Risiko, da diese im Falle einer Entfernung gegebenenfalls auch wieder eingepflanzt werden können) Patienten, denen die Nebenschilddrüsen fehlen oder deren Funktion dauerhaft gestört ist, müssen das fehlende Kalzium und Vitamin D als Tabletten, ggf. sogar per Infusion zu sich nehmen.
Ebenfalls besteht das Risiko einer Beschädigung des Stimmbandnerven, es kann zu einer vorübergehenden Sprachunfähigkeit (Rekurrensparese) kommen. Auch diese Komplikation ist heute seltener, da moderne Einsatzgeräte (Neuromonitor) in vielen Kliniken zum Einsatz kommen. Angestrebt wird auch hier eine Unterfunktion, die ebenfalls mit Tabletten oder Tropfen ausgeglichen wird, denn die nun fehlenden Schilddrüsenhormone müssen ersetzt werden, da der Körper auf sie angewiesen ist (gegeben wird in der Regel ein T4 Präparat, Thyroxin, es darf kein Iodpräparat verschrieben werden). Jedoch können auch Kombipräparate, eine Mischung aus T4 und T3, eingesetzt werden. Die Patienten sollten nach individueller Wohlfühldosis eingestellt werden, wobei ein TSH-Wert um 1 herum angestrebt wird.
Literatur
[Bearbeiten]- Graves RJ. New observed affection of the thyroid gland in females.(Clinical lectures.) London Medical and Surgical Journal (Renshaw), 1835; 7: 516-517. Nachdruck in Medical Classics, 1940;5:33-36.
- Von Basedow KA. Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle. [Casper's] Wochenschrift für die gesammte Heilkunde, Berlin, 1840, 6: 197-204; 220-228. Englische Übersetzung in: Ralph Hermon Major (1884-1970): Classic Descriptions of Disease. Springfield, C. C. Thomas, 1932. 2nd edition, 1939; 3rd edition, 1945.
- Von Basedow KA. Die Glotzaugen. [Casper's] Wochenschrift für die gesammte Heilkunde, Berlin, 1848: 769-777.
- Brakebusch / Heufelder / Zuckschwerdt: „Leben mit Morbus Basedow“ Ein Ratgeber für Betroffene. Ausführliche Erläuterungen zu Symptomen, Therapie, Hormonen und Ursachen, 2002, ISBN 3-88603-799-1
Weblinks
[Bearbeiten]- Gut verständliche, ausführliche Beschreibung der Krankheit
- www.morbusbasedow.de - Umfangreiche Informationen bezüglich der Krankheit, geschrieben von zwei Medizinern
- www.schilddruesenspezialisten.de Authentische Erfahrungsberichte von Betroffenen, eine Arztliste, FAQ u. v. m
Endokrine Orbitopathie (EO)
[Bearbeiten]Die endokrine Orbitopathie (EO) ist eine entzündliche Erkrankung der Augenhöhle, die meist im Zusammenhang mit einer autoimmunen Schilddrüsenerkrankung vom Typ Morbus Basedow auftritt. Ausmaß der Schilddrüsen Überfunktion, ein großes Schilddrüsen-Volumen und hohe TSH-Rezeptor-Antikörper (TRAK) Spiegel stehen in Zusammenhang mit einem schweren Krankheitsverlauf.
Rauchen und Stress zählen zu den Umwelteinflüssen, die die EO beeinflussen. Weiterhin besteht eine starke genetische Veranlagung. Die Festlegung des Klinischen Aktivitäts- Scores und des Schweregrades der EO ist Ausgangspunkt für die Stadien abhängige Therapie.
Bei aktiver Erkrankung stehen die orale und die intravenöse (Megadosis) Steroidtherapie und/oder Orbitaspitzenbestrahlung noch immer an erster Stelle. Der Effekt neuer antientzündlicher Medikamente (Somatostatinanaloga, Antioxidantien) muss noch in kontrollierten Studien geprüft werden.
Im inaktiven Stadium stehen neue und klassische Operationstechniken zur Verfügung. Dabei sollte ein Orbitaeingriff zuerst, anschließend Augenmuskelchirurgie und zuletzt die Lidchirurgie erfolgen.
Epidemiologie
[Bearbeiten]Vorkommen und Häufigkeit
[Bearbeiten]Die Endokrine Orbitopathie tritt am häufigsten (90-95 %) im Rahmen einer Autoimmunthyreopathie vom Typ Morbus Basedow (MB), das heißt mit Schilddrüsen Überfunktion und positiven TRAK, seltener (3-5 %) im Rahmen einer Autoimmunthyreopathie vom Typ Hashimoto, das heißt mit Schilddrüsen Unterfunktion, Thyroxinperoxidase- und Thyreoglobulin-Antikörpern und ganz selten (0.5-5 %) ohne begleitende Schilddrüsen-Erkrankung auf.
Die Häufigkeit des Morbus Basedow beträgt 22 von 1000 Personen.
Zeitlicher Zusammenhang zur Manifestation der Schilddrüsen-Überfunktion
[Bearbeiten]Bei 46-60 % der Patienten tritt die Endokrine Orbitopathie innerhalb von 6 Monaten zusammen mit der Schilddrüsen-Überfunktion auf. Bei ca. 30 % manifestiert sich die Schilddrüsen-Überfunktion Jahre bis Jahrzehnte vor der Augenerkrankung. Die Augenerkrankung tritt dann häufig mit einem Rezidiv der Schilddrüsen-Überfunktion auf. In einem kleinen Prozentsatz (ca. 10 %) gehen die Symptome der Augenerkrankung der Schilddrüsen Erkrankung wenige Jahre voraus.
Manifestationsalter und Geschlechtsverteilung
[Bearbeiten]Am häufigsten manifestiert sich die Endokrine Orbitopathie zwischen dem 40. und 50. Lebensjahr. Manche Autoren geben auch eine zweigipflige Häufigkeitskurve mit einem weiteren Gipfel zwischen dem 25. und 35. Lebensjahr an. Bei der Schilddrüsen-Überfunktion zeigt sich eine deutliche Bevorzugung des weiblichen Geschlechts (5-10 Frauen : 1 Mann) etwas geringer für die Endokrine Orbitopathie (2-5 Frauen : 1 Mann).
Genetische Veranlagung
[Bearbeiten]Wie bei allen Autoimmunerkrankungen wird eine genetische Veranlagung diskutiert, was im wesentlichen aus Studien an Zwillingen resultiert. Für die Endokrine Orbitopathie und den Morbus Basedow besteht eine Konkordanzrate von 35 % für monozygote und von 3 % für dizygote Zwillinge. Daraus ergibt sich eine genetische Prädisposition für beide Erkrankungen von 79 %. Bei einem bereits vorhandenen Patienten in der Familie haben weibliche Verwandte ersten Grades ein 5-8 %iges Risiko ebenfalls zu erkranken. Das Risiko für männliche Verwandte ist wesentlich geringer.
Klinisches Bild
[Bearbeiten]Der typische Symptomenkomplex besteht (in absteigender Häufigkeit) aus
- Lidretraktion (Zurückbleiben des Oberlides)
- Weichteilschwellungen (z.B. Ödeme)
- Exophthalmus (Hervortreten der Augen, "Glubschaugen")
- Bewegungsstörung der Augen
- Sehstörung
Die entzündlichen Veränderungen des Bindegewebes der Augenhöhle erzeugen bei fast allen Patienten ein sehr charakteristisches Krankheitsbild. Allerdings kann das Ausmaß der Manifestation sehr stark variieren, sowohl zwischen unterschiedlichen Patienten als auch bei einem Patienten zwischen beiden Augen. Circa 50 % aller Basedow-Patienten entwickeln klinisch sichtbare Augensymptome. Im Kernspin sind jedoch Muskelverdickungen auch bei 2/3 der Patienten sichtbar, die klinisch keine Zeichen einer EO aufweisen. Bei den meisten Patienten verläuft die EO mild bis mittelschwer, nur in 3 – 5 % entwickeln die Patienten eine schwerste EO mit Kompression des Sehnervs (Optikuskompression).
- Lidretraktion: Die häufigste (ca. 90 %) und zugleich typischste Manifestation ist die Lidretraktion am Oberlid (sogenanntes Dalrymple-Zeichen). Diese ist entweder funktionell bedingt durch eine verstärkte Innervation des M. tarsalis Müller (folge eines erhöhten Sympathikotonus durch Schilddrüsen Überfunktion), oder bedingt durch eine fibrotische Verkürzung der Lidretraktoren bzw. eine erweiterte Lidspalte auf Grund eines starken Exophthalmus. Das Stellwag-Zeichen bezeichnet einen seltenen Lidschlag bei endokriner Orbitopathie.
- Weichteilschwellungen: Am zweithäufigsten treten bei ca. 80 % der Patienten in der aktiven Phase der Erkrankung entzündliche Weichteilsymptome auf (Lidödeme, Lidrötung, Karunkelschwellung, Bindehautinjektion, Bindehautchemosis, Limbuskeratitis).
- Exophthalmus: Zwischen 50-60 % der Patienten entwickeln aufgrund der Volumenzunahme in der Augenhöhle (Orbita), vor allem durch Zunahme des dortigen Fettgewebes, an einem oder beiden Augen einen Exophthalmus und einen Fettprolaps durch das Septum orbitale hindurch. Wenn diese beiden Mechanismen den Entlastungsdruck des zunehmenden Augenhöhlengewebes nicht auffangen, führt dies - besonders bei Patienten mit einer kleinen knöchernen Orbita - zu einem Anstieg des orbitalen Gewebedrucks, der sich direkt auf das Auge überträgt. Dies führt zu einem erhöhten Augendruck, der meist auch ein Anzeichen für eine beginnende Kompression des Sehnervs (nervus opticus) darstellt.
- Bewegungsstörungen:: Um 40 % der Patienten, die eine Muskelbeteiligung aufweisen, entwickeln eine Einschränkung der Augenbeweglichkeit mit Doppelbildern. Am häufigsten kommt es zu einer Einschränkung der Dehnbarkeit der Mm. recti inferiores und damit zu einem ein- /oder beidseitigen Hebungsdefizit. Am zweithäufigsten sind die Mm. recti mediales betroffen. Bei stärkerer Verkürzung dieser Muskeln entwickelt der Patient ein Innenschielen. Das Moebius-Zeichen bezeichnet eine Konvergenzschwäche bei endokriner Orbitopathie.
- Sehstörungen: Bei ausgeprägter Schwellung der Augenmuskeln im sogenannten Muskelkonus besteht die Gefahr einer Sehnervkompression. Begleitend sieht man eine deutliche Abflusstauung des Blutes mit Erweiterung der Venen rund um die Hornhaut (rote Augen!), und es kommt zu einem starken Anstieg des Augeninnendruckes. Eine Sehnervkompression bemerkt der Patient durch Farbsehstörungen (besonders der Farbentsättigung), Minderung der Sehschärfe (Visusminderung) und Verschwommensehen.
Die am häufigsten vom Patienten beklagten Symptome im Falle einer aktiven EO entstehen durch die Entzündung: Schmerzen bzw. Druckgefühl hinter den Augäpfeln und Schmerzen bei Augenbewegung, sowie wechselnde Doppelbildwahrnehmung. Über die Hälfte der Patienten beklagt Symptome der Benetzungsstörung: Fremdkörpergefühl, Augenbrennen, Trockenheitsgefühl, erhöhte Lichtempfindlichkeit. Weiterhin fühlen sich die Patienten durch Ihr verändertes Aussehen erheblich beeinträchtigt.
Krankheitsverlauf
[Bearbeiten]Die Erkrankung folgt in der Regel einem dreiphasigen Verlauf. Nach einer Phase der kontinuierlichen Verschlechterung erreicht die EO ein Plateau, um danach in vielen Fällen kontinuierlich wieder besser zu werden. Allerdings wird mit dem inaktiven Endstadium nur selten der Ausgangszustand wieder erreicht. Wichtig ist es, die Verschlechterung in der Phase der aktiven Erkrankung zu stoppen bzw. den Rückgang der Entzündung zu beschleunigen. Ferner sollte man das Erreichen des inaktiven Stadiums erkennen, um dann die operativen Korrekturen verbliebener Veränderungen zu beginnen. Zur Beurteilung der Prognose ist es wichtig zu wissen, dass sich bei 65 % der Patienten mit leichter und moderater EO die Erkrankung nach Erreichen einer normalen Schilddrüsenfunktion ganz ohne Therapie bessert. Bei 22 % bleibt die EO gleich und nur bei 13 % tritt eine Verschlechterung ein.
Behandlung der Erkrankung
[Bearbeiten]Kurzübersicht
[Bearbeiten]Aktive Form
[Bearbeiten]Milde EO und geringe subjektive Beschwerden
- Symptomatische Therapie- Licht/Windschutz, künstliche Tränen, Hochlagern des Kopfes beim Schlafen
Milde EO und geringe entzündliche Zeichen
- Abwarten des Spontanverlaufs
Schwere EO und hohe entzündliche Aktivität
- Glukokortikoide ( zb wöchentlich 1 * 0,5 g Prednison iv )
- evt Retrobulbärbestrahlung
Optikusneuropathie
- 0,5 - 1 g Prednisolon intravenös - wenn erfolglos
- Operative Dekompression
Alternative Verfahren:
- Ciclosporin, Octreotid, Immunglobuline in Kombination mit Glukokortikoiden
Inaktive Form
[Bearbeiten]Korrektur bleibender Defekte bei inaktiver EO Exophtalmus
- Ossäre Dekompression
Fettansammlung
- Fettgewebsresektion
Diplopie
- Operative Augenmuskelkorrektur
Lidretraktion
- Operative Korrektur
Medikamente
[Bearbeiten]Nach Erreichen einer euthyreoten Stoffwechsellage ist bei einer aktiven bzw. fortschreitenden EO ohne Spontan-Besserungstendenz eine antientzündliche bzw. immunsuppressive Therapie angezeigt, insbesondere bei entsprechendem Leidensdruck des Patienten.
Bei der Indikationsstellung muss man beachten, dass 65 % der Patienten mit leichter und moderater EO sich nach Erreichen einer euthyreoten Stoffwechsellage ganz ohne Therapie bessern. Ein Patient mit allen Risikofaktoren für einen schlechten Verlauf (hohe bzw. ansteigende TRAK, hohe Aktivität der Erkrankung, hoher Schweregrad, Raucher) sollte im Zweifelsfall behandelt werden.
Standard ist eine Steroidstoßtherapie, was in zwei randomisierten prospektiven Studien bewiesen wurde. Studien belegten auch, dass die Steroide intravenös besser toleriert wurden als wenn sie als Tabletten verabreicht wurden. Die intravenöse Gabe führte zu weniger Knochendemineralisierung und einem stärkeren Rückgang der TRAK.
Bei therapieresistenter EO gibt es folgende Alternativen:
Cyclosporin A: In einer randomisierten Studie (Steroide in absteigender Dosierung gegen Cyclosporin A über 12 Wochen) erwiesen sich die Steroide als besser wirksam. Allerdings sind Steroide in Kombination mit Cyclosporin A wirksamer als Steroide allein.
Somatostatin-Rezeptor-Agonisten: In einer Studie erwies sich Octreotide über 3 Monate s.c. weniger effektiv als Prednison über 3 Monate. Lanreotide erwies sich in einer kleinen kontrollierten Studie vergleichbar wirksam wie Octreotide. Die Besserung der EO war signifikant stärker als in der Kontrollgruppe.
Antioxidantien: Vielversprechend sind die Ergebnisse der „Münchner EO prevention study“. Untersucht wurde die Häufigkeit der Entwicklung einer EO bei Patienten, die bei Manifestation der SD-Überfunktion noch keine Zeichen einer EO aufwiesen. Nur 6 von 28 in der Antioxidantiengruppe (Selen, N-Acetyl-Cystein, Nicotinamid, Alpha-Liponsäure und Vitamine C und E), aber 13 Patienten der Placebogruppe entwickelten nach 18 Monaten eine EO.
Orbitaspitzenbestrahlung: Eine Orbitaspitzenbestrahlung ist bei Patienten mit mittelschwerer EO und Bewegungsstörungen angezeigt. Die Ergebnisse in jüngster Zeit veröffentlichter Studien haben den Wert der Orbitaspitzenbestrahlung etwas in Frage gestellt. Relativ konsistent ist jedoch der Nachweis der Besserung der Augenbeweglichkeit. Nach dem Stand der Literatur würde man eine Orbitaspitzenbestrahlung bei Patienten mit mittelschwerer EO und Motilitätsstörungen im Anschluss an oder parallel zu eine(r) Steroidtherapie empfehlen.
Für den Wirkungsnachweis von Methotrexat, Cyclophosphamid und Pentoxifilline gibt es nur unkontrollierte Studien. Im Durchschnitt wird eine Ansprechrate zwischen 50-60 % beschrieben.
Operation
[Bearbeiten]Voraussetzung für alle operativen Maßnahmen (außer der knöchernen Dekompression bei Optikuskompression, einer akuten Notsituation!) ist eine inaktive EO und unveränderte Befunde über 6 Monate. Weiterhin sollte möglichst der Auslassversuch der medikamentösen Schilddrüsentherapie erfolgt sein und mindestens 6 Monate zurückliegen, da in den ersten 6 Monaten nach Absetzen dieser Medikamente 80-90 % der Rezidive der Schilddrüsen Überfunktion auftreten (Insgesamt Rezidivrate der Schilddrüse 50 %). Bei einem Rezidiv der Schilddrüsen Überfunktion kann die EO wieder aktiviert werden. Im Falle eines Rezidivs der Schilddrüsen Überfunktion bzw. bei medikamentös nicht einstellbarer Schilddrüsen Funktion sollte die ablative Therapie der Schilddrüse (Radiojodtherapie, Operation der Schilddrüsen) vor den chirurgischen Korrekturen der EO erfolgen. Vor allem nach einer Radiojodtherapie muss man darauf achten, dass der Patient eine normale Schilddrüsen Funktion hat und regelmäßig kontrolliert wird.
Ist die optimale Ausgangssituation für die chirurgischen Maßnahmen erreicht, sollte man eine bestimmte Reihenfolge einhalten.
1. Orbitachirurgische Maßnahmen
Neben der Notfallsituation einer Optikuskompression sind ein entstellender Exophthalmus (knöcherne Dekompression) oder ein starker Prolaps des orbitalen Fettgewebes (Orbitafettresektion) Indikationen zu einem Orbitachirurgischen Eingriff. Eine Orbitadekompression reduziert den Exophthalmus, verbessert den venösen Abfluss reduziert aber die Augenbeweglichkeit.
2. Augenmuskeloperationen
Ziel der Augenmuskeloperation sind Verbesserung der Augenbeweglichkeit, Reduktion von Doppelbildwahrnehmung und Kopfzwanghaltung.
3. Lidoperationen
Ziel der Operation der Ober-und Unterlidretraktion sind die Reduktion einer eventuell vorhandenen Benetzungsstörung und die Wiederherstellung eines normalen Aussehens.
Einflussfaktoren auf den Krankheitsverlauf
[Bearbeiten]Rauchen
[Bearbeiten]Das Rauchen hat sich als starker Einflussfaktor für die EO erwiesen. Das Vorkommen einer EO unter Rauchern mit Morbus Basedow ist signifikant höher als bei Nichtrauchern. Weiterhin zeigte sich eine von der Zigarettenzahl abhängige Zunahme des Schweregrades der EO. In zwei prospektiven Studien konnte gezeigt werden, dass Rauchen das Risiko Fortschreitens der EO nach Radiojodtherapie erhöht und den Effekt der Steroidtherapie und der Orbitaspitzenbestrahlung reduziert.
Einfluss der Schilddrüsen Funktion
[Bearbeiten]Allein der zeitliche Zusammenhang zwischen Auftreten einer Schilddrüsen Überfunktion und einer EO lässt einen engen Zusammenhang zwischen beiden Erkrankungen vermuten. Die TRAK sind durch ihre TSH-Rezeptor Stimulation verantwortlich für die Schilddüsen Überfunktion. Ihre Bedeutung bei der EO wurde lange Zeit kontrovers diskutiert. In den jüngeren Arbeiten unter Nutzung neuer sensitiverer Assays zur TRAK Bestimmung wurde jedoch ein klarer Zusammenhang zwischen TRAK und der Aktivität sowie des Schweregrads der EO gefunden. Darüber hinaus haben Patienten mit Therapie resistenter EO signifikant häufiger höhere TRAK als Patienten, bei denen die klinische Aktivität durch die Therapie zurückgeht. In einer Verlaufsbeobachtung (TRAK-Bestimmung alle 3 Monate über 2 Jahre) wiesen Patienten mit einer milden EO signifikant niedrigere TRAK-Spiegel im Vergleich zu Patienten mit moderater bis schwerer EO auf. Diese Daten zeigen, dass man bei mehr als der Hälfte der Patienten den Verlauf der EO anhand der TRAK-Spiegel schon bei der ersten Kontrolle voraussagen kann.
Weiterhin erwartet man eine schlechte Prognose bei initial großer Schilddrüse und starker Überfunktion. Eine schlecht eingestellte Schildrüsen Funktion beeinflusst Manifestation und Verlauf einer EO negativ. Deshalb sind das Erreichen und die Aufrechterhaltung einer gleichmäßig normalen Schilddrüsen Funktion ein primäres Ziel der erfolgreichen EO Therapie.
Auch die Art der Schilddrüsen Therapie beeinflusst den Verlauf der EO. Obwohl in der Literatur nicht dokumentiert, lehrt die Erfahrung, dass sich die EO schon allein durch die thyreostatische Therapie bessert. Das ist sicher einerseits durch das Erreichen der Euthyreose bedingt andererseits aber auch durch die leichte immunsuppressive Wirkung der Antithyreostatika. Methimazol hemmt die Bildung freier Radikale der Monozyten. Zwei prospektive Studien zeigten, dass eine Radiojodtherapie bei 24-33 % der Patienten die Verschlechterung einer vorbestehenden EO bewirken kann. Das Risiko des Neuauftretens einer EO ist jedoch gering. Im Vergleich dazu liegt das Risiko der Verschlechterung einer EO unter thyreostatischer Therapie nur bei 4-10 % und nach Schilddrüsen Operation bei subtotaler Resektion bei 7-16 % und bei totaler Resektion bei 6%. Ursächlich werden für die höhere Verschlechterungsrate der EO nach einer Radiojodtherapie die Freisetzung von Schilddrüsen Antigenen durch die radiogene Zerstörung der Schilddrüse, die danach ansteigenden Schilddrüsen-Autoantikörperspiegel und die häufig erst mit Latenz nach der Radiojodtherapie diagnostizierte Schilddrüsen Unterfunktion (Hypothyreose) diskutiert.
Stress
[Bearbeiten]Auch sogenannte „stressful life events“ haben Einfluss auf die Entwicklung einer Autoimmunthyreopathie mit EO. Bei chronischem psychischen Stress ist der Erfolg der thyreostatischen Therapie ebenfalls geringer.
Spezialisten für EO
[Bearbeiten]- Herr Prof. Dr. George J. Kahaly, Mainz
Links
[Bearbeiten]- http://www.tellmed.ch/include_php/previewdoc.php?file_id=3627
- Schöne Zusammenfassung über die Behandlung der EO
Unterfunktion der Schilddrüse
[Bearbeiten]siehe Schilddrüse: Unterfunktion
Gutartige Schilddrüsentumoren
[Bearbeiten]Schilddrüsenkrebs
[Bearbeiten]Als Schilddrüsenkrebs (Schilddrüsenkarzinom, lat. Struma maligna) wird eine bösartige (maligne) Neubildung der Schilddrüse bezeichnet.
Vorkommen und Ursachen
[Bearbeiten]Frauen sind etwa dreimal so häufig betroffen wie Männer, der Altersgipfel liegt zwischen dem 25. und 50. Lebensjahr. Die Ursachen sind im Einzelnen nicht vollständig geklärt. Es besteht ein kausaler Zusammenhang mit dem Iodmangel (etwa 2,3fach erhöhtes Risiko). Auch radioaktive Strahlung spielt - wie bei vielen Krebserkrankungen - eine wesentliche Rolle: nach den Atombombenabwürfen auf Hiroshima und Nagasaki stieg das Risiko in den betroffenen Gebieten, ein Schilddrüsenkarzinom zu entwickeln, um ein Vielfaches an.
Symptome
[Bearbeiten]Als Symptome gelten derbe Knotenbildung im Bereich der Schilddrüse mit Wachstumstendenz, Heiserkeit und vergrößerte Halslymphknoten (Spätsymptome).
Diagnostik
[Bearbeiten]- Palpation ( Abtasten der Schilddrüse)
- Man tastet einen odere mehrere derbe , nicht verschiebliche Knoten
- Sonographie
- Szintigraphie,
- kalter Knoten
- Feinnadelpunktion oder Gewebsprobe des kalten Knotens mittels Punktion
(Beurteilung der entnommenen Zellen unter dem Mikroskop
- Bestimmung des Calcitoninspiegels im Serum (Erhöhung pathologisch, jedoch Abgrenzung zu einer Schilddrüsenüberfunktion notwendig)
- Kehlkopfspiegelung (Laryngoskopie)
- Bei einem krebsverdächtigen Knoten wird meist direkt eine Thyreoidektomie (Entfernung der Schilddrüse) mit anschließender Beurteilung des Zellgewebes (Histologie) durchgeführt.
Differentialdiagnose
[Bearbeiten]- Zyste
- Struma nodosa ( Knotenkropf (kalter Knoten / heißer Knoten)
- Adenom
- Metastasen (bspw. von einem Brustkrebs)
- Riedelstruma
Tumorarten und Therapie
[Bearbeiten]Im Wesentlichen liegen epitheliale Neubildungen (Karzinome) vor. Lymphome, Metastasen anderer Tumore oder andere Tumorformen können vorkommen, sind aber selten.
Follikuläres und papilläres Karzinom
[Bearbeiten]Sie machen 80 % aller bösartigen Schilddrüsentumore aus. Die Therapie besteht aus Kombination von radikaler Thyreoidektomie und Resektion aller verdächtigen Lymphknoten, einer (bzw. falls notwendig, mehrerer) Radiojodtherapie(n) sowie einer dauerhaften Einstellung auf eine leichte Schilddrüsenüberfunktion (Suppressionstherapie), um auffällige im Körper verbliebene kleinste Schilddrüsenreste (die möglicherweise bösartig sein könnten) vom Wachstum abzuhalten. Regelmäßige Kontrollen (Tumormarker Thyreoglobulin und Ultraschall) müssen lebenslang durchgeführt werden. Der Haupmetastasierungsweg des papillären Karzinoms ist lymphogen, wobei besonders regionäre Halslymphknoten betroffen sind. Das follikuläre Karzinom metastasiert in der Regel zuerst hämatogen.
Anaplastisches Karzinom
[Bearbeiten]Das anaplastische Karzinom macht 1-2 % aller bösartigen Schilddrüsentumore aus. Es ist hochmaligne. Die Behandlung erfolgt als totale Thyreoidektomie inkl. Neck-Dissection. Eine Chirurgische Intervention ist anzustreben, das anaplastische Karzinom ist jedoch oftmals inoperabel. Die Metastasierung erfolgt lymphogen und hämatogen.
Medulläres Karzinom (C-Zellkarzinom)
[Bearbeiten]Es macht circa 5 % bis 10 % der bösartigen Schilddrüsentumore aus. Die Mehrzahl der medullären Karzinome tritt sporadisch auf, bei 20 % läßt sich eine Mutation am ret-Proto-Onkogen nachweisen. Das medulläre Karzinom kann familiär gehäuft auftreten oder im Rahmen der Multiplen endokrinen Neoplasie Men2A oder 2B vermehrt vorkommen.
Der Tumormarker des medullären Karzinomes ist das Calcitonin.
Bei gefährdeten Personen sind enge Kontrollen des Schilddrüsenultraschalles und des Tumormarkers notwendig.
Als Behandlung sollte die Thyreoidektomie und Neck-Dissection bds. erfolgen. Adjuvante Therapieformen sind bis jetzt noch wenig effektiv, allerdings gibt es einige Ansätze in der Erprobung.
Nachsorge
[Bearbeiten]Zitat:
Die immunometrische Bestimmung von Serum Thyreoglobulin (S-Tg), ist nach Thyreoidektomie und Radiojodablation in der Nachsorge des differenzierten Schilddrüsenkarzinomen (DTC) ein verlässlicher und sensitiver Parameter eines Rezidivs in hypothyreoter Stoffwechsellage. Allerdings bilden ca. 20% der differenzierten Schilddrüsenkarzinome Thyreoglobulinantikörper aus, die neben der molekularen Heterogenität des Tg - Moleküls ursächlich für falsch negative Ergebnisse im Immunoassay sein können.
Prognose
[Bearbeiten]Folgende 5-Jahres-Überlebensraten werden im Allgemeinen angegeben (bei Behandlung):
- papilläres Karzinom 80-90 %
- follikuläres Karzinom 80 %
- medulläres Karzinom 60-70 %
- anaplastisches Karzinom unter 10 %
Literatur
[Bearbeiten]- Current management of medullary thyroid cancer.
- Sippel, Rebecca S; Kunnimalaiyaan, Muthusamy; Chen, Herbert
- Oncologist. 2008 May;13(5):539-47.
- Gute Übersichtsarbeit über das medulläre SD-CA
- Sippel, Rebecca S; Kunnimalaiyaan, Muthusamy; Chen, Herbert
Weblinks
[Bearbeiten]- http://www.krebshilfe.de/fileadmin/Inhalte/Downloads/PDFs/Blaue_Ratgeber/009_schilddruese.pdf
- Guter Patientenratgeber zum Thema Schilddrüsenkrebs
- www.dmoz.org - Schilddrüsenkrebs im Open Directory Project
- http://www.schilddruesenkrebs.de
- http://www.c-zell-karzinom-online.info
- http://www.selbsthilfegruppe.at/
- Selbsthilfegruppe für Schilddrüsencarcinom-PatientInnen Österreich
- http://www.forpath.org/0201/
- Ausführlicher Text über die histopathologische Differentialdiagnose von Schilddrüsentumoren
- In Englisch
- Ausführlicher Text über die histopathologische Differentialdiagnose von Schilddrüsentumoren
Fall
[Bearbeiten]36-Jähriger männlicher Patient aserbaidschanischer Herkunft stellt sich mit folgendem Befunden vor: ein szintigraphisch kalter Knoten links sowie eine sonografisch gesehene eher zystische Struktur mit 0,6cm Durchmesser zentral bis rechts im Lobus pyramidalis bei Struma nodosa. Palpatorisch und inspektorisch ist die Schilddrüse unauffällig. Der Calcitonin-Wert ist um das zehnfache erhöht (148,44pg/ml vs 15 als Normwert). Intraoperative Schnellschnitte (primär war eine Hemithyreoidektomie geplant) ergeben für den zentralen Prozess ein papilläres CA und für den linken kalten Knoten überraschenderweise ein medulläres CA, sowie in der entnommenen rechten Schilddrüsenhälfe noch ein bisher nicht gesehenes papilläres CA. Die OP wird ausgedehnt auf eine totale Strumektomie, sowie, wegen dem medullären CA, auf eine komplette modfizierte Neckdisektion beidseits mit Entfernung aller Lymphknoten entlang der Vagina Carotica und des m. Sternocleidomastoideus.
Seltene SD-Krankheiten
[Bearbeiten]Resistenz gegen Schilddrüsenhormone (resistance to thyroid hormone, RTH)
[Bearbeiten]Diese seltene Krankheit wird nach dem Entdecker auch Refetoff-Syndrom bezeichnet. Die Schilddrüsenhormonspiegel sind hoch, gleichzeitig wirken die Hormone vermindert. Die typische Laborkonstellation der Erkrankung lautet:
- erhöhter Thyroxin (T4)-und Trijodthyronin (T3)-Serumspiegel
- normaler oder erhöhter Thyreoidea stimulierendem Hormon (TSH) spiegel.
Ursächlich liegt eine Mutation der Beta1-Form des Schilddrüsenhormonrezeptors (thyroid hormone receptor, TR) vor.
Bisher wurden circa 600 Fälle in der Literatur beschrieben.
Riedel-Struma
[Bearbeiten]Die Riedel-Struma (Riedel-Thyreoiditis, „eisenharte Struma“) ist eine sehr seltene invasiv sklerosierende Schilddrüsenentzündung (Thyreoiditis), die meist bei Frauen mittleren Alters auftritt.
- Invasiv heißt hier: in die Umgebung einwachsend.
- Sklerosierend heißt: vernarbend.
Die Ursache der Erkrankung ist unbekannt. Es kommt es zu einer kompletten Zerstörung des Schilddrüsengewebes durch eine fibrosierende Proliferation (bindegewebigen Umbau) . Häufig ist eine Überschreitung der Schilddrüsenkapsel mit Infiltration des umgebenden Halsgewebes zu beobachten.
ICD 10
[Bearbeiten]E06.5 Riedel-Struma
Diagnostik
[Bearbeiten]Bei der klinischen Untersuchung zeigt sich eine tastbare und „eisenharte“ Schilddrüsenvergrößerung (Struma). Diese kann zu lokalen Problemen mit Einengung der Luftröhre und der Halsgefäße, aber auch zu einer Verdrängung großer Halsnerven bis zu einer Rekurrensparese führen. Die Schilddrüse ist beim Schluckakt nicht mehr verschieblich als Zeichen der Verwachsung mit dem umliegenden Halsgewebe, zeigt jedoch nur selten eine Schmerzempfindlichkeit.
Bei der Ultraschalluntersuchung der Schilddrüse lassen sich das Volumen bestimmen und knotige Veränderungen sowie Infiltration in das Halsgewebe nachweisen. Typischer Weise zeigt das Szintigramm bei der Riedel-Struma eine insgesamt erniedrigte Aufnahme des Technetiums. Bei Nachweis von kalten Knoten ergibt sich immer der Verdacht eines Krebses, was eine operative Entfernung zur Folge hat.
Man kann auch gezielt eine Gewebsprobe aus der betroffenen Schilddrüse entnehmen, um die Diagnose zu stellen.
Differentialdiagnosen
[Bearbeiten]Abzugrenzen sind vor allem Schilddrüsenkrebs und die fibröse Variante der Hashimoto-Thyreoiditis.
Therapie
[Bearbeiten]Da die Riedel-Struma ausschließlich lokale Probleme am Hals verursacht, sollte sie möglichst frühzeitig operativ entfernt werden. Bei der anschließenden feingeweblichen Beurteilung des entnommenen Gewebes kann dann auch eine Krebserkrankung ausgeschlossen (oder nachgewiesen) werden.
Es existieren keine gesicherten Erfahrungen mit konservativen Therapieansätzen. Nach der operativen Entfernung der Schilddrüse müssen lebenslang künstliche Schilddrüsenhormone eingenommen werden.
Literatur
[Bearbeiten]- Wien Klin Wochenschr. 1988 Apr 1;100(7):210-5.
- Chronic invasive fibrous thyroiditis (Riedel struma). Case report with special reference to preoperative diagnosis
- Beham A, Langsteger W, Schmid C, Lind P, Kronberger D. Institut fur Pathologische Anatomie, Universitat Graz.
- Artikel in deutscher Sprache
- Chronic invasive fibrous thyroiditis (Riedel struma). Case report with special reference to preoperative diagnosis
Weblinks
[Bearbeiten]- http://www.madeasy.de/6/riedel.htm
- http://www.emedicine.com/med/topic2036.htm
- Ausführlicher Übersichtsartikel mit Histologiebildern in Englisch



