Sensorische Systeme/ Allgemeines/ Schmerzwahrnehmung
Einführung: Was ist Schmerz?
[Bearbeiten]Schmerz wird von der International Association for Study of Pain (IASP) definiert als "eine unangenehme sensorische und emotionale Erfahrung, die mit einer tatsächlichen oder potenziellen Gewebeschädigung verbunden ist oder in Bezug auf einen solchen Schaden beschrieben wird". Außerdem ist Schmerz auch ein komplexer sensorischer Weg, der für das Überleben essentiell ist. Die Mechanismen des Nervensystems, die Reize detektieren, welche Gewebeschäden verursachen können, sind unabdingbar, um Verhaltensprozesse auszulösen, die das Gewebe vor gegenwärtigen oder weiteren Schäden schützen. Zu diesen Reizen gehören unter anderem starke mechanische Kräfte, Temperaturextreme und Exposition gegenüber Chemikalien oder Sauerstoffmangel.
Arten von Schmerz
[Bearbeiten]Im Allgemeinen können Schmerzen in zwei Kategorien unterteilt werden: akute oder chronische.
Typische Merkmale von akuten Schmerzen sind ein plötzlicher Beginn und eine Dauer von weniger als sechs Monaten. Die zugrundeliegende Pathologie kann oft leicht identifiziert werden, da akuter Schmerz durch seine Assoziation mit Gewebeschäden gut lokalisiert und definiert ist. Darüber hinaus hört der akute Schmerz normalerweise mit der Gewebeheilung auf.
Im Gegensatz dazu erstreckt sich der chronische Schmerz über die normale Genesungszeit hinaus und bleibt nach dem normalen Heilungsprozess bestehen. Er kann, muss aber nicht, anhaltenden Gewebeschaden signalisieren und ist oft mit der Aktivierung von dysfunktionalen neurologischen oder psychologischen Reaktionen verbunden. Viele Patienten, die an chronischen Schmerzen leiden, haben eine lange Geschichte von misslungenen Behandlungen (d. h. Behandlung wurde versucht, erzielte aber keine Wirkung) und zeigen übliche Nebenwirkungen wie Depression, Wut, Frustration, vermindertes Aktivitätsniveau oder verminderten Schlaf.
Aber der Schmerz kann auch nach der Art des Schadens klassifiziert werden, der ihn verursacht. Die zwei Hauptkategorien sind dann nozizeptiver Schmerz, der durch Gewebeverletzung verursacht wird, und neuropathischer Schmerz, der aufgrund von Nervenschäden entsteht. Typische Unterkategorien sowie Merkmale und Mechanismen sind in Tabelle 1 aufgeführt. Eine weit diskutierte dritte Kategorie ist der psychogene Schmerz, der häufig entweder in Gewebe- oder Nervenschäden seinen Ursprung hat, aber der durch diesen Schaden verursachte Schmerz wird durch psychologische Faktoren wie z. B. Angst, Depression, Stress oder Besorgnis verlängert. Fälle, in denen Schmerzen nur von einer psychischen Erkrankung herrühren, sind selten.
| Art des Schmerzes | Charakteristiken | Mechanismen |
|---|---|---|
| Nozizeptiv
- Somatisch (Gewebeverletzung) - Viszeral (Eingeweide) - Entzündlich (muskuloskelettal) |
Oberflächliche (Haut) oder tiefe Schmerzen (Muskel, Faszie, Sehnen) Konstant oder krampfhaft, schlechte Lokalisierung Lokalisierter oder diffuser Schmerz, Hyperalgesie, Allodynie |
Mechanische, thermische oder chemische Reize Viszerale Dehnung Verbunden mit lokalisierter Entzündung |
| Neuropathisch
- Kausalgie (Neuralgie, ZNS-Läsionen, ...) - Funktionell (FM, Thalamus-Syndrome, ...) |
Spontaner, paroxysmaler Schmerz, Allodynie, Hyperalgesie Diffuse tiefe Schmerzen, Hyperalgesie, Allodynie |
Periphere oder ZNS-Läsionen Dysregulation von exzitatorischen oder inhibitorischen Mechanismen im ZNS |
Nozizeptive Signalwege
[Bearbeiten]
(Basierend auf ScoreUSMLE (2015)[2])
Um die Physiologie des Schmerzes zu verstehen, ist es am einfachsten, die nozizeptiven Signalwege von den sensorischen Rezeptoren zum Gehirn zu verfolgen. Besondere Aufmerksamkeit ist der Integration und Modulation des nozizeptiven Signals an verschiedenen Stufen des zentralen Nervensystems (ZNS) zu widmen. Während sich Schmerz auf die Wahrnehmung eines Gefühls bezieht, bezieht sich Nozizeption (lat. nocere, "verletzen") auf den sensorischen Prozess, der ausgelöst wird. Schädliche Reize wie starke mechanische Kräfte oder Temperaturextreme werden von sogenannten Nozizeptoren,die diese Reize in elektrische Signale umwandeln, erkannt. Die Signale werden dann durch die primären afferenten Nervenfasern zum Rückenhorn des Rückenmarks geleitet. Dort bilden die primären Neuronen einen synaptischen Kontakt mit den sekundären Neuronen, die sich sofort im Rückenmark kreuzen und dann die spinothalamischen und spinoretikulären Bahnen bilden. Durch diese Bahnen werden die Projektionen zum Thalamus geschickt, wo die Afferenzen eine zweite Synapse bilden. Die tertiären Neuronen führen zu den somatosensorischen Rinden, die an der sensorischen Qualität des Schmerzes, einschließlich Intensität, Dauer und Ort, beteiligt sind.
Von der Peripherie zum ZNS
[Bearbeiten]
(Basierend auf Hasudungan (2013) [3])
Eine nozizeptive Stimulation initialisiert eine Ereigniskaskade. Zuerst wird eine Reihe von pro-nozizeptiven Entzündungsstoffen einschließlich Kalium, Bradykinin, Histamin und Substanz P in die Peripherie nahe der Verletzung freigesetzt (Tabelle 2). Diese führen zu Hyperalgesie, d.h. einer erhöhten Schmerzempfindlichkeit, die als eine niedrigere Schmerzschwelle in und um die Läsion herum gemessen werden kann.
| Substanz | Quelle |
|---|---|
| Potassium (K+) | Beschädigte Zellen |
| Serotonin | Blut (Plättchen) |
| Bradykinin | Blut (Plasma) |
| Histamin | Mastzellen |
| Prostaglandine | Beschädigte Zellen |
| Leukotriene | Beschädigte Zellen |
| Substanz P | Primäre Nervenafferenzen |
Als nächstes werden freie Nervenenden, die Nozizeptoren genannt werden, durch den schädlichen Reiz aktiviert. Sie wandeln die Reize in elektrische Signale um, die dann über die afferenten Nervenfasern zum Rückenhorn des Rückenmarks weitergeleitet werden.

(Basierend auf Marchand (2008)[1])
Die afferenten Fasern fallen in drei Gruppen: Aβ-Fasern, Aδ-Fasern und C-Fasern. Aβ-Fasern führen normalerweise nicht-nozizeptive Signale, sind hier jedoch aufgelistet, da sie an der später beschriebenen Schmerzmodulation teilnehmen. Die Eigenschaften der verschiedenen afferenten Fasern sind in der folgenden Tabelle aufgeführt:
| Aβ-Fasern | Aδ-Fasern | C-Fasern | |
|---|---|---|---|
| Ort | Haut | Haut | Haut, Muskeln und viszerale Organe |
| Durchmesser | 6 bis 12 µm
myelinisiert |
1 bis 5 µm
myelinisiert |
0.2 bis 1.5 µm
nicht myelinisiert |
| Leitung | 35 bis 75 m/s | 6 bis 30 m/s | 0.5 bis 3 m/s |
| Rolle | Leichte Berührung, Propriozeption |
Temperatur, Nozizeption |
Nozizeption (mechanisch, thermisch |
Zunehmender Durchmesser und Myelinisierung erhöhen die Leitungsgeschwindigkeit des Reizes zum Rückenmark hin. Die Aδ-Fasern leiten das nozizeptive Signal relativ schnell, weshalb sie für den nozizeptiven Reflex verantwortlich sind (z. B. ziehen Sie Ihre Hand sehr schnell weg, wenn Sie etwas Heißes berühren) sowie für die scharfe Lokalisierung von Schmerzen. Im Gegensatz dazu haben C-Fasern eine langsame Leitungsgeschwindigkeit (keine Myelinisierung, kleiner Durchmesser) und führen daher zu einem dumpfen, nicht lokalisierten und länger anhaltenden Schmerz.
Sekundäre Neuronen im Rückenmark
[Bearbeiten]
(Basierend auf Hasudungan (2013)[3])
Die afferenten Nervenfasern haben einen ersten synaptischen Kontakt mit sekundären Neuronen im Rückenhorn des Rückenmarks. Zusätzlich haben sowohl nicht-nozizeptive als auch nozizeptive Afferenzen an dieser Kreuzung eine synaptische Wechselwirkung mit einem wichtigen Netzwerk von erregenden Interneuronen und Schmerz-Neurotransmittern, einschließlich Substanz P oder Glutamat. Diese modulieren das nozizeptive Signal, bevor es auf übergeordnete Zentren des ZNS projiziert wird. Die sekundären Nervenzellen wandern entlang zweier wichtiger Pfade dem Rückenmark entlang: dem spinothalamischen und dem spinoretikulären Trakt. Beide kreuzen sich innerhalb weniger Segmente der Eintrittsebene zur kontralateralen Seite des Rückenmarks. Während im spinothalamischen Trakt die sekundären Neuronen direkt zum Thalamus aufsteigen, synapsen die Neuronen im spinoretikulären Trakt wieder in der Formatio reticularis, bevor sie zum Thalamus führen. Die Formatio reticularis befindet sich im Hirnstamm und ist an einer Vielzahl von Funktionen wie Aufmerksamkeit und Bewusstsein beteiligt. Es wird daher angenommen, dass es Änderungen des Aufmerksamkeitsniveaus und der emotionalen Reaktionen als Reaktion auf Schmerz beeinflusst.
Von Nozizeption zu Schmerz
[Bearbeiten]Schmerz kann nur gespürt werden, wenn nozizeptive Signale den Kortex erreichen. Die Neuronen, die entlang des Rückenmarks nach oben kommen, bilden daher ein letztes Mal im Thalamus eine Synapse. Von dort leiten tertiäre Neuronen die nozizeptive Information zu verschiedenen Strukturen im Kortex: Die somatosensorischen Kortizes (SI und SII) sind hauptsächlich an der sensorischen Unterscheidung von Schmerz beteiligt, während der anteriore cinguläre Kortex (ACC) und der insulare Kortex (IC) mit den affektiven Komponenten des Schmerzes verbunden sind.
In den somatosensorischen Kortizes konvergieren sowohl die nozizeptive als auch die normalen somatischen sensorischen Informationen auf demselben kortikalen Bereich. Daher können Informationen über den Ort und die Intensität des Schmerzes verarbeitet werden, um zu einem lokalisierten schmerzhaften Gefühl zu werden. Diese kortikale Repräsentation des Körpers wird in Penfields Homunculus beschrieben.
Modulation der Schmerzwahrnehmung
[Bearbeiten]Schmerz ist ein dynamisches Phänomen, das von jedem Menschen unterschiedlich wahrgenommen wird. Der Grund dafür ist, dass das nozizeptive Signal nicht nur zu den Kortizes übertragen wird, sondern auch auf mehreren Ebenen innerhalb des ZNS moduliert wird. Diese Modulation umfasst erregende und hemmende Mechanismen des Hirnstamms, des vegetativen Nervensystems und der kortikalen Strukturen, die für den emotionalen (ACC und IC) sowie den kognitiven (SI und SII) Aspekt des Schmerzes verantwortlich sind.
Hier werden nur hemmende endogene Modulationsmechanismen diskutiert. Sie sind wichtig, um die Möglichkeiten zur Schmerzbehandlung zu verstehen. Um ihre Rolle besser zu verstehen, sollte auf drei Modulationsebenen im ZNS geachtet werden (analog zu Marchand (2008)[1]):
- spinale Mechanismen, die lokalisierte Analgesie, d. h. Unempfindlichkeit gegenüber Schmerz, erzeugen,
- absteigende inhibitorische Mechanismen vom Hirnstamm, die eine diffuse Schmerzhemmung hervorrufen, und
- Überlegene Center-Effekte, die entweder absteigende Mechanismen modulieren oder die Wahrnehmung von Schmerz verändern, indem sie das nozizeptive Signal neu interpretieren.
Spinale Mechanismen: Gate Control Theorie
[Bearbeiten]

(Siehe Bild rechts) Wenn auch Aβ-Fasern feuern, werden inhibitorische Interneuronen aktiviert. Das Tor ist auch für nicht-schädliche Reize geöffnet und das Signal der C-Fasern ist geschwächt.
Die Gate-Control-Theorie wurde 1965 von Melzack & Wall entwickelt[5]. Sie legt nahe, dass der Schmerz an der ersten Synapse, d. h. zwischen primären afferenten Fasern und sekundären Neuronen auf der Rückenmarksebene, gehemmt werden kann. Wenn C-Fasern feuern, geben sie das schädliche Signal nicht nur an das sekundäre Neuron weiter, sondern behindern auch die hemmenden Interneurone. Dies wird als geschlossenes Gate interpretiert und nur schädliche Signale werden weitergeleitet. Auf der anderen Seite, wenn Aβ-Fasern feuern, erregen sie die hemmenden Neuronen. Daher ist die Aktivierung des sekundären Neurons nicht auf schädliche Signale beschränkt, was als geöffnetes Gate interpretiert wird. Abhängig von den effektiven Geschwindigkeiten des Feuerns zwischen C-Fasern und Aβ-Fasern wird das Schmerzsignal blockiert.
Ein bekanntes Beispiel der Gate-Control-Theorie ist, dass das Schmerzempfinden nach einem Ellbogenschlag abnimmt, wenn Sie den Ellbogen reiben. Die Vorteile sind, dass dieses Beispiel nicht schädlich ist und keine Medikamente benötigt werden, während es zu sofortiger Schmerzmodulation führt. Doch sobald der hochfrequente Stimulus, der die Aβ-Fasern aktiviert, verschwunden ist (d. h. Sobald Sie aufhören, Ihren Ellenbogen zu reiben), wird auch der Schmerzpegel nicht mehr verringert.
Absteigende hemmende Mechanismen: Endogene Opioide
[Bearbeiten]Schon lange ist bekannt, dass Opium und seine Derivate wie Morphin und Heroin schmerzstillend wirken. In den 1960er und 1970er Jahren wurden ihre Rezeptoren vor allem in der periaquäduktalen grauen Substanz (PAG) und der rostroventralen Medulla (RVM) sowohl im Hirnstamm als auch im Rückenmark gefunden. Dies implizierte, dass ähnliche Chemikalien vom Nervensystem produziert werden, um den Schmerz endogen zu modulieren. Serotonin und Noradrenalin sind die Haupttransmitter des absteigenden hemmenden Nervensystems. Diese inhibitorischen Wege rekrutieren dann Interneurone im Rückenmark, um eine schmerzlindernde Reaktion über den Rest des Körpers zu erzeugen, die auch als Gegenreizung bekannt ist. Beispiele für diese Art der Modulation sind nicht nur zahlreiche Schmerzmittel, sondern auch Massage, Akupressur und Akupunktur. In den letzten beiden Fällen wird das körpereigene System durch zusätzliche Schmerzen ausgelöst, weshalb sie in der Regel erst dann eingesetzt werden, wenn andere Möglichkeiten zur Schmerzmodulation probiert wurden.
Überlegene Center-Effekte
[Bearbeiten]Es ist gezeigt worden, dass kognitive Manipulationen wie Ablenkung, Hypnose oder Erwartung die Schmerzwahrnehmung von Individuen beeinflussen.[6] Darüber hinaus wurde bestätigt, dass die Suggestion der Schmerzintensität die mit der Schmerzwahrnehmung verbundene Gehirnaktivität verändern kann.[7] Diese Ergebnisse unterstützen die Idee, dass Placebo-Effekte die Leistung der endogenen Schmerzmodulation anpassen können.
Phantomschmerz
[Bearbeiten]Geschichte
[Bearbeiten]Die Phänomene, die als Phantom-Gliedmaßen-Schmerz und Phantom-Gliedmaßen-Empfindung bekannt sind, sind seit dem 16. Jahrhundert bekannt. Ein französischer Militärchirurg, Ambroise Paré, war der erste, der 1551 den Phantomschmerz und die Phantomempfindung medizinisch dokumentierte:

"Die Patienten sagen noch lange nach der Amputation, dass sie immer noch Schmerzen im amputierten Teil haben. Darüber beschweren sie sich stark, eine Sache würdig und fast unglaublich für Leute, die das nicht erlebt haben".[8]
Ein schottischer Neurologe, Charles Bell, veröffentlichte 1830 eine Beschreibung des Phänomens im Nervensystem des menschlichen Körpers. Allerdings wurde der Begriff "Phantomschmerz" erst 1871 von Silas Weir Mitchell, einem amerikanischen Militärchirurgen, eingeführt. Er gab die erste moderne Beschreibung des post-chirurgischen "Geister"-Gefühls, das viele Amputierte erleben:

"Es gibt etwas fast Tragisches, etwas Grässliches, in der Vorstellung von diesen Tausenden von Geistern, die so viele gute Soldaten verfolgen und sie von Zeit zu Zeit quälen ... wenn ... der scharfe Sinn für die Anwesenheit des Gliedes den Mann in eine Anstrengung hineinführt, deren Versagen ihn plötzlich an seinen Verlust erinnert ".[8]
Unterschiede zwischen Phantomempfindung und Phantomschmerz
[Bearbeiten]Phantomschmerz und -empfindung sind untrennbar miteinander verbunden. Sie sind jedoch nicht gleich und es ist daher wichtig, sie voneinander zu unterscheiden.
Phantomempfindungen umfassen kinästhetische Empfindungen wie das Gefühl von Länge, Umfang oder Stellung des Gliedes, kinetische Empfindungen wie spontane oder intentionale Bewegungen und exterozeptive Empfindungen wie Kribbeln, Juckreiz oder Druck [9]. Diese Empfindungen können entweder nach einer Amputation, einem kongenitalen Gliedmaßendefizit oder wenn die Empfindung in der Extremität zum Beispiel aufgrund einer Rückenmarksverletzung verschwunden ist auftreten[8]. Studien haben gezeigt, dass Phantomempfindungen bei 90-98% aller Patienten auftreten. [10] [11] [12] Ein besonderes Phänomen, das bei etwa 25-40% der Patienten mit Phantomempfindungen auftritt, ist das Teleskopieren, das Gefühl, dass sich das Phantomglied mit der Zeit zum Stumpf zurückzieht, bis es daran befestigt ist oder im Stumpf drin. [12] [13]
Phantomschmerz ist variabel und kann unter anderem als brennende, stechende oder pochende Empfindungen beschrieben werden. [14] Darüber hinaus können sehr komplexe Schmerzempfindungen auftreten, zum Beispiel das Gefühl der Verwindung im Phantomglied oder das schmerzhafte Eingraben von Fingernägeln in die Handfläche der Phantomhand. [9] Die meisten Personen leiden nach einer Amputation unter Phantomschmerzen, wobei die Prävalenz zwischen 55 und 85% liegt. [15][8] In vielen Fällen gibt es Schmerzen sowohl am Stumpf als auch am Phantomglied, sodass es schwierig ist, sie voneinander zu unterscheiden.
Studien haben auch gezeigt, dass fast alle Amputierten, die Phantomempfindungen spüren, auch an Phantomschmerz leiden; das Gegenteil ist selten der Fall. [8]
Epidemiologie
[Bearbeiten]In den letzten Jahrzehnten wurden viele klinische Studien zu Phantomschmerz und -empfindung durchgeführt, die einige allgemeine Tendenzen bei Patienten, die an dem Syndrom litten, aufzeigten.
Die Häufigkeit von Phantomschmerzen scheint mit dem Grad der Amputation zu variieren: Je höher das Ausmaß der Amputation, desto größer ist das Auftreten von mittelschweren bis schweren Phantomschmerzen. [8] Es gibt auch Hinweise darauf, dass bei einer geplanten chirurgischen Amputation einer nicht schmerzenden Extremität die Häufigkeit von Schmerzen geringer sein kann als bei einem traumatischen Verlust einer Extremität oder bei einem bereits bestehenden Schmerz. [10] Darüber hinaus wird der Schmerz in der Regel am distalsten Teil der Extremität, wie die Finger in den Händen oder Zehen in den Beinen, gefühlt. Es wurde spekuliert, dass dies auf die Tatsache zurückzuführen ist, dass die Gliedmaßenenden im somatosensorischen Kortex besser dargestellt sind. [11] [12] Interessanterweise ist die Häufigkeit von Phantomschmerz bei Amputierten der unteren Extremitäten viel höher als bei Amputierten der oberen Extremitäten. [8]
In Bezug auf die Frequenz ist Phantomschmerz bei einer Untergruppe von Patienten kontinuierlich vorhanden, während es in anderen Fällen episodisch in Form von Schmerzattacken auftritt. [16] Aber auch in diesen Fällen kann ein kontinuierlicher Schmerz dazwischen bestehen. Die Schmerzattacken können von wenigen Sekunden bis zu mehreren Stunden andauern. In seltenen Fällen können Patienten die Episoden über mehrere Tage erleben. [15]

Der Phantomschmerz beginnt meist schon in den ersten Tagen bis Wochen nach der Amputation, kann aber auch noch nach Jahren beginnen, ausgelöst durch Operationen im Stumpf. [15] Der Schmerz kann viele Jahre nach der Amputation anhalten. Unterschiedliche klinische Studien stimmen jedoch nicht überein, wie lange der Schmerz in einem Phantomglied anhält. Zum Beispiel haben Studien an älteren Patienten, die aufgrund von Gefäßinsuffizienz ihre Gliedmaßen verloren haben, zu anderen Ergebnissen geführt als Studien an jüngeren Amputierten mit traumatischer Amputation nach einer Verletzung. [8] Mehrere Studien berichteten jedoch über gemeinsame Tendenzen: Nur 16% der Menschen, die Phantomschmerzen hatten, leiden nicht mehr daran, während in weiteren 37% eine signifikante Reduktion, in 44% die gleichen Schmerzen und in 3% der Fälle war der Schmerz im Laufe der Zeit stärker geworden. [17] [15] Ein weiterer gemeinsamer Bezugspunkt ist, dass, wenn der Schmerz noch sechs Monate nach der Amputation anhält, es sehr schwierig wird, ihn zu behandeln. [18]
Interessanterweise klagen viele Patienten oft darüber, dass der Schmerz, der in ihren Gliedmaßen vor der Amputation bestanden hat, im Phantomglied fortbesteht. Diese Beharrlichkeit des Schmerzes könnte eine Form der sensorischen Erinnerung sein. [19] Im Zusammenhang mit diesen Befunden wurde auch berichtet, dass Phantom-Gliedmaßen-Empfindungen bei kleinen Kindern weniger häufig sind als bei Erwachsenen. Eine mögliche Erklärung ist, dass es bei kleinen Kindern nicht genügend Zeit gab, das Körperbild zu festigen. In der Tat behaupten einige Studien, die Häufigkeit von Phantomempfindungen erhöhe sich drastisch mit dem Alter der Kinder. [10]
Laut einer Studie an 139 Patienten [16] kann Phantomschmerz ausgelöst werden durch [15]:
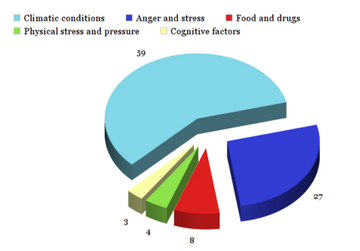
- Klimatische Bedingungen: 59%. Dazu gehören wetterbedingte 55%, saisonal bedingt 1% und die Umgebungstemperatur 3%.
- Wut und Stress: 27%
- Nahrung / Drogen: 8%
- Physischer Stress und Druck: 4%
- Kognitive Faktoren: 3%. Beispiele für kognitive Faktoren sind fixierte Aufmerksamkeit auf das Phantomglied und Beobachten der Verletzung.
Der Grund, wieso diese Faktoren Phantomschmerzen auslösen, wird im nächsten Abschnitt klar.
Herkunft von Phantomschmerz
[Bearbeiten]In Übereinstimmung mit der Tatsache, dass Phantomschmerz als ein multifaktorielles Schmerzsyndrom angesehen wird, und aktuellen Theorien über die Pathophysiologie von Phantomschmerz, wird der Schmerz in der Regel in periphere, zentrale und psychologische Komponenten getrennt. Diese drei Bereiche sind stark miteinander verbunden.
Periphere Mechanismen
[Bearbeiten]Nach der Amputation findet eine zelluläre Differenzierung statt, die zur Degeneration der distalen peripheren Nerven sowie zur Entwicklung von Neuromen (Wachstum oder Tumoren in Nervengeweben) führt. [20]

Neurome entstehen durch die Regeneration des überlebenden proximalen Nervenabschnitts und können abnormale Entladungen erzeugen, die die Beharrlichkeit des Schmerzes verursachen. Tatsächlich wurde in mehreren Studien ein Hinweis auf Hyperaktivität in den Stumpfmuskeln im Vergleich zur kontralateralen Extremität gefunden. [21] [11] Diese Hyperaktivität war in Form von leichten Zuckungen in kleinen Faserbündeln oder sogar krampfartigen Kontraktionen des gesamten Stumpfes vorhanden.
Die Tatsache, dass der Schmerz nicht durch eine Leitungsblockade peripherer Nerven eliminiert wird, sowie die Tatsache, dass Schmerzen, auch nachdem ektopischen Entladungen in den peripheren Nerven durch pharmakologische oder chirurgische Maßnahmen eliminiert worden sind, bestehen bleiben, beweisen, dass Phantomschmerz nicht nur wegen der Entwicklung von Neuromen ein komplexer Mechanismus ist. [19] In der Tat sind einige zusätzliche periphere Mechanismen in Phantomschmerzen beteiligt: Blutzirkulationseffekte und sympathische Aktivierung.
Blutzirkulationseffekte
[Bearbeiten]Bei niedrigen Temperaturen wird unser sympathisches Nervensystem stimuliert, was zu einer Vasokonstriktion in Haut, Armen und Beinen führt.[22] Dies führt zu einer Hypoperfusion im Stumpf, welche die Aktivität der nozizeptiven Nervenfasern erhöht und somit das Schmerzempfinden verstärken kann. Dies ist sowohl auf Ischämie als auch auf die Abkühlung von Neuronen zurückzuführen. [16] Diese vaskulären Mechanismen sind der Grund, warum das Wetter einer der Hauptauslöser des Phantomschmerzes ist.
Darüber hinaus wurde in mehreren Studien ein Zusammenhang zwischen kurzen, starken Zunahmen der Muskelspannung im Stumpf und nachfolgenden Phantomschmerzepisoden festgestellt. [22] Mechanischer Druck und starke Muskelkontraktion können ebenfalls Perfusionseffekte haben, die wiederum den Schmerz verschlimmern können. Darüber hinaus können Perfusionseffekte auch als Folge von einigen Nahrungsmitteln und Drogen wie Kaffee auftreten, die dessen schmerzauslösende Natur erklären.
Sympathische Aktivierung
[Bearbeiten]Innerhalb von Neuromen können sympathische efferente Nervenendigungen mit nozizeptiven afferenten Nerven verwickelt werden, die direkt interagieren und zu einer erhöhten sympathischen Aktivität und einer Verschlimmerung des Phantomschmerzes führen. [23]
Zentralnervöse Faktoren
[Bearbeiten]Wie zuvor erläutert, wird Phantomschmerz nicht ausschließlich durch periphere Mechanismen verursacht. Die Komplexität der Empfindungen in der Phantom-Gliedmaße legt auch nahe, dass diese Wahrnehmungen höhere Nervenstrukturen beteiligen. [9]
Die Neuromatrix-Theorie
[Bearbeiten]Die Haupttheorie zur Erklärung von Phantomschmerzen im Kontext des zentralen Nervensystems ist die Neuromatrix-Theorie. Die Neuromatrix umfasst den Kortex, insbesondere den primären somatosensorischen Kortex und den hinteren Parietallappen, den Thalamus und das limbische System.

Diese Theorie postuliert, dass die Repräsentation des Körpers im Nervensystem durch sensorische Inputs ständig verändert wird und eine Neurosignatur erzeugt. Nach der Entfernung eines Körperteils erzeugt das Fortbestehen der Neuromatrix schmerzlose Empfindungen an der Phantomstelle, während der Schmerz von einer abnormalen Reorganisation innerhalb der Neuromatrix herrührt. Genauer gesagt sendet die Neuromatrix nach der Amputation weiterhin ein ausgehendes Signal, und die Veränderung dieser Signale kann für Schmerz verantwortlich sein. Theoretisch könnte es möglich sein, den Schmerz zu verringern, indem das ausgehende Signal von der Neuromatrix eliminiert wird oder indem ein normales Rückkehrsignal durch elektrische Stimulation erzeugt wird. Tatsächlich zeigen einige Studien, dass Phantomschmerz mit neuronaler Aktivität und Funktion der thalamischen Repräsentation des amputierten Glieds verbunden sein kann. Dies kann durch die Tatsache gezeigt werden, dass die Mikrostimulation im ventrokaudalen Thalamus eine schmerzhafte Empfindung im Phantomglied erzeugt. [19]
Während die Neuromatrix-Hypothese nützlich sein kann, um den Ursprung des Schmerzes zu beschreiben, erklärt sie nicht, warum die Erleichterung der Phantomempfindung selten Phantomschmerz lindert, warum die Empfindung plötzlich weggehen kann oder warum nicht alle Amputierten Phantomschmerz erfahren. [19] Daher müssen andere mögliche Erklärungen in Betracht gezogen werden.
Zentrale Hyper-Empfänglichkeit
[Bearbeiten]Mehrere Studien haben gezeigt, dass nach Amputationen und anderen Arten von Nervenschäden ein Zustand der Übererregbarkeit im zentralen Nervensystem auftreten kann. [21] [11]
Kortikale Reorganisation
[Bearbeiten]Neben der Hyperempfindlichkeit, und möglicherweise als Folge, treten nach einer Amputation Veränderungen in der kortikalen Repräsentation des Körpers auf. Diese Veränderungen werden im Allgemeinen nach Deafferenzierung beobachtet und sind im primären somatosensorischen Kortex besonders ausgeprägt.

Mehrere Studien sowohl bei Primaten als auch bei Menschen haben gezeigt, dass sich die Darstellung der angrenzenden Körperteile im primären somatosensorischen Kortex einige Monate nach einer Amputation um einige Millimeter erweitert und das ehemalige Territorium des amputierten Teils fast vollständig eingenommen hat.
[24] [25] [26] [27] Interessanterweise ist der Bereich, über den diese Reorganisation stattfindet, in Amputierten der unteren Extremitäten variabler. Diese kortikale Reorganisation kann sogar als vorübergehende Verschiebung während der Lokalanästhesie beobachtet werden, [28] [29] und auch umgekehrt als Folge intensiven Trainings eines Körperteils. [30] Es kommt auch im motorischen Kortex vor, wahrscheinlich als Folge der starken Verbindungen zwischen dem somatosensorischen und motorischen Kortex. [31] [32] Intuitiv könnte man denken, dass diese Umlagerung vorteilhaft wäre, da ein ansonsten unbenutzter Bereich des Kortex somit einem tatsächlichen Teil des Körpers zugeordnet werden kann, wodurch das verlorene Glied aus dem Körperschema eliminiert und dadurch Phantomschmerz reduziert wird. Aber diese Reorganisation hat ihren Preis, denn es wurde ein positives Verhältnis zwischen dem Ausmaß der Reorganisation und der Intensität des Phantomschmerzes beobachtet. [27] [33] Diese Ergebnisse haben zu dem Glauben geführt, dass kortikale Reorganisation in der Tat maladaptive Plastizität und eine der Ursachen von Phantomschmerz ist. [34]
Die kortikale Reorganisation wird durch drei grundlegende Mechanismen vermittelt:
a) Kortikale Prozesse
[Bearbeiten]Bei der kurzfristigen Reorganisation besteht der Hauptmechanismus in der Entmaskierung bestehender latenter Verbindungen zwischen benachbarten Bereichen. [29] Es wird angenommen, dass dieser Mechanismus durch eine Änderung des Gleichgewichts zwischen erregendem und hemmendem Zustrom ausgelöst wird. [35] [28] Für langfristige Reorganisationsprozesse entstehen jedoch neue neuronale Verbindungen. Daher finden in diesem Fall neben den funktionalen auch strukturelle Veränderungen statt. [16]
b) Die Wirbelsäulenprozesse
[Bearbeiten]Bei starker oder längerer nozizeptiver Stimulation kann die bereits erwähnte zentrale Sensibilisierung auch in den Rückenhornneuronen des Rückenmarks auftreten. Dies kann zu einer erhöhten spontanen Aktivität und einer gesteigerten Reaktion auf nicht-schädliche Reize führen [36] [37], wodurch der Schmerz verlängert wird, lange nachdem die schädlichen Reize vorhanden sind.
Bisher stammen alle Befunde zu amputationsinduzierten Veränderungen des Rückenmarks aus Tierversuchen. Sie weisen darauf hin, dass die vom Stumpf kommenden afferenten Fasern in den deafferenierten Bereich des Rückenmarks und des Hirnstamms reichen. [38] [8]
Ein Einblick in die Rolle von spinalen Neuronen bei der Entstehung von Schmerz wurde auch aus der Untersuchung von Verbrennungsopfern erhalten. Diese Studien zeigen, dass Rückenmarksneuronen nach einer Verbrennungsverletzung ihre Entladungsraten erhöhen, was zu einer Übererregbarkeit des Neurons führt. Diese Übererregbarkeit wurde durch lokale Betäubungsblockaden an der verletzten Stelle nicht beeinflusst. Dies deutet darauf hin, dass bereits eine Sensibilisierung oder ein "Schmerzgedächtnis" entstanden ist. Das wiederum legt nahe, dass eine Blockierung des Rückenmarks vor und während der chirurgischen Amputation diesen Sensibilisierungsprozess im Rückenmark verringern oder verhindern könnte. [19]
Phantomschmerzen können auch von Menschen mit kompletter Rückenmarksverletzung erfahren werden, was darauf hinweist, dass neben den peripheren und spinalen Prozessen auch Veränderungen im zentralen Nervensystem in die Entstehung von Schmerzen involviert sein können. [8]
c) Thalamische Prozesse
[Bearbeiten]Abgesehen von den Tiefenhirnstimulationen, die Beiträge des Thalamus zum Phantomschmerz aufgedeckt haben, ist nicht viel über die Rolle des Thalamus in diesem Zusammenhang bekannt. Tierversuche mit Lokalanästhesie haben eine kurzfristige und reversible Reorganisation der Darstellung einiger Körperteile im Thalamus berichtet. [39]
Psychologische Faktoren
[Bearbeiten]Sowohl Stress als auch Wut werden als auslösende Faktoren für Phantomschmerzen angesehen, wie in der Epidemiologie diskutiert. In der Tat wurde bei 74% der Probanden eine konsistente und insgesamt enge positive Korrelation zwischen Stress und Phantomschmerz gefunden. [16] Dies ist wahrscheinlich auf die Tatsache zurückzuführen, dass sowohl psychologische als auch physische Belastungen eine nozizeptive Wirkung haben, welche physiologische Mechanismen wie sympathische Aktivierung, Vasokonstriktion und Muskelspannung einschließen, die alle auslösende Mechanismen sind. Viele Patienten haben auch berichtet, dass Phantomschmerzen verstärkt oder sogar bewusst ausgelöst werden können, und umgekehrt, dass sie durch Ablenkung abnehmen. [9] [10]
Behandlung von Phantomschmerzen
[Bearbeiten]Dem Phantomschmerz fehlt noch eine wirksame Behandlung. Einige der angewandten Ansätze sind: Analgetika -mit begrenzter Wirkung-, Neuroleptika, Antidepressiva, Nervenblockaden, Stimulation des Nervensystems - insbesondere des Rückenmarks und der Nerven im Stumpf, aber auch Tiefenhirnstimulation -, Vibrationstherapie und Massagen am Stumpf, Wärmeanwendung, Biofeedback und Akupunktur. In einigen Fällen wird Narbengewebe, das einen Nerv verwickelt, chirurgisch entfernt. [40] [41] Eine andere populäre Therapie ist die Verwendung eines Spiegels, um dem Patienten zu erlauben, das Phantomglied zu “sehen", indem er die Reflexion des restlichen Gliedes beobachtet. Wie bei den anderen Therapien ist es nicht vollständig wirksam und für viele Patienten nicht erfolgreich. In der Tat profitieren etwa 40% der Menschen nicht von der Spiegeltherapie. [42]
Referenzen
[Bearbeiten]- ↑ 1,0 1,1 1,2 1,3 Marchand, S. (2008), ‘The physiology of pain mechanisms: From the peripheryto the brain’, Rheumatic Disease Clinics of North America 34(2), 285-309.
- ↑ ScoreUSMLE (2015), ‘Spinal pathways made super easy (part 1-2)’, Youtube Video, (Zugriff 21.7.2015).
- ↑ 3,0 3,1 Hasudungan, A. (2013), ‘Nociceptors - an introduction to pain’ (Erklärt den aufsteigenden Weg, sehr einfach zu verstehen), Youtube Video, (accessed 21.7.2015).
- ↑ Patel, N. B. (2010), ‘Physiology of pain’, Extrahiert von Kopf und Patel (Ed) „Guide to Pain Management in Low-Resource Settings“, 2010, International Association for the Study of Pain.
- ↑ Melzack, R. & Wall, P. D. (1965), ‘Pain mechanisms: a new theory’, Science 150, 971--979.
- ↑ Apkarian, A. V., Bushnell, M. C., Treede, R. D. & Zubieta, J. K. (2005), ‘Human brain mechanisms for pain perception and regulation in health and disease’, European Journal of Pain 9(4), 463-484.
- ↑ Goffaux, P., Redmond, W. J., Rainville, P. & Marchand, S. (2007), ‘De- scending analgesia – when the spine echoes what the brain expects’, Pain 130(1-2), 137-143.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 C. M. Kooijman, P. U. Dijkstra, J. H. B. Geertzen, A. Elzinga, und C. P. Van Der Schans, “Phantom pain and phantom sensations in upper limb amputees: An epidemiological study,” Pain, vol. 87, no. 1, S. 33–41, 2000.
- ↑ 9,0 9,1 9,2 9,3 P. Jensen, T.S. & Rasmussen, Phantom pain and other phenomena, Textbook o. Edinburgh: Churchill Livingstone, 1994.
- ↑ 10,0 10,1 10,2 10,3 10,4 V. S. Ramachandran und W. Hirstein, “The perception of phantom limbs. The D. O. Hebb lecture,” Brain, vol. 121, no. 9, S. 1603–1630, 1998.
- ↑ 11,0 11,1 11,2 11,3 B. Cronholm, Phantom limbs in amputees: a study of changes in the integration of centripetal impulses with special reference to referred sensations. Stockholm, 1951.
- ↑ 12,0 12,1 12,2 E. Frank, B. & Lorenzoni, “Phantomerleben und Phantomschmerz. Fortschritte der Neurologie und Psychiatrie,” vol. 60, S. 74–85, 1992.
- ↑ L. Schmalzl, “‘Pulling telescoped phantoms out of the stump’: Manipulating the perceived position of phantom limbs using a full-body illusion,” Front. Hum. Neurosci., vol. 5, no. November, S. 1–12, 2011
- ↑ K. Sherman, R.A., Katz, J., Marbach, J.J. & Heermann-Do, Locations, characteristics, and descriptions. New York: Plenum Press, 1997.
- ↑ 15,0 15,1 15,2 15,3 15,4 M. Döbler, K. & Zenz, “Stumpf- und Phantomschmerz,” in Lehrbuch der Schmerztherapie, Stuttgart: Wissenschaftliche Verlagsgesellschaft, 1993, S. 377–384.
- ↑ 16,0 16,1 16,2 16,3 C. Winter-Barnstedt, “Phantomschmerz nach Extremitätenamputation : Diagnostik und Biofeedback-Behandlung,” Ruprecht-Karls-Universität Heidelberg, 2001.
- ↑ S. W. Wartan, W. Hamann, J. R. Wedley, und I. McColl, “Phantom pain and sensation among British veteran amputees.,” Br. J. Anaesth., vol. 78, S. 652–659, 1997.
- ↑ C. Sherman, RA, Sherman, “Prevalence and characteristics of chronic phantom limb pain among American veterans: results of a trial survey,” Am. J. Phys. Med., vol. 62, no. 5, S. 227–238, 1983.
- ↑ 19,0 19,1 19,2 19,3 19,4 R. G. Bittar, S. Otero, H. Carter, und T. Z. Aziz, “Deep brain stimulation for phantom limb pain.,” J. Clin. Neurosci., vol. 12, no. 4, S. 399–404, 2005.
- ↑ “Neuroma,” Wikipedia, 2016. [Online]. Verfügbar: Neuroma [Zugriff: 05-Jun-2016].
- ↑ 21,0 21,1 W. Larbig, P. Montoya, H. Flor, H. Bilow, S. Weller, und N. Birbaumer, “Evidence for a change in neural processing in phantom limb pain patients.,” Pain, vol. 67, no. 2–3, S. 275–283, 1996.
- ↑ 22,0 22,1 R. A. Sherman, V. D. Griffin, C. B. Evans, und A. S. Grana, “Temporal relationships between changes in phantom limb pain intensity and changes in surface electromyogram of the residual limb,” Int. J. Psychophysiol., vol. 13, no. 1, S. 71–77, 1992.
- ↑ R. A. Sherman, J. G. Arena, C. J. Sherman, und J. L. Ernst, “The mystery of phantom pain: Growing evidence for psychophysiological mechanisms,” Biofeedback Self. Regul., vol. 14, no. 4, S. 267–280, 1989
- ↑ M. M. Merzenich, R. J. Nelson, M. P. Stryker, M. S. Cynader, A. Schoppmann, und J. M. Zook, “Somatosensory cortical map changes following digit amputation in adult monkeys.,” J. Comp. Neurol., vol. 224, no. 4, S. 591–605, 1984.
- ↑ T. P. Pons, E. G. Preston, A. K. Ommaya, H. K. Jon, E. Taub, und M. Mishkin, “Massive Cortical Reorganization After Sensory Deafferentation in Adult Macaques,” Science (80-. )., vol. 252, no. 5014, S. 1857–1860, 1991.
- ↑ T. Elbert, H. Flor, N. Birbaumer, S. Knecht, S. Hampson, W. Larbig, und E. Taub, “Extensive reorganization of the somatosensory cortex in adult humans after nervous system injury.,” Neuroreport, vol. 5, no. 18, S. 2593–2597, 1994.
- ↑ 27,0 27,1 H. Flor, T. Elbert, S. Knecht, C. Wienbruch, C. Pantev, N. Birbaumer, W. Larbig, und E. Taub, “Phantom-limb pain as a perceptual correlate of cortical reorganization following arm amputation.,” Nature, vol. 375, no. 6531, S. 482–484, 1995.
- ↑ 28,0 28,1 H. Buchner, C. Kauert, und I. Radermacher, “Short-term changes of finger representation at the somatosensory cortex in humans,” Neurosci. Lett., vol. 198, no. 1, S. 57–59, 1995.
- ↑ 29,0 29,1 P. M. Rossini, G. Martino, L. Narici, A. Pasquarelli, M. Peresson, V. Pizzella, F. Tecchio, G. Torrioli, und G. L. Romani, “Short-term brain ‘plasticity’ in humans: transient finger representation changes in sensory cortex somatotopy following ischemic anesthesia,” Brain Res., vol. 642, no. 1–2, S. 169–177, 1994.
- ↑ W. M. Jenkins, M. M. Merzenich, M. T. Ochs, T. Allard, und E. Guic-Robles, “Functional reorganization of primary somatosensory cortex in adult owl monkeys after behaviorally controlled tactile stimulation,” J. Neurophysiol., vol. 63, no. 1, S. 82–104, 1990.
- ↑ A. Karl, N. Birbaumer, W. Lutzenberger, L. G. Cohen, und H. Flor, “Reorganization of motor and somatosensory cortex in upper extremity amputees with phantom limb pain.,” J. Neurosci., vol. 21, no. 10, S. 3609–18, 2001.
- ↑ R. Chen, B. Corwell, Z. Yaseen, M. Hallett, und L. G. Cohen, “Mechanisms of cortical reorganization in lower-limb amputees.,” J. Neurosci., vol. 18, no. 9, S. 3443–50, 1998.
- ↑ H. Flor, T. Elbert, W. Mühlnickel, C. Pantev, C. Wienbruch, und E. Taub, “Cortical reorganization and phantom phenomena in congenital and traumatic upper-extremity amputees,” Exp. Brain Res., vol. 119, no. 2, S. 205–212, 1998.
- ↑ E. a Franz und V. S. Ramachandran, “Bimanual coupling in amputees with phantom limbs.,” Nat. Neurosci., vol. 1, no. 6, S. 443–444, 1998.
- ↑ M. Calford und R. Tweedale, “Immediate and chronic changes in responses of somatosensory cortex in adult flying-fox after digit amputation.,” Nature, vol. 332, no. 6163. S. 446–448, 1988.
- ↑ L. Arendt-Nielsen und S. Petersen-Felix, “Wind-up and neuroplasticity: is there a correlation to clinical pain?,” Eur. J. Anaesthesiol. Suppl., vol. 10, S. 1–7, 1995.
- ↑ J. Li, D. A. Simone, und A. A. Larson, “Windup leads to characteristics of central sensitization,” Pain, vol. 79, no. 1, S. 75–82, 1999.
- ↑ S. L. Florence und J. H. Kaas, “Large-scale reorganization at multiple levels of the somatosensory pathway follows therapeutic amputation of the hand in monkeys.,” J. Neurosci., vol. 15, no. 12, S. 8083–8095, 1995.
- ↑ M. A. Nicolelis, R. C. Lin, D. J. Woodward, und J. K. Chapin, “Induction of immediate spatiotemporal changes in thalamic networks by peripheral block of ascending cutaneous information.,” Nature, vol. 361, no. 6412, S. 533–6, 1993.
- ↑ “Phantom limb,” Wikipedia, 2016. [Online]. Verfügbar: w: Phantom_limb Phantom_limb [Zugriff: 05-Jun-2016].
- ↑ “Pain Management Health Center,” WebMD, 2015. [Online]. Verfügbar: phantom-limb-pain| [Zugriff: 05-May-2016].
- ↑ J. Foell, R. Bekrater-Bodmann, M. Diers, und H. Flor, “Mirror therapy for phantom limb pain: Brain changes and the role of body representation.,” Eur. J. Pain, S. 1–11, 2013.
