Unsere Quantenwelt
Dieses Buch steht im Regal Physik.

Vorwort des Übersetzers
[Bearbeiten]Dieser Text ist eine teilweise Übersetzung des englischen Wikibooks This quantum world, welches unter CC-BY-SA 3.0 veröffentlicht ist. Eine Liste der Hauptautoren findet man in der Versionsgeschichte zu den jeweiligen Kapiteln. Ich versuche, möglichst nahe am Originaltext zu bleiben. Hinweise sind jederzeit Willkommen. -- Tom Bachmann
Über dieses Buch
[Bearbeiten]Seit 1999 gebe ich einen Einführungskurs über zeitgenössische Physik für Highschool-Schüler (Klasse 11-12) und Jüngere am Sri Aurobindo International Centre of Education (SAICE) in Puducherry (früher Pondicherry), Indien. Die SAICE ist keine typische Highschool. Während Schüler eine außerordentliche Freiheit bei der Wahl ihrer Projekte und Kurse genießen, ist es den Lehrern erlaubt, Fächer ihrer Wahl anzubieten, und sind dazu angehalten, neue Lernmethoden auszuprobieren. Deshalb ist mein Kurs optional. Er ist für jeden mit Interesse daran, was die zeitgenössische Physik uns über die "Natur der Natur" erzählen will, gedacht. Für Physikschüler bietet er eine Perspektive, die ergänzend zu der vieler exzellenter Lehrbücher ist.
Jedes Jahr am Anfang des neuen Schuljahres korrigiere ich das Material, dass ich meinen Schülern gebe, und versuche, es zu verbessern. Diese Veränderungen basieren zu einem beachtlichen Teil auf Schülerfeedback. Zur Zeit bereite ich die Handouts für das nächste Schuljahr vor und plane, sie gleichzeitig hier verfügbar zu machen, und ich hoffe auf zusätzliches wertvolles Feedback durch die Wikibooks-Community.
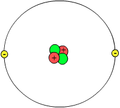
Wie sieht ein Atom aus?
[Bearbeiten]So?
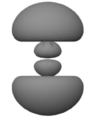
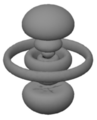
[Bearbeiten]Oder so?
[Bearbeiten]
Keines dieser Bilder stellt ein Atom so dar, wie es ist. Das ist deshalb der Fall, weil es unmöglich ist, sich ein Atom auch nur so vorzustellen, wie es ist. Das Beste, was man mit den Bildern der ersten Reihe machen kann, ist, sie aus seinem Gedächtnis zu verbannen, denn sie stellen das Atom für unsere Zwecke zu vereinfacht dar. Allerdings bedürfen die acht unscharfen Bilder in den nächsten beiden Reihen einer Untersuchung. Jedes repräsentiert einen stationären Zustand von atomarem Wasserstoff. Man kann weder den Kern (ein Proton) noch das Elektron sehen. Was man sieht ist eine unscharfe Position. Um Präziser zu sein: Was man sieht, ist eine wolkenähnliche und unscharfe Abbildung, die symmetrisch zur vertikalen Achse ist, und die interne relative Position des Atoms repräsentiert (die Position des Elektrons ist relativ zum Proton oder die Position des Protons ist relativ zum Elektron).
- Was ist der Zustand eines Atoms?
- Was ist ein stationärer Zustand?
- Was genau ist eine unscharfe Position?
- Wie genau repräsentiert so eine unschärfe Abbildung die interne relative Position des Atoms?
- Warum können wir die interne relative Position des Atoms nicht so wie es ist beschreiben?
Quantenzustände
[Bearbeiten]In der Quantenmechanik sind Zustände Wahrscheinlichkeitsalgorithmen. Wir benutzen sie um auf Basis tatsächlicher Messergebnisse die Wahrscheinlichkeit möglicher Messergebnisse zu berechnen. Ein Quantenzustand übernimmt als seine Eingabe
- ein oder mehrere Messergebnisse,
- eine Messung M,
- die Zeit von M,
und er liefert als Ausgabe die Wahrscheinlichkeiten der möglichen Messergebnisse von M.
Ein Quantenzustand wird stationär genannt, wenn die Wahrscheinlichkeiten, die er zuordnet, unabhängig von der Zeit der Messung sind.
Aus der mathematischen Sicht repräsentiert jede unscharfe Abbildung eine Dichtefunktion . Man stelle sich eine kleine Region , wie die kleine Box in der ersten unscharfen Abbildung, vor. Und man nehme an, dass diese eine Region des (mathematischen) Raums der Position relativ zum Proton ist. Wenn man über integriert, erhält man die Wahrscheinlichkeit das Elektron in zu finden, wenn die angebrachte Messung durchgeführt wird:
- .
"Angebracht" bedeutet hier, in der Lage, den Wahrheitswert der Aussage "das Elektron ist in " festzustellen, wobei die möglichen Wahrheitswerte "wahr" oder "falsch" sind. Was wir in jedem der folgenden Bilder sehen, ist die Oberfläche von konstanter Wahrscheinlichkeitsdichte.
Jetzt stelle man sich vor, dass die angebrachte Messung durchgeführt wird. Vor der Messung ist das Elektron weder innerhalb von noch außerhalb von , denn wäre es innen, wäre die Wahrscheinlichkeit, es außerhalb zu finden, Null, und wenn es außerhalb wäre, wäre die Wahrscheinlichkeit, es innen zu finden, Null. Nach der Messung, andererseits, ist das Elektron entweder innerhalb oder außerhalb von .
Schlussfolgerungen:
- Vor der Messung ist die Aussage "das Elektron ist innerhalb von " weder wahr noch falsch; sie hat keinen (definitiven) Wahrheitswehrt.
- Eine Messung ändert normalerweise den Status des Systems, auf dem sie durchgeführt wird.
Wie vorher bemerkt, werden Wahrscheinlichkeiten nicht nur zu Messergebnissen, sondern auch auf der Basis von Messergebnissen, zugeordnet. Jede Dichtefunktion dient dazu, den möglichen Ergebnissen einer Messung der Position des Elektrons relativ zum Proton Wahrscheinlichkeiten zuzuordnen. In jedem Fall basiert die Messung auf den Ergebnissen der gleichzeitigen Messung von drei Observablen: der Energie des Atoms (spezifiziert durch die Hauptquantennummer ), seinem Gesamtdrehimpuls (spezifiziert durch einen Buchstabe, hier p, d oder f), und der Vertikalen Komponente seines Drehimpulses .
Unscharfe Observable
[Bearbeiten]Wir sagen das eine Observable mit einer endlichen oder abzählbaren Anzahl möglicher Werte unscharf ist (oder, dass sie einen unscharfen Wert hat), wenn und nur wenn mindestens eine der Aussagen "Der Wert von ist " keinen definitiven Wahrheitswert hat. Das ist äquivalent zur folgenden nötigen und ausreichenden Bedingung: mindestens eine der Wahrscheinlichkeiten, die einem zugeordnet wird ist weder 0 noch 1.
Was ist mit Observablen, die normalerweise als kontinuierlich beschrieben werden, wie Position?
Die Beschreibung einer Observablen als "kontinuierlich" ist potentiell irreführend. Auf der einen Seite können wir eine Observable und ihre möglichen Werte nicht von einer Messung und ihren möglichen Ergebnissen entkoppeln, und eine Messung mit einer überabzählbaren Menge möglicher Ergebnisse ist nicht mal prinzipiell möglich. Auf der anderen Seite gibt es keine einzelne Observable die "Position" genannt wird. Unterschiedliche Teile des Raumes definieren unterschiedliche Positionsmessungen mit unterschiedlichen Mengen möglicher Ergebnisse.
- Korollar: Die Möglichen Ergebnisse einer Positionsmessung (oder die möglichen Werte einer Positionsobservable) sind durch eine Raumunterteilung definiert. Sie bilden eine endliche oder abzählbare Menge von Regionen im Raum. Eine exakte Position ist daher weder ein mögliches Messergebnis noch ein Wert einer Positionsobservable.
Also wie repräsentieren diese wolkenähnlichen unscharfen Abbildungen die unscharfe Position des Elektrons relativ zum Proton? Genau genommen repräsentieren sie grafisch Wahrscheinlichkeitsdichten im mathematischen Raum der exakten relativen Positionen anstatt unscharfer Positionen. Und diese Wahrscheinlichkeitsdichten repräsentieren unscharfe Positionen, indem sie uns erlauben, die Wahrscheinlichkeit jedes möglichen Wertes jeder Positionsobservable zu berechnen.
Es sollte nun klar sein, warum wir die interne relative Position eines Atoms nicht wie sie ist beschreiben können. Eine unscharfe Observable beschreiben bedeutet, Wahrscheinlichkeiten zu möglichen Messergebnissen zuzuordnen. Aber eine Beschreibung, die auf der Annahme beruht, dass eine Messung durchgeführt wird, beschreibt die Observable nicht wie sie (alleine, unabhängig von der Messung) ist.
Gravierende Krankheiten erfordern drastische Heilmittel
[Bearbeiten]Planck
[Bearbeiten]Die Quantenmechanik begann als eine verzweifelte Maßnahme, um einige spektakuläre Fehlschläge dessen, was danach als klassische Physik bekannt wurde, zu umgehen.
1890 entdeckte Max Planck ein Gesetz, das das Spektrum eines glühenden, heißen Objektes perfekt beschreibt. Es stellte sich heraus, dass das Plancksche Strahlungsgesetz unvereinbar mit der damaligen Physik war. (Wenn die klassische Physik recht hätte, würde man durch ultraviolettes Licht erblinden, blickte man in den Brenner eines Campingkochers.) Zunächst war es nur ein Gedanke, „eine zufällige Vermutung über eine Interpolationsformel“, wie Planck selbst es nannte. Nur Wochen später stellte sich heraus, dass es die Quantisierung von Energie für die Emission von elektromagnetischer Strahlung implizierte: die Energie eines Strahlungsquants ist Proportional zur Frequenz der Strahlung, der Proportionalitätsfaktor ist das Plancksche Wirkungsquantum :
- .
Natürlich können wir die Kreisfrequenz anstelle von benutzen. Indem wir die reduzierte Version des Planckschen Wirkungsquantums einführen, haben wir
- .
Rutherford
[Bearbeiten]1911 schlug Ernest Rutherford ein Atommodell vor, welches auf Experimenten durch Geiger und Marsden basierte. Geiger und Marsden hatten einen Strahl von Alphateilchen auf eine dünne Goldfolie gerichtet. Die meisten der Partikel durchdrangen die Folie mehr oder weniger wie erwartet, aber ungefähr eines von 8000 prallte ab, als ob es ein viel schwereres Objekt getroffen hätte. Laut Rutherford sei das so unglaublich als ob man eine 15 Zoll Kanonenkugel auf ein Stück Papiertaschentuch abfeuert und sie prallt ab und trifft einen. Nachdem er die Daten, die Geiger und Marsden gesammelt hatten, analysiert hatte, schlussfolgerte Rutherford, dass der Durchmesser des Atomkerns (welcher über 99.9% der Masse des Atoms enthält) weniger als 0.01% des Durchmessers des Gesamtatoms beträgt, und er war sich sicher, dass die Elektronen den Kern umkreisen, in vielerlei Hinsicht wie Planeten, die einen Stern umkreisen.
Die klassische Theorie des Elektromagnetismus anderseits sagt voraus, dass ein umkreisendes Elektron in ungefähr 0.5ns seine Energie in Strahlung umwandeln und auf einer spiralförmigen Bahn in den Kern wandern wird. Das war der schlimmste quantitative Fehlschlag in der Geschichte der Physik, da die Lebensdauer von Wasserstoff um mindestens vierzig Größenordnungen unterschätzt wurde. (Dieser Vergleich basiert auf der experimentell festgestellten unteren Schranke für die Lebensdauer eines Protons.)
Bohr
[Bearbeiten]1913 postulierte Niels Bohr, dass der Drehimpuls eines Elektrons, dass einen Atomkern umkreist, quantisiert sei: seine "erlaubten" Werte seien ganzzahlige Vielfache von :
- mit
Warum gerade den Drehimpuls statt irgend eine andere Größe quantisierten?
- Strahlungsenergie einer gegebenen Frequenz ist in Vielfachen des Planckschen Wirkungsquantums quantisiert.
- Das Plancksche Wirkungsquantum wird in der selben Einheit gemessen wie der Drehimpuls.
Bohrs Postulat erklärte nicht nur die Stabilität von Atomen, sonder auch, warum die Emmision und Absorption von elektromagnetischer Strahlung durch Atome diskret ist. Zusätzlich ermöglichte es ihm mit bemerkenswerter Genauigkeit das Spektrum von Wasserstoff — die Frequenzen, bei denen es in der Lage ist, Licht zu emittieren (sichtbares sowie infrarotes und ultraviolettes) — zu berechnen. Das nächste Bild zeig das sichtbare Emissionsspektrum von atomarem Wasserstoff, welches vier Linien der Balmer-Serie enthält.


Abgesehen von seinem Quantisierungspostulat blieb Bohrs Gedankengang zu dieser Zeit komplett klassisch. Nehmen wir mit Bohr an, dass der Orbit des Elektrons ein Kreis mit Radius ist. Die Geschwindigkeit des Elektrons ist dann gegeben durch , und seine Beschleunigung durch . Eliminierung von ergibt . Im cgs Einheitensystem ist die Coulomb-Kraft einfach , wobei die Ladung von sowohl Elektron als auch Proton ist. Mit Newtons ergeben die letzten beiden Gleichungen , wobei die Masse des Elektrons ist. Wenn wir annehmen, dass das Proton ruht, erhalten wir als kinetische Energie des Elektrons.
Wenn die potentielle Energie des Elektrons im Unendlichen zu 0 gesetzt wird, ist seine potentielle Energie bei der Entfernung vom Proton minus die Arbeit, die nötig ist, um es von unendlich weit vom Proton weg zu bewegen,
Die Gesamtenergie des Elektrons ist daher
- .
Wir wollen das durch den Drehimpuls des Elektrons ausdrücken. Wenn wir uns erinnern, dass , und daher , und den Nenner mit multiplizieren, erhalten wir
- .
Jetzt kommt Bohrs Bruch mit der klassischen Physik: er ersetzte einfach durch . Die "erlaubten" Werte für den Drehimpuls definieren eine Reihe erlaubter Werte für die Energie des Atoms:
Ein Ergebnis davon ist, dass das Atom Energie nur in Mengen absorbieren oder emittieren kann, die dem Betrag der Differenzen
entspricht, wobei ein Rydberg (Ry) gleich ist. Das ist auch die Ionisierungsenergie von atomarem Wasserstoff — die Energie, die benötigt wird, um das Elektron komplett vom Proton zu entfernen. Es stellte sich heraus, dass der Wert, den Bohr vorhergesagt hatte, exzellent mit dem Gemessenen übereinstimmte.
Durch Umstellung der beiden Ausdrücke für die Energie des Atoms von oben nach erhalten wir . Für den Grundzustand ist das auch der Bohrradius des Wasserstoffatoms, welcher entspricht. Die vollentwickelte Theorie kommt zum selben Ergebnis, interpretiert es aber as die wahrscheinlichste Entfernung von Proton, bei der das Elektron gefunden würde, wenn seine Entfernung vom Proton gemessen würde.
de Broglie
[Bearbeiten]1923, zehn Jahre nachdem Bohr das Spektrum von atomaren Wasserstoff hergeleitet hatte, indem er die quantisierung des Drehimpulses postuliert hatte, fand Louis de Broglie eine Erklärung dafür, dass der Drehimpuls eines Atoms in Vielfachen von auftritt. Seit 1905 hatte Einstein argumentiert, dass elektromagnetische Strahlung selbst quantisiert sei (und nicht nur ihre Emission und Absorption, wie Planck dachte). Wenn elektromagnetische Wellen sich verhalten können wie Partikel (heute als Photonen bekannt), dachte de Broglie, warum können sich Elektronen nicht wie Wellen verhalten?
Man nehme an, dass das Elektron eines Wasserstoffatoms eine stehende Welle auf dem ist, was man bisher für den kreisförmigen Orbit des Elektrons hielt. Damit so eine Welle auf einem Kreis existieren kann, muss dessen Umfang ein ganzzahliges vielfaches der Wellenlänge ersterer sein: .
Einstein hatte nicht nur festgestellt, dass elektromagnetische Strahlung mit der Frequenz in Quanten von Energie auftritt, sondern auch, dass diese Quanten einen Impuls tragen. Benutzt man diese Formel um aus der Bedingung zu eliminieren, erhält man . Aber ist einfach der Drehimpuls eines klassischen Elektrons mit einem Orbit vom Radius . Auf diese Weise konnte de Broglie die Bedingung herleiten, die Bohr einfach postuliert hatte.
Schrödinger
[Bearbeiten]Wenn das Elektron eine stehende Welle ist, warum sollte es (sie) auf einen Kreis beschränkt sein? Nach de Broglies entscheidender Erkenntnis, dass Partikel Wellen einer gewissen Sorte sind, dauerte es weniger als drei Jahre, bis die vollentwickelte Quantentheorie nicht nur ein mal, sondern zwei mal, gefunden wurde: 1925 durch Werner Heisenberg und 1926 durch Erwin Schrödinger. Wenn wir das Elektron als eine stehende Wellen in drei Dimensionen betrachten, haben wir alles, was man braucht, um bei der Schrödingergleichung anzukommen, dem Herz der vollentwickelten Theorie.
Bleiben wir in einer Raumdimension. Die einfachste mathematische Beschreibung einer Welle mit Wellenzahl und Kreisfrequenz ist die Funktion
- .
Wir wollen die Phase durch die Energie des Elektrons und seinen Impuls ausdrücken:
- .
Die partiellen Ableitungen nach und sind
Wir brauchen auch die zweite partielle Ableitung von nach :
Wir haben also
In nichtrelativistischer, klassischer Physik stehen die kinetische Energie und der kinetische Impuls in einer Dispersionsrelation
- .
Diese Beziehung gilt auch in der nichtrelativistischen Quantenphysik. Du wirst später lernen, warum.
In drei Raumdimensionen ist der Betrag eines Vektors . Wenn das Partikel auch potentielle Energie und einen potentiellen Impuls hat (dann ist es nicht frei), und wenn und respektive für die komplette Energie und den kompletten Impuls des Partikels stehen, ist die Dispersionsrelation
Mit dem Quadrat eines Vektors meinen wir das Skalarprodukt . Du wirst später lernen, warum wir mögliche Einflüsse auf die Bewegung eines Partikels durch solche Felder als und darstellen.
Wenn wir zu unserer fiktiven Welt mit nur einer Raumdimension zurückkehren, eine potentielle Energie erlauben, die Differentialoperatoren und für und in der sich ergebenden Dispersionsrelation substituieren, und wenn wir beider Seiten der so entstandenen Operatorgleichung auf anwenden, erhalten wir die eindimensionale (zeitabhängige) Schrödingergleichung:
In drei Raumdimensionen and mit sowohl potentieller Energie als auch potentiellem Impuls , nehmen wir die Relation als Ausgang und substituieren für und für . Der Differentialoperator ist ein Vektor, dessen Komponenten die Differentialoperatoren sind. Das Ergebnis:
wobei nun eine Funktion von und ist. Das ist die dreidimensionale Schrödingergleichung. In nicht-relativistischen Untersuchen (auf welche die Schrödingergleichung beschränkt ist) kann der potentielle Impuls normalerweise ignoriert werden, warum die Schrödingergleichung oft in dieser Form angegeben wird:
- }}
Die freie Schrödingergleichung (sogar ohne den Term für die potentielle Energie) wird durch (in einer Dimension) oder (in drei Dimensionen) erfüllt, wenn gleich ist, was gleichbedeutend ist mit: . Da wir es jedoch mit einer homogenen, linearen Differentialgleichung zu tun haben — was uns sagt, dass man zu Lösungen eine Konstante addieren oder Lösungen mit einer Konstante multiplizieren kann, um auf weitere Lösungen zu kommen — löst jede Funktion der Form
mit die (eindimensionale) Schrödingergleichung. Wenn keine Integrationsgrenzen angegeben werden, integrieren wir über die gesamte reelle Achse, dass heißt, das Integral ist als der Grenzwert definiert. Die umkehrung gilt auch: jede Lösung ist von dieser Form. Der Faktor vor dem Integral existiert nur zu kosmetischen Zwecken, wie du gleich verstehen wirst. ist die Fouriertransformation von , was bedeutet, dass
Die Fouriertransformation von existiert, weil das Integral endlich ist. Im nächsten Abschnitt werden wir den physikalischen Grund kennenlernen, warum das Integral endlich ist.
Jetzt haben wir die Bedingung, die jede "Elektronenwellenfunktion" erfüllen muss, damit die entsprechende Dispersionsrelation erfüllt ist. Wenn sie (und dadurch die Schrödingergleichung) eines oder beide der Potentiale oder enthält, kann das Finden von Lösungen schwer sein. Als ein angehender Quantenmechaniker wirst du eine beachtliche Zeit damit zubringen, zu lernen, Schrödingergleichungen mit verschiedenen Potentialen zu lösen.
Born
[Bearbeiten]Im selben Jahr, in dem Erwin Schrödinger die Gleichung veröffentlichte, die nun seinen Namen trägt, wurde die nichtrelativistische Theorie durch Max Borns Einsicht komplettiert, dass die Schrödinger Wellenfunktion eigentlich nichts außer einem Werkzeug zum Berechnen von Wahrscheinlichkeiten ist, und dass die Wahrscheinlichkeit, ein Partikel, dass durch "beschrieben wird", in einer Raumregion zu finden, durch das Integral
gegeben ist — wenn die angebrachte Messung durchgeführt wird, in diesem Fall ein Test, ob das Partikel in ist. Da die Wahrscheinlichkeit, dass Partikel irgendwo (egal wo) zu finden, 1 sein muss, können nur quadratisch integrierbare Funktionen (Funktionen, für die das Integral des Quadrats dieser Funktion über ihrem Definitionsbereich endlich ist) ein Partikel "beschreiben". Das schließt aus. Anders ausgedrückt, kann kein Partikel einen so scharfen Impuls haben, dass er durch mal einen Wellenvektor angegeben wird, statt durch eine echte Wahrscheinlichkeitsverteilung über verschieden Impulsen.
Wenn eine Wahrscheinlichkeitsdichtefunktion gegeben ist, können wir den Erwartungswert als
und die Standardabweichung , und höhere Momente von , definieren. Aus den Gleichungen folgt
- and
Hier ist ein anderer Ausdruck für
Um zu überprüfen, dass die beiden Gleichungen tatsächlich identisch sind, setzen wir in die letztere Gleichung ein:
Als nächstes ersetzen wir durch und mischen die Integrale mit mathematischer nonchalance, die in der Physik üblich ist:
Der Ausdruck in eckigen Klammern ist eine Repräsentation von Dircas Deltadistribution , ihre definierende Charakteristik ist , für jede stetige Funktion . (Falls du es nicht bemerkt hast, dass beweist, was zu beweisen war.).
Heisenberg
[Bearbeiten]Im selben annus mirabilis der Quantenmechanik, 1926, bewies Werner Heisenberg die sogenannte Unschärferelation.
- .
Da die Relation eine Konsequenz der Tatsache ist, dass und Fouriertransformationen von einander sind, überlassen wir den Beweis den Mathematikern. Die Unschärferelation für Position und Impuls folgt via . Sie sagt aus, dass die unschärfe einer Position (gemessen durch ) und die Unschärfe des korrespondierenden Impulses (gemessen durch ) so sein müssen, dass ihr Produkt mindestens gleich ist.


























































![{\displaystyle V=-\int _{r}^{\infty }F\,dr=-\int _{r}^{\infty }\!{e^{2} \over (r')^{2}}\,dr'=+\left[{e^{2} \over r'}\right]_{r}^{\infty }=0-{e^{2} \over r}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/669b08cbf34e84930a2ad62510230dfec3a36c89)

























































![{\displaystyle \psi (x,t)={1 \over {\sqrt {2\pi }}}\int {\overline {\psi }}(k)\,e^{i[kx-\omega (k)t]}dk={1 \over {\sqrt {2\pi }}}\int {\overline {\psi }}(k,t)\,e^{ikx}dk}](https://wikimedia.org/api/rest_v1/media/math/render/svg/decd70ac0746010d4114e8be9a3aff7f4567684f)























![{\displaystyle \langle k\rangle =\int \!\int {\overline {\psi }}\,^{*}(k')\,k\,{\overline {\psi }}(k)\left[{\frac {1}{2\pi }}\int e^{i(k-k')x}dx\right]dk\,dk'.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eeb26219d324cc48516a301db11ad6b4a291924a)










