Lehrbuch der Biochemie: Grundlagen: Organische Chemie
Dieser Artikel ist, wie vieles andere in diesem Buch auch, schwer in Bearbeitung. Ich habe alle unfertigen Teile hier anstelle der Spielwiese online gestellt, da ich nach wie vor auf Mitarbeit hoffe. Nothingserious 20:08, 1. Jan. 2015 (CET)
Die organische Chemie ist die Lehre von den Kohlenstoffverbindungen und ihren Reaktionen. Der Übergang zur anorganischen Chemie ist in einigen Teilbereichen fließend, da organische Moleküle auch Verbindungen und Reaktionen mit anorganischen Stoffen eingehen, und Kohlenstoff auch in einigen anorganischen Verbindungen vorkommt, allen voran den Carbonaten (CO32-) und den Carbiden. Da Kohlenstoff aufgrund seiner Stellung im PSE vierbindig ist, kann er eine Vielzahl von strukturell verzweigten Verbindungen mit anderen Kohlenstoffatomen eingehen. Alles Leben, das der Menschheit bekannt ist, basiert auf Kohlenstoffverbindungen.
Will man die Vorgänge der Biochemie nachvollziehen, ist eine räumliche Betrachtung der beschriebenen Verbindungen unerlässlich. Der Umgang damit sei natürlich dem Leser überlassen, aber ein einfacher Molekülbaukasten kann viele Strukturen greifbar machen und gleichzeitig auf intuitive Weise vermitteln, warum einige Verbindungen möglich sind, und andere nicht. Eine ausgezeichnete Ergänzung, oder ein guter (und kostenfreier!) Ersatz ist Software, wie Chemdoodle.
Darstellung
[Bearbeiten]Zur Darstellung von organischen Molekülen benutzt man fast immer eine Art von Valenzstrichformel. Diese verdeutlicht schnell erkennbar die beteiligten Atome und die unter ihnen aufgeteilten Valenzelektronen. Die anderen aufgeführten Formelschreibweisen ergänzen, oder vereinfachen jeweils die Valenzstrichformel für den benötigten Zweck. Wichtige Darstellungsmöglichkeiten sollen hier kurz an Propan, einem einfachen Alkan erläutert werden.
Valenzstrichformel
[Bearbeiten]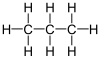
Die Valenzstrichformel stellt die Verbindung ausführlich mit allen gebundenen Wasserstoffatomen dar. Jeder Strich zeigt eine kovalente Bindung an, bei der sich je zwei Bindungspartner ein Elektronenpaar teilen. Eine Doppelbindung wird als Doppel-, eine Dreifachbindung als Dreifachstrich angezeigt.
Konstitutionsformel
[Bearbeiten]Die Konstitutionsformel ist eine abkürzende Schreibweise, bei der man die Struktur einzelner Gruppen als dem Leser bekannt voraussetzt.
Strichformel
[Bearbeiten]
Bei der Strichformel stellt jede Ecke ein Kohlenstoffatom dar. Wird an einem Kohlenstoffatom nichts anderes angezeigt, ist es mit zwei, bei endständigen (terminalen) Kohlenstoffen mit drei Wasserstoffatomen verbunden. Zum besseren Verständnis wird gelegentlich die endständige Gruppe mit eingezeichnet.
Keilstrichformel
[Bearbeiten]
Bei der Keilstrichformel soll zum Ausdruck kommen, welche räumliche Orientierung eine Verbindung hat, was für die chiralität, also die räumliche Anordnung wichtig ist. Alle durch Striche verbundene Atome liegen zunächst in der Papier- (oder Bildschirm-)ebene. Ein Vollkeil weist nach vorne, also aus der Papierebene heraus, ein gestrichelter Keil nach hinten.tetraedrisch, trigonal...
Fischer-Projektion
[Bearbeiten]Die Fischer-Projektion ist eine andere Darstellungsform von räumlichen Verhältnissen, bei der man sich die Keilstrichformel gedreht vorstellen muss. ((WIIE??!)). Vor allem bei Aminosäuren und Kohlenhydraten kommt diese Darstellung noch häufig zum Einsatz.
Newman-Projektion
[Bearbeiten]
Um den Torsionswinkel (oder Verdrehungswinkel) zwischen zwei Gruppen entlang ihrer Bindung beurteilen zu können, zieht man die Newman-Projektion heran. Dabei werden zwei Atome einer Bindung entlang ihrer Bindung dargestellt. Der Mittelpunkt stellt dabei das Atom dar, das man betrachtet, verdeckt dahinter liegt das verbundene Atom. Die vom Mittelpunkt ausgehenden Striche zeigen die Gruppen an, die mit dem vorderen Atom verbunden sind, die vom Kreis ausgehenden Striche die Gruppen, die mit dem zweiten Atom verbunden sind.
Nomenklatur
[Bearbeiten]
Die Nomenklatur der organischen Verbindungen ist systematisch, und zur eindeutigen Benennung folgt man den IUPAC-Regeln. Viele häufig verwendete Organische Verbindungen haben aber - zum Glück - auch deutlich einprägsamere, historisch erwachsene Trivialnamen, eines von unzähligen Beispielen ist das am Rand abgebildete Adrenalin. Dennoch kommt einer systematischen Nomenklatur bei Millionen von bekannten Verbindungen Bedeutung zu, da nur aus der systematischen Nomenklatur eine eindeutige Beschreibung der Chemikalie hervorgeht. Gerade bei vernetztem Wissen in Form von frei zugänglichen Datenbanken ist eine eindeutige Beschreibung unerlässlich. Sucht man nach Alanin, findet man beide Enantiomere, sucht man hingegen nach dem IUPAC-Namen, findet man ausschließlich eine einzige, konkrete Struktur. Eine Vertiefung der Nomenklatur erfolgt in diesem Kapitel jeweils mit der Einführung neuer Klassen von Seitenketten und funktionellen Gruppen. Die Zahl der Kohlenstoffatome wird mit den latainischen Vorsilben ausgedrückt.
Die Nomenklatur erfolgt systematisch, indem zuerst die längste durchgehende Kohlenstoffkette identifiziert wird. Dabei werden Verzweigungen berücksichtigt. Seitenketten werden entsprechend ihrer jeweiligen Nomenklatur benannt, und ein "-yl" wird angehängt. Der Ort der Verzweigung wird immer Anhand der längsten Kohlenstoffkette, und anschließend durch die Priorität der Seitenkette ermittelt. Da es nach diesem Schema bereits jeweils mehrere Möglichkeiten zur Benennung gibt, wird die erste Verzweigung immer so gewählt, dass sich eine möglichst kleine Zahl ergibt. Die nebenstehende Verbindung könnte man also als Beispiele!! benennen.
ALLES IN EINEM BILD VEREINIGEN
Kohlenwasserstoffe
[Bearbeiten]Die einfachste Art der organischen Verbindungen beinhaltet nur Kohlenstoff und Wasserstoff. In einer Kohlenstoff-Kohlenstoff (C-C) Bindung teilen sich die Kohlenstoffatome wegen ihrer gleichen Elektronegativität die Elektronen gleichmäßig untereinander. In Verbindungen mit anderen Elementen ist die Elektronenverteilung hingegen nicht gleichmäßig. Bedeutung später
Alkane
[Bearbeiten]Aufbau und Nomenklatur

Als Alkane bezeichnet man Kohlenwasserstoffe, die Ausschließlich aus C-C Einfachbindungen und C-H Bindungen bestehen und deren Summenformel CnH2n+2 lautet. Der einfachste Vertreter ist das Methan (CH4). Substituiert - also ersetzt - man eines der Wasserstoffatome mit einem Kohlenstoffatom, erhält man den nächsten Vertreter der Homologen Reihe der Alkane, das Ethan. Ersetzt man ein weiteres, erhält man das Propan, bei C4H10 spricht man von Butan.

Durch die Vierbindigkeit kann man aber ebenso eines der Wasserstoffatome in einer Alkankette mit einem weiteren Kohlenstoff ersetzen um eine Verzweigung, oder Seitenkette zu erhalten. Die Nomenklatur folgt der Systematik, indem man anstelle eines "-an" ein "-yl" anhängt. beispiel daneben Wenn man dieses Konzept weiterdenkt, kann man alleine daraus schon eine Unzahl an organischen Verbindungen Ableiten. [[[bsp?]]
Eigenschaften
Alkene
[Bearbeiten]Aufbau und Nomenklatur

Da Kohlenstoff vier kovelente Bindungen eingehen kann, besteht auch die Möglichkeit, zwei C-Atome durch eine Doppelbindung zu verknüpfen. Daraus entsteht die Reihe der Alkene. Der einfachste Vertreter ist hier das Ethen. Betrachtet man das nächste Homolog, Propen, ergeben sich nur zwei Möglichkeiten zur Doppelbindung, die, wenn man sie räumlich dreht, exakt gleich sind. Beim Penten hingegen ergeben sich bereits zwei Möglichkeiten eine Doppelbindung einzufügen. Die Zahl der Möglichkeiten wächst exponentiell mit der Zahl der Kohlenstoffatome. HybridisierungRäumlichkeit Eigenschaften
Alkine
[Bearbeiten]Aufbau und Nomenklatur
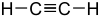
Die letzte Art der reinen Kohlenwasserstoffe sind die Alkine, bei denen zwei C-Atome untereinander eine Dreifachbindung ausbilden. Ihre räumliche Anordnung verhält sich analog zu der der Alkene, indem die Dreifachbindung räumlich stabil ist. Eigenschaften
Substituierte Kohlenwasserstoffe
[Bearbeiten]Fügt man zu einem Kohlenwasserstoff anstelle von Wasserstoffatomen ein anderes, kovalent gebundenes Atom hinzu, spricht man von substituierten Kohlenwasserstoffen. Auch hier gibt die Vierbindigkeit des Kohlenstoffs die möglichen Kombinationen vor. Kohlenstoff kann in organischen Verbindungen eine Vielzahl von Substituenten aufnehmen, von denen das Sauerstoffatom, das Stickstoffatom, das Schwefelatom und das Phosphoratom die am häufigsten vorkommenden in der Biochemie sind. Zuerst betrachten wir Halogene als Substituenten, danach die verschiedenen Sauerstoff und die Metalle.
Da die räumliche Struktur im weiteren Verlauf oft eine Rolle spielt, werden ab jetzt Keilstrichformeln benutzt.
Alkohole
[Bearbeiten]Aufbau und Nomenklatur Eigenschaften

Ersetzt man ein oder mehrere C-Atome durch eine OH-Gruppe
Ether
[Bearbeiten]Ether sind auch als ungesättigte Kohlenwasserstoffen in bestimmten Verbindungen zu finden. Mit ihrer kronenförmigen Struktur (siehe Bild rechts) können sie auch eine cyclische Struktur bilden.

Aldehyde
[Bearbeiten]Ketone
[Bearbeiten]Carbonsäuren
[Bearbeiten]Halogenkohlenwasserstoffe
[Bearbeiten]
Aufbau und Nomenklatur Eigenschaften Substituiert man ein Wasserstoffatom durch ein Halogenatom, spricht man von Halogenorganischen Verbindungen.
Amide
[Bearbeiten]Aromaten
[Bearbeiten]Metallorganische Verbindungen
[Bearbeiten]Weblinks
[Bearbeiten]http://www.chem.qmul.ac.uk/iupac/
Literatur
[Bearbeiten]Vollhardt Schore
- Exkurs: Warum kein Silizium???

