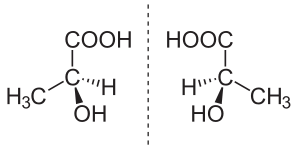Organische Chemie für Schüler/ Carbonsäuren
Carbonsäuren (organische Säuren)
[Bearbeiten]V1: In konzentrierte Essigsäure werden zwei Elektroden aus Graphit gegeben und ein Stromkreis mit Ampèremeter angeschlossen (5-10 Volt Wechselspannung). Die so gemessene Stromstärke gibt Auskunft über die Leitfähigkeit der Lösung.
Nach dem ersten Messen der Leitfähigkeit wird kontinuierlich Wasser hinzu gegeben und die Stromstärke beobachtet.
| B | S: |
| 1. Essigsäure zeigt keinerlei messbare Leitfähigkeit | → In Lösungen können nur Ionen die Elektronen von einer Elektrode zur anderen transportieren.
Liegt keine Leitfähigkeit vor, ist der Stromkreis nicht geschlossen. Also sind demzufolge keine Ionen in der Lösung vorhanden |
| 2. Je mehr Wasser hinzu gegeben wird, desto höher steigt die Leitfähigkeit. Sie übertrifft sogar den Wert der Leitfähigkeit von reinem Wasser. | → Durch die Zugabe von Wasser müssen sich Ionen gebildet haben. |
Wo kommen diese Ionen her?
- Essigsäure (Ethansäure) + Wasser → Essigsäuresäureanion + Oxoniumion
- Wichtige Zusatzinformationen
- Die Heterolyse ist ebenfalls eine heterolytische Spaltung. Eine solche Aufspaltung von Verbindungen in Wasser in ihre Ionen wird auch Dissoziation genannt.
- Eine Dissoziation muss nicht vollständig sein. Bei Essigsäure dissoziiert ca. jedes 100. Molekül (→ pH ca. 5, da die Konzentration an H3O+ = 10-5 mol/l (statt 10-7 mol/l bei Wasser)
- Da H+ keine Elektronen hat und nur ein Proton (und kein Neutron!), wird es unter Chemikern auch als Proton bezeichnet!
- Wichtig: Säure und saure Eigenschaften sind keine unveränderbaren Stoffeigenschaften (wie z.B. der Siedepunkt). Essigsäure beispielsweise ist also erst in Verbindung mit Wasser eine Säure! Sauer kann folglich keine Stoffeigenschaft sein, sondern erst das Ergebnis einer Reaktion, bei der Oxoniumionen[1] entstehen.
- Umgangssprachlich sagen Chemiker oft, dass das H+ - Ion die Säureeigenschaften ausmacht. Als Erklärung für viele Modelle ist dies auch mehr als ausreichend. Genau genommen ist es aber immer das Oxoniumion (H3O+), welches die sauren Eigenschaften ausmacht.
- Zum Nachdenken: Du kennst jetzt die beiden Grundtypen chemischer Reaktionen:
a) Redoxreaktionen: Elektronen (e-) werden übertragen b) Säure-Base-Reaktionen: Protonen (p+) werden übertragen
- Zusatzinformationen
Eisessig
[Bearbeiten]Carbonsäuren haben durch ihren Aufbau und vor allem durch das Ausbilden starker WBBs hohe Schmelz- und Siedepunkte (im Vergleich zu Alkanen und Alkoholen gleicher Kettenlänge).
Besonders deutlich wird dies beim Gefrieren von Essigsäure.
V: Essigsäure wird in den Kühlschrank gestellt (evtl. ein gelegtes RG).
B: Essigsäure ist nach wenigen Minuten gefroren.
S: Der Schmelzpunkt von Essigsäure liegt oberhalb der Temperatur des Kühlschranks.
Kühlschränke kühlen meist im Bereich von 4-6°C, der Schmelzpunkt von wasserfreier, konzentrierter Essigsäure liegt bei 16,2°C.
Versuche mit Carbonsäuren
[Bearbeiten]V1. pH- Messung von Natriumacetat in wenig Wasser
B: Natriumacetat zeigt mit Wasser einen leicht alkalischen pH-Wert von ca. 9.
S: Nicht alle Salze reagieren mit Wasser neutral! Es gibt mit Wasser reagierende saure und alkalisch reagierende Salze. Natriumacetat ist ein Salz der Essigsäure. Es reagiert als Base, indem es ein Proton des Wassers aufnimmt. Dabei bilden sich Hydroxidionen (OH–), welche für den gemessenen pH-Wert verantwortlich sind.
- Natriumacetat + Wasser → Essigsäure + Hydroxid + Natriumion

V2. Essigsäure unverdünnt und verdünnt in Calciumcarbonat (Kalk) geben. Das Gas kann mit einem Stopfen und einem Glasrohr in Kalkwasser geleitet werden.
B:
- Bei verdünnter Essigsäure ist die saure Wirkung viel stärker!
- Gasentwicklung (wenn Kalkwasser verwendet wurde, trübt es sich milchig)
S: Man würde erst mal erwarten, dass bei einer konzentrierten Säure die Reaktion heftiger ist.
Zur Reaktion muss man aber wissen, dass durch Wasserzugabe eine weitere (zweite!) Säure (das Oxoniumion H3O+) entsteht und diese als starke Säure viel stärker sauer als Essigsäure ist.
- Essigsäure + Calciumcarbonat + Wasser → Essigsäuresäureanion + Oxoniumion + Kohlenstoffdioxid
Kalkwasser trübt sich aufgrund des Kohlenstoffdioxids. Kalkwasser ist ein Kohlenstoffdioxidnachweis. Das entstandene Kohlenstoffdioxid lässt die Flüssigkeit aufschäumen.
Informationen zu Carbonsäuren
[Bearbeiten]Carbonsäuren kommen in der Natur häufig vor. Sie dienen z.B. als Abwehrstoff (Ameisensäure), Fruchtsäuren, kommen in Schweiß vor und bilden Ölen, Fette, Harze und Wachse. Man findet sie ebenfalls in Geruchsstoffen und in natürlichen Aromen. Essigsäure beispielsweise entsteht durch die Oxidation von Aldehyden oder primären Alkoholen:
Stehenlassen von Wein in einer geöffneten Flasche:
Alkohol → Oxidation zum Aldehyd → Oxidation zur Carbonsäure
Ethanol → Ethanal → Ethansäure (= Essigsäure)
Da die Carbonsäuren sich von den Alkanen ableiten und als funktionelle Gruppe die Carboxyl-Gruppe enthalten (Achtung: das C-Atom der Carboxygruppe wird mitgezählt!), kann man entsprechend auch hier eine homologe Reihung aufstellen[2]:
| Name | Trivialname | Säurerestanion | Formel |
|---|---|---|---|
| Methansäure | Ameisensäure | Formiat | H–COOH |
| Ethansäure | Essigsäure | Acetat | H3C–COOH |
| Propansäure | Propionsäure | Propionat | H3C–CH2–COOH |
| Butansäure | Buttersäure | Butyrat | H3C–(CH2)2–COOH |
-
Propionsäure (im Schweiß enthalten)
-
Buttersäure (in ranziger Butter enthalten)
- Zusatzinformationen
Carbonsäuren Ameisensäure Essigsäure Propionsäure Buttersäure
Weitere Typen von Carbonsäuren
[Bearbeiten]Gesättigte und ungesättigte Fettsäuren:
Höhere, (langkettige) Carbonsäuren werden Fettsäuren genannt. Carbonsäuren mit mindestens 4 Kohlenstoffatomen können von Lebewesen zum Aufbau von Fetten verwendet werden. Man nennt sie deshalb und auch wegen ihrer Unlöslichkeit in Wasser Fettsäuren. Die meisten Fettsäuren bei Säugetieren tragen 15-16 Kohlenstoffatome.
Enthalten sie keine Doppelbindungen, nennt man sie gesättigte Fettsäuren. Sie sind eher in tierischen Fetten zu finden. Ungesättigte Fettsäuren enthalten entsprechend eine oder mehrere Mehrfachbindungen. Sie sind für die menschliche Ernährung sehr wertvoll, da sie Vorstufen zu Vitaminen darstellen können. Man findet sie eher in Pflanzen.
Beispiele für Fettsäuren:

Palmitinsäure (Anion: Palmitat) H3C–(CH2)14–COOH(=C15H31COOH) Palmitinsäure und Stearinsäure sind die mit am häufigsten vorkommenden Bestandteile pflanzlicher Fettsäuren. Palmöl besteht z.B. zu 45% daraus.

Stearinsäure (Anion: Stearat) H3C–(CH2)16–COOH(= C17H35COOH)schwache, feste (!) Säure, bildet weiße Blättchen, Geruch nach altem Fett, nicht wasserlöslich, Verwendung als Zusatzstoff in Waschmitteln. Das Natriumsalz Natriumstearat wird als Reinigungsmittel verwendet, auch Zusatzstoff der Lebensmittelindustrie, manchmal Wachsbestandteil. Stearinsäure ist Ausgangsstoff zur Herstellung von Kernseife und somit in vielen Waschmitteln vorhanden. Ebenfalls für Kosmetika verwendet (Cremes).
Als gesättigte Fettsäure v.a. im Schweinefett (14%), im Rinderfett (20%), und auch in der Milch (im Milchfett 13%) zu finden. Stearinsäure

Ölsäure (Anion: Oleat) H3C–(CH2)15–COOH(=C17H33COOH)Bestandteil der entsprechenden Triglyceride sehr vielen natürlichen Ölen und Fetten vor, z.B.: Olivenöl (55-80 %), Traubenkernöl (15-20 %) und Erdnussöl.

- Weitere wichtige Alkansäuren
Ameisensäure, Arachinsäure, Essigsäure, Propionsäure, Buttersäure, Valeriansäure, Capronsäure, Önanthsäure, Caprylsäure, Pelargonsäure, Caprinsäure, Undecansäure, Laurinsäure, Tridecansäure, Myristinsäure, Pentadecansäure, Palmitinsäure, Margarinsäure, Stearinsäure
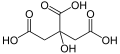
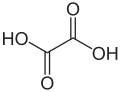
Dicarbonsäuren und Polycarbonsäuren
Carbonsäuren können eine oder mehrere Carboxylgruppen enthalten. Carbonsäuren mit zwei Carboxylgruppen werden Dicarbonsäuren genannt.
Die Vorsilben Mono-, Di- oder Tri- geben dabei natürlich die Anzahl der Carboxyl-Gruppen an
- Beispiele
- Oxalsäure Oxalat HOOC–COOH (=Ethandisäure; kommt in Sauerklee vor)
- Malonsäure Malonat HOOC–CH2–COOH
- Bernsteinsäure Succinat HOOC–CH2–CH2–COOH
Hydroxycarbonsäuren
Ihr Kennzeichen ist, dass sie zusätzlich zur Carboxylgruppe noch eine Hydroxygruppe (OH) haben.
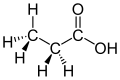
z.B. Milchsäure (Hydroxypropansäure), Citronensäure, Weinsäure.
-
Äpfelsäure
-
Citronensäure
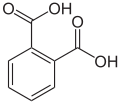
Cyclische Carbonsäuren
Ist die funktionelle Carboxygruppe mit einem aromatischem Ring verbunden (oft Benzol) nennt man sie Cyclo-Carbonsäuren. Der Benzolring kann zusätzlich noch mit einer OH-Gruppe verbunden sein (aromatischen Hydroxycarbonsäuren).
-
Benzolcarbonsäure (Benzoesäure)
-
Phthalsäure (aromatische Dicarbonsäure)
-
Acetylsalicylsäure (enthalten in Aspirin)
-
Ascorbinsäure (bekannt als Vitamin C)
Übersicht über die wichtigsten Carbonsäuren und ihre Salze
[Bearbeiten]Wenn eine Carbonsäure dissoziiert, dann entsteht ein Proton und ein Säurerestanion. Das Säurerestanion kann sich aufgrund seiner negativen Ladung leicht mit einem positiv Metallkation (z.B. Na+ oder K+) vereinigen und so ein Salz bilden. Diese Salze heißen entsprechend den anorganischen Salzen nach dem Metallnamen und dem Säurerestionnamen.
| Säure | Säurerestion | Beispielsalz |
|---|---|---|
| Oxalsäure | Oxalat | Natriumoxalat |
| Buttersäure | Butyrat | Natriumbutyrate |
| Malonsäure | Malonat | Natriummalonat |
| Bernsteinsäure | Succinat | Natriumsuccinat |
| Palmitinsäure | Palmitat | Natriumpalmitat |
| Stearinsäure | Stearat | Natriumstearat |
| Milchsäure | Lactat | Natriumlactat |
| Citronensäure | Citrat | Natriumcitrat |
| Weinsäure | Tartrat | Natriumtartrat |
| Äpfelsäure | Malat | Natriummalat |
| Ascorbinsäure | Ascorbat | Natriumascorbat |
Allgemeine Eigenschaften der Carbonsäuren
[Bearbeiten]
Kurzkettige Carbonsäuren (bis C8) sind bei Raumtemperatur flüssig. Durch ihre hohe Polarität lösen sie sich gut in Wasser. Dabei geben sie ihr Proton ab (Dissoziation in Ionen). Aber nur kurzkettige Carbonsäuren (bis C4) sind wasserlöslich, da bei ihnen der polare Anteil der Carboxylgruppe gegenüber der unpolaren Kohlenstoffkette überwiegt. Wasserstoffbrückenbindungen erhöhen die Wasserlöslichkeit. Je länger nun die apolare Kohlenstoffkette wird, desto mehr nehmen deren apolare Eigenschaften zu, die Van-der-Waals-Kräfte steigen und die Siedepunkte nehmen auch zu. So ist die Pentansäure kaum noch in Wasser löslich.
Die feste Ausbildung von Wasserstoffbrückenbindungen und die daraus resultierenden hohen Siedepunkte sind die Konsequenz. In der Reihe Alkane → Aldehyde → Alkohole → Carbonsäuren haben sie die höchsten Siedepunkte bei gleicher Kohlenstoffkettenlänge.
→ kürzerkettige Carbonsäuren (bis Octansäure) sind wasserlöslich und bei Raumtemperatur flüssig
Carbonsäuren längerer Kohlenwasserstoffketten sind dickflüssiger und ihr apolarer Charakter nimmt deutlich zu. Fettsäuren sind kaum noch wasserlöslich.
Verstärkt wird dieser Effekt durch die bei Carbonsäuren typische Bildung von „Dimeren“ - dabei handelt es sich um eine Form von Assoziation zwischen jeweils zwei Molekülen:

Zwei Moleküle bilden einen lockeren Verband (ein Dimer) - dieser zusätzliche Zusammenhalt erhöht Schmelz und Siedepunkte der Carbonsäuren. So liegen Smp. und Sdp. wesentlich höher als die der vergleichbaren Alkohole.
Die O-H Bindung ist durch den -I Effekt des anderen (hier: oberen) Sauerstoffatoms stark polarisiert.
Entsprechend wie die Wasserlöslichkeit nimmt auch die Dissoziation und die damit verbundene Säurestärke mit zunehmender Kettenlänge der Carbonsäuren ab.
- Vergleich[3]
- pKs-WertAmeisensäure = 3,65
- pKs-WertEssigsäure = 4,65
Generell ist die Säurestärke vor allem von der Elektronegativität des Atoms an welches das H-Atom gebunden ist abhängig. Ein weiterer Effekt ist die anschließende Stabilisierung des negativ geladenen Anions (Säurerests) durch Elektronen ziehende Effekte sowie durch Mesomerie der Doppelbindung:
Mesomerie: Grenzstrukturen zeigen eine Delokalisierung der Doppelbindung
Herstellung:
Carbonsäuren können durch Oxidation von Alkoholen oder Aldehyden sowie durch die Reduktion von Kohlendioxid (mit Grignard-Verbindungen) hergestellt werden.
Der Hauptanteil der Produktion geschieht allerdings durch Gärung (Essigsäureproduktion durch Gärung im sauerstoffreichen Milieu). Dies geschieht schon durch stehen lassen einer offenen Weinflasche nach wenigen Tagen.
Verwendung:
Carbonsäuren und ihrer Salze werden zu vielen Zwecken verwendet:
- Zusatzstoffe und Konservierungsstoffe in Lebensmitteln
- Herstellung von Seifen (Tensiden)
- Ausgangsstoffe sowie Zwischenprodukte für weitere organischen Synthesen u.a. - Herstellung von Riechstoffen (als Basis für Ester)
- Herstellung von Kunststoffen,
- Medikamentenherstellung
- Farbstoffherstellung
- Kunstharzherstellung
- Aufgaben
- Was versteht man unter einem korrespondierendem Säure-Base-Paar? Erstelle zur Erklärung eine beliebige Reaktionsgleichung einer Neutralisation und kennzeichne es.
- In welche Ionen dissoziiert Ameisensäure?
- Welchen Einfluss haben andere Faktoren auf die Leitfähigkeit bei Messungen von Flüssigkeiten?
- Welcher Zusammenhang besteht zwischen Ionenanzahl einer Lösung und der sich daraus ergebenden Erhöhung der Leitfähigkeit?
- Reines (destilliertes) Wasser hat auch eine leichte Leitfähigkeit. Sie lässt nach Berechnung auf eine Konzentration von ca. 10-7 mol Ionen pro mol Wasser schließen. Weißt Du welches Ion (welche Ionen) hier für die Leitfähigkeit verantwortlich sind?
- Je länger die Kohlenstoffkette einer Monocarbonsäure, desto geringer wird ihre Leitfähigkeit. Finde verschiedene Ursachen für diesen Befund!
- Was versteht man unter Mesomerie?
Formeln von einigen ausgewählten organischen Säuren
[Bearbeiten]- Monocarbonsäuren
-
Ameisensäure
-
Essigsäure
- Dicarbonsäuren
-
Oxalsäure
-
Bernsteinsäure
- Hydroxycarbonsäuren
Der sechseckige Ring steht für eine zyklische Kohlenstoffverbindung mit der Formel C6H6
-
Äpfelsäure
-
Citronensäure
- Säuren mit aromatischen Ring
-
Acetylsalicylsäure
-
Ascorbinsäure
Übersicht über die organischen Säuren
[Bearbeiten]Die Carbonsäuren beinhalten eine große Gruppe von organischen Säuren, die in der Natur weit verbreitet sind.
Chemische Reaktionen der Carbonsäuren
[Bearbeiten]- Die bekannteste Reaktion der Carbonsäuren ist die Esterbildung aus Carbonsäure und Alkoholen. (Siehe dazu Kapitel „Ester“). Ein Sonderfall stellt dabei die Veresterung von Glycerin mit drei Fettsäuren dar. Es entstehen die zum Membranaufbau bei Menschen verwendeten Triglyceride.
- Eine weitere bekannte Reaktion ist die Substitution. Besonders Halogene lassen sich an die Kohlenstoffkette anlagern (→ Halogencarbonsäuren entstehen). Halogencarbonsäuren sind reaktiver und stärker sauer (durch den I-Effekt des Halogens) als ihre nicht halogenierten Gegenstücke. Mit Wasser reagieren die Halogencarbonsäuren wieder zurück zur Carbonsäure und dem entsprechenden Halogenwasserstoff.
Substitution einer Carbonsäure mit Chlor
- Essigsäure und Chlor reagiert zu Chloressigsäure und Chlorwasserstoff
Substituiert man halogenierte Carbonsäuren mit Ammoniak (NH3) bilden sich Amide. Bildung eines Amids aus einer Halogencarbonsäure:
- Chloressigsäure + Ammoniak → Ethansäureamid (Acetamid) + Ammoniumchlorid
Nicht zu verwechseln sind Amide (funktionelle Gruppe: CO–NR2) mit Aminosäuren (zwei funktionelle Gruppen: Aminogruppe NH2 und Carbonsäuregruppe COOH).
- Saure Reaktion der Carbonsäuren: Wie schon erwähnt spalten vor allem kürzerkettige Carbonsäuren recht leicht ihr Proton ab und reagieren unter Bildung in Wasser von H3O+ sauer. Günstig wirkt dabei die Mesomeriestabilisierung des Anions.
Beachte den Einfluss der Substituenten auf die Säurestärke:
- Substituenten mit -I-Effekt erhöhen die Säurestärke (also geringer pKs).
- Substituenten mit +I-Effekt verringern die Säurestärke (hoher pKs)
- Aufgabe
- Erkläre den Zusammenhang zwischen dem I-Effekt und der resultierenden Säurestärke mit eigenen Worten
- Wie stellt man mit den Metallen Magnesium, Calcium, Zink oder Eisen die entsprechenden Acetate her? (Welche Gemeinsamkeit haben diese Metalle?)
Stereoisomerie (=Spiegelbildisomerie)
[Bearbeiten]Milchsäure ist u.a. das Produkt der Milchsäurebakterien. Diese befinden sich bei Menschen und Wirbeltieren auf der Haut und leben mit diesen in Symbiose (zum gegenseitigen Nutzen). Sie werden vom Körper u.a. über den Schweiß ernährt und scheiden als Stoffwechselendprodukt Milchsäure aus. Diese schützt uns Menschen beispielsweise vor Hautpilzen und anderen (schädlichen) Bakterien.
Milchsäurebakterien befinden sich auch am Euter der Kuh. So gelangen sie in die Milch und nach wenigen Tagen, haben sie sich ausreichend vermehrt und soviel Milchsäure hergestellt, dass die Milch sauer wird. Bei der Herstellung von vielen Milchprodukten (z.B. der Yoghurtherstellung) macht man sich dies zunutze.
Wenn man die Milchsäure im Labor untersucht, stellt man fest, dass es zwei Isomere gibt. Da sie sich im Aufbau wie Spiegelbilder zueinander verhalten, nennt man diese auch Spiegelbildisomere (oder Stereoisomere)
- Linksdrehende Milchsäure = L(+)-Milchsäure (lat.: laevus = links)
- Rechtsdrehende Milchsäure = D(-)-Milchsäure (lat.: dexter = rechts)
Stellt man die Kohlenstoffkette von oben nach unten dar (nach Fischer), so erkennt man, dass der Wasserstoff und das Hydroxid sowohl einmal links oder rechts liegen können. Durch einfaches Drehen der Verbindung kann man beide Formen nicht ineinander überführen.
Dies tritt immer dann auf, wenn vier unterschiedliche Substituenten an einem Kohlenstoffatom sitzen. Solche Substanzen, die sich spiegelbildlich zueinander verhalten, nennt man auch Enantiomere (griechisch: enantios = entgegengesetzt).
(Man nennt solche Verbindungen auch chirale Verbindungen (nicht deckungsgleich), das Phänomen auch Chiralität. In allen Fällen liegt ein zentrales asymmetrisches Kohlenstoffatom vor.)
Die bekanntesten chiralen Verbindungen sind Zucker, einige Carbonsäuren wie Milchsäure und Weinsäure sowie die Aminosäuren.
Chirale Verbindungen lassen sich durch polarisiertes Licht unterschieden, deshalb spricht man in diesem Zusammenhang auch oft von optischer Aktivität.
Ein Gemisch aus links- und rechtsdrehenden Substanzen wird auch Racemat genannt.
- Zusatzinformationen
Es gibt Stereoisomere, die keine Enantiomere sind. Man bezeichnet diese als Diastereomere.
- Aufgaben
- Zeichne beide Isomere der Weinsäure
Fischer Projektion
[Bearbeiten]Die Fischer-Projektion erlaubt das Darstellen der optisch aktiven Substanzen auf dem Papier.
- Regeln
- Die Kohlenstoffkette wird senkrecht angeordnet, so dass das C-Atom mit der höchsten Oxidationszahl oben ist.
- die restlichen Substituenten werden horizontal angeordnet
- Gruppen, die waagrecht am C* sitzen zeigen nach vorne aus der Tafelebene. Gruppen, die senkrecht am C* sitzen zeigen nach hinten aus der Tafelebene
- Das Enantiomer wird nach der Stellung der funktionellen Gruppe am C* bezeichnet.- steht die funktionelle Gruppe nach links → L-Form - steht funktionelle Gruppe steht nach rechts → D-Form
- Zusatzinformationen
Fischer-Projektion Hermann Emil Fischer