Organische Chemie für Schüler/ Ester
Versuche mit Estern
[Bearbeiten]Darstellung von Essigsäureethylester
[Bearbeiten]
In einem Rundkolben werden 50 ml Ethanol und 50 ml Essigsäure sowie 10 ml konz. Schwefelsäure ca. 5 min. erhitzt.
Das Erhitzen geschieht aus Sicherheitsgründen mit einer elektrischen Heizplatte. Wenn die Reaktion abgelaufen und abgekühlt ist wird alles aus dem Kolben in ein Becherglas mit Wasser erhitzt
B: Ein flüssiges Produkt entsteht
S: Es entsteht Essigsäureethylester, welcher sehr flüchtig ist.
Zusatzversuch: in Essigsäureethylester kann leicht Styropor aufgelöst werden.
Veresterungen im RG
[Bearbeiten]a) Ester aus anorganischen Säuren
[Bearbeiten]V: 1 ml Ethanol + 3 ml konz. Schwefelsäure werden über der Brennerflamme erwärmt.
S: Es bildet sich Ethylschwefelsäureester, welcher einen typischen Estergeruch hat.
b) Birnenaroma
[Bearbeiten]V: Zu 3 ml Pentanol werden 3 ml halbkonzentrierter Essigsäure und wenige Tropfen konz. Schwefelsäure zugefügt. Dann wird alles kurz erwärmt. (Wegen der brennbaren Dämpfe nicht erhitzen!)
S: Es entsteht Essigsäurepentylester (naturidentischer Aromastoff), welcher ein Hauptbestandteil von Birnenaroma ist.
c) Nelkenaroma
[Bearbeiten]V: Zu einer Spatelspitze Benzoesäure wird wenig (ca. 3 ml) Ethanol sowie wenige Tropfen Schwefelsäure gegeben.
S: Es ist der naturidentische Aromastoff Benzoesäureethylester entstanden
Was sind Ester?
[Bearbeiten]
Ester sind Verbindungen mit der funktionellen Gruppe R1-COOR2 (R1=Rest 1; R2=Rest 2)
Ester entstehen bei der Reaktion einer organischen Säure[1] und eines Alkohols unter Abspaltung von Wasser (Kondensation). Die umgekehrte Reaktion, Spaltung eines Esters in Alkohol und Säure unter Anlagerung von Wasser, nennt man Hydrolyse.
Das Wort Ester ist aus der Bezeichnung Essig-Äther (Ethylacetat) abgeleitet, einer wenig wasserlöslichen Substanz mit einer ähnlich betäubenden Wirkung wie Diethylether.
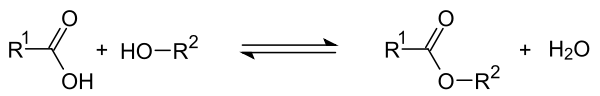
Diese Reaktion wird Veresterung genannt. Sie entspricht einer nukleophilen Addition[2]. Veresterungen laufen nicht einfach durch, solange bis kein Ausgangsstoff vorliegt (wie z.B. es bei einer Verbrennung der Fall wäre). Es findet auch eine Rückreaktion der Produkte zu den Ausgangsstoffen statt. Nach einiger Zeit stellt sich also innerhalb des Reaktionsgemisches ein chemisches Gleichgewicht ein, und es liegen alle vier Stoffe gleichzeitig vor. Da Seife durch Hydrolyse von Fettsäure-Glycerinestern hergestellt wird, spricht man bei der Rückreaktion der Veresterung auch von „Verseifung“ bzw. Verseifungsreaktion.
Benannt werden Ester
[Bearbeiten]a) entweder korrekt nach den beiden Komponenten und der funktionellen Gruppe: Ethylethanoat
b) nach dem Prinzip „Rest des Alkohols“ mit -yl (also hier Ethyl) + Grundkörper der Säure (= Ethan) und der Endung „oat“ gebildet.
c) manchmal auch durch Trivialnamen, die sich in der Regel aus den Trivialnamen der Salze der Säuren ableiten: Methylacetat (=Essigsäuremethylester), Ethylbutyrat (=Buttersäureethylester) u.a.
Seife wird durch Kochen von Fetten mit Laugen hersgestellt. Die Hydroxid-Ionen der Lauge neutralisieren die Wasserstoff-Ionen der Fettsäuren und verschieben so das Gleichgewicht stark in Richtung Hydrolyse, so daß die Esterspaltung fast vollständig verläuft.
Verseifung
[Bearbeiten]- R1-COO-R2 + H2O + NaOH → R1-COO-Na+ + R2-OH
Eigenschaften & Verwendung
[Bearbeiten]- Carbonsäureester zeigen nur eine geringe Polarität (durch die beiden Sauerstoffatome). Sie lösen sich demzufolge nur minimal in Wasser, was auf der Ausbildung von Wasserstoffbrücken-Bindungen zwischen dem Lösungsmittel Wasser und dem herausragenden, freien Sauerstoffatom beruht.
- Je länger die Kohlenstoffketten werden, desto geringer ist die Wasserlöslichkeit, da die Wirkung des polaren Sauerstoffs im Verhältnis zu den unpolaren Kohlenstoffketten immer kleiner wird. Zum Vergleich: In 1 l Wasser lösen sich 250 g Essigsäuremethylester, nur noch 80 g Essigsäureethylester und weniger als 1 g Essigsäurebutylester. Alle längerkettigen Ester sind also hydrophob.
- In Wasser reagieren sie neutral.
- Ihre Siedepunkte liegen im Vergleich zu Alkoholen bzw. Carbonsäuren gleicher Kettenlänge durch nur geringe Ausbildung von Wasserstoffbrücken-Bindungen wesentlich niedriger.
- Die Ester der kurzkettigen Carbonsäuren (C1 bis C5) sind stark flüchtig und haben einen angenehmen, fruchtigen Geruch. Man findet Ester als Aromastoffe in der ganzen Natur, unter anderem auch in reifen Früchten (Fruchtester)[3].
- Ester finden vielfältige Verwendung in der Lebensmittelindustrie (u. a. als Aromastoffe in Fastfood, Limonaden, Weingummi, Bonbons).
- Ester werden auch als Lösungsmittel verwendet, z. B. in Farben und Lacken.
- Wachse sind Ester aus langkettigen Säuren (z. B. Palmitinsäure) und langkettigen Alkoholen (>26 C-Atome). So besteht Bienenwachs hauptsächlich aus Estern des Myrcylalkohols (C30H61OH).
- Fette und fette Öle sind Mehrfachester langkettiger Carbonsäuren mit Glycerin.
- Andere Mehrfachester sind zum Beispiel die als Bestandteile der Zellmembran vorkommenden, aus Glycerin gebildeten Phosphoglyceride.
- Seifen sind Alkalisalze höherer Fettsäuren. Ihre wässrigen Lösungen haben durch das gleichzeitige Vorliegen eines polaren Endes (Carbonsäure-Anion) und eines unpolaren Endes (lange Kohlenwasserstoffkette) eine waschaktive Wirkung. Solche Stoffe werden auch Tenside genannt.
- Lactone sind cyclische Ester mit nur einem Ausgangsmolekül, welches beide an der Esterbildung beteiligten funktionellen Gruppen zugleich enthält, die Säuregruppe und die Alkoholgruppe.
- Aus Dicarbonsäuren und Mehrfachalkoholen lassen sich lange Ester-Kettenmoleküle darstellen: Polyester. Der bekannteste Polyester ist der Kunststoff PET (PolyEthylenTerephtalat).
- Auch Zellulose, welche ja aus Glucosemolekülen aufgebaut ist und sehr viele Hydroxylgruppen trägt, kann mit Essigsäure verestert werden. Celluloseacetat findet u. a. Verwendung als Textilfaser ("Acetatseide"). Das Polymergerüst wird hier aber, anders als bei den Polyestern, nicht durch die Veresterung gebildet, es liegt schon beim Ausgangsmaterial Zellulose vor.
- Ein anderer Celluloseester ist Cellulosenitrat (RCO-NO2), das vor der Entwicklung der modernen Kunststoffe von großer Bedeutung war, z. B. als Bestandteil des Zelluloids (für photographische Filme, Brillengestelle etc.). Auch heute findet es noch Verwendung, z. B. für Tischtennisbälle oder hochwertige Füllhalter.
- Man verwendet Ester in Weichmachern für Kunststoffe wie PVC. (Geruch nach neuem Auto!)
- Medizinische Verwendung: Ethylnitrit (CH3-CH2-O-N=O) wirkt harntreibend und fiebersenkend, Amylnitrit ((CH3)2CHCH2CH2-O-N=O) wirkt krampflösend bei Asthma und bei epileptischen Anfällen.
- Verwendung einiger Phosphorsäureester als Insektizid (z.B. Parathion (C10H14NO5PS) und Dichlorvos (C4H7Cl2O4P).
- Einige Ester werden auch als militärische Kampfstoffe verwendet. Tabun (Dimethylphosphoramidocyansäureethylester, C5H11N2O2P2), Soman (Methylphosphonofluoric acid, C7H16FO2P), Sarin (Methylfluorphosphonsäureisopropylester, CH3P(O)(F)OCH(CH3)2)
- Glycerintrinitrat (O2NO-H2C-CH(ONO2)-CH2-ONO2), auch bekannt als Nitroglyzerin, wird als Sprengstoff verwendet.
- Im Saft von Wolfsmilchgewächsen sind Phorbolester enthalten. Sie lösen neben ausgeprägten Hautverätzungen und starken Magenbeschwerden auch bösartige Tumore aus, da sie das Enzym Proteinkinase C stimuliert, welches das Wachstumsverhalten von Krebszellen modifiziert.
Zusatzinformationen:
- Eine weitere (technisch bedeutende) Reaktion ist die Umesterung. Hierbei wird bei einem Ester der Alkoholrest durch einen anderen ausgetauscht. So wird z. B. Rapsöl mit Methanol umgeestert, so dass aus einem Fettsäure-Glycerinester-Molekül mit drei langkettigen Fettsäuren drei Moleküle Fettsäure-Methylester erzeugt werden: Biodiesel
- Ester
Beispiele für Veresterungen
[Bearbeiten]Einfache Ester
[Bearbeiten]| + |
→ 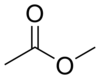 |
+
| |
 |
+ |
→  |
+
|
| + |
→  |
+
|
Komplexe Ester: Fette und Öle
[Bearbeiten]Komplexe Ester: Polyester:
[Bearbeiten]
- ↑ es gibt auch Ester von anorganischen Säuren (z.B. Phosphorsäure, Borsäure).
- ↑ zuerst greift der Alkohol an das partial positive Kohlenstoffatom der Carboxylgruppe an.
- ↑ Beispiele: Ethansäure-2-butylester (CH3COOC4H9) riecht nach Apfel, Ethansäure-2-methyl-1-propylester (CH3COOCOOC3H7) riecht nach Banane, Ethansäure-2-hexylester (CH3COOC6H13) riecht nach Erdbeere.