Sonographie: Herz
Zurück zu Sonographie

Echokardiographie
Echokardiografie Allgemein
[Bearbeiten]Echokardiografie nennt man die Untersuchung des Herzens mittels Ultraschall. Neben dem EKG ist die Echokardiografie eine der wichtigsten technischen nichtinvasiven Untersuchungsmethoden des Herzens und mittlerweile unverzichtbarer Bestandteil der kardiologischen Diagnostik.
TEE und TTE
[Bearbeiten]Um das Herz zu erreichen gibt es mehrere Möglichkeiten:
- Der "normale" Weg ist der Ultraschall von außen durch die Brustwand (Transthorakale Echokardiografie, kurz TTE). Mit dem Kurzwort "Echo" ist in der Regel die transthorakale Echokardiografie gemeint.
- Seltener notwendig und aufwendiger ist der Ultraschall von der Speiseröhre aus (Transösophageale Echokardiografie, kurz TEE genannt). Hierzu muss der Patient einen Schlauch mit der Ultraschallsonde schlucken, daher auch der Kurzname "Schluckecho". Diese Methode liefert eine bessere Darstellung einiger Abschnitte des Herzens. So werden die kleinen Thromben im linken Herzohr besser gesehen, die man von außen (transthorakal) nicht erkennen kann.
- Eine weitere selten angewendete Methode ist der IVUS, der intravaskuläre Ultraschall.
Methoden der Echokardiografie
[Bearbeiten]- 2-D Bild
- Mit dem 2-D Bild kann man in Echtzeit mittels eines schwarzweißen Schnittbilds direkt der Herzaktion zuschauen.
- Insbesondere die Größe der Herzkammern, die Klappenfunktion und die Pumpfunktion des Herzens sind dabei gut erkennbar
- M-Mode = Motion Mode
- Aus dem 2-D Bild wird ein bestimmter Ultraschallstrahl ausgewählt. Dieses lineare Ultraschallsignal wird in seiner Veränderung in der Zeitachse aufgezeichnet.
- Die genaue Klappenfunktion der einzelnen Klappen und eine Querschnitt durch die linke Herzkammer kann man mit dem M-Mode sehr genau aufzeichnen und vermessen. Auch ist die Herzfrequenz und einzelne Zeitintervalle der Herzaktion im M-Mode erfasst.
- Die TAPSE und die MAPSE lassen sich mit dem M-Mode gut messen.
- PW-Doppler = Pulsed-wave Doppler
- Mit dem Doppler wird die Blutstromgeschwindigkeit erfasst. Der PW Doppler erlaubt dabei eine hohe örtliche Auflösung, ist aber je nach Eindringtiefe auf Geschwindigkeiten unter 2 m /sek begrenzt.
- CW-Doppler = Continuous Wave Doppler
- Auch mit dem CW-Doppler wird die Blutstromgeschwindigkeit erfasst. Im Gegensatz zum pW Doppler erfasst der CW Doppler die Geschwindigkeit des Blutes auf der Länge des ganzen Schallstrahles und erlaubt dabei die Erfassung von beschleunigten Flüssen bis 6 oder 7 m /sek . Dies hat Vorteile bei der quantitativen Beurteilung von Klappenstenosen oder Klappeninsuffizienzen.
- Farbdoppler
- Der Farbdoppler ist so etwas wie ein flächenhafter Doppler. Die Blutstromgeschwindigkeit in einer größeren Fläche wird erfasst und dann in ein Farbsignal umgesetzt. Die Farben können in der Regel an den Ultraschallgeräten frei festgelegt werden. Als Standard hat sich jedoch eingebürgert, dass der Fluss auf den Ultraschallkopf zu als rot definiert wird und vom Ultraschallkopf weg blau ist. Die Helligkeit der Farben definiert die Geschwindigkeit: hell = schneller Blutfluss, dunkel = langsamer Blutfluss. Auch ein turbulenter verrauschter Fluss ist im Farbsignal erkennbar. Dieser muss aber unbedingt vom "Aliaseffekt" (oder auch Aliasing genannt) unterschieden werden. Dabei wird die maximal messbare Geschwindigkeit überschritten und der eine Farbton verändert sich schlagartig in die andere Farbe. Es erscheint dabei in einer Farbströmung (z. B. Rot) paradoxerweise die Farbe der entgegengesetzten Blutflussrichtung (z. B. Blau).
- Gewebedoppler TDI
- Der Gewebedoppler nutzt die Reflexion der Schallwellen am Myokard bei gleichzeitiger Unterdrückung der Signale aus dem Blutstrom.
- Der TDI wird meist zur Beurteilung der diastolischen Eigenschaften sowie der Füllungsdrücke des linken Ventrikels genutzt.
- Am rechten Ventrikel kann man mit dem TDI einen TAPSE ähnlichen Parameter, die TASV (tricuspid annular systolic velocity ) messen
- Stressechokardiografie
- Das Herz wird im Ultraschall unter Belastung untersucht. Regionale Wandbewegungsstörungen der linken Herzkammer werden aufgezeichnet, was Rückschlüsse auf die Koronardurchblutung erlaubt.
- Kontrastmittelechokardiografie
- Durch die Einspritzung von Kontrastmittel lassen sind Löcher in der Herzscheidewand besser erkennen. Auch die Durchblutung des Herzmuskels und die regionale Wandbewegung können durch Kontrastmittel besser erfasst werden.
- IVUS = Intravaskulärer/ intravasalen Ultraschalluntersuchung (bei der PTA wird zusätzlich eine kleine Ultraschallsonde in das Gefäß eingeführt mit der die Wandveränderung gemessen werden kann)
- ICE = Intrakardiale Echokardiographie

Vorteile der Echokardiografie
[Bearbeiten]Die Echokardiografie erlaubt innerhalb kürzester Zeit eine nichtinvasive, patientenschonende eingehende Untersuchung des Herzens. Die Größe der einzelnen Herzkammern, die Pumpfunktion und die Funktion der einzelnen Herzklappen sind gut erkennbar. Auch Herzfehler können recht schnell und sicher erkannt werden. Mit der Echokardiografie lassen sich Herzfehler eines Kindes bereits im Mutterleib erfassen.
Mittels Echokardiografie nicht erkennbar
[Bearbeiten]Die entscheidende Lücke der Echokardiografie ist die Beurteilung der Kranzgefäße. Diese sind gar nicht oder nur indirekt durch eventuelle Wandbewegungsstörungen einschätzbar. Es gibt Ansätze die Kranzgefässe im TTE zu erkennen, die Untersuchung ist aber ziemlich fehlerträchtig und zeitaufwendig. Das Stressecho bietet eine ganz gute Möglichkeit die koronare Durchblutung mittels Echo zu beurteilen. Mittels TEE kann man zumindest die Abgänge der linken und rechten Kranzarterie ganz gut erkennen und kann eine Beurteilung bezüglich Abgangsstenose abgeben. Der Ivus ist ein Ansatz zur sonografischen Untersuchung der Kranzgefässe. Er hat sich bis jetzt aber kaum durchgesetzt, da er zu teuer ist.
Indikation zur Echokardiografie
[Bearbeiten]Die Indikation zur Echokardiografie kann sehr großzügig gestellt werden, da die Untersuchung gefahrlos ist und eine hohe Aussagekraft besitzt.
- Luftnot
- Angina pectoris
- andere Symptome mit Verdacht auf kardiale Ursache
- Beurteilung eines bekannten oder vermuteten angeborenen Herzfehlers.
- Patienten mit Herzgeräusch
- Patienten mit hypertensiver Herzerkrankung
- Patienten mit Herzrhythmusstörungen unklarer Ursache
- Patienten mit Klappenprothesen
- Verdacht auf infektiöser Endokarditis
- Verdacht auf kardialen Tumor oder Thrombus
- Verdacht auf Perikarderguß, Perikarditis, Pericarditis constrictiva.
- Bekanntes oder vermutetes Marfan-Syndrom
- Aorta, Aortenwurzel, Aortenklappe und Mitralklappe.
- Verdacht auf Kardiomyopathie
- Verlaufskontrollen bei Herzpatienten
- Verdacht auf Lungenembolie
- Suche einer kardialen Emboliequelle beim Schlaganfall
- Beurteilung der kardialen OP-Fähigkeit
Echoschnittebenen
[Bearbeiten]Folgende Schnittebenen haben sich im transthorakalen Echo bewährt:
- Subcostaler Blick
- Apikaler Blick
- Parasternaler Blick
- Suprasternaler Blick vom Jugulum aus ( keine Routineschnittebene )
Alle Varianten und Zwischenstellungen sind erlaubt. Entscheidend ist die Bildqualität und die richtige Interpretation.
Subcostalschnitt in Rückenlage
[Bearbeiten]
Dieser Schnitt wird routinemäßig von manchen Echolaboren nicht gemacht. Dies ist eigentlich schade, denn der Subcostalblick bietet eine Untersuchung des Herzens unbeeinträchtigt von Rippen und Lunge. Man muss allerdings mit dem Schnitt experimentieren, den Patienten ein- und ausatmen lassen, ordentlich mit dem Schallkopf drücken und möglichst bei leerem Magen untersuchen. Dann wird man viel Freude an diesem Ableitungspunkt haben. Auch für die Perikardpunktion unter Echosicht ist die epigastrische Region meist gut geeignet. Was sieht man gut ?
- Breite der Vena cava und Lebervenen
- Rückstrom in die Lebervenen bei schwerer TI
- Größe der Vorhöfe
- Größe des rechten Herzens
- Shunt auf Vorhofebene
- Perikardspalt, Perikarderguß
- Dicke der Wand des rechten Herzens
- Trikuspidalklappe
- Pulmonalklappe und Pulmonalarterie
- Pleuraergüsse
Man sollte die Rückenlage des Patienten immer nutzen, um zumindest orientierend rechts und links einen Pleuraerguß nachzuweisen oder auszuschliessen.
Herzspitze
[Bearbeiten]
Vierkammerblick
[Bearbeiten]Was sieht man gut ?
- Linker Ventrikel und seine Funktion
- diese wird im 4 Kammerblick meist etwas zu gut eingeschätzt.
- Mitralklappe
- Klappensklerose
- Mitralstenose
- Mitralinsuffizienz im Doppler
- Papillarapparat
- Gewebsdoppler TVI im Septum oder der Seitenwand zur Abschätzung von E Strich und mehr
- Vorhofgröße im Seitenvergleich
- Ventrikelgröße im Rechts-Linksvergleich
- Trikuspidalklappe
- Insuffizienz im Farbdoppler mit Abschätzung des Regurgitationsvolumens
- Insuffizienz im CW Doppler mit Anschätzung des systolischen RV und Pulmonalisdruckes an Hand der Refluxgeschwindigkeit.
- Endokarditis der Trikuspidalklappe
- TAPSE mit Abschätzung der RV Funktion.
Abb.:4-Kammerblick , etwas ungewohnt auf dem Kopf stehend, anatomisch aber richtig.


Apikaler Längsschnitt RAO Schnitt (Dreikammerblick)
[Bearbeiten]Die Bezeichnung RAO stammt aus dem Röntgen. RAO ist der Rechtsschräge Durchmesser des Thorax. Der in der Echokardiographie entsprechende Schnitt wird häufig auch als "Dreikammerblick" bezeichnet. Da das Herz schräg nach links im Thorax liegt, bekommt man im Rechtsschrägen Durchmesser eine ideale Seitansicht des Herzens. Man kann das resultierende Bild mit einem Fuß im Seitblick vergleichen:
- Die Ferse ist der linke Vorhof
- Die Fußssohle ist die Hinterwand
- die Fußspitze ist die LV Spitze
- der Rist ist die Vorderwand
Was sieht man gut ?
- Linker Ventrikel und seine Funktion
- Bessere Einschätzung der EF und regionalen Wandbewegung als im 4 K Blick
- Mitralklappe
- Klappensklerose
- Mitralstenose
- Mitralinsuffizienz im Doppler
- Aortenklappe
- Aorteninsuffizienz im Doppler
- Aortenklappenstenose im Doppler
- HOCM im Doppler
- Papillarapparat
Zweikammerblick
[Bearbeiten]Was sieht man gut ?
- Linker Ventrikel und seine Funktion
- Mitralklappe
- den linken Vorhof
5 Kammerblick
[Bearbeiten]Ähnelt dem 3 Kammerblick, nur sieht man noch Teile des RV Ausserdem wird der 3 K Blick meist seitenverkehrt aufgenommen Der 5 Kammerblick wird meistens aus dem 4 Kammerblick entwickelt.
Parasternaler Blick
[Bearbeiten]Längsschnitt
[Bearbeiten]Was sieht man gut ?
- Aortenklappe
- Aortenklappe im M-Mode
- Aortenwurzel
- Linker Vorhof Breite
- Mitralklappe
- Mitralklappe im M-Mode
- Linker Ventrikel
- im M-Mode zur Vermessung der diastolischen und systolischen Wanddicken und LV-Durchmesser
- Beurteilung der Hinterwand und Vorderwandbeweglichkeit 2D und M-Mode

Querschnitt Höhe Aorta
[Bearbeiten]Was sieht man gut ?
- Aortenklappe
- Aortenklappe im M-Mode
- LVOT der links ventrikuläre Ausflusstrakt
- Linker Vorhof
- Pulmonalklappe 2D, m-Mode und Doppler
Querschnitt Höhe Mitralklappe
[Bearbeiten]Was sieht man gut ?
- Mitralklappe
- Mitralklappe im M-Mode
Querschnitt Höhe LV
[Bearbeiten]Was sieht man gut ?
- Linker Ventrikel quer
- Wanddicke und Kontraktion des LV
- Papillarmuskeln
Vermessung des LV
[Bearbeiten]Die Vermessung des Linken Ventrikels im Querschnitt oder Längsschnitt liefert wichtige Werte zur Beurteilung der Größe und Funktion des LV.
Die wichtigsten Meßwerte sind:
- diastolische Septumdicke IVS = IVSd
- Enddiastolischer Durchmesser EDD = LVIDd
- diastolische Hinterwanddicke HW = LVPWd
- Endsystolischer Durchmesser ESV = LVIDs
Aus diesen Werten errechnet sich dann das Fractional Shortening FS% , die Verkürzungsfraktion und ein Schätzwert für die EF = Ejektionsfraktion der linken Herzkammer.
Die Ableitung des M-Modes fällt vielen Anfängern schwer und muß ziemlich lange geübt werden , bis brauchbare Meßwerte erzielt werden.
Abb:Querschnitt durch den LV im m-Mode. Der diastolische und systolische Durchmesser, sowie die Wanddicken können gemessen werden.

Vermessung des LVOT
[Bearbeiten]Bei der Vermessung des linksventrikulären Ausflußtraktes LVOT gibt es immer wieder Schwierigkeiten. Am besten misst man ihn parasternal in der langen Achse Verbesserung der Messung
- Verwendung des Zooms
- gemessen wird von der Innenseite der Wand zur anderen Innenseite der Wand
- gemessen wird mitsystolisch
- gemessen wird parallel zur Aortenklappe
- gemessen wird knapp an der Aortenklappe in ca. 1 mm Abstand
Manche messen an der Stelle, an der die PW-Messung im Ausflußtrakt vorgenommen wurde. Das ergibt dann erhebliche Mess- und Rechenfehler, weil der Lvot Durchmesser im Quadrat in die Berechnungen eingeht. Die Messung wird vor allem durch Septale Hypertrophie und HOCMs ungenau.
4.Aortenbogen
[Bearbeiten]
Was sieht man ?
- Aortenbogen
- Abgänge der Supraaortalen Arterien
- Aortenisthmus
Normalbefund im Echo
[Bearbeiten]Linker Vorhof normal groß Linker Ventrikel normal groß, normal kontraktil Keine regionale Wandbewegungsstörung Normale Auswurffraktion des LV EF = 65 % Keine Linksventrikuläre Hypertrophie Keine diastolische Dysfunktion Rechter Vorhof normal groß Rechter Ventrikel normal groß Tapse = 18 mm d.h normale rechtsventrikuläre Auswurffraktion. Cava inferior und Lebervenen nicht verbreitert Keine Perikarderguß, bds kein Pleuraerguß Keine Klappensklerose Aortenklappe öffnet normal, kein Rückfluß an der Klappe Mitralklappe öffnet normal, kein Rückfluß an der Klappe Trikuspidalklappe öffnet normal, kein Rückfluß an der Klappe Pulmonalklappe öffnet normal, kein Rückfluß an der Klappe Normfrequenter regelmäßiger Sinusrhythmus
Wenn man sich die Befundung erleichtern will, dann übernimmt man diesen Text als Kürzel in Ihre Textverarbeitung. In Word mit Alt + F3 in den Autotext. Geben Sie ihm Beispielsweise den Namen echo. Dann können Sie mit echo F3 sich daß nächste Mal das eintippen des Normalbefundes sparen.
Abspeichern des Autotextes von Word im Normal.dot
Befund TEE
[Bearbeiten]Sedierung mit mg Propofol. Problemloses Einführen des Gerätes in den Ösophagus Linker Vorhof normal groß, Linker Vorhof vergrößert mit Spontanechos Linkes Herzohr frei typische kräftige Vorhofflimmerwellen im Herzohr kein Thrombus im Herzohr kein ASD , kein offenes Foramen ovale Linker Ventrikel normal groß, normal kontraktil Rechter Vorhof normal groß Rechter Ventrikel normal groß Keine Perikarderguß Aortenklappe öffnet normal, kein Rückfluß an der Klappe Mitralklappe öffnet normal, geringer Rückfluß an der Klappe Trikuspidalklappe öffnet normal, kein Rückfluß an der Klappe Pulmonalklappe öffnet normal, kein Rückfluß an der Klappe Aorta : keine wandständigen Plaques, keine Aneurysma, keine Dissektion Tachyarrhythmie bei Vorhofflimmern Normfrequenter Sinusrhythmus
Empfehlung: Elektrische Kardioversion , Antikoagulation, Enge Puls- und Rhythmuskontrollen
Meßwerte im Echo
[Bearbeiten]Normalwerte beim Erwachsenen
[Bearbeiten]Aorta --------------------------------------- Aortenklappenseparation 1,5 - 2,6 cm Aortenwurzeldurchmesser 2,0 - 3,7 cm Aorta ascendens < 4 cm Aortenbogen < 3 cm Aorta descendens < 2 cm --------------------------------------- Rechtes Herz --------------------------------------- Rechter Vorhof 2,8 - 4,0 cm RA planimetrisch < 20 cm^2
Rechter Ventrikel enddiast 0,9 - 2,6 cm Rechter Ventrikel endsyst 1,5 - 2,2 cm RV-Wanddicke < 8 mm TAPSE > 20 mm ---------------------------------------- LA ---------------------------------------- Linker Vorhof 2,0 - 4,0 cm LA planimetrisch < 20 cm^2 ---------------------------------------- Linker Ventrikel --------------------------------------- Linker Ventrikel enddiast 3,7 - 5,6 cm Linker Ventrikel endsyst 2,0 - 4,0 cm EF ( Auswurffraktion ) > 60 % ---------------------------------------- Wanddicken ---------------------------------------- LV Hinterwand diastolisch 0,6 - 1,0 cm LV Septum diastolisch 0,6 - 1,0 cm ---------------------------------------- Mitralklappe ---------------------------------------- ES-Abstand 0,2 - 1,2 cm (E-Welle Vorderes Mitralsegel zum Septum ) Mitralklappe: DE-Amplitude 1,8 - 2,8 cm Mitralklappe: EF-Slope 70 - 150 mm /sek ---------------------------------------- Dopplergeschwindigkeiten ---------------------------------------- Aortenklappe 1,35 (1,0 - 1,7) m/s Mitralklappe 0,90 (0,6 - 1,3) m/s Pulmonalklappe 0,75 (0,6 - 0,9) m/s Trikuspidalklappe 0,50 (0,3 - 0,7) m/s
Links
[Bearbeiten]Normalwerte LV Füllung , Diastole
[Bearbeiten]E (cm/s) Frühdiastolische max. Geschw. PW-Doppler 72 ± 14 cm / s A (cm/s) Spätdiastolische max. Geschw. PW-Doppler 40 ± 10 cm / s E / A max Verhältnis E zu A PW-Doppler 1,9 ± 0,6 A – Dauer (ms) Dauer der spätdiastol. Füllung PW-Doppler DT (ms) Dezelerationszeit der E-Welle 180 ± 20 ms IVRT (ms) Isovolumetrische Relaxationszeit 70 ms VP (cm/s) Frühdiast.Propagationsgeschw. Farb-M-Modus > 55 ms
Asynchronieparameter
[Bearbeiten]Die Messung der Asynchronieparameter dient dazu, die Selektion der Patienten für die biventrikulären Stimulation zu verbessern. Neben dem Hauptkriterium QRS-Verbreiterung über 130–150 ms im EKG sind weitere Parameter im Echo zur Quantifizierung der Asynchronie herausgearbeitet worden. Schnell zu erheben und praktisch bewährt haben sich vor allem drei Echoparameter:
- septal-posteriore Kontraktionsverzögerung im M-Mode des Linken Ventrikels SPWMD
- rechts- und linksventrikuläre Präejektionsintervalle
- diastolische transmitrale Füllungszeit
Asynchronie und Desychronisation sind bedeutungsgleich ( synonym) .
Übersicht
[Bearbeiten]- M-Mode
- septal-posteriore Kontraktionsverzögerung berechnet in Millisekunden
- (engl. «septal-posterior wall motion delay» SPWMD)
- septal-posteriore Kontraktionsverzögerung berechnet in Millisekunden
- Doppler-Echo:
- Aortal – pulmonale prä-Ejektionszeit
- interventrikulären Asynchronie
- (engl. «interventricular mechanical delay» IVMD)
- Mitrale Füllungszeit
- Aortales VTI (Schlagvolumen)
- LV dP/dt mittels CW-Doppler
- Aortal – pulmonale prä-Ejektionszeit
- 2D/3D Echo:
- Endokardiale Wandbewegungsanalyse mittels 2D / 3D Echo
- Gewebedoppler (TDI):
- Regionale myokardiale Geschwindigkeiten
- Strain rate imaging
Rechts-Links-Asynchronie
[Bearbeiten]PET = Präejektionszeit
Gemessen werden die Präejektionszeiten links und rechts als das Zeitintervall zwischen dem
- Beginn der elektrischen Aktivierung (Beginn des QRS-Komplexes)
- und dem Beginn des Dopplerflusses an der Pulmonalklappe-(RV-PET) und
- dem Beginn des Dopplerflusses an der Aortenklappe (LV-PET).
Typischerweise finden sich bei Vorliegen eines Linksschenkelblocks Werte rechts um 100 ms (RV-PET) und links 150 ms (LV-PET). Von einem signifikanten interventrikulären Asynchronie (IVMD) spricht man bei einer Differenz DPET (LV-PET – RV-PET) von über 40 ms.
Beispiel:
gemessen PET Aortenklappe 188 , 172 und 193 ms >> 186 ms im Durchschnitt gemessen PET Pulmonalklappe 134 , 144, 150 ms >> 143 ms im Durchschnitt ------------------------ Delta Ao- Pu = 186 ms - 143 ms = 43 ms
Literatur
[Bearbeiten]- Wasted septal work in left ventricular dyssynchrony:
- a novel principle to predict response to cardiac resynchronization therapy
- European Heart Journal Cardiovascular Imaging, Oxford University Press
- J. Vecera, M. Penicka, [...], and O.A. Smiseth
- Interessanter Artikel über eine neue echokardiografische Messmethode, die es erlaubt, den Erfolg einer Resynchronisationstherapie vorherzusagen.
- European Heart Journal Cardiovascular Imaging, Oxford University Press
- a novel principle to predict response to cardiac resynchronization therapy
Links
[Bearbeiten]- http://www.cardiovascular-medicine.ch/pdf/2005/2005-12/2005-12-015.pdf
- Echokardiographie bei kardialer Resynchronisationstherapie
- http://www.dgk.org/cme/downloads/28%5Cgoetze.PDF
- Kardiale Resynchronisation bei Herzinsuffizienz, Ausführliche Übersichtsarbeit
- http://www.echobasics.de/asynchronie.html
- Asynchroniemessung gut erklärt
RV im Echo
[Bearbeiten]Abschätzung der Funktion des rechten Ventrikels und einer pulmonalen Hypertonie
- Grösse des RV in verschiedenen Ebenen insbesondere von subcostal
- Rechtsventrikuläre Durchmesser in der parasternalen, langen Achse
- Grösse des RA, planimetrisch und volumetrisch bezogen auf den RV oder die KÖF
- Ventrikelseptum Dicke, Beweglichkeit
- paradoxe Septumbewegung parasternal lange und kurze Achse sowie in den Kammerblicken
- LV-EI (LV-Exzentrizitätsindex)
- Trikuspidalklappe
- Farbdoppler über der Trikuspidalklappe
- cw-Doppler über der Trikuspidalklappe
- Abschätzung des systolischen Pulmonalisdruckes an Hand der maximalen Flussgeschwindigkeit der Trikuspidalinsuffizienz
- sPAP durch TI
- TAPSE im 4- (5-) Kammerblick und/ oder von subcostal mit dem M- Mode gemessen
- TAPSE (tricuspid annular plane systolic excursion) > 17 mm
- TAPSE * 3 = Rechts EF
- TASV (tricuspid annular systolic velocity) < 15 cm/s
- mittels TDI gemessen
- Pulmonalklappe
- Akkzelerationszeit über der Pulmonalklappe
- Schweregrad der PI
- PHT der PI
- Tei-Index des rechten Ventrikels
- Tei-Index (myocardial performance index) > 0,50
- Cava inferior und Lebervenen
- Durchmesser und Atemmodulation der VCI
- Vorhofseptum
- Pleuraergüsse
- Perikard
- systolischer Strain > 25%
Links
[Bearbeiten]Literatur
[Bearbeiten]Rudski LG, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography. J Am Soc Echocardiogr. 2010 Jul;23(7):700.
TAPSE
[Bearbeiten]Die TAPSE (tricuspid annular plane systolic excursion) ist ein einfach zu messender Parameter zur Beurteilung der rechtsventrikulären Funktion. Es wird im 4 Kammerblick die Vorwärtsbewegung ( nach apikal ) des Trikuspidalringes im M-Mode gemessen. Wenn man sich auf die systolische Bewegung des Trikuspidalringes in Richtung Herzspitze konzentriert, kann man aus dem 2 D Bild heraus die Tapse auch ohne Messung schon recht gut abschätzen.
Normalwert > 17 mm
Die TAPSE erlaubt die schnelle Abschätzung der rechtsventrikulären EF
Tapse * 3 = RV-EF
Was ist die Tapse ?
TAPSE = tricuspidal annular plane systolic excursion
- systolische Auslenkung der Trikuspidalklappenebene in Richtung Herzspitze.
- Distanz der Bewegung des Trikuspidalringes von der Enddiastole und Endsystole
Der TAPSE - Score ist erniedrigt bei:
- Hinterwandinfarkt (inferiorer Ischämie)
- Septuminfarkt
- pulmonaler Hypertonie
- Stenose der Pulmonalklappe
Literatur
[Bearbeiten]Tapse Erstbeschreibung
[Bearbeiten]- Kaul et al von 1984 (Kaul et al. Assessment of right ventricular function using two-dimensional echocardiography. Am Heart J 107:526, 1984).
Links
[Bearbeiten]- http://eurheartj.oxfordjournals.org/content/ehj/33/19/2451.full.pdf
- Leitlinien der Behandlung der Lungenembolie der Europ.Kardiologischen Gesellschaft (2012).
- http://www.students.informatik.uni-luebeck.de/zhb/ediss876.pdf
- Doktorarbeit TAPSE - Evaluierung eines neuen echokardiographischen Parameters
- Universität zu Lübeck Sonja Muthorst aus Ahrensburg Lübeck 2010
- Doktorarbeit TAPSE - Evaluierung eines neuen echokardiographischen Parameters
- http://www.echobasics.de/TAPSE.jpg
- Bild mit stark reduzierter TAPSE
TASV (tricuspid annular systolic velocity)
[Bearbeiten]Die TASV (tricuspid annular systolic velocity ist der TAPSE sehr ähnlich und misst die maximale systolische Geschwindigkeit des Trikuspidalringes im Gewebsdoppler.
Normalwert: > 15 cm/sek
Schlagvolumen und Cardiac Output im Echo
[Bearbeiten]Das Schlagvolumen und das Herzzeitvolumen kann im Echo relativ leicht aus den Flußkurven an der Aortenklappe oder der Pulmonalklappe und der Breite der jeweiligen Ausflußbahn abgeschätzt werden .
- siehe z. B. http://www.kup.at/journals/summary/5724.html
Doppler
[Bearbeiten]Dopplerechokardiografisch berechnet sich das Schlagvolumen (SV) als Produkt aus
- der effektiven systolischen Aortenklappenöffnungsfläche (AVAeff) und
- dem Integral der systolischen Flussgeschwindigkeit (Time velocity integral, TVI = VTI ).
SV = AVAeff * TVIao
Genaue Berechnung
[Bearbeiten]SV = Pi * LVOT/2 * LVOT/2 * VTI (LVOT ) CO = SV * HR / 1000
Eingaben
[Bearbeiten]- LVOT Left ventricular outflow tract diameter (mm) Breite des Ausflußtraktes in mm
- VTI1 LVOT subvalvular velocity time integral (cm) Geschwindigkeitszeitintegral im LVOT
- HR Heart rate (bpm) Herzfrequenz
Berechnete Werte
[Bearbeiten]- SV Stroke Volume (mL)
- CO Cardiac Output (L/min)
Referenzwerte
[Bearbeiten]- Schlagvolumen SV in Milliliter ml
- Normal 60-120 ml
- Cardiac Output = Herzmiutenvolumen = CO (Liter/min)
- Normal 4-8 Liter/ min
Formel
[Bearbeiten]SV=π * (LVOT/2)^2 * LVOT VTI CO=SV * HR / 1000
Quelle
[Bearbeiten]Huntsman LL, et al. Noninvasive Doppler determination of cardiac output in man-clinical validation. Circulation 1983; 106:1057-1065.
Am besten gibt man die Messwerte in den Onlinerechner ein:
Einschränkungen
[Bearbeiten]- Aortenklappenstenose
- Gravierende Aortenklappeninsuffizienz
- HOCM
3D 4D Echo
[Bearbeiten]LV 4D Aufnahme
[Bearbeiten]Im folgenden wird die LV 4D beim Vivid E95 beschrieben:
- EKG anschließen und auf stabile EKGableitung achten
- 4 Kammerblick mit senkrechtem Septum im 2 D schön einstellen
- evt Virtual Apextaste drücken: Apex wird breiter dargestellt
- Durchführung 4 D Aufnahme :
- Multi D Taste drücken
- Bildtaste Gross oder Mittel wählen
- Bildrate zb 4 Zyklen wählen
- 4 Zyklen aufnehmen und abspeichern
Strain Rate Imaging
[Bearbeiten]Übersicht
[Bearbeiten]Neue Darstellung der Myokardbewegung mit der Echokardiographie
- Tissue Doppler = Gewebsdoppler= TDI = Tissue Doppler Imaging
- Speckle tracking
Alter Darstellung der Myokardbewegung
- M-Mode
- Manuelle 2 D Bildanalyse in verschiedenen Phasen zb Systole, Diastole
- der LV wird in verschiedenen Ebenen und Herzphasen ummalt
Gute Internetseite dazu , siehe
Definitionen
[Bearbeiten]Strain
[Bearbeiten]Strain ist ein englisches Wort mit der Bedeutung
- Dehnung
- Zerrung , auch Muskelzerrung
- Belastung
- Anspannung
In der Echokardiografie versteht man darunter die Änderung einer bestimmten Faserlänge des Herzmuskels bezogen auf die Ausgangslänge
- Negativer Strain: Verkürzung , in roter Farbe dargestellt, systolisch
- Positiver Strain: Dehnung, in blauer Farbe dargestellt.
- Null Strain: keine Bewegung, in grüner Farbe dargestellt
Zahlenwerte: Negative Werte bedeuten eine Kontraktion und -20 ist beispielsweise normal.
Automatisierte EF Berechnung
[Bearbeiten]Vorbemerkung
[Bearbeiten]Die EF = Ejektionsfraktion ist ein sehr wichtiger Wert in der Kardiologie, der aber physiologisch schwankt und beim Messen einer erheblichen Meßungenauigkeit unterliegt. Meist wird zunächst von der linksventrikulären EF gesprochen, die ein Maß für die Pumpfunktion der linken Herzkammer ist. Es gibt aber auch eine Rechts EF, die einfach über die Tapse abzuschätzen ist und natürlich auch ein EF des linken und rechten Vorhofes.
EF = Ejektionsfraktion = Auswurffraktion EF = SV / EDV * 100 %
Normalwerte der Links EF
[Bearbeiten]60-75 % normal 45–60 % leichtgradig eingeschränkt 30–45 % mittelgradig eingeschränkt < 30 % hochgradig eingeschränkt > 75 % erhöhte EF zb bei Fieber, Hyperthyreose, körperlicher Anstrengung, Stressecho, Katecholamineinfluß
- Semi-automated-quantification-of-left-ventricular-volumes-and-ejection-fraction-by-real-time-three-1476-7120-7-18-S1.ogv
Automatische EF Bestimmung im Echo
[Bearbeiten]Im folgenden wird die Auto-EF-Messung beim Vivid E95 beschrieben:
- EKG anschließen und auf stabile EKGableitung achten
- Bildaufbaurate auf > 40 BPS ( Bilder pro Sekunde) einstellen
- einen schönen LV Zyklus speichern ( 4 Kammer- und/oder 2 Kammerblick )
- Durchführung der Messung:
- Aufrufen der Bildschleife aus dem Speicher ( Taste Trackball drücken - Mauszeiger erscheint )
- Taste Messung Auto EF drücken
- Auswahl 4 CH oder 2 CH vornehmen , (rechts am Monitor )
- Endokardgrenzlinie wird vom Gerät automatisch eingezeichnet
- Korrektur der Linie durch Anklicken, Festhalten und Verrutschen der Linienpunkte mit dem Trackball
- Trackball 4 Sekunden nicht bewegen
- berechnetes Ergebnis erscheint automatisch
Falls gewünscht die Messung im 2 CH auch durchführen, dann erscheint als Ergebnis die biplane EF.
Ultraschallanatomie des Herzens
[Bearbeiten]Herzhöhlen
[Bearbeiten]Linker Vorhof
[Bearbeiten]Größe des linken Vorhofes
[Bearbeiten]- Was ist besser bei der Bewertung der Vorhofgröße
- der Querdurchmesser im parasternalen Längsschnitt ?
- die planimetrierte Fläche im 4Kammerblick ?
Wahrscheinlich ist die planimetrierte Fläche aussagekräftiger, weil damit auch die länglich vergrößerten Vorhöfe erfasst werden. Normalwert Vorhoffläche:
- normal <20 cm^2
- leicht vergrößert 20 - 30 cm^2
- mittelgradig 30 - 40
- stark vergrößert > 40 cm^2
mit der aus Gewicht und Größe bestimmten Körperoberfläche kann man den Vorhofgrößenindex berechnen, wenn die Vorhoffläche durch die KO teilt.
Linkes Herzohr
[Bearbeiten]
Das linke Herzohr sieht man im TTE fast nie. Es liegt im 4 Kammerblick in Höhe der Mitralklappe an der Lateralwand des linken Vorhofes und zieht kommaförmig an der Mitralklappe vorbei nach apikal. Die beste und einfachste sonografische Darstellung des LAA gelingt im multiplanen TEE. Man stellt einen 40 - 80 Grad Winkel ein. Konzentriert sich auf den linken Vorhof. An der Lateralwand findet man das linke Herzohr. Meist ist es kommaförmig etwas gebogen und zieht an der CX und der Mitralklappe vorbei nach apikal . Typische Messwerte:
- Eingangsbreich Breite 2 - 2,5 cm
- Landingzone Breite 1,8 - 2,5 cm
- Länge 2 - 3 cm
Man erkennt oft Trabekel im LAA und oft eine Umschlagsfalte des Perikards als laterale Wand des LAA. Parallel zum LAA läuft etwas weiter dorsal die linke Pulmonalvene. Im LAA kann man sehr leicht einen pW Doppler und einen Farbdoppler ableiten, um einen Sinusrhyhthmus, Vorhofflimmern oder Vorhofflattern nachzuweisen. Ein Thrombus im LAA ist eher selten und meist gut erkennbar.
Lungenvenen Pulmonalvenen
[Bearbeiten]Es gibt davon meist 4, die im Normalfall im linken Vorhof münden. Sie lassen sich mit Mühe im 4 Kammerblick des TTE darstellen. Am besten sieht man sie im TEE, wenn man den linken Vorhof darstellt. Die linke Pulmonalvene sieht man am besten im 60 Grad Blick, parallel und dorsal des linken Herzohres verlaufend. Die rechte Pulmonalvene sieht man am besten im bicavalen Blick des rechten Vorhofes ( 90 Grad) . Meist erkennt man die rechte Pulmonalvene im Farbdoppler als typischen roten Zufluss zum LA besser als im 2 D Bild. Die Pulmonalvenen sind zur Durchführung einer PVI wichtig. Ausserdem kann man im Doppler der Pulmonalvene den Schweregrad einer Mitralinsuffizienz beurteilen. Dazu misst man den systolischen und diastolischen Zufluss aus der Pulmonalvene in den LA und zeichnet ihn als Dopplerkurve auf. Bei höhergradiger MItralinsuffizienz findet man einen systolischen Reflux in die Pulmonalvene. Normal ist ein systolischer Zufluss.
Zeichen der Normalen Vorhoffunktion
[Bearbeiten]- EKG
- stabiler SR im EKG und Langzeit EKG
- keine oder wenige Vorhofextraschläge
- im EKG normal große p Welle
- nicht zu klein
- nicht zu groß ( z. B. p pulmonale )
- nicht zu lang
- Echo
- normal groß
- (parasternal < 40 mm)
- (subcostal < 50 mm)
- planimetrisch < 20 cm^2
- normal groß
- normal große A-Welle
- intrakardiales EKG
- P-Wellen Sensing > 3 bei Männern
- P-Wellen Sensing > 2 bei Frauen
- normale Sinusknotenerholungszeit
- Frequenzanstieg
- normaler Frequenzanstieg bei Belastung
- normaler Frequenzanstieg auf Atropin
- normaler Frequenzanstieg auf Alupent
- normaler Frequenzabfall auf Betablocker , Isoptin oder Dilzem
Linke Kammer
[Bearbeiten]
2 Kammer Blick
[Bearbeiten]Welche Wände sieht man im 2 Kammerblick ?
- in der Nähe der Mitralklappe sieht man die inferiore Wand .
- siehe z. B. mit einem Hinterwandinfarkt im 2 Kammerblick
Rechter Vorhof
[Bearbeiten]Der rechte Vorhof ist im TTE meist leicht erkennbar im apikalen 4Kammerblick und von epigastrisch. Auch im Schrägschnitt zwischen dem apikalen und parasternalen Ableitpunkt sieht man ihn recht gut. Im TEE ist er ganz gut im Transversalschnitt erkennbar.
Differenzierte Strukturen des rechten Vorhofs sind schwieriger erkennbar:
- Mündung untere Hohlvene
- Eustachische Klappe
- Rete Chiari
- Christa terminalis
- Mündung des Koronarsinus
- Vorhofseptum
- Trikuspidalklappe
- Mündung der oberen Hohlvene
- rechtes Herzohr
Messwerte
[Bearbeiten]- planimetrierte Fläche
- Trikuspidalinsuffizienz
- maximale Flussgeschwindigkeit der Trikuspidalinsuffizien und erechneter Druckgradient über der Klappe
- TAPSE
Links
[Bearbeiten]- http://www.kup.at/kup/images/browser/63.jpg
- vergrösserter Rechter Vorhof im 4-Kammerblick
- http://www.kup.at/kup/pdf/5076.pdf
- echokardiografische Pathologie des rechten Vorhofes
- http://radiology.rsna.org/powerpoint/247/3/658/F12
- schöne CT Bilder der Eustachischen Klappe
Rechte Kammer
[Bearbeiten]Stichworte
[Bearbeiten]- Größe im Vergleich zum LV
- Wanddicke von Subxyphoidal
- Abschätzung der RV-EF = TAPSE * 3,2
- Paradoxe Septumbewegung im parasternalen Querschnitt
- TI
- Delta P Max an der Trikuspidalklappe
- Moderatorband
Klappen
[Bearbeiten]Aortenklappe
[Bearbeiten]
Die Aortenklappe liegt in der Aortawurzel am Ende der Ausflußbahn der linken Herzkammer. Sie verhindert den diastolischen Rückfluss des Blutes aus der Aorta in die linke Herzkammer.
Die Aortenklappe besteht meist aus drei halbmondförmigen Taschen. (Trikuspide Klappe)
- Valvula semilunaris dextra (rechte halbmondförmige Tasche)
- Valvula semilunaris sinistra (linke halbmondförmige Tasche)
- Valvula semilunaris septalis (zur Herzkammerscheidewand gelegene halbmondförmige Tasche)
Als Variante kann auch eine Klappe mit nur 2 Taschen vorliegen (Bikuspide Klappe)
Die Aortenklappe läßt sich im Echokardiogramm meistens sehr gut beurteilen. Dazu wählt man den parasternalen Zugang im Längs- oder Querschnitt, den apikalen RAO Schnitt oder den subcostalen Blick. Bei transthorakal unzureichender Beurteilbarkeit kann man auch im TEE die Aortenklappe sehr gut untersuchen. Parasternal kann man die Klappe meist gut im M-Mode darstellen und man kann die 3 Taschen der Klappe oft gut erkennen. Im apikalen RAO Schnitt sieht man den Fluß durch die Klappe am besten und kann eine Aortenstenose oder Aortenklappeninsuffizienz gut erkennen.
Wie immer wird die Klappe zunächst im 2D-Bild untersucht. Dann folgt die Dokumentation der Klappenöffnung im M-Mode. Schließlich wird im Doppler der systolische Fluß durch die Klappe ausgemessen. Ein diastolischer Reflux läßt sich so auch leicht erkennen.
Typische Fragestellungen:
[Bearbeiten]- Aortenstenose + Schweregrad
- Aorteninsuffizienz + Schweregrad
- Aortenklappensklerose
- Aortenklappenendokarditis
Links
[Bearbeiten]- http://www.kup.at/kup/images/browser/3908.jpg
- M-Mode der Aortenklappe
- http://edoc.hu-berlin.de/habilitationen/bauer-matthias-dirk-2005-04-18/HTML/front.html
- Bikuspide Aortenklappe und Dilatation der Aorta ascendens
- http://www.aerztlichepraxis.de/img/art/1_1_1159350273.jpg
- Verkalkte Aortenklappe
Mitralklappe
[Bearbeiten]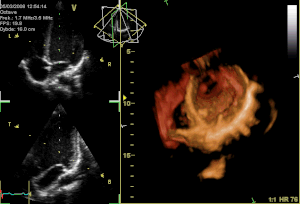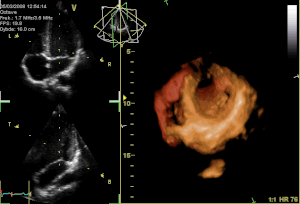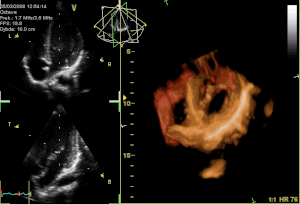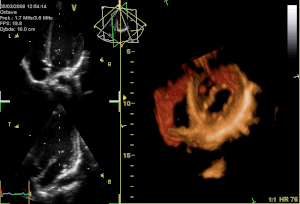
Ein alphanumerischer Code wird zur Identifizierung der Mitralklappenabschnitte benutzt: Die Buchstaben P und A beziehen sich auf das posteriore und anteriore Segel.
- P hinteres Segel
- P1 lateraler Anteil
- P2 mittlerer Anteil
- P3 medialer Anteil
- A vorderes Segel
- A1 lateraler Anteil
- A2 mittlerer Anteil
- A3 medialer Anteil
Trikuspidalklappe
[Bearbeiten]Pulmonalklappe
[Bearbeiten]Schichten
[Bearbeiten]Perikardbeutel
[Bearbeiten]Epikard
[Bearbeiten]Myokard
[Bearbeiten]Endokard
[Bearbeiten]Vorhofscheidewand
[Bearbeiten]Kammerscheidewand ( Septum )
[Bearbeiten]Koronararterien
[Bearbeiten]Beispiel eines IVUS Bildes siehe http://www.koronargefaesse.de/Untersuchung/IVUS%20Rahmen.jpg Die Koronararterien werden routinemässig bisher sonografisch nicht dargestellt, da sie mit den vorhandenen Ultraschallgeräten nur schwer, unvollständig oder gar nicht zu sehen sind. Trotzdem gibt es bestimmte Abschnitte der Koronarien, die sonografisch gut zu erfassen sind. So ist der Hauptstamm der linken Kranzarterie im TEE knapp oberhalb der Aortenklappe gut zu sehen. Er kann dann auch für bestimmte Fragestellungen beispielsweise bei einer Abgangsstenose gut beurteilt werden.
Koronarvenen Sinus coronarius Koronarvenensinus
[Bearbeiten]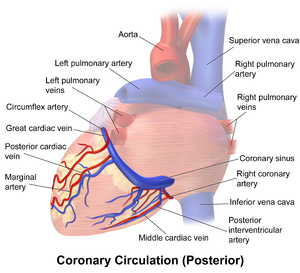
Der Sinus coronarius läßt sich mit folgenden Methoden untersuchen.
- Transthorakale Echokardiografie
- TEE
- direkte Phlebografie während der Rechtsherzkatheteruntersuchung.
- indirekte Phlebografie als Spätaufnahme nach der Koronarangiografie
- im CT
- im Kernspin
Vor allem durch die Implantation von 3 Kammerschrittmachern und die EPU ist die genaue Anatomie des CS wichtig geworden.
Darstellung des CS im TTE
[Bearbeiten]Der Koronarsinus läßt sich ziemlich leicht im 4 Kammerblick dorsal der Mitralklappe als echoarmer Streifen darstellen. Er kommt aus dem rechten Vorhof und zwar aus der Ecke zwischen septalem Trikuspidalsegel und klappennahem Vorhofseptum. Von dort läuft er quer über die Mitralklappe in der Klappenebene und verdämmert an der Aussenwand des LV im Bereich der CX und des LAA. Steckt eine Elektrode eines 3 Kammerschrittmachers im Coronarsinus kann man diese gut bis zur Lateralwand des LV verfolgen.
Darstellung des CS im TEE
[Bearbeiten]Auch hier ist die Darstellung im 4 Kammerblick oder bei 50 Grad dorsal der Mitralklappe am einfachsten. Wenn man weiß, wo im TEE die CX ist, kann man den Koronarsinus von dort ziemlich leicht bis zum RA verfolgen. Die genaue Darstellung des Abganges im RA ist dann schwieriger. Man suche in der Ecke zwischem septalen Trikuspidalsegel und klappennahem Vorhofseptum.
Nachbarstrukturen
[Bearbeiten]Cava inferior, Lebervenen
[Bearbeiten]Eustachische Klappe
Cava superior
[Bearbeiten]Die Cava superior = obere Hohlvene läuft rechts neben der Brustwirbelsäule von den Schlüsselbeinen bis zum rechten Vorhof. In ihr wird das venöse Blut aus der oberen Körperhälfte gesammelt. Sie läßt sich sonografisch im TTE und TEE nur in ihren oberen und unteren Abschnitten darstellen. Von oben findet man die Cava, wenn man den Schallkopf am Hals entlang nach unten bewegt und die Vena jugularis rechts verfolgt. Dann erkennt man meist recht gut die Einmündung der Vena subclavia von rechts und den dann gemeinsamen Verlauf als Cava superior. Parasternal rechts oder links kann man die Cava schlecht darstellen. Das Sternum oder Lunge ist meist im Weg. Von kaudal sieht man die Cava superior zumindest im Farbdoppler ein stückweit. Um sie besser von den anderen Gefässen zu trennen, die in den rechten Vorhof münden, dreht man das Ultraschallbild am besten auf den Kopf und erhält eine Darstellung des Herzrns, die sehr einer Röntgen Thorax Aufnahme ap ähnelt. Probieren Sie es aus, es funktioniert erstaunlich gut. Auch die Pulmonalarterie sieht man dann anatomisch richtig. Eine persistierende obere Hohlvene links mündet meist über den Coronarsinus in den rechten Vorhof. Sonografisch erkennt man dies im 4 Kammer blick als sehr breiten Cotonarsinus dorsal der Mitralklappe.
Aorta ascendens
[Bearbeiten]Aorten bogen
[Bearbeiten]Aorta descendens
[Bearbeiten]Pleura
[Bearbeiten]TEE
[Bearbeiten]
TEE = Transösophageale Echokardiografie = Schluckecho
TEE Kurzanleitung
[Bearbeiten]Der Patient muß nüchtern sein und im Bett gebracht werden.
Patienten vorbereiten:
- Dem Patienten einen Beißschutz verpassen
- Ihn nach rechts oder links drehen und etwas Moltex unterlegen
Prämedikation : sichere, etwas unangenehme Methode:
- ausgiebig Xylocain Rachenspray
- keine ode nur sehr wenig iv Sedative sind verzichtbar
angenehme, aber etwas aufwendigere Methode: Iv Sedierung
- (Gefahr: Atemstillstand, Aspiration):
- Midazolam 3 - 10 mg als Bolus und weiter fraktioniert
- alternativ Propofol am Anfang z. B. 30 bis 50 mg iv und weiter nach Wirkunf fraktioniert
- Xylocain Rachenspray ist verzichtbar
US Gerät einstellen:
- Sondenwahl TEE
Das Gerät einführen
- am besten mit Zeige- und Mittelfinger der linken Hand die Zunge etwas runterdrücken
- zwischen den Fingern das Gerät einführen und dabei zum Schlucken auffordern (wenn wach)
- vorschieben bis in den Magen (ca. 40 - 50 cm)
- nicht an der Rachenhinterwand mit dem Gerät herumstochern, das löst Würgereize aus.
Bei der Untersuchung Zeit lassen und dabei anschauen (inkl. Farbe):
- LA , Herzohr , Pulmonalvenen
- MiV , AoV , LV , LVOT
- PuV , PA , RA , RV , RVOT , VCsup , VCinf
- Vorhofseptum
- Aorta asc , Aortenbogen , Aorta desc
Nach Gebrauch das Gerät in die Endoskopie zur Wiederaufbereitung
TEE Kontrastmittel
[Bearbeiten]Leider gibt es Echovist nicht mehr. Es war ein nicht lungengängiges Echokontrastmittel. So muß man sicht mit einer selbst gemixten Rezeptur behlfen:
- 10 ml Glucose 20%
- 1 ml Luft dazu
- Luft über einen Dreiwegehahn und eine zweite leere 10 ml Spritze verwirbeln.
- mehrfach von einer Spritze in die andere hin und her Spritzen
- schnell injizieren, wenn die Luftbläschen genügend fein gemischt erscheinen.
Projektionen TEE
[Bearbeiten]Gradeinstellungen bei einer multiplanen Sonde im Ösophagus
0 Grad Vier Kammer Blick, Kontraktilität LV + RV, Größe RV in Relation zum LV, Mitralklappe, Trikuspidalklappe,
Pulmonalstamm, Pulmonalklappe, Aortenbogen, Aorta descendens
40 Grad Aortenklappe
75 Grad RV, RVOT, Mitralklappe, Trikuspidalklappe, Pulmonalklappe, Vorhofseptum
90 Grad LV, linkes Herzohr, Pulmonalvenen, Vorhofseptum
90 Grad Aortenbogen, Aorta descendens, Cava superior, Cava inferior, rechtes Herzohr
120 Grad LV, LVOT, Aortenklappe, Mitralklappe, Aorta ascendens
Gradeinstellungen bei einer multiplanen Sonde im Magen
0 Grad LV, LVOT, Aortenklappenfluss 70 Grad RV, RVOT, Pulmonalklappe 90 Grad LV 100 Grad LVOT, Aortenklappe 130 Grad Trikuspidalklappe
Fragestellung der TEE
[Bearbeiten]- Herzfehler
- infektiöse Endokarditis
- Abszesse
- Segelperforationen
- Lungenvenenfluss
- offenes Foramen ovale, Schirmverschluss
- Thromben im LA (linkes Atrium) und LAA (linkes Vorhofohr)
- Lungenvenenanomalien
- Aorta thoracica: Thromben, Aneurysma, Dissektion, Ruptur
- Aortenstents
- kardiale mediastinale Tumoren
- Artefakte im TTE (transthorakale Echokardiografie)
- Graduierung und Morphologie der Mitralinsuffizienz
- Frühzeitige Ischämiediagnostik einzelner Wandabschnitte
- Feststellung des Füllungszustandes der Herzkammern
- Diagnostik von Shuntvitien
- Möglichkeit der Messung des Herzzeitvolumens
- Überprüfung der Funktion künstlicher Herzklappen
Befundungskürzel TEE
[Bearbeiten]Sedierung mit 70 mg Propofol, problemlose Einführung des Gerätes Linker Vorhof normal groß Linker Vorhof vergrößert mit Spontanechos Linkes Herzohr frei typische kräftige Vorhofflimmerwellen im Herzohr Linker Ventrikel normal groß, normal kontraktil Rechter Vorhof normal groß Rechter Ventrikel normal groß Keine Perikarderguß kein ASD , kein offenes Foramen ovale Aortenklappe öffnet normal, kein Rückfluß an der Klappe Mitralklappe öffnet normal, geringer Rückfluß an der Klappe Trikuspidalklappe öffnet normal, kein Rückfluß an der Klappe Pulmonalklappe öffnet normal, kein Rückfluß an der Klappe Aorta : keine wandständige Plaques, kein Aneurysma, keine Dissektion Tachyarrhythmie bei Vorhofflimmern Normfrequenter Vorhofrhythmus, Sinusrhythmus
Typischer Befund bei Brady-Tachysyndrom
[Bearbeiten]- Sonographie TEE vom
- Sedierung mit 60 mg Propofol, problemlose Einführung des Gerätes
- Linker Vorhof nur gering vergrößert
- Spontanechos
- Linkes Herzohr frei
- typische Vorhofflimmerwellen,
- reduzierte Flußgeschwindigkeit
- Vorhoffrequenz ca 350 / min d.h eher Vorhofflimmern als Vorhofflattern
- Linker Ventrikel normal groß, noch ausreichend kontraktil
- Rechter Vorhof normal groß Rechter Ventrikel normal groß Keine Perikarderguß
- kein ASD , kein offenes Foramen ovale
- Aortenklappe öffnet normal, kein Rückfluß an der Klappe
- Mitralklappe öffnet normal, leichter Rückfluß an der Klappe
- Trikuspidalklappe öffnet normal, leichter Rückfluß an der Klappe
- Pulmonalklappe öffnet normal, kein Rückfluß an der Klappe
- Aorta : keine wandständige Plaques, kein Aneurysma, keine Dissektion
- Vorhofflimmern mit teilweiser Bradykardie bis 32 / min
- Diagnose:
- Brady-Tachysyndrom bei Vorhofflimmern
- Mechanisch wenig aktiver linker Vorhof
- Kein Thrombus im LAA , allerdings ausgeprägte Spontanechos
- Empfehlung
- DDD Schrittmacher Implantation
- Elektrische Kardioversion
- Lebenslange Antikoagulation
- Isthmusablation und PVI planen
Mögliche Komplikationen der TEE
[Bearbeiten]Insgesamt sind Komplikationen bei der TEE selten.
- Bei der Rachenbetäubung muß man nach der Untersuchung solange nüchtern bleiben, bis die örtliche Betäubung abgeklungen ist (ca. 20-30min) (sonst Aspirationsgefahr).
- Nach der Beruhigungsspritze darf man frühestens nach 24 Stunden wieder selbst Auto fahren.
Durch die Untersuchung selbst können folgende Komplikationen auftreten:
- Verletzungen der Speiseröhre und des Kehlkopfs
- Herzrhythmusstörungen;
- Atemstörungen, vor allem nach Sedierung
- Herz-Kreislauf-Störungen;
- Gebissschäden, besonders bei lockeren Zähnen;
- Überempfindlichkeitsreaktionen auf die örtliche Betäubung oder die intravenösen Medikamente.

Fragen
[Bearbeiten]Wie kann man das Gerät am besten einführen ?
[Bearbeiten]- Beißring
- Sedierung
- mit dem Zeige- und Mittelfinger der linken Hand den Zungengrund ertasten und nach unten drücken
- Gerät in den Mund einführen
- Mit dem Zeigefinger das Gerät nach unten drücken und in den Rachen schieben
- Kopf auf die Brust
- Gerät am Kehlkopf vorbei in die Speiseröhre schieben
- Sanfte Gewalt , keine massive Gewalt !!
Wie findet man am besten die rechte Pulmonalvene ?
[Bearbeiten]Man stellt circa 120 Grad und eine bicavale Schnittebene ein. Aus dem linken Vorhof findet man dann am besten mit dem Farbdoppler den roten systolischen und diastolischen Einstrom aus der Pulmonalvene in den LA. Der pw Doppler wird etwa 1 cm vor der Einmündung in der Pulmonalvene abgeleitet.
Literatur
[Bearbeiten]- M. H. Hust: Transösophageale Echo- und Dopplerechokardiografie, 2000, ecomed, ISBN 3-609-62592-9
Links TEE
[Bearbeiten]- http://www.echobasics.de/tee.html
- TEE Anlotungen ausführlich beschrieben
- http://www.ct2tee.agh.edu.pl/#sv
- TEE Online Simulator
Thrombemboliequelle Herz
[Bearbeiten]
linkes Herzohr
[Bearbeiten]Literatur
[Bearbeiten]- Veinot JP et al.: Anatomy of the normal left atrial appendage. Circulation
1997;96:3112-3115.
- Ernst G et al.: Morphology of the left atrial appendage. The Anatomical Record
1995:242;553-561.
Klappenvegetationen
[Bearbeiten]
Thrombus im LV
[Bearbeiten]Ein Thrombus im linken Ventrikel ist häufiger als man denkt und wird auch gerne einmal bei der Echokardiografie übersehen, wenn man sich die LV Spitze nicht genau anschaut oder sie bei schlechten Schallverhältnissen nicht so gut zu sehen ist. Meist liegt ein Aneurysma der LV Spitze vor, in dem sich dann der Thrombus bildet.
PFO und ASD
[Bearbeiten]Paradoxe Embolien durch ein offenes Foramen ovale oder einen ASD sind selten, müssen aber insbesondere bei jüngeren Patienten mit unklarem Apoplex oder peripherer arterieller Thrombolie akribisch mittels
- TEE
- Beinvenenultraschall
- Transthorakalem Echo
- Thorax und Abdomen CT
untersucht werden.
- siehe Fallbericht über einen Thrombus inflagranti
- Thrombus im offenen Foramen ovale
Stressecho
[Bearbeiten]Kurzanweisung
[Bearbeiten]Patientenvorbereitung
[Bearbeiten]- im Bett
- sämtliche Unterlagen mitbringen
- Aufklärung
- Venenverweilkanüle
- Anschließen an 12-Kanal EKG
- Blutdruckmeßgerät
- EKG vom Sonogerät anschließen
Sonstiges
[Bearbeiten]- Dobutamin 250 mg / 500 ml Nacl 0,9 %
- IVAC-Besteck
- IVAC-Pumpe
In Reichweite
[Bearbeiten]- Atropin iv
- Beloc iv
- Defi
Experten
[Bearbeiten]- Prof Hagendorf , Uni Leipzig
- veranstaltet auch Stressechokurse
Literatur
[Bearbeiten]Links
[Bearbeiten]Krankheitsbilder im Echo
[Bearbeiten]Das Hypertonieherz im Echo
[Bearbeiten]Typische Zeichen
- Hypertrophie des Linken Ventrikels
- Vergrößerter linker Vorhof
- Anfangs hohe A-Welle , dann zunehmend kleine A-Welle und schließlich Vorhofflimmern
Im EKG: SR --> SickSinusSyndrom --> Vorhofflimmern zusätzlich Linkshypertrophiezeichen manchmal Linksschenkelblock
Diastolische Dysfunktion
[Bearbeiten]Siehe Innere Medizin kk: diastolische Dysfunktion

Lungenembolie
[Bearbeiten]Typische Ultraschall Zeichen (manche nur bei Rechtsherzbelastung)
- Dilatation von rechtem Ventrikel und rechtem Vorhof
- prominentes "Moderator-Band"
- paradoxe Septumbewegung
- Trikuspidalklappeninsuffizienz
- erhöhter systolischer Druckgradient über der Trikuspidalklappe
- gestaute Lebervenen
- Hyperkontraktilität des linken Ventrikels
- Tachykardie
- Thrombose in den Bein-, Becken oder Armvenen
- Pleuritis, kleiner Pleuraerguß oder pleuranahes Infiltrat
Der Goldstandard der Lungenembolie ist das Thorax CT mit Kontrastmittel.
Im Labor hilfreich sind die Blutgasanalyse und die D-Dimere.
Der Vorderwandinfarkt
[Bearbeiten]
Der Hinterwandinfarkt
[Bearbeiten]Die dilatative Kardiomyopathie
[Bearbeiten]Kennzeichen:
- Großer kugeliger LV.
- Allseits wandverdünnt.
- Kaum mehr kontrahierend
- ES - Abstand stark vergrößert.
- EDD vergrößert
- EF reduziert


Aortenklappensklerose
[Bearbeiten]An der Aortenklappe können sich arteriosklerotische Ablagerungen bilden, die mit dem Alter zunehmen. Ab dem 60. Lebensjahr sind Veränderungen an der Aortenklappe eher die Regel als die Außnahme. Sie werden durch die üblichen Arterioskleroserisikofaktoren verstärkt. Zudem können morphologisch bereits veränderte Klappen einer vermehrten Arteriosklerose unterworfen sein.
Meist schreitet der Sklerosierungsprozeß vom Rand der Klappe zum Zentrum hin fort. Es besteht ein fließender Übergang von der Aortenklappensklerose zur erworbenen arteriosklerotischen Aortenstenose.
Die Aortenklappenstenose ist in der Regel im Echo leicht zu erfassen und auch im Schweregrad meist gut einschätzbar. Das Thema wird ausführlich im Inneren Medizin Wikibook abgehandelt.
Berechnung der Aortenklappenöffnungsfläche nach der Kontinuitätsgleichung
[Bearbeiten]- siehe http://www.uni-leipzig.de/~herz/echo/index.php?l=de&id=03_archiv/0608/loesung3
- siehe http://www.csecho.ca/cardiomath/?eqnHD=echo&eqnDisp=avavti
- Online Berechnung
Tabelle Schweregrad der Aortenstenose an hand der Aortenklappenöffnungsfläche
[Bearbeiten]Normal 3.0-4.0 cm2 leichtgradig > 1.5 cm2 mittelgradig 1.0-1.5 cm2 Schwer < 1.0 cm2
Beispiel eines männliches Normalbefundes der Aortenklappe 26 j Größe 175 cm schlank
[Bearbeiten]Klappengrundfläche 6,81 cm^2 Klappenöffnungsfläche 3,50 cm^2 Verhältnis Öffnung/Grundfläche 51 %
Fehlermöglichkeiten bei der Einschätzung des Schweregrades der Aortenstenose
[Bearbeiten]Schweregrad wird unterschätzt
[Bearbeiten]Man misst einen maximalen Gradienten über der Klappe von circa 30 mm Hg . Dabei ist die Auswurffraktion stark reduziert. Dann kann hier schon eine hochgradige Stenose vorliegen.
Schweregrad wird überschätzt
[Bearbeiten]- hochgradige AI , erzeugt ein Pendelvolumen und damit einen stark beschleunigten Fluß an der Klappe
- hyperkontraktiler LV: durch den hyperaktiven linken Ventrikel wird das Blut an der Klappe stark beschleunigt
das entscheidende Kriterium ist die Klappenöffnungsfläche
[Bearbeiten]Allerdings ist sie bei stark verkalkten Klappen nicht immer gut messbar Messung im TEE und im TTE
Aorteninsuffizienz AI
[Bearbeiten]siehe Aortenklappeninsuffizienz
Bei der Aortenklappeninsuffizienz ist die Aortenklappe undicht und es kommt zu einem diastolischem Rückfluß von Blut aus der Aorta in der Linken Ventrikel.
Leichte Formen der Aorteninsuffizienz findet man ziemlich häufig im Ultraschall des Herzens, meist auf dem Boden arteriosklerotisch oder narbig veränderter Klappensegel. Mittelgradige und schwere Formen sind in den letzten Jahren seltener geworden, da das rheumatische Fieber als Ursache meist sehr schnell behandelt wird und somit seltener Klappenprobleme bereiten kann. Außerdem werden mittelgradige und schwere Erkrankungen bald operiert.
Fragestellung
[Bearbeiten]Die Echokardiografie sollte eine Klärung folgender Fragen bringen
- Liegt eine solitäre Aorteninsuffizienz vor oder ist die Aorteninsuffizienz Folge einer anderen Erkrankung ( z. B. einer Aortendissektion, Marfan Syndrom, Mesaortitis luetica, Takayasu-Arteriitis ) ?
- Liegt eine Aortenklappenendokarditis als Ursache der Insuffizienz vor ?
- Liegt eine akute oder chronische AI vor ?
- Wie schwer ist die AI ?
- Muß die AI operiert werden ?
- Verlaufsbeurteilung einer bekannten AI ?
Anmerkungen
[Bearbeiten]Die Aorteninsuffizienz wird mittels Doppler diagnostiziert. Am schnellsten geht es mit dem Farbdoppler, die beste Ortsauflösung bietet der pW-Doppler.
Im 4 Kammerblick sieht man die AI als rot-gelben Jet, da der Fluß auf den Schallkopf zuströmt. Unterschieden werden muß der AI-Jet vom physiologischen diastolischen Einstrom durch die Mitralklappe. Die leichte Aorteninsuffizienz zeigt einen schmalen und kurzen Jet. Die schwere AI zeigt einen breiten und langen Jet. Bei der schweren AI kann man im im M-Mode einen vorzeitigen Mitralklappenschluß erkennen. Ist der Jet auf das vordere Mitralsegel gerichtet erkennt man Flatterwellen an demselben.
Erschwert wird die Untersuchung der AI durch eine Tachykardie, die das zeitliche Beobachtungsfenster für den Rückstrom stark verkürzt.
Auch wenn sich der Rückstrom im TEE oft nicht so gut darstellen läßt, kann man die Morphologie der Klappe im TEE oft perfekt beurteilen. Insofern ist die TEE noch einmal eine sehr hilfreiche Methode zur Beurteilung der AI.
Schweregradeinteilung
[Bearbeiten]Die Schweregradeinteilung der AI ist nicht so einfach und verläßlich wie die Einteilung der Aortenstenose. Trotzdem kann man in der Zusammenschau einiger Parameter eine brauchbare Aussage über den Schwergrad machen. Die meisten Untersucher verlassen sich dabei einfach auf die Größe der Farbwolke des Rückstroms in den LV. Weitere Parameter zeigt folgende Tabelle.
| leicht | mittel | schwer | |
|---|---|---|---|
| Reflux-Jet | auf Ausflußtrakt beschränkt | weiter als Ausflußtrakt | |
| V. contracta | < 3 mm | 3 - 7 mm | > 7 mm |
| V. contracta / LVOT | < 40 % | 40 - 60 % | > 60 % |
| PISA | < 1 cm2 | ≥ 1 cm2 | |
| LV-Durchmesser | normal | vergrößert (bei chron. AI) | |
| MK-Schluß | zeitgerecht (mit Ende P-Welle) | vorzeitig (bei akuter AI) | |
| PHT | > 500 ms | 200 - 500 ms | < 200 ms |
Links
[Bearbeiten]- http://www.herzzentrum.de/Media/PDF/MB_ARTIKEL/04-2007-Kongress.pdf
- Op-Indikation bei AI
Aortendissektion
[Bearbeiten]HOCM
[Bearbeiten]Aortenklappenendokarditis
[Bearbeiten]Die operative 30-Tage-Mortalität der akuten Aortenklappenendokarditis beträgt
insgesamt ca. 20 % bei nativer Aortenklappenendokarditis ca. 15 % bei Prothesenendokarditis ca. 30 %
Überlebensrate nach 17 Jahren ca. 70 - 80 %
Links
[Bearbeiten]- http://www.aerztlichepraxis.de/Fortbildung/Themen2007/Thema41/Images/bild3_aortenklappe.jpg
- Bild einer Aortenklappenendokarditis
- http://edoc.hu-berlin.de/dissertationen/klose-holger-2005-10-27/HTML/front.html
- Langzeitergebnisse nach homologem Aortenklappen- und Aortenwurzelersatz bei florider Aortenklappenendokarditis
Die operierte Aortenklappe
[Bearbeiten]Gründe für eine Aortenklappenoperation -------------------------------------- Klappenstenose 60 % Klappeninsuffizienz 24 % kombiniertes Klappenvitium 11 % akute Endokarditis ??
Mitralklappenstenose
[Bearbeiten]Mitralinsuffizienz
[Bearbeiten]Allgemeines
[Bearbeiten]
Während der Systole strömt Blut „rückwärts“ (Pfeil) durch die Mitralklappe vom linken Ventrikel in den linken Vorhof.
1 Mitralklappe
2 Linker Ventrikel
3 Linker Vorhof
4 Aorta
Mitralklappeninsuffizienz (auch Mitralinsuffizienz, Abk.: MI) ist in der Medizin die Bezeichnung für einen beim Menschen und zumindest einigen Tierarten häufigen Herzklappenfehler. Es handelt sich um eine Schlussunfähigkeit oder „Undichtigkeit“ der Mitralklappe des Herzens, die während der Auswurfphase (Systole) zu einem Rückfluss von Blut aus der linken Herzkammer in den linken Vorhof führt.
Leichte Formen der Mitralinsuffizienz werden bei Ultraschalluntersuchungen des Herzens recht häufig entdeckt und sind in der Regel harmlos. Schwere Formen erfordern eine genaue Abklärung, da unter bestimmten Voraussetzungen eine operative Behandlung sinnvoll ist.
Früher war die Mitralinsuffizienz meist Folge eines rheumatischen Fiebers, das jedoch in Folge der konsequenteren Behandlung von bakteriellen Infektionen außerhalb von Entwicklungsländern selten geworden ist. In den Industrieländern überwiegen heute als Ursachen die koronare Herzkrankheit, Kardiomyopathien und das Mitralklappenprolapssyndrom. Eine Mitralinsuffizienz kommt darüber hinaus als einzelner angeborener Herzfehler vor oder tritt häufiger in Begleitung anderer angeborener Herzfehler oder als Folge von anderen angeborenen Krankheiten des Bindegewebes auf.
Die akute schwere Mitralinsuffizienz als Komplikation eines Herzinfarktes oder einer Herzklappenentzündung ist ein seltenes, meist aber dramatisches Krankheitsbild, welches einer intensivmedizinischen Behandlung bedarf und häufig nur durch eine notfallmäßige Klappenoperation beherrschbar ist.
Epidemiologie
[Bearbeiten]Obgleich sie zu den am häufigsten diagnostizierten Klappenfehlern beim Menschen zählt, kann die Häufigkeit der Mitralinsuffizienz nur geschätzt werden. Es liegen nur wenige fundierte Statistiken auf der Basis größerer Studien an gesunden Menschen vor. Folgende Angaben erlauben aber eine Abschätzung der Größenordnung, mit der zu rechnen ist:
- 8,6 % herzgesunder türkischer Kinder im Alter von 0–18 Jahren zeigten echokardiografisch eine Mitralinsuffizienz.[1]
- Bei den rheumatischen Herzerkrankungen im Kindes- und Jugendalter in Entwicklungsländern ist die Mitralinsuffizienz die häufigste Schädigung des Herzens.[2]
- Eine prospektive Untersuchung in Großbritannien ermittelte bei Kindern und Jugendlichen im Alter von 3-18 Jahren eine Prävalenz von 1,82 %. Keines der erkrankten Kinder war jünger als 7 Jahre.[3] Andere Untersuchungen (USA) ermittelten eine Prävalenz von 2,4 % bei ansonsten herzgesunden Kindern und Jugendlichen im Alter von 0-14 Jahren[4]
- Fast ein Fünftel von insgesamt 3589 Personen, die im Rahmen der Framingham-Studie untersucht wurden, hatten eine Mitralinsuffizienz. Ein Unterschied zwischen den Geschlechtern bestand nicht: Bei 19 % der Männer und 19,1 % der Frauen zeigte sich echokardiografisch mindestens eine leichte Insuffizienz der Klappe.[5]
- Bei 11–59 % aller Patienten nach einem Herzinfarkt wurde in verschiedenen Studien eine Mitralinsuffizienz nachgewiesen.[6]
- Bei 89 % der über 70-jährigen Patienten mit einer Herzinsuffizienz (Ejektionsfraktion < 40 %) wurde eine Mitralinsuffizienz festgestellt, die bei 20 % ein bedeutsames Ausmaß erreichte (Schweregrad III oder IV).[7]
- Mit 31 % aller Herzklappenoperationen ist die Mitralinsuffizienz in Deutschland der am zweithäufigsten operierte Herzklappenfehler.
- Eine japanische Untersuchung an 211 gesunden Freiwilligen im Alter von 6-49 Jahren zeigte eine Prävalenz der Mitralinsuffizienz von 38-45% in jeder untersuchten Altersgruppe ohne Unterscheidung nach Schweregrad und physiologisch gegenüber krankhaft.[8]
Pathophysiologie
[Bearbeiten]
Die Farbwolke symbolisiert den Blutrückstrom
1 Linker Ventrikel – 2 Linker Vorhof
Die Mitralklappe funktioniert wie ein Ventil zwischen dem linken Vorhof und dem linken Ventrikel des Herzens. Sie öffnet sich in der Füllungsphase des Ventrikels (Diastole) und ermöglicht so den Einstrom von Blut aus dem Vorhof. Zu Beginn der Auswurfphase (Systole) führt der plötzlich ansteigende Druck im Ventrikel zum Schluss der Klappe und damit zur „Abdichtung“ des Vorhofs. Auf diese Weise herrscht im Vorhof nur ein Druck von etwa 8 mmHg, während gleichzeitig im Ventrikel der systolische Druck von etwa 120 mmHg das Blut auf seinem üblichen Weg in die Hauptschlagader (Aorta) treibt.
Bei einer leichten Mitralinsuffizienz sind diese physiologischen Vorgänge nur geringfügig verändert. Weder die Größe der Undichtigkeit (Regurgitationsöffnung) noch die Menge zurückströmenden Blutes (Regurgitationsvolumen) erreichen bedeutsame Ausmaße, so dass der Druck im linken Vorhof und in den Lungenvenen ebenso normal bleibt wie die Förderleistung des Herzens.

Die Farbwolke symbolisiert den Blutrückstrom
1 Linker Ventrikel – 2 Linker Vorhof – 3 Lungenvene
Bei der schweren Mitralinsuffizienz hingegen beträgt die Regurgitationsöffnung mehr als 40 mm2 und das Regurgitationsvolumen mehr als 60 ml, was zu schwerwiegenden und zum Teil lebensbedrohlichen Veränderungen führen kann.
Im akuten Stadium, bei normaler Größe von linkem Ventrikel und linkem Vorhof, kommt es zu einem erheblichen Anstieg des Drucks im Vorhof und damit auch in den Lungenvenen. Dieser kann bis zu 100 mmHg betragen, was bei einer normalen Beschaffenheit der Lungengefäße zum sofortigen Lungenödem führt. Darüber hinaus kann der dann überwiegende Blutrückstrom eine mangelhafte Auswurfleistung in die Aorta und damit eine Mangeldurchblutung aller Organe nach sich ziehen.
Ist das Akutstadium überstanden oder entwickelt sich die Mitralinsuffizienz über einen längeren Zeitraum, so kommt es chronisch zu einer Reihe von Anpassungsvorgängen (Kompensationsmechanismen) am Herzen und an den Lungengefäßen. Zunächst führt die anhaltende Druck- und Volumenbelastung des Vorhofes zu dessen Vergrößerung (Dilatation, Dilatatio cordis), wobei das Vorhofvolumen innerhalb von Monaten und Jahren oft auf das Drei- bis Vierfache zunehmen kann. Diese Dilatation mindert im Laufe der Zeit auch den drucksteigernden Effekt des Regurgitationsvolumens im Lungenkreislauf. Zusätzlich bewirkt die Volumenbelastung auch eine Vergrößerung des linken Ventrikels, der jetzt mit jedem Herzschlag zusätzlich zur eigentlich benötigten Blutmenge auch das Regurgitationsvolumen fördern muss. Diese Dilatation kann zwar einerseits über den Frank-Starling-Mechanismus auch das Schlagvolumen erhöhen, leitet aber andererseits in einen Teufelskreis, wenn mit der Erweiterung des Ventrikels auch die Geometrie der Mitralklappe gestört und deren Insuffizienz auf diesem Weg noch verstärkt wird.
Einteilung und Nomenklatur
[Bearbeiten]Die Klassifikation der Mitralinsuffizienzen wird aufgrund ständig neuer Überlegungen und Erkenntnisse nicht einheitlich vorgenommen, so dass die daraus abgeleitete Nomenklatur im Einzelfall missverständlich sein kann. Im letzten Jahrzehnt hat besonders die Unterscheidung zwischen funktioneller und organischer Mitralinsuffizienz an Bedeutung gewonnen.[9] Als organisch (oder valvulär) wird die Mitralinsuffizienz dann bezeichnet, wenn Veränderungen der Klappe selbst als Ursache identifiziert wurden. Eine funktionelle Insuffizienz hingegen ist Folge von Veränderungen der umgebenden Strukturen, hauptsächlich des linken Ventrikels.
Eine geringe Undichtigkeit der Mitralklappe, die keinen Krankheitswert hat, kann mit Hilfe empfindlicher Untersuchungsverfahren bei bis zu 90 % aller herzgesunden Erwachsenen festgestellt werden. Sie wird oft als physiologische Mitralinsuffizienz oder minimale Mitralregurgitation bezeichnet. Im Kindes- und Jugendalter wird die Unterscheidung durch den Zeitpunkt der Regurgitation (Rückstrom) getroffen: Die echte Mitralinsuffizienz wird als Rückstrom nach Klappenschluss angesehen, der Rückstrom während des Klappenschlusses als physiologisch. Problematisch bei dieser Einteilung ist, dass auch der Rückstrom während des Klappenschlusses der Mitralklappe Krankheitswert haben kann.
„Echte“ Mitralinsuffizienzen werden üblicherweise in Schweregrade eingeteilt, wobei heutzutage meist drei (leicht, mittelschwer und schwer), gelegentlich auch noch vier (Grad I bis Grad IV) Ausprägungen unterschieden werden.
Ursachen
[Bearbeiten]

1 Diastole: Beide Mitralsegel weit geöffnet
2 Frühe Systole: Beginnender Klappenschluss
3 Das posteriore Segel prolabiert in den linken Vorhof
4 Beginn der Klappenöffnung
Die angeborene Mitralinsuffizienz wie bei der Spaltung des vorderen Mitralsegels und die rheumatische Mitralinsuffizienz als Folge eines rheumatischen Fiebers sind in den Industrieländern mittlerweile selten, in Entwicklungsländern weiter häufig vorkommend. Im Vordergrund stehen heute
- die postinfarzielle Mitralinsuffizienz nach Herzinfarkt,
- die ischämische Mitralinsuffizienz auf Grund von Durchblutungsstörungen des Herzmuskels,
- die relative Mitralinsuffizienz als Folge einer Vergrößerung des linken Ventrikels und
- die Mitralinsuffizienz bei Prolapssyndrom im Zusammenhang mit einem meist angeborenen Mitralklappenprolaps.
Weiterhin können eine bakterielle und auch eine nicht-bakterielle Endokarditis zu einer Zerstörung oder narbigen Schrumpfung von Klappengewebe und so zu einer Mitralinsuffizienz führen. Ein weiterer Sonderfall ist das Auftreten infolge einer systolischen Ansaugung des der Herzscheidewand nahegelegenen (septalen) Mitralklappensegels aufgrund einer Kardiomyopathie-Sonderform (HOCM).
Die angeborene Mitralklappeninsuffizienz wird entweder isoliert als Folge einer Spaltung des vorderen (anterioren) Mitralsegels oder einer Fehlanlage (Dysplasie) der Mitralsegel oder häufiger als sogenanntes „komplexes Vitium“ im Zusammenhang mit anderen Herzfehlern wie einer Transposition der großen Arterien, einer korrigierten Transposition, einem double outlet right ventricle, Atriumseptumdefekt oder einem Ventrikelseptumdefekt beobachtet.[10] Akzessorische Sehnenfäden (Chordae tendinae) können zu einer Verlagerung der Mitralklappensegel in Richtung des Ventrikels führen und so eine Mitralinsuffizienz bedingen.
Eine Mitralinsuffizienz kommt auch als Folge von angeborenen Erkrankungen des Bindegewebes wie dem Marfan-Syndrom und dem Ehlers-Danlos-Syndrom vor.[11] Auch angeborene Stoffwechselerkrankungen (Morbus Hurler, Mucopolysaccharidose I) können zu einer Mitralinsuffizienz führen.[12]
Eine besondere Form der Mitralinsuffizienz hinsichtlich der Ursache wird durch kardiotoxische Medikamente bedingt. Der primäre Schaden am Herzen ist die Kardiomyopathie, beispielsweise durch Chemotherapie]] bei Krebserkrankungen unter Verwendung von Anthrazyklinen wie Doxorubicin oder Daunorubicin. Echokardiographisch ist die Mitralinsuffizienz oftmals als erstes Zeichen einer Myokardschädigung zu diagnostizieren: 11,6 % der mit Anthrazyklinen behandelten Kinder und Jugendlichen entwickeln eine Mitralinsuffizienz (nicht behandelte 1,8 %) ohne klinische Symptome. Alle Betroffenen hatten eine normale linksventrikuläre Funktion zum Untersuchungszeitpunkt: im Verlauf wiesen jedoch 4 von 34 Betroffenen eine manifeste Linksherzinsuffizienz auf (5-27 Monate nach Diagnose der Mitralinsuffizienz).[13] Auch mediastinale Bestrahlungen beispielsweise im Rahmen der Therapie eines Morbus Hodgkin können zur Mitralinsuffizienz führen.[14]
Krankheitsbild
[Bearbeiten]Symptome und klinische Zeichen
[Bearbeiten]Leichtere Formen werden vom Betroffenen nicht bemerkt. Die typischen Symptome der schweren Mitralinsuffizienz sind leichte Erschöpfbarkeit („Leistungsknick“) und Luftnot (Dyspnoe). Herzrhythmusstörungen, die bei der Mitralinsuffizienz häufiger auftreten, können sich in Form von Herzstolpern oder Herzrasen bemerkbar machen.
Der wichtigste und wegweisende Befund bei der körperlichen Untersuchung ist ein hochfrequentes bandförmiges systolisches Herzgeräusch, das meist über der Herzspitze am lautesten zu vernehmen ist und in die linke Achsel fortgeleitet wird. Daneben können gelegentlich bei linksventrikulärer Dilatation ein verlagerter Herzspitzenstoß, bei Lungenstauung pulmonale Rasselgeräusche und bei sekundärer Rechtsherzinsuffizienz eine Halsvenenstauung und Ödeme festgestellt werden.
Bei Kindern und Jugendlichen unterscheiden sich die Symptome der Mitralinsuffizienz nicht von den Symptomen im Erwachsenenalter. Die Symptome der Mitralinsuffizienz sind um so schwerwiegender und schneller auftretend, je jünger das Kind ist. Bei kleinen Kindern und Neugeborenen sind die Symptome Entwicklungsverzögerung bzw. Wachstumsstillstand hervorzuheben: Trotz ausreichender Nahrungsaufnahme steigt bei Kindern mit bedeutsamer Mitralinsuffizienz das Gewicht nicht an, auch die erwartete Größenzunahme bleibt aus. Des Weiteren sind häufige Infekte der unteren Luftwege (insbesondere linksseitige Lungenentzündung bzw. obstruktive Bronchitis) ein möglicher Hinweis auf eine Mitralinsuffizienz, da der linke Hauptbronchus durch den erweiterten linken Vorhof eingeengt und somit die Belüftung der linken Lunge reduziert wird. Ansonsten korreliert auch bei Kindern der Schweregrad der Mitralinsuffizienz mit dem Schweregrad der Symptomatik.
Technische Befunde
[Bearbeiten]Neben der körperlichen Untersuchung wird heute für die Beurteilung einer Mitralinsuffizienz in der Regel nur noch eine Ultraschalluntersuchung des Herzens benötigt, in Zweifelsfällen auch in Form der transösophagealen Echokardiografie („Schluckecho“, Abk. TEE). Weitere Untersuchungsverfahren sind nur in speziellen Fällen oder vor einer geplanten Operation zum Ausschluss von Begleiterkrankungen erforderlich. Die Diagnostik der Mitralinsuffizienz unterscheidet sich bei Kindern nicht von der des Erwachsenenalters. Die TEE ist bei Kleinkindern, Säuglingen und Neugeborenen nur sehr schwer durchführbar.

|

|
| Schwere MI | Legende |
| 1 Linker Vorhof (LA) – 2 MI-Jet LV Linke Herzkammer – RV Rechte Herzkammer – RA Rechter Vorhof | |
Echokardiografie
[Bearbeiten]Die Echokardiografie ist als Standardverfahren unverzichtbar: Sie erlaubt eine Bestätigung der Diagnose, eine Feststellung des Schweregrades und der wahrscheinlichen Ursache, sowie eine Beurteilung des Verlaufs. In Folge der verbesserten Darstellungsqualität der Ultraschallbilder ist eine TEE heute nur noch bei weniger als fünf Prozent der Patienten zwingend erforderlich.[15]
Die Farbdoppler-Echokardiografie (s. Abb.) zeigt eine vorhandene Mitralinsuffizienz als Farbwolke im linken Vorhof, die als Insuffizienzjet bezeichnet wird. Breite und Ausdehnung dieser Farbwolke erlauben bereits eine grobe Abschätzung des Schweregrades der Insuffizienz. Darüber hinaus können meist bei der Echokardiografie bereits der zugrundeliegende Mechanismus (Ringdilatation, inkompletter Klappenschluss, Endokarditis, Prolaps, flail leaflet, „unklar“) und die Lokalisation eventueller Klappenveränderungen dokumentiert werden.[16]
Auch die Größe und Pumpfunktion des linken Ventrikels können mit Hilfe der Echokardiografie zuverlässig ermittelt werden. Diese wichtigen Kenngrößen der Herzfunktion sind für die Beurteilung einer schweren Mitralinsuffizienz wichtig, da sie Aufschluss über den optimalen Zeitpunkt einer Klappenoperation geben.
| leicht | mittelschwer | schwer | |
| LA-Größe | ≤ 4,0 cm | > 4,0 cm | > 4,0 cm |
| Jet-Fläche | < 4,0 cm2 | 4,0–8,0 cm2 | > 8,0 cm2 |
| Jet-Fläche/LA-Größe | < 0,2 | 0,2–0,4 | > 0,4 |
| Jet-Länge/LA-Länge | < 1/3 | 1/3–2/3 | > 2/3 |
| proximale Jet-Breite | < 0,3 cm | 0,3–0,69 cm | ≥ 0,7 cm |
| Regurgitationsvolumen | < 30 ml | 30–59 ml | ≥ 60 ml |
| Regurgitationsöffnung | < 0,2 cm2 | 0,2–0,39 cm2 | ≥ 0,4 cm2 |
| Echokardiografische Schweregradbeurteilung[17] | |||
Die Festlegung des Schweregrades einer Mitralinsuffizienz mit Hilfe der Echokardiografie hat in den vergangenen 20 Jahren erheblich an Zuverlässigkeit gewonnen. Dabei werden heute in der Regel verschiedene Parameter gemessen, die anfangs kontrovers beurteilt wurden. Der Schweregrad wird dann in einer Zusammenschau der ermittelten Werte abgeschätzt. Bei organischen Insuffizienzen, insbesondere beim Mitralklappenprolaps, wird deren Ausmaß mit der proximalen Konvergenzmethode regelmäßig überschätzt.[18]
Obengenannte Parameter sind bei einer chronischen Mitralinsuffizienz einigermaßen zuverlässig. Bei der seltenen , akuten Form der Mitralinsuffizienz ( Ursache beispielsweise Endokarditis oder Papillarmuskelabriß) sind sie wenig verläßlich, da der Vorhof keine Zeit hatte zu dilatieren und die Herzfrequenz oft stark beschleunigt ist. Hier kann die Transösophageale Echokardiografie eine bessere Beurteilung erlauben.
Abb.:Farbdopplerdarstellung einer Mitralklappeninsuffizienz beim Hund

Auch bei Kindern ist die Echokardiografie das diagnostische Mittel der Wahl. Im Unterschied zum Erwachsenenalter ist die Schweregradeinteilung anhand echokardiographisch ermittelter Parameter nicht vergleichbar gut validiert.
Andere Verfahren
[Bearbeiten]Andere Untersuchungsverfahren sind nur noch zur Erkennung etwaiger Komplikationen oder zur unmittelbaren Operationsvorbereitung erforderlich. So können EKG und ggf. Langzeit-EKG zur Diagnostik von begleitenden Herzrhythmusstörungen und die Röntgenaufnahme der Thoraxorgane zur Frage einer möglichen Lungenstauung hilfreich sein.
Bei der Herzkatheteruntersuchung wird zwar die Mitralinsuffizienz auch diagnostiziert und quantifiziert, notwendig ist die Untersuchung aber nur bei älteren Patienten vor einer geplanten Herzklappenoperation, um bei einer begleitenden koronaren Herzkrankheit gleichzeitig eine Bypass-Operation vorzunehmen.
Verlauf
[Bearbeiten]Der Verlauf einer Mitralinsuffizienz ist außerordentlich variabel und nur selten vorhersehbar. So kann selbst eine schwere Mitralklappeninsuffizienz über viele Jahre vollkommen „stabil“ (unverändert) bleiben, bei leichten Insuffizienzen ist dies sogar die Regel. Regelmäßige Kontrolluntersuchungen, beispielsweise in jährlichen Intervallen, können über den individuellen Verlauf Aufschluss geben. Dabei wird besonders auf den Schweregrad der Insuffizienz, die Größe und Pumpfunktion des linken Ventrikels und andere Zeichen einer drohenden Überlastung des Herzens geachtet, um eine bevorstehende Verschlechterung frühzeitig zu erkennen. Diese „Verlaufsparameter“ sind wichtige Anhaltspunkte für eine optimale Planung der Therapie.
Bei Kindern, insbesondere Kleinkindern und Neugeborenen, verläuft die Mitralinsuffizienz schwerer und schneller als beim Erwachsenen oder Jugendlichen. Zumeist resultiert bei kleinen Kindern binnen drei Jahre nach Diagnose einer Mitralinsuffizienz eine manifeste Herzinsuffizienz.
Therapie
[Bearbeiten]Grundsätzlich gilt, dass alle Patienten mit einer „echten“ (nicht nur „physiologischen“) Mitralinsuffizienz ein erhöhtes Risiko tragen, an einer bakteriellen Endokarditis zu erkranken. Vor allen Eingriffen, bei denen Bakterien in die Blutbahn gelangen können – wie Darmspiegelung und Zahnextraktion – sollte deshalb eine konsequente Endokarditisprophylaxe betrieben werden.
Bei einer leichten Mitralinsuffizienz ist darüber hinaus keine Therapie erforderlich. Es sollten aber normale Blutdruckwerte eingehalten werden, da ein Bluthochdruck die Druckdifferenz zwischen linkem Ventrikel und Vorhof erhöht und damit das Regurgitationsvolumen und die Druckbelastung des Vorhofes erhöht.
Im Kindesalter sind regelmäßige Kontrolluntersuchungen mittels Echokardiografie im Abstand von 6-12 Monaten angezeigt.
Medikamentöse Therapie
[Bearbeiten]Bei einer schweren Mitralinsuffizienz mit Zeichen einer Herzinsuffizienz richtet sich die Therapie nach den Prinzipien der Herzinsuffizienztherapie. Ob eine medikamentöse Langzeittherapie mit ACE-Hemmern die Prognose auch bei beschwerdefreien Patienten ohne Herzinsuffizienz verbessert, ist noch umstritten. Bei gleichzeitig vorhandenen Herzrhythmusstörungen kann der Einsatz von Antiarrhythmika notwendig sein.
In Abhängigkeit von der Größe des linken Vorhofes kann der Einsatz von Gerinnungshemmern wie Phenprocoumon oder Warfarin zur Prophylaxe einer Thrombus-Bildung innerhalb des (erweiterten) linken Vorhofes erforderlich sein.
Bei der akuten schweren Mitralinsuffizienz muss die Behandlung meist auf der Intensivstation erfolgen. Ziel der medikamentösen Therapie ist in diesem Fall eine Minderung des Regurgitationsvolumens, um einerseits den Vorwärtsfluss zu steigern und andererseits die Lungenstauung zu vermindern. Bei Patienten mit normalem Blutdruck kann dieses Ziel mit Nitroprussid-Natrium erreicht werden, bei niedrigem Blutdruck ist die zusätzliche Gabe von Katecholaminen wie Dobutamin sinnvoll. Diese Patienten profitieren oft auch von der Anwendung der intraaortalen Ballonpumpe, die zu einer Stabilisierung in der Vorbereitungsphase zur erforderlichen Klappenoperation beitragen kann.
Bei Kindern werden die leichten Verlaufsformen der Mitralinsuffizienz ebenfalls medikamentös behandelt. Der Beginn der medikamentösen Therapie hängt dabei vom Schweregrad selbst bzw. dem Verlauf der echokardiografischen Kontrollen ab. Primäres therapeutisches Ziel ist die Senkung der Nachlast (afterload). Wie beim Erwachsenen werden hauptsächlich ACE-Hemmer eingesetzt; zusätzlich werden Diuretika und Digitalis-Präparate (Digoxin, Digitoxin) verwendet.
Operative Therapie
[Bearbeiten]Bei allen Patienten mit einer schweren Mitralinsuffizienz ist die Indikation für eine Herzklappenoperation zu prüfen. Dabei wird entweder
- eine Rekonstruktion der Klappe vorgenommen oder
- eine künstliche Herzklappe eingesetzt.
Grundsätzlich wird die Klappenrekonstruktion bevorzugt, da sie zu einer geringeren Beeinträchtigung der Herzfunktion führt und bei erhaltenem Sinusrhythmus keine dauerhafte Blutverdünnung erfordert. Sie ist aber insbesondere bei stark geschrumpften, verkalkten oder gar zerstörten Klappensegeln nicht möglich, so dass dann nur ein Klappenersatz in Frage kommt. Die Chancen für eine Klappenrekonstruktion lassen sich mit Hilfe der Echokardiografie bereits vorher zuverlässig abschätzen, in Einzelfällen wird die Notwendigkeit einer künstlichen Klappe erst während der Operation deutlich.
Eine Klappenoperation ist sinnvoll, wenn eindeutig durch die Mitralinsuffizienz verursachte Beschwerden sich durch Medikamente nicht beseitigen lassen, solange die Pumpfunktion des linken Ventrikels nicht allzu schwer eingeschränkt ist (Ejektionsfraktion [EF] > 30 %).
Bei asymptomatischen Patienten (ohne Beschwerden) mit schwerer Mitralinsuffizienz wird eine Operation empfohlen, wenn Hinweise auf eine Überlastung des Herzens vorliegen. Dies ist der Fall bei eingeschränkter Pumpfunktion (EF < 60 %) oder erheblicher Vergrößerung (endsystolischer Durchmesser [LVESD] > 45 mm oder LVESD-Index > 26 mm/m2) des linken Ventrikels, gleichfalls beim Nachweis einer pulmonalen Hypertonie (systolischer Pulmonalarteriendruck > 50 mmHg in Ruhe oder > 60 mmHg bei Belastung). Bei einer rekonstruierbaren Mitralklappe wird die Indikation großzügiger gestellt, weil die erwartete Verbesserung durch die Operation höher einzuschätzen ist.
In Zweifelsfällen kann die Belastungshämodynamik, also die Veränderungen der Druckwerte und der Pumpfunktion des Herzens unter körperlicher Belastung, für die initiale Beurteilung der Operationsindikation hilfreich sein.
Postoperativ sind Patienten mit einer rekonstruierten Klappe in der Regel nach einigen Wochen als „herzgesund“ zu betrachten. Wenn keine anderen Erkrankungen vorliegen, ist ihre Belastbarkeit nicht nennenswert eingeschränkt und eine besondere herzwirksame Therapie nicht erforderlich. Patienten mit einer künstlichen Herzklappe benötigen oftmals eine dauerhafte Blutgerinnungshemmung (Antikoagulation) durch Medikamente wie Marcumar®. Bei ihnen ist die Herzfunktion unter Belastung gelegentlich messbar eingeschränkt, in Abhängigkeit vom Durchmesser der eingesetzten Klappenprothese. Bei einer sonst normalen Herzfunktion ist diese Abweichung allerdings so gering, das im Alltag keine Beschränkungen zu spüren sind.
Besonderheiten bei Kindern
[Bearbeiten]Infolge des zumeist schnelleren Fortschreitens der Mitralinsuffizienz ist bei Kindern häufiger eine operative Therapie erforderlich. Sie ist im Vergleich zum Erwachsenenalter mit besonderen Problemen behaftet. Zum einen ist der Einsatz von Klappenprothesen bei Kindern vor Erreichen der Endgrösse im Rahmen der Pubertät immer mit der Notwendigkeit einer oder mehrerer erneuter Operationen verbunden, um die Prothesengrösse der Herzgrösse anzupassen. Dies ist nicht unbegrenzt möglich. Zum anderen bedingt der zwingend erforderliche Einsatz von gerinnungshemmenden Medikamenten bei Vorhandensein einer Klappenprothese im Kindesalter vor der Pubertät deutliche Schwierigkeiten hinsichtlich Blutungskomplikationen. Insbesondere kleine Kinder halten sich nur eingeschränkt an die Verhaltensregeln zur Vermeidung von Blutungskomplikationen bei der langfristigen Einnahme von Gerinnungshemmern. Da die Gerinnungshemmung bei Einsatz einer Klappenprothese in jungen Lebensjahren auch über lange Zeiträume durchgeführt werden muss, wird die Indikation zum Einsatz einer Klappenprothese möglichst zurückhaltend gestellt. Dennoch ist bei Kindern mit einer operationsbedürftigen Mitralinsuffizienz langfristig in vielen Fällen mit einem Herzklappenersatz zu rechnen. Die kurz- und mittelfristige Prognose nach einem operativen Klappenersatz ist bei Kindern gut.[10] Die langfristige Prognose eines mechanischen oder bioprothetischen Klappenersatzes ist aufgrund des gehäuften Auftretens von behandlungsbedürftigen Herzrhythmusstörungen und linksventrikulärer Insuffizienz nur mäßig mit entsprechenden Morbiditäts- und Mortalitätsraten.[19]
Daher wird – wenn immer möglich – zunächst eine Klappenrekonstruktion ohne Einsatz einer Prothese versucht (Annuloplastie, Valvuloplastie).[20][21] Sichere und unzweifelhafte Kriterien zum Zeitpunkt des Einsatzes einer Klappenprothese gibt es im Kindesalter gegenwärtig nicht.
Prognose
[Bearbeiten]Aufgrund des individuell sehr unterschiedlichen Verlaufs der Mitralinsuffizienz ist auch die Prognose der Patienten sehr verschieden. Man geht heute davon aus, dass Menschen mit einer leichten Mitralinsuffizienz ohne sonstige Herzerkrankung eine normale Lebenserwartung haben.
Patienten, bei denen die Indikation zur Operation nach den gegenwärtigen Leitlinien gestellt wurde, hatten eine 8-Jahres-Überlebensrate von 89 %. Zahlen aus den Jahren 1980 bis 1989 zeigen eine deutliche Abhängigkeit der Prognose von der Pumpfunktion des linken Ventrikels vor der Operation: Die 10-Jahres-Überlebensrate jener Patienten mit einer normalen Ventrikelfunktion (EF ≥ 60 %) lag bei 72 % und entsprach damit der Überlebensrate Gleichaltriger ohne Herzoperation, während sie mit 32 % bei einer EF von weniger als 50 % und 53 % bei einer EF zwischen 50 und 60 % signifikant geringer war.[22]
Plötzliche Todesfälle sind bei Patienten mit Mitralinsuffizienz selten, sie treten bei Patienten mit Sehnenfadenabriss mit einer Häufigkeit von 0,8 %, bei gleichzeitigem Vorhofflimmern allerdings 4,8 % pro Jahr auf.
Literatur
[Bearbeiten]- Baylen BG. Congenital mitral insufficiency. In: HD Allen, HP Gutgesell, EB Clark (editors): Moss and Adams' Heart Disease in Infants, Children, and Adolescents Including the Fetus and Young Adult. 6th edition. November 2000. Lippincott Williams & Wilkins Publishers. ISBN 0-683-30742-8.
- Bonow RO, Braunwald E: Mitral Regurgitation in Zipes DP et al. (Hrsg.): Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine. 7. Auflage. W.B. Saunders Company, Philadelphia 2004 ISBN 1-41-600014-3.
- Bonow RO et al.: ACC/AHA Guidelines for the Management of Patients With Valvular Heart Disease. JACC (1998) 32:1486-1588. Leitlinien der US-amerikanischen Fachgesellschaften online (engl.).
- Flachkampf FA, Daniel WG: Mitralinsuffizienz. Internist (2006) 47:275-286.
- Nelson WN, Couto CG et al.: Innere Medizin der Kleintiere. 1. Auflage. Urban & Fischer, München und Jena 2006 ISBN 3-437-57040-4
- Rahimtoola SH, Enriquez-Sarano M, Schaff HV, Frye RL: Mitral valve disease. In: Fuster V, Alexander RW, O'Rourke RA (editors): Hurst's The Heart. 10th edition. November 16, 2000. McGraw-Hill Professional. New York. ISBN 0-07-135694-0
Weblinks
[Bearbeiten]- http://www.gesundheit.de/roche/ro22500/r24911.000.html
- http://www.medizin.uni-essen.de/cardio/15_mitralinsuffizienz.html
Quellen
[Bearbeiten]- ↑ Ayabakan C et al.: The Doppler echocardiographic assessment of valvular regurgitation in normal children. Turk J Pediatr (2003) 45:102-107. PMID 12921295
- ↑ Bahadur KC et al. Prevalence of rheumatic and congenital heart disease in schoolchildren of Kathmandu valley in Nepal. Indian Heart J. 2003 Nov-Dec;55(6):615-618. PMID 14989511
- ↑ Thomson JD et al. Left sided valvar regurgitation in normal children and adolescents. Heart. 2000 Feb;83(2):185-187. PMID 10648494.
- ↑ Brand A et al. The prevalence of valvular regurgitation in children with structurally normal hearts: a color Doppler echocardiographic study. Am Heart J. 1992 Jan;123(1):177-180. PMID 1729823
- ↑ Singh JP et al.: Prevalence and clinical determinants of mitral, tricuspid, and aortic regurgitation (the Framingham Heart Study). Am J Cardiol (1999) 83:897-902. PMID 10190406.
- ↑ Bursi F et al.: Mitral regurgitation after myocardial infarction: a review. Am J Med (2006) 119:103-112. PMID 16443408
- ↑ Cioffi G et al.: Functional mitral regurgitation predicts 1-year mortality in elderly patients with systolic chronic heart failure. Eur J Heart Fail (2005) 7:1112-1117. PMID 15919238.
- ↑ Yoshida K et al. Color Doppler evaluation of valvular regurgitation in normal subjects. Circulation. 1988 Oct;78(4):840-7. PMID 3262454
- ↑ Buck T, Erbel R: Fortschritte in der Diagnostik und Therapie der Mitralklappeninsuffizienz. Herz (2006) [1]
- ↑ 10,0 10,1 Webb GD et al.: Congenital Heart Disease in Zipes DP et al. (Hrsg.): Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine. 7. Auflage. W.B. Saunders Company, Philadelphia 2004 ISBN 1-41-600014-3.
- ↑ van Karnebeek CD et al. Natural history of cardiovascular manifestations in Marfan syndrome. Arch Dis Child. 2001 Feb;84(2):129-137. PMID 11159287
- ↑ Wippermann CF et al. Mitral and aortic regurgitation in 84 patients with mucopolysaccharidoses. Eur J Pediatr. 1995 Feb;154(2):98-101. PMID 7720756
- ↑ Allen J et al. Mitral regurgitation after anthracycline treatment for childhood malignancy. Heart. 2001 Apr;85(4):430-432. PMID 11250954
- ↑ Lund MB et al. Increased risk of heart valve regurgitation after mediastinal radiation for Hodgkin's disease: an echocardiographic study. Heart. 1996 Jun;75(6):591-595. PMID 8697163
- ↑ Monin JL et al.: Functional assessment of mitral regurgitation by transthoracic echocardiography using standardized imaging planes diagnostic accuracy and outcome implications.
J Am Coll Cardiol (2005) 46:302-9. PMID 16022959 - ↑ Voelker W: Strukturierter Datensatz zur Befunddokumentation in der Echokardiographie – Version 2004.
Z Kardiol (2004) 93:997. DOI 10.1007/s00392-004-0151-8. - ↑ Buck T et al.: Aktuelle Empfehlungen zur echokardiographischen Schweregradbeurteilung der Mitralklappeninsuffizienz. Herz (2006) 31:30-37
- ↑ Grossmann G et al.: Value of the proximal flow convergence method for quantification of the regurgitant volume in mitral regurgitation.
Z Kardiol (2004) 93:944-953. DOI 10.1007/s00392-004-0151-8. - ↑ Adatia I et al. Clinical course and hemodynamic observations after supraannular mitral valve replacement in infants and children. J Am Coll Cardiol 1997;29:1089–1094. PMID 9120164
- ↑ Chavaud S et al. Reconstruction surgery in congenital mitral valve insufficiency (Carpentier's techniques): long term results. J Thorac Cardiovasc Surgery 1998;115:84–92. PMID 9451050
- ↑ Aharon AS et al. Early and late results of mitral valve repair in children. J Thorac Cardiovas Surg 1994;107:1262–1270. PMID 8176970
- ↑ Enriquez-Sarano M et al.: Echocardiographic prediction of survival after surgical correction of organic mitral regurgitation. Circulation (1994) 90:830-837. PMID 8044955.
en:Mitral regurgitation
Mitralklappenendokarditis
[Bearbeiten]Mitralklappenprolaps
[Bearbeiten]Pulmonaler Hochdruck
[Bearbeiten]Die TI ist im Echo (TTE) leicht zu erfassen. Am besten geeignet ist der apikale 4-Kammerblick und der apikale Schrägblick auf die Trikuspidalklappe. Erfasst werden sollten dabei immer:
- Die RV-Größe und RV Auswurfleistung.
- Die Trikuspidalklappenmorphologie
- Die RA-Größe
- Die Cavabreite und die Lebervenenbreite
- Systolischer Rückfluss in die Lebervenen
- Der Druckgradient über der Trikuspidalklappe
Schweregradeinteilung der Trikuspidalinsuffizienz
[Bearbeiten]Grad 1 Grad 2 Grad 3 ------------------------------------------------------- Jetfläche <5 cm2 5–10 cm2 >10 cm2 Vena contracta-Breite <0,7 cm <0,7 cm ≥0,7 cm
Literatur
[Bearbeiten]- Zoghbi WA, Enriquez-Sarano M, Foster E et al (2003)
- Recommendations for evaluation of the severity of native valvular regurgitation with twodimensional and Doppler echocardiography.
- J Am Soc Echocardiogr 16: 777–802
Pulmonalklappenendokarditis
[Bearbeiten]Die Pulmonalklappenendokarditis ist ein seltener Fall. Trotzdem ist sie möglich, wie folgender Fall zeigt:
Der interessante Fall:
[Bearbeiten]47-jähriger, alkoholkranker Patient.
Einweisung wegen Kreislaufkollaps.
Klinischer Befund:
[Bearbeiten]Hochfieberhafter, deliranter Patient in stark reduziertem Allgemeinzustand. Körpertemperatur 39,4° C rektal. Puls 143/min., rhythmisch, teils ventrikulärer Trigeminus. RR 90/60 mm/Hg. Mittelgradiges Systolikum über Erb und Diastolikum über dem Pulmonalisareal und Erb.
Laborchemisch septisches Bild mit massiv erhöhtem CRP, grenzwertiger Leukozytose und schwerer Thrombopenie, deutliche Nierenfunktionseinschränkung, Anstieg der Transaminasen. Makrozytose bei toxischer Knochenmarkschädigung (äthylisch).
Röntgen Thorax im Liegen: Herz nicht dilatiert, pneumonisches Infiltrat links basal, keine Lungenstauung.
Oberbauch-Sonografie: Fettleber III, Milz nicht vergrößert, kein Aszites.
Transthorakale Echokardiografie: normale LV-Funktion, Mitralklappe, Aortenklappe und Trikuspidalklappe unauffällig.
An der Pulmonalklappe Nachweis einer flottierenden thrombusartigen Vegetation, Durchmesser 2 cm, kombiniert mit einer mittelgradigen bis höhergradigen Pulmonalinsuffizienz.
Diagnosen:
[Bearbeiten]1.) Floride Pulmonalklappenendokarditis mit septischem Schock (Staphylococcus aureus in der Blutkultur 2.) Bronchopneumonie links 3.) Alkoholentzugsdelir bei Alkoholkrankheit 4.) schwere Thrombozytopenie DD septisch, DD und/oder alkoholtoxische Knochenmarkschädigung 5.) Hypokaliämie 6.) äthyltoxischer Leberzellschaden
Therapie und Verlauf:
[Bearbeiten]Nach Abnahme von Blutkulturen, Legen eines zentralen Venenkatheters mit ZVD gesteuerter Flüssigkeitssubstitution und Kaliumsubstitution, Arterenol-Perfusor nach RR-Werten. Nach klinischer Stabilisierung Verlegung in ein Zentrum auf die internistische Intensivstation. Da bereits Blutkulturen entnommen waren, Beginn mit einer empirischen Breitspektrumantibiose intravenös. Weiterer Abfall der Thrombozyten auf minimal 9/nl. Nachweis von Staphylococcus aureus in der Blutkultur, weshalb die antibiotische Therapie testgerecht umgestellt wird. Im TEE Bestätigung der bereits im TTE nachgewiesenen Pulmonalklappenendokarditis. Erweiterung der Antibiose mit Rifampicin. Wegen Stupor bei septischer Encephalopathie und Delirium tremens, schwerer Thrombopenie und schlechtem klinischem Zustand war ein operativer Eingriff mit Pulmonalklappenersatz leider nicht möglich. Bei infauster Prognose verstarb der Patient 6 Tage nach der stationären Aufnahme unter den Zeichen einer Sepsis mit respiratorischer Insuffizienz und septischem Schock.
Links
[Bearbeiten]- http://www.kup.at/kup/pdf/1354.pdf
- Pulmonalklappenendokarditis
Perikarderguß
[Bearbeiten]Ein Perikarderguß ist im Ultraschall leicht zu erkennen. Schaut man von subcostal aus dem epigastrischen Winkel auf das Herz, sieht man immer einen kleinen physiologischen Perikarderguß.

Perikarditis
[Bearbeiten]Perikarditis konstriktiva
[Bearbeiten]ASD Vorhofseptumdefekt
[Bearbeiten]Der Vorhofseptumdefekt läßt sich meist am besten aus dem epigastrischen Winkel unter Benutzung des Farbdopplers erkennen. Hilfreich ist auch die Gabe eines Ultraschallkontrastmittels. Typisch für einen hämodynamisch relevanten ASD ist folgende Konstellation:
- 3 Kammer zu groß ( RA,RV,LA)
- 1 Kammer normal groß ( LV)

Das gezeigte Bild läßt zwar einen Vorhofseptumdefekt vermuten. Beweisend ist es nicht. Das Vorhofseptum ist im Bereich des Foramen ovale sehr dünn. Man meint da wäre eine Lücke. In Wirklichkeit ist aber nicht immer eine vorhanden.
VSD Ventrikelseptumdefekt
[Bearbeiten]Abb.:Schönes Bild eines Ventrikelseptumdefektes
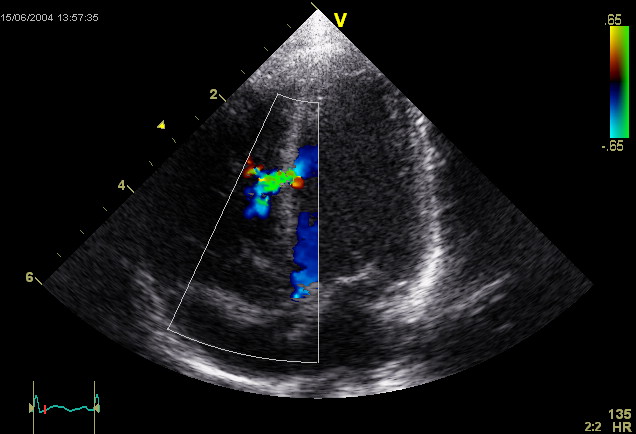
Was hat der Bauchschallkopf am Herzen zu suchen ?
[Bearbeiten]Wenn man mit einem Ultraschallgerät arbeitet , das über einen guten Bauchschallkopf, aber über keinen guten Echoschallkopf verfügt, kann man manche Vorteile des Bauchschallkopfes auch am Herzen nutzen.
Da der Sektorschallkopf im Nahfeld durch seine Geometrie oft ein überstrahltes Bild zeigt , bringt der Linearschallkopf in solchen Fällen ein besseres Bild .
Wo bringt der Bauchschallkopf ein besseres Bild ?
[Bearbeiten]- Nahfeld
- Beurteilung des Epikards und Perikards
- Beurteilung von Perikardergüßen
- Ausmessung der Dicke der RV Wand
- Wandbewegung der LV Spitze
- Thrombus in der LV Spitze
- Weicheres Bild durch höhere Dynamik ( mehr Grautöne )
- Beurteilung der Klappen bei der Suche nach Endokarditischen Vegetationen
- Wo ist eindeutig der Echoschallkopf besser ?
- Bei der Farbdarstellung ist der Bauchschallkopf meist überfordert
- Allerdings ist die Dopplergeschwindigkeit meist falsch eingestellt.
Kann man einen guten Echoschallkopf auch für den Bauch nutzen ?
[Bearbeiten]Echo Didaktik
[Bearbeiten]Wie man ins Herz hinein schallt, so tönt es wieder heraus.
Die Echokardiografie zu erlernen ist nicht ganz so einfach wie der Ultraschall des Bauches. Am Anfang bereitet es einem große Probleme überhaupt vernünftige Bilder herzubekommen. Die Rippen, die Lunge und die Atembewegungen des Patienten stören sehr. Außerdem ist die eigene Hand noch nicht so trainiert, um gute Bildeinstellungen zu ermöglichen.
Was man außerdem braucht ist Zeit. Lieber sollte man einen einzigen Patienten am Anfang 30 Minuten mit einem alten weniggenutzten Schwarzweißgerät untersuchen, wenn man selbst Zeit hat und nicht ständig gestört wird, als daß man auf einem Superfarbdopplergerät 2 Minuten den Schallkopf in die Hand nehmen darf, bis 3 andere Doktors schon mit schlauen Sprüchen zu helfen versuchen und einem den Schallkopf wieder aus der Hand nehmen.
Am Anfang interessiert nur eins: eine gute 2D Bildqualität. Das genaue Ausmessen und die genaue Einhaltung von Standardschnittebenen sind erst in zweiter Linie wichtig.
Dann muß man versuchen, all das was man sieht, anatomisch richtig zuzuordnen. Danach kommt die Beurteilung von pathologischen Befunden.
Das Schluckecho ( TEE ) zu lernen ist vergleichsweise einfach. Hier bereitet vielleicht das Einführen des Gerätes Probleme. Etwas Dormicum iv hilft dem Patienten und erleichtert dem Doktor die Arbeit. Die Bilderzeugung ist dann relativ einfach. Probleme bereitet am Anfang vielleicht die Interpretation, da man jetzt hinter dem Herzen sitzt und nicht davor. Deswegen gilt auch hier als Gebot Nr.1: Zeit lassen und in aller Ruhe untersuchen.
Weitere Tips :
- So viele Echos machen wie nur möglich
- Sich am Anfang nicht frustrieren lassen
- Am Anfang leicht schallbare Patienten heraussuchen ( junge Menschen, alte kachektische Menschen)
- Typische Schnitte auf Papier aufmalen
- z. B. Vierkammer Blick , parasternal
- typische Bilder aufheben und kleine eigene Videoprint Sammlung anlegen.
- Mit dem Subcostalschnitt in Rückenlage anfangen , diese Einstellung ist einem vom Ultraschall her vertraut und bringt mehr als mancher Echoexperte denkt.
- interessante Fälle nachvollziehen und nochmal schallen
- z. B. Lungenembolie , Kardiogener Schock , Perikarditis , Dissektion, Klappenfehler
- Endokarditis , Infarkte , ASD , VSD etc
- interessante EKG befunde im Echo anschauen
- typischer Vorderwandinfarkt , typischer Hinterwandinfarkt , AV Block , LSB etc
- keine Vorbefunde glauben
- klassische Dopplerbefunde:
- Aortenstenose , Mitralstenose , Trikuspidalinsuff nachvollziehen und im Schweregrad zu beurteilen versuchen
- M Mode + CW Doppler messen
- Dopplerbefunde ( gut zu sehen , Schweregrad schlecht einzuordnen)
- Mitralinsuffizienz und Aorteninsuff schön zu sehen , schlecht zu messen
- ( Kriterien sammeln , MI : LA Größe , Refluxgröße in der Farbe , LV Funktion gut oder schlecht, Rechte Seite )
- AI: subclavia Doppler , wie tief ist der DIP , diastol RR , LV EDD , LV HW Dicke
- Seltenes beim Erwachsenenecho : ASD , VSD , persist Hohlvene , Pulmonalstenose , Perik.konstriktiva
- Spezialthemen in Serie machen
- ( neben der Routine )
- z. B. 20 CW s der Aortenklappe , 20 mal genaue LV Beweglichkeit evt mit Planimetrie
- 20 * Trikuspidalinsuffizienz , 20 mal Vorhofseptum genau anschauen , 20 mal RV Wanddickemessen )
- gutes simples Buch für den Anfang :
- Böhmeke, Thomas; Weber, Klaus:
- Checkliste Echokardiographie.
Kosten einer Echokardiografie
[Bearbeiten]GOÄ Privatpatienten
[Bearbeiten]siehe auch Sonographie:_Abrechnung
Normales Echo + Farbe GOÄ-Ziffern 410 (2,3) + 424(2,3) + 406 ( 1) Euro 26 + 67 + 11 = 104 Euro
zusätzlich CW Doppler bei Ti oder Aortenstenose
CW-Doppler GOÄ Ziffer 405 Euro 11,66 Euro zusätzlich
Häufige Abkürzungen in Echobefunden
[Bearbeiten]- 2D 2-dimensional
- 3D 3-dimensional
- A A-Welle = zweite diastolische Füllungsphase der Kammer,
- Systole des Vorhofes, gibt es nur bei Sinusrhythmus
- ACS akutes Koronarsyndrom
- AK Aortenklappe
- AoV Aortenklappe
- AI Aortenklappeninsuffizienz
- AKÖF AK-Öffnungsfläche
- ARVC arrhythmogene rechtsventrikuläre CM
- AS Aortenstenose
- ASD Atrium-Septum-Defekt
- CM Kardiomyopathie
- DCM dilatative Kardiomyopathie
- ICM ischämische Kardiomyopathie
- CRT kardiale Resynchronisationstherapie
- cw-Doppler kontinuierlicher Doppler
- E = E-welle erste Diastolische Füllungsphase der Herzkammer
- E' = E Strich = E-Welle im Gewebsdoppler
- EE' = Verhältnis der Doppler E Welle zur Gewebsdoppler E Welle,
- Maß für die diastolidche Dysfunktion
- EDD = Enddiastolischer Durchmesser des Linken Ventrikels = ID
- ESD = Endsystolischer Durchmesser
- EF Ejektionsfraktion = Auswurffraktion
- EROA effektive Regurgitationsöffnung
- IE infektiöse Endokarditis
- IMH intramurales Hämatom
- IOE intraoperative Echokardiographie
- IVUS intravasculärer Ultraschall
- ICE intracardiale Echokardiography
- KHK koronare Herzkrankheit
- LA linker Vorhof (linksatrial)
- LV linker Ventrikel (linksventrikulär)
- LVMM LV-Muskelmasse
- LVOT LV-Ausflusstrakt
- MK Mitralklappe
- Miv Mitralklappe
- MKÖF Mitralklappenöffnungsfläche
- MRT Magnet-Resonanz-Tomographie
- PA Pulmonalarterie (pulmonalarteriell)
- PC Pericarditis constrictiva
- PC PC-Druck Pumonalcapillärer Druck = Wedge Druck
- PISA proximal isovelocity surface area
- PFO offenes Foramen ovale
- PHT Druckhalbwertszeit
- pw-Doppler gepulster Doppler
- RA rechter Vorhof (rechtsatrial)
- RV rechter Ventrikel (rechtsventrikulär)
- SAM systolic anterior movement
- TEE transösophageale Echokardiographie
- TTE transthorakale Echokardiographie
- TVI Tissue Velocity Imaging Gewebsdoppler
- VCI Vena cava inferior
- VHF Vorhofflimmern
- VSD Ventrikelseptumdefekt
- VTI Geschwindigkeits-Zeit-Integral
Internetauftritt für das Echo Labor
[Bearbeiten]Statistik einer kleinen kardiologischen Abteilung
[Bearbeiten]- 263 * 12 TTE
- 83 * 12 TEE
- 77 * 12 Carotiden
- 115 * 12 Pleurauntersuchungen
- 12* 12 Pleurapunktionen
- 18 * 12 Kardioversionen
- 45 * 12 Beinvenen
- 8 * 12 Beinarterien
- Stressechokardiografie
- Sonstiges : Perikardpunktionen, SD, Sonografie Abdomen, ZVK Anlagen, Nierenarterienstenosen, suprapubischer Katheter
Einleitung
[Bearbeiten]In der Echokardiografie des Krankenhauses xy werden alle gängigen kardiologischen Ultraschalluntersuchungen durchgeführt. Im Jahr führen wir im Durchschnitt insgesamt ### Untersuchungen durch. Es stehen zwei hochwertige Echokardiografiegerät und zwei kleine echoakardiografische Laptop-Echomaschinen zu Verfügung. Es gibt zwei TEE Sonden inklusive 4D Möglichkeit. Eine transthorakale 4D Sonde ergänzt die Untersuchungsmöglichkeit. Während kardiologischer Eingriffe im katheterlabor wird das Schluckecho zur Lagekontrolle der transseptalen Punktion, des Vorhofohrverschlusses und der Pulmonalvenenisolation genutzt
Fragen
[Bearbeiten]Was ist die L-Welle an der Mitralklappe ?
[Bearbeiten]Die mitrale L-Welle ist definiert als ausgeprägte mittdiastolische Flussgeschwindigkeit, folgend der E-Welle mit einer Spitzengeschwindigkeit von mehr als 20 cm/sec Sie ist meist Zeichen einer diastolische Dysfunktion. Quelle : http://www.praxis-depesche.de/nachrichten/mitrale-l-welle-im-herzecho-zeigt-fortgeschrittene-diastolische-dysfunktion-bei-vorhofflimmern-an/
Weitere Literaturstelle:
- The International Journal of Cardiovascular Imaging
- September 2017, Volume 33, Issue 9, pp 1377–1384| Cite as
- Long-term outcome of patients with triphasic mitral flow with a mid-diastolic L wave: prognostic role of left atrial volume and N-terminal pro-brain natriuretic peptide
- September 2017, Volume 33, Issue 9, pp 1377–1384| Cite as
Luftreflexe im Koronarsinus
[Bearbeiten]Was kann man daraus schließen , wenn der Koronarsinus im TEE sehr breit ist und bei intravenöser Infusion über den linken Arm Luftreflexe im Koronarsinus zu sehen sind ?
Literaturtipps Echokardiografie
[Bearbeiten]- Echokardiographie: Lehrbuch und Atlas by Thomas Bartel (2006-10-24) Taschenbuch – 1712
- von Thomas Bartel
- Verlag: Urban & Fischer Verlag/Elsevier GmbH (1712)
- immer noch sehr gutes Buch meint Benutzer:Rho
- Verlag: Urban & Fischer Verlag/Elsevier GmbH (1712)
- von Thomas Bartel
- Der Echo-Guide.
- Mit CD-ROM Die kompakte Einführung in die Echokardiographie
- von Thomas Böhmeke, Ralf Doliva
- Thiemeverlag
- Viele Bilder, leicht lesbar , gut geeignet auch für Anfänger
- EUR 39,95
- Handbuch der Echokardiographie.
- von Ursula Wilkenshoff, Irmtraut Kruck, Felix Mühr-Wilkenshoff
- EUR 39,95
- Blackwell Verlag , jetzt Thieme Verlag
- laut OA MB sehr empfehlenswert
- Kursbuch Echokardiographie
- von Frank A. Flachskampf
- EUR 129,95 Kostenlose Lieferung. Siehe Details.
- Thiemeverlag
- von Frank A. Flachskampf
- Kompendium Echokardiographie, m. CD-ROM:
- Leitfaden zur Aus-, Fort- und Weiterbildung. Hrsg. v. Stefan Pfleger, Franz Metzger u. Karl K. Haase. 2003. XVI, 168 S. m. 45 Abb. 23 cm. Kartoniert. 361gr.
- ISBN 3-8047-1964-3, KNO-NR: 11 70 78 83 -WISSENSCHAFTLICHE VERLAGSGES.-
- Böhmeke, Thomas: Checkliste Echokardiographie.
- Reihe begr. v. Felix Largiader, Alexander Sturm u. Otto Wicki. Checklisten der aktuellen Medizin. 3., überarb. **erw. Aufl. 2001. VIII, 250 S. m. 563 z. Tl. farb. Abb. 18,5 cm. Kunststoff. 285gr.
- ISBN 3-13-129403-5, KNO-NR: 05 40 58 62 -THIEME, STUTTGART- 39.95 EUR
- Köhler, Ekkehart; Tataru, Mira-Christine: Klinische Echokardiographie, m. CD-ROM.
- Lehrbuch und Video-Atlas. 5., neubearb. u. erw. Aufl. Nachdr. 2001. XI, 811 S. m. 1038 SW- u. 522 Farbabb. 24,5 **cm. Gebunden. 2168gr.
- ISBN 3-13-124995-1, KNO-NR: 01 56 51 03 -THIEME, STUTTGART; ENKE- 229.00 EUR
- die CD ist mit 1200 klinisch relevanten Videos sehr wertvoll.
- Oh, Jae K: The Echo Manual
- Lippincott-Raven, 1998, ISBN 078171205X, ca, EUR 239,80
- schlichte Aufmachung, hervorragender Inhalt.
- Lippincott-Raven, 1998, ISBN 078171205X, ca, EUR 239,80
- Nanda, Navin C:
- Atlas der transösophagealen Echokardiographie
- Deutscher Ärtzeverlag 2000, ISBN 376910384X, EUR 99,95
- Standardwerk zum TEE, gute intraoperative Korrelation der Befunde.
- Atlas der transösophagealen Echokardiographie
- Beckmann, S:
- Stressechokardiographie Kompakt, interaktiv mit CD
- Steinkopff 1998, ISBN 3798512981, EUR 79,95
- Viele praktische Beispiele, besonders Tips und Tricks sind hilfreich.
- Steinkopff 1998, ISBN 3798512981, EUR 79,95
- Stressechokardiographie Kompakt, interaktiv mit CD
Links Echokardiografie
[Bearbeiten]Linklisten
[Bearbeiten]Online Rechner
[Bearbeiten]- http://csecho.ca/cardiomath/
- Gut gemachter Online Rechner für echokardiografische Berechnungen
Deutsche Seiten
[Bearbeiten]- http://www.medlibrary.de/library/index.php?title=Echokardiographie
- Echoplattform online für Anfänger
- http://info.med.yale.edu/intmed/cardio/echo_atlas/contents/index.html
- Hervorragender Echoatlas Online
- http://demo.entec.de/sonocard/start/index.html
- Lernprogramm Herzultraschall
- http://www.uni-leipzig.de/~herz/echo/index.php?l=de&id=03_archiv
- Sehr schöne Fallbeschreibung mit Videos zum anschauen aus dem Herzzentrum Leipzig
- http://leitlinien.dgk.org/images/pdf/leitlinien_volltext/2009-05_manual.pdf
- Manual zur Indikation und Durchführung der Echokardiographie sehr ausführlich
- http://www.springerlink.com/content/71385p41653vl4um/fulltext.pdf
- Manual zur Indikation und Durchführung der Echokardiographie
- http://commons.wikimedia.org/wiki/Category:Echocardiography
- http://de.wikipedia.org/wiki/Echokardiografie
- http://www.echobasics.de/deutsch.html
- didaktisch gut gemachte elementare Anleitung in die Echokardiographie
- http://www.netdoktor.de/ratschlaege/untersuchungen/herzultraschall_echokardiographie.htm
- http://www.dgk.org/leitlinien/EchoKardiographie.html
- http://www.zwai.net/pflege/Intensiv/Journal/Intensivmedizin/TEE_in_der_Intensivmedizin/ TEE in der Intensivmedizin
- http://www.echokardio.de/qualitaetsleitlinien/qualitaetsleitlinien.html
- Echoseiten von Christian Kirsch , DEGUM-Ausbilder
Echo Leitlinien
[Bearbeiten]- http://www.dgk.org/leitlinien/PositionspapierEchokardiographie.pdf
- Positionspapier zu Qualitätsstandards in der Echokardiographie (2004)
- http://www.bsecho.org/index.php?option=content&task=category§ionid=8&id=21&Itemid=96
- British Society of Echocardiography – Guidelines & Statements
- http://www.asecho.org/i4a/pages/index.cfm?pageid=3317
- American Society of Echocardiography – ASE Guidelines & Standards
Englische Seiten
[Bearbeiten]- https://www.techmed.sk/en/echo/new-examination/
- Online FREE echocardiography education platform (TECHmED)
- Cardiology Forum in Facebook
- sehr eindrucksvolle Echofilme + Kommentare
- Echo Board Review in Facebook
- http://www.cincinnatichildrens.org/health/heart-encyclopedia/anomalies/
- Flash-Animationen angeborener Herzfehler
- http://www.asecho.org/i4a/pages/index.cfm?pageid=1
- American Society of Echocardiography - Raleigh, North Carolina
- http://info.med.yale.edu/intmed/cardio/echo_atlas/contents/
- Atlas of Echocardiography Yale University
- http://www.manbit.com/ERS/ERSindex.asp
- Atlas of Perioperative Echocardiography D. A. Pybus - The St George Hospital
- http://www.csecho.ca/
- Canadian Society of Echocardiography CSE - Toronto, Ontario
- http://www.ecocardiografia.info/didattica.htm
- Didactische Animationen G. Giordano - Ecocardiografia.info
- http://www.echokardio.de/
- Echokardio C. Kirsch
- http://www2.umdnj.edu/~shindler/imgndx.html
- Echocardiographic Images on the Internet D. Shindler - Echocardiography Journal
- http://www2.umdnj.edu/~shindler/imgndx.html
- Echocardiography tutorial Atlas of Human Cardiac Anatomy P. A. Iaizzo University of Minnesota
- http://www.echoincontext.com/
- Echo in Context Duke University School of Medicine
- http://www.echo-web.com/html/edu-interactive-studies.htm
- Echo-Web S. Wiegers - T. Plappert - M. St. John Sutton
- http://www.mayo.edu/webcasts/
- Mayo Clinic - Webcasting Mayo Clinic - Echocardiology Grand Rounds/Echocardiography: From Pictures to Information
- http://folk.ntnu.no/stoylen/strainrate/
- Strain rate imaging A. Stoylen - Norwegian University of Science and Technology - Trondheim
- http://www.anaesthetist.com/icu/organs/heart/tee/
- Transesophageal Echocardiography J. van Schalkwyk - O. Larson
- http://info.med.yale.edu/intmed/cardio/imaging/techniques/echo_tee/
- Transesophageal Echocardiography Yale University
