Teilchenphysik: Von den Atomen zu den Elementarteilchen
Das Atom
[Bearbeiten]Bereits 400 vor Christus, im antiken Griechenland, vermutete der Philosoph Demokrit, dass die Welt aus unteilbaren Teilchen besteht - er bezeichnete sie, nach dem griechischen a-tomos für unteilbar, als Atome. In einem wörtlich erhaltenen Fragment des Demokrit heißt es:
"Nur der Meinung nach", sagt Demokrit, "gibt es süß, nur der Meinung nach bitter, warm, kalt, nur der Meinung nach Farbe, in Wahrheit gibt es nur Atome und den leeren Raum".
Es ist erstaunlich, dass ein Philosoph durch Denken allein zu so einer tiefen Aussage kam. Es ist allerdings wahrscheinlich, dass er ein Experiment zur Gewinnung von Süßwasser aus dem Meerwasser mittels Dialyse kannte, das von Aristoteles beschrieben wird. Im weiteren historischen Verlauf setzte sich jedoch Aristoteles' Auffassung der 5 Elemente durch, die die Naturwissenschaft der folgenden 2 Jahrtausende prägte.
Nachdem die Atom-Idee bis ins 18. Jahrhundert in Vergessenheit geraten war, wurde sie von John Dalton, dem Schöpfer der modernen Chemie, wieder aufgegriffen. Aber noch um 1900 war Ernst Mach, der berühmte österreichische Physiker und Philosoph, ein eifriger Gegner der Atomhypothese. Zu Anfang des zwanzigsten Jahrhunderts konnte man aber erstmals experimentell zeigen, dass die Welt wirklich aus Atomen aufgebaut ist, beispielsweise durch Beobachtung der Brownschen Bewegung und ihrer quantitativen Erklärung durch Einstein.
Sichtbarmachung der Atome
[Bearbeiten]Der schottische Botaniker Robert Brown entdeckte 1827 unter dem Mikroskop, dass Pollenkörner in einem Wassertropfen unregelmäßig zuckende Bewegungen machen. Er nahm zunächst an, dass dies ein Hinweis auf die "Lebenskraft" sei, deren Wirken lange Zeit vermutet wurde; Brown fand den Effekt aber später auch bei eindeutig unbelebten Staubkörnern. Das Video links zeigt die "Brownsche Bewegung" von Fetttröpfchen in Milch.
Die Brownsche Bewegung wird hier dadurch bewirkt, dass die bewegten Wassermoleküle der Umgebung unregelmäßig gegen die Fetttröpfchen stoßen, so dass sich manchmal eine etwas größere Kraft in der einen, manchmal in einer anderen Richtung ergibt. Die durchschnittliche Geschwindigkeit der Bewegungen hängt von der Temperatur des Mediums ab - je schneller sich die Moleküle bewegen, desto wärmer ist das Medium. Im Jahre 1905 gelang Albert Einstein die quantitative Beschreibung dieser Bewegung, wobei sich aus der Beobachtung der Bewegung die Größe der sogenannten Avogadro-Konstanten, der Anzahl der atomaren Teilchen in einem Mol einer Substanz, bestimmen lässt. Es war also nicht nur möglich geworden, die Bewegung der Moleküle infolge ihrer thermischen Energie indirekt zu beobachten, sondern auch ihre Zahl pro Masseneinheit zu bestimmen.

1951 wurde erstmals ein Mikroskop entwickelt, mit welchem man einzelne Atome "sehen" konnte. Seit den Achtzigerjahren des 20. Jahrhunderts ist es aber auch möglich, mit Hilfe des Rastertunnelmikroskops (oder dem verwandten Rasterkraftmikroskop) die atomare Struktur einer Festkörperoberfläche unmittelbar abzubilden.1 In dem Bild links wurde eine Graphit-Oberfläche bei Raumtemperatur, an Luft, mit Hilfe eines Rastertunnelmikroskops gemessen. Die Vergrößerung lässt sich an dem Maßstab rechts unten ablesen, der eine Länge von 0,5 nm = 0,5 × 10-9 m hat. Die regelmäßige Anordnung der Graphitatome ist offenkundig, und zwar sieht man diejenigen Oberflächenatome, die kein unmittelbares Nachbaratom in der nächst unteren Graphitschicht besitzen.
Einschub: Wie untersucht man kleinste Strukturen?
[Bearbeiten]Auch wenn wir uns der Thematik der experimentellen Teilchenphysik erst im dritten Teil des Buches widmen wollen, so ist es doch zum problemlosen Verständnis der folgenden Abschnitte nötig zu wissen, wie man zu dieser Erkenntnis kam. Wir wollen also hier erklären, wieso in der Teilchenphysik keine Mikroskope verwendet werden und woher die Teilchenphysik ihre Kenntnisse nimmt.
Wenn man beispielsweise die Struktur einer pflanzlichen oder tierischen Zelle untersuchen will, verwendet man bekanntlich ein Mikroskop. Die Auflösung (d.h. seine Fähigkeit, kleinste Objekte getrennt darzustellen) ist durch die Wellennatur des Lichtes begrenzt. Das heißt, man kann zwei Körnchen, die näher beisammen liegen als die Wellenlänge des Lichtes (etwa 500 nm = 5 × 10-7 m)2 nicht mehr unterscheiden. Benötigt man höhere Auflösung, so kann man z.B. ein Elektronenmikroskop verwenden. Die de Broglie-Wellenlänge des (als Materiewelle betrachteten) Elektronenstrahls ist über die Energie der Elektronen wesentlich kleiner wählbar, dadurch ist eine wesentlich bessere Auflösung möglich. Die Auflösungen solcher Mikroskope sind zwar bereits - wie wir oben gesehen haben - hoch genug um Atome darzustellen, um jedoch zu testen ob Atome wirklich elementar sind reichen solche Mikroskope nicht aus.
Eine andere Möglichkeit, kleinste Strukturen zu untersuchen, besteht darin, atomare Teilchen auf das Objekt zu schießen und damit deren Oberfläche bzw. Bestandteile abzutasten. Gemessen wird die Streuung dieser Teilchen - deshalb spricht man hier von Streuexperimenten. Jedoch haben nach der Quantenmechanik auch Teilchen Wellencharakter, somit gelten auch für diese Methode die obengenannten Einschränkungen der klassischen Licht-Mikroskopie. Um also immer kleinere Stukturen zu untersuchen, benötigt man Teilchenstrahlen mit möglichst kleiner Wellenlänge, dies läßt sich dadurch realisieren, dass man Teilchen mit hoher Energie, also sehr schnelle Teilchen verwendet. Hier kommen die Teilchenbeschleuniger mit denen wir uns im dritten Teil noch ausführlich beschäftigen werden zum Zuge. Auf diese Weise war es möglich, zunächst die Größe und Form der Atomkerne zu messen, dann die Größe und Form der Protonen, und schließlich hat man Strukturen innerhalb der Protonen entdeckt - aber dazu kommen wir noch.
Atomhülle und Atomkern
[Bearbeiten]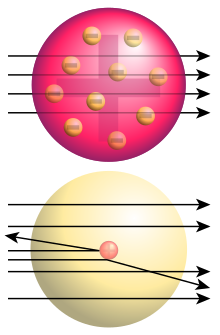
Joseph Thomson entdeckte 1897 die negativ geladenen Elektronen als Bestandteile des Atoms. Er nahm jedoch an, dass diese Elektronen in die (positive) Masse des Atoms eingebettet seien wie Rosinen in einen Kuchen. In den Jahren 1911 beschossen Hans Geiger und Ernest Marsden im Labor von Ernest Rutherford eine nur wenige tausend Atome dicke Goldfolie mit sogenannten Alphateilchen aus einer radioaktiven Quelle (Radium) und zählten die unter verschiedenen Winkeln gestreuten Teilchen. Alphateilchen sind Teilchen welche von einigen radioaktiven Teilchen ausgesendet werden. Es zeigte sich, dass die meisten Teilchen die Folie geradlinig durchsetzten; einige, wenige aber wurden um Winkel von über 140 Grad zurückgestreut. Das war, wie Rutherford sagte, "beinahe so unglaublich, als wenn man mit einer 15-Zoll-Granate auf ein Stück Seidenpapier schießt und die Granate zurückkommt und einen selber trifft". Aus diesem Messresultat schloss Rutherford, dass sich irgendwo im Inneren ein kleiner Körper hoher Dichte befinden musste, der in der Lage war, ein schnell fliegendes Teilchen nicht nur abzulenken, sondern zurückprallen zu lassen. Die Masse des Atoms befand sich also hauptsächlich in einem kleinen, zentralen Teil - dem Atomkern. Erstaunlich war auch, dass der größte Teil des Atoms weitgehend leer sein musste, denn die meisten Alphateilchen flogen durch die Goldschicht nahezu ungehindert hindurch. Besonders dieses Ergebnis war nur schwer zu verstehen, widersprach es doch augenscheinlich der üblichen Vorstellung von der Festigkeit der Materie.
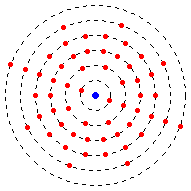
Aus dem Rutherfordschen Atommodell entwickelte der dänische Physiker Niels Bohr ein planetenartiges Atommodell. Danach bewegen sich die Elektronen auf bestimmten Bahnen um den Kern, wie Planeten die Sonne umkreisen. Die Bahnen werden auch als Schalen bezeichnet. Der Kern in der Mitte ist massiv und viel, viel kleiner als die Elektronenhülle (Faktor 104 also 10.000).
Das Bild links stellt die schalenmäßige Anordnung der 56 Hüllenelektronen im Bariumatom (Kernladungszahl Z = 56), gemäß dem bohrschen Atommodell, dar - wobei die Größenverhältnisse natürlich nicht korrekt sind.
Seit 1928 wissen wir, dass das Bohrsche Atommodell nicht korrekt ist, da die Elektronen gemäß der Quantenmechanik keine genaue Bahn besitzen. Der Atomkern ist von Orbitalen umgeben, welche die Aufenthaltswahrscheinlichkeit der Elektronen angibt. Da sich die Teilchenphysik jedoch nur am Rande mit den Orbitalen beschäftigt und ein Verständnis des Orbitalmodells Kenntnisse der Quantenmechanik erfordern würde, will ich hier nicht weiter darauf eingehen und mich lieber dem Atomkern widmen.
Der Aufbau des Atomkerns
[Bearbeiten]Der Atomkern ist kein elementares punktförmiges Teilchen, sondern hat eine endliche Größe. Beispielsweise hat der Kern des Bariumatoms einen Radius von etwa 6 fm (1 fm = 10-15 m). Der Atomkern ist aus sogenannten Nukleonen aufgebaut. Es gibt zwei verschiedene Nukleonen:
- Proton: Elektrische Ladung +1 e, Masse etwa 1836 Elektronenmassen
- Neutron: Elektrische Ladung 0 e, Masse etwas größer als beim Proton (1839 Elektronenmassen)
Protonen und Elektronen tragen die gleiche Ladung e = 1.6 x 10-19 C (Coulomb), nur mit entgegengesetztem Vorzeichen. Bei dieser Ladung handelt es sich um die Elementarladung, sie ist die kleinste Ladung, welche ein frei vorkommendes Teilchen besitzen kann. Wenn man in der Teilchenphysik von elektrischen Ladungen spricht, so gibt man diese immer in Vielfachen der Elementarladung an (Das gilt natürlich auch für dieses Buch).
In einem Atom ist normalerweise die Zahl der Protonen gleich der Zahl der Elektronen, daher ist das Atom normalerweise elektrisch neutral, weil sich die Ladungen, nach außen hin, aufheben. Die Elektronen bestimmen die chemischen Eigenschaften. Daher bestimmt die Anzahl der Protonen indirekt, um welches chemische Element es sich handelt - die Anzahl der Neutronen bestimmt, um welches Isotop des Elements es sich handelt. Die Zahl der Protonen heißt Kernladungszahl Z, die Zahl der Neutronen heißt N, die Gesamtzahl der Nukleonen heißt Kernmassenzahl A. Es ist Z + N = A.
Sie werden sich jetzt vielleicht fragen, wieso ein Atomkern stabil sein kann, da gleich geladene Teilchen (wie die Protonen) sich gegenseitig abstoßen. Tatsächlich würde ein Kern sofort zerfallen, wenn er nur aus Protonen bestünde. Es muss also eine weitere Kraft geben, welche die Nukleonen zusammenhält und dadurch den Atomkern stabilisiert. Diese Kraft heißt Starke Kraft - wir werden uns weiter unten noch mit ihr beschäftigen. Sie wirkt zwischen allen Nukleonen, also zwischen Neutronen und Neutronen, zwischen Protonen und Neutronen, und auch (zusätzlich zur elektrischen Kraft) zwischen Protonen und Protonen. Nur wenn ein genügend hoher Anteil an Neutronen im Kern vorhanden ist, ist diese Kraft stark genug, die Teilchen zusammenzuhalten. Dies erklärt auch, warum sehr große Atomkerne einen hohen Anteil an Neutronen haben. So besitzt das häufigste Sauerstoff-Isotop 8 Protonen und 8 Neutronen - das langlebigste Uran-Isotop besitzt hingegen 92 Protonen und 146 Neutronen. Damit ist die Materie um uns herum aus drei Teilchen: dem Elektron, dem Proton und dem Neutron, aufgebaut.


Das Nukleon
[Bearbeiten]Auch die Nukleonen sind ebenfalls nicht punktförmig, sondern haben eine endliche Größe (ungefähr 1 fm). In den 1960er-Jahren hat sich in Streuexperimenten gezeigt, dass die Nukleonen aus Quarks bestehen, die von Gluonen zusammengehalten werden. Die Gluonen sind dabei masselose Teilchen.
Der Name Quark geht auf Murray Gell-Mann zurück, der diesen Ausdruck im Buch "Finnegan's Wake" von James Joyce fand. Das ist das erste Beispiel der blumigen Sprache, wie sie Physiker bei der Beschreibung kleinster Teilchen verwenden. Während in der normalen makroskopischen Physik alle elektrischen Ladungen Vielfache der Elementarladung e sind, haben die Quarks nur Bruchteile dieser Ladung. In der normalen Materie, wie wir sie kennen, kommen nur zwei Arten von Quarks vor (später werden wir noch weitere kennen lernen): Das Up-Quark mit einer elektrischen Ladung von +2/3 und das Down-Quark mit einer Ladung von -1/3. Ein Proton besteht aus 2 Up- und einem 1 Down-Quark, das Neutron hingegen besteht aus 1 Up- und 2 Down-Quarks; die Ladungen sind daher 2/3 + 2/3 - 1/3 = 1, bzw. 2/3 - 1/3 - 1/3 = 0 (immer in Einheiten der Elementarladung e).
Freie Quarks (mit Bruchteilen der Elementarladung) hat man trotz eifriger Suche noch nie gefunden; die Quarks kommen nur in Gruppen von drei, zwei - oder ganz selten auch fünf - Quarks vor.
Auch die Quarks haben hübsche blumige Namen, wie wir noch sehen werden; die Bezeichnungen "Up" und "Down" haben jedenfalls nichts mit einer Richtung im Raum zu tun.
1) Es sei angemerkt, dass es heute etliche Mikroskope gibt, mit welchen man Atome sichtbar machen kann.
2) Zur Erklärung der Schreibweise der Zahlen und zu den Präfixen der Einheiten siehe den Anhang A.

