Biochemie und Pathobiochemie: Glutathion-Stoffwechsel
Allgemeines
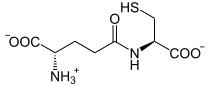
[Bearbeiten]Glutathion ist ein Tripeptid aus Glutamat, Cystein und Glycin. Es wirkt mit seiner SH-Gruppe vor allem in Erythrozyten als Antioxidans. Für seine Regeneration ist die ständige Zufuhr von NADPH + H+ aus dem Pentosephosphatweg notwendig.
Biosynthese und Abbau von Glutathion (GSH) - der γ-Glutamyl-Zyklus
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| L-Glutamat, ATP
ADP, Pi |
Glutamat--Cystein-Ligase (γ-Glutamyl- cystein-Synthetase) | 6.3.2.2 | Lig | Glutamat--Cystein-Ligase-Defizienz | ||||||
|
||||||||||
| Glycin, ATP
ADP, Pi |
Glutathion-Synthase | 6.3.2.3 | Lig | Hämolyt. Anämie, 5-Ketoprolinurie | ||||||
|
||||||||||
| H2O | γ-Glutamyltransferase (γ-GT) | 2.3.2.2 | Tr | Glutathionurie | ||||||
|
|
oder |
|||||||||
|
||||||||||
| H2O | Zn | Membran-Alanyl-Aminopeptidase | 3.4.11.2 | Hyd | ||||||
|
||||||||||
Glutathion (γ-L-Glutamyl-L-cysteinylglycin, GSH) ist ein Tripeptid aus L-Glutamat, Glycin und L-Cystein. Die Bindung zwischen L-Cystein und L-Glutamat ist dabei etwas ungewöhnlich, da die Peptidbindung hier über die γ-Carboxylgruppe von Glutamat gebildet wird. Dies schützt die Bindung vor der Spaltung durch intrazelluläre Peptidasen.
Die Gamma-Glutamyltransferase (γ-GT) kann den γ-Glutamyl-Rest auch vom Glutathion auf andere Aminosäuren übertragen.
Die Synthese des Tripeptids benötigt keine Ribosomen.
Auf einem Nebenweg entsteht 5-Ketoprolin
[Bearbeiten]Abbau von γ-Glutamylcystein zu Glutamat und Cystein
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| γ-Glutamylcyclotransferase | 2.3.2.4 | Tr | ||||||||
|
||||||||||
| 2 H2O, ATP
ADP, Pi |
5-Ketoprolinase (Pyroglutamase) | 3.5.2.9 | Hyd | 5-Ketoprolinase-Defizienz | ||||||
|
||||||||||
γ-Glutamylcystein wird über zwei enzymatische Schritte unter ATP-Verbrauch zu Cystein und Glutamat gespalten. Zwischenprodukt ist 5-Ketoprolin. Dieser Weg wird insbesondere bei der schweren Glutathion-Synthase-Defizienz (5-Ketoprolinurie) aktiviert. Ansonsten fließt γ-Glutamylcystein überwiegend in die GSH-Biosynthese, da die Glutathion-Synthase für γ-Glutamylcystein einer höheren Affinität aufweist als die γ-Glutamylcyclotransferase.
Abbau von γ-Glutamyl-Aminosäuren zu Glutamat und Aminosäure
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
|
|
γ-Glutamylcyclotransferase | 2.3.2.4 | Tr | |||||||
|
||||||||||
| 2 H2O, ATP
ADP, Pi |
5-Ketoprolinase (Pyroglutamase) | 3.5.2.9 | Hyd | 5-Ketoprolinase-Defizienz | ||||||
|
||||||||||
Die γ-Glutamylcyclotransferase spaltet analog zu oben auch γ-Glutamylreste von anderen Aminosäuren ab, die zuvor im γ-Glutamylzyklus auf die Aminosäuren übertragen wurden (s.o.). Auch dabei entsteht 5-Ketoprolin.
Biologische Funktionen
[Bearbeiten]Glutathion schützt mit seiner reduzierten Sulfhydrylgruppe (SH-Gruppe von Cystein) Hämoglobin in Erythrozyten u.a. Proteine (z.B. in der Leber) vor der Oxidation durch freie Radikale (Hydroxyl-Radikal, Lipidperoxyl-Radikal, Peroxynitrit, H2O2), in dem es sich selbst für Oxidationsvorgänge zur Verfügung stellt, d.h. Elektronen resp. Wasserstoff abgibt. Dadurch kann es z.B. das stark oxidativ wirkende Wasserstoffperoxid (H2O2), das bei verschiedenen Reaktionen frei wird, zu Wasser entgiften. Diese Vorgänge können enzymatisch katalysiert werden oder spontan ablaufen.
Regeneriert wird die oxidierte Form des Glutathions hauptsächlich von der Glutathionreduktase. Die dafür benötigten Elektronen bezieht das Enzym aus NADPH/H+, welches wiederum im 1. Teil des Pentosephosphatwegs aus NADP+ regeneriert wird.
NADP+ kann ebenfalls von der Isocitrat-Dehydrogenase im Citratzyklus zu NADPH/H+ reduziert werden. Diese Möglichkeit haben Erythrozyten wegen der fehlenden Mitochondrien jedoch nicht.
Weitere Aufgaben von Glutathion:
- Glutathion geht in die Biosynthese der Leukotriene C4, D4 und E4 ein.
- Der γ-Glutamyl-Zyklus resp. die γ-Glutamylierung von Aminosäuren dient zum Aminosäuren-Transport in die Zelle.
- Glutathion ist an der Biotransformation Phase II beteiligt.
- Glutathion dient als „Cystein-Transporter“ im Körper.
- Die Glutathionylierung modifiziert die Funktion von verschiedenen Proteinen, z.B. Thioredoxin, Ubiquitin-konjugierendes Enzym und Cytochrom-c-Oxidase.
- Bindung von Stickoxid (NO).
Arbeitsweise von Glutathion als Reduktionsmittel
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| Protein-disulfid
Protein-dithiol |
Protein-disulfid-Reduktase (Glutathion) | 1.8.4.2 | Ox | |||||||
|
2 H2O |
oder | Selen | oder
Glutathion-Peroxidase |
1.11.1.9 | Ox | Glutathion-Peroxidase-Def. | ||||
|
||||||||||
| NADPH/H+ | FAD | Glutathion-disulfid-Reduktase | 1.8.1.7 | Ox | Glutathion-disulfid-Reduktase-Def. | |||||
|
||||||||||
Regulation
[Bearbeiten]Die GSH-Produktion und der GSH-Verbrauch resp. die Balance zwischen GSH und GSSG untersteht zahlreichen Einflüssen.
- Die Expression/Aktivität der γ-Glutamylcystein-Synthetase (GCS), des geschwindigkeitsbestimmenden Enzyms, wird durch zahlreiche Faktoren erhöht:
- Oxidativer Stress (via NFκB), nitrosativer Stress
- Inflammation (via NFκB), Krebs, Chemotherapie, ionisierende Strahlung
- Inhibition der GCS-Aktivität
- GSH-Depletion (via NFκB), GSH-Konjugation
- Prostaglandin A2, Schwermetalle, Antioxidantien, Insulin
- Erhöhte Zufuhr von Cystein, Cystin, N-Acetyl-Cystein, Methionin.
- Die Expression/Aktivität der GCS wird vermindert durch:
- Proteinmangel (Glutamat, Cystein, Glycin!)
- Hyperglykämie
- GCS-Phosphorylierung
- Hormone/Zytokine:
- Dexamethason
- Erythropoietin
- TGFß (tumor growth factor ß)
- NO-Anstieg: S-Nitrosation von GCS durch NO-Donatoren. (Link zur Stickoxid-Synthase).
Transport
[Bearbeiten]GSH bzw. γ-Glutamylcystein wird vor allem in der Leber transportiert und dann über den Blutweg an die extrahepatischen Organe (v.a. Niere, Lunge, Darm) geliefert. Wegen des hohen GSH-Gradienten wird GSH schlecht in die Zelle aufgenommen. Daher wird es dort zerlegt und nach Aufnahme in die Zelle neu synthetisiert. γ-Glutamylcystein kann auch direkt aufgenommen werden.
Pathobiochemie
[Bearbeiten] |
 |
 |
Die Glucose-6-phosphat-Dehydrogenase ist ein Enzym des HMP-Wegs. Ein G6PDH-Mangel führt zum NADPH-Mangel im Erythrozyt, dadurch zur mangelhaften Re-Reduktion des Glutathions und als Folge zu hämolytischen Krisen. Zu ähnlichen Symptomen führen auch andere seltenere Defekte der Glutathion-Stoffwechsel-Enzyme, was die Bedeutung dieses Reduktionssystems für den Erythrozyten unterstreicht.
Die Glutathion-Peroxidase enthält die in Proteinen selten anzutreffende Aminosäure Selenocystein, die im Genom durch ein Stop-Codon (UGA) kodiert wird. Ein Selenmangel, wie er endemisch in einigen Regionen Chinas vorkommt führt zur Keshan-Krankheit, einer schweren Kardiomyopathie. Die Beteiligung des humanen Coxsackievirus B3 an der Pathogenese wird diskutiert.
Klinische Chemie
[Bearbeiten]Die γ-GT (GGT) im Serum ist leber- und gallengangsspezifisch, obwohl das Enzym auch in vielen anderen Geweben vorkommt. Die Bestimmung des γ-GT-Spiegels wird daher in der Leber- und Gallenwegs-Diagnostik genutzt. Das Enzym ist membrangebunden und steigt schon bei geringen zellulären Schäden an. Seine Sensitivität ist damit höher als die der GOT und GPT. Der γ-GT-Spiegel korreliert mit dem Ausmaß der Leberschädigung. Die HWZ beträgt 3-4 Tage.
Weblinks: Laborlexikon - Gamma-GT
Toxikologie
[Bearbeiten]Beim Abbau von Paracetamol in der Leber entsteht das reaktive N-Acetyl-p-benzochinonimin (NAPQI), das normalerweise durch Glutathion unschädlich gemacht wird. Bei einer Paracetamolvergiftung erschöpft sich die Entgiftungskapazität des Glutathions und NAPQI beginnt die Zellbestandteile zu schädigen. Die Symptome des Leberversagens stellen sich oft erst nach einer symptomarmen Latenzzeit von 12 bis 24 h ein. In den ersten Stunden nach der Einnahme ist die Zufuhr von N-Acetylcystein (ACC, NAC) erfolgsversprechend. NAC besitzt ebenfalls SH-Gruppen und kann die Glutathion-Lücke schließen.
Literatur
[Bearbeiten]PMID 14988435 PMID 12818476 PMID 18158646 PMID 10569625 PMID 10385608 PMID 19166318 PMID 18601945
Weblinks
[Bearbeiten]- KEGG: Glutathione metabolism - Homo sapiens (human)
- PDB Molecule of the Month - Selenocystein-Synthase
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.