Biochemie und Pathobiochemie: Cobalamin-Stoffwechsel
 |
 |
Biosynthese / Herkunft
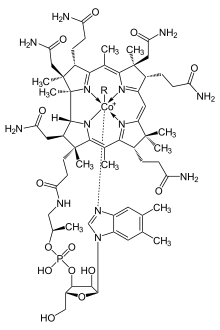
[Bearbeiten]Der Biosynthese-Weg der Cobalamine zweigt vom Häm-Syntheseweg (Uroporphyrinogen III) ab. Das wasserlösliche Vitamin wird nur von Bakterien und Archaeen gebildet und besteht aus einem Corrin-Ringsystem, das zentral ein Kobaltion komplexiert. Anders als beim Häm-Molekül ist das Ringsystem nicht durchgehend Mesomerie-stabilisiert, d.h. die konjugierten Doppelbindungen sind nicht rundum vorhanden.
Die Resorption im terminalen Ileum durch Rezeptor-vermittelte Endozytose erfordert die Bindung von Vitamin B12 an das Glycoprotein intrinsic factor, der von den Belegzellen des Magens gebildet wird. Vitamin B12 wird im Blut von einem spezifischen Transportprotein befördert und in der Leber gespeichert. Da der Bedarf sehr gering ist kann es bei einer Unterversorgung mehrere Monate bis Jahre dauern, bis Mangelsymptome eintreten.
Chemische Formen
[Bearbeiten]Die 6. Koordinationsstelle des Kobalt-Ions kann verschieden besetzt sein, so dass die verschiedenen Cobalamine resultieren, die auch ineinander umgewandelt werden können:
- Hydroxycobalamin - R: Hydroxyl-Gruppe (-OH)
- Adenosylcobalamin - R: Adenosin
- Desoxyadenosylcobalamin - R: Deoxyadenosin
- Cyanocobalamin - R: Cyanid (-C≡N)
- Methylcobalamin - R: Methyl-Gruppe (-CH3)
Biologische Funktionen
[Bearbeiten]- (5'-Desoxy)Adenosylcobalamin (AdoCbl) findet sich in den Mitochondrien als Cofaktor der Methylmalonyl-CoA-Mutase, die für die Umlagerung von Alkylresten sorgt, z.B. die Isomerisierung von Methylmalonyl-CoA zu Succinyl-CoA beim Abbau von Propionyl-CoA.
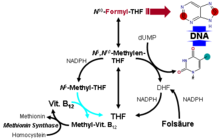
- Methylcobalamin (MeCbl) ist im Zytosol zu finden als Cofaktor der Methionin-Synthase, die die Remethylierung von Homocystein zu Methionin katalysiert (und damit auch die Regeneration des Methylgruppenüberträgers S-Adenosylmethionin), wobei die Methylgruppe von der N5-Methyl-THF stammt (Regeneration von THF).
Stoffwechselwege im Detail
[Bearbeiten]Bildung von Cobalamin II
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| ? | ||||||||||
|
||||||||||
| LMBRD1 (lysosomal cobalamin exporter) | MMA und Homocystinurie, Typ cblF | |||||||||
|
||||||||||
| ?
? |
MMACHC | MMA und Homocystinurie, Typ cblC | ||||||||
|
||||||||||
| ?
? |
MMADHC (C2orf25) | MMA und Homocystinurie, Typ cblD | ||||||||
|
||||||||||
Bildung von Adenosylcobalamin (AdoCbl) aus Cbl II
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| ?
? |
MMADHC (C2orf25) | MMA, Typ cblD, Variante 2 | ||||||||
|
||||||||||
| ?
? |
MMAB (Cob(I)alamin-Transferase) | Tr | MMA, Typ cblB | |||||||
|
||||||||||
| ?
? |
MMAA | MMA, Typ cblA | ||||||||
|
||||||||||
Bildung von Methylcobalamin (MeCbl) aus Cbl II
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| ?
? |
MMADHC (C2orf25) | Homocysteinurie, Typ cblD, Variante 1 | ||||||||
|
||||||||||
| NADPH/H+, 2 SAM | FAD, FMN | Methionin-Synthase-Reduktase | 1.16.1.8 | Ox | Homocysteinurie, Typ cblE | |||||
|
||||||||||
Die Methionin-Synthase-Reduktase regeneriert das spontan oxidierte Cob(II)alamin in der Methionin-Synthase mittels einer reduktiven Methylierung mit Hilfe von S-Adenosylmethionin (SAM) und NADPH/H+, da nur das reduzierte Methylcob(I)alamin als Kofaktor wirken kann.
Pathobiochemie
[Bearbeiten]B12-Mangel
[Bearbeiten]Ursachen:
- Intrinsic-Faktor-Mangel bei: Z.n. Gastrektomie, chronische Typ-A-Gastritis, Malabsorptionssyndrom (z.B. Sprue), Kurzdarmsyndrom, Fischbandwurmbefall.
- Dünndarm-Fehlbesiedlungen (insbesondere Störungen im Ileum).
- Hereditäre Störungen.
- Höchst selten bei einseitiger Ernährung.
Pathogenese:
- Durch die Schnittstelle von Folsäure und Cobalamin im Stoffwechselschritt der Methionin-Synthese, kommt es bei einem Mangel an Cobalamin auch zu einer mangelhaften Rückgewinnung von THF aus N5-Methyl-THF. Da für die Purinnukleotidsynthese (AMP, GMP) N10-Formyl-THF und für die dTMP-Synthese aus dUMP (Pyrimidine) N5,N10-Methylen-THF benötigt wird, kommt es nachfolgend zu Störungen der DNA- und RNA-Synthese. Besonders betroffen sind regenerationsfreudige Organe mit hoher Zellteilungsrate wie Knochenmark und Schleimhäute.
- Vitamin B12-Mangel führt ebenfalls über die B12/Folat-Schnittstelle auch zu einem Mangel an S-Adenosylmethionin, was neben der DNA/RNA-Synthesestörung zu den neurologischen Störungen führen soll.
- Das nicht isomerisierte Methylmalonyl-CoA wird verstärkt zu Methylmalonat hydrolysiert. Methylmalonsäure soll einen allgemeinen toxischen Effekt haben. Der Nachweis im Urin ist ein empfindlicher Indikator für Vitamin B12-Mangel.
Klinisches Krankheitsbild:
- Perniziöse Anämie (makrozytäre megaloblastäre Anämie), sensorische Neuropathie (20-30 %), Glossitis, Diarrhö.
Genetische Störungen des Cobalaminstoffwechsels
[Bearbeiten]Enzymdefekte können die Bereitstellung von Cobalamin II - der gemeinsamen Vorstufe von Adenosylcobalamin und Methylcobalamin - oder isoliert einen der beiden Pfade betreffen. Dadurch werden die davon abhängigen Enzyme Methylmalonyl-CoA-Mutase und/oder Methionin-Synthase in ihrer Funktion beeinträchtigt mit der Folge einer Methylmalonylacidämie (durch gestörten Abbau von Propionyl-CoA) und/oder Homocysteinämie (durch Störung der Methionin-Rückgewinnung aus Homocystein).
Pharmakologie und Toxikologie
[Bearbeiten]Hydroxocobalamin eignet sich zur Behandlung von Cyanid-Vergiftungen.
Literatur
[Bearbeiten]- Manoli I, Venditti CP., et al.. “Methylmalonic Acidemia”. Gene Reviews,. PMID 20301409.
- Watkins D, Rosenblatt DS. “Inborn errors of cobalamin absorption and metabolism”. Am J Med Genet C Semin Med Genet, 157:33–44, February 2011. DOI:10.1002/ajmg.c.30288. PMID 21312325.
- Froese DS, Gravel RA. “Genetic disorders of vitamin B₁₂ metabolism: eight complementation groups--eight genes”. Expert Rev Mol Med, 12:e37, 2010. DOI:10.1017/S1462399410001651. PMID 21114891.
- Morel CF, Watkins D, Scott P, Rinaldo P, Rosenblatt DS. “Prenatal diagnosis for methylmalonic acidemia and inborn errors of vitamin B12 metabolism and transport”. Mol. Genet. Metab., 86:160–71, 2005. DOI:10.1016/j.ymgme.2005.07.018. PMID 16150626.
Weblinks
[Bearbeiten]
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.
