Biochemie und Pathobiochemie: Methionin-Stoffwechsel
Allgemeines
[Bearbeiten]L-Methionin ist eine essentielle, schwefelhaltige proteinogene Aminosäure. Das Methionin-Derivat S-Adenosylmethionin dient an vielen Stellen des Stoffwechsels als Methylgruppen-Lieferant. Weiterhin ist die Bildung der Aminosäure Cystein aus Serin mit dem Methionin-Abbau verknüpft. Die Rückgewinnung von Methionin aus Homocystein benötigt Cobalamin und Folsäure (5-Methyl-THF), dabei wird 5-Methyl-THF, die Transportform der Folsäure im Blut, in die biologisch vielseitiger einsetzbare Tetrahydrofolsäure (THF) überführt.
== Abbau von Homocystein
==
| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| ATP
3 Pi |
Methionin- Adenosyltransferase | 2.5.1.6 | Tr | Hypermeth- ioninämie | ||||||
|
||||||||||
| Akzeptor
Akzeptor-CH3 |
Akzeptor
Akzeptor-CH3 |
Bsp.:
DNA(Cytosin-5-)- Methyltransferase |
2.1.1.37 | Tr | ICF-S. | |||||
|
||||||||||
| H2O | H2O | NAD | Adenosylhomocysteinase | 3.3.1.1 | Hyd | Hypermeth- ioninämie | ||||
|
||||||||||
|
Pyridoxal- phosphat | Cystathionin-β-Synthase | 4.2.1.22 | Ly | Homo- cystinurie I | |||||
|
||||||||||
|
Pyridoxal- phosphat | Cystathionin-γ-Lyase | 4.4.1.1 | Ly | Cystathio- ninurie | |||||
|
||||||||||
| CoA-SH, ?
CO2, ? |
NAD | α-Ketosäure-Decarboxylase | ? | ? | ||||||
|
||||||||||
Biologische Rolle
[Bearbeiten]Das schwefelhaltige L-Methionin ist eine für den Menschen und viele Tiere essentielle Aminosäure. Der Abbauweg von Methionin hat mehrere Bedeutungen:
- Produktion des Methylgruppen-Donors S-Adenosylmethionin (SAM).
- Bildung der proteinogenen schwefelhaltigen Aminosäure L-Cystein aus L-Serin (L-Cystein ist für Säuglinge eine essentielle Aminosäure, da bei ihnen die entsprechende Enzymausstattung noch nicht ausgereift ist.)
- Abbau des Restes zu Propionyl-CoA.
Funktion von S-Adenosylmethionin als Methylgruppen-Donor
[Bearbeiten]- Im Stoffwechsel der aromatischen Aminosäuren bzw. der biogenen Amine:
- Methylierung von DNA-Basen, z.B. von Cytosin zu 5-Methylcytosin
- Methylierung von Guanidinoacetat zu Kreatin
- Biosynthese von Carnitin aus Lysin
- Methylierung von Ethanolamin zu Cholin
- Methylierung von Glycin zu Sarcosin (wahrscheinlich zur Senkung des S-Adenosylmethionin-Angebots)
- Biosynthese von Ubichinon
- Methylierung von Cobalamin zu Methylcobalamin zur Verwendung an der Methionin-Synthase (reduktive Methylierung)
Rückgewinnung von Methionin aus Homocystein
[Bearbeiten]| (⇓) | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| THF | Methylcobalamin, Zn | Methionin-Synthase | 2.1.1.13 | Tr | Methylcobalamin-Def., Typ cblG | |||||
| ferner: | Zn | ferner:
Betain--Homocystein- S-Methyltransferase |
2.1.1.5 | Tr | ||||||
|
||||||||||
Da u.U. mehr Methyl-Gruppen bzw. S-Adenosylmethionin benötigt wird, als Methionin abgebaut wird, kann Methionin durch Methylierung von Homocystein regeneriert werden. Die Methylgruppe stammt dabei entweder aus dem Folsäure-Stoffwechsel (also meist aus dem Serin- und Glycin-Abbau) oder aus dem Cholin-Abbau (Betain). Die mit Folat arbeitende Methionin-Synthase benötigt Cobalamin (Vitamin B12) als Cofaktor. Die 2. Funktion dieses Stoffwechselschritts besteht darin, die Transportform der Folsäure 5-Methyl-THF in die biologisch aktivere Tetrahydrofolsäure (THF) umzuwandeln.
Die Methionin-Synthase ist auf reduziertes (Methyl-)Cob(I)alamin als Kofaktor angewiesen. Dieses wird im Laufe der Zeit jedoch zu Cob(II)alamin oxidiert und damit die Enzymaktivität herabgesetzt. Reaktiviert wird das Enzym bzw. der Kofaktor durch eine reduktive Methylierung an der Methionin-Synthase-Reduktase mit S-Adenosylmethionin (SAM) als Methylgruppen-Donor.
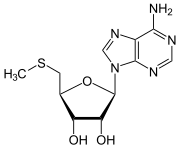
Bildung von 5'-Methylthioadenosin
[Bearbeiten]Im Rahmen der Polyaminbiosynthese wird S-Adenosylmethioninamin benötigt, um die basischen Polyamine Spermidin und Spermin mit Aminopropyl-Resten zu verlängern. Es entsteht 5'-Methylthioadenosin, das im Folgenden wieder zu Methionin recycliert werden kann.
| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
|
|
Pyruvat | Adenosylmethionin- Decarboxylase | 4.1.1.50 | Ly | ||||||
|
||||||||||
| Putrescin/Spermidin | Spermidin-Synthase | 2.5.1.16 | Tr | |||||||
| Spermin-Synthase | 2.5.1.22 | Tr | Snyder-Robinson-S. | |||||||
|
||||||||||
Methionin-Salvage
[Bearbeiten]Der Salvage-(Rückgewinnungs-)Weg für Methionin verhindert, dass Schwefel energieaufwändig neu assimiliert werden muss. Die auf die Polyamine übertragene Aminopropylgruppe wird in sechs Reaktionsschritten wieder aus dem Ribosering hergestellt.
| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| Pi | S-Methyl-5-thioadenosin- Phosphorylase | 2.4.2.28 | Tr | |||||||
|
||||||||||
| 5′-Methylthioribose-1-phosphat-Isomerase | 5.3.1.23 | Iso | ||||||||
|
||||||||||
|
H2O |
5′-Methylthioribulose-1-phosphat-Dehydratase | 4.2.1.109 | Ly | |||||||
|
||||||||||
| H2O
Pi, 2H+ |
Enolase-Phosphatase E1 | 3.1.3.77 | Hy | |||||||
|
||||||||||
| O2
Formiat |
Acireducton-Dioxygenase | 1.13.11.54 | Ox | |||||||
|
||||||||||
| R-CH(NH3+)-COO−
R-CO-COO− |
(Transaminase) | 2.6.1.- | Tr | |||||||
|
||||||||||
Weblinks
[Bearbeiten]- KEGG: Cysteine and methionine metabolism - Homo sapiens (human)
- KEGG: Propanoate metabolism - Homo sapiens (human)
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.