Biochemie und Pathobiochemie: Cholin-Stoffwechsel
Allgemeines
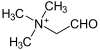
[Bearbeiten]Cholin entspricht chemisch einem Ethanolamin, das am Stickstoffatom 3fach methyliert wurde.
Bildung und Abbau von Acetylcholin
[Bearbeiten]| ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. |
|---|---|---|---|---|---|---|---|
| Acetyl-CoA | 1. |
H2O |
1) Cholin-O-Acetyltransferase | 2.3.1.6 | Tr | Kongenitales Myasthenie-Syndrom mit episodischer Apnoe (CMS-EA) | |
| 2) Acetylcholinesterase | 3.1.1.7 | Hyd | |||||
 |
 |
Das kationische Acetylcholin ist ein wichtiger Neurotransmitter an der Muskelendplatte, im Gehirn, in den vegetativen Ganglien, an den parasympathischen Nervenenden sowie an der sympathischen Schweißdrüseninnervation. Im synaptischen Spalt wird es von der Acetylcholinesterase inaktiviert.
Pharmakologie und Toxikologie: Die Acetylcholinesterase kann durch Medikamente (Acetylcholinesterasehemmer, indirekte Parasympathomimetika) gehemmt werden. Damit können z.B. die postoperative Darmatonie (durch cholinerge Anregung der Darmmotilität), das Glaukom (durch Verengung der Pupille mit Erweiterung des Kammerwinkels), die Myasthenia gravis (durch Erhöhung der Acetylcholinkonzentration an der Muskelendplatte) und die Alzheimerdemenz (durch Erhöhung des kortikalen Acetylcholinangebots) behandelt werden. Weiterhin kann damit die Wirkung von Atropin (ein Muskarinrezeptorblocker) und nicht-depolarisierenden Muskelrelaxantien (Acytylcholinrezeptorblocker) antagonisiert werden. Zu den Giften, die hier angreifen, gehören z.B. die Alkylphosphate, die die Acetylcholinesterase durch Phosphorylierung längerfristig hemmen. Zu dieser Gruppe gehören das Parathion (E605), früher als Insektenvertilger eingesetzt, und die Kampfgase Tabun, Sarin und VX. Die Vergiftung führt zum cholinergen Syndrom mit Muskelkrämpfen und vegetativer Entgleisung (Miosis, Schwitzen, Hypersalivation, Bronchialhypersekretion und -spasmen, Bradykardie, Blutdruckabfall, Diarrhoe und Bauchkrämpfe, Harndrang).
Biosynthese von Phosphocholin und CDP-Cholin
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. |
|---|---|---|---|---|---|---|---|
| ATP
ADP |
1. |
Pi
H2O |
1) Cholin-Kinase | 2.7.1.32 | Tr | ||
| Mg / Co / Mn | 2) Phosphoethanolamin-/ Phosphocholin-Phosphatase | 3.1.3.75 | Hyd | ||||
| CTP
PPi |
Cholin-phosphat- Cytidylyltransferase | 2.7.7.15 | Tr | ||||
 CDP-Cholin CDP-Cholin
|
|||||||
Das CDP-Cholin wird benötigt für die Biosynthese von Phosphatidylcholin (Lecithin).
Biosynthese von Betain und Abbau zu Glycin
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
| Ox. Akz.
Red. Akz. |
PQQ | Cholin-Dehydrogenase | 1.1.99.1 | Ox | ||||||
| H2O, FAD | PQQ | Cholin-Dehydrogenase | 1.1.99.1 | Ox | ||||||
|
||||||||||
| L-Homocystein | Zn | Betain--Homocystein- S-Methyltransferase | 2.1.1.5 | Tr | ||||||
| H2O, Ox. Akz.
Formaldehyd, Red. Akz. |
FAD | Dimethylglycin-Dehydrogenase | 1.5.99.2 | Ox | DMGDH-Def. | |||||
| H2O, O2
H2O2 |
FAD | Sarcosin-Oxidase | 1.5.3.1 | Ox | ||||||
|
Red. Akz. |
oder | FMN | oder
Sarcosin-Dehydrogenase |
1.5.99.1 | Ox | Sarcosinämie | ||||
Umkehrung des letzten Schritts:
| ( ⇓ ) | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. |
|---|---|---|---|---|---|---|---|
| S-Adenosyl-L-Homocystein | Glycin-N-Methyltransferase | 2.1.1.20 | Tr | GNMT-Def. | |||
Betain agiert als Methylgruppendonor im Methionin-Stoffwechsel zur Rückgewinnung von Methionin aus Homocystein.
Die Glycin-N-Methyltransferase-Reaktion dient wahrscheinlich nicht der Biosynthese von Sarcosin, dem keine physiologische Bedeutung zukommt, sondern der Regulation des S-Adenosyl-L-Methionin/S-Adenosyl-L-Homocystein-Quotienten in Leber und Pankreas. Durch die Reaktion kann die Konzentration des Methylgruppendonors S-Adenosyl-L-Methionin verringert werden, der beim Methionin-Abbau anfällt, wenn sonst keine Verwendung für die Methylgruppen besteht.
Weblinks
[Bearbeiten]- KEGG: Glycerophospholipid metabolism - Homo sapiens (human)
- KEGG: Glycine, serine and threonine metabolism - Homo sapiens (human)
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.