Praktikum Organische Chemie/ Trennung und Isolierung niedermolekularer organischer Verbindungen/ Trennungen durch Destillation
Diese Seite ist noch nicht ganz fertig
Trennungen durch Destillation
[Bearbeiten]Bekanntlich tritt beim Erhitzen einer flüssigen Substanz (Flüssigkeit) das Phänomen des Siedens auf, wenn ihr Dampfdruck den äußeren Druck erreicht hat. Bei der Siedetemperatur, oft als Siedepunkt (Sdp.) oder Kochpunkt (Kp.) bezeichnet, findet an der Grenzfläche ein Übergang zwischen flüssiger Phase und Dampfphase (Gasphase) statt. Beim Destillieren wird dem Dampf in einem Kühler Energie entzogen, so dass er kondensiert und als Flüssigkeit aufgefangen werden kann.
Das Verfahren der Destillation ist eine der ältesten Methoden zur Trennung flüchtiger von nicht-flüchtigen Stoffen. In den vorangehenden Praktikumsversuchen wurde die einfachste Variante bereits geübt: Beim Konzentrieren (Einengen) von Lösungen im Rotationsverdampfer soll der Hilfsstoff „Solvens“ selektiv entfernt werden, während die gelösten Substanzen im Kolben zurückbleiben sollen. Das Lösungsmittel ist flüchtig, die extrahierten Stoffe möglichst wenig flüchtig.
Die Flüchtigkeit eines Stoffes wird durch dessen Dampfdruck definiert. Der Dampfdruck gibt an mit welchem Druck die Flüssigkeitsteilchen in den gasförmigen Aggregatzustand übertreten, wobei der Dampf mit der flüssigen Phase im Gleichgewicht steht. Flüchtige Substanzen, z. B. Lösungsmittel, haben relativ hohe Dampfdrücke, lassen sich also mit geringem Energieaufwand in die Gasphase überführen. Es gilt prinzipiell der Zusammenhang hoher Dampfdruck bedeutet eine niedrige Siedetemperatur und ein niedriger Dampfdruck eine hohe Siedetemperatur.
Destillationen können systematisch, d.h. in der Theorie, als Untergruppe eines Kapitels „Trennungen von Substanzen mit verschiedenem Dampfdruck“ aufgefasst werden. Die Methode der Sublimation wäre der Destillation an die Seite zu stellen.
Die Standard-Apparatur zur Destillation
[Bearbeiten]Neben dem später in die Labortechnik eingeführten Rotationsverdampfer wird als einfachstes Gerät eine Anordnung benutzt, die aus Siedekolben, Destillieraufsatz, Destillationsthermometer, absteigendem Liebig-Kühler, Vorstoß und Vorlagekolben besteht. Früher verwendete man für die Verbindung der einzelnen Komponenten einer Destillationsapparatur Kork- oder Gummistopfen. Heute sind Normschliff-Verbindungen (Kegel und Hülse, Normschliffgröße NS 29 oder NS 14,5) selbstverständlich. Diese müssen jedoch (sparsam!) gefettet werden, in der Regel mit Silikonfett. Es gibt auch polierte Normschliffe, die ohne Fett auskommen, jedoch teuer sind.
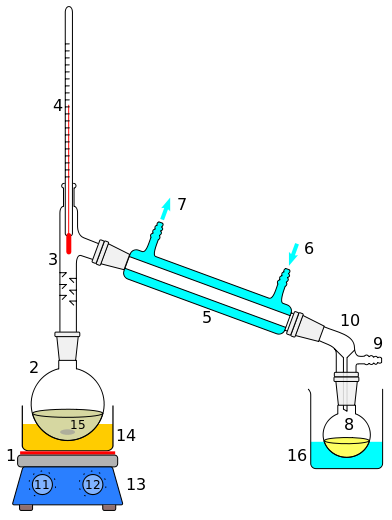
Bild 9-1. Aufbau einer Apparatur zur „einfachen Destillation“ im Labor. 1: Heizquelle (im Bild durch Heizplatte des Magnetrührgeräts), 2: Destillierkolben, 3: Destillieraufsatz (im Bild mit Einstichen als Spritzschutz, nicht unbedingt notwendig), 4: Thermometer, 5: Liebig-Kühler, 6: Kühlwassereingang, 7: Kühlwasserausgang, 8: Rundkolben (Vorlage) für das Destillat, 9: Druckausgleich, bei der Vakuumdestillation Schlauchverbindung zur Vakuumpumpe, 10: Vorstoß, 11: Regler für die Badtemperatur 12: Regler für die Drehzahl des Magnetrührers, 13: Magnetrührgerät mit Heizplatte, 14: Heizbad (Wasserbad, Ölbad), 15: Magnetrührstab oder Siedesteine, 16: Kühlbad, evt. Eisbad. Um beim Kühlen das Eindringen von Feuchtigkeit (Kondensation feuchter Luft) in das Destillat zu verhindern, verbindet man den "Druckausgleich" (9) mit einem Trockenrohr, das z. B. Calciumchlorid enthält.
Die zu destillierende Flüssigkeit wird in den Siedekolben gefüllt, wobei man in der Regel einige Siedesteinchen oder Siedeperlen zufügt. Diese sollen sogenannte Siedeverzüge, d h. unkontrolliertes abruptes Aufkochen, verhindern. Hat man nur kleine Flüssigkeitsmengen zu destillieren, verwendet man meistens ein Magnetrührgerät; der Rührstab („Rührfisch“) übernimmt dann die Funktion der Siedesteinchen. In einem Heizbad, dessen Temperatur variiert werden kann, wird die Flüssigkeit erhitzt. Die Wahl des Heizbades (Wasserbad, Ölbad, Silikonbad) richtet sich nach der erwarteten Siedetemperatur. Sobald die Flüssigkeit siedet, beobachtet man am Destillationsthermometer die Siedetemperatur und notiert diese kontinuierlich als Funktion der Menge des Destillats. Die Badtemperatur wird so eingestellt, dass das Destillat tropfenweise (nicht zu rasch!) in der Vorlage aufgefangen wird. Sollte bei der gewählten Badtemperatur kein Destillat mehr abtropfen („übergehen“), muss das Bad stärker erhitzt werden. Falls dann die Siedetemperatur stärker ansteigt, wechselt man die Vorlage.
Die Qualität der Destillate (Zusammensetzung, Reinheit) wird durch Bestimmung des Brechungsindex, der Dichte, oder durch Aufnahme von Gaschromatogrammen oder Spektren ermittelt (siehe die einzelnen Praktikumsversuche).
Die Glasapparatur wurde im Laufe der Zeit verändert und verbessert. Um zu verhindern, dass durch beim Sieden hochspritzende Flüssigkeit das Thermometer benetzt und dadurch eine zu hohe Siedetemperatur vorgetäuscht wird, wurde der Destillieraufsatz erweitert (Claisen-Aufsatz); das Thermometer wird in den zweiten Hals eingesetzt, wo es nur vom Dampf umspült werden soll. Der senkrecht über dem Siedekolben stehende Hals wird durch einen Schliffstopfen verschlossen und kann zum Einfüllen oder Nachfüllen von Flüssigkeit benutzt werden. Bei Destillationen unter vermindertem Druck (Vakuum-Destillation) kann hier die Siedekapillare eingeführt werden. Destillieraufsatz und Liebig-Kühler können zu einer sogenannten Destillationsbrücke verschmolzen sein.

Bild 9-2. Destillieraufsatz nach Claisen (schematisch).

Bild 9-3. Destillationsbrücke mit Kühlmantel (Liebig-Brücke) und Vakuum-Vorstoß.

Bild 9-4. Destillationsbrücke nach Claisen (schematisch).
Die klassische Destillationsapparatur kann man auch in miniaturierter Ausführung kaufen (Bild #-5)

Bild 9-5. Apparatur zur Destillation im Halbmikro-Maßstab.
Gemeinsame Destillation nicht-mischbarer Flüssigkeiten
[Bearbeiten]Unter der Voraussetzung, dass die Komponenten nicht mischbar sind, ist der Dampfdruck des über der kräftig bewegten Flüssigkeit stehenden Dampfes bei gegebener Temperatur die Summe der Dampfdrücke, welche die einzelnen Komponenten (A,B,C...) des Gemisches in isoliertem Zustand hätten:
PTges = PTA + PTB + PTC + ...
Die einzelnen Komponenten verhalten sich daher im Idealfall in ihren Dampfdrücken unabhängig voneinander, zwischenmolekulare Kräfte sollen also nicht wirksam sein. Wichtig ist ferner, dass der Gesamtdruck PTges unabhängig ist vom relativen Anteil der Komponenten A,B,C...
Eine in der Praxis früh ausgeübte, apparativ einfache Anwendung dieses Falles ist die Wasserdampfdestillation, welche im Prinzip auf einer gemeinsamen Destillation (Co-Destillation) von Wasser und darin unlöslichen organischen Substanzen beruht.
Wasserdampfdestillation
[Bearbeiten]Eine Wasserdampf-Destillation hat den Zweck, auf relativ schonende Weise (Temperaturen um 100 °C) flüchtige organische Substanzen von nicht-flüchtigen Begleitstoffen abzutrennen. Die flüchtigen organischen Verbindungen müssen jedoch in Wasser unlöslich, exakter ausgedrückt: schwerlöslich, sein. In der Industrie ist die Gewinnung ätherischer Öle aus Pflanzenmaterial durch Wasserdampf-Destillation ein seit langem genutztes Verfahren. Auch zur Abtrennung flüchtiger Syntheseprodukte von (nicht-flüchtigen) Schmieren und Harzen kann die Wasserdampf-Destillation geeignet sein.
Für kleinere Ansätze, z. B. mit analytischer Zielsetzung, wie in den Praktikums-Versuchen Nr. #, genügt es, eine Suspension des zerkleinerten Pflanzenmaterials zusammen mit viel Wasser am absteigenden Kühler (Bild #-1) zu destillieren.
Für präparative Ansätze wird heißer Wasserdampf, der in einem Dampf-Generator entwickelt wird, durch das siedende heterogene Gemisch in Wasser geleitet (Bild #-6). Die Dämpfe werden kondensiert; in der Vorlage der Destillationsapparatur sammelt sich ein zweiphasiges Gemisch aus Wasser und organischer Substanz an, das im Scheidetrichter leicht voneinander getrennt werden kann.

Bild 9-6. Einfache Apparatur zur Wasserdampfdestillation. Im Dampferzeuger aus Metall (Kupfer), "Dampfkanne" genannt, wird Wasser zum kräftigen Sieden erhitzt (Bunsenbrenner). Sollte das Einleitungsrohr verstopft werden, wird es gefährlich! Der sich aufbauende Druck kann durch ein sogenanntes Steigrohr (Länge 1 bis 2 m) in der Dampfkanne abgebaut werden. Vorsicht: Das heiße Wasser kann bei starker Verstopfung oben heraussprudeln! Die Apparatur sollte daher in einem Abzug aufgebaut werden. Um den Wasserstand in der Dampfkanne beobachten zu können, ist dort eine Umleitung mit Schauglas angebracht (links im Bild). Um das Einleiten des heißen Dampfes rasch unterbrechen zu können, sollte eine Verzweigung (T-Stück) zwischen Dampferzeuger und Destillationskolben eingebaut werden; auf dem freien Schenkel sitzt ein Gummischlauch mit Quetschhahn.
Die Wasserdampf-Destillation von Limonen, dem Hauptbestandteil des ätherischen Öls aus Citrus-Fruchtschalen, soll als Beispiel betrachtet werden. In Bild #-7 ist ein Ausschnitt aus den Dampfdruck-Kurven von Limonen und Wasser wiedergegeben.

Bild 9-7. Dampfdruck-Kurven von Limonen und Wasser im Bereich von 95-100°C.
Der Siedepunkt des heterogenen Gemisches Wasser/Limonen ist bekanntlich die Temperatur, bei welcher der Gesamt-Dampfdruck Pges gleich dem Atmosphärendruck (unter Normalbedingungen, 760 Torr) ist. Aus dem Diagramm (Bild #-7) ist zu entnehmen, dass diese Bedingung bei einer Temperatur von ca. 97,5°C erfüllt ist; denn hier gilt:
P97,5 °Limonen = 66.3 Torr
P97,5 °Wasser = 694.5 Torr
P97,5 °ges = 760.8 Torr
Beachten Sie, dass nach der Theorie der Siedepunkt des Gemisches niedriger als der des reinen Wassers (100°C bei 760 Torr) liegt. Achten Sie bei Versuch Nr. #-# darauf, ob Sie dies bestätigen können. Der erniedrigte Siedepunkt wird so lange beibehalten, bis alles Limonen überdestilliert ist; erst dann steigt das Thermometer auf die Siedetemperatur des reinen Wassers an.
Der Vorteil der Wasserdampf-Destillation liegt auf der Hand: Reines Limonen würde bei 178 °C/760 Torr destillieren. Man müsste also das Pflanzenmaterial hoch erhitzen, wenn man daraus Limonen durch normale Destillation gewinnen wollte. Zersetzungsprozesse wären unvermeidlich. Außerdem findet beim Einleiten des Wasserdampfs bzw. beim intensiven "Durchkochen" des heterogenen Gemisches ein Aufschluss des pflanzlichen Gewebes statt.
Temperaturabhängigkeit des Dampfdrucks
[Bearbeiten]Der Dampfdruck ist eine Funktion der Temperatur. Der Zusammenhang kann durch eine Exponentialfunktion mit zwei empirisch zu bestimmenden Konstanten A und B beschrieben werden:
p = 10A-B/T
Diese Funktion (August-Gleichung) wurde aus der Clausius-Clapeyron-Gleichung abgeleitet. Die Antoine-Gleichung beschreibt den Zusammenhang durch eine Gleichung mit drei Parametern A, B und C:
p = 10A-B/T+C
Die Konstanten A, B und C sind für viele Stoffe bestimmt worden.[1]
In welchen Maßeinheiten gibt man den Druck an? Nach dem SI-System müsste er in Pascal-Einheiten (Pa) angegeben werden. Da jedoch Dampfdrücke in der Vergangenheit mit Quecksilber-Manometern gemessen wurden und in vielen Laboratorien auch noch werden, ist die Maßeinheit "Millimeter Quecksilbersäule" (mm Hg) oder Torricelli (Torr) sehr verbreitet. Mit elektronisch arbeitenden, modernen Manometern wird der Druck auch in bar oder millibar-Einheiten abgelesen.
Zur Erinnerung:
1 bar = 105 Pa = 0.1 MPa = 750,062 Torr
102 Pa = 1 Hektopascal (1 hPa)
1 Torr = 1.3332 mbar = 133.32 Pa = 1.333 hPa
1 hPa = 0.750 Torr
In Bild 9-8 ist eine Dampfdruckkurve von Wasser im Temperaturbereich 0 bis 100 °C gezeigt.

Bild 9-8. Dampfdruckkurve von Wasser
Die Gleichung von Clausius-Clapeyron und die August-Gleichung werden meist in logarithmischer Form angegeben:
log p = A - B/T
Trägt man also log p gegen die reziproke Temperatur 1/T auf, so erhält man Geraden.
Als Beispiel betrachten wir wiederum das Diagramm von Wasser.
Bild 9-9. Abhängigkeit des Dampfdrucks von Wasser von der Temperatur (T, in Kelvin, links) und der reziproken Temperatur (1/T, rechts ).
Der logarithmische Zusammenhang zwischen Dampfdruck und Temperatur führte zur Aufstellung einer in der Laborpraxis nützlichen Faustregel, die annähernd für viele organische Flüssigkeiten gilt:
"Eine Verminderung des äußeren Drucks um die Hälfte reduziert den Siedepunkt um etwa 15 °C."[2]
Siedet z. B. eine Flüssigkeit (Benzaldehyd) bei 178 °C/760 Torr, so kann man bei 380 Torr eine Siedetemperatur von ca. 163 °C erwarten, bei 190 Torr 148 °C. Im Grobvakuum (ca. 10 Torr) also 88 °C. Beobachteter Sdp. von Benzaldehyd: 60 °C bei 10 Torr.
Vakuumdestillation
[Bearbeiten]Viele organische Verbindungen halten eine Belastung durch höhere Temperaturen nicht aus. Deshalb ist es ratsam, bei thermolabilen Substanzen die Destillation unter möglichst schonenden Bedingungen auszuführen. Dazu arbeitet man bei vermindertem Druck ("im Vakuum", englische und ältere deutschsprachige Versuchsbeschreibungen: "in vacuo").
Erzeugung von Vakuum im Organischen Labor
[Bearbeiten]Im Praktikum für Anfänger beschränken wir uns auf Destillationen im sogenannten Grobvakuum. Man versteht darunter den Bereich unterhalb des Atmosphärendrucks bis herab zu ca. 15 mbar. In den Zeiten als man sich über den Preis von Wasser und Abwasser keine Gedanken machen musste und Umweltgesichtspunkte keine Rolle spielten, benutzte der Chemiker zur Erzeugung von Grobvakuum die Wasserstrahlpumpe (Bunsen, 1868, Minimaldruck 10-12 Torr, d.h. ca.15 mbar), deren Funktion aus dem anorganischen Praktikum bekannt sein dürfte. Ökologisch vorteilhafter, aber sehr viel teurer in der Anschaffung sind Membranvakuumpumpen, die auch im Praktikum verwendet werden.
Von den Herstellern werden Membranpumpen verschiedener Ausführung angeboten, u.a. einstufige und zweistufige. Die erreichbaren Enddrücke betragen 80 bzw. 15 mbar. Während bei der Wasserstrahlpumpe zur Messung des Druckes einfache, mit Quecksilber gefüllte Manometer aus Glas verwendet wurden und werden, dienen zur Druckmessung bei Membranpumpen elektronische Anzeigegeräte. Zweckmäßigerweise übernehmen diese auch Steuerungsfunktionen, indem sie den Druck regeln und konstant halten (Vakuum-Controller). Im Rotationsverdampfer werden Lösungsmittel "im Vakuum" schonend abdestilliert. Unter Umweltaspekten ist es wichtig, dass dabei möglichst geringe Mengen Lösungsmittel, vor allem chlorierte Kohlenwasserstoffe, in die Atmosphäre gelangen. Für die Kondensation der Lösungsmitteldämpfe ist selbstverständlich die Temperatur des Kühlwassers entscheidend, welche möglichst niedrig sein soll. Bei einer Kühlwassertemperatur von 15-20°C sollte die Siedetemperatur des abzudestillierenden Lösungsmittels nicht unter 40°C liegen, wenn eine weitgehende Kondensation der Lösungsmitteldämpfe durch Wasserkühlung angestrebt wird. Bei einer Wasserbad-Temperatur von 60-70°C im Rotationsverdampfer gibt man daher mit dem Vakuum-Controller einen geeigneten, d.h. auf das abzudestillierende Lösungsmittel abgestimmten Arbeitsdruck vor. Das volle, d.h. dem Arbeitsdruck entsprechende Vakuum wird jedoch nicht sofort "angelegt", sondern von höherem Druck aus, d.h. "von oben langsam angefahren" bis ausreichendes Sieden eintritt.
Hier stellt sich die Frage: Wie groß muß der Druck sein, damit ein Lösungsmittel bei 40°C bis 60°C rasch abdestilliert? Bei Kenntnis der Konstanten A, B und C der Antoine-Gleichung lässt sich der benötigte Arbeitsdruck berechnen. In der Praxis des chemischen Labors werden Tabellen verwendet, welche oft den Betriebsanleitungen der Vakuum-Controller beiliegen.
Feinvakuum wird meistens erst in den Praktika für Fortgeschrittene verwendet. Man erzeugt es mittels ölgedichteten Drehschieberpumpen (Öl-Drehschieberpumpe, Ölrotationspumpe), wobei in der Regel Drücke zwischen 10-2 und 10-4 mbar bzw. Torr erreicht werden können.
Beachten Sie, dass bei allen Arbeiten unter vermindertem Druck (Vakuum) unbedingt eine Schutzbrille getragen werden muss!
Destillation miteinander mischbarer flüchtiger Substanzen
[Bearbeiten]Physikalische Grundlagen
[Bearbeiten]Bei der Destillation von Gemischen flüchtiger Substanzen ist die Zusammensetzung der Dampfphase eine andere als die der flüssigen Phase; in der Dampfphase ist die leichter flüchtige Komponente angereichert (aber nicht ausschließlich vorhanden!). Als einfachstes Beispiel soll die Verdampfung zweier miteinander mischbarer Substanzen A und B unterschiedlicher Flüchtigkeit betrachtet werden, ein sogenanntes binäres Gemisch. Beim Verdampfen der Flüssigkeit müssen durch Zufuhr thermischer Energie die zwischenmolekularen Kräfte überwunden werden. Im idealen Fall sind die Wechselwirkungskräfte zwischen den ungleichen Molekülen (A...B) ebenso groß wie zwischen den gleichen (A...A, bzw. B...B). Das Raoultsche Gesetz konstatiert, dass bei gegebener Temperatur der Partialdruck einer Komponente eines idealen binären Gemisches eine Funktion der Zusammensetzung ist; und zwar ist der Partialdruck der Komponente A in der Gasphase (pA) gleich dem Produkt aus dem Dampfdruck der reinen Substanz A (PA) und ihrem Molenbruch xA in der flüssigen Phase: pA = PA × xA
Analog gilt für den Partialdruck von B:
pB = PB • xB
Der Gesamtdampfdruck in der Gasphase über diesem binären Gemisch A+B setzt sich additiv aus den Partialdrücken der Komponenten A und B zusammen (Daltonsches Partialdruckgesetz):
Pges = pA + pB
Anschaulich können diese Beziehungen durch Dampfdruckdiagramme (p,x-Diagramme) dargestellt werden, wobei der Dampfdruck als Funktion des Molenbruchs oder der Molprozente in der flüssigen Phase dargestellt wird. So erhält sich zum Beispiel das System Benzol/Toluol für alle Mischungsverhältnisse nahezu ideal. Mischt man zu Benzol Toluol, so nimmt der Dampfdruck der Mischung linear mit dem Molenbruch von Toluol ab, ebenso sind die Partialdrucke von Benzol und Toluol linear von den Molenbrüchen abhängig.
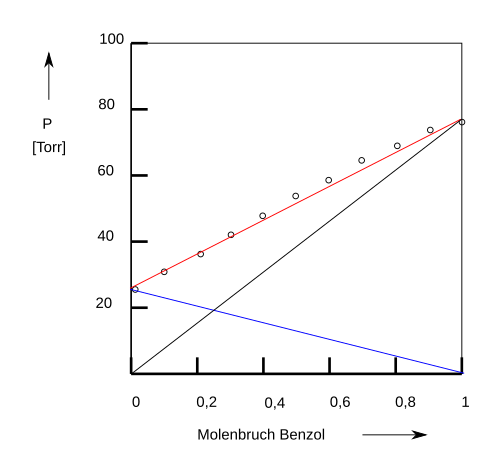
Bild 9-11. Dampfdruckdiagramm (P,x-Diagramm) eines homogenen Gemisches von Benzol und Toluol bei 20 °C. Die schwarze und blaue Geraden zeigen die Partialdrücke von Benzol bzw. Toluol an.
Beim Destillieren in der Praxis ist man jedoch weniger am Dampfdruck als Funktion variabler Temperatur sondern an der Siedetemperatur bei konstantem Druck, in der Regel bei Atmosphärendruck, interessiert. Graphisch lässt sich die Abhängigkeit der Siedetemperatur von der Zusammensetzung der flüssigen Phase durch das sog. Siedepunktsdiagramm (Siedediagramm, T,x-Diagramm) darstellen. Es besteht aus zwei Kurven, der Siedekurve (für die Flüssigkeit) und der Kondensationskurve (für den Dampf, auch Taupunktskurve genannt). Für ein ideales binäres Gemisch sind die Kurven gekrümmt und steigen monoton (Bild #-13).
So verhält sich das System Aceton/Butanon nahezu ideal; offensichtlich besteht kein großer Unterschied in den Wechselwirkungskräften von Aceton- und Butanon-Molekülen.

Bild 9-12. T,x-Diagramme von Aceton/Butanon aus verschiedenen Messungen.

Bild 9-13. Siedediagramm eines idealen binären Gemisches bei konstantem Druck. Die untere Kurve spiegelt die Zusammensetzung der siedenden flüssigen Phase wieder; die obere Kurve gibt die Zusammensetzung des Dampfes an.
Betrachten wir eine Destillation anhand dieses Diagramms: Destilliert man ein Gemisch mit dem Molenbruch x1 = 0,37 (entspricht 37 Mol%) der höhersiedenden Komponente A, so ist ihr Molenbruch im Dampf nur y1 = ca. 0,14 (entspricht ca. 14 Mol% A). Führt man das Verdampfen weiter, so verarmt die flüssige Phase zunehmend an der tiefer siedenden Komponente, infolgedessen steigt die Siedetemperatur der Flüssigkeit an.
Azeotrope Gemische
[Bearbeiten]Beim Destillieren binärer Flüssigkeitsgemische wird das durch die Gesetze von Raoult und Dalton beschriebene Siedeverhalten keineswegs immer beobachtet; es gibt Abweichungen. Der Grund ist, dass die zwischenmolekularen Kräfte zwischen Molekülen verschiedener Art (A...B) größer oder kleiner sind als die zwischen gleichen Molekülen (A...A bzw. B...B). Man spricht von nicht-idealem Verhalten und von realen Mischungen. Die Siedediagramme solcher Flüssigkeitsgemische können die Besonderheit aufweisen, dass sich Siedekurve und Kondensationskurve berühren, d.h. einen gemeinsamen Punkt besitzen. Hier ist die Zusammensetzung der Dampfphase dieselbe wie die der flüssigen Phase. Das aus dem kondensierten Dampf gebildete Destillat unterscheidet sich also im Siedepunkt nicht von der Flüssigkeit vor der Destillation: Man nennt solche Flüssigkeiten azeotrope Gemische oder kurz Azeotrope. Bei ’normalem‘ Siedeverhalten spricht man auch von zeotropen Gemischen (griechisch zeo, ξέω, sieden, kochen).
Man unterscheidet zwei Arten von Azeotropen: Beim ersten ist die Wechselwirkung A...B größer als der Mittelwert von A...A und B...B, d.h. die verschiedenen Moleküle ziehen sich stärker an. Dann ist die Mischung weniger flüchtig als nach dem Raoultschen Gesetz zu erwarten; die Dampfdruckkurve weist bei bestimmter Zusammensetzung ein Minimum auf (negative Abweichung vom Raoultschen Gesetz).
Beispiel: Der Dampfdruck im System Aceton/Chloroform ist niedriger als für die ideale Mischung erwartet, weil Wasserstoffbrücken die Aceton- und Chloroform-Teilchen in der Mischung zusammenhalten.

Bild 9-14. Dampfdruckdiagramm eines Chloroform/Aceton-Gemischs (P,x-Diagramm) bei 20 °C.
Eine Siedekurve dieses homogenen Gemisches ist in folgender Abbildung dargestellt (Bild #-15). Am Punkt, wo sich die beiden Kurven berühren, siedet das Flüssigkeitsgemisch bei höherer Temperatur als die reinen Komponenten. Der Siedepunkt dieses Azeotrops beträgt bei Atmosphärendruck 64,7 °C und liegt für den Molenbruch von Aceton bei 0,37. Aceton bildet mit vielen Lösungsmitteln Azeotrope. Für die Praxis im Labor ist dies wichtig: Die Wiedergewinnung (Recycling) von reinem Aceton durch bloße Destillation (Rektifikation, siehe unten) ist schwierig.
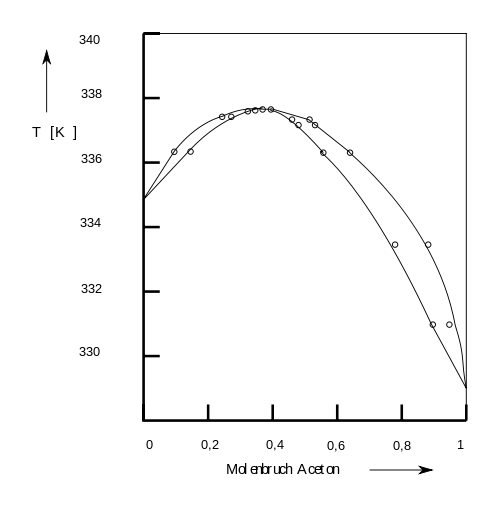
Bild 9-15. T,x-Diagramm von Aceton/Chloroform bei 760 Torr.
Das System Aceton/Chloroform ist ein Beispiel für Azeotrope mit Siedepunktsmaximum. Viele im organischen Labor auftretende Azeotrope weisen jedoch Siedepunktsminima auf.

Bild 9-16. Siedediagramme azeotroper Gemische zweier Flüssigkeiten (schematisch). Oben: Azeotrop mit Siedepunktsmaximum. Unten: Azeotrop mit Siedepunktsminimum. Auf der Ordinate wird der Molenbruch, gelegentlich auch Gewichtsprozente, aufgetragen.
Das wohl in der Praxis wichtigste Beispiel (Biotechnologie) ist das System Ethanol/Wasser. "Bioalkohol" wird bekanntlich durch Vergärung (Fermentation) zuckerhaltiger pflanzlicher Rohstoffe gewonnen. Die dabei entstehenden wässrigen Flüssigkeiten enthalten aber relativ geringe Mengen Ethanol und müssen daher durch Destillation angereichert werden. Allerdings ist das Siedediagramm Ethanol/Wasser sehr ’asymmetrisch‘; das konstant siedende Gemisch enthält 89 Mol% Ethanol (Molenbruch x = 0.89, das sind 96 Gewichtsprozent. Ein alkoholärmeres Gemisch kann man durch systematisch wiederholte Destillation (Rektifikation, s.u.) bis auf 89 Molprozent anreichern. Dann kondensiert nur noch der Dampf des Azeotrops ("96-prozentiges Ethanol").
Bild 9-17. Siedediagramm von Ethanol/Wasser-Gemischen.
Acetonitril/Wasser
Im Praktikum werden wir später mit dem Lösungsmittel Acetonitril arbeiten. Bei dem Versuch entstehen als Abfall wässrige Lösungen, die entsorgt werden sollten (Recycling). Das binäre Gemisch Wasser/Acetonitril zeigt eine starke Abweichung vom idealen Verhalten. Für den Gesamtdruck fand man eine nach oben stark gekrümmte Kurve, die im Bereich von x = 0.2 bis ca. 0.8 ziemlich flach wird und dann wieder abfällt.

Bild 9-18. Dampfdruckdiagramm (P,x) von Wasser/Acetonitril bei 60 °C (333 K).
Das Dampfdruckmaximum hat zur Folge, dass das System Acetonitril/Wasser ein Azeotrop bildet, welches (bei 760 Torr) aus 69 mol% Acetonitril und 31 mol% Wasser besteht. In Gewichtsprozenten sind dies 83.5% Acetonitril und 16.5% Wasser. Der Siedepunkt dieses Gemisches beträgt 76.8°C. Reines Acetonitril hat den Siedepunkt 82°C bei 760 Torr, Wasser natürlich 100°C. Das Siedediagramm (T,x) von Wasser/Acetonitril ist in Bild #-18 gezeigt.
Bild 9-19. Siedediagramm (T,x) von Wasser/Acetonitril bei 760 Torr (1013 mbar).
Beachte: Das Wasser in azeotropen Lösungsmitteln kann also durch Destillation nicht vollständig entfernt werden. Es muss durch andere Verfahren "herausgeholt" werden (Trocknen des Lösungsmittels, "Absolutieren").
Weitere Anwendungen der azeotropen Destillation
Da Azeotrope bei definiertem Druck eine genau bekannte Zusammensetzung haben, kann man solche Gemische zur Herstellung oder Eichung anderer binärer Gemische verwenden. So stellt man aus dem 96-prozentigem Ethanol/Wasser-Azeotrop den pharmazeutisch verwendeten 70-prozentigen Alkohol her; dazu ist die Kenntnis des Mischungskreuzes nützlich.
In der organischen Synthesechemie dient die azeotrope Destillation gelegentlich zur Entfernung von Wasser aus Lösungen, z. B. nach Extraktionen und Verteilungs-Trennungen. Auch manche schwerflüchtige Chemikalien, die Wasser enthalten, lassen sich „azeotrop trocknen“. Man versetzt die zu trocknende Substanz mit einem Lösungsmittel, das mit Wasser ein Azeotrop bildet, z. B. Benzol, und destilliert.
Beispiel: Im Handel erhältliche p-Toluolsulfonsäure enthält Kristallwasser. Man kann dieses entfernen, indem man die Säure in Benzol auflöst und das Benzol/Wasser-Azeotrop abdestilliert (heute verwendet man vielleicht besser Toluol dazu). Bei Synthesereaktionen, die unter Abspaltung von Wasser erfolgen, kann häufig das „Reaktionswasser azeotrop entfernt“ werden. Beispiele: Synthese von Carbonsäureestern aus Carbonsäure und Alkoholen; Herstellung von Enaminen aus Carbonylverbindungen und sekundären Aminen.
Siedeanalysen, Siedegrenzen, Siedebereiche
[Bearbeiten]Zur Prüfung und Charakterisierung von Gemischen flüchtiger Komponenten wird häufig eine Siedeanalyse durchgeführt. Ein Beispiel aus der industriellen Praxis ist die Bestimmung des Siedeverlaufs flüssiger Mineralölkohlenwasserstoffe, z.B. Treibstoffe für Kraftfahrzeuge. Hierfür gibt es genormte Destillationsapparaturen, die unter nach DIN festgelegten Bedingungen betrieben werden müssen. Dabei wird die Flüssigkeit destilliert ; man beobachtet die Siedetemperatur und trägt in einer Tabelle die bei der jeweiligen Siedetemperatur in die Vorlage übergehende Destillatmenge ein. Anschließend erstellt man eine Grafik, in der auf der Abszisse die Menge des Destillats und auf der Ordinate die jeweilige Siedetemperatur aufgetragen wird. Die Destillation wird ohne Kolonne durchgeführt; nicht mit "fraktionierender (‘fraktionierter’) Destillation" verwechseln!
Als Beispiel könnten wir im Praktikum Superbenzin-Sorten untersuchen. Wegen der Geruchsbelästigung durch intensiv riechende Komponenten der Treibstoffe können wir ersatzweise auch das Lösungsmittel Petroläther einer Siedeanalyse unterziehen (Versuch #-#).
Systematisch wiederholte Destillationen
[Bearbeiten]Eine einmalige Destillation liefert nur dann reine Substanzen, wenn sich die Dampfdrücke bzw. Siedepunkte der Komponenten sehr stark unterscheiden. Ist diese Voraussetzung nicht gegeben, so kann die Destillation in systematischer Weise wiederholt werden. Wir betrachten dazu das Siedediagramm eines binären Gemisches mit nahezu idealem Verhalten: Aceton/Butanon

Bild 9-20. Siedediagramm eines Gemisches von Aceton und Butanon bei 760 Torr.
Erhitzt man ein Aceton/Butanon-Gemisch der Zusammensetzung x1 = 0,29 zum Sieden (siehe Siedediagramm, Sdp. ca. 71 °C), so erhält man einen Dampf der anfänglichen Zusammensetzung y1 = 0,45 der also reicher an Aceton ist als die ursprüngliche Flüssigkeit. Kondensiert man den Dampf, so erhält man eine flüssige Fraktion mit demselben Acetongehalt, d.h. eine Anreicherung. Man hat durch einfache Destillation des Flüssigkeitsgemischs in eine acetonreichere und eine acetonärmere Fraktion zerlegt. Wiederholt man die Destillation mit dieser Fraktion, so erhält man eine noch acetonreichere Fraktion x2 = 0,62. Eine dritte Destillation mit x2 = 0,62 liefert schließlich x3 = 0,78, und so weiter.
Dies ist nur ein Modellversuch; in der Praxis wäre diese Verfahrensweise zu langwierig und unökonomisch. Als Annäherung an dieses Prinzip kann die relativ einfach durchzuführende Fraktionierende Destillation betrachtet werden.
Fraktionierende Destillation
[Bearbeiten]Diese Technik wird in der Standardapparatur zur "einfachen“ Destillation durchgeführt (siehe oben, Bild #-1), häufig im Vakuum. Das zu destillierende Gemisch wird im Siedekolben langsam erhitzt, bis Destillat in den Vorlagekolben zu tropfen beginnt. Man notiert die vom Thermometer angezeigte Siedetemperatur.
Die Siedetemperatur wird langsam ansteigen, da bei fortschreitender Destillation der Dampf an der leichter flüchtigen Komponente (d.h. diejenige mit dem niedrigeren Siedepunkt) verarmt. Hat die Siedetemperatur einen bestimmten Wert erreicht, ist beispielsweise 10 Kelvin höher geworden, wechselt man rasch – bei laufender Destillation – den Vorlagekolben und fängt darin die zweite Fraktion auf. Steigt die Siedetemperatur weiter an, sammelt man eine dritte Fraktion, usw. Das Gemisch wird also in verschiedene Fraktionen unterschiedlicher Siedepunkte zerlegt; im Laborjargon: man ’schneidet‘ durch ’fraktionierte Destillation‘ (grammatikalisch falsch!) verschiedene Fraktionen. Die einzelnen Fraktionen werden traditionell durch ihren Brechungsindex und/oder durch ihre Dichte charakterisiert. Wesentlich aussagekräftiger ist jedoch die Aufnahme eines Gaschromatogramms oder 1H-NMR-Spektrums.
Führt man die Destillation unter Vakuum durch, darf sich beim Wechseln der Vorlage der Druck nicht ändern. Dafür hat man die sogenannte ’Spinne‘ ersonnen: Durch Drehen der Normschliff-Hülse können die an der Spinne befestigten Vorlagekolben (in der Regel drei bis vier) gewechselt werden.
Die Trennleistung bei fraktionierenden Destillationen wird wesentlich verstärkt, wenn man auf den Siedekolben noch eine Destillationskolonne (siehe unten) setzt. Für Laborversuche wird meistens eine Einstichkolonne (Vigreux-Kolonne) verwendet. Diese kann mit dem Destillieraufsatz und Liebig-Kühler zu einem Gerät verschmolzen sein (Bild #-21).

Bild 9-21. Fraktionierende Destillation im Vakuum. Verspiegelte Vigreux-Kolonne mit angeschmolzenem Destillieraufsatz und Liebig-Kühler. Vorstoß und Spinne mit Auffangkolben für die Fraktionen des Destillats wurden mit Normschliffen angebaut. Um Siedeverzüge zu vermeiden, wird die Flüssigkeit im Siedekolben durch ein Magnetrührstäbchen in Bewegung gehalten. Das Ölbad (Silikonöl) wird auf dem heizbaren Magnetrührgerät erwärmt. Zur Steuerung der Badtemperatur diente ein Kontaktthermometer. Das Destillationsthermometer vor dem Kühler ist nur teilweise sichtbar.
In der Vigreux-Kolonne steht für den Stoffaustausch zwischen flüssiger Phase und Dampfphase eine größere Fläche zur Verfügung als im Destillieraufsatz der „einfachen“ Standard-Destillationsapparatur. Eine detaillierte mathematische Beschreibung des Trennvorgangs bereitet jedoch große Schwierigkeiten. Daher beschreibt man den Vorgang als Analogie mit der Funktionsweise von großen Destillationskolonnen, die in der Technischen Chemie zur Rektifikation benutzt werden.
Rektifikation – Destillation in Kolonnen
[Bearbeiten]Im Praktikum Organische Chemie für Anfänger/innen dürften Destillationen in leistungsfähigen Kolonnen weniger auf dem Programm stehen, da die benötigten Apparaturen relativ teuer sind, und die Versuche viel Zeit benötigen. Bei der Wiedergewinnung von Lösungsmitteln (Recycling) und deren Reinigung sind jedoch Destillationskolonnen unentbehrlich. Solche Arbeiten sollten auch in Anfängerpraktika wenigstens von einigen Studierenden unter Anleitung durch Betreuer/innen durchgeführt werden, weshalb hier wesentliche Aspekte dieses Themas kurz behandelt werden sollen.
Der Trennvorgang in Destillationskolonnen lässt sich in einem physikalischen Modell als Folge systematisch wiederholter einzelner Destillationsschritte – wie oben beschrieben – auffassen. Die Theorie dieser Modelle wurde für die Chemische Verfahrenstechnik entwickelt (siehe Wikipedia-Artikel am Ende des Kapitels).
Um das Prinzip zu verstehen, betrachten wir zunächst die Funktion einer
Glockenbodenkolonne.


Bild 9-22. Schema einer Bodenkolonne zur Destillation in der chemischen Technik.
Das zu trennende Flüssigkeitsgemisch befindet sich in einem heizbaren Gefäß (in der Technik auch „Destillationsblase“ genannt, im Bild "Verdampfer"), auf den ein Rohr aufgesetzt ist. Dieses enthält Einbauten, in denen sich Flüssigkeit kondensieren kann, die sogenannten Böden. Die Böden sind mit Öffnungen versehen, durch welche der Dampf aufsteigen kann. Glockenförmige Einbauten zwingen den Dampf, durch das Kondensat auf dem Boden durchzuströmen. Der Dampf, der mit der flüchtigeren Komponente angereichert ist, wird im ersten, noch kalten Boden kondensiert. Das Kondensat fließt zurück und verdampft beim Rückströmen erneut. Mit zunehmender Erwärmung verdampft auch die Flüssigkeit des ersten Bodens und ihr Dampf wird auf dem zweiten Boden kondensiert. Das Spiel wiederholt sich, bis nach Passage aller Böden der Dampf zum Rückflusskühler gelangt und dort vollständig kondensiert wird.
Anmerkung zu Bild 9-22: Bei industriellen Destillationen (Rektifikationen) kann man in mittlerer Höhe der Kolonne Flüssigkeit zuführen ("Zulaufboden"). Zum Verständnis der Wirkungsweise braucht hier nicht darauf eingegangen zu werden.
Im Siedediagramm (z. B. Aceton/Butanon, Bild #-20) kann man die Anreicherung der niedriger siedenden Komponente verfolgen. Der besseren Anschaulichkeit wegen, soll das Prinzip nochmals im allgemeinen Fall erläutert werden (Bild #-23).

Bild 9-23. Schema einer mehrstufigen Destillation.
Das zu destillierende Gemisch (S) liefert einen Dampf, der im Kühler zu einer Flüssigkeit D1 kondensiert. In dieser ist die leichter flüchtige Komponente B angereichert (Molenbruch xB). Im Siedekolben (’Sumpf‘) verbleibt die Flüssigkeit W1, die hautsächlich die schwerer flüchtige Komponente A und nur wenig B enthält. W1 kann „abgezogen“ werden. Das Kondensat D1 wird wieder destilliert: Der Dampf liefert nach Abkühlen die Flüssigkeit D2; im Sumpf bleibt W2 zurück. Schließlich ergibt die zweite Wiederholung das Destillat D3, in welchem B stark angereichert ist. Die Flüssigkeiten W2 und W3 müssten nochmals destilliert werden.
Solange kein Kondensat am „Kopf“ der Kolonne (d.h. am oberen Ende, vor dem Rückflusskühler) entnommen wird, sollte sich das System Flüssigkeit/Dampf im thermodynamischen Gleichgewicht befinden. Entnimmt man aber Kondensat am Kopf, so wird prinzipiell das Gleichgewicht gestört. Um aus diesem Dilemma herauszukommen, verwendet man Vorrichtungen, durch welche nur ein Teil der im Rückflusskühler kondensierten Flüssigkeit abgeführt werden kann (Kolonnenkopf). Zwar wird dann das Gleichgewicht doch gestört, aber für die Praxis ist eine geringfügige Störung vertretbar. Entscheidend ist, dass ein möglichst großer Teil des Dampfes in die Kolonne zurückfließt.
Der Quotient aus zurückfließender Stoffmenge und entnommenem Destillat wird Rücklaufverhältnis genannt. Dieses muss der speziellen Trennaufgabe angepasst werden: Liegen die Siedepunkte der Komponenten weit auseinander, kann man ein kleines Rücklaufverhältnis wählen, um in angemessener Zeit die Trennung durchführen zu können. Bei Stoffen, deren Dampfdrücke bzw. Siedepunkte sich wenig unterscheiden, muss mit hohem Rücklaufverhältnis gearbeitet werden, was selbstverständlich die Arbeitszeit erhöht. Also muss ein Kompromiss eingegangen werden.
Die Rektifikationskolonne mit Glockenböden ist zwar anschaulich, wird aber nur in der industriellen chemischen Verfahrenstechnik, nicht jedoch im Laboratorium benutzt. Denn die Dimensionen und der Betriebsinhalt von Glockenbodenkolonnen sind zu hoch für den Laborbetrieb. Hier werden Kolonnen mit kleinerem Betriebsinhalt verwendet: an die Stelle der Böden treten Füllkörper. Die Oberfläche für den Stoffaustausch Flüssigkeit/Dampf wird stark erhöht, wenn man das Glasrohr der Labor-Kolonne mit Ringen aus Glas oder Keramik (Raschig-Ringe) oder Wendeln beschickt (Füllkörper-Kolonnen).
Bei Destillationen im Vakuum können jedoch Füllkörper hinderlich sein, da diese durchgewirbelt werden können, wenn plötzlich größere Druckdifferenzen auftreten. In diesem Fall werden Einstich-Kolonnen (Vigreux-Kolonnen) bevorzugt, welche allerdings eine geringere Oberfläche und damit Trennleistung haben.

Bild 9-24. Links: Schema einer mit Raschig-Ringen gefüllten Destillationskolonne. HETP = Height equivalent to a theoretical plate, siehe unten. Rechts: Prinzip einer Einstich-Kolonne (Vigreux-Kolonne).

Nach der Theorie der Rektifikation soll bei einer Kolonne kein Wärmeaustausch mit der Umgebung (Laborluft) stattfinden (adiabatische Betriebsweise). Um diesen zu verhindern oder möglichst gering zu halten, kann man die Kolonnen mit Aluminiumfolien oder Vliesen aus Glaswolle isolieren. Meistens sind jedoch Glaskolonnen mit einem angeschmolzenen Glasmantel versehen, der auf der Innenseite versilbert ist. So sollen Verluste durch Wärmestrahlung vermindert werden. Der Raum zwischen Kolonnenrohr und Glasmantel wird evakuiert.

Bild 9-25. Destillation in einer verspiegelten Glaskolonne mit Kolonnenkopf.
Im Labor werden Kolonnenköpfe aus Glas verwendet, bei welchen ein Intensivkühler (Schlangenkühler) mit einem „Kragen“ verschmolzen ist, in dessen Rinne sich das Kondensat sammeln kann. Dieses kann durch einen Hahn tropfenweise abgenommen werden. In diesem einfachen Fall kann das Rücklaufverhältnis definiert werden als
- Zahl der in die Kolonne rückfließenden Tropfen/Zahl der Tropfen entnommener Flüssigkeit.
Bei einem Kolonnenkopf aus Glas können die rückfließenden Tropfen visuell beobachtet werden.
Kolonnenköpfe mit Magnetventil und angeschlossenem elektronischem Steuergerät erlauben, eine Rektifikation im Labor automatisch und mit variablem Rücklaufverhältnis über viele Stunden hinweg durchzuführen.

Bild 9-26. Destillation (Rektifikation) im Labor mit Steuergerät für die Temperatur des Heizbads und den elektromagnetisch betriebenen Kolonnenkopf.
Die Dimension einer im Labor verwendeten Kolonne sollte dem zu lösenden Trennproblem angepasst werden. Je schwieriger die Trennung ist, desto länger sollte die Kolonne sein. Ihre Trennleistung wird definiert, indem man auf das physikalische Modell der Bodenkolonnen zurückgreift. Ein bestimmter Abschnitt der Füllkörper- oder Vigreux-Kolonne entspricht in seiner Trennwirkung einem einzelnen Boden im Modell; anders ausgedrückt: die Höhe (der benutzten Kolonne) ist einem theoretischen Boden äquivalent (HETP, Height equivalent to a theoretical plate) (Bild #-24). Durch Destillation von Testgemischen kann die Trennstufenhöhe und Trennstufenzahl einer Kolonne ermittelt werden.
Einzelnachweise
- ↑ Vapor liquid equilibrium data collection : tables and diagrams of data for binary and multicomponent mixtures up to moderate pressures; constants of correlation equations for computer use, J. Gmehling, U. Onken, DECHEMA, Frankfurt am Main 1979 und folgende Bände (Chemistry data series, Deutsche Gesellschaft für Chemisches Apparatewesen).
- ↑ Organikum. Organisch-chemisches Grundpraktikum, von einem Autorenkollektiv. 7. Aufl., Deutscher Verlag der Wissenschaften, Berlin, 1967.
Artikel in Wikipedia:
Rektifikation (Verfahrenstechnik Rektifikationskolonne Glockenboden (Destillation) Kontinuierliche Destillation
Literatur
[Bearbeiten]- Rudolf Bock, Methoden der Analytischen Chemie. Eine Einführung, Bd. 1: Trennungsmethoden. Verlag Chemie, Weinheim, 1974. ISBN 3-527-25502-8.
- Organikum. Organisch-chemisches Grundpraktikum, von einem Autorenkollektiv. 7. Aufl., Deutscher Verlag der Wissenschaften, Berlin, 1967 und spätere Auflagen. Aktuell: Verlag Wiley-VCH, Weinheim, 23. Auflage 2009, ISBN 978-3-527-32293-3
- Erich Krell, Handbuch der Laboratoriumsdestillation: mit einer Einführung in die Pilotdestillation. 3. Aufl., Hüthig, Heidelberg u.a., 1976. ISBN 3-7785-0340-5.
- Adolf Schmidt, Destillation, in Ullmanns Encyklopädie der technischen Chemie, 4. Auflage, Band 5: Analysen- und Messverfahren, S.75-90, Verlag Chemie, Weinheim, 1980.
Versuche
[Bearbeiten]- Trocknen und Destillieren von Toluol
- Isolierung des ätherischen Öls aus Orangenschalen durch Wasserdampf-Destillation
- Isolierung des ätherischen Öls aus Kümmel durch Wasserdampfdestillation
- Vakuumdestillation von Orangenschalen-Öl
- Siedeanalyse von Petrolether
- Fraktionierende Destillation eines Methanol/Wasser-Gemischs