Praktikum Organische Chemie/ Trennung und Isolierung niedermolekularer organischer Verbindungen/ Trennungen durch Verteilung zwischen zwei flüssigen Phasen
Ausschütteln, Flüssig-Flüssig-Extraktion
[Bearbeiten]Trennungen nach diesem Prinzip werden meistens in Scheidetrichtern durchgeführt. Diese enthalten zwei nichtmischbare oder nur wenig untereinander mischbare Flüssigkeiten von verschiedener Dichte. Die dichtere Flüssigkeit sinkt nach unten und bildet die Unterphase. Die Oberphase besteht aus der Flüssigkeit mit der geringeren Dichte. In der Regel ist die Unterphase Wasser oder eine wässrige Lösung von mit Wasser mischbaren organischen Solventien, z.B. niederen Alkoholen. Häufig enthält die wässrige Unterphase gelöste Salze, z. B. Natriumchlorid, wodurch deren Dichte noch erhöht wird. Als Oberphase dienen organische Lösungsmittel, wie niedere Alkane, z.B. Pentan und Hexan, Benzol, Toluol, und sehr häufig Diethylether. Dichlormethan, Trichlormethan (Chloroform) und Tetrachlormethan sind spezifisch schwerer als Wasser; sie erscheinen daher gegenüber diesem als Unterphase.
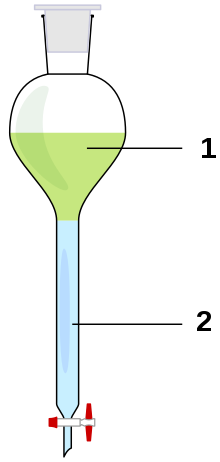
Bild 4-1: Ein Scheidetrichter mit Oberphase (1) und Unterphase (2).
Scheidetrichter werden in verschiedenen Formen hergestellt: kugelförmige, konische, zylindrische und aus diesen Grundformen kombinierte Geräte.
Bild 4-2: Konische und cylinderförmige Scheidetrichter.
Zum Ausschütteln kleiner Volumina, z. B. für Vorversuche oder GC und DC-Tests, kann man Reagenz- oder Zentrifugengläser verwenden, wobei man die beiden Phasen mit einer lang ausgezogenen Pipette (Pasteur-Pipette) aufsaugt.
Bild 4-3: Pasteur-Pipetten.

Bild 4-4: Ausschütteln kleiner Substanzmengen.
Das Nernstsche Verteilungsgesetz
[Bearbeiten]Eine Trennung kann erfolgen, wenn sich die Substanzen in den beiden flüssigen Phasen unterschiedlich verteilen. Die Verteilung einer Substanz wird durch den Nernstschen Verteilungssatz beschrieben: Das Verhältnis der Konzentrationen einer Substanz in den beiden Phasen ist konstant (ideales Verhalten vorausgesetzt, Aktivitätskoeffizienten werden nicht berücksichtigt). Die Gleichgewichtskonstante wird meist als Verteilungskoeffizient bezeichnet.
co = Konzentration in der Oberphase, cu = Konzentration in der Unterphase.
Das Nernstsche Verteilungsgesetz wird üblicherweise in Konzentrationen ausgedrückt. Der präparative und analytische Chemiker kann durch Wahl des Volumenverhältnisses der Ober- und Unterphase die Verteilung beeinflussen. Man definiert als Volumenverhältnis (Phasenverhältnis)[1]:
wobei Vo = Volumen der Oberphase, Vu = Volumen der Unterphase ist.
Die beiden Phasen enthalten die Substanzmengen xo (in Gramm oder mg ausgedrückt) und xu. Das Verhältnis dieser Substanzmengen im Gleichgewicht wird als Verteilungszahl definiert:
Ferner ist es nützlich, die relative Substanzmenge und die prozentuale Verteilung zu definieren. Die relative Substanzmenge in der Oberphase ist
in der Unterphase
Mithin ist also p + q = 1
Multipliziert man p und q mit dem Faktor 100, so erhält man die prozentuale Verteilung der Substanz:
P = 100 p, Q = 100 q, also P + Q = 100
Damit ist die Verteilungszahl auch gegeben durch die Beziehungen
Da P + Q = 100, gilt weiter
oder
und
oder
Mit diesen Definitionen lässt sich der Nernstsche Verteilungssatz folgendermaßen formulieren:
Da
und
d. h. Substanzmenge/Volumen
wird aus
oder
Übungsaufgabe
[Bearbeiten]Wässriger Tee-Extrakt (25 ml), vgl. Praktikumsversuch "Coffein aus Tee", soll mit verschiedenen Chlorkohlenwasserstoffen (spezifisch schwerere Lösungsmittel, Unterphase) einmal ausgeschüttelt werden. Wie viel Lösungsmittel benötigt man, damit 99 % des Coffeins in die organische Phase überführt werden? Folgende Werte für die Nernstschen Verteilungskoeffizienten von Coffein im System Organisches Lösungsmittel/Wasser bei 20 °C wurden ermittelt:[2]
- Dichlormethan (Methylenchlorid): Kcoffein = 8,0
- 1,2-Dichlorethan: Kcoffein = 2,9
- Trichlormethan (Chloroform): Kcoffein = 4,7
- Tetrachlormethan: Kcoffein = 0,12
Beachten Sie, dass diese K-Werte nicht der oben gegebenen Definition entsprechen, daher sollte hier zuerst der reziproke Wert 1/K berechnet werden.
Wiederholtes Ausschütteln
[Bearbeiten]Wie der Vergleich mit dem Resultat der voranstehenden Übungsaufgabe zeigt, ist es ökonomischer, anstelle eines einmaligen Ausschüttelns wiederholt mit kleineren Mengen Lösungsmittel auszuschütteln: Man braucht weniger Lösungsmittel und daher auch weniger Zeit zum anschließenden Abdestillieren der Hilfsphase.
Übungsaufgabe zum Praktikumsversuch "Coffein aus Tee"
[Bearbeiten]a) Berechnen Sie die prozentuale Verteilung P und Q in der Wasserphase und Dichlormethanphase, wenn Coffein (K = 8,0) in 25 ml Wasser mit 12,5 ml Dichlormethan ausgeschüttelt wird.
b) Wie viel Prozent des ursprünglich vorhandenen Coffeins sind aus der wässrigen Phase (25 ml) extrahiert worden, wenn man diese dreimal mit je 12,5 ml Dichlormethan ausschüttelt? Vergleiche den Lösungsmittelverbrauch (3 mal 12,5 ml) mit dem der vorigen Übungsaufgabe.
Kontinuierliche Extraktion
[Bearbeiten]Wenn Verteilungskoeffizienten sehr groß oder sehr klein sind, genügt mehrmals wiederholtes Ausschütteln nicht, um Substanzen zu >99 % in der spezifisch schwereren bzw. leichteren organischen Phase anzureichern. Man kann dieses dadurch erreichen, indem man die organische Hilfsphase kontinuierlich durch die wässrige Phase strömen lässt. Es gibt Extraktionsgeräte für spezifisch leichte organische Lösungsmittel, z.B. Diethylether oder Hexan (Hilfsphase steigt nach oben) und spezifisch schwere Lösungsmittel, z. B. Methylenchlorid oder Chloroform. Bild 4-5 zeigt schematisch ein Gerät für eine spezifisch leichte Extraktionsflüssigkeit, den Kutscher-Steudel-Apparat.

Bild 4-5. Flüssig-Flüssig-Extraktion im Kutscher-Steudel-Apparat (schematisch). Die wässrige Phase ist blau gezeichnet.
In einem Siedegefäß wird Diethylether erhitzt. Der Dampf tritt durch ein schräg nach oben verlaufendes „Knierohr“ in den Apparat ein und gelangt schließlich zu einem Rückflusskühler, wo er kondensiert wird. Die Tropfen werden in einem trichterförmigen Glaseinsatz aufgefangen, der am unteren Ende eine Öffnung besitzt. Der Einsatz steckt in einem zylindrischen Gefäß, in dem sich die vorher eingefüllte zu extrahierende wässrige Lösung befindet. Am Ende des Einsatzes - im Bild mündet er in eine grobporige Glasfritte - kommt der Ether in Kontakt mit der wässrigen Lösung; die Tropfen wandern einzeln nach oben, da sie spezifisch leichter sind als Wasser. Auf ihrem Weg werden sie mit den extrahierbaren Substanzen beladen und sammeln sich über der Wasserphase. Sobald der Spiegel des Ethers das „Knierohr“ erreicht hat, fließt die organische Phase in das Siedegefäß zurück, wo sie wieder verdampft wird. Auf diese Weise reichern sich die Substanzen langsam im Siedekolben an. Nach Abkühlen kann der Ether-Extrakt analytisch untersucht werden.
Die kontinierliche Extraktion nach diesem Prinzip wird von Chemikern auch als ’Perforation‘ bezeichnet. Dieser Ausdruck ist jedoch unglücklich: er leitet sich vom Lateinischen foramen (= Loch) ab, siehe Perforation. Die Methode hat jedoch kein Loch! Nur Teile des Gerätes zur Extraktion können perforiert sein, also Löcher haben (durch welche Flüssigkeitstropfen wandern können), z. B. eine Glasfritte.
Zur kontinuierlichen Extraktion mit spezifisch schwereren Lösungsmitteln (Chloroform, Dichlormethan u.a.) wird meistens der Extraktionsapparat nach Wehrli eingesetzt.[3]
Beziehungen zwischen Verteilungskoeffizient und Molekülstruktur
[Bearbeiten]Im organischen Laboratorium sind in erster Linie Verteilungen zwischen Wasser und organischen Lösungsmitteln, die mit Wasser eine nur beschränkte Löslichkeit zeigen ((vgl. Tab. 4), wichtig. Häufig verwendete organische Lösungsmittel zur Verteilung sind Pentan (niedriger Siedepunkt!), Hexan, Petrolether, Cyclohexan, Dichlormethan, Chloroform, Dieth.ylether, Ethylacetat, also relativ unpolare Solventien. Was den zu verteilenden Stoff angeht, so ist es nützlich, aprotonische Moleküle von protonischen Molekülen zu unterscheiden. Die Verteilung eines aprotonischen organischen Stoffes zwischen einem unpolaren Solvens (z. B. Hexan, Cylohexan) und Wasser hängt ab:
- von der Molekülgröße des gelösten Stoffes. Je voluminöser das Molekül, desto mehr reichert es sich in der unpolaren Phase an,
- vom Dipolmoment des gelösten Stoffes. Je größer dieses ist, desto mehr reichert sich der Stoff in der Wasserphase an,
- von der Wasserstoffbrücken-Akzeptor-Basizität (HBA-Basizität) des gelösten Stoffes. Je größer diese ist, desto mehr reichert sich der Stoff in der Wasserphase an.
Der letzte Effekt ist, wenn die Voraussetzungen dazu vorliegen, bei weitem der wichtigste.
Wenn der zu verteilende Stoff selbst protonisch ist, besitzt er durch seinen Wasserstoffbrücken-Donor-Charakter (HBD-Acidität) die Fähigkeit zu weiteren starken Wechselwirkungen mit organischen Phasen, die HBA-Charakter haben, z. B. Diethylether, Ethylacetat. Zum Ausschütteln sind diese Lösungsmittel daher geeigneter als Kohlenwasserstoffe.
Die Beispiele in den Tabellen 6 und 7 sollen diese allgemeinen Betrachtungen illustrieren.
Tabelle 6.[4]

| Verbindung | Formel | Hexan/Wasser | Diethylether/Wasser |
|---|---|---|---|
| Methanol | CH3OH | 0,0015 | 0,14 |
| 1-Butanol | CH3CH2CH2CH2OH | 0,31 | 7,7 |
| 2,3-Butandiol | CH3CH(OH)CH(OH)CH3 | 0,000325 | 0,029 |
| Glycerin | HOCH2CH(OH)CH2OH | ? | 0,00066 |
| Ameisensäure | HCOOH | 0,36 | |
| Essigsäure | CH3COOH | 0,48 | |
| Propionsäure | CH3CH2COOH | 1,59 | |
| Buttersäure | CH3CH2CH2COOH | 4,76 | |
| Pivalinsäure | (CH3)3CCOOH | 12,99 | |
| Glykolsäure | HOCH2COOH | 0,028 |
Verteilungen zwischen Wasser und lipophilen Phasen haben nicht nur für Trennungen und Analysen in der organischen Chemie, sondern auch in der Biologie, Biologischen Chemie und Medizinischen Chemie eine enorme Bedeutung. So ließ sich die narkotische Aktivität vieler einfacher organischer Moleküle mit den Verteilungskoeffizienten zwischen Olivenöl/Wasser, einem Modell für die Verteilung zwischen der Fettphase von Nervenzellen und wässriger Körperflüssigkeit, korrelieren. Auch die Fähigkeit organischer Chemikalien, Pflanzenzellmembranen zu durchdringen, lässt sich mit Verteilungskoeffizienten im System Öl/Wasser korrelieren.
Corvin Hansch führte als Modell für die Verteilung in biologischen Systemen (lipophile Phase/wässrige Lösung) die Solvens-Kombination 1-Octanol/Wasser ein, für die zahlreiche Verteilungskoeffizienten bestimmt wurden. Tabelliert werden die Logarithmen der Verteilungskoeffizienten log K, von Hansch als log P (von P = partition, Verteilung) bezeichnet.
Die Größe log P kann daher als empirisches Maß für die Liphophilie, manchmal auch Hydrophobie genannt, betrachtet werden.
Es wurde gefunden, dass sich diese log-P-Werte im System Octanol/Wasser sogar quantitativ abschätzen ("berechnen") lassen, indem man Inkremente von Teilstrukturen und Substituenten addiert. Außerdem können die log P-Werte mit dem Hildebrandschen Löslichkeitsparameter δ und den Polaritätsparametern π* und β linear korreliert werden.
Diese qualitativen Beziehungen ließen sich an einigen Beispielen auch quantifizieren: Der Logarithmus des Verteilungskoeffizienten log K im System Cyclohexan-Wasser gibt eine lineare Korrelation mit dem Molvolumen des gelösten Stoffes (V), dem Polaritätsparameter π* und dem Parameter der HBA-Basizität α (siehe Kap. 1).[5]: log K (C6H12/H2O) = -0.05 + 3.69 V/100 - 1.15 π* - 5.64 α
Tabelle 8 zeigt einige Beispiele für Verteilungen im System 1-Octanol/Wasser.[6]

Der Trennfaktor
[Bearbeiten]Sollen zwei Substanzen A und B durch Verteilung zwischen zwei nicht mischbaren flüssigen Phasen getrennt werden, so müssen ihre Verteilungskoeffizienten verschieden groß sein. Unterscheiden sie sich nur wenig, so erhält man lediglich eine Anreicherung einer Komponente gegenüber der anderen:

Die Wirksamkeit einer Trennung wird durch den Trennfaktor β beschrieben, der folgendermaßen definiert ist:
Da
und
ergibt sich
Der Trennfaktor ist also gleich dem Verhältnis der Verteilungskoeffizienten der Substanzen A und B. Ist KA = KB, d. h. β = 1, so ist eine Trennung durch Verteilung prinzipiell unmöglich. Durch eine einmalige Verteilung lassen sich Substanzen nur dann befriedigend trennen, wenn β > 100 ist, d. h. die Verteilungskoeffizienten müssen sich möglichst stark unterscheiden.
Im wässrig/organischen Lösungsmittelsystem ist dies mit Sicherheit der Fall, wenn die eine Komponente (A) eine aprotonische Neutralsubstanz, die andere (B) eine ionogene Verbindung (Salz) ist. So lassen sich anorganische Salze, die beim Neutralisieren von Reaktionsansätzen entstehen, von organischen Verbindungen meistens dadurch abtrennen, dass man das Gemisch zwischen Ether und Wasser verteilt: die Salze gehen in die wässrige, die organischen Verbindungen in die etherische Phase. Organische Säuren und Neutralsubstanzen lassen sich häufig dadurch trennen, dass man die ersteren mit wässrigen Basen, z. B. 5 % NaOH- oder KOH-Lösung, aus etherischer Lösung herausextrahiert. Für die selektive Extraktion von Carbonsäuren genügt die schwächere Base Natriumhydrogencarbonat. So lassen sich z. B. Phenole (pKa = ca. 10) von Carbonsäuren (pKa = ca. 4.7) trennen.

Bild 4-6: Trennung von Benzaldehyd und Benzoesäure durch Verteilung.
Organische Basen und Neutralsubstanzen (erstere können z. B. Amine, basische Stickstoff-Heterocyclen oder Alkaloide sein) lassen sich oft trennen, indem man zwischen Ether und verdünnter wässriger Salzsäure (ca. 5 % HCl) verteilt. Die organischen Stickstoffbasen werden am N protoniert; die entstehenden Ammoniumsalze werden durch Wasser besser solvatisiert als durch Ether und gehen daher in die wässrige Phase. Die Abbildungen 4-6 und 4-7 demonstrieren zwei charakteristische Beispiele.
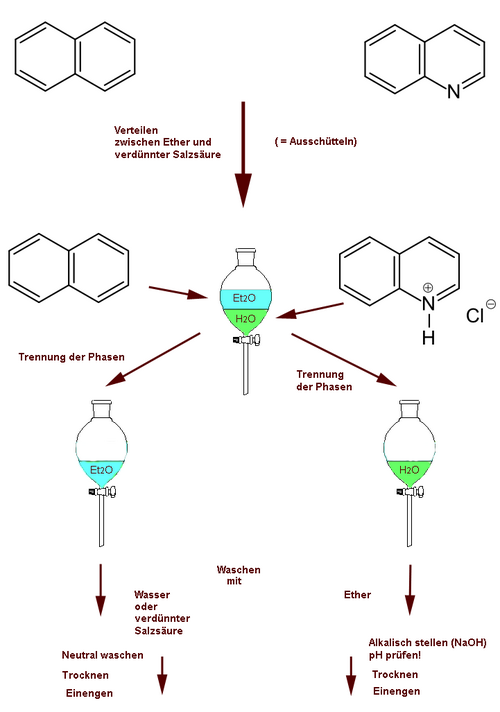
Bild 4-7. Trennung von Naphthalin und Chinolin durch Verteilung
Das Trocknen von Flüssig/Flüssig-Extrakten
[Bearbeiten]Beim Ausschütteln oder kontinuierlichen Extrahieren wässriger Lösungen wird in die organische Phase Wasser eingeschleppt. Da auch mit Wasser "nicht mischbare" Lösungsmittel mehr oder weniger große Mengen an Wasser lösen können (vgl. Kapitel 1, Tab. 4), werden diese nach einer Extraktion mit Wasser gesättigt sein. Bevor man den organischen Extrakt weiter verarbeitet, muss man das Wasser entfernen, was man das "Trocknen" der Extrakte nennt. Unterlässt man dies, so können Störungen im weiteren Gang der Aufarbeitung oder Minderung der Ausbeute eintreten. So kann sich beim anschließenden Abdestillieren der leichtflüchtigen Lösungsmittel das Wasser im Rückstand anreichern und die Kristallisation verzögern oder verhindern. Hydrolyseempfindliche Stoffe können beim Abdestillieren des wasserhaltigen Lösungsmittels reagieren. Im harmlosesten Fall wird der Rückstand von Wassertröpfchen durchsetzt sein, die anders schwierig zu entfernen sind. Trockenmittel für Extrakte sind wasserfrei getrocknete anorganische Salze, die Hydrate bilden:
MetXm + n H2O → ← MetXm × H2O
Am häufigsten werden verwendet:
- Calciumchlorid, CaCl2,
- Natriumsulfat, Na2SO4,
- Magnesiumsulfat, MgSO4,
- Calciumsulfat, CaSO4.
Um Säurespuren, wenn noch vorhanden, aus Extrakten zu entfernen, kann man auch mit wasserfreiem Kaliumcarbonat (Pottasche) trocknen, einem leicht basischen Trockenmittel. Natriumhydroxid oder Kaliumhydroxid dienen weniger zum Trocknen von Extrakten als vielmehr von Lösungsmitteln, Pyridin oder Aminen. Die verschiedenen Trockenmittel unterscheiden sich in ihrer Aufnahmefähigkeit für Wasser und im Trocknungsgrad, den sie liefern. In Tabelle 9 sind die möglichen Hydrate der oben genannten Trockenmittel angegeben.
| Trockenes Salz | Maximaler Kristallwassergehalt n H2O | Gleichgewichtsdampfdruck des H2O über dem Hydrat bei Raumtemperatur |
|---|---|---|
| CaCl2 | 6 H2O | 3,5 Torr |
| Na2SO4 | 10 H2O | ?? |
| MgSO4 | 7 H2O | 11,5 Torr |
| CaSO4 | 2 H2O | 0,004 Torr |
Die Aufnahmefähigkeit eines Trockenmittels für Wasser wird durch den Begriff der Trocknungskapazität ausgedrückt, der angibt, wie viel Gewichtsprozent Wasser das betreffende wasserfreie Trockenmittel aufnehmen kann:
- Trocknungskapazität (%) =
Die Trocknungsintensität, d. h. wie "scharf" ein Trockenmittel trocknet, wird durch den Gleichgewichtsdampfdruck des Wassers über dem Salzhydrat bestimmt. Tabelle 9 zeigt, dass sich die üblichen Trockenmittel hierin unterscheiden: Calciumsulfat ("Drierite", registriertes Warenzeichen) hat eine besonders hohe Trocknungsintensität, aber eine geringe Trocknungskapazität - es bindet nur 1/2 Moläquivalent H2O. Daher kann man Lösungen mit Calciumsulfat "feintrocknen", nachdem sie - zur Entfernung der Hauptmenge an Wasser - mit einem der anderen Trockenmittel "vorgetrocknet" worden sind.
Für die praktische Durchführung des Trocknens sollte man folgendes beachten:
- Verwenden Sie nur Trockenmittel einwandfreier Qualität, d.h. solche, die wirklich wasserfrei sind. In der Regel muss man Trockenmittel vor Gebrauch entwässern, was durch Ausheizen ("Glühen") auf einem Blech oder in einer Eisenschale getan wird. Das ausgeheizte Trockenmittel sollte rasch in eine dicht verschließbare Vorratsflasche abgefüllt werden, wo man es abkühlen lässt. Selbstverständlich darf noch warmes Trockenmittel nicht in organische Lösungen gegeben werden.
- Das Trocknen braucht genügend Zeit, denn es ist ein Diffusionsprozess zwischen flüssiger und fester Phase. Gelegentliches Umschütteln oder magnetisches Rühren erhöht die Trocknungsgeschwindigkeit. Wenn nicht gerührt wird, sollte mehrere Stunden, am besten über Nacht, getrocknet werden.
- Nicht übertrieben viel Trockenmittel nehmen; durch Adsorption kann Substanz verloren gehen. Beim Abfiltrieren des Trockenmittels müsste man dieses mit einem Übermaß an getrocknetem (!) Lösungsmittel auswaschen. Am besten trocknet man den Extrakt kurze Zeit mit wenig Trockenmittel vor, dekantiert vom Trockenmittel ab und gibt dann frisches Trockenmittel zur Lösung, das man längere Zeit einwirken lässt.
- Das Trockenmittel muss abfiltriert und mit trockenem Lösungsmittel ausgewaschen werden, bevor man das Lösungsmittel abdestilliert. Sonst kann beim Destillieren Hydratwasser zum Teil reversibel freigesetzt werden.
- Calciumchlorid ist als Trockenmittel nicht für alle Stoffe geeignet. Es kann Komplexe bilden mit vielen Alkoholen, Aminen und einigen Estern und Ketonen. Das handelsübliche wasserfreie Calciumchlorid kann durch den industriellen Entwässerungsprozess etwas basische Calciumsalze enthalten, die Carbonsäuren und Phenole binden können. Im Zweifelsfalle also lieber Magnesiumsulfat oder Natriumsulfat verwenden.
Einzelnachweise
[Bearbeiten]- ↑ Die folgenden mathematischen Ableitungen und Beziehungen sind den Büchern von E. Hecker, Verteilungsverfahren im Laboratorium, Verlag Chemie, Weinheim 1955, und R. Bock, Methoden der Analytischen Chemie, Bd. 1, S. 24, Verlag Chemie, Weinheim 1973 entnommen.
- ↑ G. S. Klebanov, L. N. Mednikova, A. D. Ovcharova, Extraction of caffeine from aqueous solutions, Pharmaceutical Chemistry Journal, 1, 221-223 (1967); translated from Khimiko-Farmatsevticheskii Zhurnal, No. 4, pp.49-52, April, 1967. DOI: 10.1007/BF00770195
- ↑ S. Wehrli, Ein Apparat zur Extraktion von Lösungen mit schwereren Lösungsmitteln, Helv. Chim. Acta 20, 927 (1937).
- ↑ C. Hansch, A. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, Wiley-Interscience, New York, 1979.
- ↑ M. J. Kamlet, M. H. Abraham, R. M. Doherty und R. W. Taft, J. Am .Chem. Soc. 106, 464 (1984).
- ↑ C. Hansch, A. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, Wiley-Interscience, New York, 1979.
Literatur
[Bearbeiten]- E. Hecker, Verteilungsverfahren im Laboratorium, Verlag Chemie, Weinheim 1955.
- R. Bock, Methoden der Analytischen Chemie, Bd. 1, Verlag Chemie, Weinheim 1973.
- Informationsschrift der E. Merck AG, Trocknen im Laboratorium, Darmstadt






















