Wikijunior Die Elemente/ Atom
Die kleinsten Teilchen
[Bearbeiten]Du hast schon viel über Chemie erfahren, auch ohne große Worte wie: Atome, Ionen, Moleküle, Elektronen und so weiter. Bis vor etwa 150 Jahren wussten selbst die Wissenschaftler nicht richtig über diesen Teil der Chemie Bescheid. Niemand hatte diese allerkleinsten Teilchen, aus denen Materie besteht, zuvor gesehen – dabei sind sie es doch, die für fast alles verantwortlich sind, was in der Chemie passiert. Atome sind die Grundbausteine der Chemie. Sie sind im Universum für alles die Basis. Du solltest dich erinnern, dass Materie aus Atomen zusammengesetzt ist. Atome und das Studium der Atome sind eine Welt für sich. Atome sind der Schlüssel, um zu beschreiben, warum es verschiedene Elemente gibt und warum sie so miteinander reagieren, wie sie es tun. Sie erklären auch, warum das Periodensystem der Elemente genau so aufgebaut ist.
Heute können wir uns Atome ansehen, wenn wir ein Gerät benutzen, das „Raster-Tunnel-Mikroskop“ heißt. Damit kann man Dinge sehen, die sogar noch Millionen mal kleiner sind als das, was uns normale Mikroskope zeigen. Unter dem Raster-Tunnel-Mikroskop sehen Atome aus wie kleine verschwommene Kugeln.
Atome = Basisbausteine
[Bearbeiten]
Atom heißt auf griechisch ἄτομος, átomos, und bedeutet „das Unteilbare“. Die Chemiker glaubten vor 200 Jahren, dass die Grundbausteine der Chemie unteilbar seien und nannten sie "Atome".
Seit Beginn des 20. Jahrhunderts wissen sie, dass sie aus kleineren Teilchen zusammengesetzt sind. Der Name "Atom" ist zwar nicht zutreffend, wird aber weiterhin benutzt.
Atome bestehen aus Protonen, Neutronen und Elektronen. Darum werden diese auch subatomare Teilchen genannt. Atome unterscheiden sich voneinander durch die Anzahl der Protonen, Neutronen und Elektronen.
Die Physiker untersuchen diese subatomaren Teilchen. Einige von ihnen, wie Protonen und Neutronen, bestehen aus kleineren Strukturen (Quarks genannt), bei anderen (z. B. Elektronen) ist es nicht gelungen, sie weiter zu teilen.
Aufbau
[Bearbeiten]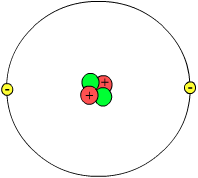

Nach dem heutigen Verständnis besteht das Atom aus zwei Teilen, dem Atomkern (oder Nukleus) und einer Atomhülle (Elektronenwolken oder Orbitale). Der Nukleus besteht aus Protonen und Neutronen (auch Nukleonen genannt). Mit dem Atomkern beschäftigen sich Teilchen-Physiker.
Die Chemie eines Elementes, also ob es bei Zimmertemperatur fest, flüssig oder gasförmig ist, und was passiert, wenn verschiedene Atome zusammentreffen, hängt nur von den Vorgängen in der Atomhülle (und damit von der Anzahl der Protonen und Elektronen) ab.
Der Atomkern ist im Vergleich zur Atomhülle sehr klein: wenn du den Rand der Atomhülle mit den obersten Plätzen eines Fußballstadions vergleichst, wäre der Atomkern nur so groß wie ein Reiskorn am Anstoßpunkt. Um den Atomkern herum ist also viel Raum, in dem sich elektromagnetische Felder befinden.
In den neutralen Elementen befinden sich gleich viel Elektronen und Protonen. Elektronen sind negativ geladen, Protonen sind positiv geladen. Die Anzahl an Protonen bestimmt, welches Element du vor dir hast. Im Periodensystem sind die Elements nach ihrer Protonen-Anzahl geordnet. Das erste Element (Wasserstoff) hat ein Proton, das zweite Element (Helium) hat zwei Protonen, usw. Die Elemente können eine unterschiedliche Anzahl von Neutronen besitzen. Neutronen haben keine Ladung, aber sie helfen, den Kern zu stabilisieren. Die positiven Ladungen im Kern würden sich alleine voneinander abstoßen, und der Kern könnte auseinanderfallen. Bei der richtigen Neutronenanzahl sind die Elemente stabil, wenn zu viele oder zu wenig Neutronen im Kern sind, ist er instabil und zerfällt. Dabei senden sie radioaktive Strahlung aus. Elemente mit gleichen Protonenzahlen und unterschiedlicher Anzahl von Neutronen nennt man Isotope. Wasserstoff zum Beispiel hat 3 Isotope, eines mit einem Neutron, eines mit zwei und eines mit drei Neutronen. Sie haben alle nur ein Proton und sind deshalb alle Wasserstoff-Isotope.
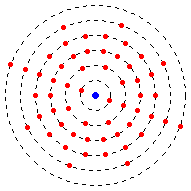
Die Elektronenwolke umgibt den Kern. Früher glaubten manche Wissenschaftler, die Elektronen bewegen sich um den Kern und werden von ihm angezogen, weil sie negativ geladen sind. In ihren Modellen umkreisen Elektronen den Kern wie die Planeten die Sonne, auf ganz bestimmten, festgelegten Bahnen. Heute wissen wir, dass das nicht stimmt. Das Bohrsche Atommodell konnte nicht alle Beobachtungen erklären und wurde zum Orbitalmodell erweitert.
Kleine Objekte wie Elektronen, Atome oder Moleküle besitzen Eigenschaften, die wir aus unserer Alltagswelt nicht kennen. Die Quantenmechanik beschreibt diese Eigenschaften.
Über Atome
[Bearbeiten]Die Atome der verschiedenen chemischen Elemente besitzen eine unterschiedliche Zusammensetzung. Ihr innerer Aufbau hilft uns, die Elemente zu ordnen:
- 1. Element: 1 Proton und 1 Elektron
- 2. Element: 2 Protonen und 2 Elektronen
- 3. Element: 3 Protonen und 3 Elektronen
- 4. Element: 4 Protonen und 4 Elektronen
- usw.
Alle Elemente haben einen Namen und eine Abkürzung (Formelzeichen). Diese Formeln müssen Chemiker auswendig lernen:
- 1. Element: Wasserstoff, H: 1 Proton und 1 Elektron
- 2. Element: Helium, He: 2 Protonen und 2 Elektronen
- 3. Element: Lithium, Li: 3 Protonen und 3 Elektronen
- 4. Element: Beryllium, Be: 4 Protonen und 4 Elektronen
- usw.
Vor dem Elementsymbol stehen manchmal eine tiefgestellte Zahl:
1H
Die tiefgestellte Zahl nennt man Ordnungszahl. Sie entspricht der Zahl der Protonen und damit auch der Zahl der Elektronen.
(Wasserstoff, H hat (immer) 1 Proton und 1 Elektron)
Vor dem Elementsymbol steht manchmal eine hochgestellte Zahl:
3H
Die hochgestellte Zahl nennt man Massenzahl. Sie entspricht der Summe von Protonen und Neutronen.
(Wasserstoff H hat immer 1 Proton und folglich 2 Neutronen: 1+2=3 )
Elemente, die eine unterschiedliche Anzahl von Neutronen besitzen, nennt man Isotope. Elemente können (theoretisch) beliebig viele Neutronen haben:
- 1. Element: 1 Proton und 1 Elektron und (theoretisch) beliebig viele Neutronen
- 2. Element: 2 Protonen und 2 Elektronen und (theoretisch) beliebig viele Neutronen
- 3. Element: 3 Protonen und 3 Elektronen und (theoretisch) beliebig viele Neutronen
- 4. Element: 4 Protonen und 4 Elektronen und (theoretisch) beliebig viele Neutronen
- usw.
"Theoretisch" bedeutet hier, das man auf dem Papier eine beliebige Zahl von Neutronen aufschreiben kann. "Praktisch", also in der Natur kommen nur wenige Kombinationsmöglichkeiten vor:
- 1. Element: 1 Proton und 1 Elektron und 0 oder 1 oder 2 Neutronen
- 2. Element: 2 Protonen und 2 Elektronen und 1 oder 2 oder 3 oder 4 Neutronen
- 3. Element: 3 Protonen und 3 Elektronen und 3 oder 4 Neutronen
- 4. Element: 4 Protonen und 4 Elektronen und 3 oder 4 oder 5 oder 6 oder 7 Neutronen
- usw.
