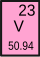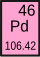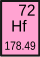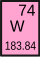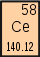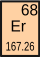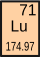Wikijunior Die Elemente/ Periodensystem
Erscheinungsbild
Periodensystem
[Bearbeiten]
Was ist das Periodensystem der Elemente?
[Bearbeiten]- Der Wissenschaft sind viele Elemente bekannt. Viele dieser Elemente haben ähnliche Eigenschaften. Wenn man sie nach ihren Eigenschaften in Gruppen einordnet, wird es einfacher, sie zu untersuchen und sie zu vergleichen. Aus diesem Grund ist die Einordnung der Elemente in Gruppen notwendig. Das Periodensystem der Elemente ist eine Möglichkeit die bekannten Elemente in Gruppen einzuteilen.
- Früher war es üblich, Elemente in zwei Gruppen einzuteilen, Metalle und Nichtmetalle. Aber man kannte auch Elemente, die Eigenschaften von Metallen und Nichtmetallen aufzeigten. Man nannte sie Halbmetalle.
Die Geschichte des Periodensystems der Elemente
[Bearbeiten]Frühgeschichte
[Bearbeiten]
- Einige Elemente sind den Menschen bereits seit der Antike bekannt. Es handelt sich dabei um Elemente, die in reiner Form in der Natur vorkommen und mit einfachen Mitteln gewonnen werden können. Das sind zum Beispiel Gold, Silber und Kupfer.

- Der Philosoph Aristoteles war der Überzeugung, daß alle Materie aus vier Elementen besteht. Diese vier Elemente sind Erde, Wasser, Luft und Feuer. Das erinnert an die vier Aggregatzustände (in dieser Reihenfolge): fest, flüssig, gasförmig und plasmaförmig. Er war auch der Ansicht, dass diese vier Elemente in neue Verbindungen umgewandelt werden und die uns umgebende Materie bilden.
- Hennig Brand war der erste, der ein neues Element entdeckte. Er war ein deutscher Kaufmann, der mit seiner Firma pleite gegangen war. Er suchte nach dem Stein der Weisen - einem Stein, der der Sage nach ein einfaches Metall in Gold verwandeln kann. Bis 1669 experimentierte er mit menschlichem Urin. Bei der Destillation erhielt er eine weiße, glimmende Substanz. Er nannte sie Phosphorus. Bis 1680 behielt er seine Entdeckung geheim. In diesem Jahr entdeckte Robert Boyle die Substanz erneut und Brand ging mit seiner Entdeckung an die Öffentlichkeit.
- Bis 1809 wurden 47 weitere Elemente entdeckt. Mit steigender Anzahl bekannter Elemente entdeckten Wissenschaftler Ähnlichkeiten in der Reaktion der Elemente. Anhand der beobachteten Reaktionen versuchten Sie die Elemente in Kategorien einzuteilen.
Antoine-Laurent de Lavoisier
[Bearbeiten]
- Antoine Lavoisier schrieb 1789 sein Buch "Elementare Abhandlung über die Chemie". Dieses Buch ist das erste moderne Chemiebuch. Es enthält eine Reihe von Elementen, die nicht weiter zerlegt werden können. Lavoisier beschreibt unter anderem den Sauerstoff, Stickstoff, Wasserstoff, Phosphor, Quecksilber, Zink und Schwefel. Diese Auflistung bildet den Grundstein für die heute bekannten Elemente. Seine Liste enthielt jedoch auch das Licht und Wärme. Lavoisier war der Meinung, dass diese Feststoffe sind. Viele führende Chemiker seiner Zeit schenkten den Ansichten Lavoisiers keine Beachtung. Jedoch war sein Buch über die Chemie sehr gut geschrieben und fand unter der jungen Generation viel Beachtung.
- Er unterschied die Elemente lediglich in "Metalle" und "Nichtmetalle". Diese Einteilung wurde jedoch nicht akzeptiert.
Alexandre-Emile Béguyer de Chancourtois
[Bearbeiten]
- Alexandre-Emile Béguyer de Chancourtois war ein französischer Geologe. Er ordnete die bekannten Elemente nach ihrem Atomgewicht an. Chancourtois erkannte, dass die Gewichtsunterschiede zwischen den Elementen immer gleich groß sind. Er leitete aus dieser Erkenntnis eine erste Periodische Tafel ab. Er ordnete die Elemente auf einer Spirale an, die sich um einen Zylinder wand. Dabei erkannte er, dass Elemente mit gleichen Eigenschaften untereinander zu liegen kamen. Zusätzlich zu den Elementen enthielt sein Diagramm noch Ionen und Verbindungen. Seine Ausführung erschien 1862. Er benutzte in der Hauptsache geologische und keine chemischen Ausdrücke und benutzte auch keine Diagramme. Aus diesem Grund wurde seine Arbeit wenig beachtet. Erst als Dimitri Mendeleev seine Arbeiten veröffentlichte, änderte sich das.
John Newlands
[Bearbeiten]- John Newlands war ein englischer Chemiker, der 1865 die bis dahin bekannten 56 Elemente in 11 Gruppen einordnete. Diese Gruppen teilte er nach ähnlichen physikalischen Eigenschaften ein. Dabei entdeckte er, dass viele sehr ähnliche Elemente sich in einem Atomgewicht um acht oder einem Vielfachen von acht unterscheiden. Mit seinem "Gesetz der Oktaven" stellte er diese Regelmäßigkeit in die Nähe der Musik. Seine Zeitgenossen machten sich deshalb über ihn lustig. Es dauerte noch 50 Jahre, bis Lewis seine "Theorie der Valenzen" veröffentlichte und damit die Wichtigkeit des Vielfachen der Acht erkannt wurde.
Die erste Periodische Tafel
[Bearbeiten]
- Dimitri Mendeleev entwickelte als erster eine Periodische Tafel der Elemente, die der heutigen Form sehr nahe kommt. Er ordnete die Elemente auf einer Tafel nach ihrem Atomgewicht an. Es wird über ihn gesagt, dass er auf langen Zugfahrten ein "chemisches Solitaire" spielte. Auf den Karten waren die Elemente und ihre unterschiedlichen Eigenschaften aufgelistet. Am 6.März 1869 reichte er sein Arbeit bei der russischen chemischen Gesellschaft ein. Der Name der Arbeit war "Die Abhängigkeit der chemischen Eigenschaften der Elemente vom Atomgewicht". Seine Tafel wurde in einer kleinen russischen Zeitschrift veröffentlicht. Wenig später wurde sie erneut veröffentlicht, dieses Mal in der deutschen Zeitschrift "Zeitschrift für Chemie". Er erstellte folgende Regeln:

- 1. Ordnet man die Elemente ihrem Atomgewicht entsprechend an, zeigen sie eine eindeutige Regelmäßigkeit in ihren Eigenschaften.
- 2. Elemente die hinsichtlich ihrer Eigenschaften sehr ähnlich sind, unterscheiden sich entweder kaum in ihrem Atomgewicht (z.B. Pt, Ir, Os) oder ihr Gewicht wächst gleichmäßig an (z.B. K, Rb, Cs).
- 3. Die Anordnung der Elemente oder von Elementgruppen in der Reihenfolge ihres Atomgewichtes entspricht ihren sogenannten Valenzen, ebenso wie ihren charakteristischen chemischen Eigenschaften. Dies zeigt sich unteranderem in der Gruppe Li, Be, Ba, C, N, O und Sn.
- 4. Diejenigen Elemente, die leicht flüchtig sind, haben ein geringes Atomgewicht.
- 5. Die Höhe des Atomgewichtes bestimmt den Charakter des Elementes, ebenso wie das Ausmaß eines Moleküls den Charakter einer Verbindung bestimmt.
- 6. Wir müssen mit der Entdeckung vieler neuer Elemente rechnen - zum Beispiel mit Elementen, die dem Aluminium und Silizium ähnlich sind. Deren Atomgewicht würde zwischen 65 und 75 liegen.
- 7. Das Atomgewicht eines Elementes sollte in manchen Fällen den Atomgewichten seiner benachbarten Elemente angepasst werden. Dementsprechend muss das Atomgewicht von Tellurium zwischen 123 und 126 liegen. Es kann nicht 128 sein.
- 8. Gewisse Eigenschaften der Elemente können vorhergesagt werden, wenn das Atomgewicht bekannt ist.
Vorteile
[Bearbeiten]- Mendeleev sagte die Entdeckung weitere Elemente voraus und ließ entsprechend Platz in seinem Periodensystem der Elemente. Diese Elemente waren Eka-Aluminium (heute Gallium), Eka-Boron (Scandium) und Eka-Silizium (Germanium). Als diese Elemente entdeckt wurden, konnten sie ohne Probleme eingeordnet werden.
- Er sagte die Eigenschaften sowohl dieser noch unbekannten Elemente als auch Verbindungen mit diesen sehr genau voraus.
- Er wies darauf hin, dass einige der damals angegebenen Atomgewichte nicht richtig waren.
- Er sah Lücken in seinem Periodensystem vor, um Abweichungen im Atomgewicht auszugleichen.
Nachteile
[Bearbeiten]- Es gab keinen Platz für die Isotope der Elemente.
- Seine Tafel enthielt keine Edelgase, da diese zu diesem Zeitpunkt noch nicht entdeckt waren. Sir William Ramsay fügte die Edelgase später als Gruppe 0 hinzu, was die bestehende Periodische Tafel nicht beeinträchtigte.
- Ohne das Wissen von Mendeleev arbeitete Lothar Meyer ebenfalls an einem Periodensystem. Er veröffentlichte seine Arbeit 1864. In seinem Periodensystem ordnete Meyer lediglich 28 Elemente nach ihren Valenzen an. Er kam nie auf die Idee, neue Elemente vorherzusagen oder die Atomgewichte bekannter Elemente zu korrigieren. Nur wenige Monate nach Mendeleev veröffentlichte er ein nahezu identisches Periodisches System. Einige Leute sehen Mendeleev und Meyer als gleichwertige Entdecker an. Andere Leute sind jedoch der Meinug, dass Mendeleev der wichtigere Entdecker ist, weil er die Eigenschaften der noch nicht entdeckten Elemente genau vorhergesagt hat. Auf jeden Fall beeindruckten die Vorhersagen Mendeleevs seine Zeitgenossen und wurden später bestätigt. Ein englischer Chemiker entwickelte 1864 ein Periodensystem, welches dem von Mendeleev sehr ähnlich sah.
Henry Moseley
[Bearbeiten]
- 1914 entdeckte Henry Moseley einen Zusammenhang zwischen der Wellenlänge von Röntgenstrahlen, die auf ein Element gerichtet waren und dem Atomgewicht diese Elements. Bis zu dieser Entdeckung waren die Atomnummern lediglich aufeinanderfolgende Nummern basierend auf dem Atomgewicht der Elemente. Es wurde erkannt, dass die Atomnummern eine experimentell nachweisbare Grundlage haben.
- Die Forschung von Moseley ergab ferner, dass es zu diesem Zeitpunkt keine bekannten Elemente mit den Atomnummern 43 beziehungsweise 61 gab. Diese beiden Elemente sind radioaktiv und kommen in der Natur nicht vor. Moseley sagte ebenfalls neue Elemente voraus.
Glenn T. Seaborg
[Bearbeiten]- Während des Manhattan-Projekts von 1944 hatte Glenn T. Seaborg erhebliche Schwierigkeiten, die beiden Elemente Americium und Curium zu isolieren. Er nahm an, dass diese beiden neuen Elemente einer neuen Serie an Elementen angehörten. Dieses würde auch die Unterschiede zwischen ihren tatsächlichen und den vorhergesagten Eigenschaften erklären. Entgegen dem Rat seiner Kollegen änderte er die Periodische Tafel von Mendeleev erheblich und fügte die Aktinoidenreihe hinzu.
Liste der chemischen Elemente
[Bearbeiten]
| 1 Wasserstoff H | 2 Helium He | 3 Lithium Li | 4 Beryllium Be | 5 Bor B | 6 Kohlenstoff C | 7 Stickstoff N | 8 Sauerstoff O |
| 9 Fluor F | 10 Neon Ne | 11 Natrium Na | 12 Magnesium Mg | 13 Aluminium Al | 14 Silizium Si | 15 Phosphor P | 16 Schwefel S |
| 17 Chlor Cl | 18 Argon Ar | 19 Kalium K | 20 Kalzium Ca | 21 Scandium Sc | 22 Titan Ti | 23 Vanadium V | 24 Chrom Cr |
| 25 Mangan Mn | 26 Eisen Fe | 27 Kobalt Co | 28 Nickel Ni | 29 Kupfer Cu | 30 Zink Zn | 31 Gallium Ga | 32 Germanium Ge |
| 33 Arsen As | 34 Selen Se | 35 Brom Br | 36 Krypton Kr | 37 Rubidium Rb | 38 Strontium Sr | 39 Yttrium Y | 40 Zirkonium Zr |
| 41 Nobium Nb | 42 Molybdän Mo | 43 Technetium Tc | 44 Ruthenium Ru | 45 Rhodium Rh | 46 Palladium Pd | 47 Silber Ag | 48 Kadmium Cd |
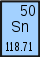
| 49 Indium In | 50 Zinn Sn | 51 Antimon Sb | 52 Tellur Te | 53 Jod I | 54 Xenon Xe | 55 Cäsium Cs | 56 Barium Ba |
| 57 Lanthan La | 58 Cer Ce | 59 Praseodym Pr | 60 Neodym Nd | 61 Promethium Pm | 62 Samarium Sm | 63 Europium Eu | 64 Gadolinium Gd |
| 65 Terbium Tb | 66 Dysprosium Dy | 67 Holmium Ho | 68 Erbium Er | 69 Thulium Tm | 70 Ytterbium Yb | 71 Lutetium Lu | 72 Hafnium Hf |
| 73 Tantal Ta | 74 Wolfram W | 75 Rhenium Re | 76 Osmium Os | 77 Iridium Ir | 78 Platin Pt | 79 Gold Au | 80 Quecksilber Hg |
| 81 Thallium Tl | 82 Blei Pb | 83 Wismut Bi | 84 Polonium Po | 85 Astat At | 86 Radon Rn | 87 Franzium Fr | 88 Radium Ra |
| 89 Aktinium Ac | 90 Thorium Th | 91 Protactinium Pa | 92 Uran U | 93 Neptunium Np | 94 Plutonium Pu | 95 Amerikium Am | 96 Curium Cm |
| 97 Berkelium Bk | 98 Kalifornium Cf | 99 Einsteinium Es | 100 Fermium Fm | 101 Mendelevium Md | 102 Nobelium No | 103 Lawrencium Lr | 104 Rutherfordium Rf |
| 105 Dubnium Db | 106 Seaborgium Sg | 107 Bohrium Bh | 108 Hassium Hs | 109 Meitnerium Mt | 110 Darmstadtium Ds | 111 Röntgenium Rg | 112 Copernicium Cn |
| 113 Nihonium Nh | 114 Flerovium Fl | 115 Moscovium Mc | 116 Livermorium Lv | 117 Tenness Ts | 118 Oganesson Og | 119 Ununennium Uue | 120 Unbinilum Ubn |