Sensorische Systeme/ Neurosensorische Implantate
Netzhautimplantate
[Bearbeiten]Seit dem späten 20. Jahrhundert ist die Wiederherstellung der Sehkraft für blinde Menschen mittels künstlicher Augenprothesen das Ziel zahlreicher Forschungsgruppen und einiger privater Unternehmen auf der ganzen Welt. Ähnlich wie bei Cochlea-Implantaten besteht das Schlüsselkonzept darin, das visuelle Nervensystem mit elektrischen Impulsen zu stimulieren und die beschädigten oder degenerierten Photorezeptoren auf der menschlichen Netzhaut zu ersetzen. In diesem Kapitel werden wir die grundlegenden Funktionen eines Retina-Implantats sowie die verschiedenen Ansätze beschreiben, die derzeit untersucht und entwickelt werden. Die beiden üblichsten Ansätze für Netzhautimplantate sind die "epiretinale" und "subretinale" Implantate, welche Augenprothesen sind die sich entweder oben oder hinter der Netzhaut befinden. Wir werden keine nicht retinaspezifischen Ansätze zur Wiederherstellung des Sehvermögens behandeln, wie das BrainPort Vision System, das die Zunge durch visuelle Reize anregt oder Stimulationsimplantate im primären visuellen Kortex.
Netzhautstruktur und Funktionalität
[Bearbeiten]Abbildung 1 zeigt die schematische Nervenstruktur der menschlichen Netzhaut. Wir können zwischen drei Zellschichten unterscheiden. Die erste, welche von der Augenlinse am weitesten entfernt ist, besteht aus den Photorezeptoren (Stäbchen und Zapfen), deren Aufgabe darin besteht, ankommendes Licht in elektrische Signale umzuwandeln, die dann zur Zwischenschicht aus hauptsächlich bipolaren Zellen weitergeleitet werden. Diese bipolaren Zellen, die sowohl mit Photorezeptoren als auch mit Zelltypen wie horizontalen Zellen und Amakrinzellen verbunden sind, leiten das elektrische Signal an die retinalen Ganglienzellen (RGC) weiter. Für eine detaillierte Beschreibung der Funktionalität von Bipolarzellen, insbesondere hinsichtlich ihrer Unterteilung in AN- und AUS-Bipolarzellen, siehe das Kapitel zu Visuellen Systemen (Visual Systems). Die oberste Schicht, bestehend aus RGCs, sammelt die elektrischen Impulse aus den horizontalen Zellen und leitet sie über den Sehnerv an den Thalamus weiter. Von dort werden Signale zum primären visuellen Kortex weitergeleitet. Bei der Signalverarbeitung in der menschlichen Netzhaut sind einige wichtige Aspekte nennenswert. Erstens, während bipolare Zellen, ebenso wie horizontale und Amakrinzellen, abgestufte Potentiale erzeugen, erzeugen die RGCs stattdessen Aktionspotentiale. Ferner ist die Dichte der Zelltypen der Retina nicht einheitlich. Während im Bereich der Fovea eine extrem hohe Dichte an Stäbchen und Zapfen vorliegt, wobei zudem nur sehr wenige Photorezeptoren über die Zwischenschicht mit RGCs verbunden sind, findet sich eine deutlich geringere Dichte an Photorezeptoren in den peripheren Bereichen der Netzhaut wobei viele Photorezeptoren mit einem einzelnen gemeinsamen RGC verbunden sind. Letzteres hat auch direkte Auswirkungen auf das rezeptive Feld eines RGC, da es dazu tendiert, in den äusseren Regionen der Retina hin schnell zuzunehmen, aufgrund der niedrigeren Photorezeptordichte und der erhöhten Anzahl von Photorezeptoren, die mit demselben RGC verbunden sind. Dass bedeutet, die Genauigkeit nimmt in den Randbereichen stark ab.
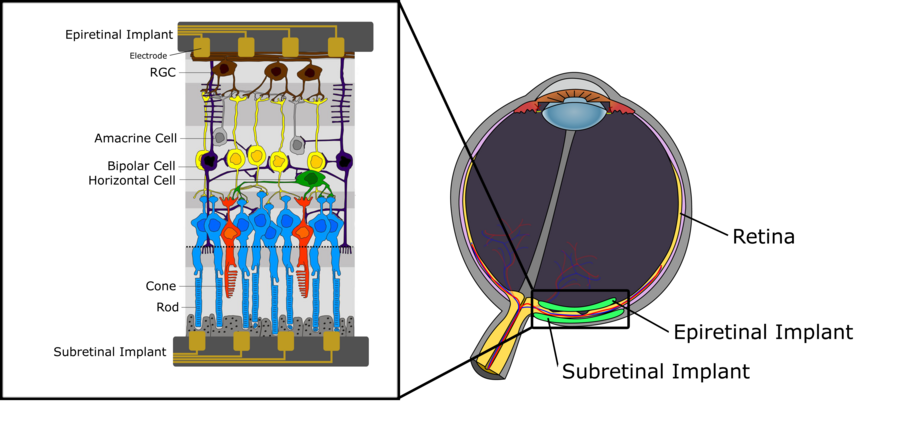
Implantat Anwendungsfall: Retinale Degeneration
[Bearbeiten]Wie bereits in diesem Wiki erwähnt, ist die Netzhaut ein lichtempfindliches Gewebe, das sich auf der Rückseite des Auges befindet und aus verschiedenen Schichten besteht, die eine Vielzahl von Zelltypen enthalten. Die Retina ist hauptsächlich an der neuralen visuellen Verarbeitung beteiligt, wobei Signale von Photorezeptoren ausgehen und durch die Axone der Ganglienzellen zum Gehirn wandern. Wenn dieses geschichtete Gewebe degeneriert, kann ein permanenter Sehverlust auftreten[1]. Dies wird häufig durch degenerative Netzhauterkrankungen wie altersbedingte Makuladegeneration (AMD) und Retinitis pigmentosa (RP) verursacht, welche die häufigsten auftretenden Krankheiten sind, die fortlaufend zu permanenter Sehstörung und -verlust führen. Gegenwärtig gibt es keine Heilung für diese beiden Netzhauterkrankungen und da moderne Therapien nur dazu in der Lage sind den Krankheitsverlauf zu verlangsamen, sind Therapien erforderlich, welche die Sehkraft des Patienten wiederherstellen. Eine der derzeit erforschten Geräte ist die Retinaprothese, die lebensfähiges Netzhautgewebe stimuliert, um das Sehvermögen wiederherzustellen, was in einem späteren Abschnitt genauer beschrieben wird[2].
Altersbedingte Makuladegeneration (AMD)
[Bearbeiten]

Wie der Name vermuten lässt, handelt es sich bei der Makuladegeneration um eine degenerative Netzhauterkrankung, die vor allem bei älteren Menschen auftritt. AMD dreht sich um die fortschreitende Degeneration von Zapfenphotorezeptoren in der Makula, was zu einer verschwommenen Sicht in der Mitte des Sichtfeldes führt. Die kann bis zu einem kompletten Sehverlust der Mitte des Sichtfeldes führen, welche als "blind spots" bekannt sind. Obwohl AMD ein oder beide Augen betreffen kann, führt dies selten zu völliger Erblindung, da die periphere Sicht des Patienten intakt bleibt. Es gibt zwei Haupttypen von AMD: trocken und nass. Die trockene AMD ist für die Mehrzahl der Erkrankungsfälle verantwortlich und ist durch kleine gelbe Ablagerungen, sogenannte Drusen, gekennzeichnet, die in der Makula zwischen retinalem Pigmentepithel und Choroidea vorkommen. Das Fortschreiten dieser Form der AMD ist zunächst langsam mit sehr wenigen Symptomen und verstärkt sich erst bei Retinaatrophie (Schwund). Die feuchte Form der AMD ist durch eine choroidale Neovaskularisation gekennzeichnet, dem abnormalen Wachsen von Blutgefässen, welche bei Beschädigung Blut- und Proteinlecks verursachen und zu Vernarbungen führen, was letztendlich zu einer dauerhaften Schädigung der Zapfenphotorezeptoren und damit zu Sehverlust führt. Das Fortschreiten der feuchten Form und der Verlust der Sehkraft ist viel schneller als bei der trockenen AMD[3].
Retinitis Pigmentosa (RP)
[Bearbeiten]
Retinitis pigmentosa ist eine vererbte degenerative Augenerkrankung, die Stäbchen-Photorezeptor-Zellen involviert, die vor allem bei jungen Individuen auftritt. Bei dieser Krankheit verschlechtern sich die Stäbchen progressiv und führen schliesslich zu Sehverlust im peripheren Sichtfeld sowie der Nachtsicht. Dieser Verlust tritt zuerst äusserlich, also in dem peripheren Sichtfeld, auf und schreitet dann nach innen fort, was einen "Tunnelblick" Effekt erzeugt. Die Sehbehinderung tritt symmetrisch auf, wobei beide Augen in ähnlichen Zeiträumen betroffen sind. Im Gegensatz zur AMD kann sich diese Augenerkrankung über die Peripherie hinaus ausdehnen und durch die Degeneration von Zapfenphotorezeptorzellen das zentrale Sichtsfeld beeinflussen. Dies lässt das Individuum kontinuierlichem Sehverlust erleiden, der schliesslich zur vollständigen Erblindung führen kann, wobei dies nur sehr selten geschieht. Retinitis Pigmentosa ist genetisch vererbt und hat eine Vielzahl von Genmutationen, die zu einem RP-Phänotyp führen können, was zu einer Vielzahl von Vererbungsmustern führt. Wenn das Vererbungsmuster jedoch autosomal dominant ist, sind die meisten Fälle mit Mutationen im Rhodopsin Gen verknüpft. Diese Mutation stört die Funktion von Rod-Opsin, einem essentiellen Protein in der Phototransduktionskaskade. Es gibt derzeit keine Heilung für Retinitis pigmentosa[2]. Im Jahr 2008 entdeckten Shigeru Sato und seine Kollegen jedoch ein extrazelluläres Matrix-ähnliches Netzhautprotein namens Pikachurin, das aufgrund seiner Beteiligung an Wechselwirkungen zwischen Photorezeptorzellen und bipolaren Zellen zu einer möglichen Krankheitstherapie führen könnte[4].
Mikroelektroden-Arrays zur Retinastimulation
[Bearbeiten]
Wie oben erwähnt, gibt es keine Heilung für die progressiven Sehstörungen, die durch Makuladegeneration und Retinitis pigmentosa verursacht werden. Bei beiden Erkrankungen überleben jedoch, selbst wenn ein erheblicher Verlust an Photorezeptorzellen vorliegt, eine signifikante Menge der inneren Netzhautneuronen besteht Jahre nach Beginn der Krankheit. Dies bietet eine Möglichkeit zur künstlichen Stimulation der verbleibenden, noch richtig funktionierenden Retinazellen durch Elektroden, um visuelle Information für den menschlichen Patienten wiederherzustellen. Mikroelektrodenarrays verwenden Elektroden, um die Retina extrazellulär durch eine enge Platzierung zu stimulieren. Diese enge Platzierung ermöglicht es eine elektrochemische Schnittstelle mit den bestehenden Zellen über die Salzlösung, welche sich bereits auf der Retina befindet, zu bilden. Der Strom wird durch die Matrix-Retina-Schnittstelle injiziert und verursacht schliesslich durch Depolarisation der Membranen der Neuronen Aktionspotentialen. Diese Stimulation kann kathodisch oder anodisch sein. Bei der kathodischen Stimulation entstehen negative Ladungen ausserhalb der Membran, wodurch intrazellulär positive Ladungen erzeugt werden, was zu einem Depolarisationsgradienten führt, der in unmittelbarer Nähe zur Elektrode am stärksten ist. Bei der anodischen Stimulation tritt eine Hyperpolarisation in den Bereichen auf, die den Elektroden am nächsten sind, und eine Depolarisation tritt in weiteren Abständen auf. Daher wird kathodisch im Allgemeinen als effizienter für eine Stimulation angesehen, da es eine viel geringere Strominjektion erfordert. Die Phase der Stimulation ist nicht der einzige Faktor, der die Wirksamkeit der Stimulation beeinflusst. Die Wellenform, die eine Vielzahl von Formen annehmen kann, wie beispielsweise monophasisch und biphasisch, spielt eine grosse Rolle bei der Sicherheit der Stimulation von Netzhautneuronen. Zum Beispiel wurde bei Affen entdeckt, dass ein monophasischer Strom mit nur einer anodischen Phase zuvor gesunde Zellen schädigen kann. Daher verwenden Implantate, die retinale Stimulation verwenden, eine ladungsausgeglichene biphasische Wellenform. Diese Wellenform verwendet eine kathodische Phase zur Stimulation und eine anodische Phase zur Entladung, wodurch die Ladungen auf der Membran ausgeglichen werden. Mit dieser Art der Stimulation kann eine Netzhautprothese ebenfalls hinter der Netzhaut implantiert werden und wird dann als subretinales Implantat bezeichnet. Dies bringt die Elektroden am nächsten zu den geschädigten Photorezeptoren und den noch funktionsfähigen Bipolarzellen, die das eigentliche Stimulationsziel darstellen. Wenn die Stimulationselektroden die Choroidea durchdringen, die die Blutversorgung der Retina enthält, werden die Implantate manchmal als "suprachoroidale" Implantate bezeichnet. Oder das Implantat kann auf die Netzhaut gelegt werden, die der Ganglion-Zellschicht am nächsten liegt, um stattdessen die RGCs zu stimulieren. Diese Implantate werden als epiretinale Implantate bezeichnet. Beide Ansätze werden derzeit von mehreren Forschungsgruppen untersucht. Sie haben sowohl signifikante Vorteile als auch Nachteile. Bevor wir sie einzeln näher betrachten, beschreiben wir einige wichtige Herausforderungen, die in beiden Fällen berücksichtigt werden müssen[2].
Herausforderungen
[Bearbeiten]Herausforderungen an die Elektrodentechnologie
[Bearbeiten]Eine grosse Herausforderung für Netzhautimplantate liegt in der extrem hohen räumlichen Dichte von Nervenzellen in der menschlichen Netzhaut. Es gibt ungefähr 125 Millionen Fotorezeptoren (Stäbchen und Zapfen) und 1,5 Millionen Ganglienzellen in der menschlichen Netzhaut, im Gegensatz zu ungefähr nur 15000 Haarzellen in der menschlichen Cochlea[5] [6] . In der Fovea, wo die höchste Sehschärfe erreicht wird, befinden sich bis zu 150000 Zapfen auf einem Quadratmillimeter. Während es im Vergleich zu Photorezeptoren insgesamt viel weniger RGCs gibt, liegt ihre Dichte im fovealen Bereich nahe bei der Dichte der Zapfen, was eine enorme Herausforderung darstellt, die Nervenzellen mit künstlichen Elektroden in ausreichend hoher räumlicher Auflösung anzusprechen. Praktisch alle aktuellen wissenschaftlichen Experimente mit Netzhautimplantaten verwenden Mikroelektrodenarrays (MEAs), um die Netzhautzellen zu stimulieren. Hochauflösende MEAs erreichen einen Zwischenelektrodenabstand von ungefähr 50 Mikrometern, was zu einer Elektrodendichte von 400 Elektroden pro Quadratmillimeter führt. Daher ist eine Eins-zu-eins-Verbindung zwischen Elektroden und Photorezeptoren oder RGCs im fovealen Bereich mit aktueller Elektrodentechnologie unmöglich. Die räumliche Dichte sowohl der Photorezeptoren als auch der RGCs nimmt jedoch schnell in Richtung der äusseren Bereiche der Netzhaut ab, wodurch eine Eins-zu-Eins-Stimulation zwischen Elektroden und peripheren Nervenzellen realistischer ist[7]. Eine weitere Herausforderung besteht darin, die Elektroden in sicheren Ladungsgrenzen zu betreiben. Ladungsdichten von mehr als 0,1 mC/cm² können das Nervengewebe bereits schädigen[7]. Im Allgemeinen ist die Stromamplitude, die für die Stimulation der Zelle erforderlich ist, umso grösser, je weiter eine Zelle von der Stimulationselektrode entfernt ist. Je niedriger die Stimulationsschwelle ist, desto kleiner kann die Elektrode sein, und desto kompakter können die Elektroden auf den MEAs platziert werden, wodurch die räumliche Stimulationsauflösung verbessert wird. Die Stimulationsschwelle ist definiert als die minimale Stimulationsstärke, die notwendig ist, um eine Nervenreaktion in mindestens 50% der Stimulationsimpulse auszulösen. Aus diesen Gründen besteht ein primäres Ziel bei der Gestaltung von Retina-Implantaten darin, einen möglichst niedrigen Stimulationsstrom zu verwenden und dennoch eine zuverlässige Stimulation (dh. Erzeugung eines Aktionspotentials bei RGCs) der Zielzelle zu gewährleisten. Dies kann entweder erreicht werden indem die Elektrode so nahe wie möglich an den Bereich der Zielzelle platziert wird, welcher am empfindlichsten auf einen elektrischen Feldimpuls reagiert, oder indem die Zellteile wie Dendriten und/oder Axone über der Elektrode wachsen. Dies erlaubt eine Stimulation der Zelle mit sehr geringen Strömen auch wenn der Zellkörper weit entfernt ist. Ausserdem folgt ein an der Netzhaut befestigtes Implantat automatisch den Bewegungen des Augapfels. Dies bringt zwar einige signifikante Vorteile mit sich, bedeutet aber auch, dass jede Verbindung mit dem Implantat - zum Einstellen der Parameter, zum Auslesen der Daten oder zum Bereitstellen externer Energie für die Stimulation - ein Kabel erfordert, das sich mit dem Implantat bewegt. Wenn wir unsere Augen etwa dreimal pro Sekunde bewegen, werden das Kabel und die damit verbundenen Verbindungen starken mechanischen Belastungen ausgesetzt. Für ein Gerät, das ohne externe Intervention für eine gesamte Lebensdauer funktionieren sollte, stellt dies eine grosse Herausforderung für die verwendeten Materialien und Technologien dar.
Biokompatibilität Herausforderungen
[Bearbeiten]Neben den elektrischen Herausforderungen ist eine wesentliche Herausforderung eines Netzhautimplantats der Kontakt mit biologischem Gewebe. Wenn eine fremde Substanz, wie ein Implantat, mit physiologischen Substanzen in Kontakt kommt, wird eine Immunantwort ausgelöst. Diese Reaktion erfolgt typischerweise in Form einer Entzündung oder Isolierung der Substanz, was oft zu einer Vernarbung der beteiligten Gewebe führt. Dies ist insbesondere bei Netzhautimplantaten ein Problem, da die Prothese durch Gewebe an den geeigneten Ort eingeführt werden muss. Wenn das verwendete Material zu grob ist oder nicht sorgfältig genug platziert wurde, kann eine Verletzung des Gewebes auftreten, wodurch die Immunantwort weiter verstärkt wird. Darüber hinaus können diese Reaktionen zu einem Verlust des elektrischen Signals im Laufe der Zeit führen, da das Immunsystem die stimulierte Fläche im Laufe der Zeit "einkapseln" kann, was ein langlebiges Implantat schwierig macht. Bis jetzt konnte ein epi-retinales Implantat, Argus II, Probleme mit der Biokompatibilität umgehen. Es funktioniert nach 3 Jahren bei einem Patienten noch. Dieses Implantat verwendet Silikon, ein Material mit einer guten Langzeit-Biokompatibilität, welches aber steif ist und somit nicht leicht zu modifizieren ist. Andere Materialien wie Polyimid und Gold wurden auf Retina-Implantat-Funktionalität und Biokompatibilität untersucht. Polyimid ist ein vielversprechendes Polymer für zukünftige Implantate, da Implantate aus diesem Material in Kurzzeitstudien für das menschliche Auge funktionsfähig sind. Ein solches Material ist aufgrund seiner hohen Biokompatibilität, Flexibilität und geringen Kosten überaus vorteilhaft. Die Optimierung von Materialien, die für Netzhautimplantate geeignet sind, wird fortgesetzt, da durch technologische Fortschritte komplexere Mikroelektrodenarrays erzeugen werden können, die unterschiedliche Substrate für maximale Funktionalität benötigen[8][9].
Subretinale Implantate
[Bearbeiten]Wie der Name bereits suggeriert sind subretinale Implantate visuelle Prothesen hinter der Netzhaut. So befindet sich das Implantat am nächsten an den beschädigten Photorezeptoren, mit dem Ziel, die Stäbchen und Zapfen zu umgehen und die bipolaren Zellen in der nächsten Nervenschicht in der Retina zu stimulieren. Der Hauptvorteil dieses Ansatzes liegt in der relativ geringen visuellen Signalverarbeitung, die zwischen den Photorezeptoren und den bipolaren Zellen stattfindet, die durch das Implantat nachgeahmt werden müssen. Das heisst, rohe visuelle Informationen, die beispielsweise von einer Videokamera aufgenommen werden, können direkt oder mit nur relativ rudimentärer Signalverarbeitung an die MEA weitergeleitet werden. Diese stimulieren dan die bipolaren Zellen, was die Prozedur von der Perspektive der Signalverarbeitung aus eher einfach macht. Dieser Ansatz hat jedoch einige schwerwiegende Nachteile. Die hohe räumliche Auflösung von Photorezeptoren in der menschlichen Retina stellt eine grosse Herausforderung bei der Entwicklung und Gestaltung einer MEA mit ausreichend hoher Stimulationsauflösung und daher geringem Abstand zwischen den Elektroden dar. Darüber hinaus fügt das Stapeln der Nervenschichten in der z-Richtung (mit der xy-Ebene tangential zur Netzhautkrümmung) eine weitere Schwierigkeit hinzu, wenn es darum geht die Elektroden in der Nähe der bipolaren Zellen anzuordnen. Da sich das MAE hinter der Netzhaut befindet, muss eine signifikante räumliche Lücke zwischen den Elektroden und den Zielzellen überwunden werden. Wie bereits erwähnt zwingt ein vergrösserter Abstand von Elektrode zu Zielzelle das MAE dazu, mit höheren Strömen zu arbeiten, wodurch die Elektrodengrösse, die Anzahl von Zellen innerhalb des Stimulationsbereichs einer einzelnen Elektrode und die räumliche Trennung zwischen benachbarten Elektroden vergrössert werden. All dies führt zu einer verminderten Stimulationsauflösung und zu einer Gefährdung der Netzhaut gegenüber dem Risiko einer Gewebeschädigung durch zu hohe Ladungen. Wie unten gezeigt, besteht ein Weg zur Bewältigung grosser Abstände zwischen Elektroden und den Zielzellen darin, die Zellen dazu zu bringen ihre Ansätze über längere Distanzen direkt über der Elektrode zu wachsen.
Ende 2010 veröffentlichte eine deutsche Forschungsgruppe in Zusammenarbeit mit der deutschen Privatfirma "Retina Implant AG" Ergebnisse von Studien mit subretinalen Implantaten bei Probanden[10]. Ein drei mal drei Millimeter grosses Mikrophotodiodenarray (MPDA) mit 1500 Pixeln, wobei jedes Pixel aus einer einzelnen lichtempfindlichen Photodioden und einer Elektrode besteht, wurde hinter der Netzhaut von drei Patienten implantiert, die aufgrund von Makuladegeneration an Erblindung litten. Die Pixel waren ungefähr 70 Mikrometer voneinander entfernt, was eine räumliche Auflösung von ungefähr 160 Elektroden pro Quadratmillimeter ergab - oder, wie von den Autoren des Papiers angegeben, einen visuellen Kegelwinkel von 15 Bogenminuten für jede Elektrode. Es sollte angemerkt werden, dass im Gegensatz zu Implantaten, die externe Videokameras verwenden, um eine visuelle Eingabe zu erzeugen, jedes Pixel des MPDA selbst eine lichtempfindliche Photodiode enthält, die den elektrischen Strom aus dem durch den Augapfel empfangenen Licht für seine eigene zugehörige Elektrode autonom erzeugt. Somit entspricht jedes MPDA-Pixel in seiner vollen Funktionalität einer Photorezeptorzelle. Dies hat einen grossen Vorteil: Da das MPDA hinter der menschlichen Netzhaut fixiert ist, bewegt es sich automatisch mit, wenn der Augapfel bewegt wird. Und da das MPDA selbst die visuelle Reize empfängt, um die elektrischen Ströme für die Stimulationselektroden zu erzeugen, werden Bewegungen des Kopfes oder des Augapfels natürlich gehandhabt und benötigen keine künstliche Berechnung. Bei einem der Patienten wurde das MPDA direkt unter der Makula platziert, was im Vergleich zu den anderen zwei Patienten, deren MPDA weiter entfernt von der Mitte der Netzhaut implantiert wurde, zu besseren Ergebnissen bei experimentellen Tests führte. Die Ergebnisse, die der Patient mit dem Implantat hinter der Makula erzielte, waren herausragend. Er konnte Buchstaben (5-8 cm gross) erkennen und Wörter lesen sowie Schwarz-Weiss-Muster mit unterschiedlichen Orientierungen unterscheiden[10].
Die experimentellen Ergebnisse mit den MPDA-Implantaten haben auch auf ein anderes visuelles Phänomen aufmerksam gemacht, was einen zusätzlichen Vorteil des MPDA-Ansatzes gegenüber Implantaten mit externen Bildgebungsgeräten zeigt: Die schnell nachfolgende Stimulation von Netzhautzellen führt schnell zu verminderten Antworten, was darauf hindeutet, dass Netzhautneuronen nach dem wiederholten Stimulieren für eine kurze Zeit gehemmt werden. Dies bedeutet, dass eine visuelle Eingabe, die auf eine MEA projiziert wird, die an oder hinter der Netzhaut befestigt ist, zu einem gesehenen Bild führt, das schnell verschwimmt, obwohl die elektrische Stimulation der Elektroden konstant bleibt. Dies liegt daran, dass die fixierten Elektroden auf der Netzhaut ständig dieselben Zellen auf der Netzhaut stimulieren, wodurch die Zellen im Laufe der Zeit immer weniger empfindlich auf einen konstanten Reiz reagieren. Der Prozess ist jedoch reversibel und die Zellen gewinnen ihre ursprüngliche Empfindlichkeit wieder, wenn der Stimulus wieder fehlt. Wie geht also ein intaktes visionäres System mit diesem Effekt um? Warum können gesunde Menschen auf ein Objekt fixieren, ohne dass es verschwimmt? Wie in [11] erwähnt , passt sich das menschliche Auge kontinuierlich in kleinen, nicht wahrnehmbaren Augenbewegungen an, was dazu führt, dass derselbe visuelle Reiz mit der Zeit auf leicht unterschiedliche Netzhautbereiche projiziert wird, auch wenn wir das Auge auf einem Objekt fixiert lassen. Dies umgeht erfolgreich das dieses Problem. Da das Implantat sowohl als Photorezeptor als auch als Elektrodenstimulator dient, wie es beim MPDA der Fall ist, können die natürlichen kleinen Augeneinstellungen leicht verwendet werden, um diesen Effekt in einer direkten Weise zu handhaben. Andere Implantatsansätze, die externe visuelle Eingaben (z. B. von Videokameras) verwenden, leiden unter diesem Effekt. Schnelles, künstliches Zittern der Kamerabilder löst das Problem möglicherweise nicht, da diese externe Bewegung nicht mit der Augenbewegung übereinstimmt und daher der visuelle Kortex dies einfach als eine wackelige oder verschwommene Szene interpretieren kann anstelle der gewünschten stetigen Langzeitprojektion des fixierten Bildes. Ein weiterer Vorteil von subretinalen Implantaten ist die präzise Korrelation zwischen stimulierten Arealen auf der Retina und der wahrgenommenen Lage des Reizes im Gesichtsfeld des Menschen. Im Gegensatz zu RGCs, deren Lage auf der Retina nicht direkt mit der Lage ihrer einzelnen rezeptiven Felder übereinstimmt, wird die Stimulation einer bipolaren Zelle genau an dem Punkt im Sichtfeld wahrgenommen, der dem geometrischen Ort auf der Netzhaut entspricht, an dem sich die bipolare Zelle befindet. Ein deutlicher Nachteil subretinaler Implantate ist jedoch der invasive chirurgische Eingriff.
Epiretinale Implantate
[Bearbeiten]Epiretinale Implantate befinden sich oben auf der Netzhaut und sind daher den Retina-Ganglionzellen (RGCs) am nächsten. Aus diesem Grund zielen epiretinale Implantate darauf ab, die RGCs direkt zu stimulieren, indem sie nicht nur die beschädigten Photorezeptoren umgehen, sondern auch jegliche neurale visuelle Zwischenberechnungen durch die bipolaren, horizontalen und amakrinen Zellen. Dies hat einige Vorteile: Erstens ist der chirurgische Eingriff bei einem epiretinalen Implantat weit weniger kritisch als bei einem subretinalen Implantat da die Prothese nicht hinter dem Auge implantiert werden muss. Ausserdem gibt es viel weniger RGCs als Photorezeptoren oder bipolare Zellen, was eine gröbere Stimulation mit erhöhtem Abstand zwischen den Elektroden (zumindest in den peripheren Regionen der Retina) oder sogar eine der tatsächlichen RGC-Dichte überlegene Elektrodendichte erlaubt. Dies ermöglicht mehr Flexibilität und Genauigkeit bei der Stimulation der Zellen. Eine Studie zur epiretinalen Stimulation peripherer Parasolzellen, die auf der Makaken-Retina durchgeführt wurde, liefert quantitative Details[7]. Parasolzellen sind eine Art von RGCs, die den zweit dichtesten Sehweg in der Retina bilden. Ihr Hauptzweck besteht darin, die Bewegung von Objekten im Sichtfeld zu kodieren und so Bewegung zu erfassen. Die Experimente wurden in vitro (im Glas) durchgeführt, indem das Makaken-Retina-Gewebe auf eine 61-Elektroden-MEA (60 Mikrometer Abstand zwischen den Elektroden) gelegt wurde. 25 individuelle Parasolzellen wurden identifiziert und elektrisch stimuliert, während Eigenschaften wie die Stimulationsschwelle und den optimalen Stimulationsort analysiert wurden. Die Schwelle wurde als der niedrigste Strom definiert, der bei 50% der Stimulationsimpulse (Impulsdauer: 50 Millisekunden) eine Spitze auf der Zielzelle auslöste und durch schrittweises Erhöhen der Stimulationsstärke bestimmt wurde, bis eine ausreichende neurale Antwort der Zelle registriert wurde. Zwei Aspekte sollten beachtet werden: Erstens zeigen Parasolzellen als RGCs ein Aktionspotentialverhalten, im Gegensatz zu bipolaren Zellen, die mit abgestuften Potentialen arbeiten. Zweitens wurden die Elektroden auf dem MAE sowohl für die Stimulationsimpulse als auch für die Aufzeichnung der neuralen Antwort von den Zielzellen verwendet. 25 Parasolzellen wurden auf dem 61-Elektroden-MAE lokalisiert, welches eine Elektrodendichte besass die signifikant höher als die Parasolzellendichte war, wodurch effektiv mehrere Elektroden innerhalb der rezeptiven Bereichen einer einzelnen Parasolzelle enthalten war. Zusätzlich zur Messung der Stimulationsschwellen, die notwendig sind, um eine zuverlässige Zellantwort auszulösen, wurde auch der Ort der besten Stimulation bestimmt. Der Ort der besten Stimulation bezieht sich auf den Ort der Stimulationselektrode auf der Zielzelle, wo der niedrigste Stimulationsschwellenwert benötigt wurde. Überraschenderweise wurde festgestellt dass dieser Bereich nicht, wie man annehmen könnte, au dem Zellsoma liegt, sondern etwa 13 Mikrometer weiter unten Axon entlang. Von nun an zeigten die Experimente die erwartete quadratische Zunahme der Stimulationsschwellenströme in Bezug auf den Anstieg der Distanz von Elektrode zu Soma. Die Studienergebnisse zeigten auch, dass alle Stimulationsschwellen deutlich unter den Sicherheitsgrenzwerten lagen (etwa 0,05 mC/cm², im Gegensatz zu 0,1 mC/cm² als (untere) Sicherheitsgrenze) und dass die Zellantwort auf einen Stimulationsimpuls schnell (0,2 ms Latenz im Durchschnitt) und präzise war (geringe Varianz der Latenz). Ferner ermöglichte die überlegene Elektrodendichte gegenüber der Parasolzellendichte eine zuverlässige Adressierung einzelner Zellen durch die Stimulation der geeigneten Elektrode, während verhindert wurde, dass in benachbarte Zellen ebenfalls eine Antwort hervorgerufen wird.
Überblick über alternative technische Ansätze
[Bearbeiten]In diesem Abschnitt wird ein kurzen Überblick über einige alternative Ansätze und Technologien, die derzeit erforscht werden, gegeben.
Nanoröhrchenelektrode
[Bearbeiten]Klassische MAEs enthalten Elektroden aus Titannitrid oder Indiumzinnoxid, die eine langfristiger Biokompatibilität des Implantat äusserst schwer gestalten[12]. Eine vielversprechende Alternative zu metallischen Elektroden sind Kohlenstoffnanoröhre, (carbon nanotubes, CNT), die eine Reihe sehr vorteilhafter Eigenschaften besitzen. Erstens sind sie vollständig biokompatibel, da sie aus reinem Kohlenstoff bestehen. Zweitens sind sie aufgrund ihrer Robustheit für eine langfristige Implantation geeignet, eine äussert wichtige Eigenschaft für visuelle Prothesen. Ferner können sie als Elektroden eingesetzt werden, da sie eine gute elektrische Leitfähigkeit besitzen. Und schliesslich führt ihre sehr poröse Natur zu extrem grossen Kontaktflächen, was die Neuronen dazu bringt, auf den CNTs zu wachsen, wodurch der Kontakt zwischen den Neuronen und den Elektroden verbessert und die Stimulationsströme verringert werden, die notwendig sind, um eine Zellreaktion auszulösen. CNT-Elektroden sind jedoch erst kürzlich entstanden und zu diesem Zeitpunkt sind nur wenige wissenschaftliche Ergebnisse verfügbar.
Drahtlose Implantatansätze
[Bearbeiten]Eine der wichtigsten technischen Herausforderungen bei Netzimplantaten betrifft die Verkabelung, die die MEA mit den externen Reizen, der Stromversorgung sowie den Steuersignalen verbindet. Die mechanische Beanspruchung der Verkabelung beeinträchtigt die Langzeitstabilität und -beständigkeit und stellt eine grosse Herausforderung an die verwendeten Materialien. Drahtlose Technologien könnten eine Möglichkeit darstellen, jegliche Verkabelung zwischen dem eigentlichen Netzhautimplantat und externen Geräten zu umgehen. Die Energie des einfallenden Lichts durch das Auge reicht nicht aus, um neuronale Antworten auszulösen. Um ein drahtloses Implantat arbeiten zu lassen, muss daher zusätzliche Energie zugeführt werden. Ein von der Stanford School of Medecine vorgestellter Ansatz verwendet ein Infrarot-LCD-Display, um die von einer Videokamera aufgenommene Szene auf eine Brille zu projizieren, wobei Infrarotimpulse auf den auf der Retina befindlichen Chip weiterreflektiert werden. Der Chip verwendet eine photovoltaische wiederaufladbare Batterie, um die Energie bereitzustellen, die benötigt wird, um die IR-Lichtimpulse in ausreichend starke Stimulationsimpulse zu übertragen. Ähnlich wie bei dem subretinalen Ansatz ermöglicht dies dem Auge auch, Objekte in der Szene auf natürliche Weise zu fixieren und zu fokussieren, da sich das Auge frei bewegen kann, wodurch verschiedene Teile des IR-Bildes auf der Brille auf verschiedene Bereiche des Chips auf der Netzhaut projiziert werden können. Anstelle von Infrarotlicht können auch induktive Spulen verwendet werden, um elektrische Energie und Datensignale von externen Geräten an das Implantat auf der Retina zu übertragen. Diese Technologie wurde erfolgreich im Netzhautimplantat EPIRET3 implementiert und getestet[13]. Diese Tests waren jedoch eher ein Proof-of-Concept, da nur die Fähigkeit des Patienten ein visuelles Signal bei Anwendung eines Reizes auf die Elektroden zu fühlen getestet wurde.
Gerichtetes neurales Wachstum
[Bearbeiten]Eine Möglichkeit eine präzise neurale Stimulation über längere Distanzen mit niedrigen Strömen zu erreichen ist die Neuronen über die Elektroden wachsen zu lassen. Durch das Auftragen der richtigen chemischen Lösung auf das Netzhautgewebe kann das neurale Wachstum gefördert werden. Dies kann erreicht werden, indem eine Schicht Laminin auf die MEA-Oberfläche aufgebracht wird. Um die neuralen Pfade zu steuern, wird das Laminin nicht gleichmässig über die MEA-Oberfläche aufgebracht, sondern in schmalen Pfaden, die ein den Verbindungen entsprechendes Muster bilden, an denen sich die Neuronen bilden sollen. Dieser Prozess des präzisen Auftragens des Laminins wird "Mikrokontaktdruck" genannt. Abbildung 5 zeigt solche Pfade. Das erfolgreiche gerichtete neurale Wachstum, das mit dieser Methode erreicht wurde, erlaubte die Anwendung von signifikant niedrigeren Stimulationsströmen im Vergleich zur klassischen Elektrodenstimulation, während es dennoch eine neurale Reaktion zuverlässig auslösen konnte[14]. Weiterhin folgt die Stimulationsschwelle nicht mehr dem quadratischen Anstieg gegenüber dem Elektroden-Soma-Abstand, sondern bleibt auch bei grösseren Abständen (> 200 Mikrometer) konstant auf dem gleichen niedrigen Niveau.
Mikroelektroden-Arrays zur Darstellung der Netzhautfunktion: Eine CMOS-basierte Technologie
[Bearbeiten]Wie bereits im Abschnitt "Herausforderungen" von Retina-Implantaten erläutert, leiden viele Mikroelektrodenanordnungen unter einer grossen Schrittgrösse und einer geringen Anzahl von Elektroden, was ihre Spezifität und Zielausrichtung auf Neuronen in neuralen Netzwerken beeinträchtigt. Dies ist ein limitierender Faktor wenn es darum geht Netzwerkdynamiken und Funktionalitäten von neuronalen Populationen zu beobachten. Insbesondere gehen viele zelluläre Details wie axonale Ausbreitungsgeschwindigkeiten und axonale Informationsverarbeitung in Arrays mit geringerer Dichte verloren. Kürzlich haben Forscher die Komplementär-Oxid-Halbleiter (CMOS)-Technologie genutzt, um Mikroelektrodenarrays hoher Dichte mit hoher räumlicher Auflösung zu erzeugen, die die Messung dieser zellulären Information sowie ein hohes Signal-Rausch-Verhältnis durch Platinbeschichtungen erlauben. Solche Arrays können 26400 Mikroelektroden über der Erfassungsmatrix von 3,85 × 2,10 mm² aufweisen. Mit einer Schrittweite von 17,5 μm beträgt die Elektrodendichte 3265 Elektroden pro μm² zu den 1024 Auslesekanälen[15]. Bei vielen Schaltern unter den Elektroden können verschiedene Elektrodenkonfigurationen verwendet werden, um die neuronale Population auf dem Chip zu analysieren. Mit solch einem empfindlichen und dichten Mikroelektrodenchip können Einzelzellenidentifikation, Netzwerkpegelanalyse und axonale Information von neuralen Zellen aufgezeichnet werden. Diese Technologie öffnet die Tür zu elektrophysiologischen Phänotypen "Biomarkern", die für die Modellierung von Krankheiten und für die Funktionalität von Geweben bestimmt werden sollen, da eine präparierte Retina plattiert und auf einem Mikroelektroden-Array aufgezeichnet werden kann[16].
Netzhautaufnahmen
[Bearbeiten]Lichtsignale werden in der Netzhaut interpretiert und diese Information wird in den Neuronen der Ganglionschicht gespeichert, die als retinale Ganglienzellen (RGCs) bekannt sind. Diese Zellen senden diese Information dann über Aktionspotentiale, die durch Mikroelektrodenarrays aufgezeichnet werden können, um die Retinalschaltung, die Entwicklung und die Codierung einer visuellen Szene zu verstehen. Diese In-vitro-Experimente werden typischerweise durchgeführt, indem zuerst die Netzhaut von ihrem nativen Gewebe isoliert wird, das Gewebe mit den nach unten gerichteten Netzhautganglienzellen auf der Anordnung plattiert wird und unter Verwendung von Lichtstimulation aufgezeichnet wird. Anschliessend werden die Daten mittels Spikesortierung (Spitzensortierung) analysiert, was weiter unter genauer erklärt wird. Medikamentenblocker und verschiedene Lichtreize können verwendet werden, um die Reaktion des Photorezeptors zu bestimmen und die Funktionalität zu bewerten. Darüber hinaus können Forscher die Auswirkungen von retinalen Mutationen auf das RGC-Spiking-Verhalten untersuchen, um elektrophysiologische Biomarker zu bestimmen. In einem Experiment verwendeten die Forscher ein Mikroelektroden-Array für Wildmaus-Retinas und Mäuse mit einem FRMD7-Knockout. FMRD7 ist eine Mutation, die bei betroffenen Individuen mit einer horizontalen, blickabhängigen schnellen Augenbewegung verbunden ist. Die Daten von den Aufnahmesitzungen auf der Mikroelektrodenanordnung deuteten darauf hin, dass es einen Verlust an Reaktionen auf horizontal gerichtete selektive Zellen in der Retina gab. Die Wildmäuse hatten keinen Verlust der Reaktionen in horizontalen oder vertikalen Richtungsselektiven Zellen. Ein solcher Befund weist auf die Fähigkeit hin, Mikroelektroden-Array-Technologie zu verwenden, um elektrophysiologische Biomarker von Netzhauterkrankungen in zukünftigen Forschungen zu bestimmen[17].
Spike Sortierung
[Bearbeiten]Mit den neuesten Mikroelektroden-Technologien, die neuronale Aufzeichnungen von Tausenden von Elektroden ermöglichen, können grosse Mengen simultaner elektrophysiologischer Daten aus neuralem Gewebe und Netzwerken analysiert werden, um relevante elektrische Informationen über das Nervensystem zu enthüllen. Bei Verwendung eines Mikroelektrodenarrays für die Neurowissenschaft werden elektrische Signale von Neuronen (Aktionspotentiale) extrazellulär aufgezeichnet. Dies bedeutet, dass das Signal, das in diesen Aufzeichnungen erfasst wird, das Gegenteil von Patch Clamp ist; die Amplitude des Aktionspotentials ist im Gegensatz zur Patch-Clamp negativ. Diese extrazellulären Signaturen enthalten nicht nur Informationen über die Aktionspotentiale, sondern auch über die synaptische Mechanismen (lokale Feldpotentiale), die durch Filterung und Analyse identifiziert werden können. Der Prozess zum Analysieren und Zuordnen dieser elektrophysiologischen Information zu einem einzelnen Neuron wird als Spikesortieren bezeichnet.


Der Hauptaspekt einer Aufzeichnung, die in einer Mikroelektrodenaufzeichnung analysiert wird, ist der Spike-Train. Ein Neuron kann durch seine Spikingsaktivität identifiziert werden, da der Zeitpunkt jedes Ereignisses von der Grösse, Form und Position des Neurons relativ zur Elektrode abhängt. Bei der Aufzeichnung von Tausenden von Neuronen wird die Spikesortierung für das Cocktailparty-Phänomen eine Herausforderung. Mit mehreren Neuronen in unmittelbarer Nähe zueinander ist es für eine Elektrode sehr einfach, Signale von mehreren Neuronen gleichzeitig aufzuzeichnen. Daher muss das Spikesortieren ein einzelnes Neuron durch sein elektrisches "Rattern" identifizieren, wenn auch viel Hintergrund- "Rattern" auftritt. Die Spike-Sortierung ist ein mehrstufiger Prozess, bei dem die Rohdaten aus der neuronalen Population entnommen und trotz dieses Hintergrundrauschens Spikes einem einzelnen Neuron zugewiesen werden.
Die Übersicht für den Spike-Sortierprozess kann folgende Schritte haben: Rohdaten vorverarbeiten → Spike-Erkennung → Spikes und Ausrichtung extrahieren → Funktionsextraktion → Clustering → Klassifikation. In diesem allgemeinen Arbeitsablauf nimmt ein Spike-Sortieralgorithmus die Rohdaten aus der neuronalen Population und bereitet sie zunächst vor, indem er den niederfrequenten Teil des Aktionspotentials (Rauschen) herausfiltert. Spikes werden dann durch Setzen einer Spannungsschwelle erkannt. Danach müssen die extrahierten Spike-Wellenformen mit der Zeit in Bezug auf ein allgemeines Merkmal des Aktionspotentials, wie beispielsweise seine Position, ausgerichtet werden. Dann werden die Merkmale aus jeder einzelnen Wellenform unter Verwendung einer Hauptkomponentenanalyse oder von Wavelets extrahiert, was notwendig ist, um die Daten auf die notwendigen Dimensionen zu reduzieren, die die interessante Information enthalten. Die Spitzen werden dann gruppiert, um eine Vorlage für ein einzelnes Neuron zu erstellen. Dies geschieht für die einzelnen Neuronen in den Daten. Es gibt keinen Spike-Sortierungsalgorithmus, der "eine Grösse für alle passt", da Multielektroden-Aufzeichnungen zwischen verschiedenen Zelltypen, Spezies und der Art der durchgeführten Aufzeichnung unterscheiden können. Daher müssen Algorithmen angepasst und optimiert werden, um Ergebnisse zu erzeugen, die die Rohdaten genau darstellen können. Sobald die Daten jedoch spike-sorted sind, kann aus den Daten eine Fülle von Informationen gewonnen werden, wie Interspike-Intervalle, Refraktärzeiten und die Fähigkeit, Daten einzelner Neuronen gegeneinander abzubilden, um Unterschiede zu erkennen[18].
Andere visuelle Implantate
[Bearbeiten]Neben der Stimulation der Netzhaut können auch andere Elemente des visuellen Systems stimuliert werden
Stimulation des Sehnervs
[Bearbeiten]Mit Manschettenelektroden, typischerweise mit nur wenigen Segmenten.
Vorteile:
- Kleines Trauma für das Auge.
Herausforderungen:
- Nicht sehr spezifisch.
Kortikale Implantate
[Bearbeiten]
Dr. Mohamad Sawan , Professor und Forscher am Polystim neurotechnologies Laboratory der Ecole Polytechnique de Montreal, hat an einer visuellen Prothese gearbeitet, die in den menschlichen Kortex implantiert werden soll. Das Grundprinzip von Dr. Sawans Technologie besteht darin, den visuellen Kortex zu stimulieren, indem ein Silizium-Mikrochip auf ein Netzwerk von Elektroden aus biokompatiblen Materialien implantiert wird und jede Elektrode einen stimulierenden elektrischen Strom injiziert, um eine Reihe von Leuchtpunkten zu erzeugen ( eine Reihe von Pixeln) im Sichtfeld der blinden Person. Dieses System besteht aus zwei Teilen: dem Implantat und einem externen Controller. Das im visuellen Kortex platzierte Implantat empfängt drahtlos Daten und Energie von der externen Steuerung. Dieser implantierbare Teil enthält alle Schaltkreise, die notwendig sind, um die elektrischen Stimuli zu erzeugen und die sich ändernde Grenzfläche zwischen Mikroelektrode und biologischem Gewebe zu überwachen. Andererseits umfasst die batteriebetriebene äussere Steuerung eine Mikrokamera, die das Bild erfasst, sowie einen Prozessor der das Bild in Elektrische Signale für den Körper übersetzt und das Implantat überwacht. Der externe Controller und das Implantat tauschen Daten über eine leistungsstarke transkutane Funkfrequenzverbindung (RF) in beide Richtungen aus. Das Implantat wird auf die gleiche Weise angetrieben.
Vorteile:
- Viel grössere Fläche für die Stimulation: 2° Radius des zentralen Retina-Sichtsfeldes entspricht 1 mm² auf der Netzhaut, aber 2100 mm² im visuellen Kortex.
Herausforderungen:
- Die Implantation ist invasiver.
- Teile des Sichtfeldes liegen in einem Sulcus und sind sehr schwer zu erreichen.
- Die Stimulation kann Anfälle auslösen.
Cochleaimplantate
[Bearbeiten]
Ein Cochleaimplantat (CI) ist ein chirurgisch implantiertes elektronisches Gerät, das die mechanischen Teile des auditorischen Systems durch direkte Stimulation der Hörnervenfasern durch Elektroden in der Cochlea ersetzt. Kandidaten für Cochlea-Implantate sind Menschen mit schwerem bis tiefgreifendem sensorineuralen Hörverlust in beiden Ohren und einem funktionierenden Hörnervensystem. Sie werden von post-lingual tauben Menschen verwendet, um ein gewisses Verständnis von Sprache und anderen Lauten zurück zu erlangen, sowie von vorsprachlich tauben Kindern, um ihnen das Hören in einer schwächeren Form zu ermöglichen. (Die Diagnose von Hörverlust bei Neugeborenen und Kleinkindern erfolgt mit otoakustischen Emissionen und / oder der Aufzeichnung von akustisch evozierten Potentialen.) Eine relativ neue Entwicklung ist die Verwendung von bilateralen Implantaten, die es dem Empfänger ermöglichen, Schall zu lokalisieren.
Teile des Cochlea-Implantats
[Bearbeiten]Das Implantat wird chirurgisch unter die Haut hinter dem Ohr gelegt. Die grundlegenden Teile des Geräts umfassen:
Extern:
- ein Mikrofon das Geräusche aus der Umgebung aufnimmt
- ein Sprachprozessor der selektiv die hörbaren Sprache priorisiert und die elektrischen Schallsignale durch ein dünnes Kabel zum Sender sendet,
- ein Sender der von einem hinter dem äusseren Ohr angeordneten Magneten in Position gehalten wird, und die verarbeiteten Schallsignale durch elektromagnetische Induktion an das interne Gerät sendet

Intern:
- ein Empfänger und Stimulator der im Knochen unter der Haut befestigt ist, welcher die Signale in elektrische Impulse umwandelt und sie durch ein internes Kabel an die Elektroden sendet,
- eine Anordnung von bis zu 24 in die Cochlea gelegten Elektroden, die die Impulse zu den Nerven in der Scala tympani und dann direkt durch den Hörnerv zum Gehirn senden
Signalverarbeitung für Cochlea-Implantate
[Bearbeiten]Beim normalen Hörern ist der primäre Informationsträger für Sprachsignale die Hüllkurve, während es bei Musik die Feinstruktur ist. Dies ist auch für tonale Sprachen wie Mandarin relevant, wo die Bedeutung von Wörtern von ihrer Tonlage abhängt. Ebenfalls sind räumliche Informationen der Geräusche auch in der Feinstruktur kodiert.
Der Sprachprozessor in einem Cochlea-Implantat transformiert das Mikrofoneingangssignal in eine parallele Anordnung von Elektrodensignalen, die für die Cochlea bestimmt sind. Algorithmen für die optimale Übertragungsfunktion zwischen diesen Signalen sind immer noch ein aktives Forschungsgebiet. Die ersten Cochlea-Implantate waren Einkanalgeräte. Der rohe Ton wurde bandpassiert, um nur den Frequenzbereich der Sprache einzuschliessen, und dann auf eine 16 kHz-Welle moduliert, um dem elektrischen Signal zu ermöglichen, elektrisch mit den Nerven zu koppeln. Dieser Ansatz war zwar in der Lage, ein sehr grundlegendes Hören zu ermöglichen, welches jedoch extrem eingeschränkt war, da es die Kapazität der Cochlea nicht vollständig ausgenutzt werden konnte.
Das Aufkommen von Mehrkanalimplantaten öffnete die Tür, um eine Reihe verschiedener Sprachverarbeitungsstrategien auszuprobieren, um das Hören zu erleichtern. Diese können grob in Wellenform- und Merkmalextraktionsstrategien unterteilt werden.
Wellenformstrategien
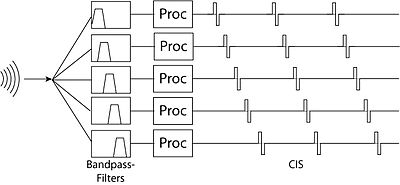
[Bearbeiten]Diese beinhalten im Allgemeinen das Anwenden einer nichtlinearen Verstärkung auf den Klang (ein Eingangsaudiosignal mit einem Dynamikbereich von ~ 30 dB muss zu einem elektrischen Signal mit einem Dynamikbereich von ~ 5 dB komprimiert werden) und Weiterleiten durch parallele Filterbänke. Die erste Wellenformstrategie, die versucht wurde, war der komprimierte analoge Ansatz. Bei diesem System wird das Rohaudio zunächst mit einem geregelten Verstärker gefiltert (die Verstärkungsregelung reduziert den Dynamikbereich des Signals). Das Signal wird dann durch parallele Bandpassfilter geleitet, und der Werte aus diesen Filtern wird genutzt, um Elektroden an ihren geeigneten Stellen zu stimulieren.
Ein Problem mit dem Compressed Analog-Ansatz bestand darin, dass zwischen benachbarten Elektroden ein starker Wechselwirkungseffekt bestand. Wenn Haarzellen in der Reichweite beider Elektroden waren, konnte es zu Verzerrungen kommen. Die Lösung dafür war der Continuous Interleaved Sampling Approach - bei dem die von benachbarten Filtern angesteuerten Elektroden zu etwas unterschiedlichen Zeiten stimulierten. Dies eliminiert den Interferenzeffekt zwischen benachbarten Elektroden, bringt jedoch das Problem mit sich, dass aufgrund der Verschachtelung die zeitliche Auflösung verschlechtert wird.
Merkmalextraktionsstrategien
[Bearbeiten]Diese Strategien konzentrieren sich weniger auf das Übertragen von gefilterten Versionen des Audiosignals und mehr auf das Extrahieren von mehr abstrakten Merkmalen des Signals und das Übertragen dieser an die Elektroden. Die ersten Merkmalextraktionsstrategien suchten nach den Formanten (Frequenzen mit maximaler Energie) in der Sprache. Nur Elektroden, die diesen Formantfrequenzen entsprechen, würden aktiviert werden. Die Hauptbeschränkung dieses Ansatzes bestand darin, dass Formanten hauptsächlich Vokale identifizieren, und Konsonanteninformation, die hauptsächlich in höheren Frequenzen liegt, wurde schlecht übertragen. Das MPEAK-System verbesserte später dieses Design durch den Einbau von Hochfrequenzfiltern, die stimmlose Laute (Konsonanten) besser stimulieren könnten, indem Hochfrequenzelektroden und Formantfrequenzelektroden in zufälligen Intervallen stimuliert wurden.[19][20][21]
Aktuelle Entwicklungen
[Bearbeiten]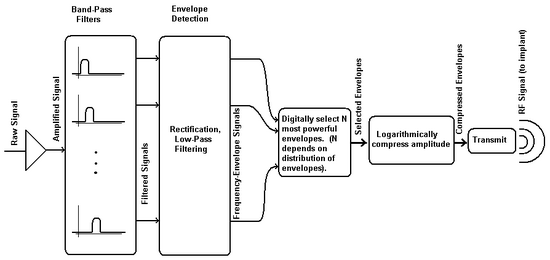
Die führende Strategie ist derzeit das SPEAK-System, das die Eigenschaften von Waveform- und Feature-Detection-Strategien kombiniert. In diesem System durchläuft das Signal eine parallele Anordnung von 20 Bandpassfiltern. Die Hüllkurve wird aus jeder dieser Filtern extrahiert, und mehrere der stärksten Frequenzen werden ausgewählt (wie viele davon von der Form des Spektrums abhängen), und der Rest wird verworfen. Dies wird als "n-of-m" -Strategie bezeichnet. Die Amplituden werden dann logarithmisch komprimiert, um den mechanischen Signalbereich des Schalls an den viel engeren elektrischen Signalbereich der Haarzellen anzupassen.
Mehrere Mikrofone
[Bearbeiten]Auf seinen neuesten Implantaten verwendet die Firma Cochlear 3 Mikrofone anstatt nur einem. Die zusätzliche Information wird zur Strahlformung verwendet, dh zum Extrahieren von mehr Information von Schall, der von geradeaus kommt. Dies kann das Signal-Rausch-Verhältnis um bis zu 15 dB verbessern, wenn mit anderen Personen gesprochen wird, wodurch die Sprachwahrnehmung in geräuschvollen Umgebungen erheblich verbessert wird.
Kombination CI und Hörgerät
[Bearbeiten]Die Erhaltung des niederfrequenten Gehörs nach Cochlea-Implantation ist mit einer sorgfältigen Operationstechnik und sorgfältiger Planung der Elektroden möglich. Für Patienten mit verbleibendem Niederfrequenz-Hörvermögen bietet das Unternehmen MedEl eine Kombination aus einem Cochlea-Implantat für die höheren Frequenzen und einem klassischen Hörgerät für die niedrigeren Frequenzen an. Dieses System, das als EAS für die elektroakustische Stimulation bezeichnet wird, nutzt nur 18 mm der Cochlea, während das vollständige CI 31,5 mm besetzt. (Die Länge der Cochlea beträgt etwa 36 mm.) Dies führt zu einer signifikanten Verbesserung der Musikwahrnehmung und einer verbesserten Spracherkennung für Tonsprachen da nur Teile des Gehörs elektronisch sind.
Feine Struktur
[Bearbeiten]
Für hohe Frequenzen verwendet das menschliche Hörsystem nur tonotopische Codierung für Information. Für tiefe Frequenzen wird jedoch auch zeitliche Information verwendet: Der Hörnerv feuert synchron mit der Phase des Signals. Im Gegensatz dazu verwendeten die ursprünglichen CIs nur das Leistungsspektrum des eingehenden Signals. In seinen neuen Modellen verwendet MedEl die Zeitinformation für niedrige Frequenzen, die es Feinstruktur nennt, um das Timing der Stimulationsimpulse zu bestimmen. Dies verbessert die Musikwahrnehmung und Sprachwahrnehmung für Tonsprachen wie Mandarin.
Mathematisch kann die Hüllkurve und Feinstruktur eines Signals elegant mit der Hilbert-Transformation berechnet werden (siehe Abbildung). Der entsprechende Python-Code ist verfügbar unter [22].
Virtuelle Elektroden
[Bearbeiten]Die Anzahl der verfügbaren Elektroden ist durch die Grösse der Elektrode selbst (und die resultierenden Ladungs- und Stromdichten) und durch die Stromverteilung entlang der Endolymphe begrenzt. Um die Frequenzspezifität zu erhöhen, kann man zwei benachbarte Elektroden zusammen stimulieren. Die Probanden berichten, dies als einen einzelnen Ton bei einer Frequenz zwischen den beiden Elektroden wahrzunehmen.
Simulation der Stimulationsstärke eines Cochlea-Implantats
[Bearbeiten]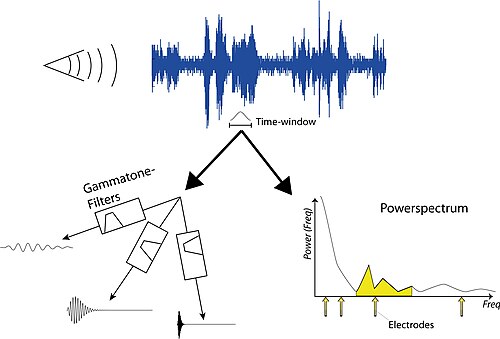
Die Klangverarbeitung im Cochlea-Implantat unterliegt noch einer Menge Forschung und ist einer der wichtigsten Produktunterscheidungen zwischen den Herstellern. Die grundlegende Klangverarbeitung ist jedoch ziemlich einfach und kann implementiert werden, um einen Eindruck von der Klangqualität zu erhalten, die von Patienten wahrgenommen wird, die ein Cochlea-Implantat verwenden. Der erste Schritt in diesem Prozess besteht darin, einige Geräusche aufzunehmen und deren Frequenz zu analysieren. Dann wird ein Zeitfenster gewählt für welches wir die Stimulationsstärken der CI-Elektroden finden wollen. Es gibt zwei Möglichkeiten, dies zu erreichen: i) durch den Einsatz linearer Filter ( siehe Gammatone-Filter ); oder ii) durch Berechnung des Leistungsspektrums (siehe Spektralanalyse ).
Cochlea-Implantate und Magnetresonanztomographie
[Bearbeiten]Mit mehr als 150.000 Implantationen weltweit sind Cochlea-Implantate (CIs) mittlerweile eine Standardmethode zur Behandlung von schwerem bis hochgradigem Hörverlust. Da die Vorteile von CIs gross sind, werden die Kostenträger eher bereit, CIs zu unterstützen, und aufgrund der Untersuchungsprogramme von Neugeborenen in den meisten Industrieländern erhalten viele Patienten CIs in den Kinderschuhen und werden sie wahrscheinlich auch während ihres gesamten Lebens behalten. Einige von ihnen werden im Verlauf ihres Lebens eine MRT Untersuchung benötigen. Für grosse Teile der Bevölkerung, einschliesslich Patienten mit Schlaganfall, Rückenschmerzen oder Kopfschmerzen, hat sich die MRT zu einer Standardmethode für die Diagnose entwickelt. Die MRT verwendet Impulse von Magnetfeldern, um Bilder zu erzeugen. Aktuelle MRT-Maschinen arbeiten mit Magnetfeldern von 1,5 Tesla. 0,2 bis 4,0 Tesla Geräte sind üblich und die Radiofrequenzleistung kann in einer 1,5 Tesla Maschine bis zu 6 kW erreichen.
Cochlea-Implantate wurden historisch als inkompatibel mit MRT-Maschinen mit Magnetfeldern von mehr als 0,2 T angesehen. Die externen Teile des Geräts müssen immer entfernt werden. Für die internen Teile des Geräts gelten unterschiedliche Vorschriften. Die aktuellen Richtlinien der US-amerikanischen Food and Drug Administration (FDA) erlauben eine eingeschränkte Nutzung der MRT nach CI-Implantation. Die Geräte Pulsar und Sonata (MED-EL Corp, Innsbruck, Österreich) sind für den Einsatz des Magneten mit 0,2 T MRT zugelassen. Der Hi-res 90K (Advanced Bionics Corp., Sylmar, CA, USA) und der Nucleus Freedom (Cochlear America, Englewood, CO, USA) sind nach chirurgischer Entfernung des internen Magneten für 1,5 T MRT zugelassen. Jedes Entfernen und Wiedereinsetzen des Magneten kann mit einem kleinen Eingriff unter örtlicher Betäubung durchgeführt werden, aber das Verfahren schwächt wahrscheinlich die Tasche des Magneten und riskiert eine Infektion des Patienten.
Leichenuntersuchungen haben gezeigt, dass das Risiko besteht, dass das Implantat in einem 1,5-T-MRT-Gerät verschoben wird. Das Risiko könnte jedoch eliminiert werden, wenn ein Kompressionsverband verwendet wird. Dennoch erzeugt das CI ein Artefakt, das möglicherweise den diagnostischen Wert des Scans verringern könnte. Die Grösse des Artefakts steht im Verhältnis zur Grösse des Kopfes des Patienten, dies könnte für MRT-Scans mit Kindern besonders schwerwiegend sein. Eine neuere Studie von Crane et al., 2010 fand heraus, dass das Artefakt um den Bereich des CI eine mittlere anterior-posteriore Dimension von 6,6 ± 1,5 cm (Mittelwert +/- Standardabweichung) und eine Mittelung von links nach rechts hatte 4,8 +/- 1,0 cm (Mittelwert +/- Standardabweichung) (Crane et al., 2010). ([23])
Vestibularimplantate
[Bearbeiten]Einführung
[Bearbeiten]Menschen mit geschädigten vestibulären Systemen leiden an einer Kombination von Symptomen, die Gehör- und Sehstörungen, Gleichgewichtsstörungen, Schwindel und räumliche Desorientierung umfassen können. Gegenwärtig gibt es keine wirksame Behandlung für Patienten mit schwachen oder beschädigten vestibulären Systemen. In den letzten zehn Jahren haben Wissenschaftler ein elektrisches Stimulationsgerät entwickelt, das ähnlich wie Cochlea-Implantate die Funktion des halbkreisförmigen Kanals wiederherstellen soll. Vestibuläre Implantate sollen das Gleichgewicht bei Patienten mit einem geschädigten vestibulären System wiederherstellen. Abbildung [24] zeigt einen Prototyp des vestibulären Implantats, bei dem es sich um ein modifiziertes Cochlea-Implantat handelt, das von MED-EL (Innsbruck, Österreich) entwickelt wurde.

Dieser vestibuläre Neuroprothesen-Prototyp enthält vier Hauptkomponenten: einen elektrischen Stimulator, drei extracochleäre Elektroden, die in den Ampullen eines jeden Bogengangs platziert werden und eine intracochleäre Anordnung. Wenn das vestibuläre Implantat eingeschaltet wird, werden elektrische Stimulationsimpulse in Form von zweiphasigen Ladungsausgleichsimpulsen über jede extracochleäre Elektrode in Richtung eines jeweiligen Vestibularnervs abgegeben [24]. Letztendlich würde die elektrische Stimulation das Gleichgewicht im Patienten wiederherstellen, indem der Blick über den vestibulookulären Reflex (VOR) stabilisiert wird. Der Fortschritt in Richtung einer implantierbaren Prothese hat vielversprechende Ergebnisse gezeigt, um die normale vestibuläre sensorische Transduktion von Kopfdrehungen effektiv wiederherzustellen. Das Erzielen eines genauen Stimulationsparadigmas, um dreidimensionale Kopfbewegungen chronisch zu kodieren, ohne unerwünschte neuronale Aktivität zu verursachen, bleibt jedoch eine von mehreren Hauptherausforderungen.
Entwicklung der Vestibularprothese (1963-2014)
[Bearbeiten]Cohen und Suzuki[25] führten 1963 den Begriff der vestibulären Prothese ein, indem sie demonstrierten, dass Augenbewegungen durch elektrische Stimulation des Ampullenastes eines Vestibularnervs induziert werden können. Die folgenden Studien wurden entwickelt, um ein kontinuierliches und genaues Stimulationsmodell für die Rehabilitation von Patienten mit verschiedenen Arten von vestibulären Störungen, wie bilateraler Verlust der vestibulären Funktion (BVL) und Meniere-Krankheit[24][26] zu entwickeln. Vier Jahrzehnte nach Cohen und Sukukis bahnbrechenden Arbeiten entwickelten Merfeld und seine Kollegen das erste vestibuläre Gerät zur Erzeugung glatter Augenbewegungen durch elektrische Stimulation des Vestibularnervs[27][28] . Die Durchführbarkeit von neuro-elektronischen Vestibular-Geräten hat Forscher dazu inspiriert, ein Bewegungserkennungssystem zu integrieren, um Kopfbewegungen zu messen. Santina und seine Kollegen[29][30][31][32] verwendeten gyroskopische Sensoren, um Bewegungen im dreidimensionalen Raum zu messen und kodierten diese Informationen um Signale zu erzeugen, die die Muskeln jedes Auges über den Gleichgewichtsnerv steuern. Seit Ende 2012 haben nur zwei Gruppen auf der Welt Vestibularimplantat-Studien am Menschen durchgeführt: Ein Team geführt von Jay Rubinstein an der Universität von Washington und eine gemeinsame Anstrengung eines Teams geführt von Herman Kingma an der Maastrict University of Medical Center in der Niederlande und die zweite Gruppe von Jean-Philippe Guyot an den Hopitaux Universities de Geneve, Schweiz[24]. Jay Rubinstein leitete 2010 die erste vestibuläre klinische Studie. Rubinstein und seine Kollegen hatten erfolgreich einen vestibulären Schrittmacher installiert, um unwillkürliche Schwindelanfälle bei Patienten mit Menière-Syndrom zu reduzieren oder gar zu beenden[26]. Dieses Gerät wurde mit einem Handregler kombiniert, um eine Reihe von elektrischen Stimuli zu starten und zu stoppen, die eine oder alle Elektroden aktivierten aber keine Bewegung verarbeiteten[26]. Leider führte der vestibuläre Schrittmacher bei implantierten Patienten dazu, dass sich sowohl die auditorische als auch die vestibuläre Funktion erheblich verschlechterte [33][26][24]. Aus dieser Gruppe wurde eine neue Richtung gewählt, um ein anderes elektrisches Stimulationsparadigma zu erforschen, indem Informationen über Bewegung einbezogen werden[33]. Der zweite Versuch für klinische Studien am Menschen wurde von Kingma, Guyot und seinen Kollegen im Jahr 2012 durchgeführt. Vestibuläre Implantate, die in dieser Studie verwendet wurden, wurden von MED-EL prototypisiert. Perez-Fornos und seine Kollegen[24] zeigten, dass Patienten eine zufriedenstellende funktionelle Erholung erreichten, die es ihnen erlaubte, alltägliche Aktivitäten wie Gehen auszuführen.
Aktuelle Fortschritte werden durch laufende Partnerschaften zwischen Universitäten und Industrie erzielt. Es gibt vier führende Universitäten und / oder Industriepartnerschaften, die auf eine vestibuläre Prothese für klinische Anwendungen hinarbeiten. Zu diesen Teams gehören: Rubinstein an der Universität von Washington und Cochlear Ltd (Lane Cove, Australien), Della Santinas Team am Vestibular NeuroEngineering Laboratory [Johns Hopkins Schule für Medizin, Baltimore, MD, USA], Daniel Merfelds Team an der Jenks Vestibular Physiologie Laboratorium in Harvard [Massachusetts Auge und Ohr-Krankenhaus, Boston, MA, USA] und eine gemeinsame Anstrengung zwischen Herman Kingma, Jean-Philippe Guyot und MED-EL.
Zukünftige Richtungen der Forschung
[Bearbeiten]Die moderne state-of-the-art vestibuläre Implantattechnologie ist ein zweistufiges System, das elektrische Stimulationen an drei ampullären Nerven als Reaktion auf Drehungen um eine entsprechende Achse (anteriorer, posteriorer oder horizontaler Kanal) erzeugt. Die Biophysik der prothetischen Nervenstimulation bleibt jedoch eine Herausforderung, um die normale sensorische Transduktion nachzuahmen. Obwohl bereits viel darüber bekannt ist, wie vestibuläre Nervenafferenzen Kopfbewegungen kodieren, ist es noch nicht bekannt, wie eine nichtinvasive Stimuluskodierungsstrategie für eine Mehrkanalprothese zu entwickeln ist. Die aktive Forschung konzentriert sich weiterhin auf die Überwindung von Design- und Signaltransduktionsbeschränkungen.
Aktuelle neurale Prothesen sollen neurales Gewebe, in das sie implantiert sind, anregen, aber die Wirkung kontinuierlicher exzitatorischer Stimulationen verursacht noch neurologische Defizite[26]. Letztendlich ist eine Vorrichtung, die sowohl eine Kopfbewegung in einer Richtung erregen als auch eine Bewegung in der entgegengesetzten Richtung verhindern kann, sehr erwünscht. Das neueste Prototyp-System, das von Santina und seinen Kollegen, SCSD1, entwickelt wurde, hat gezeigt, dass Gleichstrom-Stimulationen exzitatorische und inhibitorische VOR-Reaktionen hervorrufen können[34]. Ihre Ergebnisse zeigen, dass Effekte der Einführung des vestibulären Systems auf eine künstliche Grundlinie möglicherweise die dynamischen Bereiche der exzitatorischen und inhibitorischen Schwellen in unvorhergesehener Weise verändern können. Auf der anderen Seite zeigen klinische Studien, dass es für den Menschen möglich ist, sich innerhalb einer relativ kurzen Zeit (einige Minuten) an das Fehlen und Vorhandensein von künstlicher neuraler Aktivität anzupassen[35]. Sobald die Anpassung erreicht ist, kann man die Amplituden- und Frequenzmodulationen der Stimulation abstimmen, um glatte Augenbewegungen mit verschiedenen Geschwindigkeiten und Richtungen hervorzurufen[35].
Eine andere Art der Designbeschränkung der elektrischen Prothese besteht darin, dass sich der Strom vom Zielgewebe weg bewegt und Stimulationen im falschen Kanal verursacht[36][37]. Dies hat zur Folge, dass diese elektrische Streuung zu einer Fehlausrichtung zwischen der Augenachse und der Kopfdrehung führt[38]. Daher bedarf es anderen Technologien wie der gerichteten neuralen Plastizität um erhöhte Präzision zu erreichen. Andere Studien deuten darauf hin, dass die Infrarotimpuls-Stimulation vorteilhaft ist, um genauer bestimmte Neuronen zu stimulieren ohne das benachbarte Neuronen reagieren[36][38]. Die Verwendung von Optiken würde eine höhere räumliche Selektivität und einen verbesserten chirurgischen Zugang ermöglichen[36].
Es wurde gezeigt, dass Reflex- und Wahrnehmungsreaktionen davon abhängen, welche vestibulären afferenten Inputs stimuliert werden[33]. Eine weiter Herausforderung besteht darin, diese komplexeren Muster zu erzeugen. Chirurgische Eingriffe werden hinsichtlich einer genauen Platzierung der Elektrode in Bezug auf die Afferenzen untersucht, was am Ende die Fähigkeit eine gewünschte Reaktion zu stimulieren, stark beeinflussen könnte.
Da die auditorischen und vestibulären Bereiche des Innenohrs miteinander verbunden sind, könnte die Ausbreitung des Stromes über die Zielamplularnerven und / oder das Operationsrisiko die Aktivität der Cochlearisnerven beeinträchtigen. Es ist wahrscheinlich, dass Menschen mit Implantaten ein Risiko für Hörverlust haben, wie es bei Rhesusaffen beobachtet wurde[39]. Santina et al.[39] fanden heraus, dass die Implantation von Elektroden bis zu 14 dB Hörverlust verursachte und die elektrische Stimulation das Hörvermögen um 0,4-7,8 dB weiter reduzierte. Diese Studie legt nahe, dass die elektrische Ausbreitung auf Cochlea-Haarzellen zufällige Aktivität in der Nähe Cochlear Regionen verursachen kann.
Olfaktorische Implantate
[Bearbeiten]Ungefähr 5% der Bevölkerung leidet an Anosmie (Geruchsverlust). Ein intaktes olfaktorisches System ist ein wichtiger Teil bei der Wahrnehmung von Geschmack beim Essen und Trinken. Die meisten Probleme bei Geschmacksverlust kommen von einer olfaktorischen Störung. Ausserdem trägt eine Geruchsempfindung wesentlich zur Lebensqualität bei, z.B. das Empfinden von einem Regentag, von frischen Blumen oder vom Zuhause. Während Geruchsverlust aufgrund von Entzündungen mithilfe von topische und systemische Steroide behoben werden kann, gibt es bei vielen anderen Auslösern von Geruchsverlust, unter anderem eine Infektion der oberen Atemwege, Schädeltrauma und Altersprobleme, keine effektiven Behandlungen.
Machbarkeitsstudie
[Bearbeiten]Eric H. Holbrook, Sidharth V. Puram und andere haben eine Studie zur Brauchbarkeit der Geruchsinduktion mit künstlichen Elektroden im menschlichen Riechkolben durchgeführt. Fünf Probanden im Alter von 43 – 72 Jahren wurden getestet und meldeten nur minimalen Beschwerden während den Tests. Die Testpersonen konnten Gerüche wahrnehmen, was mit einem kommerziellen, 40-stückigen Schnüffeltest am Anfang der Untersuchung bestätigt wurde. Unter endoskopischer Führung und ohne topische Betäubung wurde eine monopolare oder bipolare Elektrode an drei Stellen an der Verbindung zwischen der Seitenlamelle der cribiformen Platte und der Schädelbasis befestigt. Während 0.2-0.3ms wurden die Implantate mit einer Intensität zwischen 1 und 20 mA stimuliert. 3 der 5 Probanden meldeten eine Geruchsempfindung, konnten aber nicht klar ausrücken was für ein Geruch es war und es wurden verschiedene Gerüche bei verschiedenen Personen wahrgenommen. Die Geruchsempfindung hat nur minimal geändert bei verschiedenen Intensitäten oder Verschiebung der Implantate, zusätzliche Attribute wie «süss», «sauer» oder «schlecht» wurden dem Geruch hinzugefügt. Die Gerüche wurden beschrieben als «zwiebelartig», «antiseptisch», «sauer», «fruchtig» oder «schlecht». Die Testpersonen schätzten die Stärke der empfundenen Gerüche zwischen 2 und 4 bei einer Skala von 1 bis 10. Alle Personen meldeten Unannehmlichkeiten mit den Implantaten, welche sich als pochendes, kribbelndes oder pulsierendes Gefühl am Ort der Elektroden, an der Nasenspitze, am inneren Canthus der Augen oder in einem Fall weit hinter dem Auge bemerkbar machte. Elektroden in der Geruchsspalte lösten Niesen oder Beschwerden bei 4 Testpersonen aus und bei der fünften kam es zu keiner Geruchsempfindung. Die Studie konnte zum ersten Mal eine Geruchsempfindung durch elektrische Stimulation der Riechkolben erreichen. Zukünftige Studien sollen dies auch bei Menschen mit einer Geruchstörung auslösen. Diese Studie sollte lediglich den Grundstein dafür legen[40].
Zukünftige Richtungen
[Bearbeiten]Elektronische Geruchsmessung
[Bearbeiten]Heutzutage können Gerüche auf sehr unterschiedliche Weise elektronisch gemessen werden, einige Beispiele sind: Massenspektrographie, Gaschromatographie, Raman-Spektren und zuletzt elektronische Nasen. Im Grunde nehmen sie an, dass verschiedene Geruchsrezeptoren unterschiedliche Affinitäten zu spezifischen molekularen physikochemischen Eigenschaften haben und dass die unterschiedliche Aktivierung dieser Rezeptoren ein räumlich-zeitliches Aktivitätsmuster erzeugt, das Gerüche erzeugt.
Elektronische Nase
[Bearbeiten]E-Nasen sind künstliche Geruchserfassungsgeräte, die auf einem Chemosensor-Array und einer Mustererkennung basieren. Sie dienen zur Identifizierung und Quantifizierung von in Luft (oder anderen Trägerstoffen) gelösten Stoffen. Eine E-Nase besteht aus einem Probenahmegerät (analog zur Nase), einem Sensor-Array (analog zu den olfaktorischen Rezeptor-Neuronen) und einer Recheneinheit (analog zum Gehirn).
Sensor-Arrays
[Bearbeiten]Wie in den Tiernasen werden unspezifische Sensoren verwendet. Dies liegt nicht nur daran, dass es sehr schwierig ist, sehr spezifische Sensoren zu bauen, sondern man möchte auch eine grosse Auswahl an möglichen Verbindungen erkennen ohne einen Sensor für jede von ihnen bereitzustellen. Ausserdem ist es robuster, genauer und effizienter, wenn die Verarbeitung auf Informationen von mehr als einem Sensor basiert. Solche Sensoren messen eine Änderung ihrer elektrischen Eigenschaften (z. B. höherer Widerstand), wenn sie mit einer Verbindung in Kontakt kommen. Diese Änderung führt zu einer Spannungsänderung, die digitalisiert wird (AD Converter).
Zu den am häufigsten verwendeten Sensortypen gehören Metalloxidhalbleiter (MOS), Quarzkristallmikrowaagen (QCM), leitende Polymere (CP) und Oberflächenwellensensoren (SAW). Eine weitere vielversprechende Technologie sind bioelektronische Nasen, die Proteine als Sensoren verwenden. Es ist auch möglich, eine Kombination verschiedener Sensoren zu verwenden, um ein präziseres Ergebnis zu erzielen und die Vorteile mehrerer Sensortypen zu kombinieren, z. B. eine bessere Reaktionszeit gegenüber einer besseren Empfindlichkeit.
Beispiel: Arbeitsprinzip eines leitenden Polymersensors
[Bearbeiten]Ein leitender Polymersensor besteht aus einer Anordnung von etwa 2-40 verschiedenen leitenden Polymeren (lange Ketten organischer Moleküle). Einige Geruchsmoleküle dringen in den Polymerfilm ein und bewirken, dass sich der Film ausdehnt, wodurch sein Widerstand erhöht wird. Dieser Anstieg der Beständigkeit vieler Polymertypen kann durch Perkolationstheorie erklärt werden. [41] Aufgrund der chemischen Eigenschaften der Materialien reagieren unterschiedliche Polymere unterschiedlich auf den gleichen Geruch.
Berechnung
[Bearbeiten]Das Sensorsignal muss mit einem Mustererkennungsalgorithmus an eine Duftstoffmischung gebunden werden. Es ist möglich, eine Datenbank von möglichen Kombinationen zu erstellen und die beste Übereinstimmung mit multivariaten statistischen Methoden zu finden, wenn ein Geruch präsentiert wird oder ein neuronales Netzwerk trainiert werden kann, um die Muster zu erkennen. Häufig wird auch die Hauptkomponentenanalyse verwendet, um die Dimensionalität der Sensordaten zu reduzieren.
Anwendungen
[Bearbeiten]Es gibt viele mögliche Anwendungen für E-Nasen. Sie werden in der Luft- und Raumfahrt und anderen Industriezweigen eingesetzt, um gefährliche oder schädliche Substanzen zu erkennen und zu überwachen sowie zur Qualitätskontrolle. Mögliche Anwendungen in der Sicherheit sind Drogen- oder Sprengstoffdetektion. E-Nasen können eines Tages Polizeihunde ersetzen. Eine sehr wirkungsvolle Anwendung könnte die Diagnose von Krankheiten sein, die die chemische Zusammensetzung des Atems oder den Geruch von Exkrementen oder Blut verändern, wodurch möglicherweise invasive Diagnosetechniken ersetzt werden. Sie können auch verwendet werden, um Krebs zu diagnostizieren, da bestimmte Krebszellen durch ihr flüchtiges organisches Verbindungsprofil identifiziert werden können. Die Krebsdiagnose durch Geruch wurde bereits bei Hunden und Fliegen erfolgreich getestet[42], aber in der Praxis sind geeignete Methoden mit hoher Sensitivität und Spezifität noch in der Entwicklung. Eine andere medizinische Anwendung ist die Behandlung von Anosmie (Unfähigkeit Geruch wahrzunehmen) durch ein Geruchsimplantat auf der Basis einer E-Nase. Auch das ist noch in der Entwicklung. Im Gegensatz dazu werden E-Nasen bereits für Umweltüberwachung und -schutz verwendet. In der Robotik könnten E-Nasen verwendet werden, um Gerüchen oder Gerüchen auf dem Boden zu folgen. Gerade für die Robotik wäre es sehr interessant, das Geruchssystem von Insekten besser zu verstehen, denn um den Geruch zum Navigieren oder zum Auffinden von Geruchsquellen zu nutzen, muss die oft vernachlässigte zeitliche Stimulusinformation verwendet werden.
Insekten können Gerüchen folgen, da sie auf Veränderungen innerhalb von etwa 150 Millisekunden reagieren können, und einige ihrer Rezeptoren können schnelle Geruchskonzentrationsänderungen darstellen, die bei Frequenzen oberhalb von mindestens 10 Hz auftreten. Im Gegensatz dazu haben leitfähige Polymer- sowie Metalloxid-E-Nasen Ansprechzeiten im Bereich von Sekunden bis Minuten[41], wobei es nur wenige Ausnahmen im Bereich von einigen zehn Millisekunden gibt.
Optogenetische Stimulation von Neuronen
[Bearbeiten]Photostimulation von Neuronen
[Bearbeiten]Die Photostimulation von Neuronen ist ein aufstrebendes Forschungsgebiet. Das neuronale Feuern wird erreicht, indem eine fokussierte Lichtquelle auf die Nervenzelle gerichtet wird, wodurch diese depolarisiert wird. Es gibt zwei Hauptwege, um dieses Ziel zu erreichen: Bestrahlung der Neuronen mit einem Laser, Erwärmung der Zelle; und die Einführung von lichtempfindlichen Kanälen oder Rezeptoren in die Nervenzelle, wodurch diese lichtempfindlich wird, ähnlich wie Stäbchen und Zapfen in der menschlichen Netzhaut. Vorteile gegenüber der traditionell verwendeten elektrischen Stimulation sind erhöhte Präzision und weniger bis kein Gewebetrauma[43].
Elektrische vs optische Stimulation
[Bearbeiten]Die elektrische Stimulation hat im Vergleich zur optischen Stimulation inhärente Einschränkungen. Um ein zuverlässiges Abfeuern zu erreichen, müssen die Elektroden in physischem Kontakt mit dem Zielgewebe oder in unmittelbarer Nähe davon sein. Die Einführung von Elektroden in das Nervengewebe schädigt es und das umgebende Gewebe.
In vielen Fällen wird die Elektrodenanordnung in elektrisch leitendes Gewebe eingeführt, wodurch eine Stromausbreitung ermöglicht wird, was die erreichbare räumliche Auflösung weiter verringert.
Die Messung der evozierten neuralen Aktivität ist oft durch Stimulationsartefakte kontaminiert, die viel grösser sind als die gemessene neurale Aktivität. Dies ist insbesondere bei Messungen nahe der Anregungsstelle der Fall.
Im Gegensatz dazu kann die optische Stimulation zuverlässig die Erregung einzelner Zellen oder kleiner Zellpopulationen erreichen. Es erfordert keinen direkten Kontakt mit dem Zielgewebe, wodurch Gewebeschäden reduziert werden. Ebenfalls werden elektrische Aufzeichnungen neuronaler Reaktion in unmittelbarer Nähe nicht durch den Anregungsreiz beeinflusst. [43][44][45] Obwohl die elektrische Stimulation unter den oben genannten Nachteilen leidet, ist sie immer noch die am besten etablierte und zuverlässige Methode zur Nervenstimulation bei Patienten.
Infrarotstimulation
[Bearbeiten]Infrarot-Stimulation basiert auf einem Infrarot-Laser, der einen lokalen Temperaturgradienten innerhalb des Neurons induziert. Es erfordert keine Modifikation der Zellen vor der Stimulation. Der Niedrigenergielaser verursacht keine Beschädigung des Gewebes und ruft eine artefaktfreie Stimulation hervor. Die genauen Mechanismen, die zur neuronalen Entladung führen, sind nicht bekannt. Untersuchungen haben jedoch gezeigt, dass dieses Phänomen höchstwahrscheinlich auf lokale photothermische Prozesse zurückzuführen ist. Somit erzeugt die IR-Bestrahlung einen Temperaturgradienten, der auf einen kleinen Raum beschränkt ist, der nach dem Ende der Bestrahlung rasch verschwindet. Es wird angenommen, dass der lokale Temperaturanstieg von bis zu 9 ° C zu Konformationsänderungen in Molekülen führt, die letztendlich zu neuronalem Feuern führen. Bei hohen Bestrahlungsfrequenzen wird die Wärme additiv, wodurch sich das bestrahlte Gewebe allmählich erwärmt und schliesslich die Zelle beschädigt. [44][45]
Optogenetik
[Bearbeiten]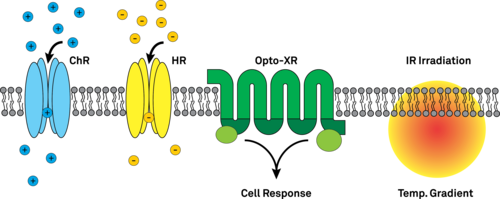
Optogenetik ist die Sensibilisierung von Zellen für Licht durch die Einführung von Fremdgenen, die eine zeit- und ortsaufgelöste Veränderung neuraler Zündmuster ermöglicht. Die Gene können in genetischer Modifikation von Tieren exprimiert werden oder durch Vektoren wie Viren eingeführt werden. Die meisten Lichtsensibilisierungsgene, die heute verwendet werden, wurden zuerst in einzelligen Organismen wie Algen oder Archaeen entdeckt. Diese Gene können lichtempfindliche Ionenkanäle oder Rezeptoren codieren, die verschiedene Reaktionen auf die optische Stimulation erzeugen.
Für die neuronale Aktivierung werden üblicherweise natürliche Channelrhodopsine (ChR) oder genetisch veränderte Varianten davon verwendet. ChRs sind lichtempfindliche nicht-spezifische Kationenkanäle, die sich öffnen, wenn sie mit blauem Licht (480 nm) angeregt werden. In Nervenzellen führt die ChR-Öffnung zu Natriumeinstrom und Membrandepolarisation. [46][47] Die lichtempfindliche Komponente ist ein all-trans-Retinal, das auch in der menschlichen Retina gefunden wird. Licht induziert eine Konformationsänderung zu 13-cis-Retinal, wodurch Kationen über den Kanal fliessen können. [46][47][48][49] Die Einführung spezifischer Punktmutationen in der Nähe der retinalen Bindungsstelle kann die kinetischen Eigenschaften und die Spezifität des Kanals verändern. [50] Die Verknüpfung von ChR mit anderen Proteinen ermöglicht Werkzeuge mit unterschiedlichen Funktionalitäten wie die in vivo-Kontrolle der eingeführten Konstrukte. [51]
Halorhodopsin (HR) sind lichtgesteuerte Chloridionenpumpen, die für die lichtaktivierte neuronale Hemmung verwendet werden. Optische Anregung durch gelbes Licht (570 nm) in sensibilisierten Neuronen führt zu einem Import von Chloridionen und Hyperpolarisation. [52][53] Wie in ChR ist das lichtempfindliche Molekül auch all-trans-retinal. Aufgrund unterschiedlicher Stabilisierungs- und damit Wellenlängensensitivitätsunterschiede der Netzhaut in HR und ChR können sie in den gleichen Zellen eingesetzt und separat anvisiert werden. Dies ermöglicht eine sehr genaue Kontrolle der Aktivität in neuronalen Schaltkreisen. [53][54]
Zur optischen Kontrolle der Zellwege wurden die Opto-XR-Proteine entwickelt, [55] wobei X für den gezielten Signalweg steht. Opto-XRs bestehen aus einem Tier-Rhodopsin (Rind, Ratte etc.), wobei seine intrazellulären Domänen gegen Signalsequenzen der Zelle ausgetauscht sind. [56] Dies ermöglicht eine optische Regulation des Signalweges der Zellen. Die Signalsequenzen können entweder durch Konformationsänderungen, die durch auf das Rhodopsin fallendes Licht induziert werden, aktiviert oder deaktiviert werden. Dies ermöglicht die spezifische Aktivierung bestimmter Rezeptorwege wie Serotonin oder adrenerge Signalwege. [55][57]
Optische Stimulation in der Neuro-Prothetik
[Bearbeiten]Die elektrische Stimulation wurde lange Zeit dazu verwendet, Nervenimpulse in neuronalen Prothesen hervorzurufen. Die Ausbreitung von elektrischem Strom und die Erzeugung von elektrischen Feldern begrenzen jedoch die erreichbare räumliche Auflösung. Dies begrenzt die Genauigkeit des übertragenen Signals. [58] Bei Hörprothesen sind maximal etwa zwanzig Elektroden möglich, so dass die Klangqualität weit hinter dem angestrebten Ziel liegt. Ein Wechsel zu einer optischen Technologie könnte die Aktivierung kleinerer Bereiche ermöglichen, wodurch die Anzahl potenziell wahrgenommener Töne erhöht wird. Jüngste Entwicklungen im Bereich der optischen Stimulation versprechen Möglichkeiten, diese Hindernisse zu überwinden und Prothesen sowie die Lebensqualität von Patienten zu verbessern.
Cochleaimplantate
[Bearbeiten]Die Infrarotstimulation der Cochlea sowie des Hörnervs wurde in verschiedenen Tiermodellen wie Nagern und Katzen getestet. Die optische Variante zeigt eine bemerkenswerte Genauigkeit in Bezug auf die durch den Laser stimulierte Fläche, die ungefähr gleich gross ist wie diejenige, die durch einen mittleren Lautheitston aktiviert wird. Es wurde auch gezeigt, dass unter Verwendung von IR-Bestrahlung mit niedriger Energie eine konstante Stimulation ohne allmähliche Erwärmung und Beschädigung des Gewebes erreicht werden kann. Dies ermöglicht die Verwendung des Implantats während des ganzen Tages, ohne das Cochlea-System zu beschädigen. Ein Hauptnachteil der IR-Stimulation ist ein viel höherer Energieverbrauch im Vergleich zur elektrischen Stimulation. [44]
Um das beschriebene Energieproblem zu überwinden, haben Forscher begonnen, einen optogenetischen Ansatz bei Nagetieren zu testen. Sie gentechnisch veränderte Mäuse, um Channelrhodopsins in Spinalganglionneuronen freizugeben. Die Sensibilisierung der Nervenzellen reduzierte die Energie, die zum Zünden erforderlich ist, im Vergleich zur IR-Bestrahlung um den Faktor sieben (IR: 15 μJ, Optogen: 2 μJ, elektrisch: 0,2 μJ). Die Stimulation wurde somit mit μLEDs anstelle von Lasern möglich. Trotz dieser Fortschritte ist die Implementierung dieser Technologie in Menschen in naher Zukunft fraglich. Dies ist hauptsächlich auf die möglichen Gefahren der viralen Einführung von genetischem Material in einen Organismus zurückzuführen. Bisher wurden nur sehr wenige Gentherapien zugelassen. Eine sichere, aber immer noch effektive Möglichkeit, die Cochlea-Organe spezifisch zu infizieren, müsste implementiert und genehmigt werden. [59]
Erste Patente wurden registriert, die mögliche optische Cochlea-Implantate für Menschen beschreiben. Diese Implantate funktionieren ähnlich wie die traditionellen elektrischen Implantate. Aber statt der Elektroden haben sie VCSELs (oberflächenemittierende Laser mit vertikalem Resonator), die vom Eingabegerät des Implantats angetrieben werden. VCSELs sind Laserdioden, die in den kleinen Schlauch des Implantats passen. Die Laser sind auf das Corti-Organ gerichtet und können viel näher als Elektroden beabstandet sein, was die Anzahl der Implantat-Ausgangskanäle mehr als verdoppelt. Laserdioden werden für Signale mit höherer Tonhöhe verwendet, während Elektroden Nervenzellen mit niedrigerer Amplitude ansteuern. [60]
Vestibuläre Prothesen
[Bearbeiten]Vestibuläre Prothesen zielen darauf ab, Gleichgewichtsprobleme, die durch eine Fehlfunktion des vestibulären Systems entstehen, wiederherzustellen. Da die halbkreisförmigen Kanäle miteinander verbunden sind, ist die Stromausbreitung ein Hauptproblem bei der Abgabe von elektrischen Stimuli. Die Stromausbreitung kann zu einer zusätzlichen Stimulation unerwünschter Bogengänge führen, was zu falschen Signalen im Gehirn führt. Die Möglichkeit der Verwendung von IR-Bestrahlung wurde untersucht. Die Bestrahlung der Ampullen rief keine Aktionspotentiale hervor. Der Grund für die fehlende Stimulation könnte in einer Unempfindlichkeit der Haarzellen gegenüber einer IR-Bestrahlung liegen. Nichtsdestotrotz könnte eine optische Stimulation des Vestibularnervs möglich sein. Es ist noch unklar, ob auf diese Weise eine getrennte Stimulation der Nerven aus verschiedenen Ampullen möglich ist. [44][61]
Referenzen
[Bearbeiten]- ↑ Larry Squire, et al. Fundamental Neuroscience 4th edition. publisher, 2012.
- ↑ 2,0 2,1 2,2 Lan Yue, James D. Weiland, Botond Roska, Mark S. Humayun. “Retinal stimulation strategies to restore vision: Fundamentals and Systems”. journal, 2016.
- ↑ Jackson, G.R., Owsley, C., Curcio, C.A. “Photoreceptor degeneration and dysfunction in aging and age-related maculopathy.”. journal, 2002.
- ↑ Shigeru Sato, Yoshihiro Omori, et al. “Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation”. journal, 2008.
- ↑ Jost B. Jonas, UlrikeSchneider, Gottfried O.H. Naumann. “Count and density of human retinal photoreceptors”. journal, 1992.
- ↑ Ashmore Jonathan. “Cochlear Outer Hair Cell Motility”. journal, 2008.
- ↑ 7,0 7,1 7,2 Chris Sekirnjak, PawelHottowy, Alexander Sher, Wladyslaw Dabrowski, Alan M. Litke, E.J. Chichilnisky. “High-Resolution Electrical Stimulation of Primate Retina for Epiretinal Implant Design”. journal, 2008.
- ↑ Jong-Mo Seo, et al. “Biocompatibility of polyimide microelectrode array for retinal stimulation”. journal, 2004.
- ↑ Eui Tae Kim, et al. “Feasibility of Microelectrode Array (MEA) Based on Silicone-Polyimide hybride for retina prosthesis”. journal, 2009.
- ↑ 10,0 10,1 Eui Ta Eberhart Zrenner, KarlUlrich Bartz-Schmidt, Heval Benav, Dorothea Besch, Anna Bruckmann, Veit-Peter Gabel, Florian Gekeler, Udo Greppmaier, Alex Harscher, Steffen Kibbel, Johannes Koch, Akos Kusnyerik, tobias Peters, Katarina Stingl, Helmut Sachs et al.e Kim, et al. “Subretinal electronic chips allow blind patients to read letters and combine them to words”. journal, 2010.
- ↑ Pritchard Roy. “Stabilized Images on the Retina”. journal, year.
- ↑ Asaf Shoval, ChrisopherAdams, Moshe David-Pur, Mark Shein, Yael Hanein, Evelyne Sernagor. “Carbon nanotube electrodes for effective interfacing with retinal tissue”. journal, 2009.
- ↑ Susanne Klauke, Michael Goertz, Stefan Rein, Dirk Hoehl, Uwe Thomas, Reinhard Eckhorn, Frank Bremmer, Thomas Wachtler. “Stimulation with a Wireless Intraocular Epiretinal Implant Elicits Visual Percepts in Blind Humans”. journal, 2011.
- ↑ Neville Z. Mehenti, GrehS. Tsien, Theodore Leng, Harvey A. Fishman, Stacey F. Bent. “A model retinal interface based on directed neuronal growth for single cell stimulation”. journal, 2006.
- ↑ Jan Muller, et al. “High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels”. journal, 2015.
- ↑ Fiscella M, et al. “Recording from defined populations of retinal ganglion cells using a high-density cmos-integrated microelectrode array with real-time switchable electrode selection”. journal, 2012.
- ↑ Fiscella M, Yonehara K, Drinnenberg A, Franke F, Müller J, Roska B and Hierlemann A. “Screening Transgenic Mouse Models of Human Eye Diseases with CMOS High-Density Microelectrode Arrays”. journal, 2016.
- ↑ Gaute T Einevoll, Felix Franke, Espen Hagen, Christophe Pouzat, and Kenneth D Harris. “Towards reliable spike-train recordings from thousands of neurons with multielectrodes”. journal, 2012.
- ↑ http://www.utdallas.edu/~loizou/cimplants/tutorial/tutorial.htm
- ↑ www.ohsu.edu/nod/documents/week3/Rubenstein.pdf
- ↑ www.acoustics.bseeber.de/implant/ieee_talk.pdf
- ↑ http://work.thaslwanter.at/CSS/Code/CI_hilbert.py
- ↑ Crane BT, Gottschalk B, Kraut M, Aygun N, Niparko JK (2010) Magnetic resonance imaging at 1.5 T after cochlear implantation. Otol Neurotol 31:1215-1220
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 Perez Fornos, A.; Guinand, N.; Van De Berg, R.; Stokroos, R.; Micera, S.; Kingma, H.; Pelizzone, M.; and Guyot, J.. “Artificial balance: restoration of the vestibulo-ocular reflex in humans with a prototype vestibular neuroprosthesis.”. Frontiers in Neurology, 5, 2014.
- ↑ Cohen, B. and Suzuki, J.. “Eye movements induced by ampullary nerve stimulation.”. The American journal of physiology, 204:347-351, 1963.
- ↑ 26,0 26,1 26,2 26,3 26,4 Golub, J. S.; Ling, L.; Nie, K.; Nowack, A.; Shepherd, S. J.; Bierer, S. M.; Jameyson, E.; Kaneko, C. R.; Phillips, J. O.; and Rubinstein, J. T.. “Prosthetic Implantation of the Human Vestibular System.”. Otology & Neurotology, 1:136–147, 2014.
- ↑ Gong, W. and Merfeld, D. M.. “Prototype neural semicircular canal prosthesis using patterned electrical stimulation.”. Annals of Biomedical Engineering, 28:572-581, 2000.
- ↑ Lewis, R. F.; Haburcakova, C.; Gong, W.; Makary, C.; and Merfeld, D. M.. “Vestibuloocular Reflex Adaptation Investigated With Chronic Motion-Modulated Electrical Stimulation of Semicircular Canal Afferents.”. Journal of Neurophysiology, 103:1066-1079, 2010.
- ↑ Dai, C.; Fridman, G. Y.; Chiang, B.; Davidovics, N.; Melvin, T.; Cullen, K. E. and Della Santina, Charles C.. “Cross-axis adaptation improves 3D vestibulo-ocular reflex alignment during chronic stimulation via a head-mounted multichannel vestibular prosthesis.”. Experimental Brain Research, 210:595-606, 2011.
- ↑ Dai, C.; Fridman, G. Y.; Davidovics, N.; Chiang, B.; Ahn, J. and Della Santina, C. C.. “Restoration of 3D Vestibular Sensation in Rhesus Monkeys Using a Multichannel Vestibular Prosthesis.”. Hearing Research, 281:74-83, 2011.
- ↑ Dai, Chenkai and Fridman, Gene Y. and Chiang, Bryce and Rahman, Mehdi A. and Ahn, Joong Ho and Davidovics, Natan S. and Della Santina, Charles C.. “Directional Plasticity Rapidly Improves 3D Vestibulo-Ocular Reflex Alignment in Monkeys Using a Multichannel Vestibular Prosthesis.”. Journal of the Association for Research in Otolaryngology, 14:863-877, 2013.
- ↑ Davidovics, Natan S. and Rahman, Mehdi A. and Dai, Chenkai and Ahn, JoongHo and Fridman, Gene Y. and Della Santina, Charles C.. “Multichannel Vestibular Prosthesis Employing Modulation of Pulse Rate and Current with Alignment Precompensation Elicits Improved VOR Performance in Monkeys.”. Journal of the Association for Research in Otolaryngology, 14:233-248, 2013.
- ↑ 33,0 33,1 33,2 Phillips, Christopher and DeFrancisci, Christina and Ling, Leo and Nie, Kaibao and Nowack, Amy and Phillips, James O. and Rubinstein, Jay T.. “Postural responses to electrical stimulation of the vestibular end organs in human subjects.”. Experimental Brain Research, 229:181-195, 2013.
- ↑ Fridman, Gene Y. and Della Santina, Charles C.. “Safe Direct Current Stimulation to Expand Capabilities of Neural Prostheses.”. IEEE Trans Neural Syst Rehabil Eng., 21:319-328, 2013.
- ↑ 35,0 35,1 Guyot, Jean-Philippe and Sigrist, Alain and Pelizzone, Marco and Kos, Maria I.. “Adaptation to steady-state electrical stimulation of the vestibular system in humans.”. Annals of Otology, Rhinology & Laryngology, 120:143-149, 2011.
- ↑ 36,0 36,1 36,2 Harris, David M. and Bierer, Steven M. and Wells, Jonathon D. and Phillips, James O.. “Optical nerve stimulation for a vestibular prosthesis.”. Processing of SPIE, 5, 2009.
- ↑ Della Santina, Charles C. and Migliaccio, Americo A. and Patel, Amit H.. “A multichannel semicircular canal neural prosthesis using electrical stimulation to restore 3-D vestibular sensation.”. IEEE transactions on bio-medical engineering, 54:1016-1030, 2007.
- ↑ 38,0 38,1 Lumbreras, Vicente and Bas, Esperanza and Gupta, Chhavi and Rajguru, Suhrud M.. “Pulsed Infrared Radiation Excites Cultured Neonatal Spiral and Vestibular Ganglion Neurons by Modulating Mitochondrial Calcium Cycling.”. Journal of Neurophysiology, 2014.
- ↑ 39,0 39,1 Dai, Chenkai and Fridman, Gene Y. and Della Santina, Charles C.. “Effects of vestibular prosthesis electrode implantation and stimulation on hearing in rhesus monkeys.”. Hearing Research, 277:204-210, 2011.
- ↑ Holbrook EH, Puram SV, See RB, Tripp AG, Nair DG.. “Induction of smell through transethmoid electrical stimulation of the olfactory bulb.”. Int Forum Allergy Rhinol., 2019;9:158-164, 2019.
- ↑ 41,0 41,1 author. “A review of gas sensors employed in electronic nose applications”. Sensor Review, 24:181–198, year. DOI:10.1108/02602280410525977.
- ↑ author. “More than apples and oranges - Detecting cancer with a fruit fly's antenna”. Scientific Reports, 4, year. DOI:10.1038/srep03576.
- ↑ 43,0 43,1 author. “Optical control of neuronal activity.”. Annual review of biophysics, 39:329-348, 2010.
- ↑ 44,0 44,1 44,2 44,3 author. “Neural stimulation with optical radiation.”. Laser & photonics reviews, 5:68-80, 2011.
- ↑ 45,0 45,1 author or editor. Optical-Thermal Response of Laser-Irradiated Tissue. Springer Netherlands, 2 edition, year.
- ↑ 46,0 46,1 author. “Channelrhodopsin-1 initiates phototaxis and photophobic responses in chlamydomonas by immediate light-induced depolarization.”. The Plant cell, 20:1665-1677, 2008.
- ↑ 47,0 47,1 author. “Channelrhodopsin-2, a directly light-gated cation-selective membrane channel”. Proceedings of the National Academy of Sciences, 100:13940-13945, 2003.
- ↑ author. “Spectral characteristics of the photocycle of channelrhodopsin-2 and its implication for channel function.”. Journal of Molecular Biology, 375:686-694, 2008.
- ↑ author. “Photoactivation of channelrhodopsin.”. The Journal of Biological Chemistry, 283:1637-1643, 2008.
- ↑ author. “Ultrafast optogenetic control.”. Nature neuroscience, 13:387-392, 2010.
- ↑ author. “Characterization of engineered channelrhodopsin variants with improved properties and kinetics.”. Biophysical journal, 96:1803-1814, 2009.
- ↑ author. “Properties and photochemistry of a halorhodopsin from the haloalkalophile, Natronobacterium pharaonis.”. Journal of Biological Chemistry, 265:1261-1267, 1990.
- ↑ 53,0 53,1 author. “Multimodal fast optical interrogation of neural circuitry.”. Nature, 446:633-639, 2007.
- ↑ author. “Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution.”. Plos one, 2:e299, 2007.
- ↑ 55,0 55,1 author. “Light-Driven Activation of 2 -Adrenergic Receptor Signaling by a Chimeric Rhodopsin Containing the 2 -Adrenergic Receptor Cytoplasmic Loops”. Biochemistry, 44:2284-2292, 2005.
- ↑ author. “Temporally precise in vivo control of intracellular signalling.”. Nature, 458:1025-1029, 2009.
- ↑ author. “Substitution of 5-HT 1A Receptor Signaling by a Light-activated G Protein-coupled Receptor”. The Journal of Biological Chemistry, 285:30825-30836, 2010.
- ↑ author. “On the nature and elimination of stimulus artifact in nerve signals evoked and recorded using surface electrodes.”. IEEE transactions on bio-medical engineering, 29:129-137, 1982.
- ↑ author. “Optogenetic stimulation of the auditory pathway”. The Journal of Clinical Investigation, 124:1114-1129, 2014.
- ↑ Stafford, James W & Ryan C Stafford, "OPTICAL-STIMULATION COCHLEAR IMPLANT WITH ELECTRODE(S) AT THE APICAL END FOR ELECTRICAL STIMULATION OF APICAL SPIRAL GANGLION CELLS OF THE COCHLEA", A1 US patent 0023967 A1, published Jan. 24, 2013, issued Jul. 21, 2012
- ↑ author. “Optical nerve stimulation for a vestibular prosthesis”. Proceedings of SPIE, 5:71800R, 2009.
