Allgemeine und Anorganische Chemie/ Druckversion
Einleitung[Bearbeiten]
Die Chemie befasst sich mit dem stofflichen Aufbau unserer Umwelt. Sie erforscht zum einen die Zusammenhänge von Struktur und Eigenschaften der Materie und damit einhergehend die Veränderung der Materie in chemischen Reaktionen. Aufgrund dieser begrifflichen Weite hat sich die moderne Chemie in viele Teilgebiete aufgespaltet:
- Die Allgemeine Chemie befasst sich mit den allgemeinen Grundlagen der Chemie.
- Die physikalische Chemie befasst sich als Grenzgebiet zwischen Chemie und Physik mit Spezialthemen (Thermodynamik, Kinetik, Elektrochemie).
- Die anorganische Chemie befasst sich mit der Chemie aller Elemente des periodischen Systems (Von den Kohlenstoffverbindungen nur die Oxide und die Pseudohalogenide).
- Die organische Chemie befasst sich mit der Chemie der Kohlenstoffverbindungen mit Ausnahme der Verbindungen die zur anorganischen Chemie gehören.
- Die Analytische Chemie befasst sich mit der Trennung und dem Nachweis von Stoffen.
- Die Technische Chemie befasst sich mit der technischen Anwendung der Chemie.
Dabei stellen die Allgemeine und die physikalische Chemie die Grundlagen für alle anderen Teilgebiete. In diesem Wikibook soll es im ersten Teil um die Allgemeine Chemie gehen. Der zweite Teil befasst sich mit der anorganische Chemie, die mit dieser eng verbunden ist und in der Regel gemeinsam gelehrt wird. Natürlich lassen sich Überschneidungen mit den anderen Teilbereichen der Chemie nicht vermeiden; daher sollte man im Kopf behalten, dass eine allzu strenge Kategorisierung oftmals nicht mehr sinnvoll ist.
Das Kapitel Chemische Grundbegriffe führt kurz in die grundlegenden Bezeichnungen und Begriffe der Chemie ein.
Grundlegende Begriffe und Konzepte der Chemie[Bearbeiten]
Stoffe, Substanzen, Verbindungen[Bearbeiten]
Die uns umgebende Materie besteht aus Stoffen. Ein Goldring, eine Goldkette sowie ein Klumpen Gold haben verschiedene Gestalt, der Begriff des chemischen Stoffes abstrahiert aber von der äußeren Form und von der Größe und betont, dass zwischen den drei Gegenständen viele Gemeinsamkeiten bestehen, die im Stoffbegriff „Gold“ zusammengefasst werden. Auch von der Größe (dem Volumen und der Masse) wird abstrahiert: ein Tropfen Wasser und die Füllung eines Trinkwasserspeichers haben eine so große Anzahl von Eigenschaften gemeinsam („flüssig“, „farblos“ und viele mehr), dass man beides unter dem Stoffnamen „Wasser“ zusammenfasst.
Seit der Entdeckung des Sauerstoffs durch Priestley und Schiele und der Erfindung der Waage durch Lavoisier 1743 - 1794 hat die Chemie einen ungeheuren Aufschwung bekommen. Man stellte fest, dass bei einer chemischen Reaktion die Waage konstant blieb. Es gilt daher folgendes allgemeines Gesetz:
- Bei chemischen Reaktionen bleiben die Massen der beteiligten Stoffe konstant
Gemisch – Verbindung – Element[Bearbeiten]
Stoffgemische lassen sich mit mechanischen Methoden wieder voneinander trennen (Beispiel: Zucker und Zimt; Sauerstoff und Stickstoff der Luft). Als Reinstoffe bezeichnet man chemisch einheitliche Substanzen. Das sind einerseits die chemischen Verbindungen, die sich mit chemischen oder thermischen Methoden wieder in ihre Bestandteile zerlegen lassen (Beispiele: Wasser, Kochsalz, Zucker). Das sind andererseits die chemischen Elemente, die sich mit chemischen oder thermischen Methoden nicht weiter zerlegen lassen (Beispiele: Gold, Eisen, Aluminium, Sauerstoff).
Verschiedene Elemente unterscheiden sich in der Anzahl der in ihrem Atomkern enthaltenen einfach positiv geladenen Protonen, d. h. die Kernladungszahlen (anderer Begriff dafür: Ordnungszahlen) sind bei den Atomen eines bestimmten Elementes gleich, bei unterschiedlichen Elementen jedoch verschieden. Die Atome der Elemente bestehen weiterhin aus einer Hülle mit um den Atomkern kreisenden, einfach negativ geladenen Elektronen. Atome sind nach außen elektrisch neutral: die Anzahl der Elektronen ist jeweils identisch mit der Anzahl der Protonen.
Elemente enthalten nur eine einzige Sorte von Atomen, wenn man Unterschiede der Atome, die nur die Anzahl Neutronen im Kern betreffen, ignoriert. Alle Atome eines Elements sind also bezüglich der Elektronenhülle gleich aufgebaut. Verbindungen enthalten verschiedene Atomsorten, d.h. sie enthalten Atome mit unterschiedlichen Elektronenhüllen. (Verschiedene Atome desselben Elements heißen Isotope.) Die Chemie befasst sich mit den Elementen und vor allem mit deren Verbindungen, ihrer Analyse und Synthese.
- Für die Chemie maßgeblich ist allein die Elektronenhülle.
- Die Atomkerne sind Arbeitsgebiet der Physik:
- Die Atomkerne enthalten außer den Protonen Neutronen. Jede durch eine bestimme Ordnungszahl (Protonenzahl) und bestimmte Neutronenzahl charakterisierte Atomsorte nennt man ein Nuklid. Isotope sind Nuklide eines Elements mit gleicher Ordnungszahl (d. h. gleicher Anzahl an Protonen und somit Elektronen und folglich auch chemisch gleichem Verhalten), aber verschiedener Neutronenzahl. Gibt es von einem Element nur ein Isotop, nennt man es Reinelement, gibt es mehrere Isotope, spricht man von einem Mischelement.
- Elemente lassen sich durch Kernspaltung oder Kernverschmelzung in andere Elemente umwandeln. Solche Kernumwandlungen unterscheiden sich von chemischen Reaktionen durch die erheblich – rund eine Million Mal – höheren Energien, die dafür nötig sind oder dabei gewonnen werden.
Fachbegriffe[Bearbeiten]
- Das Periodensystem ist eine geordnete Auflistung aller Elemente; die Anordnung erfolgt nach der aufsteigenden Kernladungszahl.
- Eine Chemische Formel gibt an, welche Elemente eine Verbindung enthält, gleichzeitig gibt sie also an, welche Atome ein Molekül oder eine Einheit der Verbindung enthält. Ionen sind elektrisch geladene Atome oder Moleküle.
- Als Isomerie bezeichnet man das Auftreten verschiedener Moleküle mit derselben Summenformel.
- Die Atome sind in Molekülen oder Salzen durch chemische Bindungen miteinander verknüpft.
- Chemische Reaktionen sind mit einem Energieumsatz, meist in Form von Wärme, verknüpft. Die chemische Thermodynamik befasst sich mit solchen Energie- und Wärmeänderungen und dem chemischen Gleichgewicht. Dieses ist erreicht, wenn chemische Reaktionen ablaufen können, aber kein Nettoumsatz mehr stattfindet. Das Massenwirkungsgesetz beschreibt den Zusammenhang zwischen den Stoffmengenkonzentration (oder genauer: den Aktivitäten) der Edukte und Produkte, die dann vorhanden sind.
- Die Zerlegung von Verbindungen nennt man Analyse. Im Gegensatz dazu ist die Synthese der Aufbau einer Verbindung. Auch die Untersuchung eines Stoffgemischs nennt man Analyse. Das Teilgebiet der Chemie, welches sich näher mit der Thematik beschäftigt ist die Analytische Chemie.
Stoffe und Stoffgruppen[Bearbeiten]
Die Stoffe lassen sich nach verschiedenen Kriterien in Kategorien einteilen.
Einteilung nach dem Aggregatzustand
- Feststoffe
- Flüssigkeiten
- Gase
- Plasmen
Einteilung nach der Form
- Reinstoffe (Elemente und Verbindungen)
- Gemische (Mischungen von Elementen und Verbindungen)
Einteilung nach den beteiligten Elementen
- Organische Verbindungen (Mit Ausnahme des Kohlenstoffs selbst, der Cyanverbindungen und der Kohlensäure und ihren Salzen fast alle Verbindungen die das Element Kohlenstoff enthalten)
- Anorganische Verbindungen (Alle übrigen Stoffe)
Einteilung nach der Elektrischen Leitfähigkeit:
- Elektrische Leiter (Metalle, Metallähnliche Modifikationen von Wasser- und Kohlenstoff)
- Elektrische Halbleiter (Halbmetalle)
- Elektrische Nichtleiter (Alle übrigen Nichtmetalle)
Diese Kategorien sind für die Physik von wichtigem Interesse und werden daher im Rahmen der Chemie nur in der Elektrochemie behandelt.
Einteilung nach der Art der Chemischen Bindung:
- Ionische Verbindungen (Salze)
- Metallische Verbindungen (Metalle, Legierungen)
- Kovalente Verbindungen (Alle Übrigen)
Einteilung nach den Chemischen Eigenschaften
- Säuren und Basen
- Oxidations- und Reduktionsmittel
- Katalysatoren
- Sonstige
Atombau[Bearbeiten]
Atombau[Bearbeiten]
Die moderne Chemie fußt auf der Theorie zum Bau der Atome. Das Verständnis des Atomaufbaus und der daraus erwachsenden Wechselwirkungsmöglichkeiten zwischen den Atomen ist von zentraler Bedeutung in der Chemie. Das nachfolgende Kapitel soll einen ersten Einblick in die Theorie geben.
Geschichte der Atomtheorien[Bearbeiten]
- Leukipp (5. Jhd. v. Chr.):
- Er vermutet auf Grund von philosophischen Überlegungen, dass Materie aus kleinsten, unteilbaren Teilchen aufgebaut sei. Diese Teilchen nannte er Atome (griech. atomos = unteilbar).
- Aristoteles (384 - 322 v. Chr.):
- Er wendet sich gegen die Atomistische Theorie. Er vermutet eine "materia prima", welche nicht stofflich ist. Aus ihr entstehen "vier Elemente" mit gewissen Grundeigenschaften: Wasser, Feuer, Erde und Luft. Die Eigenschaften der Stoffe resultieren aus Kombinationen der vier Elemente. z. B. Schwefel = Erde + Feuer.
- Paracelsus von Hohenheim (1490 - 1541):
- Er führt Stoffeigenschaften auf die Existenz dreier "Prinzipien" zurück: Sulphur (brennbar), Mercurium (metallisch) und Sal (salzartig).
- Robert Boyle (1627 - 1691)
- Er erkennt als einer der ersten, dass Materie aus verschiedenen Elementen stofflicher Natur besteht.
- John Dalton (1766 - 1844)
- Er nimmt die Theorie von Leukipp wieder auf. Alle Stoffe bestehen aus festen Körpern. Diese sind kugelförmig, fest und unzerstörbar (unteilbar/Atome). Atome verschiedener Elemente haben unterschiedliche Gewichte.
- Curie(2x), Becquerel, Elster, Geitel (um 1895)
- Radioaktivität - Uranerz sendet Strahlen aus, welche eine eingewickelte Fotoplatte schwärzen können.
- Diese Strahlung besteht aus:
- alpha-Teilchen (positive Heliumionen)
- beta-Teilchen (negative Elektronen)
- gamma-Teilchen (sehr kurzwellige, damit energiereiche Lichtquanten)
- Radioaktivität entsteht im Uranerz durch Atomzerfall
- J.J. Thomson
- Aus Stoffen lassen sich negative Teilchen (Elektronen) herauslösen. Er folgerte daraus, dass sich in einer positiv geladenen Wolke Elektronen verteilen. Man kann sich das Thomsonsche Atommodell wie eine Erdbeere vorstellen. Alles was rot ist, entspricht dem Fruchtfleisch und die Kerne, welche auf der Haut liegen, sind die Elektronen.
Heutige Modelle[Bearbeiten]
Bohrsches Atommodell[Bearbeiten]
Grundgedanke[Bearbeiten]
1913 veröffentlichte Nils Bohr, ein dänischer Physiker seine Theorie zum Atombau, heute als Bohrsches Atommodell bekannt. Mit diesem Atommodell lassen sich viele physikalische und chemische Erscheinungen erklären. Er postulierte, dass sich die Elektronen auf Kreisbahnen um den Atomkern bewegen. Dabei heben sich Fliehkraft und elektrostatische Kraft zwischen Kern und Elektron auf. Da die Fliehkraft auf höheren Bahnen mit größerem Abstand vom Kern geringer ist, muss auch die Geschwindigkeit auf äußeren Bahnen geringer sein. Es könnten sich rein theoretisch sehr viele Elektronen auf einer Bahn bewegen. Damit ein Elektron sich neben den anderen Elektronen ungestört bewegen kann, muss die Kreisbahn ein Vielfaches der Wellenlänge lang sein. Somit können auch keine beliebigen Kreisbahnen entstehen, sondern lediglich solche, die einem Vielfachen der Wellenlänge des Elektrons entsprechen.
Herleitung von konkreten Formeln[Bearbeiten]
Als erster Ansatz wird postuliert, dass sich Elektronen in Kreisbahnen um den Atomkern bewegen. Um auf diese Weise einen stabilen Zustand zu erhalten, müssen die wirkenden Kräfte, Fliehkraft und elektrostatische Anziehung, sich gegenseitig aufheben:
Fliehkraft = elektrostatische Anziehungskraft
Durch Multiplizieren mit r und Dividieren mit 2 ergibt sich die Formel für die Bahnenergie (Bewegungsenergie) des Elektrons:
- : Masse des Elektrons
- : Geschwindigkeit des Elek. auf der n-ten Bahn
- : elektrische Feldkonstante
- : Radius der n-ten Bahn
Ein Elektron hat sowohl die Eigenschaften einer Welle wie auch die eines Teilchens. Diese verschiedenen Eigenschaften können, abhängig von der jeweiligen Experimentieranordnung, empirisch erfasst werden. Demnach ist ein Elektron durch keines der beiden Modelle allein, Teilchen oder Welle, vollständig beschreibbar. Diesen Fakt bezeichnet man als Welle-Teilchen-Dualismus. Dieser Dualismus ist dabei jedoch keineswegs so zu verstehen, dass ein Elektron mal ein Teilchen und mal eine Welle ist, sondern Elektronen vereinen immer Wellen- und Teilcheneigenschaften in sich. Die scheinbar unterschiedlichen empirischen Ergebnisse kommen dadurch zustande, dass man sich aufgrund seiner Experimentieranordnung nur mit einem Aspekt des Elektrons befasst. Eine Zusammenführung von Teilchen- und Wellencharakter erfolgt über die de Broglie-Beziehung:
welche sowohl die Wellennatur, Wellenlänge (), als auch Materienatur, Impuls (), beinhaltet.
Eine weitere Forderung des Bohrschen Atommodels ist, dass der Bahnumfang ein Vielfaches der Elektronenwellenlänge, welche sich aus der de Broglie-Beziehung ergibt, sein muss. Diese Forderung ist essentiell, da sich die im Kreis laufende Welle nach kurzer Zeit selbst aufgrund von Interferenz auslöschen würde, wenn sie diese Bedingung nicht erfüllen würde. Das würde die Vernichtung des Elektrons und damit des Atoms bedeuten. Es sind demnach nur diskrete Bahnen, auf denen die Elektronen den Kern umlaufen, möglich. Man erhält:
Woraus sich für
- ergibt. Und für
- mit
Durch Dividieren durch 2 und erhält man die vorläufige Gleichung (2) für r
Um den Radius der n-ten Bahn berechnen zu können, ist es notwendig, v zu eliminieren. Man nehme Gleichung (1), multipliziere sie mit 2 und r, so erhält man
Man nehme Gleichung (2), multipliziere sie mit m und v, so erhält man
Dividiert man nun die Gleichungen (3)/(4)
so erhält man nach Kürzen
Setzt man nun Gleichung (5) in Gleichung (2) ein, so erhält man die Endformel zur Radienbestimmung:
Um nun eine Gleichung für die Bahnenergie zu erhalten, welche nur noch von n abhängig ist, benötigt man Gleichung (1) und (6):
Setzt man nun r in E ein, so erhält man:
Mittels Vivalsatz erhält man:
daraus folgt:
Hieraus lassen sich auch Energiedifferenzen zwischen zwei verschiedenen Bahnen n und m berechnen. Voraussetzung n<m:
Hiermit wäre die Herleitung der gewünschten Formeln erledigt.
Folgende Formeln wurden hergeleitet:
Es folgen nun einige Rechnungen, welche die Nützlichkeit dieses Modells angesichts seiner Fehlerhaftigkeit darstellen:
Gegebene Größen für die Berechnungen:
- (Ladung des Elektrons, Elementarladung)
- (Plancksches Wirkungsquantum)
- (elektrische Feldkonstante)
- (Masse des Elektrons)
Bahngeschwindigkeiten für n = 1, 2, 3:
- usw.
Bahnradien für n = 1, 2, 3:
Dies sind keine realen Werte, es ist jedoch erstaunlich, dass die realen Werte sehr nahe bei den Rechenwerten liegen. realer Mittelwert von Atomradien = 100 * 10-12m.
Energiedifferenzen:
Es werden nun die Spektrallinien der Balmerserie berechnet. Verbrennt man Wasserstoff, so entstehen für Wasserstoff charakteristische Lichtfärbungen. Dies ist damit zu erklären, dass bei der Erhitzung ein Elektron von der zweiten Bahn auf eine höhere n-te Bahn (n>2) gehoben wird. Bei der Abkühlung springt das Elektron zurück auf die zweite Bahn, dabei gibt es Energie ab, welche der Differenz der Bahnenergien entspricht. Die Energie wird in Form von Licht abgegeben. Wenn man E berechnet hat lässt sich über
- die Wellenlänge
berechnen.
Linien der Balmer Serie:
- n=2,m=3:
- n=2,m=4:
- n=2,m=5:
- n=2,m=6:
Dieser Effekt ist nicht nur bei Wasserstoff zu beobachten, sondern generell bei jedem Element.
Besetzungsregeln für die Bahnen[Bearbeiten]
Diese wurden empirisch gefunden und lassen sich wissenschaftlich nicht näher erklären.
- Jede Bahn enthält maximal Elektronen n=Bahnnummer
- Eine Außenbahn enthält maximal 8 Elektronen, dies ist ein besonders günstiger Zustand. Er entspricht der Konfiguration von Edelgasen, man spricht daher von Edelgaskonfiguration.
- Eine Innenbahn wird, falls nach Regel 1 möglich, erst dann mit mehr als 8 Elektronen besetzt, wenn die Außenbahn genau 2 Elektronen enthält.
Kritik am Bohrschen Atommodell[Bearbeiten]
- Bewegte Ladung strahlt elektromagnetische Wellen aus, somit würde ein Elektron auf seiner Bahn an Energie verlieren, langsamer werden, so dass sich dass Gleichgewicht zwischen elektromagnetischer Kraft und Zentripetalkraft kontinuierlich neu einstellen würde. Dies sähe so aus, dass der Radius immer kleiner werden würde und das Elektron schon nach kurzer Zeit in den Kern stürzen würde. Unabhängig davon würden bei einem veränderten Radius die De Broglie Annahmen nicht mehr zutreffen.
- Die Heisenbergsche Unschärferelation besagt, dass man Ort und Impuls nur bis zu einer gewissen Grenze gleichzeitig messen kann, bzw diese gleichzeitig existent sein können.
Wenn man also versucht, ein Elektron auf eine Kreisbahn zu zwingen, d.h. laut Heisenberg auf der Kern-Elektron-Achse gegen 0 laufen zu lassen, dann bekäme das Elektron einen unendlich großen Impuls, welcher bei endlicher Masse eine unendliche Geschwindigkeit hervorrufen würde. Die daraus resultierende Zentripetalkraft würde das Elektron aus dem Atom schleudern.
- Bei vielen Elementen treten im Farbspektrum Linien auf, welche sich nicht durch Energiesprünge zwischen 2 Bahnen erklären lassen, da die dazu benötigte Energie viel zu gering ist.
- Mit dem Bohrschen Atommodell kann man zwar Bindungsverhalten von Stoffen teilweise erklären, es lässt sich allerdings keine Aussage über die räumliche Struktur des entstandenen Moleküls machen, dies ist aber elementar wichtig für die Beschreibung von physikalischen und chemischen Eigenschaften.
- Viele chemische Verbindungen lassen sich nicht mit dem Bohrschen Atommodell erklären.
- Das Bohrsche Atommodell basiert fast ausschließlich auf der Teilchenvorstellung von Elektronen. Da ein Elektron aber sowohl Teilchen als auch Welle ist müssen beide Eigenschaften gleichermaßen in ein Atommodell einfließen.
Orbitalmodell[Bearbeiten]
Objekte unter einer bestimmten Größe gehorchen nicht den Gesetzen der klassischen Newtonschen Mechanik. Das gilt auch für Elementarteilchen wie Elektronen, Protonen oder Neutronen. Um die Eigenschaften dieser Teilchen zu beschreiben wurde die Quantenmechanik entwickelt. Eine Vereinfachung und Anwendung der Quantenmechanik ist das Orbitalmodell, welches im wesentlichen die Aufenthaltswahrscheinlichkeiten von Elektronen in Atomen und Molekülen beschreiben soll. Da die chemischen Eigenschaften von Atomen und deren Bindungen mit anderen Atomen von Elektronen abhängen, ist dieses Modell sehr hilfreich in der Erklärung von chemischen Eigenschaften.
In Begriffen der klassischen Physik würde man sagen, dass die elektrostatische Anziehungskraft zwischen Kern und Elektron das Elektron im gewissen Maße anzieht und durch seine Geschwindigkeit, das Elektron dieser Kraft entgegenwirkt. Man hat jedoch festgestellt, dass dies nicht, wie nach Bohr auf konkreten Kreisbahnen geschieht, sondern dass sich das Elektron mehr oder weniger frei um den Kern herumbewegt. Da das Elektron auch Welleneigenschaften besitzt, kann man seinen Zustand bzw. seinen Ort mit einer Wellenfunktion beschreiben. Ein Elektron, welches ungestört in der Atomhülle ist, befindet sich demnach nicht an einem konkreten Ort. Vielmehr besitzt es für alle Orte eine bestimmte Aufenthaltswahrscheinlichkeit, die von seinem Quantenzustand (vgl. Pauli-Prinzip) abhängt. Das Quadrat der Wellenfunktion gibt diese Aufenthaltswahrscheinlichkeit des Elektrons im Raum, für Elektronen in Atomhüllen auch Orbital genannt, wieder. Weiteres folgt!
Detailierte Informationen zu den vorkommenden Isotpen für alle bekannten chemischen Elemente sortiert nach der Ordnungszahl sind der Tabelle der Isotope zu entnehmen. Für jedes Isotop sind seine Häufigkeit im natürlichen Vorkommen, die Spinparität, radioaktive Zerfallsart und Halbwertszeit angegeben.
Chemische Bindung[Bearbeiten]
Die Ausbildung chemischer Bindungen ist die Grundvoraussetzung für den Zusammenhalt von Molekülen, bestehend aus Atomen verschiedenster Elemente. In chemischen Reaktionen werden Bindungen getrennt und wieder geknüpft, was neue Verbindungen mit neuen chemischen Eigenschaften entstehen lässt.
Der Zusammenhalt von chemischen Elementen in Verbindungen setzt bindende Kräfte unterschiedlicher Art voraus. Je nach Stärke, also Energieinhalt dieser Kräfte spricht man einerseits lediglich von Wechselwirkungen, andererseits von Bindungen. Die Grenze dazwischen wurde mehr oder weniger willkürlich gezogen. Schwache Kräfte herrschen zum Beispiel zwischen Molekülen mit ungleicher Verteilung der Elektronendichte, kurz Dipolen, zwischen Dipolen und Ionen sowie zwischen scheinbar völlig unpolaren Molekülen über so genannte van-der-Waals-Wechselwirkungen. Zu den starken Bindungen zählt man die Ionenbindung, die Atom- und die Metallbindung.
Wenn Elemente miteinander eine chemische Reaktion eingehen, ist jedes Element bestrebt, einen stabilen elektronischen Zustand zu erreichen. Dabei lassen sich zwei Extremzustände beobachten. Zum Einen gelingt dies durch den Austausch von Elektronen, den Valenzelektronen, zum Anderen durch die Bildung von Elektronenpaaren, die beiden Bindungspartnern gemeinsam gehören.

Inhalt[Bearbeiten]
- Ionenbindung
- Atombindung
- Metallbindung
- Dipol-Dipol-Wechselwirkung
- Ion-Dipolwechselwirkung
- Van-der-Waals-Wechselwirkung
Das Modell der Ionenbindung basiert auf dem Idealbild einer rein elektrostatischen Wechselwirkung zwischen entgegen gesetzt geladenen Ionen: Das eine Element gibt seine Valenzelektronen vollständig an das andere ab. Es entstehen Anionen und Kationen, die sich gegenseitig anziehen. Tatsächlich definiert man das Vorliegen einer Ionenbindung bei einer Elektronegativitätsdifferenz (ΔEN) von mehr als 1,8 zwischen den beteiligten Elementen, wohl wissend, dass diese Grenze relativ willkürlich und der Übergang von der homopolaren Atombindung (siehe Atombindung) zur heteropolaren Ionenbindung fließend ist.
Grob gesagt, beim Blick auf das Periodensystem, können wir uns merken, dass Elemente, die dort links zu finden sind (Alkali- und Erdalkalimetalle), sehr niedrige Elektronegativitäten aufweisen, während Elemente rechts im Periodensystem (Chalkogene und Halogene) sehr hohe Elektronegativitätswerte besitzen, folglich Verbindungen von Elementen dieser Gruppen ionische Verbindungen sein müssen. Doch Vorsicht: Selbst bei Natriumchlorid, dem vielfach angeführten Paradebeispiel einer durch Ionenbindung zu Stande gekommenen Verbindung, liegt deren Anteil an den bindenen Wechselwirkungen bei 73 %.

Das Coulombsche Gesetz[Bearbeiten]
Struktur von Molekülen[Bearbeiten]
Strukturvorhersagen nach VSEPR[Bearbeiten]
Das VSEPR-Modell (VSEPR ist die Abkürzung für Valence shell electron pair repulsion, deutsch Valenzschalen-Elektronenpaar-Abstoßung) wird manchmal auch EPA-Modell (Elektronenpaarabstoßungsmodell) genannt. Man kann es dazu verwenden die Struktur von einfachen Molekülen vorauszusagen.[1]
Es besagt, dass die Elektronenwolken in der Valenzschale des Zentralatoms sich so weit entfernt wie möglich anordnen. Schließlich sind sie stets negativ geladen und gleiche Ladungen stoßen sich ab. Die Molekülgestalt ist eine Konsequenz dieser gegenseitigen Abstoßung der Elektronenwolken.
Dreieck[Bearbeiten]
Für den Fall, dass sich drei Liganden um ein Zentralatom anordnen sollen, ist die Möglichkeit mit den größten Winkeln ein gleichseitiges Dreieck also 120° Abstand zwischen den Bindungspartnern. In der Chemie wird diese Struktur trigonal planar, also dreieckig flach, genannt.
Die gestrichelte Linie soll andeuten, dass es sich um mesomere Grenzzustände handelt, da formal gesehen, eine Doppelbindung vorkommen muss. In Wirklichkeit gibt es diesen Formalismus nicht.
Polyeder (Vielflächler)[Bearbeiten]
Tetraeder[Bearbeiten]
Möglicherweise hat man in der Mathematik schon etwas von Tetraedern gehört, wobei sie dort meist als Pyramide, mit einem gleichseitigem Dreieck als Grundfläche, bezeichnet werden. Ein Tetraeder hat vier Ecken, vier Flächen, und sechs Kanten. Jede Fläche ist ein gleichseitiges Dreieck.
Der Tetraeder ist eine sehr wichtige und häufig vorkommende Geometrie in der Chemie, wobei das Molekül nicht aus Dreiecken besteht. Die folgenden Grafiken machen deutlich wie ein tetraedisches Molekül aussieht. Das Zentralatom ist magenta gezeichnet, die umgebenden Atome sind in weiß gehalten.
-
ein tetraedisches Molekül -
um den Tetraeder zu sehen, verbindet man (gedanklich) die äußeren Atome mit einer Linie -
Die Linien bilden die Kanten eines Tetraeders -
Zur Veranschaulichung nochmals die geometrische Figur eines Tetraeders

Wichtig in diesem Zusammenhang ist der Tetraederwinkel von ca. 109.5° im Gegensatz zum Quadrat in dem die Kanten jeweils nur einen Winkel von 90° bilden. Elektronenwolken, die sich abstoßen werden sich also immer tetraedisch anordnen um sich maximal aus dem Weg zu gehen.
Chemiker verwenden Keile und Striche um auch in zwei-dimensionalen Zeichnungen die reale 3D-Gestalt anzudeuten.
-
eine flache Lewis-Strichformel für CH4 Methan -
eine realistischere Version, die Molekülgestalt berücksichtigt -
3D-Modell eines Methanmoleküls
Das Modell lässt sich auch auf einfache Ionen anwenden, daher hier noch ein paar weitere Beispiele für tetraedisch gebautete Moleküle:
-
Thiosulfat, S2O32− -
Sulfat, SO42− -
Phosphat, PO43− -
Ammonium, NH4+
ein freies Elektronenpaar[Bearbeiten]
Nun betrachten wir den Fall, dass ein Elektronenpaar frei ist, also keinen Bindungspartner hat, am Beispiel von Ammoniak NH3. Die zwei Punkte in der Valenzstrichformel sollen deutlich machen, dass es sich um ein freies Elektronenpaar handelt. Normalerweise werden diese durch einen Balken abgekürzt. Das freie Elektronenpaar trägt zwar zur Struktur bei, die wirkliche Molekülgestalt wird aber letztendlich nur durch die Position der Atomkerne beschrieben.
-
Valenzstrichformel des Ammoniakmoleküls -
3D Modell mit freiem Elektronenpaar als gedachten Bindungspartner (Pseudostruktur) -
trigonal-pyramidale Struktur des Ammoniakmoleküls (Realstruktur)
Man geht also so vor, dass man freie Elektronenpaare wie Bindungspartner betrachtet, woraus sich eine tetraedische Pseudostruktur ergibt und denkt sich dann die Elektronenpaare weg. Was bleibt ist eine trigonal-pyramidale Struktur - eine Pyramide mit dreieckiger Grundfläche.
zwei freie Elektronenpaare[Bearbeiten]
Ein Beispiel für zwei freie Elektronenpaare ist das Wassermolekül H2O. Auch hier geht man wieder von der tetraedischen Struktur aus und kommt dann ohne die zwei Elektronenpaare auf eine gewinkelte Struktur. Der Winkel beträgt 104,5°. Er weicht aufgrund des erhöhten Platzbedarfs der freien Elektronenpaare vom idealen Tetraederwinkel 109,5° ab.
-
Valenzstrichformel H2O (flach) -
3D Modell mit den beiden freien Elektronenpaaren (blaßgelb) -
gewinkeltes Wassermolekül
drei freie Elektronenpaare[Bearbeiten]
Zuletzt noch einmal am Beispiel des Fluorwasserstoffes ein lineares Molekül mit 3 freien Elektronenpaaren.
-
Valenzstrichformel -
3D-Modell mit freien Elektronenpaaren -
lineares Molekül des Fluorwasserstoffes
Trigonale Bipyramide[Bearbeiten]
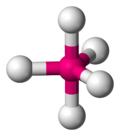
Fünf Liganden ordnen sich trigonal-bipyramidal um ein Zentralatom an, sprich das Molekül sieht aus wie eine doppelte Dreieckspyramide. Hierbei kommen zwei Winkel ins Spiel:
- Die dreieckige Grundfläche bieten den Bindungspartner einen Abstand von 120° - vgl. #Dreieck
- Die senkrecht darauf stehenden Atome von den übrigen Bindungspartner nur 90° von einander entfernt.
ein freies Elektronenpaar[Bearbeiten]
Das freie Elektronenpaar wird zunächst einen der 120° Plätze in der Grundfläche besetzen. Da es zudem auch noch mehr Platz beansprucht als ein gebundenes Elektronenpaar entsteht eine verzerrte Geometrie, die wie eine Wippe oder ein Schaukelbrett aussieht und auch bisphenoidal oder (irreführenderweise) "tetraedrisch verzerrt" genannt wird.
-
vier Liganden, ein freies Elektronenpaar -
es bleibt eine Art "Wippe" zurück
Der Unterschied zum #Tetraeder ohne freies Elektronenpaar ist sehr deutlich zu sehen. Die Struktur hat mit der tetraedischen Geometrie auch nichts zu tun.
zwei freie Elektronenpaare[Bearbeiten]
Auch das nächste freie Elektronenpaar wird sich einen Platz in der dreieckigen Grundfläche suchen, wodurch ein T-förmiges Molekül entsteht.
-
drei Liganden, zwei freie Elektronenpaare -
T-förmige Molekülgestalt
drei freie Elektronenpaare[Bearbeiten]
Jetzt fällt die gesamte trigonalen Grundfläche weg und es gibt wieder eine lineare Molekülgestalt.
-
zwei Liganden, drei freie Elektronenpaare -
Lineare Molekülgestalt
Oktaeder[Bearbeiten]
Die einzige Möglichkeit sechs Moleküle um ein Zentralatom anzuordnen und den größtmöglichen Abstandswinkel zu erhalten, ist ein sogenannter Oktaeder, ein Achtflächler. Er besitzt sechs Ecken, acht Flächen und zwölf Kanten. Der Winkel beträgt für alle Bindungspartner exakt 90°. Man könnte auch vierseitige Bipyramide mit quadratischer Grundfläche sagen, aber Oktaeder ist geläufiger.
-
ein beliebiges oktaedrisches Molekül -
um den Oktaeder zu sehen, verbinden wir die Liganden mit einer Linie -
Die Linien bilden die Kanten eines Oktaeders -
raumfüllendes Modell eines Oktaeders

Ein Anwendungsbeispiel ist das Schwefelhexafluorid Molekül, dessen Atome sich oktaedrisch anordnen.
-
Schwefelhexafluorid SF6 mit -
Kugel-Stab-Modell von SF6 -
Stäbchenmodell von SF6
Oktaeder kommen häufig bei Verbindungen mit Übergangsmetallen in sogenannten Komplexverbindungen vor. Dort stößt das relativ einfache VSEPR-Modell jedoch an seine Grenzen und lässt sich nicht immer anwenden.
ein freies Elektronenpaar[Bearbeiten]
Wieder nach dem gleichen Prinzip ergeben sich die aus dem Oktaeder abgeleiteten Strukturen. Wird ein Elektronenpaar nicht zur Atombindung verwendet ergibt sich eine quadratisch-pyramidale Struktur.
-
fünf Liganden, ein freies Elektronenpaar -
übrig bleibt eine Seite der Pyramide
zwei freie Elektronenpaare[Bearbeiten]
Nehmen wir noch einen weiteren Bindungspartner weg, ergibt sich eine quadratisch-planare Struktur.
-
vier Liganden, zwei freie Elektronenpaar -
übrig bleibt die quadratische Grundfläche
Diese Struktur ist nicht mit dem #Tetraeder (vier Liganden, keine freien Elektronenpaare) zu verwechseln. Die freien Elektronenpaare bestimmen die Struktur mit und erzwingen in diesem Fall das Quadrat.
VSEPR Geometrien[Bearbeiten]
Häufig angetroffene Strukturen:
-
linear -
gewinkelt -
trigonal-planar -
pyramidal -
quadratisch-planar -
tetraedisch -
trigonal-bipyramidal -
oktaedrisch
Tabelle[Bearbeiten]
Hier nocheinmal in einer Tabelle kompakt alle VSEPR-Typen zusammengestellt. Um also eine Molekülstruktur korrekt vorherzusagen, muss man zunächst eine korrekte Valenzstrichformel aufstellen. Anhand der Anzahl der Atome und freien Elektronenpaare im Molekül kann man sich dann die günstigste räumliche Struktur überlegen. Nach etwas Übung hat man es heraus.
- ↑ Ronald J. Gillespie, Edward A. Robinson: Models of molecular geometry Chem. Soc. Rev., 2005, 34, S.396-407, DOI:10.1039/b405359c
Komplexchemie[Bearbeiten]
Ein Komplex ist ein Molekülkation, -anion oder neutrales Molekül, bei dem ein Zentralatom oder -ion eine größere Zahl von Bindungspartnern (Liganden) besitzt, als man es von seiner Ladung bzw. seiner Stellung im Periodensystem erwarten würde (Hypervalenz). Unter Komplexbildung versteht man also die Änderung der Zahl der Atome oder Atomgruppen, die an ein Zentralatom gebunden (koordiniert) sind. Man spricht daher auch von einer Koordinationsverbindung. Die Komplexbildung geht sowohl mit einer Änderung der Geometrie, als auch mit neuen physikalischen und chemischen Eigenschaften im Vergleich zu den Ausgangstoffen einher.
Aufbau[Bearbeiten]
Das allgemeine Bauprinzip von Komplexen ist sehr einfach:
Um ein Zentralatom (meist ein Metallion) lagern sich bei einer Komplexbildungsreaktion nach einem bestimmten Schema Liganden an und sorgen so beispielsweise für eine massive Verbesserung der Löslichkeit. Diese Liganden gehen dabei eine koordinative Bindung mit dem Zentralatom ein. Je nach Koordinationszahl (Zahl der Liganden an einem Zentralatom), Größe, Polarität und Ladung kommt es hierbei zur Ausbildung von verschiedenen geometrischen Körpern.
-
[Fe(CN)6] Valenzstrichformel
-
[Fe(CN)6] 3D-Modell
-
K3[Fe(CN)6],
rotes Blutlaugensalz
Im Falle des Hexacyanidoferrat(III)-anions ist Zentralteilchen das Eisen(III)-kation, die Liganden sind die Cyanid-anionen, die Koordinationszahl ist sechs und der Koordinationspolyeder oktaedrisch.
Nomenklatur[Bearbeiten]
| F− | fluorido (früher fluro) |
| Cl− | chlorido (früher chloro) |
| OH− | hydroxido (früher (hydroxo) |
| CN− | cyanido (früher cyano) |
| H2O | aqua |
| NH3 | ammin |
| CO | carbonyl |
Die Benennung von Komplexverbindung erfolgt systematisch. Bei anionischen Komplexen gilt folgendes Schema, welches am Beispiel von K3[Fe(CN)6] erklärt wird:
| Kalium | hexa | cyanido | ferr | at | (III) |
|---|---|---|---|---|---|
| Kation | Anzahl der Liganden | Ligandname | Zentralteilchen (lateinisch) | at | Oxidationszahl |
| Kation | |||||
Die Benennung von kationischen Komplexen wird am Beispiel von [Ag(NH3)2]Cl erläutert:
| Di | ammin | silber | (I) | -chlorid |
|---|---|---|---|---|
| Anzahl der Liganden | Ligandname | Zentralteilchen | Oxidationszahl | Anion |
| Anion | ||||
Geometrien[Bearbeiten]
Die Geometrien des Hexacyanideferrat-anions und die des Diaminsilber(I)-kations lässt sich noch mit dem Elektronenpaarabstoßungsmodell aus dem Kapitel Struktur von Molekülen problemlos erklären.
-
linear:
Diamminsilber(I), [Ag(NH3)2]+ -
linear:
Dicyanidoaurat(I), [Au(CN)2]− -
tetraedisch:
Tetrachloridoniccolat(II), [NiCl4]2− -
tetraedisch:
Tetracarbonylnickel, Ni(CO)4 -
tetraedisch:
Tetrahydridoborat(III)]], [BH4]− -
tetraedisch:
Tetrahydroxidozinkat(II), [Zn(OH)4]2− -
oktaedrisch:
Hexaaquakupfer(II), [Cu(H2O)6]2+
Jedoch kommt es bei den Komplexverbindungen nicht nur zur tetraedischen Anordnung, die sich durch den größtmöglichen Abstandswinkel der Elektronenwolken erklären lässt, sondern auch zur eigentlich ungünstigen quadratisch flachen Koordination.
-
quadratisch planar:
Tetraamminkupfer(II), [Cu(NH3)4]2+ -
quadratisch planar:
Tetracyanidoniccolat(II), [Ni(CN)4]2− -
quadratisch planar:
Cisplatin, Cis-diammindichloridoplatin(II), PtCl2(NH3)2
Um diese Geometrien verstehen und sogar vorhersagen zu können, werden kompliziertere #Theorien benötigt.
Komplexisomerie im Tetraeder[Bearbeiten]
Komplexisomerie im Oktaeder[Bearbeiten]
cis und trans[Bearbeiten]
Für den Fall Z4L2 gibt es zwei Möglichkeiten der Anordnung: eine benachbarte (cis) und eine gegenüberliegende (trans).
-
cis-[CoCl2(NH3)4]+ -
trans-[CoCl2(NH3)4]+
fac und mer[Bearbeiten]
Für Z3L3, gibt es zwei mögliche Isomere: facial (fac) falls drei identische Liganden in der quadratischen Grundfläche des Oktaeder und einer Pyramidenspitze eine Fläche aufspannen. Die zweite die Anordnung heißt meridional (mer), sie entspricht einer trans-Anordnung bei der auch ein Ligand aus der quadratischen Grundfläche des Oktaeders beteiligt ist.
-
fac-[CoCl3(NH3)3] -
mer-[CoCl3(NH3)3]
Chiralität[Bearbeiten]
Kompliziertere Komplexe mit mehreren verschiedenen oder zweizähnigen Liganden können chiral sein, sie lassen sich also nicht mit ihrem Spiegelbild zur Deckung bringen. Ein allgemeines Kriteritum für die Chiralität eines Komplexes ist das Fehlen einer Drehspiegelachse.
-
Λ-[Fe(ox)3]3− -
Δ-[Fe(ox)3]3− -
Λ-cis-[CoCl2(en)2]+ -
Δ-cis-[CoCl2(en)2]+
Theorien[Bearbeiten]
Valence-Bond-Theorie[Bearbeiten]
Kristall- und Ligandenfeldtheorie[Bearbeiten]
Molekülorbitaltheorie[Bearbeiten]
Eigenschaften[Bearbeiten]
Farbigkeit[Bearbeiten]



Bekannt sind vor allem die farbigen Komplexverbindungen der Übergangsmetalle, die in Nachweisereaktionen Verwendung finden. Eine Verbindung erscheint farbig, wenn die Verbindung sichtbares Licht absorbiert. In Übergangsmetallkomplexen müssen die Energiestufen sorgfältiger definiert werden. Die schematischen Energiestufen entsprechen den Atomorbitalen. Elektronen in Übergangsmetallkomoplexen können von ihrem Standard-Orbital in ein Orbital höherer Energie angehoben werden.
- In ihrem normalen Orbital 1, hat ein Elektron die Energie .
- In einem energetisch höher liegenden Oribtal 2, die Energie .
- Die Energiedifferenz entspricht: .
Das erste Diagramm zeigt den Ausgangszustand: Orbital 1 ist mit einem Elektron besetzt, Orbital 2 ist frei. Im zweiten Schritt absorbiert das Elektron Energie in Form von Licht. Der Betrag der Energie ist dabei von Bedeutung.
- Falls , dann hat das Photon nicht genug Energie um das Elektron anzuheben, es wird also nicht absorbiert.
- Falls , hat das Photon eine zu hohe Energie und kann ebenfalls nicht absorbiert werden.
- Falls , also die Energie des Photon genau der zu überwindeten Energiebarriere zwischen den Orbitalen entspricht, findet die Anhebung des Elektrons statt.
Dadurch, dass die Energiebarriere exakt getroffen werden muss, können nur Photonen einer bestimmten Wellenlänge von Orbital 1 in Orbital 2 befördert werden. Die Wellenlänge bestimmt die Farbe des absorbierten Lichtes. Da es sich um Absorbtion handelt: also das Licht, dass von der Substanz "verschluckt" wird, entspricht genau die Komplementärfarbe des einfallenden Lichtes, der Farbe, die wir beim Ansehen der Verbindung wahrnehmen. Beispielsweise würde eine blaue Flüssigkeit, oranges Licht absorbieren.
Die Komplementärfarben kann man im unten abgebildeten Farbkreis ablesen: sich dort gegenüberstehende Farben sind zueinander komplementär.
-
Lichtabsorption einer Lösung
-
Farbkreis
Chemische Reaktion[Bearbeiten]
Die chemische Reaktion ist ein Vorgang wobei die Reinstoffe sich verändern. Dies ist mit der Veränderungen der Stoffeigenschaften deutlich. In der Chemie gibt es 3 Hauptreaktione:
Definitionen[Bearbeiten]
Eine chemische Reaktion ist eine Stoffumsetzung. Die Reaktionsgeschwindigkeit gibt an, wie schnell die Umsetzung verläuft; sie kann mit einem Katalysator beschleunigt werden. Chemische Reaktionen werden symbolisch in Form eines Reaktionsschemas wiedergegeben („Reaktionsgleichung“).
- Die Verbrennung ist ein Spezialfall der Oxidation. Der Gegensatz davon ist die Reduktion. Oxidation und Reduktion treten in der Redoxreaktion gemeinsam auf.
- Säuren und Basen reagieren miteinander in der Säure-Base-Reaktion. Ein Spezialfall ist die Neutralisation; dazu müssen im einfachsten Fall der einwertigen und starken Säuren und Basen gleiche Stoffmengen von Säure und Base zusammengegeben werden.
Analyse[Bearbeiten]
Definition: Unter einer Analyse versteht man die Zerlegung eines Stoffes in seine Bestandteile oder die Bestimmung derselben.
Man unterscheidet zwischen:
- Qualitative Analyse ("Was ist drin?")
- Quantitative Analyse ("Wieviel ist drin?")
Die qualitative Analyse:
Dazu werden verschiedene Verfahren angewendet. Die Trennung von Stoffgemischen und die Reinigung von Stoffen erfolgen meist mittels physikalischer Verfahren. Diese machen sich Unterschiede in den physikalischen Eigenschaften wie zum Beispiel Dichte oder Siedepunkt zunutze und erfolgen ohne Stoffumwandlung. Dennoch gehören sie zu den wichtigsten und häufigsten Aufgaben des Chemikers, z. B.: Adsorption – Chromatographie – Destillation – Extraktion – Filtration – Flotation – Magnetseparation] – Sedimentation – Umkristallisieren – Zentrifugation – Zonenschmelzen
- Chemische Trennverfahren können beispielsweise auch zur Racematspaltung angewandt werden. Chemische Trennverfahren benutzen oft Fällungsreaktionen, um einen Stoff aus einer Lösung als Feststoff abzuscheiden. Eine Folge solcher Fällungsreaktionen ist der Trennungsgang (Kationentrenngang) mit seinen Nachweisreaktionen für bestimmte Kationen. Es gibt sogar einen Anionentrennungsgang. Näheres siehe vor allem in der Analytischen Chemie.
Die quantitative Analyse:
Hier wird ein Stoff mengenmäßig erfasst. Dazu gibt es verschiedene Methoden:
- Gravimetrisch
- Titrimetrisch (Maßanalyse)
- Fotometrisch
Bei der gravimetrischen Bestimmung wird ein Stoff aus einer zumeist wässrigen Lösung mit einem Fällungsmittel ausgefällt, dann getrocknet, um das anhaftende Wasser und Fällungsreagenz zu entfernen, und dann gewogen. Die titrimetische Bestimmung wird meistens bei Salzen, Säuren und Basen angewandt. Man unterscheidet zwischen Redox-, Neutralisations- oder Fällungsmaßanalyse. Dazu wird eine Maßlösung mit genauem Gehalt verwendet, die über eine Bürette langsam zugeführt wird. Der Endpunkt der Titration wird über einen Indikator, durch Messung der Leitfähigkeit oder einen anderen Farbumschlag erkenntlich gemacht. Bei der fotometrischen Bestimmung wird eine unbekannte Lösung gegen eine farbige Kontrolllösung verglichen und über die Stärke der Farbe die Menge an Substanz ermittelt.
Thermolyse[Bearbeiten]
Elektrolyse[Bearbeiten]
Synthese[Bearbeiten]
Unter einer Synthese versteht man die gezielte Herstellung eines Chemischen Stoffes. Dabei fallen oft Nebenprodukte an, die anderweitig weiterverwendet werden. Für die Herstellung einer bestimmten Menge des gewünschten Chemischen Stoffes werden gemäß der Gesetze der Stöchiometrie gezielte Ausgangsmengen berechnet und eingesetzt.
Stöchiometrie[Bearbeiten]
Grundlagen[Bearbeiten]
Einleitung[Bearbeiten]
Werden Stoffe bei chemischen Reaktionen umgesetzt, so lässt sich dies oft recht einfach anhand von Eigenschaftsänderungen verfolgen. Will man jedoch eine solche Umsetzung verstehen und deuten so muss man sie sowohl qualitativ wie auch quantitativ untersuchen. Die systematische Beobachtung von messbaren Parametern bei chemischen Reaktionen und deren Bewertung, stellt prinzipiell die Geburtsstunde der Chemie als Naturwissenschaft dar.
Experimentelle Befunde der „frühen“ Chemie[Bearbeiten]
Die Untersuchung der Massen von Reaktionsteilnehmern war eines der ersten Felder, die systematisch erforscht wurden. Diese Untersuchungen führten zu den wichtigsten Grundlagen der Chemie.
Einer der Fundamentalsätze der Chemie ergibt sich, wenn man die Masseveränderung aller Reaktionsteilnehmer untersucht. Man gelangt zur uns mittlerweile als selbstverständlich geltenden Erkenntnis: Es gibt keine Masseänderung. Man kann argumentiern, dass das Verbrennen eines Stückes Holz sehr wohl mit einer drastischen Gewichtsabnahme einhergeht, aber dies ist nur scheinbar der Fall. Führt man die Reaktion in einem geschlossenem System durch, also einem System, bei dem kein Stoffaustausch mit der Umgebung möglich ist, so wird die Masse des Systems vor und nach der Reaktion gleich groß sein, nämlich die Masse der Verbrennungsprodukte (Kohlendioxid usw.) plus die Masse des Verbrennungsrückstandes (Asche). Der Französiche Chemiker Antoine Laurent Lavorsier formulierte diese Feststellung 1774 im Gesetz von der Erhaltung der Masse:
Bei allen chemischen Vorgängen bleibt die Gesamtmasse der Reaktionsteilnehmer unverändert.
Außer der Gesamtmasse aller Reaktionsteilnehmer kann man auch die Massenverhältnisse der verschiedenen an der Reaktion beteiligten Stoffe untersuchen. Das bedeutet man kann feststellen, welche Masse von einem Stoff mit welcher Masse eines anderen Stoffes reagiert und einen neuen Stoff bildet.
Eine solche Untersuchung wurde erstmals von dem französischen Chemiker Joseph Louis Proust vorgenommen.
Er stellte fest, dass die Elemente Wasserstoff und Sauerstoff nur im Masseverhältnis
miteinander reagieren. Ist einer der beiden Reaktionspartner im Überschuss vorhanden so reagiert dieser Überschuss nicht, er liegt nach der Reaktion unverändert vor. Das gleiche Verhältnis der Massen von Wasserstoff und Sauerstoff erhält man bei der elektrochemischen Zerlegung von Wasser in die Elemente. Proust stellte bei der Analyse und Synthese verschiedener anderer Verbindungen ebenfalls konstante Masseverhältnisse der Reaktanden fest und fasste diese Untersuchungen 1799 im Gesetz der konstanten Proportionen zusammen:
Das Massenverhältnis zweier sich zu einer chemischen Verbindung vereinigender Elemente ist konstant
Im Gesetz konstanter Proportionen ist das 'einer Chemischen Verbindung' extra hervorgehoben. Der Engländer John Dalton stellte fest, dass sich bei der Verbrennung von Kohle (idealerweise dem Element Kohlenstoff) abhängig von der Luftzufuhr zwei verschiede Gase als Produkte bilden können. Das eine Gas, welches sich bei geringerer Luftzufuhr gebildet hatte, konnte bei weiterer Luftzufuhr entzündet werden und verbrannte mit blauer Flamme, während das Gas welches bei ausreichender Zufuhr von Luft entstanden war keine derartige Reaktion zeigte.
Bei genauerer Betrachtung dieses Sachverhaltes stellte Dalton fest, dass 1 g Kohlenstoff mit 1,333 g Sauerstoff zu dem entzündbaren Gas reagiert oder 1 g Kohlenstoff mit 2,666 g Sauerstoff zum nicht brennbaren Gas. Außerdem reagiert das brennbare Gas mit weiteren 1,333 g Sauerstoff ebenfalls einem nicht brennbaren Gas.
Dalton erweiterte daher 1803 das Gesetz der konstanten Proportionen zum Gesetz der multiplen Proportionen:
Die Massenverhältnisse zweier sich zu verschiedenen chemischen Verbindungen vereinigender Elemente stehen im Verhältnis einfacher ganzer Zahlen zueinander
Ein weiterer experimenteller Befund, welcher von großer Wichtigkeit für das Verständnis der Chemie ist, wurde 1808 vom Franzosen Joseph Louis Gay-Lussac gefunden.
Bei einer bestimmten Temperatur und einem bestimmten Druck hat jeder gasförmigen Stoff ein bestimmtes Volumen. Gay-Lussac stellte nun fest, dass bei der Zersetzung von Wasser immer Sauerstoff und Wasserstoff im Volumenverhältnis 1:2 entstehen. Außerdem stellte er ebenfalls fest, dass bei Temperaturen oberhalb von 100 °C, also oberhalb des Siedepunktes von Wasser,
1 Volumen Sauerstoff und 2 Volumina Wasserstoff zu 2 Volumina Wasserdampf reagieren. Gay-Lussac formulierte diese Beobachtung im chemischen Volumengesetz aus:
Das Volumenverhältnis gasförmiger Reaktionsteilnehmer lässt sich bei gegebener Temperatur und gegebenen Druck durch ganze Zahlen ausdrücken
Die Deutung der Befunde – Atome und Moleküle[Bearbeiten]
Fassen wir die experimentellen Ergebnisse des vorangegangenen Absatzes noch einmal zusammen:
1. Gesetz von der Erhaltung der Masse: Bei allen chemischen Vorgängen bleibt die Gesamtmasse der Reaktionsteilnehmer unverändert.
2. Gesetz der konstanten Proportionen: Das Massenverhältnis zweier sich zu einer chemischen Verbindung vereinigender Elemente ist konstant.
3. Gesetz der multiplen Proportionen: Die Massenverhältnisse zweier sich zu verschiedenen chemischen Verbindungen vereinigender Elemente stehen im Verhältnis einfacher ganzer Zahlen zueinander.
4. chemisches Volumengesetz: Das Volumenverhältnis gasförmiger Reaktionsteilnehmer lässt sich bei gegebener Temperatur und gegebenen Druck durch ganze Zahlen ausdrücken.
Der Engländer John Dalton stellte 1808 seine Atomhypothese auf, welche die Deutung der bis dahin bekannten ersten drei Gesetze darstellt. Der wichtigste Inhalt dieser Hypothese ist, dass sich chemische Stoffe nicht beliebig teilen lassen, da sie aus kleinsten nicht weiter zerlegbaren Teilchen bestehen, welche er in Anlehnung an den griechischen Philosophen Leukipp Atome nannte. Eine weitere wesentliche Eigenschaft der Atome ist, dass die Atome eines bestimmten Elementes alle gleich sind. Sie haben in erster Linie alle die gleiche Masse wohingegen Atome verschiedener Elemente voneinander verschiedene Massen haben. Mit Hilfe dieser Hypothese konnte Dalton seine experimentellen Befunde und die seiner Vorgänger bequem und überzeugend deuten:
Deutung des Gesetzes von der Erhaltung der Masse[Bearbeiten]
Bei einer Reaktion erfolgt eine Um- oder Zusammenlagerung der an der Reaktion teilnehmenden Atome. Da Atome nicht verschwinden oder aus dem Nichts entstehen können, kann auch keine Masseänderung eintreten.
Deutung der Gesetze der konstanten und der multiplen Proportionen[Bearbeiten]
Da Atome nicht weiter teilbar sind, können sie nur als ganzes reagieren und nur Verbindungen bilden, die auch ganze Atome enthalten. Die verschiedenen Massenverhältnisse der Verbindungen sind also nichts weiter als die Massenverhälnisse der Atome bzw. deren ganzzahligen Vielfachen. Die Masse der Atome der verschiedenen Elemente kann man jedoch nur bestimmen, wenn man das Zahlenverhältnis der Atome zueinander kennt bzw. umgekehrt kann man auch das Zahlenverhältnis bei Kenntnis der Massen bestimmen.
Das chemische Volumengesetz deutete der italienische Physiker Amedeo Avogadro so, dass Atomverbände, welche eine verschiedene Anzahl von Atomen enthalten können, bei den beobachteten Gasreaktionen mit einander reagieren. Diese Atomverbände nannte er Moleküle, wobei die gleiche Zahl von Molekülen bei gleichem Druck und gleicher Temperatur das gleiche Volumen hat. Wenn also ein Volumen Sauerstoff mit zwei Volumina Wasserstoff zu zwei Volumina Wasser reagieren, kann man das nach Avogadro wie folgt interpretieren:
- Es entstehen genau soviele Wassermoleküle wie Wasserstoffmoleküle eingesetzt wurden.
- Das Verhältnis Wasserstoff zu Sauerstoff in Wassermolekülen ist 2 zu 1
Das ganze lässt sich mit Hilfe chemischer Formeln und Reaktionsgleichungen wesentlich kürzer ausdrücken.
Atom- und Molekülmassen[Bearbeiten]
Grundlegende Gleichungen[Bearbeiten]
Stöchiometrisches Rechnen[Bearbeiten]
Beispielaufgabe: Wie viel Wasserstoff entsteht bei der Reaktion von 1 g Lithium mit Wasser?
1. Schritt: Zuerst muss die Reaktionsgleichung für die untersuchte Umsetzung erstellt werden. Eine Reaktionsgleichung beschreibt die Stoffumwandlung nicht nur qualitativ (also Was?), sondern auch quantitativ (also Wie viel?). Deshalb muss man erst einmal wissen, was miteinander reagiert und die Edukte (Ausgangsstoffe) und die Produkte (Endstoffe) bestimmen.
Dies kann man zuerst einmal mit Hilfe einer Wortgleichung durchführen.
... um sich dann zu überlegen, wie die Symbolschreibweise für die Stoffe lautet:
Damit die Umsetzung auch quantitativ richtig durch die Reaktionsgleichung beschrieben wird, muss die Reaktionsgleichung ausgeglichen werden. Momentan enthalten die Edukte 2 H-Atome, während bei den Produkten aber 3 H-Atome vorkommen.
Nun ist die Reaktionsgleichung richtig.
2. Schritt: Die Berechnung beruht auf dem Prinzip der Proportionalität: Setzt man die doppelte Menge an Edukten ein, erhält man auch die doppelte Menge an Produkten. Man bestimmt deshalb die Massen der an der Reaktion beteiligten Moleküle. Dazu verwendet man die molare Masse (dargestellt als M) mit der Einheit g/mol, wie sie im Periodensystem zu finden sind.
| 2 Li | + | 2 H2O | → | H2 | + | 2 LiOH |
| M = 2 × 7 g/mol = 14 g/mol |
M = 2 × ( (2 × 1 g/mol) + 16 g/mol ) = 36 g/mol |
M = 2 × 1 g/mol = 2 g/mol |
M = 2 × ( 7 g/mol + 16 g/mol + 1 g/mol ) = 48 g/mol |
So weiß man nun, dass aus 14 g Lithium 2 g Wasserstoff entstehen, womit man das Ergebnis berechnen kann:
Man kann in dieser Gleichung die Einheit u wegkürzen und sie nach x auflösen:
Alternativ lässt sich das Ergebnis auch per Dreisatz-Rechnung bestimmen.
Das Ergebnis der stöchiometrischen Rechnung ist, dass für jedes eingesetzte Gramm Lithium 0,143 g Wasserstoff entstehen. Mit Hilfe der Dichte kann man dann noch das Volumen des entstandenen Wasserstoffs berechnen: Es entstehen ≈1,59 Liter Wasserstoff.
Zuhilfenahme der Oxidationszahl[Bearbeiten]
Zur Berechnung der Verhältnisse von chemischen Verbindungen aus Atomen zweier chemischer Elemente muss das kleinste gemeinsame Vielfache (kurz: kgV) der Oxidationszahl der beiden beteiligten chemischen Elemente gebildet werden. Um nun die Zahl der in der Verbindung vorhandenen Atome des jeweiligen Elements zu ermitteln, muss das kgV durch diese Oxidationszahl dividiert werden.
Beispiel 1: Die Ermittlung der chemischen Formel von Wasser[Bearbeiten]
- Die Oxidationszahl von Wasserstoff in der Verbindung ist:
- +1
- Die Oxidationszahl von Sauerstoff ist:
- -2
- Das kgV heißt:
- .
- Die Zahl der beteiligten Sauerstoff-Atome ist:
- .
- Die Zahl der beteiligten Wasserstoff-Atome ist:
- .
- Die chemische Formel lautet:
- ,
- und da die Eins (1) im Index von Sauerstoff (O) nicht mit notiert wird:
- .
Beispiel 2: Die Ermittlung der chemischen Formel von Aluminiumoxid[Bearbeiten]
- Die Oxidationszahl von Aluminium ist:
- +3
- Die Oxidationszahl von Sauerstoff ist:
- -2
- Das kgV heißt:
- .
- Die Zahl der beteiligten Sauerstoff-Atome ist:
- .
- Die Zahl der beteiligten Aluminium-Atome ist:
- .
- Die chemische Formel lautet:
- .
Beispiel 3: Die Ermittlung der chemischen Formel von Ammoniak[Bearbeiten]
- Die Oxidationszahl von Stickstoff ist:
- -3
- Die Oxidationszahl von Wasserstoff ist:
- +1 da Wasserstoff in der I. Hauptgruppe steht.
- Das kgV heißt:
- .
- Die Zahl der beteiligten Wasserstoff-Atome ist:
- .
- Die Zahl der beteiligten Stickstoff-Atome ist:
- .
- Die chemische Formel lautet:
- ,
- und da die Eins (1) im Index von Stickstoff (N) nicht notiert wird:
- .
Elementaranalyse[Bearbeiten]
Oktan (ein Bestandteil des Benzins) verbrennt mit Sauerstoff zu Kohlendioxid und Wasser:
- .
Die beteiligten Elemente haben folgende Atommassen:
Hieraus lassen sich die Molekülmassen berechnen:
In Gramm ausgedrückt lautet das Reaktionsschema also
- .
Bei der Verbrennung von 228 g Oktan entstehen also 704 g und 324g . Dabei werden 800 g verbraucht. Umgerechnet ergibt das 3,09 kg pro kg Oktan.
Umsatz[Bearbeiten]
Einem chemischen Reaktor werden 100 Teile "A" und 50 Teile "B" zugeführt. Die darin ablaufende chemische Reaktion sei
Es reagiert also jeweils ein Teil "A" mit einem Teil "B" zu je einem Teil "C" und "D". In diesem Fall würde der Umsatz auf den Stoff "B" bezogen werden, da "A" im Überschuss vorliegt.
Wenn nun eine Mischung aus 90 Teilen "A", 40 Teilen "B" und je 10 Teilen "C" und "D" den Reaktor verlässt, dann ist der resultierende Umsatzgrad 0,2 oder 20%, denn es wurden 20% des in den Reaktor eintretenden "B" in andere Stoffe umgewandelt:
Ausbeute[Bearbeiten]
Einem chemischen Reaktor werden 100 Teile "A" und 50 Teile "B" zugeführt. Die darin ablaufenden chemischen Reaktionen seien
- (Folgereaktion)
d.h. es reagiert jeweils ein Teil "A" mit einem Teil "B" zu je einem Teil "C" und "D". Außerdem können zwei Teile "C" zu einem Teil "E" reagieren. In diesem Fall würden Umsatzgrad und Ausbeute auf den Stoff "B" bezogen werden, da "A" im Überschuss vorliegt.
Nun verlässt eine Mischung aus 60 Teilen "A", 10 Teilen "B", 20 Teilen "C", 40 Teilen "D" und 10 Teilen "E" den Reaktor. In der ersten Reaktion wurden also je 40 Teile "A" und "B" in je 40 Teile "C" und "D" umgewandelt. Nach der zweiten Reaktion wurden 20 Teile "C" in 10 Teile "E" umgewandelt.
Hier wäre nun die Ausbeute an "D" gleich 80% (oder 0,8), da (40-0)/50 = 0,8. Die Ausbeute an "C" wäre nur gleich 40% (20-0/50), da ein Teil weiterreagiert hat.
Das chemische Gleichgewicht[Bearbeiten]
Ein chemisches Gleichgewicht entsteht, wenn in einem isolierten System bei konstanten Bedingungen wie Temperatur und Druck, Hin- und Rückreaktionen gleichzeitig ablaufen. Das bedeutet, dass Edukte zu Produkten reagieren, diese aber auch wieder in die Edukte zerfallen. Dies geschieht so lange bis sich das chemische Gleichgewicht eingestellt hat, also die Reaktionsgeschwindigkeit der Hin- und Rückreaktion gleich groß ist. An diesem Punkt finden zwar noch Reaktionen statt, aber die Konzentration der einzelnen Edukte und Produkte bleibt unverändert. Katalysatoren können zwar die Einstellung dieses chemischen Gleichgewichts beschleunigen, den Punkt an dem sich das Gleichgewicht einstellt aber nicht verschieben.
Das Prinzip von Le Chatelier[Bearbeiten]
Das Verschieben des Gleichgewichts ist jedoch möglich. Dabei wirken die Prinzipien von Le Chatelier oder auch das Prinzip des kleinsten Zwanges genannt. Dieses besagt, dass sich ein chemisches Gleichgewicht unter folgenden Gesichtspunkten verändern kann:
- Veränderung des Drucks bei Gasen
- Bei einer Druckerhöhung verschiebt sich das Gleichgewicht auf die Seite der Reaktionsgleichung, auf der weniger Mol an Gas vorliegen.
- Bei einer Druckerniedrigung bilden sich verstärkt die Stoffe auf der Seite der Reaktionsgleichung, wo mehr Mol an Gas vorhanden sind.
- Veränderung der Temperatur
- Exotherme Reaktionen werden unterstützt, wenn man die Temperatur im System senkt. Im allgemeinen werden Reaktionsgleichungen für exotherme Reaktionen von links nach rechts aufgeschrieben. Somit verschiebt sich das Gleichgewicht zu Seiten der Produkte.
- Wird die Temperatur erhöht, so verschiebt sich das Gleichgewicht zur Seite der endothermen Reaktionsprodukte. Also der endothermen Rückreaktion mit den Edukten auf der linken Seite der Gleichung.
- Veränderung der Konzentrationen
- Die Entnahme eines Produkts oder auch Edukts führt zu seiner Nachbildung, da das Gleichgewicht bestrebt ist, sich wieder einzustellen. Somit kann die Bildung eines Produkts erhöht werden, indem man es aus dem System immer wieder entfernt.
- Die Zugabe eines Edukts führt immer zu seinem Verbrauch. Somit kann durch Zuführen eines Edukts die Konzentration der Produkte ebenfalls erhöht werden.
- Die maximale Ausbeute an Produkten erhält man also, indem man das gewünschte Produkte immer wieder entfernt und die Edukte immer wieder zuführt.
Schauen wir uns diesen Zusammenhang des chemischen Gleichgewichts am Beispiel der Ammoniaksynthese nach dem Haber-Bosch-Verfahren an:
; ΔRHM = - 92,1 kJ/mol
Wie man an der Reaktionsenthalpie sehen kann ist diese Reaktion eine exotherme Reaktion, es werden dabei pro Mol 92,1 kJ an Energie in Form von Wärme abgegeben.
Im Haber-Bosch-Verfahren findet diese Reaktion jedoch unter folgenden weiteren Reaktionsbedinungen statt:
- Eisenkatalysatoren: Fe/Al2O3/K2O mit einer Betriebstemperatur von 500°C
- einem Druck von 20 MPa
Nun kann man an diesem Beispiel das Prinzip von Le Chatelier nachvollziehen:
- Druckerhöhung:
Wie man sieht, findet die Reaktion bei 20 MPa statt (Standarddruck: 101,325 kPa) das ist beinahe das 200fache des Normaldrucks. Warum verschiebt sich nun das Gleichgewicht in Richtung des Produkts Ammoniak? - Wie man sieht, beinhaltet diese Formel 4 Mol an gasförmigen Edukten (1 Mol Stickstoff und 3 Mol Wasserstoff), aber nur 2 Mol an gasförmigen Produkten (Ammoniak). Nach dem Prinzip von Le Chatelier verschiebt sich bei einer Druckerhöhung das chemische Gleichgewicht in Richtung der Seite, auf der weniger Mol gasförmiger Stoffe vorhanden sind. Im Fall der Ammoniaksynthese also nach rechts, da das Verhältnis 4 : 2 vorliegt.
- Temperaturerhöhung:
Bei der Ammoniak-Synthese ist eine Veränderung des Gleichgewichts mittels einer Temperaturerniedrigung leider nicht möglich. Das liegt daran, dass der Katalysator erst ab 500°C seine Betriebstemperatur erreicht hat und ohne Katalysator eine längere Zeitspanne nötig wäre, bis sich das Gleichgewicht einstellt. Somit muss diese Reaktion bei hohen Temperaturen ablaufen, auch wenn eigentlich eine Temperaturerniedrigung auf Grund einer exothermen Reaktion sinnvoll wäre. Der Einsatz eines Katalysators überwiegt jedoch diesem Vorteil, durch die beschleunigte Einstelllung des Gleichgewichts.
- Konzentrationsänderungen
An der Reaktionsgleichung nicht abzulesen, aber in der Anlage, in dem das Haber-Bosch-Verfahren zur Anwendung kommt, wird das entstandene Ammoniak mittels Verflüssigung aus dem Kreislauf entfernt und neue Edukte hinzugeführt. Dies geschieht in einem ständigen Kreisprozess.
Berechnung der Ausbeute[Bearbeiten]
Manchmal kann es vorkommen, dass man wissen möchte, wie viel von einem Produkt in einem chemischen Gleichgewicht vorhanden ist. Da ein chemisches Gleichgewicht ja kein vollständiger Stoffumsatz ist, kann man die Ausbeute also auch nicht an der Reaktionsgleichung ablesen.
Um die Ausbeute eines Produkts in einem chemischen Gleichgewicht berechnen zu können, benötigt man aber die Konzentration in der das Produkt im Gleichgewicht vorliegt. Da sich das Gleichgewicht, wie wir jetzt wissen verschieben kann, gilt die Ausbeute natürlich auch nur für die Temperatur und den Druck, also alle Bedingungen, für die wir die Konzentration gegeben haben.
Schauen wir uns nun also die Berechnung der Ausbeute eines Produkts am Beispiel der Reaktion von Iod und Wasserstoff zu Iodwasserstoff an:
Iod + Wasserstoff <--> 2 Iodwasserstoff
Bei einem vollständigen Stoffumsatz hätten wir nun 2 Mol Iodwasserstoff. Da aber ein chemisches Gleichgewicht herrscht haben wir weniger als 2 Mol. Wie viel % davon lässt sich nun wie folgt berechnen:
gegeben: n[HI] = 1,56 mol ; n [I2] = 0,22 mol gesucht: Ausbeute von HI
Die Ausbeute lässt sich nach folgender Formel berechnen:
Die reale Ausbeute ist 1,56 Mol, die maximale Ausbeute wird aus der Reaktionsgleichung entnommen und beträgt 2 Mol.
Somit ergibt sich eine Ausbeute von η = 0,78 und somit 78%. Man kann also sagen, dass bei den gegebenen Bedingungen für dieses chemische Gleichgewicht 78% Iodwasserstoff entsteht, von dem was eigentlich nach der Reaktionsgleichung zu erwarten wäre.
Thermodynamik[Bearbeiten]
Enthalpie[Bearbeiten]
Definitionen[Bearbeiten]
Ist die Wärme- und Volumenarbeit eines Systems bei konstantem Druck.
Verschiedene Arten von Enthalpien und ihren Berechnungsarten[Bearbeiten]
Die molare Verbrennungsenthalpie ΔcH°[Bearbeiten]
Die molare Verbrennungsenthalpie gibt an, wie viel Energie bei der Verbrennung von einem Mol eines brennbaren Stoffes freigesetzt wird.
Beispiel: Verbrennung von Ethan:
Das in bedeutet molar und wird hier weggelassen (bzw. ist in der Rechnung an der Einheit ersichtlich). Das steht für combustion. Der Kringel steht für die Standardbedingungen vor und nach der Reaktion, das sind 25 °C und 101,3 kPa (nach IUPAC dagegen 100,0 kPa).
Die molare Reaktionsenthalpie ΔRH° (auch ΔrH°)[Bearbeiten]
Die molare Reaktionsenthalpie ist der Quotient aus den Formelumsätzen entsprechend der Reaktionsgleichung und der Reaktionsenthalpie. Sie ist also abhängig von der Stoffmenge der Reaktion. Häufig tritt in diesem Kontext auch der Begriff der molaren Standard- Reaktionsenthalpie (ΔrHm°) auf, wobei noch einmal ein besonderer Fokus darauf gelegt werden soll, dass Standardbedingungen (25 °C ; 1000hPa) vorherrschen.
Beispiel der Wassersynthese aus den Elementen:
- ΔRH°
Die molare Standardbildungsenthalpie ΔfH° (auch ΔfH° oder ΔBH°)[Bearbeiten]
Die molare Standardbildungsenthalpie gibt an, wie sich die Enthalpie bei der Synthese von einem Mol eines Stoffes aus den Elementen ändert.
Als Beispiel benutzen wir die Wassersynthese:
- ΔfH°
- ΔfH°
Die Differenz bei der Wassersynthese beruht auf der molaren Kondensationsenthalpie für ein Mol Wasser. Wie zu sehen ist, wird bei der Kondensation des Wassers zusätzlich Energie abgegeben.
Regeln zur Berechnung der molaren Standardbildungsenthalpie:
- Die molare Standardbildungsenthalpie für Elemente in Reinform beträgt 0
- ΔfH° einer Modifikation oder einer instabilen Form eines Elements ≠ 0
- Beispiel: ΔfH° [Graphit] = 0 ; ΔfH° [Diamant] = +1,897 kJ/mol
- ΔfH° ist vom Aggregatzustand abhängig, normalerweise geht man von chemischen Reaktionen bei Zimmertemperatur aus
Berechnen wir nun einmal die molare Standardbildungsenthalpie von Methan (CH4:
Die Berechnung über die Formel
ist jedoch nicht möglich. Also müssen wir die Snythese von Methan in mehrere Reaktionsschritte zerlegen:
- ΔfH° (CO2) = −393 kJ/mol
- ΔfH° (H2O) = −285 kJ/mol
- ΔRH° = −889 kJ/mol
gesucht: ΔfH° [CH4].
Ansatz:
wobei der stöchiometrische Koeffizient zu Stoff X ist. Dieser wird der Reaktionsgleichung entnommen.
Hinweis: Sauerstoff muss in dieser Reaktion nicht beachtet werden, da nach Regel 1.) ΔfH°[O2] = 0 ist.
- −ΔfH° [CH4] = [−889 kJ/mol] − [1·(−393 kJ/mol) + 2·(−285 kJ/mol)]
- −ΔfH° [CH4] = −889 kJ/mol − (−963 kJ/mol) |·(−1)
- ΔfH° [CH4] = −74 kJ/mol
Wenn man diesen Wert nun mit einem offiziellen Wert, der wissenschaftlich berechnet wurde, vergleicht, so findet man beispielsweise als offizielle Angabe ΔfH° [CH4] = −75 kJ/mol. Dies beweist, dass ein berechneter Wert sehr dicht an den offiziellen Wert heran kommt, natürlich immer kleine Abweichungen zu Referenzwerten möglich sind, da es sich um eine einfache Berechnung handelt, in der bereits vor dem Einsetzen der Werte gerundet wurde.
Einige wichtige Enthalpiewerte[Bearbeiten]
Tabellensammlung Chemie/ Enthalpie und Bindungsenergie
Hubarbeit bei Reaktionen[Bearbeiten]
Innere Energie[Bearbeiten]
Entropie[Bearbeiten]
Definitionen[Bearbeiten]
Zur weiteren Betrachtung von chemischen Reaktionen ermittelte Boltzmann eine weitere Kenngröße. Die Entropie — diese gibt Aufschluss über die Ordnung in einem chemischen System und die damit verbundenen Anordungsmöglichkeiten der Teilchen im System. Ist die Entropie gleich 0 so gibt es für alle Teilchen maximal eine Anordnungsmöglichkeit in einem System. Berechnen lässt sich die Entropie nach folgender Formel:
mit
- : Entropie,
- : Boltzmann-Konstante, ,
- : (Kehrwert der) thermodynamische(n) Wahrscheinlichkeit = Zahl der Anordnungsmöglichkeiten oder Mikrozustände der Teilchen eines unveränderten, geschlossenen Systems.
Da die Berechnung der Entropie sehr komplexer Beobachtungen bedarf, greift man bei chemischen Berechnungen größtenteils auf vorgegebene Werte zurück.
Einige wichtige Entropiewerte[Bearbeiten]
Rechnen mit der Entropie[Bearbeiten]
Für chemische Berechnungen ist vor allem die molare Standard-Reaktionsentropie:
Diese ist bereits mit einem Δ als eine veränderbare Größe gekennzeichnet. Sie wird berechnet aus der Summe der Entropien der Produkte und der Summe der Entropien der Edukte. Findet eine Entropieänderung mit negativen Vorzeichen statt, so ist die Ordnung im System angestiegen (je weniger Makrozustände können eingenommen werden) und je höher ein positiver Wert für die Standard-Reaktionsentropie ist, um so größer ist die Zahl der möglichen Makrozustände und somit der möglichen Unordnung des Systems.
Für die Beobachtung, ob eine Reaktion unter bestimmten Dingen freiwillig abläuft, ist die Entropie ein wichtiger Wert. Mit ihr und der Standard-Reaktionsenthalpie kann nach der Gibbschen »freien Enthalpie« eine Aussage getroffen werden. Dabei gilt, eine Reaktion kann dann freiwillig ablaufen, wenn die Unordnung zunimmt, somit die Standard-Reaktionsentropie positiv ist. Jedoch kann man nicht von der Entropie alleine ausgehen, man benötigt immer die Standard-Reaktionsenthalpie, um eine Aussage zu treffen.
Die freie Enthalpie/ Gibbs'sche Enthalpie[Bearbeiten]
Die Zusammenführung von Enthalpie und Entropie, mit ihr lässt sich bestimmen, ob eine bestimmte chemische Reaktion bei einer bestimmten Temperatur spontan stattfinden kann oder nicht.
Berechnet wird die freie Enthalpie nach der sogenannten Gibbs-Helmholtz-Gleichung.
Diese wurde folgendermaßen definiert:
- : Enthalpie; : Temperatur in Kelvin; : Entropie
Molare Gibbsche Enthalpie:
Wie bei der Entropie und der Enthalpie kann auch für die Gibbsche Enthalpie kein absoluter Wert angegeben werden. Es ist lediglich möglich die Änderung zu betrachten, welche abhängig ist vom Anfangs- und vom Endzustand des Systems vor und nach der Reaktion. Der Reaktionsweg ist dabei nicht von Bedeutung. Für Systeme in denen keine Druckveränderung auftritt gilt also folgendes:
So viel zur Theorie und nun zur Überprüfung, ob eine chemische Reaktion freiwillig abläuft oder nicht. Dafür rechnen wir nun mit der molaren freien Reaktionsenthalpie der eigentlichen Gibbs-Helmholtz-Gleichung:
An dieser Formel ist ebenfalls zu erkennen, welcher Anteil der Enthalpie auf jeden Fall als Wärme abgegeben wird und für die chemische Reaktion nicht nutzbar ist. Dies ergibt sich aus:
Mit dem errechneten Wert der freien Enthalpie (ΔRG) lassen sich nun Aussagen über die Reaktionsrichtung geben:
- ΔRG < 0
- die Reaktion verläuft exergonisch, es wird Arbeit abgegeben
- die Reaktion verläuft freiwillig (für θ = 25°C bzw. θ = 20°C bei Zimmertemperatur)
- das Gleichgewicht liegt auf der Seite der Produkte (prozentual liegen nach der Reaktion mehr Produkte als Edukte vor)
- ΔRG > 0
- die Reaktion verläuft endergonischer, es muss Arbeit verrichtet werden, damit die Reaktion stattfindet
- die Reaktion verläuft nicht freiwillig bei der entsprechenden Temperatur
- das Gleichgewicht liegt auf der Seite der Edukte (prozentual liegen nach der Reaktion weniger Produkte als Edukte vor)
- ΔRG = 0
- es herrscht ein chemisches Gleichgewicht, somit findet keine Konzentrationsänderung der Edukte und Produkte statt
Säuren und Basen[Bearbeiten]
Historie[Bearbeiten]
Definitionen[Bearbeiten]
Definition nach Arrhenius (1884):
- Jede Verbindung, die in wässriger Lösung H+-Ionen bildet ist eine Säure, z. B.: HCl, HBr, HI, HF, H2SO4
- Jede Verbindung, die in wässriger Lösung OH--Ionen bildet ist eine Base, z. B.: NaOH, KOH, LiOH, Ba(OH)2
Definition nach Brönsted:
- Säuren sind Verbindungen die H+-Ionen abspalten können
- Basen sind Verbindungen die H+-Ionen aufnehmen können
Zu den Brönstedt-Säuren gehören nun auch die Säurereste, die noch ein H-Atom enthalten, z. B.: HPO42- (Hydrogenphosphat) und zu den Brönstedt-Basen gehören auch Verbindungen wie Ammoniak und Hydrazin.
Es bilden sich konjugierte Säure-Base-Paare.
Definition nach Lewis (1938):
- Säuren sind Verbindungen, die eine Lücke in ihrer äußeren Elektronenlücke aufweisen.
- Basen sind Verbindungen, die ein freies Elektronenpaar aufweisen
Ampholyte:
Ampholyte sind Substanzen, die sowohl als Säure, als auch als Base reagieren können, z. B.: Wasser (Als Säure gegenüber Ammoniak, als Base gegenüber Schwefelsäure). Es kommt hier auf den Reaktionspartner an.
Heute[Bearbeiten]
Nomenklatur der gängigen Säuren und ihrer Salze[Bearbeiten]
Nach Brönsted sind Säuren Protonendonatoren, sie sind also im Stande Protonen abzugeben. Basen hingegen gelten als Protonenakzeptoren, sie sind fähig Protonen aufzunehmen, zu akzeptieren.
Definitionen und Begriffserklärungen[Bearbeiten]
Protolysegleichungen[Bearbeiten]
pH und pOH[Bearbeiten]
Der pH-Wert (lateinisch für: pondus hydrogenii, also: „Gewicht des Wasserstoffs“) ist der negative dekadische Logarithmus der - rsp. -Ionenkonzentration:
Analog dazu ist der pOH-Wert der negative dekadische Logarithmus der -Ionenkonzentration:
Ein pH-Wert von 2 entspricht einer -Konzentration von 10−2 mol/l.
Säuren und Basen haben unterschiedliche Stärken, d. h., sie dissoziieren unterschiedlich ausgeprägt in Wasser. Kennt man die Stärke einer Säure (oder Base) und deren Konzentration, kann man daraus den pH-Wert berechnen.
pH- und pOH-Wert einer wässrigen Lösung ergeben addiert immer 14. Eine Säure erzeugt in Wasser einen pH-Wert von maximal 7, einen pOH-Wert von minimal 7. Bei der Base ist es umgekehrt.
Reines Wasser unterliegt der sogenannten Autoprotolyse:
![]()
Bei dieser Reaktion liegt das Gleichgewicht auf Seite des Ausgangsstoffs, also beim Wasser. Es entstehen jedoch etwa 10−7 mol/l H3O+-Ionen, welche den pH-Wert von 7 erzeugen. Dieser Wert ist übrigens temperaturabhängig und liegt nur um 25 °C bei 10−7 mol/l. 80 °C heißes Wasser hat z. B. eine pH-Wert von 6,3.
Säurekonstanten, pKw, pKs und pKb[Bearbeiten]
Der Säure-Basebegriff[Bearbeiten]
Arrhenius (1883)[Bearbeiten]
Svante Arrhenius definierte Säuren und Basen wiefolgt:
Eine Säure ist eine Substanz, welche in Wasser Ionen abspaltet!
Bsp.:
Eine Base ist eine Substanz, die in Wasser Ionen abspaltet!
Bsp.:.
Diese erste allgemeingültige Theorie über Säuren und Basen weist einen Fehler auf: Ammoniak kann laut dieser Theorie keine Base sein, da nicht zu dissoziieren kann. Außerdem beschränkt sie sich auf Wasser als Lösungsmittel.
Brønsted und Lowry (1923)[Bearbeiten]
Diese Definition ist eine Erweiterung des Säure-Basen-Begriffs. Nach Brønsted und Lowry gilt.
Eine Säure gibt ein -Ion an das Lösungsmittel ab, sie ist daher ein Protonendonator. Eine Base nimmt das Proton auf, sie ist daher ein Protonenakzeptor.
In wässriger Lösung entsteht durch die Autoprotolyse des Wassers das Oxoniumion .
Um diese Erkenntnisse auf andere Säuren anzuwenden, wird nun die Protolyse von Schwefelsäure in Wasser betrachtet:
Auch hier entsteht das Oxoniumion mit einem Restion, dem Hydrogensulfation, welches wiederum ein Wasserstoffatom besitzt. Da dieses Ion sich immer noch in einer wässrigen Lösung befindet, kann auch hier wiederum ein Proton abgegeben werden:
In wässriger Lösung entstehen Ionen.
Bei der Dissoziation einer Base entsteht ihre konjugierte Säure. ist die konjugierte Säure von .
Die Vorteile dieses Konzeptes sind, dass es auch auf andere Lösungsmittel als Wasser angewendet werden kann, und eine quantitative Bestimmung der Säure- oder Basestärke über die Konzentration der -Ionen möglich ist.
Ampholyte[Bearbeiten]
Wasser kann dabei sowohl als Brønsted-Säure, als auch als Brønsted-Base auftreten. Eine solche Substanz nennt man Ampholyt. Auch viele konjugierte Säuren oder Basen sind Ampholyte. Ob sie Protonen abgeben oder aufnehmen, kommt dann auf den Reaktionspartner an, so wird ein Hydrogenphosphat-Ion in Gegenwart eines Hydroxid-Ions ein Proton abgeben und zu einem Phosphat-Ion werden, in Gegenwart eines Hydronium-Ions ein Proton aufnehmen um zu einem Dihydrogenphosphat-Ion zu werden.
Lewis[Bearbeiten]
Nach ihm gilt:
Eine Säure ist eine elektrophile Substanz, die Elektronenpaare aufnimmt. Die Säure ist also ein Elektronenpaarakzeptor. Die Lewisbase ist der Elektronenpaardonator.
Lewissäuren und -basen spielen eine Rolle in der Komplexbildung, außerdem stellt sich durch dieses Konzept ein Zusammenhang zwischen Säure-Base-Reaktionen und Redoxreaktionen her. Eine weitere Verwendung haben Lewissäuren in der Organischen Chemie (Friedel-Kraft-Reaktionen).
Elektrochemie[Bearbeiten]
Daniell-Element[Bearbeiten]
Ein Daniel-Element ist eine elektrische Stromquelle, welche ihre elektrische Energie aus chemischer Energie gewinnt. Das Funktionsprinzip beruht darauf, dass verschiedene Metalle und Nichtmetalle eine unterschiedliche Fähigkeit besitzen, Elektronen abzugeben. Man nennt das Daniell-Element auch galvanische Zelle, galvanisches Element, Daniellsches Element oder auch galvanische Kette.
Aufbau und Funktionsweise eines Daniell-Elements[Bearbeiten]
Das Daniell-Element besteht aus zwei Halbzellen oder Halbkammern, die entweder durch eine poröse Membran namens Diaphragma oder durch eine Salzbrücke aus Kaliumchloridlösung, verbunden sind. Dadurch wird verhindert, dass sich die Lösungen vermischen. Dennoch ist ein Ladungsausgleich durch Ionenwanderung möglich und der Stromkreis geschlossen.

In der einen Kammer der galvanischen Zelle befindet sich zB. eine Zinkelektrode, die in eine Zinksulfatlösung (ZnSO4) eingetaucht ist und in der anderen Kammer befindet sich eine Kupferelektrode, die in einer Kupfersulfatlösung (CuSO4) getaucht ist. Die beiden Elektroden sind mit einem elektrischen Leiter (Kabel) außerhalb der Kammern verbunden. Jetzt fließt ein Strom über das Kabel von der Zink-Halbzelle auch Donatorhalbzelle (–) zur Kupferhalbzelle, auch Akzeptorhalbzelle (+) genannt. Der Grund dafür ist, dass die eingetauchte Zinkelektrode in der Zinksulfatlösung einige ihrer Zink-Ionen in Lösung gehen lässt. Das heißt, dass sich Zink-Ionen von der Elektrode ablösen und in die Lösung übergehen. Die Elektronen verbleiben dabei in der Elektrode. Wegen des Elektronenüberschusses ist diese nun negativ geladen.
Während dieses Vorganges werden gleich viele Kupfer-Ionen aus der Lösung an die Kupferelektrode abgeschieden und an der Elektrode abgelagert, da hier Elektronen in dieser Elektrode ankommen und damit diese Ionen anziehen. Elektronen werden, trivial ausgedrückt, in der Zink-Elektrode „erzeugt“ und in der Kupfer-Elektrode „verbraucht“. Somit ist die Ladung an der Kupferelektrode geringer, als an der anderen. Somit entsteht das Spannungspotential und schließlich ein Strom.
Durch den Ladungsunterschied bei diesem Vorgang zwischen positiv geladenen Zink-Ionen in der Lösung und der negativ aufgeladenen Zinkelektrode in der Zink-Halbzelle bildet sich eine Doppelschicht. Die negative Schicht wird gebildet durch die Elektronen in der Zinkeletrode. Die positive Schicht wird durch die hydratisierten Zink-Ionen gebildet, die sich durch die elektrostatischen Anziehungskräfte an der Elektrodenoberfläche abgesetzt haben.
In der Kupferhalbzelle erfolgt ein vergleichbarer Vorgang, wobei dort weniger Kupferatome in Lösung gehen und somit die Tendenz des Kupfers, Elektronen abzugeben und als Ion in Lösung zu gehen, geringer als bei Zink ist und durch den Stromfluss sogar umgekehrt gezwungen ist zu reagieren, wie oben beschrieben. Dadurch ist auch anders erklärt, dass die negative Ladung an der Kupferelektrode wesentlich geringer als bei der Zinkelektrode. Insgesamt gesehen kann man auch sagen, dass die Zinkelektrode durch die Abgabe von Elektronen oxidiert und die Kupferelektrode durch die Aufnahme von Elektronen reduziert. Dies sind die Erklärungen und Kenntnisse der Redoxreaktion. Im Ursprung kann man davon ausgehen, dass eigentlich jedes Metall nach Oxidation strebt, also Elektronen abgeben will, sobald es in einer galvanischen Halbzelle getaucht wird, nur das die Stärke nach Reduktion, wie schon erwähnt, unterschiedlich stark ist. Nur dadurch, dass die zwei Metalle zusammengeschaltet werden und dadurch beide Metalle miteinander kämpfen, welches nun Elektronen abgibt (eins kann ja hier nur), hängt also nur an der Stärke ab. Welches stärker ist, gibt also letztendlich die Elektronen ab und das andere ist somit gezwungen, die Elektronen aufzunehmen. Davon hängt dann auch die Richtung des Stromflusses, sowohl welche Elektrode oxidiert bzw. reduziert und wo dadurch letztendlich der Minus- bzw. Pluspol liegt.
Eine Liste von Metallen, geordnet nach ihrer Reduktionsfähigkeit unter Standardbedingungen ist die Elektrochemische Spannungsreihe. Sie kann zur Berechnung von beliebigen elektrochemischen Zellen herangezogen werden.
Anorganische Stoffchemie[Bearbeiten]
Elemente der 7. Hauptgruppe - Die Halogene[Bearbeiten]
Fluor[Bearbeiten]
Elementares Fluor ist ein stechendes gelbliches giftiges Gas. Es hat die höchste Elektronegativität (4,0) und ist daher das stärkste Oxidationsmittel.
In freier Natur kommt Fluor daher nur in Salzen vor, den Fluoriden. Aus diesen muss es durch Elektrolyse dargestellt werden. Das Gas wird anschließend in Gasflaschen aufbewahrt und überwiegend zur Fluorierung von Kohlenwasserstoffen verwendet.
Chlor[Bearbeiten]
Brom[Bearbeiten]
Iod[Bearbeiten]
Astat[Bearbeiten]
Verbindungen der Halogene[Bearbeiten]
Halogenwasserstoffsäuren[Bearbeiten]
Halogenwasserstoffsäuren sind die wässrigen Lösungen von Halogenwasserstoffen und haben die allgemeine Formel , wobei das X für ein beliebiges Halogen steht. Die Säurestärke sowie die Reduktionskraft steigt im PSE von oben nach unten.
| Formel | Name | Salz | Name der Salze |
|---|---|---|---|
| Fluorwasserstoffsäure | Fluoride | ||
| Chlorwasserstoffsäure | Chloride | ||
| Bromwasserstoffsäure | Bromide | ||
| Iodwasserstoffsäure | Iodide |
Darstellung der Chlorwasserstoffsäure[Bearbeiten]
Im Labor aus Kochsalz und Schwefelsäure
| + | + |
In der Industrie bei der Verbrennung von Chlorknallgas
| + |
Halogensauerstoffsäuren[Bearbeiten]
Halogensauerstoffsäuren haben die Allgemeine Formel . kann Werte von 1-4 annehmen, das steht für ein Halogen. Halogensauerstoffsäuren mit n = 4 sind starke Säuren, die mit n = 3 mittelstarke Säuren. Alle übrigen sind schwach.
Fluorsauerstoffsäure[Bearbeiten]
Die Fluorsauerstoffsäure hat die Formel . Fluor ist das einzige Halogen, welches nur eine Sauerstoffsäure bildet. Sie ist auch noch thermisch instabil, d.h. sie zersetzt sich in der Hitze in Sauerstoff und Flußsäure.
Chlorsauerstoffsäuren[Bearbeiten]
| Summenformel | Name | Salz | Name der Salze | Oxidationsstufe des Chlors |
|---|---|---|---|---|
| Hypochlorige Säure | Hypochlorite | +I | ||
| Chlorige Säure | Chlorite | +III | ||
| Chlorsäure | Chlorate | +V | ||
| Perchlorsäure | Perchlorate | +VII |
Bromsauerstoffsäuren[Bearbeiten]
Brom bildet analoge Säuren wie Chlor. Von diesen Bromsauerstoffsäuren ist nur die Bromsäure auf Dauer stabil und mittelstark. Die anderen sind schwache Säuren und disproportionieren leicht.
Iodsauerstoffsäuren[Bearbeiten]
Hier gilt entsprechendes wie bei Brom und Chlor.
Anhang[Bearbeiten]
SI und SI zugelassene Einheiten[Bearbeiten]
Die Grundgrößen und ihre Einheiten[Bearbeiten]
| Symbol | Einheit | Einheitensymbol | |
|---|---|---|---|
| Länge | Meter | m | |
| Masse | Kilogramm | kg | |
| Zeit | Sekunde | s | |
| Stromstärke | Ampere | A | |
| Thermodynamische Temperatur | Kelvin | K | |
| Stoffmenge | Mol | mol | |
| Lichtstärke | Candela | cd |
Präfixe für dezimale Produkte[Bearbeiten]
Autoren[Bearbeiten]
Text[Bearbeiten]
 Benutzer:Robert
Benutzer:Robert Benutzer:EndoTherm
Benutzer:EndoTherm Benutzer:Thiesi
Benutzer:Thiesi Benutzer:Kai Gärtner
Benutzer:Kai Gärtner Benutzer:Matthias M.
Benutzer:Matthias M. Benutzer:Mirabellensaft
Benutzer:Mirabellensaft Benutzer:Makee
Benutzer:Makee Benutzer:Volker7
Benutzer:Volker7
Bilder[Bearbeiten]
- vers. Kugel-Stab-Modelle - PD -
 User:Benjah-bmm27
User:Benjah-bmm27 - Bild:Atom.png - GNU FDL -
 User:Jeanot
User:Jeanot - Bild:Fe,26.jpg - GNU FDL -
 User:Paginazero
User:Paginazero - Bild:Gallium1 640x480.jpg - GNU FDL - en:User:foobar
- Bild:Sulfur.jpg - PD - en:User:Deglr6328
- Bild:NaCl polyhedra.png - PD - Benutzer:Solid State
- Bild:H Cl.PNG - GNU FDL - Philipp P. Schneider
- Bild:SaltInWaterSolutionLiquid.jpg - GNU FDL or CC-BY-SA 2.5 -
 User:Chris 73
User:Chris 73 - Bild:Kaliumperma.jpg - GNU FDL -
 FischX
FischX - Bild:HexacyanidoferratIII.svg - PD -
 Ilgom
Ilgom
Lizenzbestimmungen[Bearbeiten]
Version 1.2, November 2002
Copyright (C) 2000,2001,2002 Free Software Foundation, Inc.
51 Franklin St, Fifth Floor, Boston, MA 02110-1301 USA
Everyone is permitted to copy and distribute verbatim copies
of this license document, but changing it is not allowed.
0. PREAMBLE
The purpose of this License is to make a manual, textbook, or other functional and useful document "free" in the sense of freedom: to assure everyone the effective freedom to copy and redistribute it, with or without modifying it, either commercially or noncommercially. Secondarily, this License preserves for the author and publisher a way to get credit for their work, while not being considered responsible for modifications made by others.
This License is a kind of "copyleft", which means that derivative works of the document must themselves be free in the same sense. It complements the GNU General Public License, which is a copyleft license designed for free software.
We have designed this License in order to use it for manuals for free software, because free software needs free documentation: a free program should come with manuals providing the same freedoms that the software does. But this License is not limited to software manuals; it can be used for any textual work, regardless of subject matter or whether it is published as a printed book. We recommend this License principally for works whose purpose is instruction or reference.
1. APPLICABILITY AND DEFINITIONS
This License applies to any manual or other work, in any medium, that contains a notice placed by the copyright holder saying it can be distributed under the terms of this License. Such a notice grants a world-wide, royalty-free license, unlimited in duration, to use that work under the conditions stated herein. The "Document", below, refers to any such manual or work. Any member of the public is a licensee, and is addressed as "you". You accept the license if you copy, modify or distribute the work in a way requiring permission under copyright law.
A "Modified Version" of the Document means any work containing the Document or a portion of it, either copied verbatim, or with modifications and/or translated into another language.
A "Secondary Section" is a named appendix or a front-matter section of the Document that deals exclusively with the relationship of the publishers or authors of the Document to the Document's overall subject (or to related matters) and contains nothing that could fall directly within that overall subject. (Thus, if the Document is in part a textbook of mathematics, a Secondary Section may not explain any mathematics.) The relationship could be a matter of historical connection with the subject or with related matters, or of legal, commercial, philosophical, ethical or political position regarding them.
The "Invariant Sections" are certain Secondary Sections whose titles are designated, as being those of Invariant Sections, in the notice that says that the Document is released under this License. If a section does not fit the above definition of Secondary then it is not allowed to be designated as Invariant. The Document may contain zero Invariant Sections. If the Document does not identify any Invariant Sections then there are none.
The "Cover Texts" are certain short passages of text that are listed, as Front-Cover Texts or Back-Cover Texts, in the notice that says that the Document is released under this License. A Front-Cover Text may be at most 5 words, and a Back-Cover Text may be at most 25 words.
A "Transparent" copy of the Document means a machine-readable copy, represented in a format whose specification is available to the general public, that is suitable for revising the document straightforwardly with generic text editors or (for images composed of pixels) generic paint programs or (for drawings) some widely available drawing editor, and that is suitable for input to text formatters or for automatic translation to a variety of formats suitable for input to text formatters. A copy made in an otherwise Transparent file format whose markup, or absence of markup, has been arranged to thwart or discourage subsequent modification by readers is not Transparent. An image format is not Transparent if used for any substantial amount of text. A copy that is not "Transparent" is called "Opaque".
Examples of suitable formats for Transparent copies include plain ASCII without markup, Texinfo input format, LaTeX input format, SGML or XML using a publicly available DTD, and standard-conforming simple HTML, PostScript or PDF designed for human modification. Examples of transparent image formats include PNG, XCF and JPG. Opaque formats include proprietary formats that can be read and edited only by proprietary word processors, SGML or XML for which the DTD and/or processing tools are not generally available, and the machine-generated HTML, PostScript or PDF produced by some word processors for output purposes only.
The "Title Page" means, for a printed book, the title page itself, plus such following pages as are needed to hold, legibly, the material this License requires to appear in the title page. For works in formats which do not have any title page as such, "Title Page" means the text near the most prominent appearance of the work's title, preceding the beginning of the body of the text.
A section "Entitled XYZ" means a named subunit of the Document whose title either is precisely XYZ or contains XYZ in parentheses following text that translates XYZ in another language. (Here XYZ stands for a specific section name mentioned below, such as "Acknowledgements", "Dedications", "Endorsements", or "History".) To "Preserve the Title" of such a section when you modify the Document means that it remains a section "Entitled XYZ" according to this definition.
The Document may include Warranty Disclaimers next to the notice which states that this License applies to the Document. These Warranty Disclaimers are considered to be included by reference in this License, but only as regards disclaiming warranties: any other implication that these Warranty Disclaimers may have is void and has no effect on the meaning of this License.
2. VERBATIM COPYING
You may copy and distribute the Document in any medium, either commercially or noncommercially, provided that this License, the copyright notices, and the license notice saying this License applies to the Document are reproduced in all copies, and that you add no other conditions whatsoever to those of this License. You may not use technical measures to obstruct or control the reading or further copying of the copies you make or distribute. However, you may accept compensation in exchange for copies. If you distribute a large enough number of copies you must also follow the conditions in section 3.
You may also lend copies, under the same conditions stated above, and you may publicly display copies.
3. COPYING IN QUANTITY
If you publish printed copies (or copies in media that commonly have printed covers) of the Document, numbering more than 100, and the Document's license notice requires Cover Texts, you must enclose the copies in covers that carry, clearly and legibly, all these Cover Texts: Front-Cover Texts on the front cover, and Back-Cover Texts on the back cover. Both covers must also clearly and legibly identify you as the publisher of these copies. The front cover must present the full title with all words of the title equally prominent and visible. You may add other material on the covers in addition. Copying with changes limited to the covers, as long as they preserve the title of the Document and satisfy these conditions, can be treated as verbatim copying in other respects.
If the required texts for either cover are too voluminous to fit legibly, you should put the first ones listed (as many as fit reasonably) on the actual cover, and continue the rest onto adjacent pages.
If you publish or distribute Opaque copies of the Document numbering more than 100, you must either include a machine-readable Transparent copy along with each Opaque copy, or state in or with each Opaque copy a computer-network location from which the general network-using public has access to download using public-standard network protocols a complete Transparent copy of the Document, free of added material. If you use the latter option, you must take reasonably prudent steps, when you begin distribution of Opaque copies in quantity, to ensure that this Transparent copy will remain thus accessible at the stated location until at least one year after the last time you distribute an Opaque copy (directly or through your agents or retailers) of that edition to the public.
It is requested, but not required, that you contact the authors of the Document well before redistributing any large number of copies, to give them a chance to provide you with an updated version of the Document.
4. MODIFICATIONS
You may copy and distribute a Modified Version of the Document under the conditions of sections 2 and 3 above, provided that you release the Modified Version under precisely this License, with the Modified Version filling the role of the Document, thus licensing distribution and modification of the Modified Version to whoever possesses a copy of it. In addition, you must do these things in the Modified Version:
- A. Use in the Title Page (and on the covers, if any) a title distinct from that of the Document, and from those of previous versions (which should, if there were any, be listed in the History section of the Document). You may use the same title as a previous version if the original publisher of that version gives permission.
- B. List on the Title Page, as authors, one or more persons or entities responsible for authorship of the modifications in the Modified Version, together with at least five of the principal authors of the Document (all of its principal authors, if it has fewer than five), unless they release you from this requirement.
- C. State on the Title page the name of the publisher of the Modified Version, as the publisher.
- D. Preserve all the copyright notices of the Document.
- E. Add an appropriate copyright notice for your modifications adjacent to the other copyright notices.
- F. Include, immediately after the copyright notices, a license notice giving the public permission to use the Modified Version under the terms of this License, in the form shown in the Addendum below.
- G. Preserve in that license notice the full lists of Invariant Sections and required Cover Texts given in the Document's license notice.
- H. Include an unaltered copy of this License.
- I. Preserve the section Entitled "History", Preserve its Title, and add to it an item stating at least the title, year, new authors, and publisher of the Modified Version as given on the Title Page. If there is no section Entitled "History" in the Document, create one stating the title, year, authors, and publisher of the Document as given on its Title Page, then add an item describing the Modified Version as stated in the previous sentence.
- J. Preserve the network location, if any, given in the Document for public access to a Transparent copy of the Document, and likewise the network locations given in the Document for previous versions it was based on. These may be placed in the "History" section. You may omit a network location for a work that was published at least four years before the Document itself, or if the original publisher of the version it refers to gives permission.
- K. For any section Entitled "Acknowledgements" or "Dedications", Preserve the Title of the section, and preserve in the section all the substance and tone of each of the contributor acknowledgements and/or dedications given therein.
- L. Preserve all the Invariant Sections of the Document, unaltered in their text and in their titles. Section numbers or the equivalent are not considered part of the section titles.
- M. Delete any section Entitled "Endorsements". Such a section may not be included in the Modified Version.
- N. Do not retitle any existing section to be Entitled "Endorsements" or to conflict in title with any Invariant Section.
- O. Preserve any Warranty Disclaimers.
If the Modified Version includes new front-matter sections or appendices that qualify as Secondary Sections and contain no material copied from the Document, you may at your option designate some or all of these sections as invariant. To do this, add their titles to the list of Invariant Sections in the Modified Version's license notice. These titles must be distinct from any other section titles.
You may add a section Entitled "Endorsements", provided it contains nothing but endorsements of your Modified Version by various parties--for example, statements of peer review or that the text has been approved by an organization as the authoritative definition of a standard.
You may add a passage of up to five words as a Front-Cover Text, and a passage of up to 25 words as a Back-Cover Text, to the end of the list of Cover Texts in the Modified Version. Only one passage of Front-Cover Text and one of Back-Cover Text may be added by (or through arrangements made by) any one entity. If the Document already includes a cover text for the same cover, previously added by you or by arrangement made by the same entity you are acting on behalf of, you may not add another; but you may replace the old one, on explicit permission from the previous publisher that added the old one.
The author(s) and publisher(s) of the Document do not by this License give permission to use their names for publicity for or to assert or imply endorsement of any Modified Version.
5. COMBINING DOCUMENTS
You may combine the Document with other documents released under this License, under the terms defined in section 4 above for modified versions, provided that you include in the combination all of the Invariant Sections of all of the original documents, unmodified, and list them all as Invariant Sections of your combined work in its license notice, and that you preserve all their Warranty Disclaimers.
The combined work need only contain one copy of this License, and multiple identical Invariant Sections may be replaced with a single copy. If there are multiple Invariant Sections with the same name but different contents, make the title of each such section unique by adding at the end of it, in parentheses, the name of the original author or publisher of that section if known, or else a unique number. Make the same adjustment to the section titles in the list of Invariant Sections in the license notice of the combined work.
In the combination, you must combine any sections Entitled "History" in the various original documents, forming one section Entitled "History"; likewise combine any sections Entitled "Acknowledgements", and any sections Entitled "Dedications". You must delete all sections Entitled "Endorsements."
6. COLLECTIONS OF DOCUMENTS
You may make a collection consisting of the Document and other documents released under this License, and replace the individual copies of this License in the various documents with a single copy that is included in the collection, provided that you follow the rules of this License for verbatim copying of each of the documents in all other respects.
You may extract a single document from such a collection, and distribute it individually under this License, provided you insert a copy of this License into the extracted document, and follow this License in all other respects regarding verbatim copying of that document.
7. AGGREGATION WITH INDEPENDENT WORKS
A compilation of the Document or its derivatives with other separate and independent documents or works, in or on a volume of a storage or distribution medium, is called an "aggregate" if the copyright resulting from the compilation is not used to limit the legal rights of the compilation's users beyond what the individual works permit. When the Document is included in an aggregate, this License does not apply to the other works in the aggregate which are not themselves derivative works of the Document.
If the Cover Text requirement of section 3 is applicable to these copies of the Document, then if the Document is less than one half of the entire aggregate, the Document's Cover Texts may be placed on covers that bracket the Document within the aggregate, or the electronic equivalent of covers if the Document is in electronic form. Otherwise they must appear on printed covers that bracket the whole aggregate.
8. TRANSLATION
Translation is considered a kind of modification, so you may distribute translations of the Document under the terms of section 4. Replacing Invariant Sections with translations requires special permission from their copyright holders, but you may include translations of some or all Invariant Sections in addition to the original versions of these Invariant Sections. You may include a translation of this License, and all the license notices in the Document, and any Warranty Disclaimers, provided that you also include the original English version of this License and the original versions of those notices and disclaimers. In case of a disagreement between the translation and the original version of this License or a notice or disclaimer, the original version will prevail.
If a section in the Document is Entitled "Acknowledgements", "Dedications", or "History", the requirement (section 4) to Preserve its Title (section 1) will typically require changing the actual title.
9. TERMINATION
You may not copy, modify, sublicense, or distribute the Document except as expressly provided for under this License. Any other attempt to copy, modify, sublicense or distribute the Document is void, and will automatically terminate your rights under this License. However, parties who have received copies, or rights, from you under this License will not have their licenses terminated so long as such parties remain in full compliance.
10. FUTURE REVISIONS OF THIS LICENSE
The Free Software Foundation may publish new, revised versions of the GNU Free Documentation License from time to time. Such new versions will be similar in spirit to the present version, but may differ in detail to address new problems or concerns. See http://www.gnu.org/copyleft/.
Each version of the License is given a distinguishing version number. If the Document specifies that a particular numbered version of this License "or any later version" applies to it, you have the option of following the terms and conditions either of that specified version or of any later version that has been published (not as a draft) by the Free Software Foundation. If the Document does not specify a version number of this License, you may choose any version ever published (not as a draft) by the Free Software Foundation.
| Präfix | Kurzzeichen | Faktor |
|---|---|---|
| Exa- | E | |
| Peta- | P | |
| Tera- | T | |
| Giga- | G | |
| Mega- | M | |
| Kilo- | k | |
| Hekto- | h | |
| Deka- | da | |
| Dezi- | d | |
| Zenti- | c | |
| Milli- | m | |
| Mikro- | μ | |
| Nano- | n | |
| Piko- | p | |
| Femto- | f | |
| Atto- | a |




















































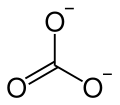




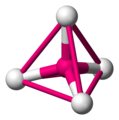


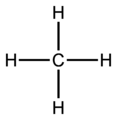




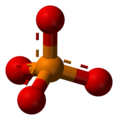



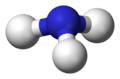
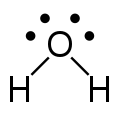











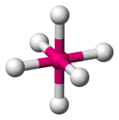






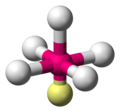
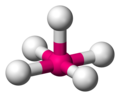

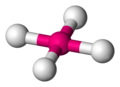





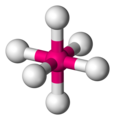












![[Fe(CN)6] Valenzstrichformel](http://upload.wikimedia.org/wikipedia/commons/thumb/6/68/HexacyanidoferratIII.svg/120px-HexacyanidoferratIII.svg.png)
![[Fe(CN)6] 3D-Modell](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1a/Ferricyanide-3D-balls.png/103px-Ferricyanide-3D-balls.png)
![K3[Fe(CN)6], rotes Blutlaugensalz](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3e/Potassium-ferricyanide-sample.jpg/120px-Potassium-ferricyanide-sample.jpg)
![linear: Diamminsilber(I), [Ag(NH3)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a6/Diamminesilver%28I%29-3D-balls.png/120px-Diamminesilver%28I%29-3D-balls.png)
![tetraedisch: Tetrachloridoniccolat(II), [NiCl4]2−](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2c/Tetrachloronickelate%28II%29-3D-balls.png/120px-Tetrachloronickelate%28II%29-3D-balls.png)

![tetraedisch: Tetrahydridoborat(III)]], [BH4]−](http://upload.wikimedia.org/wikipedia/commons/thumb/4/46/Borohydride-3D-balls.png/118px-Borohydride-3D-balls.png)
![tetraedisch: Tetrahydroxidozinkat(II), [Zn(OH)4]2−](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c5/Tetrahydroxozincate%28II%29-3D-balls.png/120px-Tetrahydroxozincate%28II%29-3D-balls.png)
![oktaedrisch: Hexaaquakupfer(II), [Cu(H2O)6]2+](http://upload.wikimedia.org/wikipedia/commons/thumb/0/09/Hexaaquacopper%28II%29-3D-balls.png/102px-Hexaaquacopper%28II%29-3D-balls.png)
![quadratisch planar: Tetraamminkupfer(II), [Cu(NH3)4]2+](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0d/Tetraamminecopper%28II%29-3D-balls.png/120px-Tetraamminecopper%28II%29-3D-balls.png)
![quadratisch planar: Tetracyanidoniccolat(II), [Ni(CN)4]2−](http://upload.wikimedia.org/wikipedia/commons/thumb/f/ff/Tetracyanonickelate%28II%29-3D-balls.png/120px-Tetracyanonickelate%28II%29-3D-balls.png)

![cis-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/120px-Cis-dichlorotetraamminecobalt%28III%29.png)
![trans-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/120px-Trans-dichlorotetraamminecobalt%28III%29.png)
![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)
![Λ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Δ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Λ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![Δ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
















































![{\displaystyle \mathrm {1\,C_{2}H_{6}(g)+3,5\,O_{2}\longrightarrow 2\,CO_{2}(g)+3\,H_{2}O(g)} ;\quad \Delta _{c}H^{\circ }[\mathrm {C_{2}H_{6}} ]=-1429\;\mathrm {kJ/mol} .}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f3ab1403037c0f7da947187029a028d3775bb85)













![{\displaystyle -\Delta _{f}H^{\circ }[\mathrm {CH_{4}} ]=\Delta _{R}H^{\circ }[\mathrm {CH_{4}} ]-\sum _{\mathrm {X} \in \mathrm {Produkte} }\nu [\mathrm {X} ]\cdot \Delta _{f}H^{\circ }[\mathrm {X} ],}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0d4663bb6dbd4c7d0c70a94981f763936d5a333)
![{\displaystyle \nu [\mathrm {X} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d3368f89480535c53088539c8c5560f1b8cff152)














































































