Praktikum Organische Chemie/ Druckversion
Dieser Text ist sowohl unter der „Creative Commons Attribution/Share-Alike“-Lizenz 3.0 als auch GFDL lizenziert.
Eine deutschsprachige Beschreibung für Autoren und Weiternutzer findet man in den Nutzungsbedingungen der Wikimedia Foundation.
Trennung und Isolierung niedermolekularer organischer Verbindungen
[Bearbeiten]Der Kurs "Trennung und Isolierung niedermolekularer organischer Verbindungen" wurde 1975 konzipiert, um angehende Studierende der Chemie mit den einfachsten Arbeitsmethoden der organischen Chemie vertraut zu machen. In früheren Jahren sollten diese Kenntnisse im Laufe der Herstellung organischer Präparate erworben werden, welche in Deutschland traditionell im Vordergrund stand.
Später stellte sich die Aufgabe, für Studierende der Biowissenschaften zu diesem Thema ein kurzes Praktikum zu organisieren. Während Chemiestudenten aber die Grundvorlesung(en) in Physikalischer Chemie besuchten, war dies bei Biologen selten der Fall. Um das Praktikum nicht zu bloßen "Kochstunden" werden zu lassen, wurde deshalb versucht, dabei elementare Kenntnisse der physikalisch-chemische Grundlagen zu vermitteln. Sie sind in das Skript zum Praktikum integriert, welches auch danach gegliedert ist.
Um die Kosten für Materialien und Entsorgung niedrig zu halten, wurde mit relativ kleinen Mengen experimentiert. Dies spart auch Zeit ein, die im Anfängerpraktikum knapp bemessen ist.
Der Autor beabsichtigte ursprünglich, sein Skript zu einem Buch, d.h. Printmedium, auszuarbeiten. Da aber schon verschiedene Praktikumsbücher erschienen sind, allerdings meistens mit präparativer Zielsetzung, zieht es der Autor vor, seinen Text als Wikibook mit freiem Inhalt Studierenden zur Verfügung zu stellen. Er hofft, dass andere an der Chemie Interessierte dieses Wikibook erweitern und optimieren werden.
Der Autor wünscht viel Freude und Befriedigung bei dieser Arbeit! Die Chemie ist keine Buchwissenschaft. Ihre Ursprünge liegen im Handwerklichen, dem Experiment. Dies zeigt sich in den Lebensläufen vieler bedeutender Chemiker und Naturforscher. Um Beobachtungen in Experimenten zu erklären, wurden Hypothesen und Theorien entwickelt, die oft im Laufe der Zeit verändert werden mussten.
Wer sich im Studium ernsthaft mit dieser Wissenschaft auseinandersetzen will, sollte daher solide handwerkliche Fähigkeiten erwerben. Fach- und Hochschulen bieten dazu Praktika an, bei denen die Studierenden in Gruppen Versuche machen. Einzelunterricht ist selten geworden. In den Praktika werden die Studierenden von Betreuern/Betreuerinnen (’Assistenten, Assistentinnen‚‘) angeleitet, Diese erklären die verwendeten Laborgeräte und deren Handhabung. In der Regel erhalten die Studierenden auch Skripte, in welchen die Versuche beschrieben werden.
Praktika der organischen Chemie setzen meistens voraus, dass grundlegende Arbeitstechniken in den Praktika ’Anorganische Chemie‘ vermittelt worden sind. Seit der Etablierung des Faches ’Allgemeine Chemie‘ in Deutschland (hervorgegangen aus ’General Chemistry‘ in USA), wird dabei auch in die Laborpraxis eingeführt. Wer Versuche zur organischen Chemie zu machen hat, benötigt weitere Techniken; schließlich sollen diese zu einer experimentell einwandfreien Forschungsarbeit (Bachelor-, Diplom-, Master-Arbeit) führen.
Für Praktika der Organischen Chemie sind zahlreiche Lehrbücher verfasst worden. In Deutschland wurden Standards gesetzt mit dem ’Gattermann-Wieland‘[1], dem ’Organikum‘[2] und dem ’Hünig-Märkl-Sauer‘[3]. Nicht unterschlagen werden sollen jedoch zahlreiche englisch-sprachige Praktikumsbücher, die zum Teil neue didaktische Konzepte bieten.
Viele Hochschullehrer mussten jedoch die Erfahrung machen, dass Studierende die Kosten für den Erwerb solcher Bücher scheuen, oder sich unter Zeitdruck fühlen, und daher auf eine gründliche Lektüre verzichten.
Obwohl über Techniken und Praxis in organisch-chemischen Laboratorien irgendwo schon alles geschrieben worden ist, soll mit diesem Wikibuch der Versuch gemacht werden, wenigstens einen Teil davon als Wikimedia-Projekt interessierten Studierenden zur Verfügung zu stellen. Das Wikibuch soll aber kein Ersatz für das Studium der klassischen Bücher (Print-Medien) sein. Daher wird in den einzelnen Kapiteln eine Auswahl entsprechender Literatur angegeben.
Wenn oben das Verhältnis von Handwerk und Theorie angesprochen wurde, soll jedoch keineswegs der Eindruck erweckt werden, dass im Praktikum Organische Chemie nur das Handwerk (’Kochen‘) zählt. Erfolgreich eingesetztes Handwerk setzt voraus, dass ausreichende theoretische Kenntnisse vorhanden sind. Daher wurde im Wikibuch versucht, die Theorie (in möglichst einfacher Form) mit den praktischen Aspekten zu verbinden. Dies vor allem für Studierende, die nicht Chemiker werden wollen, sondern mehr an ’Lebenswissenschaften‘ (Life sciences) interessiert sind. Für diese ist die organische Chemie eine Schlüsselwissenschaft.
Fußnoten
[Bearbeiten]- ↑ Ludwig Gattermann, Die Praxis des Organischen Chemikers., Verlag von Veit & Comp. 1. Aufl. Leipzig, 1894. 15. Aufl.: De Gruyter, Berlin, 1920. Fortgeführt von Heinrich Wieland und Theodor Wieland bis zur 43. Aufl. 1982; ISBN 3-11-006654-8.
- ↑ Organikum: organisch-chemisches Grundpraktikum / von einem Autorenkollektiv der Technischen Universität Dresden [Heinz Becker et al.], Deutscher Verlag der Wissenschaften, Berlin, 1962.
- ↑ Hünig-Märkl-Sauer, Integriertes Organisches Praktikum, Verlag Chemie, Weinheim, 1979.
Literatur
[Bearbeiten]- Ludwig Gattermann, Die Praxis des Organischen Chemikers., Verlag von Veit & Comp. 1. Aufl. Leipzig, 1894. 15. Aufl.: De Gruyter, Berlin, 1920. Fortgeführt von Heinrich Wieland und Theodor Wieland bis zur 43. Aufl. 1982.
- Organikum: organisch-chemisches Grundpraktikum / von einem Autorenkollektiv der Technischen Universität Dresden [Heinz Becker et al.], Deutscher Verlag der Wissenschaften, Berlin, 1962. Siehe auch den Artikel in Wikipedia: Organikum.
- Hünig-Märkl-Sauer, Integriertes Organisches Praktikum, Verlag Chemie, Weinheim, 1979.
- Tietze-Eicher, Reaktionen und Synthesen im organisch-chemischen Grundpraktikum, Thieme, Stuttgart, 1981.
- Laborpraxis, Band 1 – 4, insbesondere Band 3: Trennungsmethoden, Birkhäuser, Basel, 1987
- K. E. Geckeler, H. Eckstein, Analytische und präparative Labormethoden, Vieweg, Göttingen, 1987.
- H. Fischer, Hrsg., Praktikum in allgemeiner Chemie: ein umweltschonendes Programm für Studienanfänger mit Versuchen zur Chemikalien-Rückgewinnung, VHCA, Basel; VCH, Weinheim u.a.O., 1992-1994.
- J. Leonard, B. Lygo, G. Procter, Praxis der Organischen Chemie. Ein Handbuch, Übersetzt von S. Gräf, Herausgeber G. Dyker, VCH, Weinheim, 1996.
- H. D. Durst, G. W. Gokel, Experimental Organic Chemistry, McGraw-Hill, New York u. a. O., 1980.
- J. A. Miller, E. F. Neuzil, Modern Experimental Organic Chemistry, D. C. Heath and Co., Lexington, Toronto, 1982.
- A. Ault, Techniques and Experiments for Organic Chemistry, 5th Edit., Allyn & Bacon, Boston u. a. O., 1987.
- D. L. Pavia, G. M. Lampman, G. S. Kriz, Introduction to Organic Laboratory Techniques, 3rd Edit., Saunders College Publishing, Philadelphia u. a. O., 1988.
- J. W. Lehman, Operational Organic Chemistry: A Laboratory Course, 2nd Edit,.Allyn & Bacon, Boston u. a. O., 1988.
Trennung durch Ausnutzung unterschiedlicher Löslichkeit
[Bearbeiten]Extraktion von Feststoffen
[Bearbeiten]Die Löslichkeit von chemischen Verbindungen ist sehr verschieden. Sie hängt ab von der Natur des zu lösenden Stoffes und dem Lösungsmittel. Zeigen Substanzen in einem Gemisch unterschiedliche Löslichkeit, so können sie häufig mit einem geeigneten Lösungsmittel selektiv herausgelöst werden. Trotzdem ist es meistens nicht so, dass eine Verbindung aus einem Gemisch allein herausgelöst wird, sondern die gewünschte Verbindung ist meistens von anderen Verbindungen begleitet. Daher müssen in der Regel weitere Trennoperationen angeschlossen werden, z. B. die Kristallisation oder die Chromatographie. Das Herauslösen von Komponenten aus einem Gemisch fester Stoffe, die sog. Fest-Flüssig-Extraktion, braucht keinen hohen Aufwand. Im einfachsten Fall wird die Substanz in der Kälte mit Lösungsmittel verrieben (digeriert). Behandelt man Pflanzenmaterial (z.B. pflanzliche Drogen) mit kaltem Wasser oder organischem Lösungsmittel, so spricht man von Mazerieren. Häufig erhitzt man jedoch mit Lösungsmittel bei aufgesetztem Rückflusskühler zum Sieden (Auskochen). Dazu benötigt man folgende Glasgeräte:


Abb. 1-1. Glasgeräte zum Kochen unter Rückfluss: Rundkolben, Rückflusskühler (Kugelkühler und Schlangenkühler). Rundkolben, im allgemeinen mit Normschliff NS 29, Rückflusskühler, im allgemeinen mit Normschliff NS 29,
Das Erhitzen des Kolbens mit dem Lösungsmittel erfolgt meistens nicht direkt, sondern durch ein Heizbad, je nach dem Siedepunkt des Lösungsmittels ein Wasserbad oder Ölbad. Für Extraktionen mit nichtbrennbaren, tiefsiedenden Lösungsmitteln (z.B. Dichlormethan) kann ein mit einem Bunsenbrenner beheiztes Wasserbad verwendet werden:

Abb. 1-2. Auskochen mit Dichlormethan im Wasserbad.
Im Forschungslabor verwendet man oft Heizhauben, doch muss dabei beachtet werden, dass sich empfindliche Substanzen durch Überhitzung zersetzen können. Heizbäder sind schonender. Abbildung 1-2 zeigt den schematischen Aufbau einer Standard-Apparatur. Hier wird ein Magnetrührer mit aufgesetztem Heizbad verwendet. Durch das magnetische Rühren sollen "Siedeverzüge" verhindert werden.

Abbildung 1-3. Apparatur zum Auskochen eines Feststoffes mit Lösungsmitteln (Aufbauschema).
Um die zu extrahierenden Stoffe in möglichst guter Ausbeute zu gewinnen, werden Extraktionen meistens mehrfach wiederholt. Kontinuierliche Fest-Flüssig-Extraktionen werden in dem sog. Soxhlet-Extraktor durchgeführt (Abb. 1-4).

Abb. 1-4: Apparatur zur Fest-flüssig-Extraktion (Soxhlet).
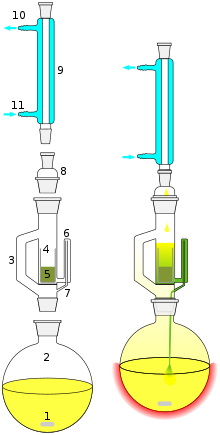

Abb. 1-5 Funktion von Soxhlet-Extraktoren.
Soxhlet-Extraktoren besitzen einen Heber, der in Intervallen die eben gefüllte Extraktionshülse vollständig entleert. Im Extraktionsteil des üblichen Soxhlet findet eine teilweise Aufwärmung statt, die im allgemeinen vernachlässigt werden kann. Wenn bei der fraktionierenden Extraktion ein Stoff in der Kälte selektiv löslich ist, muss jedoch kalt extrahiert werden, im Soxhlet-Kaltextraktor mit Kühlmantel. Für Extraktionen bei hoher Temperatur wird der Soxhlet-Heißextraktor verwendet, bei dem die Hülse durch den Dampf geheizt und durch den Heber wie üblich in Intervallen entleert wird.
Es sei daran erinnert, dass Extraktionen nicht nur im Labor und in der Analyse, sondern auch in der industriellen Praxis eine große Rolle spielen. Tabelle 1-1 gibt einige Beispiele
Tabelle 1-1
| Rohstoff | Lösungsmittel | Extrahierter Stoff |
|---|---|---|
| Zuckerrüben Zuckerrohr |
Wasser | Saccharose |
| Öl- und fetthaltige Pflanzenfrüchte und –Samen, evt. vorher ausgepresst |
n-Hexan u.a. KW Ethanol |
Öle und Fette (Glyzeride) |
| Fischmehl | n-Hexan u.a. KW | Glyzeride |
| Carnaubapalmen-Blätter | Heptan u.a. KW | Carnaubawachs |
| Kaffeebohnen | Dichlormethan l,2-Dichlorethan überkritisches CO2 |
Koffein |
| Cinchona-Rinde, vorbehandelt mit NaOH und CaCO3 |
aromatische KW | Chinin |
| Koka-Blätter (Erythroxylon coca) |
50%ige Essigsäure oder verd. H2SO4 |
Kokain |
Lösungsmittel und Gelöstes. Zur Theorie der Lösungsmittel
[Bearbeiten]‘‘Die Chemiker setzen das Lösungsmittel an die erste Stelle aller Hilfsmittel und rühmen sich, mit seiner Hilfe alle die wunderbaren Wirkungen ihrer Kunst ausführen zu können‘‘ (H.Boerhave (1664-1732): De menstruis dictis in chemia, in Elementa Chemiae, zit. nach Lit. 1.)
Worauf beruht die Löslichkeit? Sieht man von Erscheinungen, die auf die Lösungsentropie zurückzuführen sind, ab, so lässt sich allgemein feststellen, dass die zwischenmolekularen Kräfte zwischen Lösungsmittelmolekülen und Molekülen des gelösten Stoffes (Soluts) die gegenseitige Löslichkeit bestimmen. Eine Verbindung X (Solut) wird sich nur dann in einem Lösungsmittel S (Solvens) lösen, wenn die intermolekularen Anziehungskräfte K (X...X) und K (S...S) für die reinen Verbindungen kleiner sind als die Kräfte zwischen Solut- und Solvens-Molekülen K (X...S).
Für den Vorgang der Lösung eines Stoffes in einem Lösungsmittel kann man sich folgende einfache Modellvorstellung machen: Moleküle des Lösungsmittels müssen verdrängt werden, um Platz für das zu lösende Molekül zu schaffen. Der im Lösungsmittel gebildete Hohlraum (engl. cavity) nimmt das zu lösende Molekül auf. Bei der Hohlraumbildung müssen zwischenmolekulare Anziehungskräfte zwischen den Lösungsmittelmolekülen (Kohäsionkräfte) überwunden werden. Als ein Maß für die Energie, die nötig ist, um Lösungsmittelmoleküle voneinander zu trennen, kann die molare Verdampfungswärme dienen, welche durch das Molvolumen des Lösungsmittels dividiert wird; der Quotient wird als Kohäsionsenergiedichte bezeichnet:
wobei Mr die relative Molekülmasse des Lösungsmittels, ρ dessen Dichte und R die allgemeine Gaskonstante ist. Die Quadratwurzel der Kohösionsenergiedichte wurde von Hildebrand als Löslichkeitsparameter δ definiert.
Es wurde postuliert, dass bei nichtionischen Verbindungen dann eine hohe Löslichkeit zu erwarten sei, wenn sich die δ-Werte von Solvens und Solut nicht stark unterscheiden.
Das Hohlraum-Modell genügt zur quantitativen Erklärung von Löslichkeiten nicht; es müssen noch spezifische Wechselwirkungskräfte zwischen Molekülen des Lösungsmittels und des gelösten Stoffes sowie Entropie-Effekte berücksichtigt werden. Zwischenmolekulare Kräfte, die in Lösungsmitteln eine besonders große Rolle spielen, sind:
- van der Waals-Kräfte
Bei einem bestimmten Abstand zwischen Molekülen (der Summe der van der Waals-Radien) treten schwache, attraktive Wechselwirkungskräfte auf. Sie sind umso stärker, je leichter polarisierbar die Elektronenhülle ist.
- Dipol-Kräfte
Die meisten Moleküle sind aus Atomen verschiedener Elektronegativität aufgebaut und besitzen daher eine unsymmetrische Ladungsverteilung. Die molekularen Dipole ziehen sich gegenseitig an (Dipol-Dipol-Wechselwirkung) oder induzieren Dipolmomente in benachbarten polarisierbaren Molekülen. Die durch Dipole ausgeübten zwischenmolekularen Kräfte sind stärker als die van der Waals-Kräfte.
Beispiele für Dipol-Moleküle:
- Wasserstoffbrücken-Bindungen
Diese zwischenmolekularen Kräfte sind in der organischen Chemie in erster Linie bei Molekülen mit O-H- und N-H-Bindungen von Bedeutung. Sie sind stärker als van der Waals- oder Dipolkräfte und bestimmen daher in hohem Maße das Verhalten solcher Moleküle. Wasserstoffbrücken-Bindungen sind Valenzkräfte definierter Richtung. Man definiert als Wasserstoffbrücken-Akzeptor (HBA) ein Molekül, welches ein “freies“ Elektronenpaar zur Bindung des Protons beisteuert. Den protonenspendenden Partner nennt man Wasserstoffbrücken-Donor (HBD).
Beispiele:
Wasser, Alkohole, Carbonsäuren und Carbonsäureamide fungieren sowohl als HBDs und HBAs und können daher H-Brücken-Assoziate mit sich selbst bilden (amphiprotonische Verbindungen).
Weitere zwischenmolekulare Kräfte
Für die meisten organischen Moleküle sind die oben genannten zwischenmolekularen Kräfte entscheidend. Beim Lösen von ionogenen Verbindungen, z. B. Salzen, sind noch elektrostatische Wechselwirkungen (Coulomb-Kräfte) zwischen positiv und negativ geladenen Ionen sowie zwischen Ionen und Dipolen wichtig. Ionen können auch Komplex-Bindungen mit n- und π-Donormolekülen eingehen.
Charge-Transfer-Wechselwirkungen können auftreten zwischen n- oder π-Donoren und Akzeptor-Molekülen, die relativ niedrig liegende nichtbesetzte Molekülorbitale besitzen.
Beispiele:
Hydrophobe Wechselwirkungen
In wässrigen Lösungen können zwischenmolekulare Kräfte zum Phänomen der hydrophoben Wechselwirkung führen, die besonders in biologischen Systemen von großer Bedeutung ist. Die Moleküle hydrophober Substanzen, z.B. von Kohlenwasserstoffen, können von Wassermolekülen nicht solvatisiert werden; sie stoßen sich ab. Wenn man eine hydrophobe Substanz in Wasser gibt, schafft man einen unvorteilhaften Zustand, was mit einer Abnahme von Entropie einhergeht. Dies beruht darauf, dass die Wassermoleküle sich ordnen müssen, damit ein Hohlraum für die Moleküle der unpolaren Substanz ausgebildet wird (Abb.1-3)
Abb. 1-6. Schematische Darstellung der Hydrophobizität.
Hydrophobe Wechselwirkungen entstehen, wenn zwei oder mehrere unpolare Komponenten in Wasser gegeben werden. Die Moleküle der unpolaren Substanz(en) aggregieren, und durch das Aneinanderlagern wird die Oberfläche verkleinert. Dadurch sind weniger hydrophobe Bereiche der polaren Umgebung ausgesetzt. Hydrophobe Wechselwirkungen beruhen also nicht auf einer Anziehungskraft zwischen den unpolaren Molekülen. Vielmehr werden hydrophobe Moleküle durch die polare Umgebung aneinandergedrängt (Abb.1-4). Es ist also die Struktur des Wassers, welche die hydrophoben Wechselwirkungen bedingt.
Abb.1-7. Hydrophobe Wechselwirkungen, schematisch.
In der Biologie sind hydrophobe Wechselwirkungen u.a. verantwortlich für die Lipid-Doppelschicht-Struktur von Membranen und für die Bindung von Proteinen an diese Membranen. Sie gehören auch zu den Hauptkräften, welche die dreidimensionale Struktur von Proteinen stabilisieren.
Klassifizierung von Lösungsmitteln
[Bearbeiten]Die relativ starken Wasserstoffbrücken und das damit verbundene häufig besondere Verhalten der Lösungsmittel, die Wasserstoffbrücken-Donoren (HBDs) sind, machen es gerechtfertigt, dass wir
- protonische Lösungsmittel von
- aprotischen Lösungsmitteln unterscheiden.
Aprotonische Lösungsmittel Viele aprotonische Lösungsmittel bestehen aus Molekülen aliphatischer oder aromatischer monofunktioneller Verbindungen, deren zwischenmolekulare Kräfte auf van der Waals- oder/und Dipol-Anziehung zurückgeführt werden können. Wenn die Dipol-Kräfte dominieren, spricht man von polaren Lösungsmitteln. Als Maß ihrer Polarität könnte man das Dipolmoment µ (in der Gasphase!?) verwenden. In der Praxis hat es sich jedoch als günstiger erwiesen, empirische Polaritätsskalen durch vergleichende Messungen von Lösungsmitteleffekten aufzustellen (Lit.2). Verschiedene Polaritätsskalen basieren auf der durch Lösungsmittel verursachten Verschiebung der Absorptionsmaxima im UV/VIS-Spektrum von Farbstoffen (Solvatochromie), die sich experimentell leicht messen lässt. Nach den Skalen von Kosower (Z-Parameter) sowie Dimroth und Reichardt (ET-Parameter) (s. Lit.2) wurde in den 1980er Jahren die π*-Skala aufgestellt, die auf solvens-induzierten Verschiebungen der Maxima der Frequenzen der π → π*-Übergänge von sieben Indikatorfarbstoffen beruht. In der Tabelle 1-2 sind für einige aprotonische Lösungsmittel, Dipolmomente und Polaritätsparameter π* zusammengestellt (Lit.2,4,5). Die Lösungsmittel mit Dipolmomenten µ = ca. 3D, z.B. Dimethylformamid, Dimethylacetamid, Tetrahydrothiophen-S,S-dioxid (Tetramethylensulfon, “Sulfolan“), Dimethylsulfoxid, spielen in der organischen Chemie eine besondere Rolle und werden häufig als dipolare aprotonische Lösungsmittel hervorgehoben. Obwohl die Lösungsmittel Benzol und Toluol praktisch kein Dipolmoment aufweisen, ist ihr π*-Parameter relativ groß, größer als bei den gesättigten Kohlenwasserstoffen. Die größere Polarität der aromatischen Kohlenwasserstoffe ist ohne Zweifel auf die größere Polarisierbarkeit der π-Elektronen zurückzuführen. Dasselbe gilt für die mehrfach chlorierten Kohlenwasserstoffe Dichlormethan und Chloroform, die relativ kleine Dipolmomente besitzen. Perfluorhexan und -heptan haben die kleinsten (negativen!) π*-Parameter; diese Moleküle sind extrem schwer polarisierbar und damit sehr schlechte Solventien. Viele aprotische Lösungsmittel besitzen freie Elektronenpaare und sind daher Wasserstoffbrücken-Akzeptoren (HBAs). Die Akzeptorstärke eines Lösungsmittels, die sog. HBA-Basizität, korreliert nicht immer mit dem pKa-Wert in wässriger Lösung oder der Basizität in der Gasphase. Durch Messungen der Solvatochromie wurde daher eine Skala der HBA-Basizität (β-Skala) definiert, die in der Tabelle 1-2 ebenfalls aufgeführt ist.
Tabelle 1-2
| Lösungsmittel | Dipol- moment (Debye) |
π* | β |
|---|---|---|---|
| n- Hexan | 0,0 | -0,08 | 0,00 |
| n-Heptan | 0,0 | -0,08 | 0,00 |
| Cyclohexan | 0,0 | 0,00 | 0,00 |
| Benzol | 0,0 | 0,59 | 0,10 |
| Toluol | 0,36 | 0,54 | 0,11 |
| Tetrachlormethan | 0,0 | 0,28 | 0,00 |
| Dichlormethan | 1,60 | 0,82 | 0,00 |
| Chloroform | 1,01 | 0,58 | 0,00 |
| Perfluor-n-hexan | -0,41 | 0,00 | |
| Perfluor-n-heptan | -0,39 | 0,00 | |
| Diethylether | 1,15 | 0,27 | 0,47 |
| tert-Butylmethylether | 1,32 | ||
| Tetrahydrofuran | 1,63 | 0,58 | 0,55 |
| Dioxan | 0,0 | 0,55 | 0,37 |
| Pyridin | 2,2 | 0,87 | 0,64 |
| Aceton | 2,88 | 0,71 | 0,48 |
| 2-Butanon | 2,7 | 0,67 | 0,48 |
| Ethylacetat | 1,78 | 0,55 | 0,45 |
| Acetonitril | 3,92 | 0,75 | 0,31 |
| N, N-Dimethylformamid | 3,82 | 0,88 | 0,69 |
| N-Methylpyrrolidon | 4,1 | 0,92 | 0,77 |
| Dimethylsulfoxid | 3,96 | 1,00 | 0,76 |
| Tetramethylensulfon | 4,7 | 0,98 | |
| Hexamethylphosphorsäuretriamid | 5,5 | 0,87 | 1,05 |
Protonische Lösungsmittel
Protonische Lösungsmittel sind Wasserstoffbrücken-Donoren (HBDs). Die Fähigkeit eines Lösungsmittels, in einer Wasserstoff-Brücke ein Proton an einen gelösten Stoff, der als HBA fungiert, abzugeben, die HBD-Acidität, kann durch die α-Skala beschrieben werden. Die Tabelle 1-3 zeigt die α-Parameter sowie β- und π*-Werte für einige häufige protonische Lösungsmittel. Die Skala demonstriert nochmals, dass diese Lösungsmittel nicht nur Wasserstoffbrücken-Donoren, sondern auch -Akzeptoren sind (amphiprotonische Solventien). Bei den fluorierten Alkoholen 2,2,2-Trifluorethanol (TFE) und 1,1,1,3,3,3-Hexafluorisopropylalkohol (HFIP) tritt der HBA-Charakter völlig in den Hintergrund (β = Null!).
Tabelle 1-3
| Lösungsmittel | Dipol- moment (Debye) |
π* | β | α |
|---|---|---|---|---|
| Wasser | 1,85 | 1,09 | 0,18 | 1,17 |
| Methanol | 1,70 | 0,60 | 0,62 | 0,93 |
| Ethanol | 1,69 | 0,54 | 0,77 | 0,83 |
| 2-Propanol | 0,48 | 0,95 | 0,76 | |
| tert-Butylalkohol | 0,41 | 1,01 | 0,68 | |
| Ethylenglykol | 2,28 | 0,92 | 0,52 | 0,90 |
| 2,2,2-Trifluorethanol (TFE) |
0,73 | 0,00 | 1,51 | |
| 1,1,1,3,3,3-Hexa- fluor-2-propanol Hexafluorisopropanol (HFIP) |
0,65 | 0,00 | 1,96 | |
| Phenol | 1,45 | |||
| Essigsäure | 1,74 | 0,64 | 1,12 | |
| Formamid | 3,73 | 0,97 | 0,71 |
Lösungsmittel zur Extraktion
[Bearbeiten]Zur Extraktion von Naturstoffen werden (in der Reihenfolge absteigender Polarität) Methanol, Ethanol, Ethylacetat, Diethylether, chlorierte Kohlenwasserstoffe und Kohlenwasserstoffe selbst verwendet (Tabelle 1-4). Für anspruchsvollere analytische Arbeiten müssen diese Lösungsmittel rückstandsfrei, d.h. destilliert sein. Diethylether soll keine Peroxide enthalten. Die in der Tabelle aufgeführten Lösungsmittel haben meist relativ niedrige Siedepunkte. Das Lösungsmittel, das ja bloße Hilfsphase ist, lässt sich daher leicht durch Destillation, gegebenenfalls unter vermindertem Druck, entfernen. Aufgrund des sehr niedrigen Siedepunktes und seiner Unbrennbarkeit eignet sich Trichlorfluormethan besonders zur Extraktion leicht flüchtiger Verbindungen, wie z. B. Riechstoffen. Hierbei ist allerdings zu bedenken, dass Trichlorfluormethan, wie alle leicht flüchtigen Fluorchlorkohlenwasserstoffe (FCKWs), ökologisch bedenklich ist und nicht in die Atmosphäre gelangen darf.
Tabelle 1-4
| Lösungsmittel | Siedepunkt °C |
Gefahrenklasse |
|---|---|---|
| Methanol | 65 | B |
| Ethanol | 78 | B |
| Ethylacetat | 77 | A1 |
| Diethylether | 35 | A1 |
| tert-Butylmethylether | 53 | A1 |
| Dichlormethan Methylenchlorid |
40 | |
| Trichlorfluormethan | 24 | |
| Toluol | 111 | A1 |
| Hexan | 69 | A1 |
| Pentan | 36 | A1 |
| Isopentan | 28 | A1 |
| Petrolether | 40 - ? | A1 |
Es gibt jedoch einen Ersatzstoff: Kohlendioxid lässt sich unter Druck verflüssigen. In überkritischem Zustand verhält sich CO2 wie ein Lösungsmittel und hat als Extraktionsmittel ähnliche Eigenschaften wie Diethylether. Durch Entspannung des komprimierten Kohlendioxids lassen sich die extrahierten Substanzen sehr schonend gewinnen. Man benötigt jedoch zur Extraktion mit überkritischem CO2 Apparaturen, die in Praktika meistens nicht zur Verfügung stehen. Auch kontinuierliche Extraktionen in Hochdruck-Soxhlet-Extraktoren sind möglich. Die sehr schonende Methode wird in steigendem Maße zur Gewinnung von empfindlichen Pflanzeninhaltsstoffen (natürliche Aromen und Gewürzextrakte, ätherische Öle) verwendet. Industrielle Anwendungen sind die Hopfenextraktion und die Entcoffeinierung von Kaffeebohnen.
Welches Lösungsmittel löst eine bestimmte Substanz am besten? Häufig wird diese Frage auf empirischem Weg, d. h. durch Probieren, gelöst. Als einfache Faustregel kann das Ähnlichkeitsprinzip definiert werden, welches besagt, dass die Löslichkeit dann hoch sein wird, wenn in der zu lösenden Substanz und dem Lösungsmittel ähnliche zwischenmolekulare Kräfte wirksam werden können. Beispielsweise lösen sich Kohlenhydrate (Zucker) in Wasser, Alkoholen (H-Brücken), auch in Dimethylsulfoxid (starker H-Brücken-Akzeptor), nicht jedoch in Hexan, Toluol, etc. (nur van der Waals-Kräfte). Fette, deren Moleküle lange Alkylketten tragen, lösen sich bekanntlich nicht in Wasser, jedoch in unpolaren Solventien wie Toluol, Petrolether oder Dichlormethan.
Mischbarkeit organischer Lösungsmittel
Nicht alle organische Lösungsmittel lösen oder mischen sich in beliebigem Verhältnis ineinander bzw. miteinander. Für die Laborpraxis, die industrielle Chemie und die Biotechnologie sind diese Phänomene wichtig. In Abbildung 1-8 ist die Mischbarkeit einiger Lösungsmittel zusammengestellt.

Abb. 1-8. Mischbarkeit einiger organischer Lösungsmittel
Die Löslichkeit von Wasser in organischen Lösungsmitteln ist für die praktische Arbeit im Labor, insbesondere für die Verteilungsverfahren (Kapitel 4), und in der chemischen Technik von besonderer Bedeutung (vgl. auch die Einteilung in die Klassen A und B der Verordnung über brennbare Flüssigkeiten). Betrachten Sie dazu die Beispiele in Tabelle 1-5.
Tabelle 1-5
| Lösungsmittel | Löslichkeit von H2O im org. Solvens |
Löslichkeit in Wasser |
|---|---|---|
| n-Pentan | 0,0120 (25 °C) | 0,0038 (25 °C) |
| n- Hexan | 0,0111 (20 °C | 0,001 (25 °C) |
| n-Heptan | 0,0091 (25 °C) | 0,0003 (25 °C) |
| Benzol | 0,063 (25 °C) | 0,1780 (25 °C) |
| Toluol | 0,0334 (25 °C) | 0,0515 (25 °C) |
| Dichlormethan | 0,198 (25 °C) | 1,30 (25 °C) |
| Chloroform | 0,072 (23 °C) | 0,815 (20 °C) |
| Tetrachlormethan | 0,010 (24 °C) | 0,077 (25 °C) |
| Diethylether | 1,468 (25 °C) | 6,04 (25 °C) |
| tert-Butylmethylether | 1,5 (20 °C) | 4,8 (20 °C) |
| Tetrahydrofuran | ∞ | ∞ |
| Dioxan | ∞ | ∞ |
| Ethylacetat | 2,94 (25 °C) | 8,1 (25 °C) |
| Pyridin | ∞ | ∞ |
| Aceton | ∞ | ∞ |
| 2-Butanon | 10,00 (20 °C) | 24,00 (20 °C) |
| Acetonitril | ∞ | ∞ |
| N, N-Dimethylformamid | ∞ | ∞ |
| Methanol | ∞ | ∞ |
| Ethanol | ∞ | ∞ |
| 1-Propanol | ∞ | ∞ |
| 2-Propanol | ∞ | ∞ |
| Phenol | 28,72 (25 °C) | 8,66 (25 °C) |
| Formamid | ∞ | ∞ |
Die Löslichkeit von Wasser in organischen Lösungsmitteln ist für die praktische Arbeit im Labor, insbesondere für die Verteilungsverfahren (Kapitel #), und in der chemischen Technik von besonderer Bedeutung (vgl. auch die Einteilung in die Klassen A und B der Verordnung über brennbare Flüssigkeiten). Betrachten Sie dazu die Beispiele in Tabelle 1-5.
Tabelle 1-5
Trocknen von Lösungsmitteln
[Bearbeiten]Wie erhält man trockene Lösungsmittel? Sie sind im Handel zu relativ hohem Preis erhältlich; Analytiker und Biowissenschaftler greifen oft auf diese Quellen zu. Billiger ist, wenn man wasserhaltige Lösungsmittel selbst reinigt. Hierfür gibt es verschiedene Methoden; viele davon können nur für spezielle Lösungsmittel benutzt werden. Im Zweifelsfall muss hierfür die Literatur zu Rate gezogen werden.[1][2][3]. Einfach, vielseitig verwendbar und ungefährlich ist das
Trocknen mit Molekülsieben
[Bearbeiten]Molekülsiebe, meist nach dem englischen (molecular sieves) im Deutschen "Molekularsiebe" genannt, sind kristalline, synthetische Zeolithe, deren Kristallgitter zahlreiche Hohlräume (Poren) enthält, welche miteinander durch Kanäle verbunden sind. Im Laborjargon wird oft die Bezeichnung "Molsieb" benutzt; aber ein Mol lässt sich schwerlich sieben, höchstens Moleküle!
Abb. 1-9. Struktur eines Zeoliths.
Der mittlere Durchmesser der Poren (300-1000 Pikometer), die Porengröße, lässt sich bei der Fabrikation reproduzierbar einstellen und wird meistens in Angstrom-Einheiten angegeben: 3, 4, 5, 10 A). Dementsprechend unterscheidet man Molekularsieb 3A bis Molekularsieb 10A.
Molekülsiebe werden als Pulver, Perlen oder Stäbchen gehandelt. Für die Lösungsmittel-Trocknung verwendet man meistens die Perlform.
In die Hohlräume können u.a. Wassermoleküle eingelagert und reversibel gebunden werden. 100 g Molekülsieb kann bei Raumtemperatur bis zu 20 g Wasser aufnehmen. Aber auch andere Moleküle, so die des Lösungsmittels, können adsorbiert werden. Damit die relativ kleinen Wassermoleküle bevorzugt eindiffundieren können, wählt man eine möglichst kleine Porengröße, 3 oder 4 Angstrom. Dies hängt auch vom Lösungsmittel ab.
Wasserhaltige Lösungsmittel lassen sich mit Molekülsieben nach zwei Verfahren trocknen:
Bei der satzweisen Trockung (Batch-Verfahren) lässt man das Lösungsmittel in einer Flasche über Molekülsieb ungefähr 24 Stunden stehen, wobei man gelegentlich umschüttelt. Im allgemeinen sind für 1 Liter Lösungsmittel mit einem Wassergehalt von etwa 1% ungefähr 100 g Molekülsieb erforderlich.
Die kontinuierliche Trocknung in einem Glasrohr (Schwerkraftsäule) ist effizienter. Man benötigt dazu ein Glasrohr mit einem angeschmolzenen kugelförmigen Oberteil und einem Hahn am Ende. Knapp oberhalb des Hahns ist eine Glasfritte eingeschmolzen. Hat man keine Säule mit Glasfritte, so stopft man etwas Glaswolle oder Watte in den Unterteil der Säule und füllt diese dann mit Molekülsieb-Perlen. Für eine 60 cm lange Säule von ca. 25 mm Durchmesser benötigt man ungefähr 250 g Molekülsieb. Man lässt nun langsam (!) das wasserhaltige Lösungsmittel auf die Füllung tropfen; dabei kann die Säule warm werden. Steht der Flüssigkeitsspiegel über der Füllung, regelt man mit dem Hahn die Fließgeschwindigkeit auf ca. 0,5 bis 0,8 ml/min ein. Das zuerst austropfende Lösungsmittel kann noch Staubanteile (wenn frisches Molekülsieb verwendet wird) und Spuren von Wasser enthalten. Man fängt daher den "Vorlauf" (ca. 250 ml) getrennt auf und lässt ihn nochmals durch die Säule sickern. Das folgende Lösungsmittelvolumen kann dann im allgemeinen ohne weitere Reinigung verwendet werden.

Wenn das getrocknete Lösungsmittel unmittelbar in das Auffanggefäß tropft, so kann ein Teil verdunsten. Dadurch wird die Umgebung abgekühlt (Verdampfungswärme!); aus der Luft kann wieder Feuchtigkeit aufgenommen werden. Dies kann verhindert werden, indem man zwischen dem Auslauf des Hahns und dem Auffanggefäß ein Verbindungsstück anbringt, welches die Luft ausschließt. Zum Druckausgleich trägt es ein mit Calciumchlorid gefülltes Trockenrohr.
Abb. 1-10. Bild evt. ergänzen
Die getrockneten Lösungsmittel werden auch über Molekülsieb aufbewahrt. Pro Liter benötigt man etwa 10 g Molekülsieb. Dieses soll staubfrei oder regeneriert worden sein (s.u.).
Die kontinuierliche Arbeitsweise ist der diskontinuierlichen vorzuziehen; sie ist intensiver und insgesamt zeitsparender. Auch bei Verwendung kleinerer Säulen lassen sich ausgezeichnete Trocknungseffekte erzielen. Bei schwieriger zu trocknenden Lösungsmitteln bzw. bei höheren Anfangswassergehalten empfiehlt sich eine satzweise Vortrocknung.
Regenerierung und Aktivierung der Molekülsiebe
[Bearbeiten]Die Molekülsiebe können mehrfach regeneriert werden. Gebrauchtes Molekülsieb lässt man zunächst in einer Schale im Abzug (!) stehen, so dass anhängende Lösungsmittelreste verdampfen können. Anschließend wird das Molekülsieb in einer Weithalsflasche über entmineralisiertem Wasser stehen gelassen. Das Wasser wird einige Mal erneuert. Zur Aktivierung ,d.h. vollständigen Entfernung des Wassers aus dem beladenen Zeolith, wird in einer Schale das Molekülsieb in einem Trockenofen langsam erwärmt, so dass das locker anhaftende Wasser verdampft. Dann wird mehrere Stunden auf 350 bis 400 °C erhitzt; das in den Hohlräumen adsorbierte Wasser wird dabei ausgetrieben. Man lässt die Schale mit dem Molekülsieb im Exsikkator auf Raumtemperatur abkühlen. Eine gründliche Aktivierung bzw. Regenerierung der Molekülsiebe ist unerlässlich! Warnung: Erhitzen Sie niemals Molekülsiebe, die mit organischen Chemikalien in Berührung gekommen sind, im Trockenschrank! Explosionsgefahr!
Trocknen von Extrakten
[Bearbeiten]Bevor man einen organischen Extrakt weiter verarbeitet, muss man das Wasser entfernen, was man das “Trocknen“ der Extrakte nennt. Unterlässt man dies, so können Störungen im weiteren Gang der Aufarbeitung oder Ausbeuteminderungen eintreten. So kann sich beim anschließenden Abdestillieren der leichtflüchtigen Lösungsmittel das Wasser im Rückstand anreichern und die Kristallisation verzögern oder verhindern. Hydrolyseempfindliche Stoffe können beim Abdestillieren des wasserhaltigen Lösungsmittels reagieren. Im harmlosesten Fall wird der Rückstand von Wassertröpfchen durchsetzt sein, die anders schwierig zu entfernen sind. Trockenmittel für Extrakte sind wasserfrei getrocknete anorganische Salze, die Hydrate bilden: MetXm + nH2O → MetXm•nH2O.
Am häufigsten werden verwendet:
- Calciumchlorid, CaCl2
- Natriumsulfat, Na2SO4,
- Magnesiumsulfat, MgSO4,
- Calciumsulfat, CaSO4.
Für die praktische Durchführung des Trocknens sollte man folgendes beachten:
- Verwenden Sie nur Trockenmittel einwandfreier Qualität, d.h. solche, die wirklich wasserfrei sind. In der Regel muss man Trockenmittel vor Gebrauch entwässern, was durch Ausheizen (“Glühen“) auf einem Blech oder in einer Eisenschale getan wird. Das ausgeheizte Trockenmittel sollte rasch in eine dicht verschließbare Vorratsflasche abgefüllt werden, wo man es abkühlen lässt. Selbstverständlich darf noch warmes Trockenmittel nicht in organische Lösungen gegeben werden.
- Das Trocknen braucht genügend Zeit, denn es ist ein Diffusionsprozess zwischen flüssiger und fester Phase. Gelegentliches Umschütteln oder magnetisches Rühren erhöht die Trocknungsgeschwindigkeit. Wenn nicht gerührt wird, sollte mehrere Stunden, am besten über Nacht, getrocknet werden.
- Nicht übertrieben viel Trockenmittel nehmen; durch Adsorption können Substanzverluste auftreten. Beim Abfiltrieren des Trockenmittels müsste man dieses mit einem Übermaß an getrocknetem (!) Lösungsmittel auswaschen. Am besten trocknet man den Extrakt kurze Zeit mit wenig Trockenmittel vor, dekantiert vom Trockenmittel ab und gibt dann frisches Trockenmittel zur Lösung, das man längere Zeit einwirken lässt.
- Das Trockenmittel muss abfiltriert und mit trockenem Lösungsmittel ausgewaschen werden, bevor man das Lösungsmittel abdestilliert. Sonst kann beim Destillieren Hydratwasser zum Teil reversibel freigesetzt werden.
- Calciumchlorid ist als Trockenmittel nicht für alle Stoffe geeignet. Es kann Komplexe bilden mit vielen Alkoholen, Aminen und einigen Estern und Ketonen. Das handelsübliche wasserfreie Calciumchlorid kann durch den industriellen Entwässerungsprozess etwas basische Calciumsalze enthalten, die Carbonsäuren und Phenole binden können. Im Zweifelsfalle also lieber Magnesiumsulfat oder Natriumsulfat verwenden.
Einzelnachweise
[Bearbeiten]- ↑ J. F. Coetzee, (Editor), Recommended methods for purification of solvents and tests for impurities, International Union of Pure and Applied Chemistry / Commission on Electroanalytical Chemistry, Pergamon Press, Oxford u.a.O, 1983.
- ↑ W. L. F. Armarego, C. Li-Lin Chai, Purification of laboratory chemicals, 5. Aufl., Butterworth-Heinemann, Amsterdam u.a. O., 2003, und frühere Auflagen
- ↑ H. G. O. Becker, R. Beckert, Organikum: organisch-chemisches Grundpraktikum, 22. Aufl., Wiley-VCH, Weinheim u.a.O., 2004, und frühere Auflagen.
Literatur
[Bearbeiten]- C. Reichardt, Lösungsmitteleffekte in der organischen Chemie, Verlag Chemie, Weinheim, 1969.
- C. Reichardt, Solvent Effects in Organic Chemistry, Verlag Chemie, Weinheim, New York, 1979.
- J. A. Riddick und W. B. Bunger, Organic Solvents in: Techniques of Chemistry, Vol. 2 (Hrsg. A.Weissberger), Wiley-Interscience 1970.
- J. L.M. Abboud, M. J. Kamlet und R. W. Taft, Progr. Phys. Org. Chem. (Hrsg. R. W. Taft), Vol. 13, 485 (1981).
- M. J. Kamlet, J. L. M. Abboud, M. H. Abraham und R. W. Taft, J. Org. Chem. 48, 2877-2887 (1983).
- Informationsschrift der E. Merck A. G.: Trocknen im Labor , Darmstadt.
Versuche
[Bearbeiten]Entfärben und Klären von Extrakten und Lösungen, Reinigung von Lösungsmitteln
[Bearbeiten]Bei der Extraktion von Feststoffen fallen häufig trübe Lösungen an, die oft mehr oder weniger kleine Anteile von Wasser enthalten. Die Entfernung von Wasseranteilen aus Lösungen wird als "Trocknen" bezeichnet und weiter unten behandelt (Kapitel 4). Trübe Lösungen werden filtriert. Die feine Suspension, welche die Trübung verursacht, kann durch Zugabe von Filtrierhilfen leichter abgetrennt werden (Klären). Häufig verwendete Filtrierhilfen sind Cellulosepulver und Kieselgur (Diatomeenerde). Letztere besteht aus den Skeletten fossiler Kieselalgen, die aus polymerer Kieselsäure aufgebaut sind, d.h. Si-O-Si-Bindungen enthalten, und industriell von Verunreinigungen befreit werden. Im Labor wird häufig das Kieselgur-Markenprodukt Celite (geschütztes Warenzeichen) eingesetzt. Kieselgur ist resistent gegenüber den meisten Chemikalien, im Gegensatz zum Cellulosepulver, welches von stärkeren Säuren und Oxidationsmitteln angegriffen und damit unwirksam gemacht wird.
Die Ausführung kann nach zwei Methoden erfolgen:
- Einrühren
Die Lösung wird mit einer kleinen Menge Filtrierhilfsmittel wie Kieselgur oder Cellulosepulver versetzt und umgerührt. Anschließend wird die Suspension durch ein gefaltetes Papierfilter filtriert.
- Schichtfiltration
Ein Büchnertrichter (Nutsche) wird mit einem Rundfilter belegt. Man beschichtet das Papier mit dem Filtrierhilfsmittel und lässt die zu klärende Lösung vorsichtig durch die Schicht fließen. Um das Aufwirbeln der Filterschicht zu verhindern, kann man einen Glasstopfen umgekehrt auf das Filter legen und die Lösung über den Stopfen laufen lassen. Häufig wird das Filter bei dieser Prozedur verstopft werden, vor allem, wenn die Filterfläche klein ist. Um dies zu verhindern, kann man das Filtrierhilfsmittel mit dem Lösungsmittel zu einem Brei verrühren und diesen gleichmäßig auf der Filterfläche verteilen. Im Falle von Kieselgur wird empfohlen, 1 Teil mit 2 Teilen Wasser anzurühren; für 10 cm2 Filterfläche rechnet man mit ca.1-2 g Kieselgur.
Entfärbung durch selektive Adsorption
[Bearbeiten]Viele Extrakte enthalten farbige Begleitstoffe als Verunreinigungen. Diese lassen sich in günstigen Fällen durch Adsorption an Feststoffen entfernen. Der Adsorptionsvorgang spielt sich an der Grenzfläche zwischen einem Feststoff (Adsorbens, kurz: Sorbens) und einer Lösung (Flüssigkeit) ab. Es handelt sich um einen Gleichgewichtsprozess, bei dem Moleküle zwischen einem solvatisierten Zustand (in Lösung) und einem Zustand wechseln, in dem sie am Feststoff gebunden sind.
Die bekannten zwischenmolekularen Wechselwirkungskräfte treten auch hier in Erscheinung. Polare Moleküle werden an polaren Sorbentien stark gebunden, oft wird dabei Wärme frei (Sorptionsenergie). Physikalisch charakterisiert man die Adsorption durch die Adsorptionsisothermen (Abb. 2-1).
Man trägt auf der Ordinate die adsorbierte Substanzmenge (xads) in g/g Sorbens auf; auf der Abszisse wird die im Gleichgewicht (!) stehende Substanzmenge (xmobil) in der Lösung aufgetragen.
Abb. 2-1. Lineare (A) und konvexe (B) Adsorptionsisothermen (schematisch).
Sind die aktiven Zentren der Oberfläche belegt (das Sorbens also gesättigt), so wird zusätzlich angebotene Substanz nicht mehr adsorbiert, sondern liegt in solvatisiertem Zustand vor. Die maximale Menge an adsorbierter Substanz wird durch die zu belegende wirksame Oberfläche des gewählten Feststoffs bestimmt. In der Praxis muss diese durch Vorversuche, d.h. empirisch, ermittelt werden.
Sorbentien
[Bearbeiten]Als Sorbentien werden neben Cellulosepulver häufig Aktivkohle und Bleicherde verwendet. Bei Letzterer handelt es sich um ein Gemisch von Tonmineralien (Montmorillonit, Bentonit), das billig ist und daher vor allem in der Industrie genutzt wird.
Aktivkohlen werden aus Holz oder fossiler Kohle industriell hergestellt. Es gibt sie in pulverförmiger, gekörnter oder anders geformter Gestalt. Sie sind porös und haben daher eine große spezifische Oberfläche, zwischen ca. 800 und 1500 m2/g. Die Porenradien sind nicht so einheitlich wie bei den Zeolithen, sondern reichen von < 1 nm (Mikroporen) bis > 25 nm (Makroporen). Mesoporen weisen Radien von 1-25 nm auf. Durch die unterschiedlich großen Poren adsorbieren die Aktivkohlen fast jede Art von Molekülen. Das Adsorptionsvermögen der Aktivkohle hängt von der Oberfläche und der Porengröße ab, denn bei der Adsorption müssen die Moleküle in die Poren hinein diffundieren. Dies braucht seine Zeit (Geduld!). Gepulverte Kohlen lassen sich schneller beladen als gekörnte.
Kieselgel
[Bearbeiten]Anders als Kieselgur ist Kieselgel ein durch einen chemischen Prozess industriell hergestelltes Adsorptionsmittel. Es hat eine wesentlich höhere innere Oberfläche als Kieselgur und wird vor allem für die Adsorption in Trennsäulen verwendet. Kieselgele tragen an ihrer Oberfläche freie Si-OH-Gruppen (Silanol-Gruppen), welche als Wasserstoffbrücken-Donoren gegenüber den zu adsorbierenden Molekülen fungieren können und dem Sorbens einen schwach sauren Charakter verleihen. Kieselgel wird meist in körniger Form verschiedener Größen eingesetzt. Die Körner sind ebenfalls porös; der mittlere Durchmesser der Poren wird meistens in Ångström-Einheiten angegeben, z.B. 60-120 Å)
Aluminiumoxide
[Bearbeiten]Diese Sorbentien, oft nach dem englischen ’Alumina‘ genannt, werden ebenfalls industriell in standardisierter Form hergestellt. Neben der Korn- und Porengröße sind vor allem der Charakter und die sogenannte Aktivität des Aluminiumoxids zu beachten. Der technische Prozess, die Hydrolyse von Natriumaluminat, führt zunächst zu einem Aluminiumoxid mit basischem Charakter. Durch Nachbehandlung lassen sich auch Aluminiumoxide mit neutralem und saurem Charakter herstellen, die im Handel angeboten werden (Alumina basisch, neutral und sauer). Intensives Entwässern der Aluminiumoxide bei höherer Temperatur liefert hochaktives Aluminiumoxid (Aktivitätsstufe I oder Aktivitätsstufe Super I). Es adsorbiert geeignete Moleküle sehr stark. Daher behandelt man das hochaktive Aluminiumoxid mit definierten Mengen Wasser, wodurch es desaktiviert wird. Die Adsorptionskraft ist dann zwar geringer, aber die Adsorption ist in der Regel selektiver gegenüber verschiedenen Adsorbat-Molekülen. In der Praxis werden der Charakter und die Aktivitätsstufe von Aluminiumoxiden ermittelt, indem man Lösungen von Testfarbstoffen durch kleine Aluminiumoxid-Säulen laufen lässt. Die Farbstoffe werden selektiv adsorbiert (Aktivitätstest nach Brockmann, Versuche 2D und 2E).
Durch Adsorption können Stoffgemische oft grob aufgetrennt werden. In der Regel schließen sich jedoch Feintrennungen durch Kristallisation oder Chromatographie an. Grobe Trennungen können nach folgenden Techniken ausgeführt werden:
- Einrühr-Verfahren
Bei dieser satzweisen Methode ("Batch-Verfahren") wird das Sorbens in einmaligen Kontakt mit der Lösung gebracht. Man wartet bis sich das Adsorptionsgleichgewicht eingestellt hat; durch Erwärmen kann dies beschleunigt werden. Anschließend wird das Sorbens abfiltriert (Einrühren, "Ziehenlassen" und Abfiltrieren).
Beispiel für die Adsorption an Aktivkohle-Pulver:[1] Gepulverte Kohle wird der zu reinigenden Lösung entweder trocken oder als Suspension im Lösungsmittel (z.B. eine 25%ige Suspension von Aktivkohle in Wasser) zugegeben. Nach ca. 30 min Rühren, möglichst unter Erwärmen (raschere Gleichgewichtseinstellung!), filtriert man. Dosierung: 0,1 bis 1 % der zu entfärbenden Lösung; Vorversuche sind zu empfehlen. Die Verwendung gepulverter Kohle wird durch Zugabe weiterer Filtrierhilfsmittel erleichtert; besonders gut hat sich Kieselgur bewährt. Um zu vermeiden, dass sehr kleine Kohlepartikel durch das Filter wandern, kann man die Lösung direkt noch mit Kieselgur versetzen oder eine Schichtfiltration (s.o.) durch Kieselgur (Celite) vornehmen.
- Adsorptive Schichtfiltration
Man schwemmt Aktivkohle mit oder ohne Kieselgur in Lösungsmittel auf, belegt damit die Filterfläche in einem Büchner-Trichter (Nutsche) möglichst gleichmäßig und filtriert die Lösung durch die vorbereitete Schicht.
- Säulenverfahren (Perkolation, Adsorptive Filtration)
Das Sorbens wird in ein Trennrohr ("Säule") aus Glas eingebracht, dessen Ende mit einem Hahn (möglichst Teflon-Ventil) versehen ist. Eine Lösung des Gemisches wird kontinuierlich auf die Säule aufgegeben, bis diese mit allen adsorbierbaren Stoffen gesättigt ist. Die mit dem Sorbens gefüllte Säule ist möglichst senkrecht aufzustellen, damit sich beim Wandern der Lösung nach unten (Perkolieren) nicht so leicht Kanäle ausbilden können.

Bei diesem Verfahren wird nur die am schwächsten adsorbierte Substanz, die deshalb "an der Front" läuft, rein erhalten. Allen anderen sind die nachfließenden Anteile der vorhergehenden Fraktionen beigemischt. Das Verfahren eignet sich zur Reinigung von rohen Naturstoffen, unreinen Industriechemikalien und Syntheseprodukten von allen stärker adsorbierbaren Verunreinigungen. Als Sorbentien werden häufig Aktivkohle in gekörnter Form sowie Aluminiumoxide und Kieselgel eingesetzt.
- Reinigung von Lösungsmitteln
Für die Reinigung von Lösungsmitteln wird in erster Linie die adsorptive Filtration durch Aluminiumoxid genutzt: Entfernen von Wasser aus aprotischen organischen Lösungsmitteln (Trocknen) durch adsorptive Filtration.[2] Die einfachste Versuchsanordnung zur Lösungsmittelreinigung besteht aus einem Glasrohr mit einem kugelig aufgeweiteten Oberteil und einem Hahn am Ende. Knapp oberhalb des Hahns ist eine Glasfritte eingeschmolzen.

Hat man keine Säule mit Glasfritte, so bringt man etwas Glaswolle oder Watte in den verjüngten Unterteil der Säule und füllt diese dann mit einem entsprechenden Adsorptionsmittel, vorzugsweise hochaktivem Aluminiumoxid (basisch) der Aktivitätsstufe I oder Super I. Das Durchmesser/Längenverhältnis der Säulen soll ungefähr 1:10 bis 1:20 betragen. Die Verdunstung und Wiederaufnahme von Feuchtigkeit aus der Luft wird dadurch verhindert, dass man zwischen dem Auslauf des Hahns und dem Auffanggefäß ein geeignetes Verbindungsstück anbringt, das zum Zwecke des Druckausgleichs ein mit Calciumchlorid oder Aluminiumoxid gefülltes Trockenrohr trägt.
Das Lösungsmittel, welches gereinigt werden soll, wird anfänglich tropfenweise auf die Säule gegeben, und zwar so, dass sich die Säule möglichst wenig erwärmt (Sorptionswärme!). Sobald die Lösungsmittelfront an der Säule unten angekommen ist, und die ersten Tropfen ausfließen, wird die Säule soweit gefüllt, dass ein entsprechender Flüssigkeitsspiegel sich einstellt, der dann das Lösungsmittel mit höherem Fluss durch das Bett drückt. Bei einer Säule von ungefähr 25 mm innerem Durchmesser stellt ein Durchfluss von 90 Tropfen/min eine für viele Fälle adäquate Flussgeschwindigkeit dar. Die ersten wenigen Milliliter des austretenden Lösungsmittels sollten wieder auf die Säule zurückgegeben werden: Dieser Vorlauf enthält wegen der frei werdenden Adsorptionswärme meist etwas weniger reines Lösungsmittel als die nachfolgenden Volumina. Je nach Polarität und Art der Verunreinigungen ist die nun nachfolgende Solvensfraktion sehr rein. Ihr Volumen hat für die verwendete Säule eine dem Lösungsmittel spezifische Größe. Niedrig siedende polare Lösungsmittel lassen üblicherweise eine höhere, stärker polare Lösungsmittel eine niedrigere Kapazität der eingesetzten Säule erwarten. Lösungsmittel, die auf diese Art gereinigt werden, sind sowohl frei von gefärbten Verunreinigungen als auch trocken ("absolut"). In vielen Fällen ist es sehr leicht, die Belastung der Säule festzustellen, denn die Verunreinigungen konzentrieren sich anfänglich am Säulenkopf. Sie bilden einen gelben bis dunkelbraun gefärbten Ring (Zone). Dieser Ring wird durch die ebenfalls aufgenommene Feuchtigkeit langsam verdrängt und wandert in der Säule nach unten. Sobald diese Zone am Säulenausgang angekommen ist, ist die Säule "erschöpft". Es ist zweckmäßig, schon dann mit der Perkolation aufzuhören, wenn die dunkle Zone noch etwa 1 bis 2 cm über dem Säulenausgang steht.
Neben Verunreinigungen im Lösungsmittel wird auch Wasser vom Adsorbens gebunden. Feuchte Lösungsmittel können mit dieser Methode getrocknet werden. So kann der Wassergehalt von wassergesättigtem Diethylether (1,28 Gewichtsprozent H2O) durch adsorptive Filtration über basisches Aluminiumoxid der Aktivitätsstufe I auf 0,01% reduziert werden. Aus wassergesättigtem Chloroform (0,09% H2O) erhielt man das Solvens mit 0,005% Restwassergehalt.[3]
Die adsorptive Filtration ist für die Reinigung einiger aprotischer Lösungsmittel, vor allem von Kohlenwasserstoffen und Chlorkohlenwasserstoffen, im Laborbereich relativ einfach und wirtschaftlich. Die auf diese Weise hergestellten hochreinen Solventien sind besonders wertvoll, da man festgestellt hat, dass gewisse marktübliche, als "rein" deklarierte Lösungsmittel weniger stabil sind und leichter der Autoxidation unterliegen. Durch öfteres Öffnen des Vorratsgefäßes werden wieder Verunreinigungen aus der Umgebungsluft aufgenommen. Reinigt man die Lösungsmittel durch adsorptive Filtration selbst, so kann man sich auf die sofort zu verarbeitenden Mengen beschränken und hat stets die Vorteile eines frisch bereiteten Solvens. Wenn man die adsorptive Filtration von Lösungsmitteln durch aktive Aluminiumoxide mit den althergebrachten Trocknungsmethoden vergleicht, so hat die Adsorptionsmethode erhebliche Vorteile: Die verwendete Apparatur ist billig, und der Zeitaufwand für die Reinigung ist gering, sofern es sich um kleinere Lösungsmittelmengen handelt. Sehr oft sogar ist die Reinheit höher und der Restwassergehalt geringer als nach einer Lösungsmittelreinigung üblicher Art, die meistens zeitaufwendige Heiz- und Rückflussprozesse, so z.B. über Alkalimetallen (Natrium) oder Erdalkalioxiden, und nachfolgende Destillationen notwendig machen. Für Biowissenschaftler(innen) kann diese Reinigung kleinerer Mengen organischer Lösungsmittel nützlich sein, wenn diese für die Dünnschichtchromatographie (Kap. 5), Säulenchromatographie (Kap. 8), HPLC und für die Photometrie sowie Spektroskopie (UV/VIS) benötigt werden. So lässt sich "spektralreines" Hexan oder Cyclohexan auf einfache Weise herstellen.[4]
Aber nicht alle Lösungsmittel können durch adsorptive Filtration gereinigt werden. Einige Lösungsmittel werden beim Perkolieren durch hochaktives basisches Aluminiumoxid teilweise zersetzt, wie z.B. Essigsäureester. Aceton erleidet eine Aldolreaktion (Bildung von "Diacetonalkohol"). Protonische Lösungsmittel, z. B. Alkohole, werden naturgemäß selbst stark adsorbiert und können daher so nicht getrocknet oder gereinigt werden.
- Reinigung spezieller Lösungsmittel
Aktive Aluminiumoxide trocknen nicht nur Flüssigkeiten, sondern sie entfernen aus ihnen weitere polare Verbindungen, die als Verunreinigungen oder Stabilisatoren darin enthalten sein können.
- Entfernen von Peroxiden im Diethylether
Bekanntlich werden beim Stehen des Ethers an der Luft durch Autoxidation Hydroperoxide gebildet. Diese sind polarer als Ether, werden daher von basischem Aluminiumoxid selektiv adsorbiert und so aus dem Solvens entfernt.
- Entfernung von Alkohol aus Dichlormethan (Methylenchlorid) und Chloroform
Um diese Chlorkohlenwasserstoffe lagerbeständig zu machen, wird zur Stabilisierung meistens etwas Ethanol zugesetzt. Stört dies bei Versuchen, kann es leicht durch adsorptive Filtration über basisches Aluminiumoxid entfernt werden.[5]
- Gewinnung des adsorbierten Stoffes durch Desorption
Durch Behandeln mit polareren Solventien, z.B. Alkoholen, können in vielen Fällen adsorbierte Moleküle, d.h. Stoffe, vom Sorbens wieder "abgelöst" werden. Auf diese Weise lassen sich ebenfalls Reinigungen oder zumindest Anreicherungen erzielen. Ein die Glassäule umgebender Kühlmantel (Wasserkühlung) kann die Erwärmung verhindern, macht die Apparatur jedoch aufwendiger, so dass meistens darauf verzichtet wird.
Einzelnachweise
[Bearbeiten]- ↑ Informationsschrift der E. Merck AG
- ↑ Informationsschrift Woelm
- ↑ Günther Wohlleben, Entfernung von Wasser aus organischen Lösungsmitteln, Angew. Chem. 67, 741-743 (1955).
- ↑ Gerhard Hesse, Hermann Schildknecht, Reinigung von Kohlenwasserstoffen als Lösungsmittel für die Ultraviolettspektroskopie, Angew. Chem. 67, 737-739 (1955).
- ↑ G. Wohlleben, Entfernung von Alkohol aus Chloroform, Angew. Chem. 68, 752-753 (1956).
Literatur
[Bearbeiten]- Gerhard Hesse, Chromatographisches Praktikum, 2. Aufl., Akademische Verlagsgesellschaft, Frankfurt am Main, 1972.
- Informationsschrift E. Merck AG, Darmstadt.
- Chromatographie mit Aluminiumoxyden "WOELM", 2. Aufl., Woelm-Mitteilungen AL 7, M. Woelm, Eschwege, 1958.
Versuche
[Bearbeiten]- Aktivitätstest nach Brockmann und Schodder
- Adsorptive Filtration von unreinem Anthracen
Trennungen durch Kristallisation
[Bearbeiten]Allgemeines
[Bearbeiten]Die Kristallisation aus Lösungen ist die klassische Reinigungsmethode der organischen Chemie. Sie ist apparativ außerordentlich einfach durchzuführen. Auch hier werden Lösungsmittel als Hilfsphase benutzt. Voraussetzung für eine Trennung bzw. Reinigung durch Umkristallisation ist eine möglichst ausgeprägte Temperaturabhängigkeit der Löslichkeit. Die zu reinigende Substanz soll in heißem Lösungsmittel leichter löslich sein als in kaltem, was im allgemeinen zutrifft. Eine Trennung von Substanzen kann naturgemäß nur dann erfolgen, wenn sich ihre Löslichkeiten im selben Solvens stark unterscheiden. Die schwerer lösliche Substanz kristallisiert dann aus, die leichter löslichen (z. B. die Verunreinigungen) sollen in der Mutterlauge bleiben. Das Kristallisieren wird so lange wiederholt, bis das Kristallisat rein ist. Zur Kontrolle der Reinheit dient meistens die Bestimmung des Schmelzpunktes. Verunreinigungen setzen ihn herab (Schmelzpunktsdepression). Man kristallisiert so lange um, bis der Schmelzpunkt sich nicht mehr ändert. Entscheidend für das Gelingen einer Kristallisation ist die Wahl des richtigen Lösungsmittels; sie erfolgt empirisch, d.h. durch Probieren. Lösungsmittel zur Kristallisation sollen nicht zu gut lösen. Dies gilt besonders, wenn kleine Substanzmengen kristallisiert werden sollen. Findet man kein geeignetes Lösungsmittel, so ist es oft möglich, aus Lösungsmittelgemischen umzukristallisieren (Umlösen). Das Lösungsmittelgemisch ist so beschaffen, dass eine der Lösungsmittelkomponenten gut löst, die andere schlecht. Man löst dann die umzukristallisierende Substanz in dem gut lösenden Solvens, meist in der Hitze, und tropft langsam das schlecht lösende Solvens zu. Typische Beispiele sind Umkristallisation aus dem Paar Chloroform/Petrolether oder Ethanol/ Wasser. Die durch Filtration (Absaugen mit dem Hirsch- oder Büchner-Trichter) abgetrennten Kristalle müssen mit demselben (reinen!) Lösungsmittel bzw. Lösungsmittelgemisch gewaschen werden, damit Verunreinigungen aus der Mutterlauge nicht beim Trocknen an den Kristallen haften bleiben. Auch das zum Waschen der Kristalle verwendete Lösungsmittel muss entfernt werden. Dies geschieht durch Trocknen der Kristalle an der Luft (Abzug). Meist werden jedoch die Lösungsmittel durch Abpumpen der Dämpfe im Vakuumexsikkator entfernt. Der Trocknungseffekt im Exsikkator oder in der Trockenpistole kann durch sog. Trockenmittel, das sind Stoffe, welche die Lösungsmitteldämpfe absorbieren, unterstützt und beschleunigt werden. Gebräuchliche Trockenmittel sind Kieselgel (Blaugel, für Wasser und Alkohole), Calciumchlorid, Phosphorpentoxid, vorzugsweise in Granulatform (z. B. Siccapent). Säuredämpfe, wie z. B. Essigsäure, können durch Beschickung des Exsikkators mit festen Kaliumhydroxid-Plätzchen absorbiert werden. Unpolare Lösungsmittel - wie Petrolether - werden von Hartparaffin-Schnitzeln absorbiert, die man als Exsikkatorfüllung verwendet.
Kristalline Derivate zur Charakterisierung organischer Verbindungen
[Bearbeiten]Der "klassische" Weg zur Charakterisierung organischer Verbindungen mittels Schmelzpunkt ist bei flüssigen Substanzen nicht möglich. In diesen Fällen kann man durch Umsetzung mit bestimmten Reagentien kristalline Derivate herstellen, deren Schmelzpunkt bestimmt wird. Der Schmelzpunkt ist dann ein Charakteristikum der betreffenden Substanz. Außerdem lassen sich auf diese Weise funktionelle Gruppen im Molekül feststellen. Die Derivatisierungs-Technik hat an Bedeutung stark verloren, seit organische Verbindungen in erster Linie durch Spektren charakterisiert werden, die entweder nur winzige Substanzmengen benötigen, z. B. Massenspektren, oder die Substanz nicht zerstören, wie NMR, IR, UV. Eine gewisse Bedeutung haben Derivatisierungen auch heute noch zur Charakterisierung von Aminen, vor allem Alkaloiden, die verschiedene gut kristallisierende Salze (z. B. Pikrate) liefern, und zur Charakterisierung von Carbonylverbindungen, vor allem Ketonen. Diese bilden in rascher Reaktion 2,4-Dinitrophenylhydrazone und Semicarbazone (Versuch 3).
Dinitrophenylhydrazone und Semicarbazone werden nach folgenden Reaktionsgleichungen gebildet:
Versuche
[Bearbeiten]In organisch-chemischen Praktika wird die Herstellung von Semicarbazonen, 4-Nitrophenylhydrazonen und 2,4-Dinitrophenylhydrazonen seit langem zur Identifizierung von Aldehyden und Ketonen geübt. Es gibt verschiedene Vorschriften für diese analytischen Reaktionen. Schon in der vermutlich ersten deutschsprachigen Praktikumsanleitung zur organischen qualitativen Analyse von Hermann Staudinger (1923) wird eine kurze Vorschrift zur Herstellung von Semicarbazonen gegeben.[1] Ausführlichere Vorschriften findet man u.a. in
- Ralph L. Shriner und Reynold C. Fuson, The systematic identification of organic compounds, 3.Aufl., S.171, Wiley, New York u.a.O, 1948, und spätere Auflagen (1. Auflage 1935).
- Houben-Weyl, Methoden der organischen Chemie, 4. Aufl. Bd. 2, S. 446, 448, 449, Thieme, Stuttgart, 1953.
- Organikum, Organische-chemisches Grundpraktikum, 7. Aufl. VEB Deutscher Verlag der Wissenschften, Berlin, 1967 und spätere Auflagen.
- Hartmut Laatsch, Die Technik der organischen Trennungsanalyse, Thieme, Stuttgart, 1988.
Kaye und Yuska machten den Vorschlag, 2,4-Dinitrophenylhydrazone und Semicarbazone als Übungen für das Umkristallisieren und Identifizieren in organisch-chemischen Praktika herzustellen.[2]
Einzelnachweise
[Bearbeiten]- ↑ Hermann Staudinger, Anleitung zur organischen qualitativen Analyse, 1. Aufl. S. 62-63, Springer, Berlin 1923. Siehe auch die späteren Auflagen (mit W. Kern als Coautor).
- ↑ Irving Allan Kaye, Henry Yuska, Recrystallization and Melting Point Determination. An introductory organic exercise. J. Chemical Education 47, 703-704 (1970).
Ausschütteln, Flüssig-Flüssig-Extraktion
[Bearbeiten]Trennungen nach diesem Prinzip werden meistens in Scheidetrichtern durchgeführt. Diese enthalten zwei nichtmischbare oder nur wenig untereinander mischbare Flüssigkeiten von verschiedener Dichte. Die dichtere Flüssigkeit sinkt nach unten und bildet die Unterphase. Die Oberphase besteht aus der Flüssigkeit mit der geringeren Dichte. In der Regel ist die Unterphase Wasser oder eine wässrige Lösung von mit Wasser mischbaren organischen Solventien, z.B. niederen Alkoholen. Häufig enthält die wässrige Unterphase gelöste Salze, z. B. Natriumchlorid, wodurch deren Dichte noch erhöht wird. Als Oberphase dienen organische Lösungsmittel, wie niedere Alkane, z.B. Pentan und Hexan, Benzol, Toluol, und sehr häufig Diethylether. Dichlormethan, Trichlormethan (Chloroform) und Tetrachlormethan sind spezifisch schwerer als Wasser; sie erscheinen daher gegenüber diesem als Unterphase.
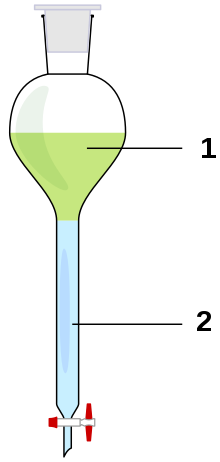
Bild 4-1: Ein Scheidetrichter mit Oberphase (1) und Unterphase (2).
Scheidetrichter werden in verschiedenen Formen hergestellt: kugelförmige, konische, zylindrische und aus diesen Grundformen kombinierte Geräte.
Bild 4-2: Konische und cylinderförmige Scheidetrichter.
Zum Ausschütteln kleiner Volumina, z. B. für Vorversuche oder GC und DC-Tests, kann man Reagenz- oder Zentrifugengläser verwenden, wobei man die beiden Phasen mit einer lang ausgezogenen Pipette (Pasteur-Pipette) aufsaugt.
Bild 4-3: Pasteur-Pipetten.

Bild 4-4: Ausschütteln kleiner Substanzmengen.
Das Nernstsche Verteilungsgesetz
[Bearbeiten]Eine Trennung kann erfolgen, wenn sich die Substanzen in den beiden flüssigen Phasen unterschiedlich verteilen. Die Verteilung einer Substanz wird durch den Nernstschen Verteilungssatz beschrieben: Das Verhältnis der Konzentrationen einer Substanz in den beiden Phasen ist konstant (ideales Verhalten vorausgesetzt, Aktivitätskoeffizienten werden nicht berücksichtigt). Die Gleichgewichtskonstante wird meist als Verteilungskoeffizient bezeichnet.
co = Konzentration in der Oberphase, cu = Konzentration in der Unterphase.
Das Nernstsche Verteilungsgesetz wird üblicherweise in Konzentrationen ausgedrückt. Der präparative und analytische Chemiker kann durch Wahl des Volumenverhältnisses der Ober- und Unterphase die Verteilung beeinflussen. Man definiert als Volumenverhältnis (Phasenverhältnis)[1]:
wobei Vo = Volumen der Oberphase, Vu = Volumen der Unterphase ist.
Die beiden Phasen enthalten die Substanzmengen xo (in Gramm oder mg ausgedrückt) und xu. Das Verhältnis dieser Substanzmengen im Gleichgewicht wird als Verteilungszahl definiert:
Ferner ist es nützlich, die relative Substanzmenge und die prozentuale Verteilung zu definieren. Die relative Substanzmenge in der Oberphase ist
in der Unterphase
Mithin ist also p + q = 1
Multipliziert man p und q mit dem Faktor 100, so erhält man die prozentuale Verteilung der Substanz:
P = 100 p, Q = 100 q, also P + Q = 100
Damit ist die Verteilungszahl auch gegeben durch die Beziehungen
Da P + Q = 100, gilt weiter
oder
und
oder
Mit diesen Definitionen lässt sich der Nernstsche Verteilungssatz folgendermaßen formulieren:
Da
und
d. h. Substanzmenge/Volumen
wird aus
oder
Übungsaufgabe
[Bearbeiten]Wässriger Tee-Extrakt (25 ml), vgl. Praktikumsversuch "Coffein aus Tee", soll mit verschiedenen Chlorkohlenwasserstoffen (spezifisch schwerere Lösungsmittel, Unterphase) einmal ausgeschüttelt werden. Wie viel Lösungsmittel benötigt man, damit 99 % des Coffeins in die organische Phase überführt werden? Folgende Werte für die Nernstschen Verteilungskoeffizienten von Coffein im System Organisches Lösungsmittel/Wasser bei 20 °C wurden ermittelt:[2]
- Dichlormethan (Methylenchlorid): Kcoffein = 8,0
- 1,2-Dichlorethan: Kcoffein = 2,9
- Trichlormethan (Chloroform): Kcoffein = 4,7
- Tetrachlormethan: Kcoffein = 0,12
Beachten Sie, dass diese K-Werte nicht der oben gegebenen Definition entsprechen, daher sollte hier zuerst der reziproke Wert 1/K berechnet werden.
Wiederholtes Ausschütteln
[Bearbeiten]Wie der Vergleich mit dem Resultat der voranstehenden Übungsaufgabe zeigt, ist es ökonomischer, anstelle eines einmaligen Ausschüttelns wiederholt mit kleineren Mengen Lösungsmittel auszuschütteln: Man braucht weniger Lösungsmittel und daher auch weniger Zeit zum anschließenden Abdestillieren der Hilfsphase.
Übungsaufgabe zum Praktikumsversuch "Coffein aus Tee"
[Bearbeiten]a) Berechnen Sie die prozentuale Verteilung P und Q in der Wasserphase und Dichlormethanphase, wenn Coffein (K = 8,0) in 25 ml Wasser mit 12,5 ml Dichlormethan ausgeschüttelt wird.
b) Wie viel Prozent des ursprünglich vorhandenen Coffeins sind aus der wässrigen Phase (25 ml) extrahiert worden, wenn man diese dreimal mit je 12,5 ml Dichlormethan ausschüttelt? Vergleiche den Lösungsmittelverbrauch (3 mal 12,5 ml) mit dem der vorigen Übungsaufgabe.
Kontinuierliche Extraktion
[Bearbeiten]Wenn Verteilungskoeffizienten sehr groß oder sehr klein sind, genügt mehrmals wiederholtes Ausschütteln nicht, um Substanzen zu >99 % in der spezifisch schwereren bzw. leichteren organischen Phase anzureichern. Man kann dieses dadurch erreichen, indem man die organische Hilfsphase kontinuierlich durch die wässrige Phase strömen lässt. Es gibt Extraktionsgeräte für spezifisch leichte organische Lösungsmittel, z.B. Diethylether oder Hexan (Hilfsphase steigt nach oben) und spezifisch schwere Lösungsmittel, z. B. Methylenchlorid oder Chloroform. Bild 4-5 zeigt schematisch ein Gerät für eine spezifisch leichte Extraktionsflüssigkeit, den Kutscher-Steudel-Apparat.

Bild 4-5. Flüssig-Flüssig-Extraktion im Kutscher-Steudel-Apparat (schematisch). Die wässrige Phase ist blau gezeichnet.
In einem Siedegefäß wird Diethylether erhitzt. Der Dampf tritt durch ein schräg nach oben verlaufendes „Knierohr“ in den Apparat ein und gelangt schließlich zu einem Rückflusskühler, wo er kondensiert wird. Die Tropfen werden in einem trichterförmigen Glaseinsatz aufgefangen, der am unteren Ende eine Öffnung besitzt. Der Einsatz steckt in einem zylindrischen Gefäß, in dem sich die vorher eingefüllte zu extrahierende wässrige Lösung befindet. Am Ende des Einsatzes - im Bild mündet er in eine grobporige Glasfritte - kommt der Ether in Kontakt mit der wässrigen Lösung; die Tropfen wandern einzeln nach oben, da sie spezifisch leichter sind als Wasser. Auf ihrem Weg werden sie mit den extrahierbaren Substanzen beladen und sammeln sich über der Wasserphase. Sobald der Spiegel des Ethers das „Knierohr“ erreicht hat, fließt die organische Phase in das Siedegefäß zurück, wo sie wieder verdampft wird. Auf diese Weise reichern sich die Substanzen langsam im Siedekolben an. Nach Abkühlen kann der Ether-Extrakt analytisch untersucht werden.
Die kontinierliche Extraktion nach diesem Prinzip wird von Chemikern auch als ’Perforation‘ bezeichnet. Dieser Ausdruck ist jedoch unglücklich: er leitet sich vom Lateinischen foramen (= Loch) ab, siehe Perforation. Die Methode hat jedoch kein Loch! Nur Teile des Gerätes zur Extraktion können perforiert sein, also Löcher haben (durch welche Flüssigkeitstropfen wandern können), z. B. eine Glasfritte.
Zur kontinuierlichen Extraktion mit spezifisch schwereren Lösungsmitteln (Chloroform, Dichlormethan u.a.) wird meistens der Extraktionsapparat nach Wehrli eingesetzt.[3]
Beziehungen zwischen Verteilungskoeffizient und Molekülstruktur
[Bearbeiten]Im organischen Laboratorium sind in erster Linie Verteilungen zwischen Wasser und organischen Lösungsmitteln, die mit Wasser eine nur beschränkte Löslichkeit zeigen ((vgl. Tab. 4), wichtig. Häufig verwendete organische Lösungsmittel zur Verteilung sind Pentan (niedriger Siedepunkt!), Hexan, Petrolether, Cyclohexan, Dichlormethan, Chloroform, Dieth.ylether, Ethylacetat, also relativ unpolare Solventien. Was den zu verteilenden Stoff angeht, so ist es nützlich, aprotonische Moleküle von protonischen Molekülen zu unterscheiden. Die Verteilung eines aprotonischen organischen Stoffes zwischen einem unpolaren Solvens (z. B. Hexan, Cylohexan) und Wasser hängt ab:
- von der Molekülgröße des gelösten Stoffes. Je voluminöser das Molekül, desto mehr reichert es sich in der unpolaren Phase an,
- vom Dipolmoment des gelösten Stoffes. Je größer dieses ist, desto mehr reichert sich der Stoff in der Wasserphase an,
- von der Wasserstoffbrücken-Akzeptor-Basizität (HBA-Basizität) des gelösten Stoffes. Je größer diese ist, desto mehr reichert sich der Stoff in der Wasserphase an.
Der letzte Effekt ist, wenn die Voraussetzungen dazu vorliegen, bei weitem der wichtigste.
Wenn der zu verteilende Stoff selbst protonisch ist, besitzt er durch seinen Wasserstoffbrücken-Donor-Charakter (HBD-Acidität) die Fähigkeit zu weiteren starken Wechselwirkungen mit organischen Phasen, die HBA-Charakter haben, z. B. Diethylether, Ethylacetat. Zum Ausschütteln sind diese Lösungsmittel daher geeigneter als Kohlenwasserstoffe.
Die Beispiele in den Tabellen 6 und 7 sollen diese allgemeinen Betrachtungen illustrieren.
Tabelle 6.[4]

| Verbindung | Formel | Hexan/Wasser | Diethylether/Wasser |
|---|---|---|---|
| Methanol | CH3OH | 0,0015 | 0,14 |
| 1-Butanol | CH3CH2CH2CH2OH | 0,31 | 7,7 |
| 2,3-Butandiol | CH3CH(OH)CH(OH)CH3 | 0,000325 | 0,029 |
| Glycerin | HOCH2CH(OH)CH2OH | ? | 0,00066 |
| Ameisensäure | HCOOH | 0,36 | |
| Essigsäure | CH3COOH | 0,48 | |
| Propionsäure | CH3CH2COOH | 1,59 | |
| Buttersäure | CH3CH2CH2COOH | 4,76 | |
| Pivalinsäure | (CH3)3CCOOH | 12,99 | |
| Glykolsäure | HOCH2COOH | 0,028 |
Verteilungen zwischen Wasser und lipophilen Phasen haben nicht nur für Trennungen und Analysen in der organischen Chemie, sondern auch in der Biologie, Biologischen Chemie und Medizinischen Chemie eine enorme Bedeutung. So ließ sich die narkotische Aktivität vieler einfacher organischer Moleküle mit den Verteilungskoeffizienten zwischen Olivenöl/Wasser, einem Modell für die Verteilung zwischen der Fettphase von Nervenzellen und wässriger Körperflüssigkeit, korrelieren. Auch die Fähigkeit organischer Chemikalien, Pflanzenzellmembranen zu durchdringen, lässt sich mit Verteilungskoeffizienten im System Öl/Wasser korrelieren.
Corvin Hansch führte als Modell für die Verteilung in biologischen Systemen (lipophile Phase/wässrige Lösung) die Solvens-Kombination 1-Octanol/Wasser ein, für die zahlreiche Verteilungskoeffizienten bestimmt wurden. Tabelliert werden die Logarithmen der Verteilungskoeffizienten log K, von Hansch als log P (von P = partition, Verteilung) bezeichnet.
Die Größe log P kann daher als empirisches Maß für die Liphophilie, manchmal auch Hydrophobie genannt, betrachtet werden.
Es wurde gefunden, dass sich diese log-P-Werte im System Octanol/Wasser sogar quantitativ abschätzen ("berechnen") lassen, indem man Inkremente von Teilstrukturen und Substituenten addiert. Außerdem können die log P-Werte mit dem Hildebrandschen Löslichkeitsparameter δ und den Polaritätsparametern π* und β linear korreliert werden.
Diese qualitativen Beziehungen ließen sich an einigen Beispielen auch quantifizieren: Der Logarithmus des Verteilungskoeffizienten log K im System Cyclohexan-Wasser gibt eine lineare Korrelation mit dem Molvolumen des gelösten Stoffes (V), dem Polaritätsparameter π* und dem Parameter der HBA-Basizität α (siehe Kap. 1).[5]: log K (C6H12/H2O) = -0.05 + 3.69 V/100 - 1.15 π* - 5.64 α
Tabelle 8 zeigt einige Beispiele für Verteilungen im System 1-Octanol/Wasser.[6]

Der Trennfaktor
[Bearbeiten]Sollen zwei Substanzen A und B durch Verteilung zwischen zwei nicht mischbaren flüssigen Phasen getrennt werden, so müssen ihre Verteilungskoeffizienten verschieden groß sein. Unterscheiden sie sich nur wenig, so erhält man lediglich eine Anreicherung einer Komponente gegenüber der anderen:

Die Wirksamkeit einer Trennung wird durch den Trennfaktor β beschrieben, der folgendermaßen definiert ist:
Da
und
ergibt sich
Der Trennfaktor ist also gleich dem Verhältnis der Verteilungskoeffizienten der Substanzen A und B. Ist KA = KB, d. h. β = 1, so ist eine Trennung durch Verteilung prinzipiell unmöglich. Durch eine einmalige Verteilung lassen sich Substanzen nur dann befriedigend trennen, wenn β > 100 ist, d. h. die Verteilungskoeffizienten müssen sich möglichst stark unterscheiden.
Im wässrig/organischen Lösungsmittelsystem ist dies mit Sicherheit der Fall, wenn die eine Komponente (A) eine aprotonische Neutralsubstanz, die andere (B) eine ionogene Verbindung (Salz) ist. So lassen sich anorganische Salze, die beim Neutralisieren von Reaktionsansätzen entstehen, von organischen Verbindungen meistens dadurch abtrennen, dass man das Gemisch zwischen Ether und Wasser verteilt: die Salze gehen in die wässrige, die organischen Verbindungen in die etherische Phase. Organische Säuren und Neutralsubstanzen lassen sich häufig dadurch trennen, dass man die ersteren mit wässrigen Basen, z. B. 5 % NaOH- oder KOH-Lösung, aus etherischer Lösung herausextrahiert. Für die selektive Extraktion von Carbonsäuren genügt die schwächere Base Natriumhydrogencarbonat. So lassen sich z. B. Phenole (pKa = ca. 10) von Carbonsäuren (pKa = ca. 4.7) trennen.

Bild 4-6: Trennung von Benzaldehyd und Benzoesäure durch Verteilung.
Organische Basen und Neutralsubstanzen (erstere können z. B. Amine, basische Stickstoff-Heterocyclen oder Alkaloide sein) lassen sich oft trennen, indem man zwischen Ether und verdünnter wässriger Salzsäure (ca. 5 % HCl) verteilt. Die organischen Stickstoffbasen werden am N protoniert; die entstehenden Ammoniumsalze werden durch Wasser besser solvatisiert als durch Ether und gehen daher in die wässrige Phase. Die Abbildungen 4-6 und 4-7 demonstrieren zwei charakteristische Beispiele.
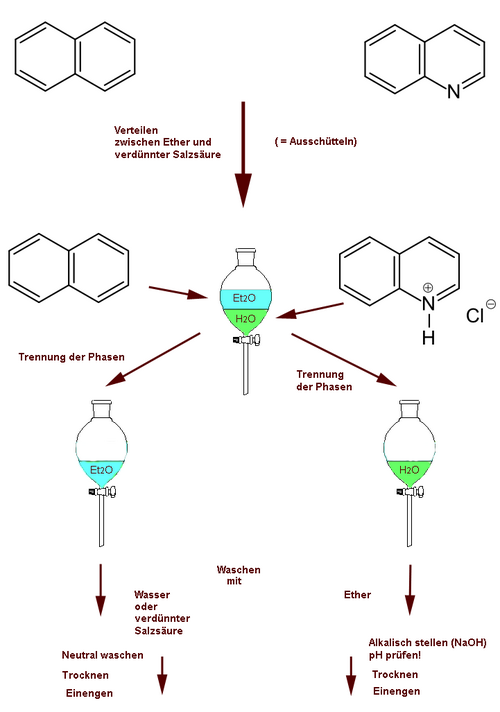
Bild 4-7. Trennung von Naphthalin und Chinolin durch Verteilung
Das Trocknen von Flüssig/Flüssig-Extrakten
[Bearbeiten]Beim Ausschütteln oder kontinuierlichen Extrahieren wässriger Lösungen wird in die organische Phase Wasser eingeschleppt. Da auch mit Wasser "nicht mischbare" Lösungsmittel mehr oder weniger große Mengen an Wasser lösen können (vgl. Kapitel 1, Tab. 4), werden diese nach einer Extraktion mit Wasser gesättigt sein. Bevor man den organischen Extrakt weiter verarbeitet, muss man das Wasser entfernen, was man das "Trocknen" der Extrakte nennt. Unterlässt man dies, so können Störungen im weiteren Gang der Aufarbeitung oder Minderung der Ausbeute eintreten. So kann sich beim anschließenden Abdestillieren der leichtflüchtigen Lösungsmittel das Wasser im Rückstand anreichern und die Kristallisation verzögern oder verhindern. Hydrolyseempfindliche Stoffe können beim Abdestillieren des wasserhaltigen Lösungsmittels reagieren. Im harmlosesten Fall wird der Rückstand von Wassertröpfchen durchsetzt sein, die anders schwierig zu entfernen sind. Trockenmittel für Extrakte sind wasserfrei getrocknete anorganische Salze, die Hydrate bilden:
MetXm + n H2O → ← MetXm × H2O
Am häufigsten werden verwendet:
- Calciumchlorid, CaCl2,
- Natriumsulfat, Na2SO4,
- Magnesiumsulfat, MgSO4,
- Calciumsulfat, CaSO4.
Um Säurespuren, wenn noch vorhanden, aus Extrakten zu entfernen, kann man auch mit wasserfreiem Kaliumcarbonat (Pottasche) trocknen, einem leicht basischen Trockenmittel. Natriumhydroxid oder Kaliumhydroxid dienen weniger zum Trocknen von Extrakten als vielmehr von Lösungsmitteln, Pyridin oder Aminen. Die verschiedenen Trockenmittel unterscheiden sich in ihrer Aufnahmefähigkeit für Wasser und im Trocknungsgrad, den sie liefern. In Tabelle 9 sind die möglichen Hydrate der oben genannten Trockenmittel angegeben.
| Trockenes Salz | Maximaler Kristallwassergehalt n H2O | Gleichgewichtsdampfdruck des H2O über dem Hydrat bei Raumtemperatur |
|---|---|---|
| CaCl2 | 6 H2O | 3,5 Torr |
| Na2SO4 | 10 H2O | ?? |
| MgSO4 | 7 H2O | 11,5 Torr |
| CaSO4 | 2 H2O | 0,004 Torr |
Die Aufnahmefähigkeit eines Trockenmittels für Wasser wird durch den Begriff der Trocknungskapazität ausgedrückt, der angibt, wie viel Gewichtsprozent Wasser das betreffende wasserfreie Trockenmittel aufnehmen kann:
- Trocknungskapazität (%) =
Die Trocknungsintensität, d. h. wie "scharf" ein Trockenmittel trocknet, wird durch den Gleichgewichtsdampfdruck des Wassers über dem Salzhydrat bestimmt. Tabelle 9 zeigt, dass sich die üblichen Trockenmittel hierin unterscheiden: Calciumsulfat ("Drierite", registriertes Warenzeichen) hat eine besonders hohe Trocknungsintensität, aber eine geringe Trocknungskapazität - es bindet nur 1/2 Moläquivalent H2O. Daher kann man Lösungen mit Calciumsulfat "feintrocknen", nachdem sie - zur Entfernung der Hauptmenge an Wasser - mit einem der anderen Trockenmittel "vorgetrocknet" worden sind.
Für die praktische Durchführung des Trocknens sollte man folgendes beachten:
- Verwenden Sie nur Trockenmittel einwandfreier Qualität, d.h. solche, die wirklich wasserfrei sind. In der Regel muss man Trockenmittel vor Gebrauch entwässern, was durch Ausheizen ("Glühen") auf einem Blech oder in einer Eisenschale getan wird. Das ausgeheizte Trockenmittel sollte rasch in eine dicht verschließbare Vorratsflasche abgefüllt werden, wo man es abkühlen lässt. Selbstverständlich darf noch warmes Trockenmittel nicht in organische Lösungen gegeben werden.
- Das Trocknen braucht genügend Zeit, denn es ist ein Diffusionsprozess zwischen flüssiger und fester Phase. Gelegentliches Umschütteln oder magnetisches Rühren erhöht die Trocknungsgeschwindigkeit. Wenn nicht gerührt wird, sollte mehrere Stunden, am besten über Nacht, getrocknet werden.
- Nicht übertrieben viel Trockenmittel nehmen; durch Adsorption kann Substanz verloren gehen. Beim Abfiltrieren des Trockenmittels müsste man dieses mit einem Übermaß an getrocknetem (!) Lösungsmittel auswaschen. Am besten trocknet man den Extrakt kurze Zeit mit wenig Trockenmittel vor, dekantiert vom Trockenmittel ab und gibt dann frisches Trockenmittel zur Lösung, das man längere Zeit einwirken lässt.
- Das Trockenmittel muss abfiltriert und mit trockenem Lösungsmittel ausgewaschen werden, bevor man das Lösungsmittel abdestilliert. Sonst kann beim Destillieren Hydratwasser zum Teil reversibel freigesetzt werden.
- Calciumchlorid ist als Trockenmittel nicht für alle Stoffe geeignet. Es kann Komplexe bilden mit vielen Alkoholen, Aminen und einigen Estern und Ketonen. Das handelsübliche wasserfreie Calciumchlorid kann durch den industriellen Entwässerungsprozess etwas basische Calciumsalze enthalten, die Carbonsäuren und Phenole binden können. Im Zweifelsfalle also lieber Magnesiumsulfat oder Natriumsulfat verwenden.
Einzelnachweise
[Bearbeiten]- ↑ Die folgenden mathematischen Ableitungen und Beziehungen sind den Büchern von E. Hecker, Verteilungsverfahren im Laboratorium, Verlag Chemie, Weinheim 1955, und R. Bock, Methoden der Analytischen Chemie, Bd. 1, S. 24, Verlag Chemie, Weinheim 1973 entnommen.
- ↑ G. S. Klebanov, L. N. Mednikova, A. D. Ovcharova, Extraction of caffeine from aqueous solutions, Pharmaceutical Chemistry Journal, 1, 221-223 (1967); translated from Khimiko-Farmatsevticheskii Zhurnal, No. 4, pp.49-52, April, 1967. DOI: 10.1007/BF00770195
- ↑ S. Wehrli, Ein Apparat zur Extraktion von Lösungen mit schwereren Lösungsmitteln, Helv. Chim. Acta 20, 927 (1937).
- ↑ C. Hansch, A. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, Wiley-Interscience, New York, 1979.
- ↑ M. J. Kamlet, M. H. Abraham, R. M. Doherty und R. W. Taft, J. Am .Chem. Soc. 106, 464 (1984).
- ↑ C. Hansch, A. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, Wiley-Interscience, New York, 1979.
Literatur
[Bearbeiten]- E. Hecker, Verteilungsverfahren im Laboratorium, Verlag Chemie, Weinheim 1955.
- R. Bock, Methoden der Analytischen Chemie, Bd. 1, Verlag Chemie, Weinheim 1973.
- Informationsschrift der E. Merck AG, Trocknen im Laboratorium, Darmstadt
Versuche
[Bearbeiten]- Praktikum Organische Chemie/ Extraktion/ Coffein aus Tee
- Praktikum Organische Chemie/ Versuche/ Sonstiges/ Verteilung von Azofarbstoffen zwischen 1-Octanol und Wasser
- Praktikum Organische Chemie/ Abtrennung von Benzoesäure aus autoxidiertem Benzaldehyd
Durch systematische Wiederholung von Verteilungsschritten lassen sich auch Substanzen trennen, die sich in ihren Verteilungskoeffizienten bzw. Trennfaktoren weniger unterscheiden.
Ein apparativ aufwendiges Verfahren ist die Gegenstromverteilung, welche jedoch in Praktika der Organischen Chemie keine Rolle spielt. Systematisch wiederholte Verteilungsschritte lassen sich mit einfacheren Mitteln durch die Methoden der Verteilungschromatographie realisieren, insbesondere in der Variante der Schichtchromatographie.
Verteilungs-Schichtchromatographie
[Bearbeiten]Prinzip der Trennung
[Bearbeiten]Die Anordnung zur Schichtchromatographie basiert auf einem Träger (Glasplatte, Aluminium- oder Kunststoff-Folie), der mit einem Sorbens beschichtet wird. Dieses dient dazu, die stationäre flüssige Phase aufzunehmen, d.h. es wird mit dieser imprägniert. Die Imprägnierung kann vor der Chromatographie oder auch während des Trennvorganges (kontinuierlich) erfolgen. Die mobile Phase, welche in der Schichtchromatographie auch als Fließmittel oder Laufmittel bezeichnet wird, strömt über die stationäre Phase.
Zur Trennung wird die zu analysierende Lösung des Stoffgemisches mit einer Mikropipette tropfenweise („Auftüpfeln“) oder als kurzer "Strich“ auf die Schicht aufgetragen. Nachdem das Lösungsmittel verdunstet ist, bringt man die Platte bzw. Folie in eine Trennkammer, die vorher mit einem für die "Entwicklung" geeigneten Lösungsmittel(gemisch) beschickt wurde. Der aufgebrachte Fleck (engl. Spot) bzw. die strichförmige Zone wandert nun langsam durch die Schicht; Kapillarkräfte bewirken die Wanderung, bei der eine Trennung der Komponenten erfolgen kann.
Die am Start aufgetragene Substanzmischung (A und B, Bild 5-1) setzt sich mit stationärer und mobiler Phase ins Verteilungsgleichgewicht. Eine bestimmte Wegstrecke entspricht einer theoretischen Trennstufe. Je weiter die mobile Phase fortschreitet, desto mehr Trennstufen lassen sich realisieren.
Bild 5-1. Prinzip der Verteilungs-Chromatographie in einer Schicht. Auf dem Träger befindet sich die stationäre Phase (blau). Die mobile Phase (grün) in einem Vorratsgefäß wandert über die stationäre Phase. Die Verteilung der Analysensubstanz wird durch die (Halb)kreise symbolisiert.
Unterscheiden sich die Substanzen A und B in ihren intermolekularen Wechselwirkungskräften, so werden sie durch das Fließmittel mit verschiedenen Geschwindigkeiten weiter transportiert. Moleküle mit hoher Affinität zur stationären Phase werden stärker festgehalten ("retentiert"). Die Konzentrationen der Substanzen bilden im Idealfall ein kegelförmiges Profil (Berge), welche in Seitenansicht Glockenkurven entsprechen. In Aufsicht ("von oben") erscheinen die Berge als kreisrunde Flecken, im Idealfall. In der Realität sind sie jedoch häufig zu einer Ellipse "verzogen" oder bilden "Schwänze" aus (engl. tailing).
Bild 5-2. Schichtchromatographie im Verteilungsmodus.
Man beschreibt das chromatographische Verhalten der Substanzen durch den Retentionsparameter Rf. Dazu misst man die Laufstrecke, welche das Fließmittel zurückgelegt hat, die Front der mobilen Phase (c), und die Strecken, welche die Substanzen zurückgelegt haben (a bzw. b). Der Rf-Wert ist definiert als
Rf = a/c bzw. Rf = b/c.
Im Gegensatz zu Schmelz- und Siedepunkten lassen sich die Rf-Werte jedoch nicht sehr genau definieren, da sie von verschiedenen, schwierig zu reproduzierenden Faktoren abhängen. Daher tüpfelt man meistens in einigem Abstand zum Startfleck von (A+B) oft eine Standard-Substanz auf, deren Rf-Wert ebenfalls vermessen wird. In vielen Fällen wählt man als Standard die im Gemisch nachzuweisende Substanz, z.B. Substanz A in reiner Form.
Wollte man beispielsweise Coffein in Getränken (Coca-Cola) oder "Schmerztabletten" nachweisen (Versuch #), so würde man reines Coffein als Standard auftüpfeln. Sind dann die Laufstrecken, d.h. die Rf-Werte gleich, ist die Wahrscheinlichkeit hoch, dass Standard und Analysensubstanz identisch sind. Die gleichen Rf-Werte könnten jedoch Zufall sein! Daher sollten mindestens zwei Versuche mit verschiedenen Fließmitteln gemacht und/oder die Substanzflecke mittels Nachweisreagentien (Sprühreagentien) weiter identifiziert werden.
Arbeitstechniken
[Bearbeiten]- Horizontale Entwicklung
Die im Modell dargestellte horizontale Entwicklung wird im organischen Praktikum selten angewandt (Sandwich-Technik). Eine Ausnahme ist die Cirkular-Technik, bei der die Substanzmischung im Zentrum einer Schicht auf einem quadratischen Träger aufgebracht wird. Die mobile Phase wird kontinuierlich im Zentrum zugeführt. Bei der Entwicklung bilden die Moleküle dann kreisförmige Zonen um den Mittelpunkt (Bild 5-3).

Bild 5-3. Prinzip der Circularchromatographie
- Aufsteigende Entwicklung
Diese Methode wird am meisten verwendet. Man benötigt dazu eine Trennkammer, welche zylindrisch oder quaderförmig sein kann. Am Boden der Trennkammer befindet sich die mobile Phase (Trennflüssigkeit). Der Träger (Folie, Glasplatte) mit der Trennschicht wird vertikal in der Kammer aufgestellt.

Bild 5-4. Zylindrische Trennkammer.
Bei der zweidimensionalen Entwicklung verwendet man eine Platte oder Folie von quadratischem Format. Die Lösung der zu analysierenden Substanzmischung muss punktförmig in der Nähe eines Ecks aufgetragen werden. Nach Beendigung der ’eindimensionalen‘ Entwicklung lässt man das Fließmittel im Abzug verdampfen. Dann dreht man die Platte (Folie) um 90° und lässt in der Trennkammer ein zweites Mal entwickeln, wobei evt. ein anderes Fließmittel gewählt wird. Die Flecke der getrennten Komponenten haben sich dann über die quadratische Schicht verteilt. Zum Beispiel wurden Gemische von Aminosäuren auf diese Weise getrennt.

Bild 5-5. Zweidimensionale Dünnschichtchromatographie (schematisch). Grün: Startlinie, Rot: Front der mobilen Phase.
Stationäre Phasen
[Bearbeiten]Wie eingangs beschrieben, sollte ein Sorbens nur die stationäre Phase fixieren und im Übrigen inert sein. Allerdings ist dieses Bild vereinfacht; denn in der Praxis ist das Sorbens selbst nicht ohne Wirkung beim Trennprozess. Die Oberfläche des Sorbens spielt ebenfalls eine Rolle. Daher ist es realistischer, das ganze "System Sorbens + stationäre Phase“ als Einheit ("Sorptionsmilieu“) zu betrachten.
Da beim Chromatographieren im Verteilungsmodus in der Regel wasserhaltige mobile Phasen verwendet werden (s.u.) sollte eine Wasserschicht auf dem Träger haften. Daraus folgt, dass in diesem Falle Sorbentien mit polarem, hydrophilem Charakter geeignet sind: Kieselgel und Cellulose adsorbieren Wasser sehr gut.
Der umgekehrte Fall, eine unpolare stationäre Phase mit einer polaren mobilen Phase, d. h. ein Solvens, das mit Wasser mischbar ist, wurde u.a. durch "Imprägnierung" des Sorbens mit schwerfüchtigen Kohlenwasserstoffen versucht. Diese Technik hat sich jedoch nicht durchgesetzt, da die Imprägnierung schlecht haftete und durch die mobile Phase ausgewaschen werden konnte. Erst mit der Methode der Umkehrphasen-Chromatographie (Reversed Phase Chromatography) wurde das Ziel erreicht. Sie ist jedoch keine Flüssig-Flüssig-Verteilung im strengen Sinn und wird daher im Kapitel "Adsorptions-Schichtchromatographie" behandelt.
- Kieselgel
Für die Schichtchromatographie wird spezielles Kieselgel benötigt, worauf im Kapitel "Adsorptions-Schichtchromatographie" eingegangen wird.
- Cellulosepulver
Cellulose adsorbiert bekanntlich Wasser bereits an feuchter Luft. Dafür sind die zahlreichen HO-Gruppen dieses Makromoleküls verantwortlich.
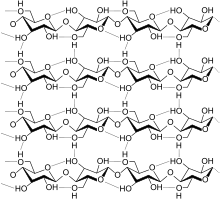
Bild 5-6. Formel eines Ausschnitts einer Cellulosefaser.
Historisch gesehen wurde Cellulose erstmals mit der Methode der Papierchromatographie zu Trennungen eingesetzt. Nachdem Cellulosepulver kommerziell verfügbar geworden war, konnte man aus diesem Material einen Brei anrühren und Glasplatten oder Folien damit beschichten. Diese Trennschichten zeigten eine höhere Trennleistung als Papier, sind allerdings teurer.
Fließmittel
[Bearbeiten]Als mobile Phasen wählt man meistens Gemische von Wasser mit Lösungsmitteln, die teilweise mit Wasser mischbar sind. Ein Standard-Fließmittel ist das System Butanol-Essigsäure-Wasser. Zur Chromatographie basischer Verbindungen wird u.a. eine Mischung von Butanol mit verdünnter wässrige Ammoniak-Lösung verwendet. Eine lange Zeit in Vergessenheit geratene Methode zur Trennung von Verbindungen in analytischem Maßstab ist die Papierchromatographie. Die Methode hatte ihren Höhepunkt in den Jahren ca. 1950 bis 1960, wurde aber dann zunehmend von der Dünnschichtchromatographie verdrängt. Beide Methoden sind Varianten der schichtchromatographischen Verfahren, die apparativ geringe Anforderungen stellen. Bereits 1855 veröffentlichte der Chemiker Friedlieb Ferdinand Runge seine "Musterbilder für Freunde des Schönen", die er auf Filtrierpapier mit farbbildenden Chemikalien erzeugte.[1]
Die Bedeutung seiner Entdeckung für die analytische Chemie erkannte er jedoch nicht. Erst 1944 wurde von Consden, Gordon und Martin die Papierchromatographie als Methode vorgestellt.[2] Diese chromatographische Methode wird an speziellen, saugfähigen Papiersorten durchgeführt, die im Handel erhältlich sind. Einfache Trennungen zur Demonstration in der Schule lassen sich schon mit Kaffeefilterpapieren durchführen. Zur Trennung wird die zu analysierende Lösung des Stoffgemisches mit einer Mikropipette tropfenweise („Auftüpfeln“) oder als kurzer Strich“ auf das Papier aufgetragen. Nachdem das Lösungsmittel verdunstet ist, bringt man das Papier in eine Trennkammer, die vorher mit einem für die „Entwicklung“ geeigneten Lösungsmittel(gemisch) beschickt wurde. Der aufgebrachte Fleck bzw. die strichförmige Zone, wandert nun langsam durch das Papier; Kapillarkräfte bewirken die Wanderung, bei der eine Trennung der Komponenten erfolgen kann.
Trennmechanismen
[Bearbeiten]Wie bei den meisten chromatographischen Methoden, sind komplexe Vorgänge für die Trennung verantwortlich. Die Cellulosefasern tragen an ihrer Oberfläche HO-Gruppen, die als Wasserstoffbrücken-Donoren wirksam werden können. Stark vereinfacht kann man jedoch die Papierchromatographie in vielen Fällen als systematisch wiederholte Verteilung betrachten. Die Cellulosefasern des Papiers enthalten nämlich stets adsorbierte Wassermoleküle. Außerdem enthalten die üblichen „Fließmittel“ („Laufmittel“) zum „Entwickeln“ des Papierchromatogramms Wasser. Damit wird während des Entwicklungsprozesses die Oberfläche der Cellulose weiter mit Wassermolekülen beladen. Die Trennung kann man daher als Verteilung der Verbindungen zwischen einer (stationären) Wasserphase und einem organischen Lösungsmittel (mobile Phase) betrachten, welche systematisch wiederholt wird. Im Modell der Verteilungs-Schichtchromatographie (Bild 5-1) stellt das Papier sowohl die Trägerschicht als auch das Sorbens dar. Das adsorbierte Wasser bildet die stationäre Phase, über welche das Fließmittel zieht. Die am Start aufgetragene Substanzmischung (A und B) setzt sich mit stationärer und mobiler Phase ins Verteilungsgleichgewicht. Eine bestimmte Wegstrecke entspricht einer theoretischen Trennstufe. Je weiter die mobile Phase fortschreitet, desto mehr Trennstufen lassen sich realisieren.
Arbeitstechniken
[Bearbeiten]- Horizontale Entwicklung
Die im Modell (Bild 5-1) dargestellte horizontale Entwicklung wird selten angewandt. Eine Ausnahme ist die Rundfilter-Technik, eine Variante der Cirkular-Chromatographie, bei der die Substanzmischung im Zentrum eines runden Papiers aufgebracht wird. Bei der Entwicklung wandern die Moleküle dann in kreisförmigen Zonen um den Mittelpunkt. Die erwähnten "Rungeschen Bilder" sind historische Vorläufer dieser Technik.

Bild 6-1. Rundfilterchromatographie,schematisch.
- Absteigende Entwicklung
Für diese Methode werden große Glaströge benötigt, in denen sich ein Gestell befindet, in das die mit dem Fließmittel gefüllte Schale eingelegt werden kann. Das lange Chromatographiepapier wird durch einen Glasstab in der Schale fixiert. Durch Kapillarkräfte und Schwerkraft wandert die mobile Phase nach unten.



Bild 6-2. Absteigende Entwicklung eines Papierchromatogramms.
- Aufsteigende Entwicklung
Diese Methode wird am meisten verwendet, da die Trennkammer kleiner sein kann als bei der Absteigenden Methode, und kein Gestell benötigt wird. Allerdings muss das Papier steif sein, damit es sich beim Aufsaugen des Fließmittels nicht durchbiegt. Oder man benötigt, wie im Bild gezeigt, eine Halterung.

Bild 6-3. Papierchromatographie in aufsteigender Entwicklung.
Fließmittel
[Bearbeiten]Als moblile Phasen wählt man meistens Gemische von Wasser mit Lösungsmitteln, die teilweise mit Wasser mischbar sind. Ein Standard-Fließmittel ist das System Butanol-Essigsäure-Wasser. Zur Chromatographie basischer Verbindungen wird u.a. eine Mischung von Butanol und verdünnter wässriger Ammoniak-Lösung verwendet.
Auswertung
[Bearbeiten]Nachdem die Front des Fließmittels in der Nähe des Papierrandes angelangt ist, wird das lösungsmittelgesättigte Papier vorsichtig aus der Trennkammer genommen, und die Front mit einem Bleistift markiert. Im Abzug(!) lässt man das Papier trocknen. Darauf markiert man die Flecken mit einem Bleistift, falls sie farbig sind. Um farblose Verbindungen nachzuweisen, sprüht man Nachweisreagentien auf, lässt wiederum trocknen (Abzug(!) und markiert die Flecken. Durch Ausmessen mit dem Lineal werden die Rf-Werte ermittelt, wie im Kapitel "Verteilungs-Schichtchromatographei" beschrieben.
Einzelnachweise
[Bearbeiten]- ↑ G. Harsch und H.H. Bussemas, Der Chemiker Runge und seine "Musterbilder für Freunde des Schönen" - Anregungen zu einem Spiel mit Farben. 2. Auflage (Reprint der 1. Auflage), Aulis-Verlag, ISBN: 978-3-7614-2495-7.
- ↑ R. Consden, A.H. Gordon, A. J. P. Martin, Qualitative analysis of proteins: a partition chromatography method using paper, Biochem. J. 38, 224-232 (1944).
Literatur
[Bearbeiten]- Friedrich Cramer, Papierchromatographie, 5. Aufl., Verlag Chemie, Weinheim, 1962 und frühere Auflagen.
Versuche
[Bearbeiten]Trennungen durch Adsorptions-Schichtchromatographie
[Bearbeiten]Diese Variante der Schichtchromatographie unterscheidet sich apparativ kaum von der Verteilungs-Schichtchromatographie. An die Stelle der stationären Phase tritt jedoch hier ein Adsorbens, über das sich die mobile Phase bewegt. Adsorptions- und Desorptions-Schritte werden so systematisch wiederholt. Dies führt dazu, dass Substanzen, die vom Adsorbens verschieden stark gebunden werden, von der mobilen Phase (Fließmittel, Laufmittel) mit unterschiedlichen Geschwindigkeiten transportiert werden. In der Praxis werden auch bei der Verteilungs-Schichtchromatographie Adsorptionsmechanismen wirksam, so dass häufig Mischmechanismen vorliegen. So hat auch eine Cellulose- bzw. Papierschicht durch die Hydroxygruppen ein gewisses Adsorptionsvermögen. Konzeptionell ist es jedoch nützlich, die Prinzipien der Adsorptions- und der Verteilungschromatographie auseinanderzuhalten.
Adsorbentien
[Bearbeiten]Die mit Wasser oder Lösungsmitteln zu einem Brei angerührten pulverförmigen Adsorbentien werden auf einen Träger (z. B. Glasplatte) ausgestrichen; anschließend lässt man die Schicht langsam trocknen. In Praktika sind Objektträger für die Mikroskopie beliebt, welche – sorgfältig fettfrei gemacht – durch Eintauchen in eine Suspension von Kieselgel beschichtet werden können. Für höhere Ansprüche gibt es im Handel Geräte zum Ausstreichen, Trocknen und Lagern der Platten. Die Adsorbentien haften schlecht auf dem Träger; daher werden Bindemittel zum Fixieren des Sorbens zugesetzt, z. B. Calciumsulfat (Gips). In der analytischen Praxis wird man sich die Mühe des Bereitens der Schichten nicht mehr machen wollen und greift daher auf „Fertigplatten“ bzw. „Fertigfolien“ zurück, die von verschiedenen Herstellern angeboten werden.
Das heute bevorzugte Adsorbens ist Kieselgel, welches in verschiedenen Korngrößen und Qualitäten käuflich ist. Daneben wird Aluminiumoxid verwendet, für spezielle Trennungen Magnesiumsilikat und andere Adsorbentien.
Kieselgel besteht aus polymerer Orthokieselsäure. Die Körner tragen an ihrer Oberfläche Silanol-Gruppen (Si-OH), welche dem Kieselgel einen schwach sauren Charakter verleihen und die Oberfläche zu einem H-Brücken-Donor machen. Moleküle mit H-Brücken-Akzeptoren, z. B. Amine, werden daher besonders stark adsorbiert, wandern daher langsam oder gar nicht mit der mobilen Phase; ihr Rf-Wert (Retentionsparameter) ist klein.
Bild 7-1. Schematisches Modell einer Kieselgeloberfläche
Beziehungen zwischen adsorbiertem Molekül und Adsorbens
[Bearbeiten]Für die chromatographische Praxis wurden Reihenfolgen der "Adsorptionsstärke" wichtiger organischer Verbindungen, geordnet nach funktionellen Gruppen, ermittelt. Diese können für die Abschätzung der „Laufeigenschaften“ im Schichtchromatogramm nützlich sein:
- Für Kieselgel:
Gesättigte Kohlenwasserstoffe < aromatische Kohlenwasserstoffe < Alkylhalogenide < Ether < Aldehyde < Ketone ~ Ester ~ Nitrile < Alkohole < Carbonsäuren < prim. Amine < Carbonsäureamide.
- Für Aluminiumoxid:
Ähnliche Abstufung, jedoch werden Carbonsäuren stärker adsorbiert als Amine oder Carbonsäureamide! Aluminiumoxid ist basischer als Kieselgel, bindet daher H-Brücken-Donoren besonders stark.
Die mobile Phase (Fließmittel)
[Bearbeiten]Nach dem Prinzip der systematisch wiederholten Adsorption/Desorption muss die mobile Phase die adsorbierten Moleküle von der Festphase verdrängen können. Die „Potenz“ eines Lösungmittels, dies zu tun, wurde als „Lösungsmittelstärke“ (engl. solvent strength) bezeichnet. In der Adsorptionschromatographie gängige Lösungsmittel wurden in der sog. Eluotropen Reihe angeordnet (Tabelle #).
| Lösungsmittel | Adsorbens | Polaritätsparameter | |||
|---|---|---|---|---|---|
| Al2O3 | SiO2 | π* | β | α | |
| n-Pentan | 0,00 | 0,00 | |||
| n-Hexan | 0,01 | 0,03 | –0,08 | 0,00 | |
| Petrolether | 0,01 | ||||
| Cyclohexan | 0,04 | 0,03 | 0,00 | 0,00 | |
| Tetrachlormethan | 0,18 | 0,11 | 0,28 | 0,00 | |
| Toluol | 0,29 | 0,54 | 0,11 | ||
| Benzol a) | 0,32 | 0,25 | 0,59 | 0,10 | |
| Diethylether | 0,38 | 0,38 | 0,27 | 0,47 | |
| tert-Butylmethylether b) | 0,3 – 0,4 | ||||
| Chloroform | 0,40 | 0,26 | 0,58 | 0,00 | |
| Dichlormethan | 0,42 | 0,32 | 0,82 | 0,00 | |
| Aceton | 0,56 | 0,47 | 0,71 | 0,48 | |
| Dioxan | 0,56 | 0,49 | 0,55 | 0,37 | |
| Tetrahydrofuran | 0,57 | 0,58 | 0,55 | ||
| Ethylacetat | 0,58 | 0,38 | 0,55 | 0,45 | |
| Acetonitril | 0,65 | 0,50 | 0,75 | 0,31 | |
| Pyridin | 0,71 | 0,87 | 0,64 | ||
| 1-Propanol | 0,82 | 0,52 | 0,78 | ||
| Ethanol | 0,88 | 0,54 | 0,77 | 0,83 | |
| Methanol | 0,95 | 0,73 | 0,60 | 0,62 | 0,93 |
| Wasser | sehr groß c) | 1,09 | 0,18 | 1,17 |
a) Das potentiell cancerogene Benzol sollte in Praktika möglichst nicht verwendet werden. In den meisten Fällen kann es durch Toluol ersetzt werden. b) C. J. Little, J. Chromatogr. 169, 381 (1979); verhält sich chromatographisch sehr ähnlich wie Diethylether. c) Wasser verursacht die Desaktivierung des Sorbens und vom Sorptionsmechanismus her eine Annäherung an die Verteilungschromatographie.
Chemisch modifizierte Kieselgelschichten. Umkehrphasenchromatographie
[Bearbeiten](Reversed phase chromatography)
Die Silanolgruppen der Kieselgeloberfläche (Bild 7-1) lassen sich mit einer monofunktionellen organischen Verbindung zur Reaktion bringen, wodurch eine Bedeckung der Oberfläche mit organischen Molekülgruppen erzielt wird. Die Kieselgeloberfläche wird dadurch chemisch modifiziert. Organosiliciumverbindungen haben für die chemische Modifizierung eine besonders große Bedeutung gewonnen. Die Si-OH-Gruppen lassen sich durch Umsetzung mit Chlortrimethylsilan "blockieren". Die H-Brücken-Bindung zur Kieselgeloberfläche wird dadurch nicht mehr wirksam. Man spricht von "silanisierten" Oberflächen.

Bild 7-2. Silylierung von Kieselgel mit Chlortrimethylsilan.
Durch Reaktion mit z.B. Chlordimethyl-octylsilan läßt sich eine monomolekulare Bedeckung der Oberfläche durch chemisch gebundene längere Alkylreste erreichen. Man kann annehmen, dass sie wie die Haare einer Bürste auf der Kieselgeloberfläche stehen. Die Oberfläche wird dadurch unpolar, hydrophob.

Bild 7-3. Kieselgeloberfläche (schematisch), belegt mit Chlor-trimethylsilan (links), Chlor-dimethyl-octylsilan (Mitte) und Dichlor-dialkylsilanen (rechts).
Leider sind die so erzeugten Oberflächen nicht völlig stabil gegen Wasser. Durch Hydrolyse können die Organosilangruppen wieder abgespalten werden.
Eine größere Stabilität gegenüber Hydrolyse wird durch Umsetzung mit Dichlordialkylsilanen erzielt: Mit benachbarten Si-OH-Funktionen bilden sich ringförmige Siliciumderivate. Im einfachsten Fall wird Dichlor-dimethylsilan verwendet, doch lassen sich Alkylreste mit bis zu 18 C-Atomen einbauen.
Besonders hydrolysestabile Schichten liefert die Reaktion mit Trichloralkylsilanen, die vermutlich mit drei OH-Gruppen der Kieselgeloberfläche eine Bindung eingehen.

Bild 7-4. Kieselgeloberfläche (schematisch), belegt mit Trichlor-octadecylsilan. Die Bindung des Siliciumatoms an drei Sauerstoffatome ist wegen der Übersichtlichkeit nur rechts gezeigt.
Die Stabilität gegen Hydrolyse ist wichtig, weil man an diesen chemisch-modifizierten Oberflächen mit wässrig/organischen Lösungsmittelgemischen, z.B. Acetonitril/Wasser, als mobiler Phase chromatographiert. Die mobile Phase ist also in diesem Fall polar, die stationäre Phase unpolar (Chromatographie mit umgekehrten Phasen, reversed phase chromatography).
Chemisch modifizierte Kieselgele werden von verschiedenen Firmen hergestellt. Auch „Fertigplatten“ für die Dünnschichtchromatogaphie werden geliefert. Reversed-Phase-Materialien werden mit dem Symbol RP charakterisiert, die angehängte Zahl gibt die Länge der Alkylkette an, z.B. Kieselgel RP-12 : Dodecyl-modifizierte Schicht. Beachte : RP-2 bedeutet Behandlung mit Dichlordimethylsilan, wird normalerweise nicht als Material für die Schichtchromatographie verwendet. Die Alkylreste können auch funktionalisiert sein; dadurch erzeugt man spezielle Oberflächen mit mittlerer Polarität. Eingebaut werden 3-CyanoethyIgruppen, 3-Amino- oder 3-Dimethylaminopropylreste. Die "3-Aminopropylphase" kann durch Umsetzung des Kieselgels mit 3-Aminopropyl-trimethoxysilan aufgebaut werden.

Bild 7-5. Funktionalisierte Silane zur Umkehrphasen-Chromatographie.
Techniken der Schichtchromatographie
[Bearbeiten]Dünnschichtchromatograhpie
[Bearbeiten]Ursprünglich war die Schichtchromatographie eine analytische Methode. Die Schichten waren dünn, ca. 0.2 mm, daher die Bezeichnung „Dünnschichtchromatographie“("DC"), engl. TLC (thin layer chromatography).
Wie in Kapitel 5 beschrieben, wird die Analysensubstanz punktförmig oder als kurzer Strich an der Startlinie aufgetragen. Man lässt in der Trennkammer das Fließmittel „laufen“ und ermittelt die Rf-Werte. Diese am meisten angewandte Technik wird auch als "eindimensionale Entwicklung“ bezeichnet.
Bild 7-6. Eindimensionale Entwicklung eines Dünnschichtchromatogramms.
Präparative Schichtchromatographie (PSC, "Dickschichtchromatographie")
[Bearbeiten]Bei dieser erst später eingeführten Technik arbeitet man mit Schichten von ca. 2 mm, die auf quadratischen oder rechteckigen Glasplatten aufgebracht sind. Man kann die Schichten selbst herstellen, aber es erfordert Übung, diese gleichmäßig und nach dem Trocknen frei von Rissen zu erhalten. Einfacher ist es, sogenannte Fertigplatten zu kaufen.
Das mit einem leicht verdampfbaren Lösungsmittel verdünnte, zu trennende Gemisch wird horizontal als langer Strich in einigem Abstand zur Kante der Platte aufgetragen (Bild 7-3a). Nach Verdunsten des Lösungsmittels lässt man in einem Chromatographietrog mit dem Fließmittel entwickeln. Welches dafür geeignet ist, findet man vorher durch dünnschichtchromatographische Tests heraus.
Die (eindimensionale) Entwicklung wird in der Regel mehrfach durchgeführt; jedesmal muss aber das Fließmittel durch Verdunsten entfernt worden sein. Die getrennten Substanzen erscheinen in bandförmigen Zonen (Bild 7-3b). Nach ihrer Lokalisierung (s.u.) werden diese mit einem Bleistift markiert und herausgeschabt. Anschließend wird die adsorbierte Substanz mit einem geeigneten (polaren) Lösungsmittel vom Kieselgel abgelöst (extrahiert).
Bild 7-7. Präparative Schichtchromatographie auf einer quadratischen Platte (20 × 20 cm), schematisch. 3a (links): Die zu trennende Substanzmischung wurde strichförmig aufgetragen (dunkle Linie). 3b (rechts): Nach der aufsteigenden Entwicklung in der Trennkammer sind die Komponenten in Zonen aufgetrennt worden. Die Front der mobilen Phase wurde markiert.
Die Methode hat den Vorteil, dass die Ergebnisse der (analytischen) Dünnschichtchromatographie leicht auf die präparative Schichtchromatographie übertragen werden können, wenn auch die Trennleistung (Performance) nicht an die der DC heranreicht. Jedoch können so relativ einfach Substanzen gewonnen werden, deren Menge für eine spektroskopische Strukturaufklärung ausreicht. Mit ca. 20 mg Substanz aus der PSC können routinemäßig NMR-, IR-, UV- und Massenspektren erhalten werden.
Es besteht auch die Möglichkeit, mehrere Dickschichtplatten gemeinsam in einem Gestell in einer größeren Trennkammer zu entwickeln. So kann man die Substanzmenge erhöhen.
In Konkurrenz zur PSC treten jedoch die Methoden der präparativen Säulenchromatographie (Kapitel 8).
Detektion und Nachweis der Substanzen in der Dünnschichtchromatographie
[Bearbeiten]Allgemeine Methoden
[Bearbeiten]Unmittelbar zu erkennen und zu lokalisieren sind die Flecke von farbigen Substanzen (vgl. 2,4-Dinitrophenylhydrazone). Substanzen mit Eigenfluoreszenz (z.B. Anthracen) können durch Betrachten der Schicht im UV-Licht erkannt werden.
Häufig wird in die Schicht der Adsorbentien (Kieselgel) noch ein Leuchtstoff (Fluoreszenzindikator) eingearbeitet. Dadurch leuchtet die Schicht, wenn man sie unter eine UV-Leuchte hält. Je nach dem Strahlungsmaximum der handelsüblichen UV-Leuchten bei 254 nm und 360 nm werden die Sorbentien mit dem Zusatz F254 bzw. F360 charakterisiert, z.B. Kieselgel GF254 (G steht für das Bindemittel Gips, F für Fluoreszenzindikator).
Flecke auf der Schicht, deren Substanz selbst UV-Licht absorbiert, z. B. Benzolderivate oder konjugierte π-Elektronensysteme, können die Fluoreszenz an ihrem Ort löschen. Auf der hellblau fluoreszierenden Schicht erscheinen daher die Flecke dunkel.
Reagentien zur Detektion in der Schichtchromatographie
[Bearbeiten]Substanzflecke, die nach den oben genannten Methoden nicht detektiert werden können, müssen durch Reagentien sichtbar gemacht werden. Zahlreiche Reagentien wurden dafür entwickelt; meistens werden diese auf die Schicht gesprüht. In manchen Fällen kann man die Platte bzw. Folie auch in eine Lösung des Reagens eintauchen, doch löst sich dabei manchmal die Schicht vom Träger ab.
Universalreagenzien
[Bearbeiten]In vielen Fällen weiß der Analytiker zunächst nicht, zu welchen Verbindungsklassen die getrennten Substanzen gehören. Hier sind Reagentien gefragt, durch welche die Flecke in möglichst jedem Fall lokalisiert werden können. Diese Reagenzien sind „brutal“ und zerstören die Substanz durch Verkohlung oder Oxidation. Häufig erwärmt man die Schicht zur Beschleunigung des Prozesses im heißen Luftstrom (Gebläse, "Fön").
- Konzentrierte Schwefelsäure kann aufgesprüht zur Braun- oder Schwarzfärbung der Flecke führen.
- Chromschwefelsäure kann viele Substanzen oxidieren und wird dabei reduziert. Die resultierenden Chrom(II)-Salze bilden einen farblosen bis schwach grünen Fleck auf der durch überschüssiges Chromat gelb gefärbten Schicht.
- Kaliumpermanganat-Schwefelsäure ist ein sehr starkes Oxidationsmittel. Die nach Aufsprühen rosafarbene Schicht zeigt an den Stellen farblose Flecke, wo Reduktion zu Mangan(II)-Salzen eingetreten ist.
- Eine Lösung von Kaliumpermanganat in Wasser, neutral oder alkalisch, evtl. mit Silbernitrat ist angenehmer zu handhaben. In diesem Fall wird die Permanganat-Ionen nur zum Mn4+ (Braunstein) reduziert, so dass auf rosa Hintergrund braune Flecken sichtbar werden.
Generell ist jedoch der Nachweis mittels dieser Universalreagenzien nicht sehr empfindlich.
Fluoreszenzerzeugende Anfärbereagenzien
[Bearbeiten]Manche Substanzen bilden Assoziate mit organischen Farbstoffen und lassen sich daher anfärben. Besonders geeignet sind dafür im sichtbaren oder ultravioletten Licht fluoreszierende Farbstoffe, wie 2',7'-Dichlorfluorescein, Rhodamin B, Rhodamin G, Ammoniumsalz der 8-Anilinonaphthalin-1-sulfonsäure (ANS-Reagens) und 6-(4-Toluidino)-naphthalin-2-sulfonsäure (TNS-Reagens). Diese Nachweise sind schon bei sehr geringen Substanzmengen wirksam, was in der analytischen Chemie für alle Fluoreszenz-Methoden gilt.
Oxidierende Reagenzien
[Bearbeiten]Neben den oben genannten oxidierenden Reagenzien werden auch schwächere Oxidationsmittel benutzt, die daher nicht "universal" wirksam sein können. Aber in einigen Fällen sind sie sehr nützlich und liefern beim Redoxvorgang prächtige Farben, u.a.
- Eisen(III)chlorid - Kaliumhexacyanoferrat(III): Eisen(III) wird zu Eisen(II) reduziert und ergibt dann „Berliner Blau“ am Ort des Flecks.
- Phosphormolybdänsäure (Molybdatophosphorsäure)
- Cer(IV)ammoniumnitrat in verd. Salpetersäure
Gruppenspezifische Reagenzien
[Bearbeiten]- Nachweis von Carbonsäuren: pH-Indikatoren wie Bromkresolgrün, Bromphenolblau.
- Nachweis von Carbonsäureestern: Hydroxylamin - Eisen(III)chlorid-Reagens (Hydroxamsäuretest).
- Nachweis von Aldehyden und Ketonen: 2,4-Dinitrophenylhydrazin-Reagens
- Nachweis von primären Aminen und Aminosäuren: Ninhydrin-Reagens
Spezialreagenzien
[Bearbeiten]In diese Klasse lassen sich zahlreiche Reagenzien einordnen, die für verschiedene Verbindungsklassen mehr oder weniger spezifisch sind. Häufig verwendet werden Lösungen aromatischer Aldehyde in starken Säuren, welche - aufgesprüht - starke, bunte Färbungen der Flecke erzeugen können (Aldehyd - Säure – Reagenzien). Hierunter fallen:
- p-Methoxybenzaldehyd (= Anisaldehyd)–Schwefelsäure-Reagens
- Vanillin-Schwefelsäure-Reagens
- p-Dimethylaminobenzaldehyd-Salzsäure-Reagens (Ehrlichs Reagens)
- Diazotierte Sulfanilsäure
Eine weitere, einfach anzuwendende Detektionsmethode sind Dämpfe von Reagenzien, denen die Schicht in einer abgeschlossenen Chromatographie-Kammer ausgesetzt wird.
- Iod – Dampf kann gelblich/bräunliche Komplexe mit manchen organischen Verbindungen liefern oder sich an C=C-Doppelbindungen addieren (Nachweis in einer „Iod-Kammer“).
Literatur
[Bearbeiten]Als Einführung in die theoretischen Grundlagen und für die praktische Arbeit können folgende kurze Lehrbücher dienen:
- G. Schwedt, Chromatographische Trennmethoden, 2. Auflage, Georg Thieme Verlag, Stuttgart, 1986.
- R. J. Gritter, J. M. Bobbitt und A. E. Schwarting, Einführung in die Chromatographie, Springer Verlag, Berlin - Heidelberg, 1987.
Ausführliche Informationen über die Dünnschichtchromatographie findet man in folgenden Monographien:
- E. Stahl (Hrsg.), Dünnschichtchromatographie, 2.Aufl., Springer Verlag, Berlin, 1967.
- G. Hesse, Chromatographisches Praktikum, 2. Aufl. Akademische Verlagsgesellschaft, Frankfurt/Main, 1968.
- K. Randerath, Dünnschichtchromatographie, 2.Aufl., 2. Nachdruck, Verlag Chemie, Weinheim, 1975.
- J. C. Touchstone und M. Dobbins, Practice of Thin Layer Chromatography, John Wiley & Sons, New York, 1978.
- H. Wagner, S. Bladt und E. M. Zgainski, Drogenanalyse. Dünnschichtchromatographische Analyse von Arzneidrogen, Springer Verlag, Berlin, 1983.
Einzelnachweise
[Bearbeiten]- ↑ L. R. Snyder, Principles of Adsorption Chromatography, Dekker, New York, 1968.
Versuche
[Bearbeiten]- Isolierung von Myristicin aus dem Muskatnuss-Extrakt durch präparative Schichtchromatographie (PSC)
Trennungen durch Säulenchromatographie
[Bearbeiten]Diese Methoden können wie bei der Schichtchromatographie beschrieben, nach dem Prinzip der Verteilung oder der Adsorption durchgeführt werden. Im organischen Praktikum hat die Adsorptions-Säulenchromatographie die größere Bedeutung; daher soll hier nur auf diese Methode eingegangen werden. In diesem Fall ist ein pulverförmiges Adsorbens die stationäre Phase in einer Trennsäule. Lösungsmittel bilden die mobile Phase, welche durch die mit dem Adsorbens beschickte Säule wandert (Bild 8-1).

Bild 8-1.
Chromatographie in der Schwerkraftsäule
[Bearbeiten]Bei dieser ältesten und apparativ einfachsten Methode wird ein senkrecht angeordnetes Chromatographierohr verwendet, das meistens aus Glas angefertigt ist (Bild 8-2).
Bild 8-2. Glassäulen zur Chromatographie.
Die mobile Phase bewegt sich durch die bloße Schwerkraft von oben nach unten. Die mit unterschiedlicher Stärke an das Adsorbens gebundenen (retentierten) Substanzen werden von der mobilen Phase transportiert und treten – mit dem Lösungsmittel (Eluens, Elutionsmittel) verdünnt - am Ende der Säule aus; sie werden eluiert. Diese Technik wird daher auch Elutionsverfahren genannt.
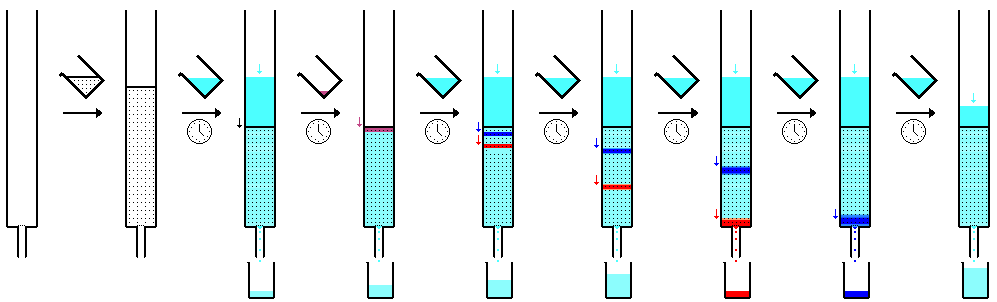
Bild 8-3. Arbeitsschritte bei der Chromatographie in einer Schwerkraftsäule (schematisch).
Um ein gutes Ergebnis der Trennung zu erhalten, muss die Trennsäule mit Sorgfalt "gepackt", d.h. mit dem Adsorbens gefüllt werden. Dies erreicht man durch "Einschlämmen". Je größer die Dimensionen der Säule sind, desto schwieriger wird es, gleichmäßige Packungen der Trennsäulen zu erhalten. Anfänger müssen diese Technik üben!
a) Füllung des Chromatographierohrs (Einschlämmen)
[Bearbeiten]Für Praktika der organischen Chemie geeignet sind Chromatographierohre von ca. 40 cm effektiver Länge und einem Innendurchmesser von ca. 1,6 cm. Die Säule wird mit zwei Klammern vertikal an einem Stativ befestigt. Unter den Auslauf stellt man einen Erlenmeyer-Kolben. Bei geschlossenem Hahn füllt man das Rohr bis zu etwa einem Viertel mit einem Lösungsmittel, welches in der eluotropen Reihe (siehe Kapitel Adsorptions-Schichtchromatographie) weit oben steht, z.B. Petrolether. Mit Hilfe eines langen Glasstabs oder Glasrohrs stößt man einen Bausch aus Watte in die Verjüngung des Auslaufs und entfernt durch Stoßen etwa gebildete Luftblasen. Man bereitet aus dem Adsorbens, meistens Kieselgel (ca. 40 g), und dem Lösungsmittel (z.B. Petrolether, ca. 120 ml) in einem Erlenmeyer-Kolben (ca. 300 ml) durch Umschütteln eine blasenfreie Suspension und gießt diese durch einen Pulvertrichter möglichst schwungvoll in die Trennsäule. Der Absetzvorgang wird durch Klopfen mit einer Reagenzglasklammer unterstützt. Überschüssiges Lösungsmittel lässt man durch Öffnen des Hahns abtropfen. Die im Erlenmeyerkolben zurückgebliebene Suspension wird mit Lösungsmittel vollständig in die Säule gespült. Es ist darauf zu achten, dass stets eine Lösungsmittelschicht über der Füllung steht; die Säule darf nicht "trockenlaufen". Nachdem sich das Adsorbens abgesetzt hat (einige Zeit warten!), lässt man ca. 1 cm hoch Seesand einrieseln. Vor Aufgabe der zu trennenden Substanzmischung lässt man die überstehende Flüssigkeit durch Öffnen des Hahns so weit ab, dass der Seesand nur noch mit einer dünnen Lösungsmittelschicht bedeckt ist.
Das spezifisch schwere Adsorbens Aluminiumoxid (siehe unten) kann man auch direkt langsam(!) in die mit der mobilen Phase gefüllte Trennsäule einrieseln lassen, wobei aber darauf zu achten ist, dass jedesmal die Luftblasen entweichen können, bevor neues Sorbens nachgefüllt wird.
b) Ermittlung des Elutionsmittels (Eluens)
[Bearbeiten]Vor der Säulenchromatographie untersucht man das zu trennende Gemisch mittels Dünnschichtchromatographie (DC, siehe Kapitel #) und ermittelt aus der eluotropen Reihe eine geeignete mobile Phase. Oft verwendet man auch Mischungen von Lösungsmitteln verschiedener Polarität, z. B. Petrolether/Ethylacetat, in verschiedenen Verhältnissen. Bei diesen Tests ist zu beachten, dass die Retention der Substanzen im DC von der in der Säule verschieden sein kann, da die Adsorbentien für die beiden Techniken nicht ganz gleich sind. Die Trennleistung (performance) im DC ist höher. Für die Säulenchromatographie stellt man meistens eine geringere Polarität ein.
c) Trennprozess
[Bearbeiten]Von dem zu trennenden Substanzgemisch wird bei Raumtemperatur(!) eine möglichst konzentrierte Lösung hergestellt, welche mit Hilfe einer Pipette vorsichtig(!) auf die Säulenfüllung ("am Kopf" der Säule) gegeben wird. Die Säulenfüllung soll dabei nicht aufgewirbelt werden. Das Lösungsmittel sollte nicht zu "polar" sein (siehe eluotrope Reihe und DC-Test). Durch vorsichtiges Öffnen des Hahns am Chromatographierohr lässt man die Lösung einsickern. Sobald dies erfolgt ist, gibt man mittels Pipette ca. 1 ml Lösungsmittel auf die Säule und lässt wiederum einsickern. Dieses "Nachwaschen" mit Lösungsmittel wird insgesamt dreimal durchgeführt. Anschließend setzt man den Tropftrichter mit dem Elutionsmittel auf und beginnt mit dem Eluieren.
Falls das Substanzgemisch nur in polaren Solventien löslich ist, kann man folgendermaßen verfahren: Man löst in einem geeigneten Solvens - ohne auf die eventuell hohe Polarität Rücksicht zu nehmen - und gibt zu der Lösung eine kleine Menge Adsorbens. Im Rotationsverdampfer entfernt man das Lösungsmittel, bis man ein trockenes Pulver erhält. Dieses mit der Analysensubstanz beladene Sorbens gibt man vorsichtig auf die gepackte Säule.
Man öffnet nun den Hahn am unteren Ende der Chromatographiesäule. Das Eluat soll mit 1-2 Tropfen pro Sekunde austreten. Es wird in einem Rundkolben (250 ml), dessen Gewicht man bestimmt hat, aufgefangen. Man eluiert durch Auftropfen der mobilen Phase. Von Zeit zu Zeit prüft man das Eluat durch Dünnschichtchromatographie. Sobald die zweite Substanz nachweisbar ist, wechselt man den Auffangkolben und fängt eine neue "Fraktion" auf. Die Elution wird abgebrochen, wenn im DC kein Fleck mehr erscheint.
Wenn die mobile Phase bei der Elution nicht verändert wird, d.h. dieselbe bleibt, bezeichnet man dieses Verfahren als
- Isokratische Elution.
In der Regel wird man jedoch die Polarität der mobilen Phase sukzessive erhöhen, damit auch stärker retentierte Komponenten rascher desorbiert werden. Dies nennt man
- Gradienten-Elution:
Dies kann stufenweise (diskontinuierlich) oder kontinuierlich erfolgen (Bild 8-4).

Bild 8-4. Stufengradient (links) und kontinuierlich steigende Gradienten (rechts).
Im Forschungslabor wird man die Fraktionen nicht "von Hand" sammeln, sondern einen Fraktionssammler verwenden.
Zum Schluss überprüft man dünnschichtchromatographisch die einzelnen Fraktionen und vereinigt solche mit gleicher Zusammensetzung. Das Elutionsmittel wird abdestilliert, vorzugsweise im Rotationsverdampfer. Der Rückstand wird spektroskopisch untersucht (NMR, IR, MS) und in der Regel umkristallisiert oder im Kugelrohr destilliert.
Kieselgel zur Säulenchromatographie
[Bearbeiten]Die meisten chromatographischen Trennungen in der Schwerkraftsäule dürften heute an Kieselgel durchgeführt werden. Dieses ist im Handel in verschiedenen Qualitäten erhältlich, die sich in der Korngröße, der wirksamen Oberfläche und der Größe der Poren unterscheiden. Das Adsorbens zur Chromatographie wird durch Klassieren gewonnen; die mittlere Korngröße liegt zwischen 0,05 und 0,5 mm. Für einfache Trennungen kann ein Material mit der Korngröße 0,06-0,2 mm (meistens in μm angegeben: 60-200 μm) verwendet werden. Beim Packen der Trennsäule ist die Kenntnis der Schüttdichte nützlich: sie beträgt ca. 0,5 g/ml. Je enger die Verteilung der Korngrößen ist, desto teurer ist das Adsorbens.
Kieselgel-Körner sind porös. Die mittlere Porengröße wird meistens in Angström-Einheiten angegeben und reicht typischerweise von ca. 40 Ä bis 120 Ä . Viel verwendet wird im Labor Material mit 60 Ä , welches als Kieselgel 60 gehandelt wird. Kieselgele besitzen erstaunlich große Oberflächen, typisch zwischen 200 und 800 m2 pro Gramm!
Die adsorptiven Eigenschaften der Kieselgele hängen in hohem Maße auch von ihrer Vorbehandlung ab. Es wird angenommen, dass die Adsorption auf den Si-OH Gruppen an der Oberfläche beruht, und unterscheidet "freie" OH-Gruppen (A), "gebundene" OH-Gruppen (B) und "reaktive" OH-Gruppen (C). Letztere sollen besonders aktiv sein.

Bild 8-5. Schematisches Modell einer Kieselgel-Oberfläche.
Das Verhalten des Kieselgels bei der Adsorption kann durch Erhitzen des Materials beeinflusst werden. Das physikalisch adsorbierte Wasser kann durch Erwärmen auf Temperaturen unterhalb 150 °C entfernt werden. Hochaktives Kieselgel erhält man durch längeres Erhitzen im Trockenschrank auf 150 bis 200 °C. Bei höheren Temperaturen (> 200 °C) werden Hydroxylgruppen an der Oberfläche unter Abspaltung von Wasser in Siloxan-Gruppen (Si-O-Si) umgewandelt; diese sind weniger aktiv.
Wer also bei der Adsorptionschromatographie möglichst reproduzierbare Ergebnisse anstrebt, sollte das Kieselgel vor der Verwendung bei 150-200°C "trocknen" und anschließend im Exsikkator abkühlen lassen, damit es keine Feuchtigkeit aus der Luft aufnehmen kann.
Aluminiumoxid zur Säulenchromatographie
[Bearbeiten]In den Anfängen der Säulenchromatographie war Aluminiumoxid das bevorzugte Adsorbens. Viele Erkenntnisse über die Methode wurden daher bei Studien mit diesem Material gewonnen. Heute dürften aber die meisten chromatographischen Trennungen an Kieselgel durchgeführt werden.
Beim Arbeiten mit Aluminiumoxid muss berücksichtigt werden, dass dieses in verschiedenen "Aktivitäten" eingesetzt werden kann. Die höchste Aktivitätsstufe (siehe Kapitel 2, Trennungen durch Adsorption) wird nur für die Reinigung von Lösungsmitteln eingesetzt. Zur Chromatographie ist dieses Material selten geeignet, da die zu trennenden Substanzen daran zu stark gebunden werden. In manchen Fällen hat man sogar chemische Reaktionen mit dem hochaktiven Aluminiumoxid festgestellt, die bei einer Trennung selbstverständlich nicht erwünscht sind.
Zur Säulenchromatographie desaktiviert man hochaktives Aluminiumoxid, indem man dieses mit einer definierten Menge Wasser behandelt. Die Wassermoleküle werden an der Oberfläche adsorbiert. Dies führt zu Adsorbentien verschiedener "Aktivitätsstufen", die mit Hilfe des Brockmann-Tests definiert wurden. Für die Säulenchromatographie verwendet man in der Regel die Aktivitätsstufen II oder III. Die für die Trennung passende Aktivitätsstufe muss für jede Substanz(mischung) empirisch ermittelt werden. Wie bei Kieselgel ist zu beachten, dass dünnschichtchromatographische Vorversuche an Aluminiumoxid-Schichten zu etwas anderen Ergebnissen führen können. Abgesehen von der verschiedenen Korngröße lässt es sich nicht vermeiden, dass Aluminiumoxid-Schichten beim Auftüpfeln der Substanzen und in der Trennkammer mit feuchter Luft in Berührung kommen. Dadurch ist das Adsorbens der DC-Schicht weniger aktiv als das in der Trennsäule.
Einstellung der Aktivitätsstufen
[Bearbeiten]Hochaktives Aluminiumoxid ist in sorgfältig verschlossenen Flaschen käuflich. Lässt man dieses Material (Aktivitätsstufe I, oder Super I) an der Luft stehen, wird es durch Adsorption von Feuchtigkeit desaktiviert. Daher müssen die geöffneten Flaschen rasch wieder verschlossen werden. Durch Feuchtigkeit desaktiviertes Aluminiumoxid erhitzt man im Trockenschrank auf 350 °C und lässt es anschließend im Exsikkator erkalten.
Um höhere Aktivitätsstufen herzustellen, versetzt man dieses Pulver in einer Flasche mit einer definierten Menge Wasser. Zunächst bilden sich Klumpen. Man verschließt die Flasche sorgfältig, schüttelt durch und lässt sie stehen, bis sich das Wasser gleichmäßig verteilt hat. Die benötigten Mengen Wasser sind in Bild 8-6 angegeben.

Bild 8-6. Desaktivierung von Aluminiumoxid der Aktivitätsstufe I.
Aktivitätstest nach Brockmann und Schodder[1]
Die Aktivitätsstufe des Aluminiumoxids wird durch Chromatographie von sechs Testsubstanzen aus der Klasse der Azofarbstoffe ermittelt (Bild 8-7. In kleinen Trennsäulen (Teströhrchen) werden je zwei in dieser Reihe (Bild 8-7) aufeinanderfolgende Farbstoffe in Petrolether/Benzol-Lösung (heute durch Petrolether/Toluol ersetzt) aufgebracht und mit diesem Lösungsmittelgemisch eluiert.
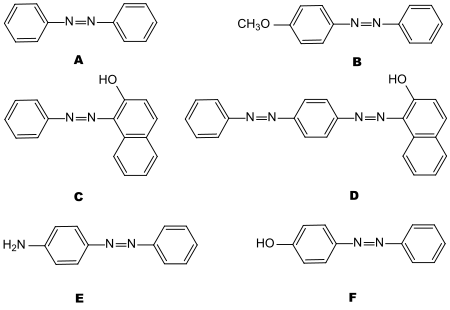
Bild 8-7. Azofarbstoffe zum Brockmann-Test: Azobenzol (A), 4-Methoxyazobenzol (B), Sudangelb (C), Sodanrot (D), 4-Aminoazobenzol (E) und 4-Hydroxyazobenzol (F).

Bild 8-8. Tests der Aktivität von Aluminiumoxiden zur Chromatographie.
Trockensäulen-Chromatographie
[Bearbeiten]Wie oben beschrieben, ist es im Labor Standard geworden, vor der Chromatographie das Sorbens mit einem Lösungsmittel in die Säule "einzuschlämmen“. Durch die industrielle Optimierung der Sorbentien ist es jedoch möglich geworden, darauf zu verzichten.
Wie der Begriff "Trockensäulen-Chromatographie“ (TSC) zum Ausdruck bringt, wird bei diesem Verfahren die Trennsäule mit einem pulverförmigen, trockenes Sorbens gefüllt. Meistens wird spezielles Kieselgel („zur Trockensäulen-Chromatographie“) verwendet. Die Packung wird durch Klopfen oder Vibration verdichtet. Darauf lässt man die Mischung der zu trennenden Substanzen einsickern, welche gegebenenfalls mit etwas Lösungsmittel verdünnt wurde. In der Regel „entwickelt“ man nur so lange, bis das Solvens am Säulenende angekommen ist, d.h. die ganze Säule befeuchtet hat. Anschließend lässt man das Lösungsmittel im Abzug verdunsten. Die Zonen werden markiert und mit einem Spatel oder Löffel aus der Säule herausgeholt. Um dies zu erleichtern, ist eine zerlegbare Trennsäule zu empfehlen. Sie besteht aus einem Glasrohr mit zwei Normschliffhülsen an den Enden („Zechmeister-Rohr“). Das Rohr wird auf ein kurzes Filterrohr aufgesetzt, in das eine Glasfritte eingeschmolzen ist. Dieses trägt am unteren Ende einen Auslass zum Druckausgleich und einen Hahn.[2]

Anstelle der Glassäule kann auch ein Schlauch aus dünner, durchsichtiger, nicht quellbarer Plastikfolie (Polyamid) verwendet werden, der an einem Ende wie eine Wurst abgebunden wird. Das Sorbens wird eingefüllt und mittels Vibrator zu einer „Wurst“ verdichtet. Die „Wurst" kann nun senkrecht in ein Stativ eingespannt werden. Mit einer Nadel werden unten einige Löcher eingestochen, durch welche das Lösungsmittel austreten kann.[3]
Nachdem die „Entwicklung“ abgeschlossen ist, zerlegt man die „Wurst“ mit einem Messer in verschiedene Abschnitte und extrahiert aus den Sektionen die Substanzen mit einem polaren Lösungsmittel. Ist das Sorbens mit Fluoreszenzindikator versetzt, kann man oft unter einer UV-Leuchte die Trennung kontrollieren.
Die TSC kann als Brücke zwischen Dünnschichtchromatographie und der klassischen Säulenchromatographie betrachtet werden. Sie ist vor allem zur Vortrennung von Gemischen geeignet, falls sich Komponenten in ihrer Polarität stärker unterscheiden.[4][5]
Auch für die TSC wurden verschiedene Varianten propagiert.[6][7] So wurde das Sorbens (Kieselgel 60) trocken in einen zylindrischen Glastrichter mit poröser Glasfritte eingebracht. Der Trichter wird mit einem konischen Gummiadapter auf eine Saugflasche gesetzt. Die Elution wird durch vorsichtiges Ansaugen in einem leichten Vakuum erreicht.[8]
Niederdruck-Chromatographie (Flash-Chromatographie)
[Bearbeiten]In der Schwerkraftsäule können Substanzen getrennt werden, die große Unterschiede in ihrem Retentionsverhalten (z. B. den Rf-Werten) aufweisen. Für Vortrennungen ist die relativ billige Methode besonders gut geeignet.
Schwierigere Trennungen werden mit Adsorbentien kleinerer und einheitlicherer Korngröße vorgenommen, die selbstverständlich teurer sind. Wird eine Säule mit diesen Materialien gepackt, reicht die Schwerkraft zum Transport der mobilen Phase nicht mehr aus, um die Trennung in akzeptablen Zeiten durchführen zu können. Daher muss die Flüssigkeit unter Druck durch die Trennsäule gepresst werden.
Im einfachsten Fall kann man Stickstoff aus einer Gasflasche auf die Trennsäule drücken lassen. In den meisten Laboratorien steht heute ohnehin eine Stickstoffleitung am Arbeitsplatz zur Verfügung. Das Verfahren wurde vermutlich erstmals von W. C. Still publiziert und „Flash-Chromatography“ genannt.[9]
Da der Druck des Stickstoffs relativ niedrig ist (bis ca. 1 bar), können die Trennungen relativ gefahrlos in Glasapparaturen durchgeführt werden. Dadurch hat sich die Methode in organischen Laboratorien rasch verbreitet. In 10-15 Minuten sollen sich Substanzen in Mengen zwischen 10 mg und 10 Gramm trennen lassen.
Als Sorbens wird meistens Kieselgel der Korngröße 40-63 μm verwendet.
Literatur
[Bearbeiten]- G. Schwedt, Chromatographische Trennmethoden, 2. Auflage, Georg Thieme Verlag, Stuttgart, 1986.
- R. J. Gritter, J. M. Bobbitt und A. E. Schwarting, Einführung in die Chromatographie, Springer Verlag, Berlin - Heidelberg 1987.
- G. Hesse, Chromatographisches Praktikum, 2. Aufl. Akademische Verlagsgesellschaft, Frankfurt/Main, 1968.
Versuche
[Bearbeiten]Einzelnachweise
[Bearbeiten]- ↑ H. Brockmann, H. Schodder, Ber. Dtsch. Chem. Ges. 74, 73 (1941).
- ↑ K. Kubeczka, Chromatographia 6, 106-108 (1973).
- ↑ Informationsschrift der Firma Woelm, Eschwege.
- ↑ K. Kubeczka, Vortrennung ätherischer Öle und ähnlich komplexer Stoffgemische für die GC-Analyse durch modifizierte Trockensäulen-Chromatographie, Chromatographia 6, 106-108 (1973).
- ↑ B. Engelbrecht, Trockensäulen-Chromatographie (TSC), eine einfache und preiswerte Trenntechnik als Brücke zwischen DC und Säulenchromatographie, GIT-Verlag, Giebeler, 1979.
- ↑ Lawrence M. Harwood, Dry-Column Flash Chromatography, Aldrichimica Acta 18, 25 (1985).
- ↑ D. S. Pedersen, C. Rosenbohm, Dry Column Vacuum Chromatography, Synthesis 2001, 2431-2434.
- ↑ Alan J. Shusterman, Patrik G. McDougal, Arthur Glasfeld, Dry-Column Flash Chromatography, J. Chem. Educ.74, 1222-1223 (1997).
- ↑ W. C. Still, M. Kahn, A. Mitra, J. Org. Chem. 43, 2923 (1978).
Diese Seite ist noch nicht ganz fertig
Trennungen durch Destillation
[Bearbeiten]Bekanntlich tritt beim Erhitzen einer flüssigen Substanz (Flüssigkeit) das Phänomen des Siedens auf, wenn ihr Dampfdruck den äußeren Druck erreicht hat. Bei der Siedetemperatur, oft als Siedepunkt (Sdp.) oder Kochpunkt (Kp.) bezeichnet, findet an der Grenzfläche ein Übergang zwischen flüssiger Phase und Dampfphase (Gasphase) statt. Beim Destillieren wird dem Dampf in einem Kühler Energie entzogen, so dass er kondensiert und als Flüssigkeit aufgefangen werden kann.
Das Verfahren der Destillation ist eine der ältesten Methoden zur Trennung flüchtiger von nicht-flüchtigen Stoffen. In den vorangehenden Praktikumsversuchen wurde die einfachste Variante bereits geübt: Beim Konzentrieren (Einengen) von Lösungen im Rotationsverdampfer soll der Hilfsstoff „Solvens“ selektiv entfernt werden, während die gelösten Substanzen im Kolben zurückbleiben sollen. Das Lösungsmittel ist flüchtig, die extrahierten Stoffe möglichst wenig flüchtig.
Die Flüchtigkeit eines Stoffes wird durch dessen Dampfdruck definiert. Der Dampfdruck gibt an mit welchem Druck die Flüssigkeitsteilchen in den gasförmigen Aggregatzustand übertreten, wobei der Dampf mit der flüssigen Phase im Gleichgewicht steht. Flüchtige Substanzen, z. B. Lösungsmittel, haben relativ hohe Dampfdrücke, lassen sich also mit geringem Energieaufwand in die Gasphase überführen. Es gilt prinzipiell der Zusammenhang hoher Dampfdruck bedeutet eine niedrige Siedetemperatur und ein niedriger Dampfdruck eine hohe Siedetemperatur.
Destillationen können systematisch, d.h. in der Theorie, als Untergruppe eines Kapitels „Trennungen von Substanzen mit verschiedenem Dampfdruck“ aufgefasst werden. Die Methode der Sublimation wäre der Destillation an die Seite zu stellen.
Die Standard-Apparatur zur Destillation
[Bearbeiten]Neben dem später in die Labortechnik eingeführten Rotationsverdampfer wird als einfachstes Gerät eine Anordnung benutzt, die aus Siedekolben, Destillieraufsatz, Destillationsthermometer, absteigendem Liebig-Kühler, Vorstoß und Vorlagekolben besteht. Früher verwendete man für die Verbindung der einzelnen Komponenten einer Destillationsapparatur Kork- oder Gummistopfen. Heute sind Normschliff-Verbindungen (Kegel und Hülse, Normschliffgröße NS 29 oder NS 14,5) selbstverständlich. Diese müssen jedoch (sparsam!) gefettet werden, in der Regel mit Silikonfett. Es gibt auch polierte Normschliffe, die ohne Fett auskommen, jedoch teuer sind.
Bild 9-1. Aufbau einer Apparatur zur „einfachen Destillation“ im Labor. 1: Heizquelle (im Bild durch Heizplatte des Magnetrührgeräts), 2: Destillierkolben, 3: Destillieraufsatz (im Bild mit Einstichen als Spritzschutz, nicht unbedingt notwendig), 4: Thermometer, 5: Liebig-Kühler, 6: Kühlwassereingang, 7: Kühlwasserausgang, 8: Rundkolben (Vorlage) für das Destillat, 9: Druckausgleich, bei der Vakuumdestillation Schlauchverbindung zur Vakuumpumpe, 10: Vorstoß, 11: Regler für die Badtemperatur 12: Regler für die Drehzahl des Magnetrührers, 13: Magnetrührgerät mit Heizplatte, 14: Heizbad (Wasserbad, Ölbad), 15: Magnetrührstab oder Siedesteine, 16: Kühlbad, evt. Eisbad. Um beim Kühlen das Eindringen von Feuchtigkeit (Kondensation feuchter Luft) in das Destillat zu verhindern, verbindet man den "Druckausgleich" (9) mit einem Trockenrohr, das z. B. Calciumchlorid enthält.
Die zu destillierende Flüssigkeit wird in den Siedekolben gefüllt, wobei man in der Regel einige Siedesteinchen oder Siedeperlen zufügt. Diese sollen sogenannte Siedeverzüge, d h. unkontrolliertes abruptes Aufkochen, verhindern. Hat man nur kleine Flüssigkeitsmengen zu destillieren, verwendet man meistens ein Magnetrührgerät; der Rührstab („Rührfisch“) übernimmt dann die Funktion der Siedesteinchen. In einem Heizbad, dessen Temperatur variiert werden kann, wird die Flüssigkeit erhitzt. Die Wahl des Heizbades (Wasserbad, Ölbad, Silikonbad) richtet sich nach der erwarteten Siedetemperatur. Sobald die Flüssigkeit siedet, beobachtet man am Destillationsthermometer die Siedetemperatur und notiert diese kontinuierlich als Funktion der Menge des Destillats. Die Badtemperatur wird so eingestellt, dass das Destillat tropfenweise (nicht zu rasch!) in der Vorlage aufgefangen wird. Sollte bei der gewählten Badtemperatur kein Destillat mehr abtropfen („übergehen“), muss das Bad stärker erhitzt werden. Falls dann die Siedetemperatur stärker ansteigt, wechselt man die Vorlage.
Die Qualität der Destillate (Zusammensetzung, Reinheit) wird durch Bestimmung des Brechungsindex, der Dichte, oder durch Aufnahme von Gaschromatogrammen oder Spektren ermittelt (siehe die einzelnen Praktikumsversuche).
Die Glasapparatur wurde im Laufe der Zeit verändert und verbessert. Um zu verhindern, dass durch beim Sieden hochspritzende Flüssigkeit das Thermometer benetzt und dadurch eine zu hohe Siedetemperatur vorgetäuscht wird, wurde der Destillieraufsatz erweitert (Claisen-Aufsatz); das Thermometer wird in den zweiten Hals eingesetzt, wo es nur vom Dampf umspült werden soll. Der senkrecht über dem Siedekolben stehende Hals wird durch einen Schliffstopfen verschlossen und kann zum Einfüllen oder Nachfüllen von Flüssigkeit benutzt werden. Bei Destillationen unter vermindertem Druck (Vakuum-Destillation) kann hier die Siedekapillare eingeführt werden. Destillieraufsatz und Liebig-Kühler können zu einer sogenannten Destillationsbrücke verschmolzen sein.

Bild 9-2. Destillieraufsatz nach Claisen (schematisch).

Bild 9-3. Destillationsbrücke mit Kühlmantel (Liebig-Brücke) und Vakuum-Vorstoß.

Bild 9-4. Destillationsbrücke nach Claisen (schematisch).
Die klassische Destillationsapparatur kann man auch in miniaturierter Ausführung kaufen (Bild #-5)

Bild 9-5. Apparatur zur Destillation im Halbmikro-Maßstab.
Gemeinsame Destillation nicht-mischbarer Flüssigkeiten
[Bearbeiten]Unter der Voraussetzung, dass die Komponenten nicht mischbar sind, ist der Dampfdruck des über der kräftig bewegten Flüssigkeit stehenden Dampfes bei gegebener Temperatur die Summe der Dampfdrücke, welche die einzelnen Komponenten (A,B,C...) des Gemisches in isoliertem Zustand hätten:
PTges = PTA + PTB + PTC + ...
Die einzelnen Komponenten verhalten sich daher im Idealfall in ihren Dampfdrücken unabhängig voneinander, zwischenmolekulare Kräfte sollen also nicht wirksam sein. Wichtig ist ferner, dass der Gesamtdruck PTges unabhängig ist vom relativen Anteil der Komponenten A,B,C...
Eine in der Praxis früh ausgeübte, apparativ einfache Anwendung dieses Falles ist die Wasserdampfdestillation, welche im Prinzip auf einer gemeinsamen Destillation (Co-Destillation) von Wasser und darin unlöslichen organischen Substanzen beruht.
Wasserdampfdestillation
[Bearbeiten]Eine Wasserdampf-Destillation hat den Zweck, auf relativ schonende Weise (Temperaturen um 100 °C) flüchtige organische Substanzen von nicht-flüchtigen Begleitstoffen abzutrennen. Die flüchtigen organischen Verbindungen müssen jedoch in Wasser unlöslich, exakter ausgedrückt: schwerlöslich, sein. In der Industrie ist die Gewinnung ätherischer Öle aus Pflanzenmaterial durch Wasserdampf-Destillation ein seit langem genutztes Verfahren. Auch zur Abtrennung flüchtiger Syntheseprodukte von (nicht-flüchtigen) Schmieren und Harzen kann die Wasserdampf-Destillation geeignet sein.
Für kleinere Ansätze, z. B. mit analytischer Zielsetzung, wie in den Praktikums-Versuchen Nr. #, genügt es, eine Suspension des zerkleinerten Pflanzenmaterials zusammen mit viel Wasser am absteigenden Kühler (Bild #-1) zu destillieren.
Für präparative Ansätze wird heißer Wasserdampf, der in einem Dampf-Generator entwickelt wird, durch das siedende heterogene Gemisch in Wasser geleitet (Bild #-6). Die Dämpfe werden kondensiert; in der Vorlage der Destillationsapparatur sammelt sich ein zweiphasiges Gemisch aus Wasser und organischer Substanz an, das im Scheidetrichter leicht voneinander getrennt werden kann.

Bild 9-6. Einfache Apparatur zur Wasserdampfdestillation. Im Dampferzeuger aus Metall (Kupfer), "Dampfkanne" genannt, wird Wasser zum kräftigen Sieden erhitzt (Bunsenbrenner). Sollte das Einleitungsrohr verstopft werden, wird es gefährlich! Der sich aufbauende Druck kann durch ein sogenanntes Steigrohr (Länge 1 bis 2 m) in der Dampfkanne abgebaut werden. Vorsicht: Das heiße Wasser kann bei starker Verstopfung oben heraussprudeln! Die Apparatur sollte daher in einem Abzug aufgebaut werden. Um den Wasserstand in der Dampfkanne beobachten zu können, ist dort eine Umleitung mit Schauglas angebracht (links im Bild). Um das Einleiten des heißen Dampfes rasch unterbrechen zu können, sollte eine Verzweigung (T-Stück) zwischen Dampferzeuger und Destillationskolben eingebaut werden; auf dem freien Schenkel sitzt ein Gummischlauch mit Quetschhahn.
Die Wasserdampf-Destillation von Limonen, dem Hauptbestandteil des ätherischen Öls aus Citrus-Fruchtschalen, soll als Beispiel betrachtet werden. In Bild #-7 ist ein Ausschnitt aus den Dampfdruck-Kurven von Limonen und Wasser wiedergegeben.

Bild 9-7. Dampfdruck-Kurven von Limonen und Wasser im Bereich von 95-100°C.
Der Siedepunkt des heterogenen Gemisches Wasser/Limonen ist bekanntlich die Temperatur, bei welcher der Gesamt-Dampfdruck Pges gleich dem Atmosphärendruck (unter Normalbedingungen, 760 Torr) ist. Aus dem Diagramm (Bild #-7) ist zu entnehmen, dass diese Bedingung bei einer Temperatur von ca. 97,5°C erfüllt ist; denn hier gilt:
P97,5 °Limonen = 66.3 Torr
P97,5 °Wasser = 694.5 Torr
P97,5 °ges = 760.8 Torr
Beachten Sie, dass nach der Theorie der Siedepunkt des Gemisches niedriger als der des reinen Wassers (100°C bei 760 Torr) liegt. Achten Sie bei Versuch Nr. #-# darauf, ob Sie dies bestätigen können. Der erniedrigte Siedepunkt wird so lange beibehalten, bis alles Limonen überdestilliert ist; erst dann steigt das Thermometer auf die Siedetemperatur des reinen Wassers an.
Der Vorteil der Wasserdampf-Destillation liegt auf der Hand: Reines Limonen würde bei 178 °C/760 Torr destillieren. Man müsste also das Pflanzenmaterial hoch erhitzen, wenn man daraus Limonen durch normale Destillation gewinnen wollte. Zersetzungsprozesse wären unvermeidlich. Außerdem findet beim Einleiten des Wasserdampfs bzw. beim intensiven "Durchkochen" des heterogenen Gemisches ein Aufschluss des pflanzlichen Gewebes statt.
Temperaturabhängigkeit des Dampfdrucks
[Bearbeiten]Der Dampfdruck ist eine Funktion der Temperatur. Der Zusammenhang kann durch eine Exponentialfunktion mit zwei empirisch zu bestimmenden Konstanten A und B beschrieben werden:
p = 10A-B/T
Diese Funktion (August-Gleichung) wurde aus der Clausius-Clapeyron-Gleichung abgeleitet. Die Antoine-Gleichung beschreibt den Zusammenhang durch eine Gleichung mit drei Parametern A, B und C:
p = 10A-B/T+C
Die Konstanten A, B und C sind für viele Stoffe bestimmt worden.[1]
In welchen Maßeinheiten gibt man den Druck an? Nach dem SI-System müsste er in Pascal-Einheiten (Pa) angegeben werden. Da jedoch Dampfdrücke in der Vergangenheit mit Quecksilber-Manometern gemessen wurden und in vielen Laboratorien auch noch werden, ist die Maßeinheit "Millimeter Quecksilbersäule" (mm Hg) oder Torricelli (Torr) sehr verbreitet. Mit elektronisch arbeitenden, modernen Manometern wird der Druck auch in bar oder millibar-Einheiten abgelesen.
Zur Erinnerung:
1 bar = 105 Pa = 0.1 MPa = 750,062 Torr
102 Pa = 1 Hektopascal (1 hPa)
1 Torr = 1.3332 mbar = 133.32 Pa = 1.333 hPa
1 hPa = 0.750 Torr
In Bild 9-8 ist eine Dampfdruckkurve von Wasser im Temperaturbereich 0 bis 100 °C gezeigt.

Bild 9-8. Dampfdruckkurve von Wasser
Die Gleichung von Clausius-Clapeyron und die August-Gleichung werden meist in logarithmischer Form angegeben:
log p = A - B/T
Trägt man also log p gegen die reziproke Temperatur 1/T auf, so erhält man Geraden.
Als Beispiel betrachten wir wiederum das Diagramm von Wasser.
Bild 9-9. Abhängigkeit des Dampfdrucks von Wasser von der Temperatur (T, in Kelvin, links) und der reziproken Temperatur (1/T, rechts ).
Der logarithmische Zusammenhang zwischen Dampfdruck und Temperatur führte zur Aufstellung einer in der Laborpraxis nützlichen Faustregel, die annähernd für viele organische Flüssigkeiten gilt:
"Eine Verminderung des äußeren Drucks um die Hälfte reduziert den Siedepunkt um etwa 15 °C."[2]
Siedet z. B. eine Flüssigkeit (Benzaldehyd) bei 178 °C/760 Torr, so kann man bei 380 Torr eine Siedetemperatur von ca. 163 °C erwarten, bei 190 Torr 148 °C. Im Grobvakuum (ca. 10 Torr) also 88 °C. Beobachteter Sdp. von Benzaldehyd: 60 °C bei 10 Torr.
Vakuumdestillation
[Bearbeiten]Viele organische Verbindungen halten eine Belastung durch höhere Temperaturen nicht aus. Deshalb ist es ratsam, bei thermolabilen Substanzen die Destillation unter möglichst schonenden Bedingungen auszuführen. Dazu arbeitet man bei vermindertem Druck ("im Vakuum", englische und ältere deutschsprachige Versuchsbeschreibungen: "in vacuo").
Erzeugung von Vakuum im Organischen Labor
[Bearbeiten]Im Praktikum für Anfänger beschränken wir uns auf Destillationen im sogenannten Grobvakuum. Man versteht darunter den Bereich unterhalb des Atmosphärendrucks bis herab zu ca. 15 mbar. In den Zeiten als man sich über den Preis von Wasser und Abwasser keine Gedanken machen musste und Umweltgesichtspunkte keine Rolle spielten, benutzte der Chemiker zur Erzeugung von Grobvakuum die Wasserstrahlpumpe (Bunsen, 1868, Minimaldruck 10-12 Torr, d.h. ca.15 mbar), deren Funktion aus dem anorganischen Praktikum bekannt sein dürfte. Ökologisch vorteilhafter, aber sehr viel teurer in der Anschaffung sind Membranvakuumpumpen, die auch im Praktikum verwendet werden.
Von den Herstellern werden Membranpumpen verschiedener Ausführung angeboten, u.a. einstufige und zweistufige. Die erreichbaren Enddrücke betragen 80 bzw. 15 mbar. Während bei der Wasserstrahlpumpe zur Messung des Druckes einfache, mit Quecksilber gefüllte Manometer aus Glas verwendet wurden und werden, dienen zur Druckmessung bei Membranpumpen elektronische Anzeigegeräte. Zweckmäßigerweise übernehmen diese auch Steuerungsfunktionen, indem sie den Druck regeln und konstant halten (Vakuum-Controller). Im Rotationsverdampfer werden Lösungsmittel "im Vakuum" schonend abdestilliert. Unter Umweltaspekten ist es wichtig, dass dabei möglichst geringe Mengen Lösungsmittel, vor allem chlorierte Kohlenwasserstoffe, in die Atmosphäre gelangen. Für die Kondensation der Lösungsmitteldämpfe ist selbstverständlich die Temperatur des Kühlwassers entscheidend, welche möglichst niedrig sein soll. Bei einer Kühlwassertemperatur von 15-20°C sollte die Siedetemperatur des abzudestillierenden Lösungsmittels nicht unter 40°C liegen, wenn eine weitgehende Kondensation der Lösungsmitteldämpfe durch Wasserkühlung angestrebt wird. Bei einer Wasserbad-Temperatur von 60-70°C im Rotationsverdampfer gibt man daher mit dem Vakuum-Controller einen geeigneten, d.h. auf das abzudestillierende Lösungsmittel abgestimmten Arbeitsdruck vor. Das volle, d.h. dem Arbeitsdruck entsprechende Vakuum wird jedoch nicht sofort "angelegt", sondern von höherem Druck aus, d.h. "von oben langsam angefahren" bis ausreichendes Sieden eintritt.
Hier stellt sich die Frage: Wie groß muß der Druck sein, damit ein Lösungsmittel bei 40°C bis 60°C rasch abdestilliert? Bei Kenntnis der Konstanten A, B und C der Antoine-Gleichung lässt sich der benötigte Arbeitsdruck berechnen. In der Praxis des chemischen Labors werden Tabellen verwendet, welche oft den Betriebsanleitungen der Vakuum-Controller beiliegen.
Feinvakuum wird meistens erst in den Praktika für Fortgeschrittene verwendet. Man erzeugt es mittels ölgedichteten Drehschieberpumpen (Öl-Drehschieberpumpe, Ölrotationspumpe), wobei in der Regel Drücke zwischen 10-2 und 10-4 mbar bzw. Torr erreicht werden können.
Beachten Sie, dass bei allen Arbeiten unter vermindertem Druck (Vakuum) unbedingt eine Schutzbrille getragen werden muss!
Destillation miteinander mischbarer flüchtiger Substanzen
[Bearbeiten]Physikalische Grundlagen
[Bearbeiten]Bei der Destillation von Gemischen flüchtiger Substanzen ist die Zusammensetzung der Dampfphase eine andere als die der flüssigen Phase; in der Dampfphase ist die leichter flüchtige Komponente angereichert (aber nicht ausschließlich vorhanden!). Als einfachstes Beispiel soll die Verdampfung zweier miteinander mischbarer Substanzen A und B unterschiedlicher Flüchtigkeit betrachtet werden, ein sogenanntes binäres Gemisch. Beim Verdampfen der Flüssigkeit müssen durch Zufuhr thermischer Energie die zwischenmolekularen Kräfte überwunden werden. Im idealen Fall sind die Wechselwirkungskräfte zwischen den ungleichen Molekülen (A...B) ebenso groß wie zwischen den gleichen (A...A, bzw. B...B). Das Raoultsche Gesetz konstatiert, dass bei gegebener Temperatur der Partialdruck einer Komponente eines idealen binären Gemisches eine Funktion der Zusammensetzung ist; und zwar ist der Partialdruck der Komponente A in der Gasphase (pA) gleich dem Produkt aus dem Dampfdruck der reinen Substanz A (PA) und ihrem Molenbruch xA in der flüssigen Phase: pA = PA × xA
Analog gilt für den Partialdruck von B:
pB = PB • xB
Der Gesamtdampfdruck in der Gasphase über diesem binären Gemisch A+B setzt sich additiv aus den Partialdrücken der Komponenten A und B zusammen (Daltonsches Partialdruckgesetz):
Pges = pA + pB
Anschaulich können diese Beziehungen durch Dampfdruckdiagramme (p,x-Diagramme) dargestellt werden, wobei der Dampfdruck als Funktion des Molenbruchs oder der Molprozente in der flüssigen Phase dargestellt wird. So erhält sich zum Beispiel das System Benzol/Toluol für alle Mischungsverhältnisse nahezu ideal. Mischt man zu Benzol Toluol, so nimmt der Dampfdruck der Mischung linear mit dem Molenbruch von Toluol ab, ebenso sind die Partialdrucke von Benzol und Toluol linear von den Molenbrüchen abhängig.
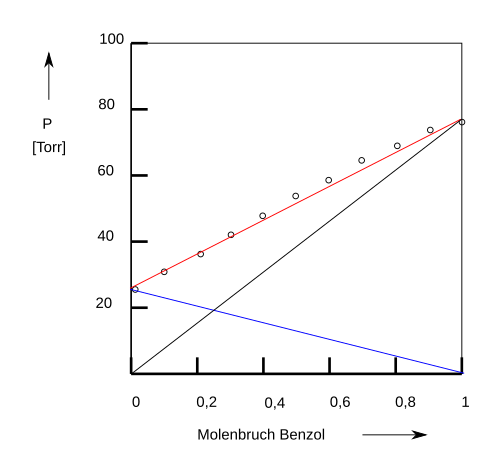
Bild 9-11. Dampfdruckdiagramm (P,x-Diagramm) eines homogenen Gemisches von Benzol und Toluol bei 20 °C. Die schwarze und blaue Geraden zeigen die Partialdrücke von Benzol bzw. Toluol an.
Beim Destillieren in der Praxis ist man jedoch weniger am Dampfdruck als Funktion variabler Temperatur sondern an der Siedetemperatur bei konstantem Druck, in der Regel bei Atmosphärendruck, interessiert. Graphisch lässt sich die Abhängigkeit der Siedetemperatur von der Zusammensetzung der flüssigen Phase durch das sog. Siedepunktsdiagramm (Siedediagramm, T,x-Diagramm) darstellen. Es besteht aus zwei Kurven, der Siedekurve (für die Flüssigkeit) und der Kondensationskurve (für den Dampf, auch Taupunktskurve genannt). Für ein ideales binäres Gemisch sind die Kurven gekrümmt und steigen monoton (Bild #-13).
So verhält sich das System Aceton/Butanon nahezu ideal; offensichtlich besteht kein großer Unterschied in den Wechselwirkungskräften von Aceton- und Butanon-Molekülen.

Bild 9-12. T,x-Diagramme von Aceton/Butanon aus verschiedenen Messungen.

Bild 9-13. Siedediagramm eines idealen binären Gemisches bei konstantem Druck. Die untere Kurve spiegelt die Zusammensetzung der siedenden flüssigen Phase wieder; die obere Kurve gibt die Zusammensetzung des Dampfes an.
Betrachten wir eine Destillation anhand dieses Diagramms: Destilliert man ein Gemisch mit dem Molenbruch x1 = 0,37 (entspricht 37 Mol%) der höhersiedenden Komponente A, so ist ihr Molenbruch im Dampf nur y1 = ca. 0,14 (entspricht ca. 14 Mol% A). Führt man das Verdampfen weiter, so verarmt die flüssige Phase zunehmend an der tiefer siedenden Komponente, infolgedessen steigt die Siedetemperatur der Flüssigkeit an.
Azeotrope Gemische
[Bearbeiten]Beim Destillieren binärer Flüssigkeitsgemische wird das durch die Gesetze von Raoult und Dalton beschriebene Siedeverhalten keineswegs immer beobachtet; es gibt Abweichungen. Der Grund ist, dass die zwischenmolekularen Kräfte zwischen Molekülen verschiedener Art (A...B) größer oder kleiner sind als die zwischen gleichen Molekülen (A...A bzw. B...B). Man spricht von nicht-idealem Verhalten und von realen Mischungen. Die Siedediagramme solcher Flüssigkeitsgemische können die Besonderheit aufweisen, dass sich Siedekurve und Kondensationskurve berühren, d.h. einen gemeinsamen Punkt besitzen. Hier ist die Zusammensetzung der Dampfphase dieselbe wie die der flüssigen Phase. Das aus dem kondensierten Dampf gebildete Destillat unterscheidet sich also im Siedepunkt nicht von der Flüssigkeit vor der Destillation: Man nennt solche Flüssigkeiten azeotrope Gemische oder kurz Azeotrope. Bei ’normalem‘ Siedeverhalten spricht man auch von zeotropen Gemischen (griechisch zeo, ξέω, sieden, kochen).
Man unterscheidet zwei Arten von Azeotropen: Beim ersten ist die Wechselwirkung A...B größer als der Mittelwert von A...A und B...B, d.h. die verschiedenen Moleküle ziehen sich stärker an. Dann ist die Mischung weniger flüchtig als nach dem Raoultschen Gesetz zu erwarten; die Dampfdruckkurve weist bei bestimmter Zusammensetzung ein Minimum auf (negative Abweichung vom Raoultschen Gesetz).
Beispiel: Der Dampfdruck im System Aceton/Chloroform ist niedriger als für die ideale Mischung erwartet, weil Wasserstoffbrücken die Aceton- und Chloroform-Teilchen in der Mischung zusammenhalten.

Bild 9-14. Dampfdruckdiagramm eines Chloroform/Aceton-Gemischs (P,x-Diagramm) bei 20 °C.
Eine Siedekurve dieses homogenen Gemisches ist in folgender Abbildung dargestellt (Bild #-15). Am Punkt, wo sich die beiden Kurven berühren, siedet das Flüssigkeitsgemisch bei höherer Temperatur als die reinen Komponenten. Der Siedepunkt dieses Azeotrops beträgt bei Atmosphärendruck 64,7 °C und liegt für den Molenbruch von Aceton bei 0,37. Aceton bildet mit vielen Lösungsmitteln Azeotrope. Für die Praxis im Labor ist dies wichtig: Die Wiedergewinnung (Recycling) von reinem Aceton durch bloße Destillation (Rektifikation, siehe unten) ist schwierig.
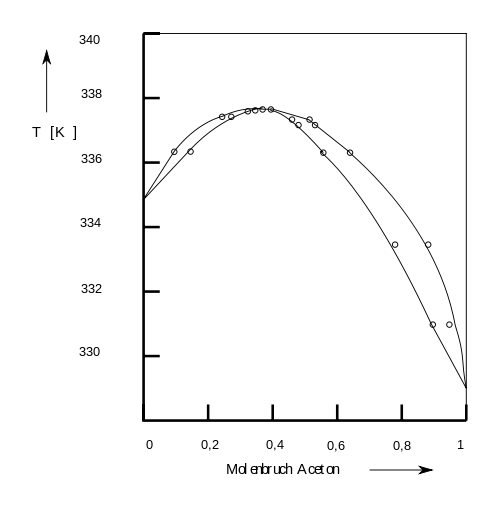
Bild 9-15. T,x-Diagramm von Aceton/Chloroform bei 760 Torr.
Das System Aceton/Chloroform ist ein Beispiel für Azeotrope mit Siedepunktsmaximum. Viele im organischen Labor auftretende Azeotrope weisen jedoch Siedepunktsminima auf.

Bild 9-16. Siedediagramme azeotroper Gemische zweier Flüssigkeiten (schematisch). Oben: Azeotrop mit Siedepunktsmaximum. Unten: Azeotrop mit Siedepunktsminimum. Auf der Ordinate wird der Molenbruch, gelegentlich auch Gewichtsprozente, aufgetragen.
Das wohl in der Praxis wichtigste Beispiel (Biotechnologie) ist das System Ethanol/Wasser. "Bioalkohol" wird bekanntlich durch Vergärung (Fermentation) zuckerhaltiger pflanzlicher Rohstoffe gewonnen. Die dabei entstehenden wässrigen Flüssigkeiten enthalten aber relativ geringe Mengen Ethanol und müssen daher durch Destillation angereichert werden. Allerdings ist das Siedediagramm Ethanol/Wasser sehr ’asymmetrisch‘; das konstant siedende Gemisch enthält 89 Mol% Ethanol (Molenbruch x = 0.89, das sind 96 Gewichtsprozent. Ein alkoholärmeres Gemisch kann man durch systematisch wiederholte Destillation (Rektifikation, s.u.) bis auf 89 Molprozent anreichern. Dann kondensiert nur noch der Dampf des Azeotrops ("96-prozentiges Ethanol").
Bild 9-17. Siedediagramm von Ethanol/Wasser-Gemischen.
Acetonitril/Wasser
Im Praktikum werden wir später mit dem Lösungsmittel Acetonitril arbeiten. Bei dem Versuch entstehen als Abfall wässrige Lösungen, die entsorgt werden sollten (Recycling). Das binäre Gemisch Wasser/Acetonitril zeigt eine starke Abweichung vom idealen Verhalten. Für den Gesamtdruck fand man eine nach oben stark gekrümmte Kurve, die im Bereich von x = 0.2 bis ca. 0.8 ziemlich flach wird und dann wieder abfällt.

Bild 9-18. Dampfdruckdiagramm (P,x) von Wasser/Acetonitril bei 60 °C (333 K).
Das Dampfdruckmaximum hat zur Folge, dass das System Acetonitril/Wasser ein Azeotrop bildet, welches (bei 760 Torr) aus 69 mol% Acetonitril und 31 mol% Wasser besteht. In Gewichtsprozenten sind dies 83.5% Acetonitril und 16.5% Wasser. Der Siedepunkt dieses Gemisches beträgt 76.8°C. Reines Acetonitril hat den Siedepunkt 82°C bei 760 Torr, Wasser natürlich 100°C. Das Siedediagramm (T,x) von Wasser/Acetonitril ist in Bild #-18 gezeigt.
Bild 9-19. Siedediagramm (T,x) von Wasser/Acetonitril bei 760 Torr (1013 mbar).
Beachte: Das Wasser in azeotropen Lösungsmitteln kann also durch Destillation nicht vollständig entfernt werden. Es muss durch andere Verfahren "herausgeholt" werden (Trocknen des Lösungsmittels, "Absolutieren").
Weitere Anwendungen der azeotropen Destillation
Da Azeotrope bei definiertem Druck eine genau bekannte Zusammensetzung haben, kann man solche Gemische zur Herstellung oder Eichung anderer binärer Gemische verwenden. So stellt man aus dem 96-prozentigem Ethanol/Wasser-Azeotrop den pharmazeutisch verwendeten 70-prozentigen Alkohol her; dazu ist die Kenntnis des Mischungskreuzes nützlich.
In der organischen Synthesechemie dient die azeotrope Destillation gelegentlich zur Entfernung von Wasser aus Lösungen, z. B. nach Extraktionen und Verteilungs-Trennungen. Auch manche schwerflüchtige Chemikalien, die Wasser enthalten, lassen sich „azeotrop trocknen“. Man versetzt die zu trocknende Substanz mit einem Lösungsmittel, das mit Wasser ein Azeotrop bildet, z. B. Benzol, und destilliert.
Beispiel: Im Handel erhältliche p-Toluolsulfonsäure enthält Kristallwasser. Man kann dieses entfernen, indem man die Säure in Benzol auflöst und das Benzol/Wasser-Azeotrop abdestilliert (heute verwendet man vielleicht besser Toluol dazu). Bei Synthesereaktionen, die unter Abspaltung von Wasser erfolgen, kann häufig das „Reaktionswasser azeotrop entfernt“ werden. Beispiele: Synthese von Carbonsäureestern aus Carbonsäure und Alkoholen; Herstellung von Enaminen aus Carbonylverbindungen und sekundären Aminen.
Siedeanalysen, Siedegrenzen, Siedebereiche
[Bearbeiten]Zur Prüfung und Charakterisierung von Gemischen flüchtiger Komponenten wird häufig eine Siedeanalyse durchgeführt. Ein Beispiel aus der industriellen Praxis ist die Bestimmung des Siedeverlaufs flüssiger Mineralölkohlenwasserstoffe, z.B. Treibstoffe für Kraftfahrzeuge. Hierfür gibt es genormte Destillationsapparaturen, die unter nach DIN festgelegten Bedingungen betrieben werden müssen. Dabei wird die Flüssigkeit destilliert ; man beobachtet die Siedetemperatur und trägt in einer Tabelle die bei der jeweiligen Siedetemperatur in die Vorlage übergehende Destillatmenge ein. Anschließend erstellt man eine Grafik, in der auf der Abszisse die Menge des Destillats und auf der Ordinate die jeweilige Siedetemperatur aufgetragen wird. Die Destillation wird ohne Kolonne durchgeführt; nicht mit "fraktionierender (‘fraktionierter’) Destillation" verwechseln!
Als Beispiel könnten wir im Praktikum Superbenzin-Sorten untersuchen. Wegen der Geruchsbelästigung durch intensiv riechende Komponenten der Treibstoffe können wir ersatzweise auch das Lösungsmittel Petroläther einer Siedeanalyse unterziehen (Versuch #-#).
Systematisch wiederholte Destillationen
[Bearbeiten]Eine einmalige Destillation liefert nur dann reine Substanzen, wenn sich die Dampfdrücke bzw. Siedepunkte der Komponenten sehr stark unterscheiden. Ist diese Voraussetzung nicht gegeben, so kann die Destillation in systematischer Weise wiederholt werden. Wir betrachten dazu das Siedediagramm eines binären Gemisches mit nahezu idealem Verhalten: Aceton/Butanon

Bild 9-20. Siedediagramm eines Gemisches von Aceton und Butanon bei 760 Torr.
Erhitzt man ein Aceton/Butanon-Gemisch der Zusammensetzung x1 = 0,29 zum Sieden (siehe Siedediagramm, Sdp. ca. 71 °C), so erhält man einen Dampf der anfänglichen Zusammensetzung y1 = 0,45 der also reicher an Aceton ist als die ursprüngliche Flüssigkeit. Kondensiert man den Dampf, so erhält man eine flüssige Fraktion mit demselben Acetongehalt, d.h. eine Anreicherung. Man hat durch einfache Destillation des Flüssigkeitsgemischs in eine acetonreichere und eine acetonärmere Fraktion zerlegt. Wiederholt man die Destillation mit dieser Fraktion, so erhält man eine noch acetonreichere Fraktion x2 = 0,62. Eine dritte Destillation mit x2 = 0,62 liefert schließlich x3 = 0,78, und so weiter.
Dies ist nur ein Modellversuch; in der Praxis wäre diese Verfahrensweise zu langwierig und unökonomisch. Als Annäherung an dieses Prinzip kann die relativ einfach durchzuführende Fraktionierende Destillation betrachtet werden.
Fraktionierende Destillation
[Bearbeiten]Diese Technik wird in der Standardapparatur zur "einfachen“ Destillation durchgeführt (siehe oben, Bild #-1), häufig im Vakuum. Das zu destillierende Gemisch wird im Siedekolben langsam erhitzt, bis Destillat in den Vorlagekolben zu tropfen beginnt. Man notiert die vom Thermometer angezeigte Siedetemperatur.
Die Siedetemperatur wird langsam ansteigen, da bei fortschreitender Destillation der Dampf an der leichter flüchtigen Komponente (d.h. diejenige mit dem niedrigeren Siedepunkt) verarmt. Hat die Siedetemperatur einen bestimmten Wert erreicht, ist beispielsweise 10 Kelvin höher geworden, wechselt man rasch – bei laufender Destillation – den Vorlagekolben und fängt darin die zweite Fraktion auf. Steigt die Siedetemperatur weiter an, sammelt man eine dritte Fraktion, usw. Das Gemisch wird also in verschiedene Fraktionen unterschiedlicher Siedepunkte zerlegt; im Laborjargon: man ’schneidet‘ durch ’fraktionierte Destillation‘ (grammatikalisch falsch!) verschiedene Fraktionen. Die einzelnen Fraktionen werden traditionell durch ihren Brechungsindex und/oder durch ihre Dichte charakterisiert. Wesentlich aussagekräftiger ist jedoch die Aufnahme eines Gaschromatogramms oder 1H-NMR-Spektrums.
Führt man die Destillation unter Vakuum durch, darf sich beim Wechseln der Vorlage der Druck nicht ändern. Dafür hat man die sogenannte ’Spinne‘ ersonnen: Durch Drehen der Normschliff-Hülse können die an der Spinne befestigten Vorlagekolben (in der Regel drei bis vier) gewechselt werden.
Die Trennleistung bei fraktionierenden Destillationen wird wesentlich verstärkt, wenn man auf den Siedekolben noch eine Destillationskolonne (siehe unten) setzt. Für Laborversuche wird meistens eine Einstichkolonne (Vigreux-Kolonne) verwendet. Diese kann mit dem Destillieraufsatz und Liebig-Kühler zu einem Gerät verschmolzen sein (Bild #-21).

Bild 9-21. Fraktionierende Destillation im Vakuum. Verspiegelte Vigreux-Kolonne mit angeschmolzenem Destillieraufsatz und Liebig-Kühler. Vorstoß und Spinne mit Auffangkolben für die Fraktionen des Destillats wurden mit Normschliffen angebaut. Um Siedeverzüge zu vermeiden, wird die Flüssigkeit im Siedekolben durch ein Magnetrührstäbchen in Bewegung gehalten. Das Ölbad (Silikonöl) wird auf dem heizbaren Magnetrührgerät erwärmt. Zur Steuerung der Badtemperatur diente ein Kontaktthermometer. Das Destillationsthermometer vor dem Kühler ist nur teilweise sichtbar.
In der Vigreux-Kolonne steht für den Stoffaustausch zwischen flüssiger Phase und Dampfphase eine größere Fläche zur Verfügung als im Destillieraufsatz der „einfachen“ Standard-Destillationsapparatur. Eine detaillierte mathematische Beschreibung des Trennvorgangs bereitet jedoch große Schwierigkeiten. Daher beschreibt man den Vorgang als Analogie mit der Funktionsweise von großen Destillationskolonnen, die in der Technischen Chemie zur Rektifikation benutzt werden.
Rektifikation – Destillation in Kolonnen
[Bearbeiten]Im Praktikum Organische Chemie für Anfänger/innen dürften Destillationen in leistungsfähigen Kolonnen weniger auf dem Programm stehen, da die benötigten Apparaturen relativ teuer sind, und die Versuche viel Zeit benötigen. Bei der Wiedergewinnung von Lösungsmitteln (Recycling) und deren Reinigung sind jedoch Destillationskolonnen unentbehrlich. Solche Arbeiten sollten auch in Anfängerpraktika wenigstens von einigen Studierenden unter Anleitung durch Betreuer/innen durchgeführt werden, weshalb hier wesentliche Aspekte dieses Themas kurz behandelt werden sollen.
Der Trennvorgang in Destillationskolonnen lässt sich in einem physikalischen Modell als Folge systematisch wiederholter einzelner Destillationsschritte – wie oben beschrieben – auffassen. Die Theorie dieser Modelle wurde für die Chemische Verfahrenstechnik entwickelt (siehe Wikipedia-Artikel am Ende des Kapitels).
Um das Prinzip zu verstehen, betrachten wir zunächst die Funktion einer
Glockenbodenkolonne.


Bild 9-22. Schema einer Bodenkolonne zur Destillation in der chemischen Technik.
Das zu trennende Flüssigkeitsgemisch befindet sich in einem heizbaren Gefäß (in der Technik auch „Destillationsblase“ genannt, im Bild "Verdampfer"), auf den ein Rohr aufgesetzt ist. Dieses enthält Einbauten, in denen sich Flüssigkeit kondensieren kann, die sogenannten Böden. Die Böden sind mit Öffnungen versehen, durch welche der Dampf aufsteigen kann. Glockenförmige Einbauten zwingen den Dampf, durch das Kondensat auf dem Boden durchzuströmen. Der Dampf, der mit der flüchtigeren Komponente angereichert ist, wird im ersten, noch kalten Boden kondensiert. Das Kondensat fließt zurück und verdampft beim Rückströmen erneut. Mit zunehmender Erwärmung verdampft auch die Flüssigkeit des ersten Bodens und ihr Dampf wird auf dem zweiten Boden kondensiert. Das Spiel wiederholt sich, bis nach Passage aller Böden der Dampf zum Rückflusskühler gelangt und dort vollständig kondensiert wird.
Anmerkung zu Bild 9-22: Bei industriellen Destillationen (Rektifikationen) kann man in mittlerer Höhe der Kolonne Flüssigkeit zuführen ("Zulaufboden"). Zum Verständnis der Wirkungsweise braucht hier nicht darauf eingegangen zu werden.
Im Siedediagramm (z. B. Aceton/Butanon, Bild #-20) kann man die Anreicherung der niedriger siedenden Komponente verfolgen. Der besseren Anschaulichkeit wegen, soll das Prinzip nochmals im allgemeinen Fall erläutert werden (Bild #-23).

Bild 9-23. Schema einer mehrstufigen Destillation.
Das zu destillierende Gemisch (S) liefert einen Dampf, der im Kühler zu einer Flüssigkeit D1 kondensiert. In dieser ist die leichter flüchtige Komponente B angereichert (Molenbruch xB). Im Siedekolben (’Sumpf‘) verbleibt die Flüssigkeit W1, die hautsächlich die schwerer flüchtige Komponente A und nur wenig B enthält. W1 kann „abgezogen“ werden. Das Kondensat D1 wird wieder destilliert: Der Dampf liefert nach Abkühlen die Flüssigkeit D2; im Sumpf bleibt W2 zurück. Schließlich ergibt die zweite Wiederholung das Destillat D3, in welchem B stark angereichert ist. Die Flüssigkeiten W2 und W3 müssten nochmals destilliert werden.
Solange kein Kondensat am „Kopf“ der Kolonne (d.h. am oberen Ende, vor dem Rückflusskühler) entnommen wird, sollte sich das System Flüssigkeit/Dampf im thermodynamischen Gleichgewicht befinden. Entnimmt man aber Kondensat am Kopf, so wird prinzipiell das Gleichgewicht gestört. Um aus diesem Dilemma herauszukommen, verwendet man Vorrichtungen, durch welche nur ein Teil der im Rückflusskühler kondensierten Flüssigkeit abgeführt werden kann (Kolonnenkopf). Zwar wird dann das Gleichgewicht doch gestört, aber für die Praxis ist eine geringfügige Störung vertretbar. Entscheidend ist, dass ein möglichst großer Teil des Dampfes in die Kolonne zurückfließt.
Der Quotient aus zurückfließender Stoffmenge und entnommenem Destillat wird Rücklaufverhältnis genannt. Dieses muss der speziellen Trennaufgabe angepasst werden: Liegen die Siedepunkte der Komponenten weit auseinander, kann man ein kleines Rücklaufverhältnis wählen, um in angemessener Zeit die Trennung durchführen zu können. Bei Stoffen, deren Dampfdrücke bzw. Siedepunkte sich wenig unterscheiden, muss mit hohem Rücklaufverhältnis gearbeitet werden, was selbstverständlich die Arbeitszeit erhöht. Also muss ein Kompromiss eingegangen werden.
Die Rektifikationskolonne mit Glockenböden ist zwar anschaulich, wird aber nur in der industriellen chemischen Verfahrenstechnik, nicht jedoch im Laboratorium benutzt. Denn die Dimensionen und der Betriebsinhalt von Glockenbodenkolonnen sind zu hoch für den Laborbetrieb. Hier werden Kolonnen mit kleinerem Betriebsinhalt verwendet: an die Stelle der Böden treten Füllkörper. Die Oberfläche für den Stoffaustausch Flüssigkeit/Dampf wird stark erhöht, wenn man das Glasrohr der Labor-Kolonne mit Ringen aus Glas oder Keramik (Raschig-Ringe) oder Wendeln beschickt (Füllkörper-Kolonnen).
Bei Destillationen im Vakuum können jedoch Füllkörper hinderlich sein, da diese durchgewirbelt werden können, wenn plötzlich größere Druckdifferenzen auftreten. In diesem Fall werden Einstich-Kolonnen (Vigreux-Kolonnen) bevorzugt, welche allerdings eine geringere Oberfläche und damit Trennleistung haben.

Bild 9-24. Links: Schema einer mit Raschig-Ringen gefüllten Destillationskolonne. HETP = Height equivalent to a theoretical plate, siehe unten. Rechts: Prinzip einer Einstich-Kolonne (Vigreux-Kolonne).

Nach der Theorie der Rektifikation soll bei einer Kolonne kein Wärmeaustausch mit der Umgebung (Laborluft) stattfinden (adiabatische Betriebsweise). Um diesen zu verhindern oder möglichst gering zu halten, kann man die Kolonnen mit Aluminiumfolien oder Vliesen aus Glaswolle isolieren. Meistens sind jedoch Glaskolonnen mit einem angeschmolzenen Glasmantel versehen, der auf der Innenseite versilbert ist. So sollen Verluste durch Wärmestrahlung vermindert werden. Der Raum zwischen Kolonnenrohr und Glasmantel wird evakuiert.

Bild 9-25. Destillation in einer verspiegelten Glaskolonne mit Kolonnenkopf.
Im Labor werden Kolonnenköpfe aus Glas verwendet, bei welchen ein Intensivkühler (Schlangenkühler) mit einem „Kragen“ verschmolzen ist, in dessen Rinne sich das Kondensat sammeln kann. Dieses kann durch einen Hahn tropfenweise abgenommen werden. In diesem einfachen Fall kann das Rücklaufverhältnis definiert werden als
- Zahl der in die Kolonne rückfließenden Tropfen/Zahl der Tropfen entnommener Flüssigkeit.
Bei einem Kolonnenkopf aus Glas können die rückfließenden Tropfen visuell beobachtet werden.
Kolonnenköpfe mit Magnetventil und angeschlossenem elektronischem Steuergerät erlauben, eine Rektifikation im Labor automatisch und mit variablem Rücklaufverhältnis über viele Stunden hinweg durchzuführen.

Bild 9-26. Destillation (Rektifikation) im Labor mit Steuergerät für die Temperatur des Heizbads und den elektromagnetisch betriebenen Kolonnenkopf.
Die Dimension einer im Labor verwendeten Kolonne sollte dem zu lösenden Trennproblem angepasst werden. Je schwieriger die Trennung ist, desto länger sollte die Kolonne sein. Ihre Trennleistung wird definiert, indem man auf das physikalische Modell der Bodenkolonnen zurückgreift. Ein bestimmter Abschnitt der Füllkörper- oder Vigreux-Kolonne entspricht in seiner Trennwirkung einem einzelnen Boden im Modell; anders ausgedrückt: die Höhe (der benutzten Kolonne) ist einem theoretischen Boden äquivalent (HETP, Height equivalent to a theoretical plate) (Bild #-24). Durch Destillation von Testgemischen kann die Trennstufenhöhe und Trennstufenzahl einer Kolonne ermittelt werden.
Einzelnachweise
- ↑ Vapor liquid equilibrium data collection : tables and diagrams of data for binary and multicomponent mixtures up to moderate pressures; constants of correlation equations for computer use, J. Gmehling, U. Onken, DECHEMA, Frankfurt am Main 1979 und folgende Bände (Chemistry data series, Deutsche Gesellschaft für Chemisches Apparatewesen).
- ↑ Organikum. Organisch-chemisches Grundpraktikum, von einem Autorenkollektiv. 7. Aufl., Deutscher Verlag der Wissenschaften, Berlin, 1967.
Artikel in Wikipedia:
Rektifikation (Verfahrenstechnik Rektifikationskolonne Glockenboden (Destillation) Kontinuierliche Destillation
Literatur
[Bearbeiten]- Rudolf Bock, Methoden der Analytischen Chemie. Eine Einführung, Bd. 1: Trennungsmethoden. Verlag Chemie, Weinheim, 1974. ISBN 3-527-25502-8.
- Organikum. Organisch-chemisches Grundpraktikum, von einem Autorenkollektiv. 7. Aufl., Deutscher Verlag der Wissenschaften, Berlin, 1967 und spätere Auflagen. Aktuell: Verlag Wiley-VCH, Weinheim, 23. Auflage 2009, ISBN 978-3-527-32293-3
- Erich Krell, Handbuch der Laboratoriumsdestillation: mit einer Einführung in die Pilotdestillation. 3. Aufl., Hüthig, Heidelberg u.a., 1976. ISBN 3-7785-0340-5.
- Adolf Schmidt, Destillation, in Ullmanns Encyklopädie der technischen Chemie, 4. Auflage, Band 5: Analysen- und Messverfahren, S.75-90, Verlag Chemie, Weinheim, 1980.
Versuche
[Bearbeiten]- Trocknen und Destillieren von Toluol
- Isolierung des ätherischen Öls aus Orangenschalen durch Wasserdampf-Destillation
- Isolierung des ätherischen Öls aus Kümmel durch Wasserdampfdestillation
- Vakuumdestillation von Orangenschalen-Öl
- Siedeanalyse von Petrolether
- Fraktionierende Destillation eines Methanol/Wasser-Gemischs
Qualitative Analyse
[Bearbeiten]Natrium-Aufschluss
[Bearbeiten]Nach Erhitzen einer Substanz mit Natrium und anschließendem Lösen des Rückstandes in Wasser entsteht eine alkalische wässrige Lösung mit folgenden Natriumsalzen:
- Natriumcyanid (NaCN), wenn Stickstoff in der Substanz enthalten war,
- Natriumsulfid (Na2S), wenn Schwefel enthalten war,
- Natriumthiocyanat (NaSCN), wenn Stickstoff und Schwefel enthalten waren (selten),
- Natriumhalogenide, wenn Halogene enthalten waren.
Weiterhin verbrennen bei der Hitze Kohlenstoff und Wasserstoff zu Kohlendioxid und Wasser, welche schnell entweichen. Diese Substanzen werden bei dieser Probe nicht nachgewiesen.
Durchführung
[Bearbeiten]Etwas organische Substanz (5-20 mg) wird in ein Glühröhrchen gegeben, dann wird ein frisch geschnittenes, höchstens linsengroßes, Stückchen Natrium in den Hals des Glühröhrchens gelegt. Nun wird das Röhrchen mit spitzer Flamme dort erhitzt, wo das Natriumstück aufliegt. Das Natrium schmilzt und fließt heiß in die organische Substanz. Es tritt eine oft heftige Reaktion ein. Sobald die Reaktion etwas abklingt, wird das Glühröhrchen mit einer Bunsenbrennerflamme zur Rotglut erhitzt. Noch heiß wird es in ca. 5 - 10 ml destilliertes Wasser gebracht (Vorsicht! heftige Reaktion! Nicht umgesetztes Natrium verbrennt dabei!). Das Röhrchen platzt und die entstandenen Salze gehen in Lösung. Das zersprungene Glas und Ruß-Rückstände werden abfiltriert und man erhält eine klare, stark alkalische Lösung der Natriumsalze.
Problematisch ist, dass leicht flüchtige Substanzen verdampfen, bevor sie mit Natrium umgesetzt werden. Dementsprechend eignen sich solche Substanzen nicht für die Elementaranalyse durch Natrium-Aufschluss.

Mit halogenierten Kohlenwasserstoffen, organischen Aziden, Diazoestern, Diazoniumverbindungen oder Nitroverbindungen kann es beim Natriumaufschluss zu heftigen Explosionen kommen. Daher darf nur mit kleinen Substanzmengen gearbeitet werden; die Sicherheitsvorschriften sind zu beachten.
Nachweise
[Bearbeiten]Bei allen Nachweisen empfiehlt es sich, zusätzliche Blindproben durchzuführen. Dazu kann man entweder zusätzlich Substanzen aufschließen, bei denen man sicher ist, dass sie Stickstoff, Schwefel oder Halogene enthalten, oder man verwendet direkt verdünnte Lösungen der Salze, die man nachweisen will.

Der Nachweis von Stickstoff als Natriumcyanid sollte zuerst erfolgen, da für die anderen Nachweise angesäuert werden muss: Gefahr der Freisetzung von Blausäure (HCN) (extrem giftig!).
Stickstoff-Nachweis
[Bearbeiten]Stickstoff wird mit der Laissagne-Probe nachgewiesen. Wenn Natriumcyanid vorhanden ist, bildet sich Berliner Blau, welches an der charakteristischen blaugrünen Farbe zu erkennen ist. Kann Cyanid nachgewiesen werden, muss die alkalische Lösung zur Trockne eingeengt werden, so dass das Cyanid basisch verkocht wird.
Blindproben: Pyridin oder Anilin (zum Aufschluss), Kaliumcyanid (KCN) (als Salz)
Schwefel-Nachweis
[Bearbeiten]Schwefel bzw. Sulfid wird durch die Fällung von Bleisulfid nachgewiesen. Etwas von der Aufschluss-Lösung wird mit Essigsäure schwach sauer gemacht, dann wird eine verdünnte Lösung von Blei(II)-acetat zugetropft. Wenn Natriumsulfid (Na2S) enthalten ist, bildet sich schwarzes Blei(II)-sulfid (PbS). Unter Umständen kann sich das Gemisch auch weiß bis gelblich trüben. Dies passiert, wenn zusätzlich Natriumhalogenide vorhanden sind, die mit Blei(II) Halogenid-Niederschläge bilden.
Blindproben: Toluolsulfonsäure oder versch. Thiole (zum Aufschluss), Schwefelwasserstoff H2S oder Natriumsulfid Na2S (als Salz)
Thiocyanat-Nachweis
[Bearbeiten]Etwas Aufschluss-Lösung wird neutralisiert und eine verdünnte Eisen(III)-chlorid-Lösung zugetropft. Wenn Natriumthiocyanat vorhanden ist, bildet sich blutrotes Eisenrhodanid.
Blindprobe: Kaliumthiocyanat (KSCN)
Halogen-Nachweis (außer Fluorid)
[Bearbeiten]Etwas Aufschluss-Lösung wird mit Salpetersäure schwach sauer gemacht, dann wird eine 5%-ige Silbernitrat-Lösung zugetropft. Sind Natriumhalogenide vorhanden, fällt ein Niederschlag von Silberhalogeniden aus.
Probleme:
- Fluorid kann hierdurch nicht nachgewiesen werden.
- Thiocyanat ist ein Pseudohalogenid. Bei Anwesenheit entsteht weißes Silberthiocyanat. Dies kann Halogene/Halogenide vortäuschen.
- Die Silberhalogenidfällung funktioniert mit Thiocyanat, Chlorid, Bromid und Iodid. Welches davon entstanden ist, kann man durch einen Halogenid-Trennungsganges genau heraus finden.
Blindproben: Benzylchlorid oder Brombenzol durchgeführt werden (Aufschluss), Natriumchlorid, Natriumbromid, Ntraiumiodid als Salz.
Kurzanleitung des Halogenidtrennungsganges
[Bearbeiten]Silberthiocyanat und Silberchlorid sind weiß und lassen sich mit gesättigter warmer Ammoniumcarbonat-Lösung wieder auflösen. Silberbromid ist schwach gelblich und Silberiodid ist gelblich, Silberbromid löst sich in konzentriertem Ammoniakwasser; Silberiodid nicht. Silberiodid löst sich in konzentrierter Natriumthiosulfat-Lösung. Näheres zum Trennungsgang findet man in Praktikumsbüchern der anorganischen Chemie.
Fluorid-Nachweis
[Bearbeiten]
Etwas Analysensubstanz wird zur absoluten Trockne eingeengt (Bunsenbrenner-Flamme). Dann wird konzentrierte Schwefelsäure zugegeben. Ist Natriumfluorid anwesend, bildet sich Fluorwasserstoff, welcher die Glaswände des Reagenzglases ätzt. Die Ätzwirkung erkennt man daran, dass das Glas beim Schütteln nicht mehr gleichmäßig mit Flüssigkeit benetzt wird (Ätzprobe).
Blindprobe: Hier ist eine Blindprobe unbedingt erforderlich, z.B. mit Natriumfluorid.
Acetat-Anionen
[Bearbeiten]als Essigsäure
[Bearbeiten]Acetat-Ionen (CH3COO−) lassen sich mit Kaliumhydrogensulfat nachweisen, indem man das Salz, von dem man annimmt, dass es ein Acetat ist, mit Kaliumhydrogensulfat im Mörser zerreibt. Dabei wird das Proton (H+) des Hydrogensulfat-Ions auf das Acetation übertragen. Dabei entsteht Essigsäure, die leicht an ihrem typischen Geruch identifiziert werden kann.
- Acetat wird durch Hydrogensulfat protoniert. Es entsteht Essigsäure und Sulfat.
als Fruchtester
[Bearbeiten]Essigsäure lässt sich auch als Fruchtester nachweisen. Hierfür 100 mg Urprobe in ein 5 ml Becherglas mit drei bis vier Tropfen Schwefelsäure bedecken. Dann setzt man zwei Tropfen Amylalkohol hinzugeben zu. Ein fruchtartiger Geruch zeigt Acetat an.
- Essigsäure und Alkohol reagieren in einer Kondensationsreaktion zu einem Essigsäureester und Wasser.
Ethylacetat riecht nach Klebstoff (durch Ethanol)
Butylacetat riecht nach saurem Apfel (durch n-Butanol)
als Silberacetat
[Bearbeiten]Für den Nachweis als Silberacetat werden einige Tropfen Silbernitrat-Lösung dazu gegeben:
Es entsteht ein flockiger, weißer Niederschlag von Ag(CH3COO), der sich allerdings leicht in verdünnter Salpetersäure wieder löst. Der Nachweis gelingt deshalb nur in pH-Wert-neutraler Lösung und ist nicht eindeutig.
Butyrat-Anionen
[Bearbeiten]Butyrat-Ionen, also die Anionen der Buttersäure, lassen sich über ihren Methylester Buttersäuremethylester, oder kurz Methylbutyrat nachweisen. Dieser besitzt einen intensiven Geruch nach Apfel. Er ist einer von zwei Stoffen, die einen apfelähnlichen Geruch verbreiten. Der zweite wäre Pentylpentanoat, der sich jedoch nicht aus Methanol herstellen lässt, sodass dieses Nachweisverfahren sehr sicher für Butyrat-Ionen ist.
- Butyrat-Ionen und Methanol reagieren zu Methylbutyrat, der sich anhand seines Geruchs schnell identifizieren lässt, und Hydroxid-Ionen.
Eine weitere Möglichkeit, Butyrat-Ionen zu untersuchen, ist es, der Probe eine mittelstarke bis starke Säure zuzugeben. Entsteht ein ranziger Geruch nach verdorbener Butter, so waren Butyrat-Ionen in der Probe.
- Butyrat-Ionen und Schwefelsäure reagieren zur widerlich ranzig riechenden Buttersäure, und Sulfat-Ionen.
Tartrat-Anionen
[Bearbeiten]
Tartrat-Ionen sind die Säurerest-Ionen der Weinsäure. Sie lassen sich durch eine farbliche Komplexbildungsreaktion nachweisen. Der zu untersuchende Stoff wird, sofern dies noch nicht der Fall ist, in Wasser gelöst (siehe Bild, linkes Reagenzglas). Zu dieser wässrigen Lösung wird etwas frisch gefälltes Kupfer(II)-hydroxid gegeben, welches in neutraler Probelösung ausfällt (mittiges Reagenzglas). Anschließend wird mit Natronlauge die Lösung alkalisiert. Entsteht eine schwach dunkelblaue Lösung, so sind Tartrat-Ionen nachgewiesen. (rechtes Reagenzglas)
- Tartrat-Ionen, Kupfer(II)-Ionen und Hydroxid-Ionen reagieren zum Ditartratocuprat(II)-Komplexion, welcher tiefblau erscheint und Wasser
Die Fehling-Probe dient zum Nachweis von Aldehyden und reduzierenden Zuckern.
Durchführung
[Bearbeiten]
Lösung
[Bearbeiten]- Fehling I: 1,73 g Kupfer(II)-sulfat in 25 mL Wasser lösen
- Fehling II: 8,5 g Seignettesalz und 2,5 g Natriumhydroxid in 25 mL Wasser lösen
Analyse
[Bearbeiten]In ein Reagenzglas werden 2-3 mL Fehling I und Fehling II vereint. Dazu wird eine Spatelspitze der zu analysierenden Substanz gegeben und im siedenden Wasserbad erwärmt.
Bei positivem Nachweis bildet sich ein gelber oder roter Niederschlag ( Kupfer(I)-oxid). Aromatische Aldehyde schlagen gewöhnlich nicht an. Andere stark reduzierende Gruppierungen stören den Nachweis.
Spektroskopie
[Bearbeiten]Charakterische Banden in der IR-Spektroskopie
[Bearbeiten]Innerhalb des Bereiches von 4000–600 cm−1 existieren vier wichtige Teilbereiche:
- 3600–2500 cm−1: O–H, N–H, C–H Valenzschwingungen
- 2500–1900 cm−1: C≡C, C≡N, X=Y=Z Valenzschwingungen
- 1900–1500 cm−1: C=O, C=C, C=N, N=O Valenzschwingungen, δ(N–H)
- 1500–600 cm−1: Fingerprint-Bereich, Gerüstschwingungen
Die folgende Graphik schlüsselt den Bereich detailierter auf funktionelle Gruppen auf:

Strukturaufklärung
[Bearbeiten]Basispeaks
[Bearbeiten]Massenspektren bestehen aus mehrere unterschiedlichen Gruppen von Peaks:
- dem Molekülion
- Isotopenpeaks
- Fragmentpeaks
- metastabilen Peaks
Massenspektrometrie zeigt zunächst einmal einen Peak für das Molekülion, welches als Radikal- Kation M+. auftritt, als Resultat der Entfernung eines Elektrons aus dem Molekül. Im Spektrum von Toluen zum Beispiel taucht der Molekülionenpeak, analog zur Molekülmasse, bei m/z 92 auf. Der Molekülpeak ist jedoch nicht immer nachzuweisen oder kann sehr schwach ausgeprägt sein. In einer homologen Reihe verringert sich der Molekülpeak mit zunehmender Anzahl an Verzweigungen und mit zunehmender Masse. Das Molekülion zu identifizieren kann schwierig sein. Eine nützliche Hilfe ist dabei die Stickstoff-Regel: Wenn die Molekülmasse eine gerade Zahl ist, enthält die Verbindung keinen Stickstoff oder eine gerade Zahl an Stickstoffatomen. Molekülionen-Peaks sind häufig begleitet von einem M-1-Peak, der aus dem Verlust eines Wasserstoffradikals resultiert.
Weitere Peaks, mit einem m/z-Verhältnis größer als das des Molekülion, entstehen durch Isotopenverteilung. Der Peak von m/z 92 für Toluene resultiert aus einer monoisotopen Masse; Toluene ist hier vollständig durch die beiden häufigsten Isotope aufgebaut, 1H und 12C. Der sogenannte M+1-Peak entsteht durch ein eingebautes Isotop höherer Masse, entweder 2H oder 13C; der M+2-Peak besitzt zwei Isotopen höherer Masse, etc. Die natürliche Häufigkeit höherer Isotope ist für häufig vorkommende Elemente wie Wasserstoff, Kohlenstoff und Stickstoff gering und damit auch die Höhe der daraus resultierenden Isotopenpeaks, die Häufigkeit nimmt mit zunehmender Masse schnell ab. Bei Halogenen dagegen sind höherer Isotope recht häufig, was sich in einem charakteristischen Signal äußert.
Peaks mit einer geringeren Masse als das Molekülion sind das Resultat aus Fragmentierungsreaktionen. Der Peak mit der höchsten Intensität nennt sich Basispeak, er muss nicht unbedingt dem Molekülion entsprechen. Es existieren zahlreiche Reaktionswege für Fragmentierungen, aber lediglich neu gebildete Kationen tauchen im Massenspektrum auf, Radikalfragmente oder Neutralfragmente dagegen nicht. Metastabile Peaks sind breite Peaks bei nicht-ganzzahligen Massewerten. Diese Peaks resultieren aus Fragmenten mit geringerer kinetischer Energie, wenn Fragmentierungen vor der Ionisationskammer stattfinden.
Hauptfragmentierungsreaktionen
[Bearbeiten]Alpha-Spaltung
[Bearbeiten]
Heteroatome fördern die Spaltung der zu ihnen ständigen alpha-Bindung. Durch einen Elektronenstoß verliert ein Heteroatom ein Elektron aus einem freien, nichtbindenden Elektronenpaar und wird zu einem Radikal. Nach der Ionisation des Heteroatoms bewegt sich ein Elektron aus der sigma-Bindung eines direkt dem Heteroatom benachbarten C-Atoms (dem alpha-C-Atom) zum Heteroatom und bildet zusammen mit dem einzelnen Elektron des Heteroatoms eine Bindung zwischen Alpha-C-Atom und Heteroatom aus. So wird eine zweite Bindung zwischen Heteroatom und C-Atom aufgebaut und das einzelne Elektron des Heteroatoms wird neu gepaart. In Folge dessen wird gleichzeitig die ursprüngliche Bindung des Alpha-A-Atoms gelöst und dessen Bindungspartner wiederum zu einem Radikal.[1] (Seite 250) Verbindungen mit Heteroatomen, die von dieser Regel betroffen sind, sind unter anderem Amine, Alkohole, Ether, Thiole, Sulfide und Halogenide. Dabei ist der zerfallsdirigierende Effekt von
So sind die Fragmente von Aminen im Spektrum außerordentlich intensiv und gut zu erkennen, die Fragmente von Jodiden dagegen nur sehr schwach.[2] (S. 64−67) Dies hängt mit der Fähigkeit des Heteroatoms zusammen, die positive Ladung zu stabilisieren. Da Heteroatome eine hohe Elektronegativität besitzen, bereitet eine Stabilisierung positiver Ladung gewisse Schwierigkeiten. Daraus resultiert, dass eine homolytische Spaltung am besten durch Heteroatome hervorgerufen werden kann, deren Elektronegativität ähnlich der von Kohlenstoff ist – daraus resultieren die starken Peaks mit Stickstoff, dessen Elektronegativität der von Kohlenstoff am ähnlichsten ist.[3]
Bei mehreren, aufeinander folgenden Fragmentierungsreaktionen findet eine alpha-Spaltung nur einmal statt, da eine homolytische Spaltung in dem kathionischen Produkt einer alpha-Spaltung sehr energieaufwändig ist. In der Literatur sind nur wenige Ausnahmen bekannt.[1]
Benzyl-Allylspaltung
[Bearbeiten]Aromaten und Doppelbindungen führen ähnlich wie Heteroatome zu Alpha-Spaltungen. Benzylspaltungen sind hierbei ausgeprägter als Allylspaltungen, da der Energiegewinn bei ersteren größer ist. Wenn in einem Molekül eine Doppelbindung vorhanden ist, kann von einer Lokalisierung der Ladung an dieser ausgegangen werden. Am wahrscheinlichsten sind dann die Bildung eines Allylions durch Homolyse oder ein Allylradikal durch Heterolyse. Theoretisch könnte durch die resultierende Masse so bei offenkettigen Molekülen die Position der Doppelbindung herausgefunden werden. Praktisch ist dies leider nicht möglich, da der Fragmentierungsreaktion zahlreiche Isomerisierungsreaktionen vorausgehen. Diese Isomerisierungen können als Wasserstoffumlagerungen betrachtet werden. In alicyclische Verbindungen sind solche Isomerisierungen seltener. Eindeutige Ergebnisse liefert die Spaltung dagegen in Aromaten, da diese sehr stabil sind. Die Spaltung der Benzylbindung ist stark begünstigt, wodurch das Benzylion erzeugt wird. Dieses taucht bei fast allen Verbindungen, die Benzyl enthalten, als intensives Signal bei m/z 91 auf.[2] (S. 56–59)
Retro-Diels-Alder-Reaktion
[Bearbeiten]Bei der Retro-Diels-Alder-Reaktion wird ein Sechsring mit einer Doppelbindung entzyklisiert (zweifach gespalten) und man erhält eine En- und eine Dienkomponente. Das Dien ist der bevorzugte Ladungsträger. Die Retro-Diels-Alder-Reaktion kann sowohl im Molekülion, wie auch in einem Fragment stattfinden.[1] Die Reaktion liefert, sofern kein Stickstoff vorhanden ist, geradzahlige Fragmente aus geradzahligen Molekülionen, was unter den sonst meist ungeradzahligen Fragmenten auffällt. [2]
Einzelnachweise
[Bearbeiten]- ↑ 1,0 1,1 1,2 Manfred Hesse, Herbert Meier, Bernd Zeeh: Spektroskopische Methoden in der organischen Chemie. 7. Auflage, Georg Thieme, Stuttgart 1995, ISBN 3-13-576105-3.
- ↑ 2,0 2,1 2,2 Josef Seibl, Walter Wolfgang: Massenspektrometrie Studienbuch fur Studierende der Chemie nach dem Vordiplom. 2. Auflage, Akademische Verlagsgesellschaft, Frankfurt am Main 1970, ISBN 3-400-00000-0.
- ↑ R. Martin Smith: Understanding mass spectra: a basic approach. 2. Auflage, John Wiley & Sons, New Jersey 2004, ISBN 978-0471429494, S. 164–166.
Fettkennzahlen
[Bearbeiten]Iodzahl
[Bearbeiten]Die Iodzahl ist ein Maß für den Gehalt eines Fettes an ungesättigten Verbindungen (Doppelbindungen). Es ist die Menge in Gramm Iod, die an 100 Gramm Fett addiert werden kann.
Iodzahl nach Hanuš
[Bearbeiten]Diese Reaktionen müssen in saurem Milieu stattfinden. Zu einer bestimmten Menge A in g eines Fettes setzt man im Überschuss Iodbromid (IBr) hinzu. Die Iod- und Bromionen binden sich unter Aufspaltung an die Doppelbindungen.
Das überschüssige IBr versetzt man mit Kaliumiodid bis die gesättigte Lösung einen Niederschlag bildet. Dadurch wird das IBr zum I2 oxidiert, die Lösung färbt sich gelb. Nach der Zugabe von Stärkelösung als Indikator bildet sich ein blauer Iod-Stärke-Komplex, der durch seine Farbtiefe besser den Umschlagpunkt anzeigt. Der Iodgehalt wird mit 0,1 molarer Natriumthiosulfat-Lösung titriert. Diese Titration beruht auf einer Zerstörung des Iod-Stärke-Komplexes. Sobald die blaue Färbung in farblos umgeschlagen ist entsprechen B ml an verbrauchter Natriumthiosulfatlösung der dem umgesetzten Iod.
Anschließend werden 10ml der eingesetzten Iodbromidlösung mit Kaliumiodid versetzt und das I2 wird mit Natriumthiosulfat zurücktitriert. Der bei dieser Blindprobe ermittelte Verbrauch wird verdoppelt und als Wert C eingesetzt.
Die Iodzahl (IZ) wird mit der folgenden Formel berechnet:
Iodzahl nach Wijs
[Bearbeiten]Nach dieser Methode werden folgende Lösungen und Reagenzien benutzt:
- 0,2 n Iodlösung nach Wijs ( Iodmonochlorid)
- 0,1 n Natriumthiosulfat: 100 g Natriumthiosulfat-5-hydrat ( Na2S2O3•5 H2O) werden auf 4 Liter mit destilliertem Wasser aufgefüllt.
- 15%ige Kaliumiodid-Lösung: 150 g Kaliumiodid werden auf 1 Liter mit destilliertem Wasser aufgefüllt.
- 1%ige Stärke-Lösung: 5 g Stärke werden mit ca. 200 ml destilliertem Wasser gekocht, bis sich die Stärke gelöst hat. Anschließend wird auf 500 ml mit destilliertem Wasser aufgefüllt.
- Chloroform
- Kaliumdichromat
- Salzsäure, konz.
- Titer der Titrationslösung
Vor der Bestimmung der Iodzahl ist die Na2S2O3-Lösung zu normieren. Etwa 0,10 bis 0,15 g Kaliumdichromat werden auf 0,001 g genau in einen Erlenmeyerkolben eingewogen. Diese Lösung wird mit 20 ml Kaliumiodidlösung versetzt, danach wird mit etwa 5 ml konzentrierter Salzsäure angesäuert und mit destilliertem Wasser auf 50 ml aufgefüllt. Unter Zusatz von Stärkelösung, als Indikator, wird die einzustellende Natriumthiosulfat-Lösung bis zur Grünfärbung titriert.
Der Faktor (Titer T) berechnet sich wie folgt:
- T = (Einwaage Kaliumdichromat in mg)/(4,903 x Verbrauch an Natriumthiosulfat-Lösung)
- Der Umrechnungsfaktor nach der Reaktionsgleichung ist 4,903.
- Der Faktor für die Iodzahl: T x 1,269
Nach den Regeln der Guten Laborpraxis sind drei Bestimmungen auszuführen. Wenn diese nicht weiter als 1 % auseinanderliegen, wird der Mittelwert gebildet.
- Durchführung
Die Einwaage richtet sich nach der erwarteten Iodzahl:
- Einwaage in Gramm = (10 x Faktor)/erwartete Iodzahl
- Faustregel: Der Verbrauch im Hauptversuch muss wenigstens 50 % des Verbrauchs im Blindversuch haben.
Die Einwaage an Fett erfolgt auf 0,1 mg genau in einen 250 ml Erlenmeyerkolben und wird in etwa 20 ml Chloroform gelöst. Dazu werden exakt 20 ml Iodlösung nach Wijs zugegeben, kräftig geschüttelt und verschlossen eine Stunde im Dunkeln belassen.
Anschließend werden 10 ml Kaliumiodidlösung zugegeben und unter Zusatz von Stärkelösung mit der normierten 0,1 n Natriumthiosulfat-Lösung titriert.
In gleicher Weise wird ein Blindversuch durchgeführt, damit unbeabsichtigte Einflüsse ausgeglichen werden.
- Berechnung
Die Iodzahl errechnet sich nach folgender Formel: IZ = (F x ( A - B)) / E
- F = Faktor der Iodzahl
- A = Verbrauch an 0,1 n Natriumthiosulfat im Blindversuch
- B = Verbrauch an 0,1 n Natriumthiosulfat im Hauptversuch
- E = Einwaage in g
Die Esterzahl (EZ) ist eine der Fettkennzahlen. Sie bezeichnet die Masse an Kaliumhydroxid, bzw. Kalilauge in Miligramm, die benötigt wird, um die in 1 Gramm Fett enthaltenen Esterbindungen zu hydrolisieren (zu verseifen).
Die Berechnung der Esterzahl erfolgt mit:
- Esterzahl = Verseifungszahl (VZ) − Säurezahl (SZ)
Bestimmung der durchschnittlichen molaren Masse einer Fettsäure mit Hilfe der Esterzahl
Um ein Glycerin zu verseifen braucht man 3 KOH-Moleküle, also
Um die molare Masse (M) der Fettsäuren zu bestimmen, muss man die Masse (m) der Fettsäuren durch die Stoffmenge der Fettsäuren (n) teilen:
Um nun auf die durchschnittliche molare Masse der Fettsäuren (∅M) zu kommen, subtrahieren wir von der molaren Masse der Fettsäuren die molare Masse des Glycerin-Moleküls und addieren die 3fache molare Masse von Wasser (für 3 hydrolisierte Esterbindungen)
ØM (Fettsäuren) ist die durchschnittliche molare Masse von 3 Fettsäuren. Wir dividieren also ØM (Fettsäuren) durch 3 und erhalten die durchschnittliche molare Masse von einer Fettsäure:
Quellen
[Bearbeiten]- Kennzahlen von Fetten. auf: tomchemie.de
Extraktion
[Bearbeiten]Trimyristin aus der Muskatnuss
[Bearbeiten]Einführung – Lernziele
[Bearbeiten]Die Früchte des ursprünglich auf den Molukken beheimateten "wohlriechenden" Muskatnussbaums (Myristica fragrans) dienen mindestens seit dem 6. Jahrhundert als Quelle für Heilmittel und Gewürze, der Samenkern - nach Entfernung der Schale - als Muskatnuss, der getrocknete Samenmantel als "Muskatblüte" (Macis).[1] Im Praktikum Organische Chemie ist der gemahlene Muskatnusskern ein Studienobjekt, an dem wir die Techniken der Feststoff-Extraktion, der Flüssig/Flüssig-Verteilung und der Chromatographie üben und schließlich mit den so gewonnenen Substanzen einige einfache Reaktionen durchführen können.
Der Kern der Muskatnuss enthält neben Gerüstsubstanzen (Polysaccharide, ca. 45-60%) ein weiches Fett, welches ausgepresst als "Muskatnussbutter" bezeichnet wird. Das Fett ist eine Mischung aus "verseifbaren Fetten" (Triglyzeriden, 25-40%) und "unverseifbaren Bestandteilen", dem "ätherischen Öl" (8-15%). Unter den verseifbaren Fetten tritt das Triglyzerid der Tetradecansäure (Myristinsäure) in ungewöhnlich hohem Anteil auf. Es lässt sich daher leicht durch Umkristallisieren abtrennen.
Trimyristin wurde erstmals aus der Muskatnussbutter gewonnen und daher nach seiner Quelle benannt. Das Fett wurde in heißem Alkohol gelöst; beim Abkühlen kristallisierte das Triglyzerid aus.[2] Aus gemahlenen Muskatnüssen wurde Trimyristin mit Lösungsmitteln extrahiert, wobei Diethylether, Benzol und Chloroform verwendet wurden.[3] Eine Extraktion mit Diethylether im 1,5 kg-Maßstab wurde ausführlich in Organic Syntheses beschrieben.[4] Als chemisches Experiment mit kleineren Mengen wurde diese Isolierung in ein Buch zum organisch-chemischen Praktikum aufgenommen.[5] Im Jahr 1971 schlugen amerikanische Autoren vor, die Ether-Extraktion von Muskatnus und die Verseifung des so gewonnenen Trimyristins als Versuch in den Praktika der organischen Chemie für Anfänger durchzuführen.[6] Anstelle des leicht entzündlichen Diethylethers wurde Chloroform als Lösungsmittel empfohlen.[7] Nachdem dieses wegen seines Gesundheitsrisikos in Verruf geraten war, wurde schließlich beim hier beschriebenen Versuch das Chloroform durch Dichlormethan ersetzt.
Versuch 1: Extraktion von Muskatnusspulver mit einem lipophilen Lösungsmittel
[Bearbeiten]- Materialien
- 20 g gemahlene Muskatnuss
- Dichlormethan (Methylenchlorid)
- 95%-iges Ethanol
- Calciumchlorid
- Besondere Sicherheitsmaßnahmen
Schutzbrille beim Evakuieren des Exsikkators und des Rotationsverdampfers, Abdecken des Exsikkators mit Handtuch.
- Versuchsbeschreibung
In einem 250 ml-Kolben werden 20 g gemahlene Muskatnuss eingewogen. Man fügt 150 ml Dichlormethan sowie einen Siedestein zu, befestigt am Stativ und setzt den Rückflusskühler auf. Das Gemisch wird im Wasserbad 90 min unter leichtem Rückfluss gekocht. Der Flüssigkeitsspiegel im Kolben soll nicht unter dem des Bades liegen. Dann lässt man auf Raumtemperatur abkühlen und filtriert durch ein Faltenfilter in einen Erlenmeyer-Kolben. Man spült das im Extraktionskolben zurückbleibende Unlösliche mit möglichst wenig Dichlormethan vollständig in das Faltenfilter und wäscht den dort befindlichen Rückstand dreimal mit je 20 ml Dichlormethan. Man trocknet den Rückstand einschließlich Filter im Vakuumexsikkator und wägt den Extraktionsrückstand aus. Der Dichlormethan-Extrakt wird zur Entfernung von Wasserspuren mit Calciumchlorid (ca. 1 Kaffeelöffel) versetzt und einige Sekunden kreisend bewegt. Man bedeckt den Erlenmeyer-Kolben mit einem Uhrglas oder verschließt ihn locker mit einem sauberen Korkstopfen, den man evt. mit Aluminiumfolie umwickelt, und lässt über Nacht stehen ("Trocknen" des Extraktes). Dann filtriert man vom CaCl2 in einen zuvor gewogenen 500 ml-Rundkolben ab. Das Lösungsmittel wird im Rotationsverdampfer abdestilliert. Wägen Sie den Rückstand aus! Welche Konsistenz und welchen Geruch hat er? Alles im Laborprotokoll notieren!
- Isolierung des Trimyristins durch Umkristallisieren
Der Rückstand wird in 95%igem Ethanol auf dem siedenden Wasserbad (Heizplatte, heizbarer Magnetrührer oder Tauchsieder) gelöst (Siedesteine, Rückflusskühler). Für 10 g Extrakt verwendet man 150 ml Ethanol. Man filtriert die heiße Lösung ab und lässt über Nacht auf Raumtemperatur abkühlem, wobei das Trimyristin auskristallisiert. Man saugt den ausgefallenen weißen Feststoff mit der Nutsche ab, presst ihn mit dem Glasstempel ab und wäscht mit möglichst wenig eisgekühltem Ethanol. Bewahren Sie die ethanolische Mutterlauge (Filtrat) auf für den Versuch Nr. #. Man trocknet das Trimyristin im Vakuumexsikkator über Nacht und bestimmt die Ausbeute, darauf den Schmelzpunkt (im Laborprotokoll notieren). Wenn das Trimyristin noch nach Muskat-Aroma riecht, wird es erneut aus Ethanol (150 ml pro 5 g, d.h. 30 ml pro Gramm) umkristallisiert. Ändert sich der Schmelzpunkt? Ausbeute? Reines Trimyristin ist völlig geruchlos und hat den Schmp. 54-55 °C.
- Verwendung/Entsorgung
Aufbewahren des reinen Trimyristins in einem ordentlich beschrifteten Präparateglas für einen weiteren Versuch. Auf dem Etikett (dies gilt für alle weiteren Präparate!) wird der vollständige Name der Substanz, ihr Gewicht, ihr beobachteter Schmelzpunkt, der Name des Experimentators und das Datum der Fertigstellung angegeben.
- Protokoll
Angabe des extrahierten Anteils der Muskatnuss in Prozent. Schmelzpunkt des Trimyristins. Später: Erstellung eines Fließschemas der Trennoperationen.
Einzelnachweise
[Bearbeiten]- ↑ Knaurs Pflanzenreich in Farben, Bd. l, S. 75, Droemer, Zürich 1964.
- ↑ Lyon Playfair, Ueber das feste Fett der Muskatbutter. Justus Liebigs Annalen der Chemie, 37, 152–164 (1841).
- ↑ Beilstein Hauptwerk Bd. 2, S.367, System Nr. 162.
- ↑ G. D. Beal, Org. Synth. 6, 100 (1926); Org. Synth. Collective Vol. 1, 538-541 (1956).
- ↑ G. K. Helmkamp, H. W. Johnson, Jr., Selected Experiments in Organic Chemistry, 2. Aufl. S. 58, W. H. Freeman, San Francisco, 1968.
- ↑ F. Frank , Th. Roberts , J. Snell , Ch. Yates, J. Collins, Trimyristin from nutmeg, J. Chem. Educ., 48, 255-256 (1971), DOI: 10.1021/ed048p255
- ↑ R. Ikan, Natural Products, A Laboratory Guide, p. 25-28, Academic Press, London-New York, 1969.
Coffein aus Tee
[Bearbeiten]
Materialien
[Bearbeiten]- "Schwarzer" oder "grüner" Tee, 5 bis 10 Gramm, billige Qualität genügt.
- Ethanol
- Magnesiumoxid
- Schwefelsäure
- Kaliumhydroxid
- Dichlormethan
Gefahrenbezeichnungen
[Bearbeiten]Gefahrstoffinformationen sind eigenverantwortlich zu recherchieren und zu dokumentieren.
Versuchsbeschreibung
[Bearbeiten]a) Soxhlet-Extraktion
10 g pulverisierter Tee wird mit etwas Alkohol befeuchtet und in die Papierhülse des Soxhlet-Extraktors gegeben. Der Siedekolben wird mit 96-prozentigem Ethanol beschickt. Man bringt das Lösungsmittel zum Sieden und lässt die Extraktion 8 Stunden lang laufen.
b) Vorarbeiten
Durch vorsichtige(!) Zugabe von konzentrierter Schwefelsäure zu der berechneten Menge eisgekühltem Wasser (Schutzbrille!) bereitet man eine 10-prozentige verdünnte Schwefelsäure. Mindestens 30 ml werden für den Versuch benötigt.
Man bereitet verdünnte Kalilauge: Kaliumhydroxid-Plätzchen (0,5 g) werden in 50 ml Wasser gelöst (Schutzbrille!). Mindestens 5 ml der 1-prozentigen Lösung werden benötigt. Beide Lösungen sollen vor der Verarbeitung Raumtemperatur angenommen haben.
c) Aufarbeitung
In einer Porzellanschale bereitet man eine Suspension von 10 g Magnesiumoxid in 100 ml Wasser. Der alkoholische Tee-Extrakt wird zugefügt. Der Siedekolben wird mit etwas heißem Wasser ausgespült; diese Flüssigkeit gibt man ebenfalls zu dem Gemisch. Dieses lässt man langsam auf einem Dampfbad oder Wasserbad eindampfen, wobei man häufig umrührt. Wenn sich der Alkohol verflüchtigt hat, versetzt man den beinahe trockenen, pulvrigen Rückstand mit soviel heißem Wasser, dass man diesen auf ein gefaltetes Filter in einem Trichter bringen kann. Die Porzellanschale wird sorgfältig gereinigt; hierfür ist ein Glasstab nützlich, dem ein kleines Stück Gummischlauch übergezogen wurde. Der Brei im Filter wird mit mehreren Portionen heißem Wasser gewaschen. Das Filtrat wird in einem 1 Liter-Kolben aufgefangen, bis man ca. 250 ml Flüssigkeit erhalten hat. Man fügt dem Filtrat 10 ml der 10-prozentigen verdünnten Schwefelsäure zu, worauf sich die Farbe der Flüssigkeit aufhellt. Bei manchen Teesorten kann eine Ausfällung erscheinen, welche beim anschließenden Ausschütteln zu einer Emulsion führen kann. In diesem Fall fügt man weitere Säure zu (bis zu 20 ml). Nachdem die Säure zugegeben wurde, erhitzt man die Lösung vorsichtig; sie kann zu Beginn schäumen! Wenn das Schäumen abgeklungen ist, lässt man die Lösung 30 Minuten kochen. Durch diese Behandlung sollen etwa vorhandene Saponine (natürliche Detergentien, Schaumbildner!) hydrolysiert werden. Man lässt nun abkühlen und filtriert dann die Flüssigkeit durch ein gefaltetes und befeuchtetes Filter in einen Scheidetrichter. Der Kolben und das Filter werden mit kleinen Mengen ca. 0,5-prozentiger Schwefelsäure gewaschen.
d) Verteilung zwischen Dichlormethan und wässriger Phase
Das klare, saure Filtrat wird mit sechs Portionen Dichlormethan (je 25 ml) ausgeschüttelt. Normalerweise trennt sich die Dichlormethan-Phase von der wässrigen Phase rasch und deutlich. Falls nicht, bewegt man den Scheidetrichter vorsichtig kreisend, oder nimmt zum Ausschütteln etwas mehr Dichlormethan. Man gibt die Dichlormethan-Auszüge in einen zweiten, trockenen Scheidetrichter und schüttelt sie vorsichtig mit 5 ml der 1-prozentigen KOH-Lösung aus. Diese „Waschen“ hat den Zweck, Säurereste und farbige Verbindungen zu entfernen. Nachdem sich die Dichlormethan-Lösung vollständig abgesetzt hat, lässt man sie durch ein kleines, trockenes Filter in einen Erlenmeyer-Kolben tropfen. Die kleine Menge alkalischer Flüssigkeit, die im Scheidetrichter verblieben ist, wird mit zwei weiteren Portionen Dichlormethan (je 10 ml) gewaschen. Man lässt die vereinigten Waschflüssigkeiten ebenfalls durch das obige Filter passieren und gibt sie zu der ersten Dichlormethan-Lösung.
e) Entfernung des Lösungsmittels
Zum Schluss destilliert man das Dichlormethan bei Normaldruck (Sdp. 40 °C) in einem Wasserbad ab. Gelöstes Restwasser wird dabei als Azeotrop mitdestillieren. Will man einen Rotationsverdampfer verwenden, sollte man den Extrakt vorher durch Zugabe einer Spatelspitze Magnesiumsulfat trocknen.
Der Rückstand, rohes Coffein, wird in möglichst wenig Dichlormethan gelöst ("aufgenommen") und in ein vorher gewogenes kleines Becherglas oder Schälchen gegeben. Man lässt das Dichlormethan wieder verdampfen (Abzug!) und trocknet das zurückgebliebene Coffein im Exsikkator über Schwefelsäure, Phosphorpentoxid oder Sikkapent. Falls ein Trockenofen vorhanden ist, lässt man bei 100 °C trocknen. Die Substanz wird ausgewogen und die prozentuale Ausbeute errechnet. Das so erhaltene Coffein ist fast farblos, und ist schon ziemlich rein.
Bestimmen Sie den Schmelzpunkt der Substanz! Da Coffein sublimiert, muss die Bestimmung im abgeschmolzenen Röhrchen erfolgen.
Versuchsauswertung
[Bearbeiten]Zeichnen Sie ein Fließdiagramm der Operationen zur Gewinnung von Coffein aus Teeblättern! Berechnen Sie die prozentuale Ausbeute, geben Sie den von Ihnen beobachteten Schmelzpunkt und den Schmelzpunkt aus der Literatur an!
Verwendung und Entsorgung
[Bearbeiten]Das Coffein kann durch Sublimation weiter gereinigt werden. Vergleichssubstanz zur Analyse von Analgetika (Schmerztabletten) (Versuch ##). Dichlormethan-Destillat sammeln und später nach Vorschrift ## zur Wiederwerwendung aufarbeiten.
Literatur zum Versuch
[Bearbeiten]F. B. Power, V. K. Chesnut, An improved Method for the Quantitative Determination of Caffeine in Vegetable Material, J. Amer. Chem. Soc. 41, 1298-1306 (1919). Damals wurde für die Extraktion Chloroform verwendet.
Hintergrund
[Bearbeiten]Nachdem aus Kaffeebohnen das Coffein isoliert worden war (Runge, 1820, Caventou, Pelletier, Robiquet, 1821), untersuchte Oudry "Schwarztee" aus dem Teestrauch (Camellia sinensis). Diesem war damals von Linné der Name Thea sinensis zugeteilt worden, und der Entdecker der Substanz nannte sie daher "Thein".[1] Einige Jahre später zeigte Jobst, dass Thein identisch war mit Coffein.[2]
Coffein ist wohl eine der am besten untersuchten organischen Verbindungen.
Die Isolierung von Coffein im organisch-chemischen Praktikum ist besonders lehrreich, denn dabei können wichtige Techniken der Stofftrennung gelernt und geübt werden. Im Laufe der Zeit sind daher viele Verfahren und Vorschriften für Versuche in Praktika ausgearbeitet worden (s.u.).
Man kann einfach durch Erhitzen von Teepulver Coffein erhalten; es sublimiert und schlägt sich in Kristallen am Kühlfinger des Sublimators nieder.[3]
Die meisten Techniken zur Isolierung von Coffein aus Teeblättern basieren jedoch auf Verfahren der Extraktion. Dabei gewinnt man aber kein reines Coffein, sondern weitere Trenn- und Reinigungsschritte schließen sich an, unter anderem die Verteilung zwischen Chloroform, Dichlormethan oder 1,2-Dichlorethan und Wasser.
Coffein ist als Purin-Alkaloid eine schwache Base. Da Tee außerdem reichliche Mengen an Tanninen enthält, liegt es darin nicht ganz „frei“ vor, sondern ist, zumindest teilweise, an diese gebunden. Tannine sind Polyphenole, und daher schwache Säuren. Ihre "Salze" mit Coffein werden jedoch beim Erhitzen mit Wasser leicht hydrolytisch zerlegt. Um Coffein aus Tee zu isolieren, wurden daher die Polyphenole (und andere Säuren) durch Zugabe von Basen, z.B. Magnesiumoxid, neutralisiert. Dann lässt sich das Coffein mit Lösungsmitteln extrahieren, z.B. mit Ethanol oder Dichlormethan.[4] Als Lösungsmittel zur Extraktion und Verteilung wurde häufig Chloroform verwendet.[5]
Nachdem sich herausgestellt hatte, dass Chloroform toxischer ist als Dichlormethan, wurde letzteres bevorzugt, zumindest in chemischen Praktika.
Im Laufe der Zeit sind viele Verfahren und Vorschriften für Versuche in Praktika ausgearbeitet worden, zum Beispiel:
- G. K. Helmkamp, H. W. Johnson, Selected Experiments in Organic Chemistry, 2nd ed. Freeman, San Francisco 1968, pp 157-158.
- J. R. Mehrig und D. C. Neckers, Laboratory Experiments in Organic Chemistry, Reinhold Corp., New York, 1968, p. 4.
- R. Ikan, Natural Products. A Laboratory Guide, Academic Press, London-New York, 1969.
- R. Adams, J. R. Johnson and C. F. Wilkox, Laboratory Experiments in Organic Chemistry, 6th ed., The Macmillan Co, New York, 1970, p. 108.
- J. Baldwin, Experimental Organic Chemistry, 2. Aufl., Mc Graw Hill, New York, 1970.
- D. L. Pavia, G. M. Lampman, G. S. Kriz, Introduction to Organic Laboratory Techniques. A Contemporary Approach, 3rd ed. P. 62-70, Saunders, Philadelphia u.a.O., 1988, ISBN 0-03-014813-8.
Einzelnachweise
[Bearbeiten]- ↑ Oudry, Thein, eine organische Salzbase im Thee, Magazin für Pharmazie, 19, 49 (1827).
- ↑ C. Jobst, Liebigs Annalen der Chemie und Pharmazie, 25, 63 (1838).
- ↑ Heijnsius, J. prakt. Chem. [1] 49, 317 (1850); zitiert nach Beilsteins Handbuch der Organischen Chemie, Bd. 26, 461 (1931).
- ↑ F. B. Power, V. K. Chesnut, An improved Method for the Quantitative Determination of Caffeine in Vegetable Material, J. Amer. Chem. Soc. 41, 1298-1306 (1919).
- ↑ W. A. Puckner, Notes on the Estimation of Caffeine, J. Amer. Chem. Soc. 18, 978-981 (1896). DOI: 10.1021/ja02097a007.
Chromatographie
[Bearbeiten]Trennung der Farbstoffe aus den Kelchblättern von Hibiscus sabdariffa L, ("Malventee") durch absteigende Papierchromatographie
[Bearbeiten]


Materialien
[Bearbeiten]- Malventee (1 Gramm pro Teilnehmer(in)
- Butanol, Eisessig, Methanol, konz. Salzsäure
- Chromatographiepapier ("mittelschnelle Laufeigenschaft") (z. B. Macherey und Nagel, Typ MN 261)
1. Vorbereitung der Trennkammer
[Bearbeiten](für 2 Personen) Im Scheidetrichter werden 100 ml n-Butanol, 25 ml Eisessig und 125 ml entmineralisiertes Wasser geschüttelt (Butanol-Eisessig-Wasser 4:1:5). Nach Trennung der beiden Phasen lässt man die Unterphase ab. Sie wird zur Kammersättigung verwendet, indem man die Trennkammer damit füllt und die Wandungen benetzt. Die Trennkammer wird mit Deckel versehen und mehrere Stunden zur Äquilibrierung sich selbst überlassen. Die Oberphase wird zum Entwickeln der Chromatogramme verwendet; mit ihr wird der Trog gefüllt.
2. Extraktion des Pflanzenmaterials
[Bearbeiten](für ganzen Praktikumskurs) Man bereitet eine Mischung von l ml konz. Salzsäure + 99 ml Methanol. In einem Erlenmeyerkolben werden 1.0 g des Pflanzenmaterials mit 10 ml der methanolischen Salzsäure übergossen und mindestens l h sich selbst überlassen.
3. Chromatographische Trennung
[Bearbeiten]Auf sauberer Unterlage schneidet man sich mit der Schere eine Bahn Chromatographiepapier zurecht (17 × 55 cm). Das Papier soll nicht geknickt, zerknittert oder beschmutzt werden. Mit weichem Bleistift zieht man 10 cm vom kurzen Rand entfernt eine gerade Linie und markiert darauf die Startpunkte, die 2.5 cm vom langen Rand entfernt sein und untereinander einen Abstand von 3 cm haben sollen. Ein kleiner Teil des Extraktes wird in steigender Konzentration (Konzentrationsreihe) aufgetüpfelt. Vor der Wiederholung des Auftüpfelns mit Haartrockner trockenblasen. Das Papier wird in die Trennkammer eingehängt; die Startlinie muss horizontal sein. Man entwickelt über Nacht. Am nächsten Morgen nimmt man das Chromatogramm heraus, markiert mit Bleistift die Lösungsmittelfront und lässt das Papier an einer "Wäscheleine" im Abzug trocknen.
4. Auswertung
[Bearbeiten]Umranden Sie nach dem Trocknen die Flecken, notieren Sie sofort die Farbe. Bestimmen Sie die Rf-Werte.
5. Hintergrund
[Bearbeiten]Die Kelchblätter von Hibiscus sabdariffa L. enthalten mehrere Farbstoffe. Neben den Hauptkomponenten A und B wurden noch in kleineren Anteilen C und D sowie das Flavyliumsalz E nachgewiesen.
6. Fragen
[Bearbeiten]In welche Naturstoffklassen kann man diese Farbstoffe einordnen? Welche Verbindungen erwarten Sie, wenn diese Farbstoffe mit verdünnten wässrigen Mineralsäuren behandelt werden? Formulieren Sie Reaktionsgleichungen! Wozu ist Säure notwendig?
Literatur
[Bearbeiten]D. T. Du, F. J. Francis, Anthocyanins of Roselle (Hibiscus sabdariffa L., J. Food Science, 38, 810-812 (1973). Der Versuch wurde vom Autor des Wikibooks für das Organisch-chemische Praktikum ausgearbeitet.
Dünnschichtchromatographie von Azofarbstoffen an verschiedenen stationären Phasen
[Bearbeiten](Kieselgel, Aluminiumoxid, Reversed-Phase)
Materialien
Verschiedene DC-Folien oder -Platten (siehe oben)
Azobenzol p-Aminoazobenzol p-Hydroxyazobenzol
Reine Lösungsmittel: Toluol, Petrolether, Ethylacetat, Methanol
Durchführung
Man bereitet Lösungen von Azobenzol, p-Aminoazobenzol und p-Hydroxyazobenzol in Toluol. Von den Lösungen wird auf folgende Trennschichten (stationäre Phasen) eine ausreichende Menge am Start aufgetüpfelt, so dass drei nebeneinanderliegende Startflecke vorliegen:
- a) Kieselgel
- b) Aluminiumoxid, basisch
- c) Reversed-Phase Kieselgel, z.B. RP-C12-SiO2
Mit einem Bleistift markiert man die Startlinie. Als mobile Phase (Fließmittel) für Kieselgel und Aluminiumoxid wird Petrolether/Ethylacetat (4:1) verwendet. Die Reversed-Phase-Schicht entwickelt man mit Methanol-Wasser (3:1).
Auswertung
Bestimmen Sie die Rf -Werte und beachten Sie jedesmal die Reihenfolge der Retention der Azoverbindungen!
Erklärung für die Unterschiede?
Isolierung von Myristicin aus dem Muskatnuss-Extrakt durch präparative Schichtchromatographie (PSC)
[Bearbeiten]Dieser Abschnitt ist noch im Entstehen und noch nicht offizieller Bestandteil des Buchs. Gib den Autoren Zeit, den Inhalt anzupassen!

Materialien und Anweisungen der GefStoffV
[Bearbeiten]- Die ethanolische Mutterlauge der Kristallisation aus dem Versuch "Trimyristin".
- tiefsiedender, trockener Petrolether
- trockenes Ethylacetat (Essigsäureethylester)
- Dichlormethan (Methylenchlorid)
- PSC-Fertigplatte (Kieselgel mit Fluoreszenzindikator 254 nm, 20 × 20 cm, Schichtdicke 2 mm)
Versuchsbeschreibung[1]
[Bearbeiten]Vorarbeit
[Bearbeiten]Aus festem Kaliumhydroxid wird eine 50-prozentige wässrige Lösung (Kalilauge, mindestens 25 ml) bereitet. Vorsicht! Schutzbrille!
a) Aufarbeitung der Trimyristin-Mutterlauge
[Bearbeiten]Zur Verseifung der restlichen Triglyceride wird die ethanolische Lösung in einem 250 ml Erlenmeyer-Kolben mit 25 ml einer 50%igen wässrigen Kaliumhydroxid-Lösung versetzt. Die dunkelbraune Reaktionsmischung lässt man über Nacht stehen. Daraufhin wird die Lösung in einen l Liter-Scheidetrichter übergeführt, vorsichtig mit je 200 ml Wasser und tiefsiedendem Petrolether versetzt (nicht schütteln - Gefahr der Emulsionsbildung) und über Nacht sich selbst überlassen (Auffanggefäß unter den Scheidetrichter stellen, falls dieser undicht wird). Am nächsten Tag wird die organische Phase abgetrennt und mit Magnesiumsulfat mindestens l h getrocknet. Nach dem Abfiltrieren werden die Lösungsmittel im Rotationsverdarapfer abdestilliert. Das so erhaltene Substanzgemisch wird gewogen und durch Dünnschichtchromatographie untersucht; als Referenzsubstanz wird reines Myristicin (vom Assistenten erhältlich) aufgetüpfelt. Entwickelt wird mit dem Lösungsmittelgemisch Petrolether/Essigsäureethylester (4:1). Die Detektion der Substanzen erfolgt unter UV-Licht und durch Besprühen der Folie mit dem Anisaldehyd- oder Vanillin-Schwefelsäure-Reagens (zur Sichtbarmachung der Flecken muss die Folie eventuell kurz mit dem Fön erhitzt werden).
b) Isolierung von Myristicin durch präparative Schichtchromatographie
[Bearbeiten]Das Substanzgemisch wird in l ml des für die Entwicklung der Dickschichtplatte benötigten Lösungsmittelgemisches (Petrolether/Essigsäureethylester (4:1) gelöst. Die PSC-Fertigplatte wird mit einem Bleistiftstrich 2 cm parallel zum unteren Rand und l cm von den beiden Seitenrändern entfernt markiert. Auf dieser Linie trägt man die Lösung mit einer ausgezogenen Pipette vorsichtig auf. Der obere Teil der PSC-Platte ist am besten mit einem Blatt Papier abgedeckt. Die Entwicklung der Platte findet in einer Kammer statt, die mit Filtrierpapier an den Seitenwänden zur Erzielung einer guten Kammersättigung ausgekleidet ist. Das Laufmittel (s.o.) soll in das Entwicklungsgefäß ca. l cm hoch eingefüllt sein. Es wird zweimal entwickelt. Vor der zweiten Entwicklung lässt man die Platte mit Hilfe eines Stickstoff-Stroms oder eines Föns kurz trocknen. Die Detektion der getrennten Substanzen findet unter der UV-Leuchte statt; die Zonen werden mit dünnen Bleistiftstrichen markiert. Zusätzlich können die Substanzen noch durch Ansprühen mit dem Anisaldehyd- oder Vanillin-Schwefelsäure-Reagens nachgewiesen werden. Hierzu wird die Platte bis auf einen Randstreifen von 1-2 cm mit einer Glasplatte oder einem starken Karton abgedeckt, der Rand mit dem Reagens besprüht und kurz mit dem Fön erhitzt. Die gewünschte Zone wird mit einem Spatel oder einem spitzen Messer herausgekratzt oder abgehoben (die besprühte Fläche wird ausgespart); dazu stellt man die Platte senkrecht auf ein Blatt Papier. Man zerkleinert die groben Kieselgel-Brocken auf dem Papier oder im Mörser und füllt dann das Pulver in einen Erlenmeyer-Kolben, wo es mit 40 ml Dichlormethan digeriert wird. Man filtriert vom Kieselgel ab und wäscht dreimal mit Dichlormethan nach. Das Filtrat wird in einem zuvor gewogenen Kolben im Rotationsverdampfer eingeengt, der Rückstand ausgewogen und im DC auf Reinheit geprüft, wobei man wieder reines Myristicin als Vergleichssubstanz verwendet. Die kleine Menge des extrahierten Myristicins kann in einem Kugelrohrofen im Vakuum destilliert werden, falls dieses Gerät im Praktikum zur Verfügung steht.

Abb. #1. Präparatives Schichtchromatogramm der Neutralfraktion des Muskatnuss-Extraktes.
Hintergrund
[Bearbeiten]Von den in der Muskatnuss enthaltenen Stoffen (siehe Versuch „Trimyristin“) wurden Fette und ätherische Öle aus den Gerüststoffen extrahiert, und ein Großteil des Triglycerids (Trimyristin) durch Kristallisation gewonnen. Die in der Mutterlauge noch enthaltenen Glyceride werden nun verseift und bleiben bei der Extraktion des ätherischen Öls in der wässrigen Phase (Salzbildung im basischen Milieu).
Für den typischen Geruch der geriebenen Muskatnuss sind die Komponenten des ätherischen Öls verantwortlich, welches durch verschiedene Methoden abgetrennt werden kann.
Die Analyse des ätherischen Öls, vor allem durch die Methode der Gaschromatographie, zeigte eine Fülle von Inhaltsstoffen an. Wie in den meisten ätherischen Ölen treten verschiedene Terpen-Kohlenwasserstoffe auf: p-Mentha-1,4-dien, p-Mentha-1,4(8)-dien, p-Mentha-1,8-dien (Limonen), p-Cymol, alpha- und beta-Pinen, Sabinen, Camphen (Formelschema 1, welche Konstitutionsformeln haben die nicht gezeigten Komponenten?)
Als weitere Terpene wurden Geraniol, Citronellol, Citronellal, Linalool, p-Menth-l-en-4-ol (4-Terpinol), p-Menth-l-en-8-ol, Cineol, Borneol, Campher und Cineol nachgewiesen (Formelschema 2, nicht angegebene Formeln nachtragen!). Typische Inhaltsstoffe des Muskatnusskerns, die auch für den Geruch bestimmend sind, gehören jedoch der Klasse der Phenylpropan-Derivate an (Formelschema 3); es handelt sich um Phenolether. Sie werden mit den Trivialnamen Eugenol (vgl. Nelkenöl), Isoeugenol, Methyleugenol, Methylisoeugenol, Safrol, Methoxyeugenol, Elemicin, Isoelemicin bezeichnet. Die Hauptkomponente des ätherischen Öls der Muskatnuss ist das Phenylpropanderivat Myristicin. Das ätherische Öl der Muskatnuss hat, in großen Mengen eingenommen, eine psychotrope (halluzinogene) und toxische Wirkung; diese scheint vor allem auf das Myristicin zurückzugehen.
Die komplexe Zusammensetzung des in unserem Versuch erhaltenen ätherischen Öls in dem Petrolether-Extrakt (Neutralfraktion) wird durch das Kapillargaschromatogramm in Abb. #2 dokumentiert. Durch die präparative Schichtchromatographie wird die Hauptkomponente des ätherischen Öls (Myristicin) in reiner Form erhalten, wie eine GC/MS-Analyse (Abb. #3) und ein 1H-NMR-Spektrum (Abb. #4) beweisen.
[[Datei:]] Abb. #2. Kapillar-GC der Neutralfraktion des Muskatnuss-Extraktes.
[[Datei:]] Abb. #3. GC/CIMS-Analyse des aus der Neutralfraktion isolierten Myristicins.
[[Datei:]] Abb. #4. 1H-NMR-Spektrum (60 MHz, CDCl3) des aus der Neutralfraktion isolierten Myristicins.
Protokoll
[Bearbeiten]Zeichnen Sie ein Fließschema, in dem die einzelnen Schritte der Auftrennung und Isolierung der Inhaltsstoffe der Muskatnuss angegeben werden.
Einzelnachweise
[Bearbeiten]<references /ref>
Literatur
[Bearbeiten]- Knaurs Pflanzenreich in Farben, Bd. l, S. 75, Droemer, Zürich 1964.
- E. Gildemeister und F. Hoffmann, Die ätherischen Öle (Hrsg. W. Treibs), 4. Aufl. Bd. 4, S. 666, Akademie-Verlag, Berlin 1956.
- D. A. Kalbhen: Die Muskatnuß als Rauschdroge, Angew. Chem. 83, 392 (1971).
Gaschromatoqraphische Untersuchung von Wasserdampfdestillaten aus Citrusfruchtschalen und Kümmel
[Bearbeiten]Zu diesen Versuchen wurde ein Gaschromatograph (Doppelsäulengerät) mit gepackten Glassäulen (Länge 1,3 m, Durchmesser 5 mm) und Wärmeleitfähigkeitsdetektor (WLD) verwendet.
Säule 1: Packung mit 5% OV 101 auf Volaspher A2 100 - 120 mesh
Säule 2: Packung mit 5% Diethylenglykolsuccinat-polyester (DEGS) auf Chromosorb G-AW 100 -120 mesh
Ofentemperatur: 150 °C
Messstrom des WLD: 100 mA
Abschwächung: 32 Skalenteile
Aufgabe
[Bearbeiten]Fertigen Sie zwei Gaschromatogramme an!
Injizieren Sie je etwa 1.5 Mikroliter der 5-prozentigen Hexan-Lösung aus den Versuchen "Ätherisches Öl aus Kümmel durch Wasserdampfdestillation" und "Ätherisches Öl aus Orangenschalen durch Wasserdampf-Destillation. Die jeweils fehlende Lösung aus diesen Versuchen lassen Sie sich von einem anderen Teilnehmer des Praktikums geben!
Auswertung
[Bearbeiten]Notieren Sie alle wichtigen GC-Parameter (Säulenlänge, Natur der stationären Phasen und Träger, siehe oben; Ofentemperatur, Strömungsgeschwindigkeit in ml Helium/min; Papiervorschub des Schreibers in cm/min).
Zeichnen Sie in das Elutionsdiagramm (= Gaschromatogramm) als Abszisse eine Skala der Retentionszeit in Minuten ein (siehe Abbildung) und ermitteln Sie die korrigierten Retentionszeiten. Kleben Sie das Gaschromatogramm in Ihr Protokoll und geben Sie die GC-Parameter an.

Abbildung: GC eines Kümmel-Wasserdampfdestillats in Hexan unter obigen Bedingungen (links Säule 1; rechts Säule 2). Das starke Signal Nr. 1 stammt vom Lösungsmittel.
Gaschromatoqraphische Identifizierung von Limonen und Carvon durch Koinjektion
[Bearbeiten]Im Wasserdampfdestillat des Kümmels sind als Hauptprodukte der Terpenkohlenwasserstoff Limonen und das Terpenketon Carvon enthalten. Schätzen Sie ab, welche Verbindung von der verwendeten GC-Phase stärker zurückgehalten (retentiert) wird! Zum Beweis, welcher Peak im GC dem Limonen und welcher dem Carvon zukommt, wird die Analysenprobe nach Aufnahme des Gaschromatogramms (siehe oben) mit - möglichst derselben Menge - Limonen und/oder Carvon versetzt und erneut gaschromatographisch untersucht. Als Vergleichssubstanz Limonen kann das Orangenöl-Destillat aus Versuch ## verwendet werden oder die Hexan-Lösung des Citrus-Wasserdampfdestillats.
Eine Probe Carvon erhalten Sie von dem/der Betreuer/in.
Die Identifizierung der Komponenten ergibt sich daraus, dass der Peak der koinjizierten Substanz zunimmt. Die Peaks dürfen jedoch nicht über den oberen Rand des Schreibpapiers "hinausschießen", sonst würde man getrennte Spitzen sehr eng beieinanderliegender Peaks nicht erkennen.
Destillation
[Bearbeiten]Isolierung des ätherischen Öls aus Kümmel durch Wasserdampfdestillation
[Bearbeiten]Materialien
- Kümmelgewürz (ca. 50 g)
- n-Hexan oder Petrolether vom Sdp. 40-60 °C:
- Magnesiumsulfat, geglüht:
R&S-Sätze ergänzen
Versuchsbeschreibung
Man zerkleinert 50 g Kümmelgewürz; das Zerkleinern im Mörser mit Pistill ist mühsam. Einfacher geht's mit einer Kaffemühle oder Gewürzmühle! Die Kümmelkörner werden zusammen mit 500 ml Wasser in einen 1-Liter-Rundkolben gegeben.
Man fügt einige Siedesteine zu und baut den absteigenden Kühler an. Als Vorlage dient ein 100 ml-Messzylinder. Heizung mit Ölbad/Heizplatte/Leistungsregler. Man erhitzt zum kräftigen Sieden; bei starker Schaumbildung muss vorsichtig erhitzt werden. Nachdem 100 ml Wasser destilliert sind, bricht man den Versuch ab; weiteres Destillieren - der Destillationskolben sollte dann mit frischem Wasser aufgefüllt werden - liefert nur noch geringe Mengen an ätherischem Öl. Schätzen Sie die im Messzylinder oben schwimmende Menge des ätherischen Öls ab! Man gießt das Destillat in einen 250 ml-Scheidetrichter, spült den Messzylinder mit 20 ml Hexan oder Petrolether vom Sdp. 40-60 °C aus und gießt ebenfalls in den Scheidetrichter, der kurz geschüttelt wird. Man wartet, bis sich die oben schwimmende Petroletherschicht, die das ätherische Öl enthält, sauber abgetrennt hat und lässt die Wasserphase abfließen. Die Petroletherphase wird in einen kleinen Erlenmeyerkolben umgegossen und mit einer kräftigen Spatelspitze Magnesiumsulfat über Nacht getrocknet (verschließen und gelegentlich umschütteln). Die Lösung wird für weitere Versuche im Dunkeln aufbewahrt.
Anmerkung Hauptbestandteile des ätherischen Öls aus Kümmel sind der Terpenkohlenwasserstoff Limonen und das Terpenketon Carvon. Strukturformeln dieser Verbindungen?
Verwendung
- Gaschromatographie
- Dünnschichtchromatographie
- Chromatographie in der Schwerkraftsäule
- Derivatisierung des Carvons (2,4-Dinitrophenylhydrazon o.a.)
Isolierung des ätherischen Öls aus Orangenschalen durch Wasserdampf-Destillation
[Bearbeiten]Materialien
- Mandarinen- oder Orangenschalen
- Bei Orangenschalen ist es empfehlenswert, die weiße innere Gewebeschicht vorher zu entfernen. Mandarinenschalen sind besser geeignet.
- n-Hexan oder Petrolether vom Sdp. 40-60°C
- Magnesiumsulfat, geglüht
Ausführung
100 Gramm Mandarinenschalen oder Orangenschalen werden in einem Haushalts-Mixgerät mit 300 ml Wasser püriert; der Brei wird in einen 1-Liter-Kolben gegeben. Der Mixer wird nochmals mit 200 ml Wasser beschickt und kurz eingeschaltet; auch diese Flüssigkeit wird in den l-Liter-Kolben übergeführt. Man gibt einige Siedesteine zu und baut den absteigenden Kühler an. Als Vorlage dient ein 100 ml-Messzylinder. Heizung mit Ölbad/Heizplatte/Leistungsregler.
Man erhitzt zum kräftigen Sieden; bei starker Schaumbildung muss vorsichtig erhitzt werden. Nachdem 100 ml Wasser destilliert sind, bricht man den Versuch ab; weiteres Destillieren - der Destillationskolben sollte dann mit frischem Wasser aufgefüllt werden - liefert nur noch geringe Mengen an ätherischem Öl. Schätzen Sie die im Messzylinder oben schwimmende Menge des ätherischen Öls ab!
Man gießt das Destillat in einen 250 ml-Scheidetrichter, spült den Messzylinder mit 20 ml n-Hexan oder Petrolether vom Sdp. 40-60 °C aus und gießt ebenfalls in den Scheidetrichter, der kurz geschüttelt wird. Man wartet, bis sich die oben schwimmende Petroletherschicht, die das ätherische Öl enthält, sauber abgetrennt hat und lässt die Wasserphase abfließen. Die Petroletherphase wird in einen kleinen Erlenmeyerkolben umgegossen und mit einer reichlichen Spatelspitze Magnesiumsulfat über Nacht getrocknet (verschließen und gelegentlich umschütteln). Die Lösung wird für weitere Versuche im Dunkeln aufbewahrt.
Anmerkung
Hauptbestandteil der ätherischen Öle aus den Schalen von Citrusfrüchten ist D-Limonen. Orangenöl enthält außerdem Spuren anderer Terpenkohlenwasserstoffe, n-Octanal, n-Nonanal, n-Decanal, D-Linalool und weitere Verbindungen. Welches sind die Strukturformeln der genannten Moleküle?
Verwendung
- Gaschromatographie
- Dünnschichtchromatographie
Siedeanalyse von Petrolether
[Bearbeiten]Materialien
- Petrolether, tiefsiedend
- R&S-Sätze ergänzen
- Graduiertes Reagenzglas mit Schliff
- Siedesteine oder Magnetrührstäbchen
Jeweils 2 Studierende machen den Versuch gemeinsam!
Versuchsbeschreibung
Bauen Sie aus einem zuvor gewogenen 100 ml Rundkolben (NS 14.5), Liebigkühler (NS 14.5), Thermometer und Vorstoß eine Destillationsapparatur auf. Bei diesem Versuch lässt man das Destillat in ein graduiertes 20-ml-Reagenzglas mit Normschliff NS 14.5 tropfen. Zum Erhitzen dient ein Ölbad mit Kontrollthermometer, sowie Heizplatte mit Spannungsregler oder heizbarer Magnetrührer. Geben Sie 50 ml Petrolether in den Destillationskolben und fügen Sie zwei Siedesteine hinzu. Erhitzen Sie das Ölbad relativ langsam und beobachten Sie sowohl das Thermometer am Aufsatz zum Liebigkühler als auch die übergegangene Destillatmenge. Nach jedem aufgefangenen halben Milliliter wird die zugehörige Siedetemperatur notiert (Werte aufstellen, Tabelle). Der Versuch wird abgebrochen, sobald die Ölbadtemperatur 150 °C erreicht hat. Wägen Sie den bei 150 °C nicht überdestillierten Rückstand aus.
Protokoll Zeichnen Sie eine Siedekurve: Man trägt die beobachteten Siedetemperaturen [°C] gegen die Destillatmenge in [ml] auf. Bestimmen Sie die übergegangene Destillatmenge bei 60 °C und bei 100 °C!
Verwendung/Entsorgung
Petrolether sammeln, wird als Lösungsmittel wiederverwendet.
Vakuumdestillation von Orangenschalenöl -Bestimmung des Brechungsindexes
[Bearbeiten]Materialen
Bauen Sie eine Apparatur zur Vakuumdestillation auf: 100 ml-Zweihals-Kolben, Vigreux-Kolonne, Vorstoß, Spinne, Siedekapillare, Thermometer. Wasserbad mit Kontrollthermometer, Heizplatte. Unbedingt Woulfe'sche Flasche!
Bestimmen Sie zunächst das Gewicht des Destillierkolbens und der Vorlagekolben. Der Destillierkolben wird mit 30 g Orangenschalenöl (kalt gepresst) beschickt. Setzen Sie die Destillation in Gang. Notieren Sie den Siedepunkt und die Badtemperatur sowie den Druck. Wenn sich der Siedepunkt stark ändert, muss der Vorlagekolben durch Drehen der Spinne gewechselt werden. Gegen Ende der Destillation wird die Badtemperatur bis zum Sieden des Wasserbads gesteigert.
Man entfernt das Wasserbad und lässt (unter Vakuum, Pumpe laufenlassen!) den Destillierkolben erkalten. Erst dann hebt man das Vakuum durch vorsichtiges Belüften über den Hahn der Woulfe'schen Flasche auf.

Auswertung Bestimmen Sie durch Auswiegen die Menge an Destillationsrückstand und an Destillaten.
Bestimmen Sie den Brechungsindex der Destillate (Erklärung des Refraktometers erfolgt durch den/die Betreuer/in). Notieren Sie alle Daten in einer Tabelle. Unterscheiden sich die verschiedenen Fraktionen in ihrem Geruch?
Anmerkung Orangenschalenöl (Orangenöl) wird unter anderem in Italien, USA und Guinea als Nebenprodukt der Orangensaftfabrikation gewonnen. Hauptbestandteil ist (R)-(+)-Limonen (Sdp. 178 °C/760 Torr, Sdp. 55 °C/10 Torr, Sdp. 64.5 °C/15 Torr, nD20 = 1.4730)
Außer dem Terpenkohlenwasserstoff Limonen enthält Orangenschalenöl zahlreiche weitere Verbindungen. Die als Riechstoffe wertvolleren Komponente sind sauerstoffhaltige Moleküle, d.h. Alkohole, Aldehyde, Ketone und Ester, die in den höher siedenden Fraktionen angereichert werden.
Fraktionierende Destillation eines Methanol/Wasser-Gemischs
[Bearbeiten]Materialen
Vorschrift
Bauen Sie aus einem 100 ml-Rundkolben, Vigreux-Kolonne, Thermometer und Vorstoß eine Destillationsapparatur auf. Bei diesem Versuch lässt man das Destillat in einen 10 ml-Messzylinder tropfen, der am Stativ mit einer Klammer befestigt wird. Zum Erhitzen dient ein Ölbad mit Kontrollthermometer und eine Heizplatte mit Spannungsregler.
Geben Sie 20 ml Methanol und 20 ml Wasser in den Destillationskolben und fügen Sie zwei Siedesteine hinzu. Erhitzen Sie das Ölbad relativ rasch, bis es den Siedepunkt der tiefsiedenden Komponente (Methanol) erreicht hat. Ab jetzt wird die Badtemperatur nur noch langsam gesteigert. Beobachten Sie das Thermometer am Kopf der Kolonne. Regulieren Sie die Ölbadtemperatur so ein, dass 1 ml Destillat in 1,5-2 min übergehen. Nach jedem aufgefangenen ml Destillat wird die Siedetemperatur notiert (Tabelle). Wenn die Temperatur stärker anzusteigen beginnt, wird die Siedetemperatur häufiger (alle 0,5 ml) abgelesen. Der Versuch wird abgebrochen, wenn mehrere ml reines Wasser übergegangen sind.
Auswertung
Zeichnen Sie eine Destillationskurve (Siedetemperatur [°C] gegen ml Destillat)!
Synthesen
[Bearbeiten]
Materialien
[Bearbeiten]Gefahrenbezeichnungen
[Bearbeiten]Gefahrstoffinformationen sind eigenverantwortlich zu recherchieren und zu dokumentieren.
Versuchsbeschreibung
[Bearbeiten]In einem kleinen Erlenmeyerkolben oder Schliffkolben mischt man 6 ml Acetonitril mit 2 ml Wasser und löst darin Hydrochinon (220 mg, 4 mmol) auf. Man gibt Cer(IV)ammonium-nitrat (2.20 g, 4 mmol) zu und bewegt das Kölbchen kreisend, bis sich das Cersalz aufgelöst hat. Welchen Farbeffekt beobachten Sie? Nach ca. 2 min, bei Raumtemperatur, gießt man das Gemisch in 10 ml Wasser (kleiner Scheidetrichter) und schüttelt zweimal mit je 15 ml Dichlormethan aus. Man vereinigt die Dichlormethanphasen und trocknet sie mit wenig Magnesiumsulfat. Die Wasserphase, in der sich Acetonitril und Cer(III)salze befinden, wird nicht weggegossen, sondern zum Recycling gesammelt (Versuch ##). Überprüfen Sie den pH-Wert der wässrigen Phase und erklären Sie im Protokoll, was Sie beobachtet haben. Nach dem Trocknen des Dichlormethan-Extraktes filtriert man das Magnesiumsulfat durch ein kleines Faltenfilter ab und engt im Rotationsverdampfer ein. p-Benzochinon sollte als gelber Feststoff zurückbleiben. Die Substanz hat einen relativ hohen Dampfdruck und sublimiert daher leicht. Lassen Sie das Kölbchen daher nicht zu lange am Rotationsverdampfer hängen. Achtung: p-Benzochinon hat einen stechenden Geruch und wird als giftiger Stoff eingestuft. Bestimmen Sie den Schmelzpunkt des rohen Benzochinons. Man kann das so gewonnene p-Benzochinon noch durch Sublimation reinigen, erhält dann goldgelbe Kristalle. Das nach Vorschrift erhaltene p-Benzochinon sollte jedoch rein genug sein für die Umsetzung zu Chinhydron (nächster Versuch).
Protokoll
[Bearbeiten]Formulieren Sie eine stöchiometrische Gleichung der Redoxreaktion und schreiben Sie den Synthesebericht nach Muster.
Verwendung/Entsorgung
[Bearbeiten]Chinon zu Chinhydron umsetzen. Acetonitril-Gemisch nach eigener Vorschrift entsorgen.
Hintergrund
[Bearbeiten]Die Dehydrierung von Hydrochinon zu 1,4-Benzochinon ist für Studierende besonders wichtig als Modell für biochemische Redox-Reaktionen.
Für organisch-chemische Praktika wurde die Oxidation (Dehydrierung) von Hydrochinon mit wässriger Chromsäure empfohlen.[2] Das gebildete Benzochinon wurde mit Benzol ausgeschüttelt. Durch Abdestillieren des Benzols wurde das restliche Wasser azeotrop entfernt. In Praktika ist dieser Versuch nicht mehr zeitgemäß, da Benzol als Hilfsphase, und Lösungen von Chromsalzen vermieden werden sollten.
Als Alternative wurde in Organic Syntheses die Oxidation mit Natriumchlorat und Vanadiumpentoxid als Katalysator in schwefelsaurer Lösung beschrieben.[3]
Beim vorliegenden Versuch wird Cer(IV)ammonium-nitrat (CAN) als Oxidationsmittel verwendet. Obwohl es relativ teuer ist, kann seine Verwendung bei kleinen Ansätzen vertreten werden. Das Recycling von Cersalzen ist für Studierende lehrreich. Außerdem ist der Reaktionsmechanismus der Oxidation mit Cer(IV)-Salzen leichter zu verstehen als der mit Chrom(VI)-Verbindungen.
Cersalze der Oxidationsstufe +IV sind kräftige Oxidationsmittel; ein Normalpotential E0 von + 1,6 V wird angegeben. In wässriger Lösung ist das Normalpotential aber abhängig von den vorliegenden Anionen (Komplexbildung) und dem pH-Wert.
Halbreaktion des Oxidans:
Halbreaktion des organischen Substrats:

In der Biochemie wird die Redox-Halbreaktion des Hydrochinon-Chinon-Systems häufig folgendermaßen abgekürzt (Q = Chinon, vom Englischen quinone):
Gesamtreaktion (die Halbreaktion des Cer(IV) muss mit "zwei" multipliziert werden):
Protonen werden also freigesetzt, die Lösung sollte daher sauer reagieren. Prüfen Sie dies mit pH-Papier nach!
Cer(IV)ammonium-nitrat und Cer(IV)ammonium-sulfat sind in Wasser löslich. Das Nitrat ist jedoch in Salpetersäure schwerer löslich und kann daher aus dieser umkristallisiert werden. Da viele organische Substrate in Wasser schwer löslich sind, muss in der Regel ein Cosolvens zugesetzt werden, welches vom Cer(IV)-Ion nicht oxidiert werden kann. Die besten Resultate hat man bis jetzt mit Acetonitril erzielt. Dieses ist mit Wasser unbeschränkt mischbar, allerdings giftig (Gefahrstoffhinweise siehe Versuchsbeschreibung). Acetonitril wird jedoch in der biologischen Chemie (Chemische Biologie) häufig verwendet, so dass wir uns bereits hier mit seinen Eigenschaften vertraut machen können.
Vom Reaktionsmechanismus her sind die Oxidationen (Dehydrierungen) von Hydrochinon am durchsichtigsten. Aber auch andere para-disubstituierte Benzolderivate, wie 4-Aminophenol, p-Anisidin, p-Phenylendiamin lassen sich zu Benzochinon oxidieren.[4]
Ein „klassischer“ Versuch ist die Oxidation von Anilin mit Natriumdichromat in Schwefelsäure.[5] Der Mechanismus ist jedoch komplizierter: Hierbei entsteht zuerst ein N-Phenyl-chinondiimin, welches anschließend hydrolytisch gespalten wird.[6]
Einzelnachweise
[Bearbeiten]<references /ref>
Literatur zum Versuch
[Bearbeiten]Tse-Lok Ho, T. W. Hall und C. M. Wong, Chemistry and Industry 1972, 729. Der Versuch wurde im Praktikum des Autors ausgearbeitet.
Oxidation von Phenanthren zu Phenanthren-1,4-chinon und Phenanthren-9,10-chinon. Adsorptionschromatographische Trennung der Chinone
[Bearbeiten]
- Materialien
- Phenanthren
- konzentrierte Schwefelsäure
- Acetonitril
- Dichlormethan (Methylenchlorid):
- Cer(IV)-ammoniumsulfat [Ce(NH4)4(SO4)4 2H2O]
- Magnesiumsulfat, geglüht:
Zur Säulenchromatographie:
- Kieselgel (40 g) zur Säulenchromatographie:
- trockenes Toluol
- trockenes Ethylacetat
Gefahrenbezeichnung sind eigenverantwortlich zu recherchieren und dokumentieren.
Versuchsbeschreibung
[Bearbeiten]a) Oxidations-Reagens
[Bearbeiten]Zuerst bereitet man 100 ml 4N-H2SO4 und kühlt auf Raumtemperatur ab. In 60 ml dieser Säure werden 3.80 g (6 mmol) Cer(IV)-ammoniumsulfat-dihydrat [Ce(NH4)4(SO4)4 2H2O] gelöst.
b) Die Oxidationsreaktion
[Bearbeiten]In einem 250 ml-Rundkolben lässt man 178 mg (1 mmol) Phenanthren in 40 ml Acetonitril (Acetonitril nicht einatmen!). Man fügt das schwefelsaure Cer-Reagens und zwei Siedesteine zu, setzt einen Rückflusskühler auf und erhitzt im Wasserbad zum leichten Sieden. Eine Badtemperatur von 90 °C genügt. Bald scheidet sich ein gelber Bodenkörper ab. Die siedende Lösung wird gelegentlich umgeschüttelt. Nach 30-minütigem Erhitzen kühlt man das Gemisch ab, dekantiert in den 250 ml-Scheidetrichter, versetzt mit 70 ml Wasser und schüttelt dreimal mit je 20 ml Methylenchlorid aus. Die vereinigten Methylenchlorid-Phasen werden dreimal mit je 20 ml Wasser gewaschen und über Magnesiumsulfat getrocknet. Nach Abfiltrieren vom Magnesiumsulfat wird das Methylenchlorid im Rotationsverdampfer abdestilliert. Bestimmen Sie die Rohausbeute! Der Rückstand wird in einer möglichst kleinen Menge Toluol (5-7 ml) in der Hitze (Wasserbad, Rückflusskühler, CaCl2-Trockenrohr) gelöst. Man lässt über Nacht kristallisieren. Die über dem Chinon-Kristallisat stehende Mutterlauge wird mit einer Pasteur-Pipette aufgenommen und in ein kleines Reagensglas abgefüllt. Man trocknet die Kristalle im Vakuum und bestimmt die Ausbeute sowie den Schmelzpunkt. Die Kristalle und die Mutterlauge werden mittels Dünnschichtchromatographie (DC) untersucht.
c) Säulenchromatographie
[Bearbeiten]Zur Chromatographie an Kieselgel werden 40 g Kieselgel mit 120 ml trockenem Toluol in einem 300 ml-Erlenmeyerkolben aufgeschlämmt. Die Suspension muss frei von Luftblasen und möglichst gleichmäßig sein; Umschütteln oder Umrühren. Die Chromatographiesäule (40 cm effektive Länge, 1.6 cm Durchmesser) wird mit der Aufschlämmung gefüllt. Zum Aufgeben der zu chromatographierenden Lösung lässt man das Toluol in der Säule abtropfen, bis es nur etwa 1 mm hoch über der Säulenfüllung steht. Mit Hilfe einer Pipette gibt man dann die möglichst konzentrierte Mutterlauge der Chinone auf. Die Säulenfüllung soll dabei nicht aufgewirbelt werden. Durch vorsichtiges Öffnen des Hahns am Chromatographierohr lässt man die Chinon-Lösung einsickern. Sobald dies erfolgt ist, gibt man mittels Pipette ca. 1 ml Toluol auf die Säule und lässt wiederum einsickern. Dieses "Nachwaschen" mit Toluol wird insgesamt dreimal durchgeführt. Anschließend setzt man den Tropftrichter mit dem Elutionsmittel auf und beginnt zu eluieren. Nach einiger Zeit trennen sich die orangefarbenen Zonen der beiden Chinone. Wenn die rascher wandernde Zone den Ausgang der Säule erreicht hat, wechselt man den Auffangkolben. In einem 100 ml-Kolben wird die erste Fraktion (gelbe Lösungsfarbe) aufgefangen. Daraufhin eluiert man mit dem stärker polaren Gemisch Toluol-Ethylacetat (80+20) und fängt die zweite orangefarbene Fraktion in einem Kolben auf. Dunkle Verunreinigungen bleiben im oberen Teil der Säule. Die beiden Fraktionen werden zur Trockene eingeengt. Bestimmen Sie Ausbeute und Schmelzpunkt! Wenn das verwendete Phenanthren noch Anthracen als Verunreinigung enthält, bildet sich bei der Oxidation auch Anthrachinon (Fp. 286 °C). Phenanthren-9,10-chinon und Anthrachinon lassen sich durch Sublimation im Vakuum weiter reinigen.
Auswertung des Versuchs
[Bearbeiten]- Ausbeutebestimmung der Kristallisation und der beiden chromatographischen Fraktionen.
- Schmelzpunktsbestimmung.
- Dünnschichtchromatographische Reinheitsprüfung der Kristallisation und der beiden Fraktionen.
- Rf-Werte der Chinone und Zuordnung.
Verwendung/Entsorgung
[Bearbeiten]- Chinone sammeln.
- Acetonitril durch Destillation nach eigener Vorschrift wiedergewinnen ("recyclen").
Hintergrund
[Bearbeiten]Die Redoxreaktion Hydrochinon-Chinon (Versuch ##) ist formal einfach, doch müssen die Hydrochinone zuerst synthetisiert werden. Vom präparativen Standpunkt viel einfacher ist die Oxidation mancher benzoider Kohlenwasserstoffe zu Chinonen. Benzol selbst kann zwar nicht direkt zu Benzochinon oxidiert werden, wohl aber mehrkernige Aromaten (Acene).
Früher bevorzugte Oxidationsmittel waren auch hier Chrom(VI)-Verbindungen, wie Chromsäure oder Chromtrioxid (CrO3). In kleinem Maßstab ist jedoch auch Cer(IV)ammonium-nitrat (CAN) und Cer(IV)ammonium-sulfat (CAS) nützlich. So entsteht aus Anthracen das Anthracen-9,10-chinon (Anthrachinon). Die Oxidation findet nur in 9,10-Position statt, ist also hochselektiv.
Während die Oxidation von Phenanthren mit Chromtrioxid ausschließlich Phenanthren-9,10-chinon liefert,[7] verläuft sie mit Cer(IV)-salzen nicht so selektiv. Neben Phenanthren-9,10-chinon, dem Hauptprodukt, entsteht Phenanthrem-1,4-chinon. Für die Synthese von Phenanthrenchinonen wäre dies ein Nachteil, doch gibt der Versuch uns Gelegenheit, die isomeren Phenanthrenchinone durch Adsorptions-Säulenchromatographie zu trennen. Die Trennung kann visuell verfolgt werden, denn beide Chinone sind orangefarben. Dagegen weist Anthrachinon nur eine schwach gelbe Farbe auf.
Einzelnachweise
[Bearbeiten]- ↑ R. Ikan, Natural Products. A laboratory guide, p. 25-26, Academic Press, London-New York, 1969. Hier wurde Myristicin durch Säulenchromatographie an Aluminiumoxid erhalten. Der Autor dieses Wiki-Beitrags hat den Versuch überarbeitet.
- ↑ E. B. Vliet, Org. Syntheses, Collective Vol. 1, 482 (1941).
- ↑ Org. Syntheses, Coll. Vol. 2, 553 (1943).
- ↑ Siegfried Hauptmann, Organische Chemie, 1. Aufl., S. 391, Harry Deutsch, Thun-Frankfurt a. M., 1985.
- ↑ Gattermann-Wieland, Die Praxis des Organischen Chemikers, 37. Aufl., S. 266, De Gruyter, Berlin, 1956.
- ↑ Beyer-Walter, Lehrbuch der Organischen Chemie, 21. Aufl., S. 517, Hirzel, Stuttgart, 1988.
- ↑ Org. Syntheses Collective Vol 4, 757.
Literatur zum Versuch
[Bearbeiten]- M. Periasamy und M. Vivekananda Bhatt, Synthesis 1977, 330. Der Versuch wurde vom Autor des Wiki-Beitrags für das Organisch-chemische Praktikum ausgearbeitet.
Sonstiges
[Bearbeiten]Entfärbung und Umkristallisieren von unreinem Phenanthren ("technische Qualität")
[Bearbeiten]Entfärbung mit Aktivkohle
Materialien
[Bearbeiten]- Phenanthren
- 96%-iges Ethanol
oder
- Toluol
- Aktivkohle
Gefahrenbezeichnung recherchieren und ergänzen
Versuchsbeschreibung
[Bearbeiten]a) Umristallisieren aus Ethanol
[Bearbeiten]Technisches, bräunlich gefärbtes Phenanthren (1,5 g) wird abgewogen. Man gibt es in einen 50 ml-Rundkolben. Man fügt 96%iges Ethanol zu (## ml) und erwärmt im Wasserbad mit aufgesetztem Rückflußkühler zum Sieden. Beobachten Sie, ob sich das Phenanthren vollständig löst. Wenn nicht, muss vorsichtig weiteres Lösungsmittel durch den Rückflusskühler zugegeben werden. Notieren Sie, wieviel Lösungsmittel insgesamt benötigt wird! Wenn alles Phenanthren aufgelöst ist, entfernt man das Wasserbad und lässt die Lösung etwas abkühlen.
Man fügt eine Spatelspitze Aktivkohle zu. Vorsicht, Brandgefahr: Beim Zugeben der Aktivkohle kann die Lösung aufschäumen (Warum?); ist sie zu heiß, könnte sie zum Sieden kommen, und die Dämpfe könnten sich entzünden.
Man setzt den Rückflusskühler wieder auf und erhitzt im Wasserbad erneut zum Sieden. Nach einigen Minuten filtriert man die heiße Lösung durch ein Faltenfilter in einen Erlenmeyerkolben. Ist die Lösung nun farblos?
Man verschließt den Erlenmeyerkolben und lässt längere Zeit stehen. Das Phenanthren kristallisiert wieder aus. Die Kristalle werden mit einer kleinen Nutsche (Büchner-Trichter) abgesaugt, und mit eiskaltem Ethanol gewaschen. Man lässt die Kristalle im Exsikkator über Calciumchlorid trocknen. Wägen Sie die Substanz aus und berechnen Sie die Ausbeute nach dem Umkristallisieren.
Bestimmen Sie im Schmelzpunktsgerät den Schmelzpunkt.
b) Umkristallisieren aus Toluol
[Bearbeiten]Anstelle von Ethanol wird Toluol verwendet. Dieses siedet jedoch bei höherer Temperatur als Ethanol, kann im Wasserbad also nicht ins Sieden kommen. Der Versuch wird analog durchgeführt.
Verwendung/Entsorgung
[Bearbeiten]Das gereinigte Phenanthren wird für Versuch ## (Säulenchromatographie) aufbewahrt.
Literatur
[Bearbeiten]- Phenanthren "technischer Qualität" läßt sich aus siedendem Toluol mit Norit umkristallisieren (Fußnote in Org. Synth. Coll. Vol IV, 757). Dieses Material wurde dort zur Darstellung von Phenanthren-9,10-chinon mit Chrom(VI)oxid benutzt.
- Das Umkristallisieren aus Ethanol wurde im Organische-chemischen Praktikum des Wiki-Autors durchgeführt.
Adsorptive Filtration von unreinem Anthracen über Aluminiumoxid
[Bearbeiten]Materialien
[Bearbeiten]- Anthracen, "technische" Qualität (0,5 g)
- Aluminiumoxid, basisch, Aktivitätsstufe I (50 g)
- Seesand
- destilliertes Toluol (ca. 500 ml)
Gefahrenbezeichnungen sind zu recherchieren und ergänzen.
Versuchsbeschreibung
[Bearbeiten]a) Füllung des Chromatographierohrs (Einschlämmen)
[Bearbeiten]Ein Chromatographierohr (effektive Länge 40 cm, innerer Durchmesser 1,6 cm) wird mit zwei Klammern vertikal an einem Stativ befestigt. Unter den Auslauf stellt man einen Erlenmeyerkolben. Bei geschlossenem Hahn füllt man das Rohr bis zu etwa einem Viertel mit Toluol. Mit Hilfe eines langen Glasstabs oder Glasrohrs stößt man einen Bausch aus Watte in die Verjüngung des Auslaufs und entfernt durch Stoßen etwa gebildete Luftblasen. Man bereitet aus 50 g Aluminiumoxid (basisch, Aktivitätsstufe I) und ca. 80 ml Toluol in einem Erlenmeyerkolben durch Umschütteln eine blasenfreie Suspension und gießt diese durch einen Pulvertrichter möglichst schwungvoll in die Trennsäule. Der Absetzvorgang wird durch Klopfen mit der Reagenzglasklammer unterstützt. Überschüssiges Toluol lässt man durch Öffnen des Hahns abtropfen. Die im Erlenmeyerkolben zurückgebliebene Suspension wird mit Toluol quantitativ in die Säule gespült. Es ist darauf zu achten, dass stets eine Lösungsmittelschicht über der Füllung steht; die Säule darf nicht "trockenlaufen". Wenn sich das Aluminiumoxid abgesetzt hat (einige Zeit warten!), lässt man ca. 1 cm hoch Seesand einrieseln. Vor Aufgabe der zu trennenden Substanzmischung lässt man die überstehende Flüssigkeit durch Öffnen des Hahns so weit ab, dass der Seesand nur noch mit einer dünnen Lösungsmittelschicht bedeckt ist.
b) Trennprozess
[Bearbeiten]Man löst 0,5 g Anthracen (techn. Qualität) bei Raumtemperatur in der nötigen Menge Toluol (ca. 50 ml). Durch einen Tropftrichter oder kleinen Scheidetrichter lässt man die Lösung auf die Säule tropfen - gleichzeitig öffnet man den Hahn am unteren Ende der Chromatographiesäule. Das Eluat soll mit 1-2 Tropfen pro Sekunde austreten. Es wird in einem Rundkolben (250 ml), dessen Gewicht man bestimmt hat, aufgefangen. Wenn die gesamte Anthracenlösung aufgegeben ist, eluiert man durch Auftropfen von Toluol. Man prüft von Zeit zu Zeit das Eluat auf Anthracen, indem man einige Tropfen auf ein Uhrglas tropfen lässt und die Flüssigkeit durch Abblasen zum Verdunsten bringt. Die Elution wird abgebrochen, wenn kein Rückstand auf dem Uhrglas bleibt (man benötigt zum Eluieren ca. 100 ml Toluol). Notieren Sie die benötigte Menge! Man destilliert das Eluat bis zur Trockene, am besten im Rotationsverdampfer. Wiegen Sie Kolben und Rückstand und bestimmen Sie die Rohausbeute. Beobachten Sie die Fluoreszenz des gereinigten Anthracens unter der UV-Lampe; untersuchen Sie, ob auch das Ausgangsmaterial fluoresziert.
c) Umkristallisieren
[Bearbeiten]Das Anthracen wird im selben Kolben in der nötigen Menge 95%igem Ethanol auf dem siedenden Wasserbad gelöst (Menge notieren! Sie benötigen mindestens 50 ml ). Die heiße Lösung wird durch vorgewärmte Trichter in einen Erlenmeyerkolben filtriert. Man bedeckt ihn mit einem Uhrglas. Nach beendeter Kristallisation - am besten lässt man über Nacht stehen - saugt man die Kristalle ab, wäscht mit eiskaltem Ethanol und trocknet über Calciumchlorid. Bestimmen Sie die Ausbeute an umkristallisierter Substanz und den Schmelzpunkt.
Anmerkungen
[Bearbeiten]Dieser Versuch ist ein Beispiel für eine sog. adsorptive Filtration. Eine Lösung des Gemisches wird kontinuierlich auf die Säule aufgegeben, bis diese mit allen adsorbierbaren Stoffen gesättigt ist. Bei diesem Verfahren wird nur die am schwächsten adsorbierte Substanz, die deshalb "an der Front" läuft, rein erhalten. Allen anderen sind die nachfließenden Anteile der vorhergehenden Fraktionen beigemischt. Das Verfahren eignet sich zur Reinigung chemischer Präparate von allen stärker adsorbierbaren Verunreinigungen. Die Begleitstoffe des "technischen" Anthracens werden stärker adsorbiert als das Anthracen selbst und werden daher zurückgehalten. Einige färben den oberen Teil der Säule gelblich.
Verwendung/Entsorgung
[Bearbeiten]Fluoreszenz des Anthracens unter der UV-Lampe beobachten. Anthracen kann zu Anthrachinon oxidiert werden (Versuch #)
Literatur
[Bearbeiten]- G. Hesse, Chromatographisches Praktikum, 2. Auflage, S. 52, Akademische Verlagsgesellschaft, Frankfurt a. M., 1972. Dort wird das giftige Benzol als Lösungs- und Elutionsmittel verwendet. Es wurde im Organisch-chemischen Praktikum des Wikibook-Autors durch Toluol ersetzt.
Verteilung von Azofarbstoffen zwischen 1-Octanol und Wasser
[Bearbeiten]Materialien
Reagenzgläser
1-Octanol (n-Octylalkohol)
Azofarbstoffe (siehe Schema)
Natronlauge, konzentrierte Salzsäure
Durchführung
Einige Milligramm der im Schema aufgeführten Azoverbindungen (wie heißen sie?) werden in verschiedenen Reagenzgläsern in ca. 3 ml 1-Octanol gelöst. Man versetzt die gefärbte Lösung mit demselben Volumen Wasser und schüttelt durch.

Schema. Formeln einiger aromatischer Azoverbindungen.
Beobachten Sie, ob sich die Azoverbindung in der Wasserphase, in der organischen Phase oder in beiden Phasen aufhält! Versuchen Sie, die Befunde mit der Struktur der Azoverbindungen zu erklären!
Anschließend werden die Octanol/Wasser-Lösungen der Azoverbindungen Nr. 2 und Nr. 4 mit einigen Tropfen 3-molarer Natronlauge versetzt und nochmals geschüttelt. Die Lösung der Azoverbindung Nr. 3 wird mit einigen Tropfen konzentrierter Salzsäure versetzt und ebenfalls geschüttelt.
Auswertung
Versuchen Sie, die beim Ändern des pH-Wertes auftretenden Effekte zu erklären!
Abtrennung von Benzoesäure aus autoxidiertem Benzaldehyd
[Bearbeiten]Materialien
[Bearbeiten]Lösungsmittel zum Verdünnen: Methyl-tert-butylether (MTBE) oder Diethylether. Letzterer muss frei von Ether-peroxiden sein, daher wird MTBE im Praktikum bevorzugt.
- Wasserfreies Natriumsulfat
- konz. Salzsäure
Gefahrenbezeichnungen bitte selber recherchieren und dokumentieren.
Versuchsbeschreibung
[Bearbeiten]Roher Benzaldehyd (## ml) wird in einem Scheidetrichter mit Lösungsmittel (## ml) verdünnt. Man bereitet eine gesättigte Lösung von Natriumcarbonat (Soda) in Wasser und schüttelt damit die Benzaldehyd-Lösung portionsweise im Scheidetrichter aus. Die wässrige Phase soll zum Schluss alkalische Reaktion zeigen (pH-Indikatorpapier). Man trennt die organische Phase ab. Die wässrigen Phasen werden vereinigt und mit Lösungsmittel (## ml) im Scheidetrichter gewaschen. Der organische Extrakt wird zur ersten abgetrennten organischen Phase gegeben. Man trocknet die vereinigten organischen Phasen über wasserfreiem Natriumsulfat. Über der trocknenden Lösung soll möglichst wenig Luft stehen, um erneute Autoxidation des Benzaldehyds zu vermeiden. Vor Gebrauch wird die Lösung des Benzaldehyds im Vakuum destilliert. Unter Normalbedingungen (760 Torr) siedet Benzaldehyd bei 178 °C. Für die Destillation im Vakuum (10 Torr) wird eine Siedetemperatur von 62 °C angegeben. Zur Gewinnung der Benzoesäure werden die vereinigten wässrigen Phasen mit konzentrierter Salzsäure vorsichtig auf pH ca. 3 angesäuert und in einem Eisbad gekühlt. Benzoesäure sollte ausfallen. Ist dies nicht der Fall (die Löslichkeit in Wasser beträgt bei 0 °C 1,7 g/l, bei 20 °C 2,9 g/l), könnte sie durch Ausschütteln mit Dichlormethan (Dichte 1,3266 g/l, bildet die Unterphase!) isoliert werden. Benzoesäure lässt sich sublimieren.
Verwendung/Entsorgung
[Bearbeiten]Aufbewahren: Verwendung von Benzaldehyd siehe Versuch ##; Benzoesäure könnte verestert werden, Riechstoffe.
Anmerkungen
[Bearbeiten]Die Dichte von Benzaldehyd (1,0415 g/ml) unterscheidet sich nur geringfügig von der des Wassers. Daher werden sich die Phasen nach dem Schütteln im Scheidetrichter nur langsam trennen. Setzt man ein Lösungsmittel geringerer Dichte als Hilfsphase zu, lassen sich die Schichten leichter trennen. Die Dichte von MTBE beträgt 0,7405 g/ml, die von Diethylether 0,7138 g/ml.
Fragen
[Bearbeiten]- Wie verändert sich die Dichte der wässrigen Phase, wenn das Natriumcarbonat zugesetzt wird?
- Formulieren Sie die Autoxidation des Benzaldehyds!
Autoren
[Bearbeiten]Text
[Bearbeiten]Wikipedia
[Bearbeiten]Teile dieses Wikibooks stammen aus Wikipedia-Artikeln, die aufgrund des stark sachbuchhaften Anleitungscharakters dort unpassend waren. Die Autoren der jeweiligen Artikel sind unten separat aufgeführt. Die Listen wurden mit dem Programm ![]() Contributors von Benutzer:Duesentrieb auf dem Wikimedia Toolserver erstellt. Hier nicht aufgeführte Artikel wurden mit Versionsgeschichte importiert.
Contributors von Benutzer:Duesentrieb auf dem Wikimedia Toolserver erstellt. Hier nicht aufgeführte Artikel wurden mit Versionsgeschichte importiert.
- bis 2006-04-02 danach #Nachweis (Chemie, Methodenteil)
- 87 Wächter 2006-01-05 11:35 – 2006-03-22 17:56
- 28 82.207.144.171 (anon) 2006-01-11 12:25 – 2006-02-01 14:16
- 9 80.143.235.108 (anon) 2006-01-09 11:52 – 2006-01-09 12:05
- 2 Christoph D 2005-03-19 16:10 – 2005-10-18 18:21
- 6 80.143.89.144 (anon) 2006-01-13 16:14 – 2006-01-13 16:52
- 5 193.158.3.10 (anon) 2005-09-26 08:14 – 2005-09-26 08:27
- 4 Baultbear 2005-12-04 19:16 – 2005-12-04 19:22
- 4 80.143.110.129 (anon) 2006-01-05 11:28 – 2006-01-05 11:45
- 3 80.137.216.237 (anon) 2005-11-22 20:28 – 2005-11-22 20:40
- 3 84.166.237.225 (anon) 2005-11-23 17:11 – 2005-11-23 17:16
- 3 80.143.73.138 (anon) 2006-01-06 13:41 – 2006-01-06 13:47
- 3 80.143.244.68 (anon) 2006-01-10 12:03 – 2006-01-10 12:16
- 3 80.143.77.155 (anon) 2006-02-01 16:51 – 2006-02-01 16:53
- 2 PIGSgrame 2006-02-01 17:37 – 2006-02-03 15:14
- 2 145.254.213.29 (anon) 2004-10-24 14:49 – 2004-10-24 14:51
- 2 128.130.142.16 (anon) 2005-10-20 11:55 – 2005-10-20 11:57
- 2 Agabuga 2005-11-16 19:55 – 2005-11-16 20:02
- 2 158.64.68.1 (anon) 2005-12-13 07:40 – 2005-12-13 07:44
- 2 85.75.108.22 (anon) 2005-12-22 11:47 – 2005-12-22 11:47
- 2 Prolineserver 2006-03-06 20:01 – 2006-03-07 18:53
- 1 Hati 2006-03-11 15:54 – 2006-03-11 16:41
- 2 88.73.214.237 (anon) 2006-03-19 19:42 – 2006-03-19 19:45
- 1 ThomasM 2004-03-14 18:39 – 2004-03-14 18:39
- 1 HenHei 2004-03-14 18:51 – 2004-03-14 18:51
- 1 Rec 2004-03-20 12:08 – 2004-03-20 12:08
- 1 80.134.250.78 (anon) 2004-12-07 09:07 – 2004-12-07 09:07
- 1 62.226.215.189 (anon) 2005-03-02 16:36 – 2005-03-02 16:36
- 1 212.204.24.73 (anon) 2005-03-26 12:39 – 2005-03-26 12:39
- 1 213.54.225.30 (anon) 2005-07-23 16:35 – 2005-07-23 16:35
- 1 84.175.127.175 (anon) 2005-10-18 12:46 – 2005-10-18 12:46
- 1 84.189.120.107 (anon) 2005-11-21 22:07 – 2005-11-21 22:07
- 1 213.39.153.228 (anon) 2005-11-30 12:23 – 2005-11-30 12:23
- 1 80.143.81.126 (anon) 2006-01-05 08:01 – 2006-01-05 08:01
- 1 86.56.9.11 (anon) 2006-01-08 17:32 – 2006-01-08 17:32
- 1 85.74.61.20 (anon) 2006-01-12 21:24 – 2006-01-12 21:24
- 1 Elya 2006-01-12 21:38 – 2006-01-12 21:38
- 1 80.171.73.187 (anon) 2006-01-13 19:40 – 2006-01-13 19:40
- 1 80.143.75.169 (anon) 2006-01-17 17:43 – 2006-01-17 17:43
- 1 84.180.43.201 (anon) 2006-01-20 17:42 – 2006-01-20 17:42
- 1 84.139.27.1 (anon) 2006-01-25 17:40 – 2006-01-25 17:40
- 1 80.184.171.204 (anon) 2006-01-26 12:34 – 2006-01-26 12:34
- 1 62.203.4.203 (anon) 2006-01-28 09:36 – 2006-01-28 09:36
- 1 80.133.104.149 (anon) 2006-01-29 17:31 – 2006-01-29 17:31
- 1 Cottbus 2006-02-16 14:21 – 2006-02-16 14:21
- 1 Mkill 2006-02-17 01:16 – 2006-02-17 01:16
- 1 132.195.66.162 (anon) 2006-02-23 07:45 – 2006-02-23 07:45
- 1 87.122.146.57 (anon) 2006-03-04 09:21 – 2006-03-04 09:21
- 1 83.135.218.4 (anon) 2006-03-06 18:52 – 2006-03-06 18:52
- 1 80.143.94.149 (anon) 2006-03-11 12:08 – 2006-03-11 12:08
- 1 193.171.131.240 (anon) 2006-03-18 12:54 – 2006-03-18 12:54
- 1 Wg0867 2006-03-25 23:48 – 2006-03-25 23:48
- 1 89.51.248.40 (anon) 2006-03-30 18:26 – 2006-03-30 18:26
- bis 2006-11-26 danach Inhalt ausgelagert nach w:Nachweis (Chemie), w:Nachweise für Anionen, w:Nachweise für Kationen, w:Nachweise organischer Stoffe; siehe w:Wikipedia:Redaktion Chemie/Archiv/2006/Dezember#Kationennachweise
- 8 84.151.235.36 (anon) 2006-10-09 10:28 – 2006-10-09 10:35
- 3 NEUROtiker 2006-09-17 20:55 – 2006-11-26 23:34
- 4 84.170.137.15 (anon) 2006-05-21 19:16 – 2006-05-21 19:20
- 1 Stefan Horn 2006-07-27 07:43 – 2006-07-27 07:47
- 1 Wg0867 2006-04-02 21:12 – 2006-04-02 21:36
- 2 84.170.8.76 (anon) 2006-06-20 14:27 – 2006-06-20 14:28
- 2 W!B: 2006-08-02 01:24 – 2006-08-06 16:47
- 2 217.230.58.106 (anon) 2006-10-18 14:55 – 2006-10-18 14:56
- 1 Hangy 2006-04-26 16:27 – 2006-04-26 16:27
- 1 84.136.219.94 (anon) 2006-05-10 16:54 – 2006-05-10 16:54
- 1 84.180.147.186 (anon) 2006-06-12 17:38 – 2006-06-12 17:38
- 1 80.132.108.240 (anon) 2006-07-27 11:15 – 2006-07-27 11:15
- 1 Mkill 2006-07-29 20:08 – 2006-07-29 20:08
- 1 84.136.206.55 (anon) 2006-07-30 15:58 – 2006-07-30 15:58
- 1 Onkel Markus 2006-08-21 15:22 – 2006-08-21 15:22
- 1 217.255.172.186 (anon) 2006-08-24 08:22 – 2006-08-24 08:22
- 1 WAH 2006-08-24 13:38 – 2006-08-24 13:38
- 1 87.78.157.232 (anon) 2006-09-14 14:15 – 2006-09-14 14:15
- 1 62.178.201.41 (anon) 2006-09-15 20:39 – 2006-09-15 20:39
- 1 88.64.190.51 (anon) 2006-10-25 15:23 – 2006-10-25 15:23
- 1 217.227.215.186 (anon) 2006-11-12 12:45 – 2006-11-12 12:45
- 1 87.168.222.228 (anon) 2006-11-22 05:05 – 2006-11-22 05:05
- 41 Siegert 2007-03-04 07:16 – 2008-08-10 17:02
- 18 Kuebi 2008-01-25 08:55 – 2008-01-25 09:02
- 4 NEUROtiker 2006-11-26 22:23 – 2008-04-21 17:39
- 7 217.93.173.69 (anon) 2006-12-14 14:24 – 2006-12-14 15:13
- 3 84.173.201.201 (anon) 2007-03-01 21:37 – 2007-03-01 21:40
- 3 90.186.37.30 (anon) 2007-04-28 15:49 – 2007-04-28 15:51
- 3 90.186.25.28 (anon) 2007-04-30 14:42 – 2007-04-30 14:43
- 3 141.43.142.19 (anon) 2008-01-11 17:58 – 2008-01-11 18:25
- 3 Matthias M. 2008-02-26 23:27 – 2008-05-18 19:38
- 1 Hystrix 2007-06-26 19:58 – 2007-10-23 12:12
- 2 Jpidtfaz 2008-07-23 18:32 – 2008-07-23 18:32
- 1 195.93.60.66 (anon) 2007-01-05 15:18 – 2007-01-05 15:18
- 1 139.14.30.170 (anon) 2007-01-26 13:13 – 2007-01-26 13:13
- 1 141.52.232.84 (anon) 2007-02-02 09:06 – 2007-02-02 09:06
- 1 84.150.89.86 (anon) 2007-02-25 14:28 – 2007-02-25 14:28
- 1 84.185.221.242 (anon) 2007-04-11 12:40 – 2007-04-11 12:40
- 1 82.82.189.32 (anon) 2007-05-19 15:28 – 2007-05-19 15:28
- 1 84.178.253.236 (anon) 2007-09-08 17:54 – 2007-09-08 17:54
- 1 89.49.225.230 (anon) 2007-10-06 14:25 – 2007-10-06 14:25
- 1 80.63.151.42 (anon) 2007-10-23 09:34 – 2007-10-23 09:34
- 1 87.162.81.70 (anon) 2007-11-15 22:10 – 2007-11-15 22:10
- 1 84.58.36.135 (anon) 2008-02-06 22:29 – 2008-02-06 22:29
- 1 77.5.242.50 (anon) 2008-03-15 15:59 – 2008-03-15 15:59
- 1 62.47.7.104 (anon) 2008-04-04 09:45 – 2008-04-04 09:45
- 1 Muck31 2008-04-06 12:47 – 2008-04-06 12:47
- 1 129.217.132.31 (anon) 2008-04-21 13:55 – 2008-04-21 13:55
- 1 Johnny Controletti 2008-04-21 14:20 – 2008-04-21 14:20
- 1 89.247.229.20 (anon) 2008-06-01 10:43 – 2008-06-01 10:43
- 1 79.196.247.141 (anon) 2008-09-08 13:16 – 2008-09-08 13:16
- 1 84.186.113.38 (anon) 2008-11-11 12:35 – 2008-11-11 12:35
- 1 Leyo 2008-12-06 21:28 – 2008-12-06 21:28
Bilder
[Bearbeiten]Lizenzbestimmungen
[Bearbeiten]Creative Commons Attribution Share-Alike 3.0 Unported
[Bearbeiten]Deed
[Bearbeiten]
Diese "Commons Deed" ist lediglich eine vereinfachte Zusammenfassung des rechtsverbindlichen Lizenzvertrages (Abschnitt "License") in allgemeinverständlicher Sprache.
Sie dürfen:
- das Werk bzw. den Inhalt vervielfältigen, verbreiten und öffentlich zugänglich machen
- Abwandlungen und Bearbeitungen des Werkes bzw. Inhaltes anfertigen
Zu den folgenden Bedingungen:


- Namensnennung — Sie müssen den Namen des Autors/Rechteinhabers in der von ihm festgelegten Weise nennen.
- Weitergabe unter gleichen Bedingungen — Wenn Sie das lizenzierte Werk bzw. den lizenzierten Inhalt bearbeiten, abwandeln oder in anderer Weise erkennbar als Grundlage für eigenes Schaffen verwenden, dürfen Sie die daraufhin neu entstandenen Werke bzw. Inhalte nur unter Verwendung von Lizenzbedingungen weitergeben, die mit denen dieses Lizenzvertrages identisch, vergleichbar oder kompatibel sind.
Wobei gilt:
- Verzichtserklärung — Jede der vorgenannten Bedingungen kann aufgehoben werden, sofern Sie die ausdrückliche Einwilligung des Rechteinhabers dazu erhalten.
- Sonstige Rechte — Die Lizenz hat keinerlei Einfluss auf die folgenden Rechte:
- Die gesetzlichen Schranken des Urheberrechts und sonstigen Befugnisse zur privaten Nutzung;
- Das Urheberpersönlichkeitsrecht des Rechteinhabers;
- Rechte anderer Personen, entweder am Lizenzgegenstand selber oder bezüglich seiner Verwendung, zum Beispiel Persönlichkeitsrechte abgebildeter Personen.
- Hinweis — Im Falle einer Verbreitung müssen Sie anderen alle Lizenzbedingungen mitteilen, die für dieses Werk gelten. Am einfachsten ist es, an entsprechender Stelle einen Link auf http://creativecommons.org/licenses/by-sa/3.0/deed.de einzubinden.
Haftungsbeschränkung
Die „Commons Deed“ ist kein Lizenzvertrag. Sie ist lediglich ein Referenztext, der den zugrundeliegenden Lizenzvertrag übersichtlich und in allgemeinverständlicher Sprache aber auch stark vereinfacht wiedergibt. Die Deed selbst entfaltet keine juristische Wirkung und erscheint im eigentlichen Lizenzvertrag nicht.
License
[Bearbeiten]CREATIVE COMMONS CORPORATION IS NOT A LAW FIRM AND DOES NOT PROVIDE LEGAL SERVICES. DISTRIBUTION OF THIS LICENSE DOES NOT CREATE AN ATTORNEY-CLIENT RELATIONSHIP. CREATIVE COMMONS PROVIDES THIS INFORMATION ON AN "AS-IS" BASIS. CREATIVE COMMONS MAKES NO WARRANTIES REGARDING THE INFORMATION PROVIDED, AND DISCLAIMS LIABILITY FOR DAMAGES RESULTING FROM ITS USE.}}
THE WORK (AS DEFINED BELOW) IS PROVIDED UNDER THE TERMS OF THIS CREATIVE COMMONS PUBLIC LICENSE ("CCPL" OR "LICENSE"). THE WORK IS PROTECTED BY COPYRIGHT AND/OR OTHER APPLICABLE LAW. ANY USE OF THE WORK OTHER THAN AS AUTHORIZED UNDER THIS LICENSE OR COPYRIGHT LAW IS PROHIBITED.
BY EXERCISING ANY RIGHTS TO THE WORK PROVIDED HERE, YOU ACCEPT AND AGREE TO BE BOUND BY THE TERMS OF THIS LICENSE. TO THE EXTENT THIS LICENSE MAY BE CONSIDERED TO BE A CONTRACT, THE LICENSOR GRANTS YOU THE RIGHTS CONTAINED HERE IN CONSIDERATION OF YOUR ACCEPTANCE OF SUCH TERMS AND CONDITIONS.
1. Definitions
[Bearbeiten]- "Adaptation" means a work based upon the Work, or upon the Work and other pre-existing works, such as a translation, adaptation, derivative work, arrangement of music or other alterations of a literary or artistic work, or phonogram or performance and includes cinematographic adaptations or any other form in which the Work may be recast, transformed, or adapted including in any form recognizably derived from the original, except that a work that constitutes a Collection will not be considered an Adaptation for the purpose of this License. For the avoidance of doubt, where the Work is a musical work, performance or phonogram, the synchronization of the Work in timed-relation with a moving image ("synching") will be considered an Adaptation for the purpose of this License.
- "Collection" means a collection of literary or artistic works, such as encyclopedias and anthologies, or performances, phonograms or broadcasts, or other works or subject matter other than works listed in Section 1(f) below, which, by reason of the selection and arrangement of their contents, constitute intellectual creations, in which the Work is included in its entirety in unmodified form along with one or more other contributions, each constituting separate and independent works in themselves, which together are assembled into a collective whole. A work that constitutes a Collection will not be considered an Adaptation (as defined below) for the purposes of this License.
- "Creative Commons Compatible License" means a license that is listed at http://creativecommons.org/compatiblelicenses that has been approved by Creative Commons as being essentially equivalent to this License, including, at a minimum, because that license: (i) contains terms that have the same purpose, meaning and effect as the License Elements of this License; and, (ii) explicitly permits the relicensing of adaptations of works made available under that license under this License or a Creative Commons jurisdiction license with the same License Elements as this License.
- "Distribute" means to make available to the public the original and copies of the Work or Adaptation, as appropriate, through sale or other transfer of ownership.
- "License Elements" means the following high-level license attributes as selected by Licensor and indicated in the title of this License: Attribution, ShareAlike.
- "Licensor" means the individual, individuals, entity or entities that offer(s) the Work under the terms of this License.
- "Original Author" means, in the case of a literary or artistic work, the individual, individuals, entity or entities who created the Work or if no individual or entity can be identified, the publisher; and in addition (i) in the case of a performance the actors, singers, musicians, dancers, and other persons who act, sing, deliver, declaim, play in, interpret or otherwise perform literary or artistic works or expressions of folklore; (ii) in the case of a phonogram the producer being the person or legal entity who first fixes the sounds of a performance or other sounds; and, (iii) in the case of broadcasts, the organization that transmits the broadcast.
- "Work" means the literary and/or artistic work offered under the terms of this License including without limitation any production in the literary, scientific and artistic domain, whatever may be the mode or form of its expression including digital form, such as a book, pamphlet and other writing; a lecture, address, sermon or other work of the same nature; a dramatic or dramatico-musical work; a choreographic work or entertainment in dumb show; a musical composition with or without words; a cinematographic work to which are assimilated works expressed by a process analogous to cinematography; a work of drawing, painting, architecture, sculpture, engraving or lithography; a photographic work to which are assimilated works expressed by a process analogous to photography; a work of applied art; an illustration, map, plan, sketch or three-dimensional work relative to geography, topography, architecture or science; a performance; a broadcast; a phonogram; a compilation of data to the extent it is protected as a copyrightable work; or a work performed by a variety or circus performer to the extent it is not otherwise considered a literary or artistic work.
- "You" means an individual or entity exercising rights under this License who has not previously violated the terms of this License with respect to the Work, or who has received express permission from the Licensor to exercise rights under this License despite a previous violation.
- "Publicly Perform" means to perform public recitations of the Work and to communicate to the public those public recitations, by any means or process, including by wire or wireless means or public digital performances; to make available to the public Works in such a way that members of the public may access these Works from a place and at a place individually chosen by them; to perform the Work to the public by any means or process and the communication to the public of the performances of the Work, including by public digital performance; to broadcast and rebroadcast the Work by any means including signs, sounds or images.
- "Reproduce" means to make copies of the Work by any means including without limitation by sound or visual recordings and the right of fixation and reproducing fixations of the Work, including storage of a protected performance or phonogram in digital form or other electronic medium.
2. Fair Dealing Rights
[Bearbeiten]Nothing in this License is intended to reduce, limit, or restrict any uses free from copyright or rights arising from limitations or exceptions that are provided for in connection with the copyright protection under copyright law or other applicable laws.
3. License Grant
[Bearbeiten]Subject to the terms and conditions of this License, Licensor hereby grants You a worldwide, royalty-free, non-exclusive, perpetual (for the duration of the applicable copyright) license to exercise the rights in the Work as stated below:
- to Reproduce the Work, to incorporate the Work into one or more Collections, and to Reproduce the Work as incorporated in the Collections;
- to create and Reproduce Adaptations provided that any such Adaptation, including any translation in any medium, takes reasonable steps to clearly label, demarcate or otherwise identify that changes were made to the original Work. For example, a translation could be marked "The original work was translated from English to Spanish," or a modification could indicate "The original work has been modified.";
- to Distribute and Publicly Perform the Work including as incorporated in Collections; and,
- to Distribute and Publicly Perform Adaptations.
- For the avoidance of doubt:
- Non-waivable Compulsory License Schemes. In those jurisdictions in which the right to collect royalties through any statutory or compulsory licensing scheme cannot be waived, the Licensor reserves the exclusive right to collect such royalties for any exercise by You of the rights granted under this License;
- Waivable Compulsory License Schemes. In those jurisdictions in which the right to collect royalties through any statutory or compulsory licensing scheme can be waived, the Licensor waives the exclusive right to collect such royalties for any exercise by You of the rights granted under this License; and,
- Voluntary License Schemes. The Licensor waives the right to collect royalties, whether individually or, in the event that the Licensor is a member of a collecting society that administers voluntary licensing schemes, via that society, from any exercise by You of the rights granted under this License.
The above rights may be exercised in all media and formats whether now known or hereafter devised. The above rights include the right to make such modifications as are technically necessary to exercise the rights in other media and formats. Subject to Section 8(f), all rights not expressly granted by Licensor are hereby reserved.
4. Restrictions
[Bearbeiten]The license granted in Section 3 above is expressly made subject to and limited by the following restrictions:
- You may Distribute or Publicly Perform the Work only under the terms of this License. You must include a copy of, or the Uniform Resource Identifier (URI) for, this License with every copy of the Work You Distribute or Publicly Perform. You may not offer or impose any terms on the Work that restrict the terms of this License or the ability of the recipient of the Work to exercise the rights granted to that recipient under the terms of the License. You may not sublicense the Work. You must keep intact all notices that refer to this License and to the disclaimer of warranties with every copy of the Work You Distribute or Publicly Perform. When You Distribute or Publicly Perform the Work, You may not impose any effective technological measures on the Work that restrict the ability of a recipient of the Work from You to exercise the rights granted to that recipient under the terms of the License. This Section 4(a) applies to the Work as incorporated in a Collection, but this does not require the Collection apart from the Work itself to be made subject to the terms of this License. If You create a Collection, upon notice from any Licensor You must, to the extent practicable, remove from the Collection any credit as required by Section 4(c), as requested. If You create an Adaptation, upon notice from any Licensor You must, to the extent practicable, remove from the Adaptation any credit as required by Section 4(c), as requested.
- You may Distribute or Publicly Perform an Adaptation only under the terms of: (i) this License; (ii) a later version of this License with the same License Elements as this License; (iii) a Creative Commons jurisdiction license (either this or a later license version) that contains the same License Elements as this License (e.g., Attribution-ShareAlike 3.0 US)); (iv) a Creative Commons Compatible License. If you license the Adaptation under one of the licenses mentioned in (iv), you must comply with the terms of that license. If you license the Adaptation under the terms of any of the licenses mentioned in (i), (ii) or (iii) (the "Applicable License"), you must comply with the terms of the Applicable License generally and the following provisions: (I) You must include a copy of, or the URI for, the Applicable License with every copy of each Adaptation You Distribute or Publicly Perform; (II) You may not offer or impose any terms on the Adaptation that restrict the terms of the Applicable License or the ability of the recipient of the Adaptation to exercise the rights granted to that recipient under the terms of the Applicable License; (III) You must keep intact all notices that refer to the Applicable License and to the disclaimer of warranties with every copy of the Work as included in the Adaptation You Distribute or Publicly Perform; (IV) when You Distribute or Publicly Perform the Adaptation, You may not impose any effective technological measures on the Adaptation that restrict the ability of a recipient of the Adaptation from You to exercise the rights granted to that recipient under the terms of the Applicable License. This Section 4(b) applies to the Adaptation as incorporated in a Collection, but this does not require the Collection apart from the Adaptation itself to be made subject to the terms of the Applicable License.
- If You Distribute, or Publicly Perform the Work or any Adaptations or Collections, You must, unless a request has been made pursuant to Section 4(a), keep intact all copyright notices for the Work and provide, reasonable to the medium or means You are utilizing: (i) the name of the Original Author (or pseudonym, if applicable) if supplied, and/or if the Original Author and/or Licensor designate another party or parties (e.g., a sponsor institute, publishing entity, journal) for attribution ("Attribution Parties") in Licensor's copyright notice, terms of service or by other reasonable means, the name of such party or parties; (ii) the title of the Work if supplied; (iii) to the extent reasonably practicable, the URI, if any, that Licensor specifies to be associated with the Work, unless such URI does not refer to the copyright notice or licensing information for the Work; and (iv) , consistent with Section 3(b), in the case of an Adaptation, a credit identifying the use of the Work in the Adaptation (e.g., "French translation of the Work by Original Author," or "Screenplay based on original Work by Original Author"). The credit required by this Section 4(c) may be implemented in any reasonable manner; provided, however, that in the case of a Adaptation or Collection, at a minimum such credit will appear, if a credit for all contributing authors of the Adaptation or Collection appears, then as part of these credits and in a manner at least as prominent as the credits for the other contributing authors. For the avoidance of doubt, You may only use the credit required by this Section for the purpose of attribution in the manner set out above and, by exercising Your rights under this License, You may not implicitly or explicitly assert or imply any connection with, sponsorship or endorsement by the Original Author, Licensor and/or Attribution Parties, as appropriate, of You or Your use of the Work, without the separate, express prior written permission of the Original Author, Licensor and/or Attribution Parties.
- Except as otherwise agreed in writing by the Licensor or as may be otherwise permitted by applicable law, if You Reproduce, Distribute or Publicly Perform the Work either by itself or as part of any Adaptations or Collections, You must not distort, mutilate, modify or take other derogatory action in relation to the Work which would be prejudicial to the Original Author's honor or reputation. Licensor agrees that in those jurisdictions (e.g. Japan), in which any exercise of the right granted in Section 3(b) of this License (the right to make Adaptations) would be deemed to be a distortion, mutilation, modification or other derogatory action prejudicial to the Original Author's honor and reputation, the Licensor will waive or not assert, as appropriate, this Section, to the fullest extent permitted by the applicable national law, to enable You to reasonably exercise Your right under Section 3(b) of this License (right to make Adaptations) but not otherwise.
5. Representations, Warranties and Disclaimer
[Bearbeiten]UNLESS OTHERWISE MUTUALLY AGREED TO BY THE PARTIES IN WRITING, LICENSOR OFFERS THE WORK AS-IS AND MAKES NO REPRESENTATIONS OR WARRANTIES OF ANY KIND CONCERNING THE WORK, EXPRESS, IMPLIED, STATUTORY OR OTHERWISE, INCLUDING, WITHOUT LIMITATION, WARRANTIES OF TITLE, MERCHANTIBILITY, FITNESS FOR A PARTICULAR PURPOSE, NONINFRINGEMENT, OR THE ABSENCE OF LATENT OR OTHER DEFECTS, ACCURACY, OR THE PRESENCE OF ABSENCE OF ERRORS, WHETHER OR NOT DISCOVERABLE. SOME JURISDICTIONS DO NOT ALLOW THE EXCLUSION OF IMPLIED WARRANTIES, SO SUCH EXCLUSION MAY NOT APPLY TO YOU.
6. Limitation on Liability.
[Bearbeiten]EXCEPT TO THE EXTENT REQUIRED BY APPLICABLE LAW, IN NO EVENT WILL LICENSOR BE LIABLE TO YOU ON ANY LEGAL THEORY FOR ANY SPECIAL, INCIDENTAL, CONSEQUENTIAL, PUNITIVE OR EXEMPLARY DAMAGES ARISING OUT OF THIS LICENSE OR THE USE OF THE WORK, EVEN IF LICENSOR HAS BEEN ADVISED OF THE POSSIBILITY OF SUCH DAMAGES.
7. Termination
[Bearbeiten]- This License and the rights granted hereunder will terminate automatically upon any breach by You of the terms of this License. Individuals or entities who have received Adaptations or Collections from You under this License, however, will not have their licenses terminated provided such individuals or entities remain in full compliance with those licenses. Sections 1, 2, 5, 6, 7, and 8 will survive any termination of this License.
- Subject to the above terms and conditions, the license granted here is perpetual (for the duration of the applicable copyright in the Work). Notwithstanding the above, Licensor reserves the right to release the Work under different license terms or to stop distributing the Work at any time; provided, however that any such election will not serve to withdraw this License (or any other license that has been, or is required to be, granted under the terms of this License), and this License will continue in full force and effect unless terminated as stated above.
8. Miscellaneous
[Bearbeiten]- Each time You Distribute or Publicly Perform the Work or a Collection, the Licensor offers to the recipient a license to the Work on the same terms and conditions as the license granted to You under this License.
- Each time You Distribute or Publicly Perform an Adaptation, Licensor offers to the recipient a license to the original Work on the same terms and conditions as the license granted to You under this License.
- If any provision of this License is invalid or unenforceable under applicable law, it shall not affect the validity or enforceability of the remainder of the terms of this License, and without further action by the parties to this agreement, such provision shall be reformed to the minimum extent necessary to make such provision valid and enforceable.
- No term or provision of this License shall be deemed waived and no breach consented to unless such waiver or consent shall be in writing and signed by the party to be charged with such waiver or consent.
- This License constitutes the entire agreement between the parties with respect to the Work licensed here. There are no understandings, agreements or representations with respect to the Work not specified here. Licensor shall not be bound by any additional provisions that may appear in any communication from You. This License may not be modified without the mutual written agreement of the Licensor and You.
- The rights granted under, and the subject matter referenced, in this License were drafted utilizing the terminology of the Berne Convention for the Protection of Literary and Artistic Works (as amended on September 28, 1979), the Rome Convention of 1961, the WIPO Copyright Treaty of 1996, the WIPO Performances and Phonograms Treaty of 1996 and the Universal Copyright Convention (as revised on July 24, 1971). These rights and subject matter take effect in the relevant jurisdiction in which the License terms are sought to be enforced according to the corresponding provisions of the implementation of those treaty provisions in the applicable national law. If the standard suite of rights granted under applicable copyright law includes additional rights not granted under this License, such additional rights are deemed to be included in the License; this License is not intended to restrict the license of any rights under applicable law.
Creative Commons Notice
[Bearbeiten]Creative Commons is not a party to this License, and makes no warranty whatsoever in connection with the Work. Creative Commons will not be liable to You or any party on any legal theory for any damages whatsoever, including without limitation any general, special, incidental or consequential damages arising in connection to this license. Notwithstanding the foregoing two (2) sentences, if Creative Commons has expressly identified itself as the Licensor hereunder, it shall have all rights and obligations of Licensor.
Except for the limited purpose of indicating to the public that the Work is licensed under the CCPL, Creative Commons does not authorize the use by either party of the trademark "Creative Commons" or any related trademark or logo of Creative Commons without the prior written consent of Creative Commons. Any permitted use will be in compliance with Creative Commons' then-current trademark usage guidelines, as may be published on its website or otherwise made available upon request from time to time. For the avoidance of doubt, this trademark restriction does not form part of the License.
Creative Commons may be contacted at http://creativecommons.org/.
GNU Free Documentation License
[Bearbeiten]Version 1.2, November 2002
Copyright (C) 2000,2001,2002 Free Software Foundation, Inc.
51 Franklin St, Fifth Floor, Boston, MA 02110-1301 USA
Everyone is permitted to copy and distribute verbatim copies
of this license document, but changing it is not allowed.
0. PREAMBLE
The purpose of this License is to make a manual, textbook, or other functional and useful document "free" in the sense of freedom: to assure everyone the effective freedom to copy and redistribute it, with or without modifying it, either commercially or noncommercially. Secondarily, this License preserves for the author and publisher a way to get credit for their work, while not being considered responsible for modifications made by others.
This License is a kind of "copyleft", which means that derivative works of the document must themselves be free in the same sense. It complements the GNU General Public License, which is a copyleft license designed for free software.
We have designed this License in order to use it for manuals for free software, because free software needs free documentation: a free program should come with manuals providing the same freedoms that the software does. But this License is not limited to software manuals; it can be used for any textual work, regardless of subject matter or whether it is published as a printed book. We recommend this License principally for works whose purpose is instruction or reference.
1. APPLICABILITY AND DEFINITIONS
This License applies to any manual or other work, in any medium, that contains a notice placed by the copyright holder saying it can be distributed under the terms of this License. Such a notice grants a world-wide, royalty-free license, unlimited in duration, to use that work under the conditions stated herein. The "Document", below, refers to any such manual or work. Any member of the public is a licensee, and is addressed as "you". You accept the license if you copy, modify or distribute the work in a way requiring permission under copyright law.
A "Modified Version" of the Document means any work containing the Document or a portion of it, either copied verbatim, or with modifications and/or translated into another language.
A "Secondary Section" is a named appendix or a front-matter section of the Document that deals exclusively with the relationship of the publishers or authors of the Document to the Document's overall subject (or to related matters) and contains nothing that could fall directly within that overall subject. (Thus, if the Document is in part a textbook of mathematics, a Secondary Section may not explain any mathematics.) The relationship could be a matter of historical connection with the subject or with related matters, or of legal, commercial, philosophical, ethical or political position regarding them.
The "Invariant Sections" are certain Secondary Sections whose titles are designated, as being those of Invariant Sections, in the notice that says that the Document is released under this License. If a section does not fit the above definition of Secondary then it is not allowed to be designated as Invariant. The Document may contain zero Invariant Sections. If the Document does not identify any Invariant Sections then there are none.
The "Cover Texts" are certain short passages of text that are listed, as Front-Cover Texts or Back-Cover Texts, in the notice that says that the Document is released under this License. A Front-Cover Text may be at most 5 words, and a Back-Cover Text may be at most 25 words.
A "Transparent" copy of the Document means a machine-readable copy, represented in a format whose specification is available to the general public, that is suitable for revising the document straightforwardly with generic text editors or (for images composed of pixels) generic paint programs or (for drawings) some widely available drawing editor, and that is suitable for input to text formatters or for automatic translation to a variety of formats suitable for input to text formatters. A copy made in an otherwise Transparent file format whose markup, or absence of markup, has been arranged to thwart or discourage subsequent modification by readers is not Transparent. An image format is not Transparent if used for any substantial amount of text. A copy that is not "Transparent" is called "Opaque".
Examples of suitable formats for Transparent copies include plain ASCII without markup, Texinfo input format, LaTeX input format, SGML or XML using a publicly available DTD, and standard-conforming simple HTML, PostScript or PDF designed for human modification. Examples of transparent image formats include PNG, XCF and JPG. Opaque formats include proprietary formats that can be read and edited only by proprietary word processors, SGML or XML for which the DTD and/or processing tools are not generally available, and the machine-generated HTML, PostScript or PDF produced by some word processors for output purposes only.
The "Title Page" means, for a printed book, the title page itself, plus such following pages as are needed to hold, legibly, the material this License requires to appear in the title page. For works in formats which do not have any title page as such, "Title Page" means the text near the most prominent appearance of the work's title, preceding the beginning of the body of the text.
A section "Entitled XYZ" means a named subunit of the Document whose title either is precisely XYZ or contains XYZ in parentheses following text that translates XYZ in another language. (Here XYZ stands for a specific section name mentioned below, such as "Acknowledgements", "Dedications", "Endorsements", or "History".) To "Preserve the Title" of such a section when you modify the Document means that it remains a section "Entitled XYZ" according to this definition.
The Document may include Warranty Disclaimers next to the notice which states that this License applies to the Document. These Warranty Disclaimers are considered to be included by reference in this License, but only as regards disclaiming warranties: any other implication that these Warranty Disclaimers may have is void and has no effect on the meaning of this License.
2. VERBATIM COPYING
You may copy and distribute the Document in any medium, either commercially or noncommercially, provided that this License, the copyright notices, and the license notice saying this License applies to the Document are reproduced in all copies, and that you add no other conditions whatsoever to those of this License. You may not use technical measures to obstruct or control the reading or further copying of the copies you make or distribute. However, you may accept compensation in exchange for copies. If you distribute a large enough number of copies you must also follow the conditions in section 3.
You may also lend copies, under the same conditions stated above, and you may publicly display copies.
3. COPYING IN QUANTITY
If you publish printed copies (or copies in media that commonly have printed covers) of the Document, numbering more than 100, and the Document's license notice requires Cover Texts, you must enclose the copies in covers that carry, clearly and legibly, all these Cover Texts: Front-Cover Texts on the front cover, and Back-Cover Texts on the back cover. Both covers must also clearly and legibly identify you as the publisher of these copies. The front cover must present the full title with all words of the title equally prominent and visible. You may add other material on the covers in addition. Copying with changes limited to the covers, as long as they preserve the title of the Document and satisfy these conditions, can be treated as verbatim copying in other respects.
If the required texts for either cover are too voluminous to fit legibly, you should put the first ones listed (as many as fit reasonably) on the actual cover, and continue the rest onto adjacent pages.
If you publish or distribute Opaque copies of the Document numbering more than 100, you must either include a machine-readable Transparent copy along with each Opaque copy, or state in or with each Opaque copy a computer-network location from which the general network-using public has access to download using public-standard network protocols a complete Transparent copy of the Document, free of added material. If you use the latter option, you must take reasonably prudent steps, when you begin distribution of Opaque copies in quantity, to ensure that this Transparent copy will remain thus accessible at the stated location until at least one year after the last time you distribute an Opaque copy (directly or through your agents or retailers) of that edition to the public.
It is requested, but not required, that you contact the authors of the Document well before redistributing any large number of copies, to give them a chance to provide you with an updated version of the Document.
4. MODIFICATIONS
You may copy and distribute a Modified Version of the Document under the conditions of sections 2 and 3 above, provided that you release the Modified Version under precisely this License, with the Modified Version filling the role of the Document, thus licensing distribution and modification of the Modified Version to whoever possesses a copy of it. In addition, you must do these things in the Modified Version:
- A. Use in the Title Page (and on the covers, if any) a title distinct from that of the Document, and from those of previous versions (which should, if there were any, be listed in the History section of the Document). You may use the same title as a previous version if the original publisher of that version gives permission.
- B. List on the Title Page, as authors, one or more persons or entities responsible for authorship of the modifications in the Modified Version, together with at least five of the principal authors of the Document (all of its principal authors, if it has fewer than five), unless they release you from this requirement.
- C. State on the Title page the name of the publisher of the Modified Version, as the publisher.
- D. Preserve all the copyright notices of the Document.
- E. Add an appropriate copyright notice for your modifications adjacent to the other copyright notices.
- F. Include, immediately after the copyright notices, a license notice giving the public permission to use the Modified Version under the terms of this License, in the form shown in the Addendum below.
- G. Preserve in that license notice the full lists of Invariant Sections and required Cover Texts given in the Document's license notice.
- H. Include an unaltered copy of this License.
- I. Preserve the section Entitled "History", Preserve its Title, and add to it an item stating at least the title, year, new authors, and publisher of the Modified Version as given on the Title Page. If there is no section Entitled "History" in the Document, create one stating the title, year, authors, and publisher of the Document as given on its Title Page, then add an item describing the Modified Version as stated in the previous sentence.
- J. Preserve the network location, if any, given in the Document for public access to a Transparent copy of the Document, and likewise the network locations given in the Document for previous versions it was based on. These may be placed in the "History" section. You may omit a network location for a work that was published at least four years before the Document itself, or if the original publisher of the version it refers to gives permission.
- K. For any section Entitled "Acknowledgements" or "Dedications", Preserve the Title of the section, and preserve in the section all the substance and tone of each of the contributor acknowledgements and/or dedications given therein.
- L. Preserve all the Invariant Sections of the Document, unaltered in their text and in their titles. Section numbers or the equivalent are not considered part of the section titles.
- M. Delete any section Entitled "Endorsements". Such a section may not be included in the Modified Version.
- N. Do not retitle any existing section to be Entitled "Endorsements" or to conflict in title with any Invariant Section.
- O. Preserve any Warranty Disclaimers.
If the Modified Version includes new front-matter sections or appendices that qualify as Secondary Sections and contain no material copied from the Document, you may at your option designate some or all of these sections as invariant. To do this, add their titles to the list of Invariant Sections in the Modified Version's license notice. These titles must be distinct from any other section titles.
You may add a section Entitled "Endorsements", provided it contains nothing but endorsements of your Modified Version by various parties--for example, statements of peer review or that the text has been approved by an organization as the authoritative definition of a standard.
You may add a passage of up to five words as a Front-Cover Text, and a passage of up to 25 words as a Back-Cover Text, to the end of the list of Cover Texts in the Modified Version. Only one passage of Front-Cover Text and one of Back-Cover Text may be added by (or through arrangements made by) any one entity. If the Document already includes a cover text for the same cover, previously added by you or by arrangement made by the same entity you are acting on behalf of, you may not add another; but you may replace the old one, on explicit permission from the previous publisher that added the old one.
The author(s) and publisher(s) of the Document do not by this License give permission to use their names for publicity for or to assert or imply endorsement of any Modified Version.
5. COMBINING DOCUMENTS
You may combine the Document with other documents released under this License, under the terms defined in section 4 above for modified versions, provided that you include in the combination all of the Invariant Sections of all of the original documents, unmodified, and list them all as Invariant Sections of your combined work in its license notice, and that you preserve all their Warranty Disclaimers.
The combined work need only contain one copy of this License, and multiple identical Invariant Sections may be replaced with a single copy. If there are multiple Invariant Sections with the same name but different contents, make the title of each such section unique by adding at the end of it, in parentheses, the name of the original author or publisher of that section if known, or else a unique number. Make the same adjustment to the section titles in the list of Invariant Sections in the license notice of the combined work.
In the combination, you must combine any sections Entitled "History" in the various original documents, forming one section Entitled "History"; likewise combine any sections Entitled "Acknowledgements", and any sections Entitled "Dedications". You must delete all sections Entitled "Endorsements."
6. COLLECTIONS OF DOCUMENTS
You may make a collection consisting of the Document and other documents released under this License, and replace the individual copies of this License in the various documents with a single copy that is included in the collection, provided that you follow the rules of this License for verbatim copying of each of the documents in all other respects.
You may extract a single document from such a collection, and distribute it individually under this License, provided you insert a copy of this License into the extracted document, and follow this License in all other respects regarding verbatim copying of that document.
7. AGGREGATION WITH INDEPENDENT WORKS
A compilation of the Document or its derivatives with other separate and independent documents or works, in or on a volume of a storage or distribution medium, is called an "aggregate" if the copyright resulting from the compilation is not used to limit the legal rights of the compilation's users beyond what the individual works permit. When the Document is included in an aggregate, this License does not apply to the other works in the aggregate which are not themselves derivative works of the Document.
If the Cover Text requirement of section 3 is applicable to these copies of the Document, then if the Document is less than one half of the entire aggregate, the Document's Cover Texts may be placed on covers that bracket the Document within the aggregate, or the electronic equivalent of covers if the Document is in electronic form. Otherwise they must appear on printed covers that bracket the whole aggregate.
8. TRANSLATION
Translation is considered a kind of modification, so you may distribute translations of the Document under the terms of section 4. Replacing Invariant Sections with translations requires special permission from their copyright holders, but you may include translations of some or all Invariant Sections in addition to the original versions of these Invariant Sections. You may include a translation of this License, and all the license notices in the Document, and any Warranty Disclaimers, provided that you also include the original English version of this License and the original versions of those notices and disclaimers. In case of a disagreement between the translation and the original version of this License or a notice or disclaimer, the original version will prevail.
If a section in the Document is Entitled "Acknowledgements", "Dedications", or "History", the requirement (section 4) to Preserve its Title (section 1) will typically require changing the actual title.
9. TERMINATION
You may not copy, modify, sublicense, or distribute the Document except as expressly provided for under this License. Any other attempt to copy, modify, sublicense or distribute the Document is void, and will automatically terminate your rights under this License. However, parties who have received copies, or rights, from you under this License will not have their licenses terminated so long as such parties remain in full compliance.
10. FUTURE REVISIONS OF THIS LICENSE
The Free Software Foundation may publish new, revised versions of the GNU Free Documentation License from time to time. Such new versions will be similar in spirit to the present version, but may differ in detail to address new problems or concerns. See http://www.gnu.org/copyleft/.
Each version of the License is given a distinguishing version number. If the Document specifies that a particular numbered version of this License "or any later version" applies to it, you have the option of following the terms and conditions either of that specified version or of any later version that has been published (not as a draft) by the Free Software Foundation. If the Document does not specify a version number of this License, you may choose any version ever published (not as a draft) by the Free Software Foundation.











































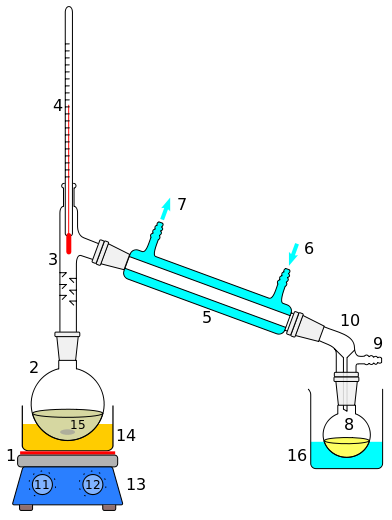








![{\displaystyle \mathrm {2\ C_{4}H_{4}O_{6}^{2-}+Cu^{2+}+2\ OH^{-}\longrightarrow \ [Cu(C_{4}H_{3}O_{6})_{2}]^{4-}+2\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b296f6aa4b2c0b2684656b2c2858f66d8960f25)












