Biochemie und Pathobiochemie: Pyrimidin-Stoffwechsel
Allgemeines
[Bearbeiten]Pyrimidinnukleotide bilden neben den Purinnukleotiden die Bausteine der DNA und RNA. UTP und CTP dienen weiterhin als Aktivatoren verschiedener Biomoleküle.
Pyrimidine bestehen aus einem aromatischen, stickstoffhaltigen, sechsgliedrigen Heterozyklus.
Übersicht
[Bearbeiten]| Übersicht: Stoffwechsel der Pyrimidine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Farbcode: Thioredoxin, Folat. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die Pyrimidinbiosynthese beginnt mit der Synthese von Uridin-5'-monophosphat (UMP). Aus UMP werden dann die anderen Pyrimidinnukleotide gebildet, wie in der Übersicht zu sehen. Nach links muß Energie (meist ATP) investiert werden, nach rechts erfolgt der Abbau.
Wichtige Cofaktoren im Pyrimidinstoffwechsel sind Thioredoxin und Folat (5,10-Methylen-THF). Ersteres wird für die Bildung von Desoxyribonukleotiden benötigt (DNA!), letzteres liefert die Methylgruppe für die Bildung der Thymin-Base im 2'-Desoxythymidin-5'-monophosphat (dTMP).
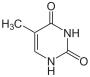
Betrachtet man nur die Basen, so entsteht Cytosin formal aus Uracil, indem der Sauerstoff am C-Atom 4 durch eine Aminogruppe substituiert wird. Thymin entsteht aus Uracil durch Anheftung einer Methylgruppe an das C-Atom 5.

Cytosin |
⇐ | 
Uracil |
⇒ | 
Thymin |
 |
 |
Biosynthese von UMP
[Bearbeiten]| All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| + PRPP
- UTP |
2 ATP, Glutamin
2 ADP, Pi, Glutamat |
Carbamoylphosphat-Synthase II (Glutamin) Zytosol | 6.3.5.5 | Lig | |||||||
|
|||||||||||
| Aspartat
Pi |
|
2.1.3.2 | Tr | ||||||||
|
|||||||||||
| - Orotat |
|
|
Zn | Dihydroorotase Zytosol |
3.5.2.3 | Hyd | |||||
|
|||||||||||
| - UMP | O2 | O2 | FAD, FMN | Dihydroorotat-Dehydrogenase
Mitochondrium |
1.3.3.1 | Ox | |||||
|
|||||||||||
| PRPP
PPi |
Orotat-Phosphoribosyltransferase
Zytosol |
2.4.2.10 | Tr | Orotacidurie I | |||||||
|
|||||||||||
| Orotidin-5'-phosphat- Decarboxylase
Zytosol |
4.1.1.23 | Ly | Orotacidurie I, Orotacidurie II | ||||||||
|
|||||||||||
Beteiligte Enzyme
[Bearbeiten]Die sechs Reaktionsschritte der de novo Pyrimidin-Biosynthese sind evolutionär hochkonserviert. Bei Bakterien werden sie jeweils von einzelnen Enzymen katalysiert. Beim Säugetier werden die ersten drei und die letzten beiden Schritte jeweils von einem multifunktionellen Enzym katalysiert. Die Proteine untergliedern sich in folgende enzymatisch aktiven Bestandteile:
- CAD:
- Carbamoylphosphat-Synthetase (CPS II)
- Aspartat-Transcarbamoylase (ATCase)
- Dihydroorotase
- Dihydroorotat-Dehydrogenase (DHOdhase)
- UMP-Synthetase (UMPS):
- Orotat-Phosphoribosyltransferase (OPRT)
- Orotidin-5'-phosphat-Decarboxylase (ODC)
Die Dihydroorotat-Dehydrogenase ist im Bereich der inneren Mitochondrienmembran lokalisiert, die zwei anderen Proteine/Multienzymkomplexe finden sind im Zytosol.
Reaktionsschritte
[Bearbeiten]Die ersten drei Schritte zur Bildung von Dihydroorotat werden vom CAD-Multienzymkomplex katalysiert.
Die zytosolische Carbamoylphosphat-Synthetase II bildet im 1. Schritt aus Bicarbonat, Glutamin und 2 ATP das Stickstoff- und Phosphathaltige Carbamoylphosphat und kontrolliert als Gatekeeper den Substratfluss durch diesen Biosyntheseweg. (Die Carbamoylphosphat-Synthetase I (CPS I) in den Lebermitochondrien produziert analog dazu Carbamoylphosphat für den Harnstoffzyklus.)
Die Aspartat-Carbamoyltransferase spaltet im 2. Schritt den Phosphatrest ab und nutzt die dabei frei werdende Energie, um die Aminosäure Aspartat anzulagern. Dabei entsteht Carbamoylaspartat. Aspartat bringt dabei das zweite Stickstoffatom und zwei Kohlenstoffatome mit für den zukünftigen Pyrimidin-Ring.
Die Dihydroorotase kondensiert nun im 3. Schritt die Carboxyl- und Aminogruppe unter Wasserabspaltung, wodurch das Ringsystem geschlossen wird. Dihydroorotat ist entstanden.
Im 4. Schritt oxidiert das in der inneren Mitochondrienmembran lokalisierte Flavoenzym Dihydroorotat-Dehydrogenase das Ringsystem, das dadurch eine zusätzliche dritte Doppelbindung erhält. Die Elektronen werden direkt über Ubichinon in die Atmungskette geschleust. Dabei entsteht Orotat.
Die letzten beiden Schritte werden von der UMP-Synthase katalysiert.
Die Orotat-Phosphoribosyltransferase (OPRT) verbindet im 5. Schritt Orotat mit dem Phosphoribosylrest von PRPP unter Abspaltung von Pyrophosphat zum Orotidin-5'-monophosphat (OMP).
Die Orotidin-5'-phosphat-Decarboxylase (ODC) decarboxyliert den Orotidin-Rest am C6-Atom, so das aus Orotidin-5'-monophosphat (OMP) Uridin-5'-monophosphat (UMP) wird.
Regulation
[Bearbeiten]Kurzfristig wird der Substratfluss bedarfsorientiert vor allem allosterisch auf Höhe der Carbamoylphosphat-Synthase II reguliert. Das Endprodukt UTP wird dabei als Feedback-Hemmer. PRPP wirkt als Feedforward-Aktivator, vermutlich um die Pyrimidinbiosynthese auf die ebenfalls PRPP-abhängige Purinbiosynthese abzustimmen.
Um die UMP-Synthese mittelfristig an die DNA-Synthese bzw. Zellproliferation (Zellteilung) anzupassen kann CAD an zwei verschiedenen Stellen phosphoryliert werden. Die Phosphorylierung von CAD durch die MAP-Kinase (nach Stimulation des zellteilungsfördernden EGF-Rezeptors) vor Beginn der S-Phase (DNA-Synthesephase) senkt den Einfluss des allosterischen Hemmers UTP und erhöht den Einfluss des allosterischen Aktivators PRPP, so dass die UMP-Synthese drastisch gesteigert wird. Die Phosphorylierung an einer anderen Domäne des CAD-Proteins durch die Proteinkinase A am Ende der S-Phase führt wieder den ursprünglichen Zustand herbei. So kann die Produktion von DNA-Bausteinen selektiv für die S-Phase gesteigert werden.
Weiterhin erfolgt eine Regulation auf Höhe der Genexpression. Der Transkriptionsfaktor C-Myc erhöht dabei die Transkription von CAD am G1/S-Übergang des Zellzyklus. Umgekehrt wird CAD im Rahmen der Apoptose unter dem Einfluss von Caspasen abgebaut.
Eine Fehlregulation mit dauerhaft aktivierter Pyrimidinbiosynthese bei unkontrollierter Zellteilung spielt in der Karzinogenese (Krebsentstehung) eine Rolle.
Stoffwechsel der Uridinphosphate
[Bearbeiten]Freisetzung von UDP aus der RNA
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| Pi
RNAn |
Polyribonukleotid- Nukleotidyltransferase | 2.7.7.8 | Tr | ||||||||
|
|||||||||||
Dephosphorylierung von UTP zu UMP
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| H2O
PPi |
Nukleosidtriphosphat- Diphosphatase | 3.6.1.19 | Hyd | ||||||||
|
|||||||||||
Von der RNA über Nukleotid und Nukleosid zur Base und vice versa
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| PPi
RNAn |
PPi
RNAn |
DNA-abh. RNA-Polymerase | 2.7.7.6 | Tr | |||||||
|
|||||||||||
| H2O
Pi |
1. |
AMP
ADP |
Ca | 1) Apyrase | 3.6.1.5 | Hyd | |||||
| 2) Nukleosidtriphosphat--Adenylat-Kinase | 2.7.4.10 | Tr | |||||||||
|
ATP |
oder |
ATP |
oder
Nukleosid-diphosphat-Kinase |
2.7.4.6 | Tr | ||||||
|
|||||||||||
| H2O
Pi |
/ | Nukleosid-diphosphatase | 3.6.1.6 | Hyd | |||||||
| Ca | Apyrase | 3.6.1.5 | |||||||||
|
ATP |
oder |
ATP |
oder
Cytidylat-Kinase |
2.7.4.14 | Tr | ||||||
|
|||||||||||
| H2O
Pi |
1. |
ADP
ATP |
1) 5'-Nukleotidase | 3.1.3.5 | Hyd | ||||||
| 2) Uridin-Kinase | 2.7.1.48 | Tr | |||||||||
|
|||||||||||
| Pi | Pi | Uridin-Phosphorylase | 2.4.2.3 | Tr | |||||||
|
|||||||||||
Endgültiger Abbau von Uracil
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| NADPH/H+ | NADPH/H+ | Dihydropyrimidin-Dehydrogenase (NADP+) | 1.3.1.2 | Ox | DPD-Defizienz | ||||||
|
|||||||||||
| H2O
|
H2O
|
Dihydropyrimidinase | 3.5.2.2 | Hyd | DPYS-Defizienz | ||||||
|
|||||||||||
| H2O
CO2, NH3 |
β-Ureidopropionase | 3.5.1.6 | Hyd | UPB1-Defizienz | |||||||
|
|||||||||||
Uridin wird in 3 Schritten zu β-Alanin abgebaut: durch Reduktion, hydrolytische Ringspaltung und Abspaltung des Carbamoyl-Restes in Form von Ammoniak und Kohlenstoffdioxid. Reaktionen und beteiligte Enzyme sind identisch zum Thymin-Abbau.
Biosynthese von CTP aus UTP
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| + GTP
- CTP |
ATP, Glutamin
ADP, Pi, Glutamat |
CTP-Synthetase | 6.3.4.2 | Lig | |||||||
|
|||||||||||
DIE CTP-Synthetase katalysiert die ATP-abhängige Amidierung des Pyrimidin-Ringsystems am C4-Atom. Den dafür benötigten Stickstoff liefert Glutamin.
Stoffwechsel der Cytidinphosphate
[Bearbeiten]Freisetzung von CDP aus der RNA
[Bearbeiten]| All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| Pi
RNAn |
Polyribonukleotid-Nukleotidyltransferase | 2.7.7.8 | Tr | ||||||||
|
|||||||||||
Von der RNA über Nukleotid zum Nukleosid (und vice versa) und bis zur Base
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| PPi
RNAn |
PPi
RNAn |
DNA-abh. RNA-Polymerase | 2.7.7.6 | Tr | |||||||
|
|||||||||||
| H2O
Pi |
Ca | Apyrase | 3.6.1.5 | Hyd | |||||||
|
ATP |
oder |
ATP |
oder
Nukleosid-diphosphat-Kinase |
2.7.4.6 | Tr | ||||||
|
|||||||||||
| H2O
Pi |
Ca | Apyrase | 3.6.1.5 | Hyd | |||||||
|
ATP |
oder |
ATP |
oder
Cytidylat-Kinase |
2.7.4.14 | Tr | ||||||
|
|||||||||||
| H2O
Pi |
1. |
ADP
ATP |
1) 5'-Nukleotidase | 3.1.3.5 | Hyd | ||||||
| 2) Uridin-Kinase | 2.7.1.48 | Tr | |||||||||
|
|||||||||||
| H2O
NH3 |
Cytidin-Deaminase | 3.5.4.5 | Hyd | ||||||||
|
|||||||||||
| Pi | Pi | Uridin-Phosphorylase | 2.4.2.3 | Tr | |||||||
|
|||||||||||
Uracil kann wiederverwertet oder zu β-Alanin abgebaut werden, wie oben dargestellt.
Biosynthese von dCDP aus CDP
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| Red. Thioredoxin
H2O, Thioredoxin-Disulfid |
ATP, Fe | Ribonukleosid-diphosphat- Reduktase | 1.17.4.1 | Ox | ||||||
|
||||||||||
Stoffwechsel der Desoxycytidinphosphate
[Bearbeiten]Von der DNA über Nukleotid zum Nukleosid (und vice versa) und bis zur Base
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| PPi
DNAn |
PPi
RNAn |
DNA-abh. DNA-Polymerase | 2.7.7.7 | Tr | |||||||
|
|||||||||||
| ADP
ATP |
ADP
ATP |
Nukleosid-diphosphat-Kinase | 2.7.4.6 | Tr | |||||||
|
|||||||||||
| ADP
ATP |
Cytidylat-Kinase | 2.7.4.14 | Tr | ||||||||
|
|||||||||||
| H2O
Pi |
1. |
NDP
NTP |
1) 5'-Nukleotidase | 3.1.3.5 | Hyd | ||||||
| 2) Desoxycytidin-Kinase | 2.7.1.74 | Tr | |||||||||
|
|||||||||||
| H2O
NH3 |
Cytidin-Deaminase | 3.5.4.5 | Hyd | ||||||||
|
|||||||||||
| Pi
Desoxy-α-D-Rib-1-P |
Purinnukleosid-Phosphorylase | 2.4.2.1 | Tr | PNP-Def. | |||||||
| Thymidin-Phosphorylase | 2.4.2.4 | Tr | MTDPS1 (MNGIE) | ||||||||
|
|||||||||||
Uracil kann wiederverwertet oder zu β-Alanin abgebaut werden, wie oben dargestellt.
Biosynthese von dUMP aus dCMP
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| H2O
NH3 |
dCMP-Deaminase | 3.5.4.12 | Hyd | |||||||
|
||||||||||
Biosynthese von dUDP aus UDP
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| Red. Thioredoxin
H2O, Thioredoxin-Disulfid |
ATP, Fe | Ribonukleosid-diphosphat- Reduktase | 1.17.4.1 | Ox | ||||||
|
||||||||||
Stoffwechsel der Desoxyuridinphosphate
[Bearbeiten]Von der DNA über Nukleotid zum Nukleosid (und vice versa) und bis zur Base
[Bearbeiten]| All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| ADP
ATP |
ADP
ATP |
Nukleosid-diphosphat-Kinase | 2.7.4.6 | Tr | |||||||
|
|||||||||||
| ADP
ATP |
ADP
ATP |
dTMP-Kinase (Thymidylatkinase) | 2.7.4.9 | Tr | |||||||
|
|||||||||||
| ADP
ATP |
Thymidin-Kinase | 2.7.1.21 | Tr | ||||||||
|
|||||||||||
| Pi
Desoxy-α-D-Rib-1-P |
Purinnukleosid-Phosphorylase | 2.4.2.1 | Tr | PNP-Def. | |||||||
| Thymidin-Phosphorylase | 2.4.2.4 | Tr | MTDPS1 (MNGIE) | ||||||||
|
|||||||||||
Uracil kann wiederverwertet oder zu β-Alanin abgebaut werden, wie oben dargestellt.
Biosynthese von dTMP aus dUMP
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| N5,N10-Methylen-THF |
|
2.1.1.45 | Tr | |||||||
|
||||||||||
Stoffwechsel der Desoxythymidinphosphate
[Bearbeiten]Von der DNA über Nukleotid zum Nukleosid (und vice versa) und bis zur Base
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| PPi
DNAn |
PPi
RNAn |
DNA-abh. DNA-Polymerase | 2.7.7.7 | Tr | |||||||
|
|||||||||||
| H2O
Pi |
Ca | Apyrase | 3.6.1.5 | Hyd | |||||||
|
ATP |
oder |
ATP |
oder
Nukleosid-diphosphat-Kinase |
2.7.4.6 | Tr | ||||||
|
|||||||||||
| H2O
Pi |
Ca | Apyrase | 3.6.1.5 | Hyd | |||||||
|
ATP |
oder |
ATP |
oder
dTMP-Kinase (Thymidylat-Kinase) |
2.7.4.9 | Tr | ||||||
|
|||||||||||
| H2O
Pi |
1. |
ADP
ATP |
1) 5'-Nukleotidase
2) Thymidinkinase |
3.1.3.5 | Hyd
Tr |
||||||
|
|||||||||||
| Pi
Desoxy-α-D-Rib-1-P |
Thymidin-Phosphorylase | 2.4.2.4 | Tr | MTDPS1 (MNGIE) | |||||||
|
|||||||||||
Endgültiger Abbau von Thymin
[Bearbeiten]| All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| NADPH/H+ | NADPH/H+ | Dihydropyrimidin-Dehydrogenase (NADP+) | 1.3.1.2 | Ox | DPD-Defizienz | ||||||
|
|||||||||||
| H2O
|
H2O
|
Dihydropyrimidinase | 3.5.2.2 | Hyd | DPYS-Defizienz | ||||||
|
|||||||||||
| H2O
CO2, NH3 |
β-Ureidopropionase | 3.5.1.6 | Hyd | UPB1-Defizienz | |||||||
|
|||||||||||
Der Abbau von Thymin erfolgt analog zum Uracil-Abbau (vgl. oben).
Biologische Bedeutung der Pyrimidinnukleotide
[Bearbeiten]Für die RNA-Biosynthese werden die Pyrimidinnukleotide CTP und UTP benötigt (Uracil ersetzt in der RNA das Thymidin der DNA), für die Synthese von DNA braucht die Zelle die Desoxynukleotide dCTP und dTTP. UTP wird zusätzlich für die Aktivierung von Glucose zu UDP-Glucose benötigt, z.B. für die Biosynthese von Glycogen und Glucuronsäure sowie den Galactose-Stoffwechsel. UTP aktiviert auch den Aminozucker N-Acetyl-D-Glucosamin-1-P zu UDP-N-Acetyl-D-Glucosamin. Analog wird Cholin mit CTP zu CDP-Cholin aktiviert, z.B. für die Biosynthese von Lecithin und der Aminozucker N-Acetylneuraminat (NANA) zu CMP-N-Acetylneuraminat.
Pharmakologie
[Bearbeiten]
Dihydrofolat-Reduktase-Hemmer wie Methotrexat (MTX) hemmen den Folat-Stoffwechsel global, indem sie die Bildung der biologisch aktiven Tetrahydrofolsäure (THF) aus Folsäure und Dihydrofolsäure (DHF) unterbinden (siehe dort). Dadurch kommt es zur Hemmung sowohl der Purin-Synthese als auch der Pyrimidin-Synthese (Thymidylat-Synthase). Die Depletion an Nukleotiden führt in der Folge zur Reduktion der Zellvermehrung, so dass über diesen Mechanismus z.B. die Proliferation von Immun- oder Krebszellen gebremst werden kann.
Eine selektive Blockade der Pyrimidin-Synthese ist mit Leflunomid möglich. Das Immunsuppressivum hemmt die Dihydroorotat-Dehydrogenase, die an der UMP-Biosynthese beteiligt ist. Als Basistherapeutikum wird es in der Behandlung von rheumatischen Erkrankungen angewandt.
Die Pyrimidin-Synthese kann weiterhin mit verschiedenen Pyrimidin-Analoga blockiert werden. Ein Beispiel ist 5-Fluoruracil (5-FU). Aufgrund seiner Ähnlichkeit mit den Nukleinbasen Uracil, Cytosin und Thymin inhibiert 5-FU die Thymidylat-Synthase. Eingesetzt wird es als Chemotherapeutikum v.a. bei Darmkrebs und Brustkrebs, sowie äußerlich bei Warzen.
Literatur
[Bearbeiten]Weblinks
[Bearbeiten]
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.