Medizinische Mikrobiologie: Retroviridae
Retroviridae
[Bearbeiten]Das Retrovirus stellt eine besondere Klasse der Viren dar, welche in der Regel nur teilungsaktive, eukaryotische Zellen infizieren. Es ist ein behülltes Einzel(+)-Strang-RNA-Virus, (ss(+)RNA), dessen Erbinformation als RNA vorliegt, aber als DNA in das Genom der Wirtszelle eingebaut wird.
Taxonomie: Historisch wurden die Retroviren zunächst nach ihrem elektronenmikroskopischen Erscheinungsbild in Typ A, B, C oder D-Retroviren eingeteilt. Später folgte eine Klassifikation, die auch biochemische Eigenschaften und den Zelltropismus (d.h. den jeweils infizierten Zelltyp) berücksichtigte. Die Klassifikation unterschied Onkornaviren, Spumaviren und die Lentiviren. Die aktuellste und zur Zeit verbindliche Klassifikation durch das International Committee on Classification of Viruses unterteilt die Retroviren vor allem aufgrund ihrer genetischen Verwandtschaftsverhältnisse wie folgt:
Familie: Retroviren (Retroviridae)
- Unterfamilie: Orthoretroviren (Orthoretrovirinae)
- Gattung (Genus):
- Alpharetrovirus
- Betaretrovirus
- Gammaretrovirus
- Deltaretrovirus
- Epsilonretrovirus
- Lentivirus
- Gattung (Genus):
- Unterfamilie: Spumaretroviren (Spumavirinae)
- Gattung (Genus): Spumavirus
Beim Menschen sind bisher 4 RNA-Retroviren bekannt:
- HTLV-I (humanes T-Zell-lymphotropes Virus Typ I, ein Deltaretrovirus)
- HTLV-II (humanes T-Zell-lymphotropes Virus Typ II, ein Deltaretrovirus)
- HIV-I (humanes Immundefizienz-Virus Typ I, ein Lentivirus)
- HIV-II (humanes Immundefizienz-Virus Typ II, ein Lentivirus)
Die menschlichen Retroviren sind den Retroviren anderer Primaten so eng verwandt, daß häufig beide Gruppen unter der Bezeichnung Primaten-Retroviren zusammengefasst werden. Tatsächlich geht man auch heutzutage davon aus, daß die entsprechenden menschlichen Retroviren durch Übertragung von Affenretroviren auf den Menschen entstanden sind. Bei HTLV-I und HTLV-II hat diese Übertragung wohl schon vor Jahrtausenden stattgefunden, für HIV-I und HIV-II wahrscheinlich im 20. Jahrhundert.
Retroviren bestehen aus einer äußeren proteinbe- bzw. durchsetzten Lipid-Hüllmembran und einer inneren Proteinhülle, sowie einem "Kern" aus weiteren Proteinen und einem Ribonuklein-Komplex.
Besonderheiten: Retroviren
- sind die einzigen RNA-Viren, die diploid angelegt sind (d.h. jedes Retrovirus hat 2 Kopien seines Genoms)
- werden nur von den wirtseigenen Transkriptions-Enzymen übersetzt und neusynthetisiert
- benötigen eine spezifische zelluläre RNA (tRNA)
- sind die einzigen einsträngig-plusstrangorientierten RNA-Viren, bei denen das Genom nicht sofort als Matrize (mRNA) bei der Infektion benutzt werden kann.
Wenn das Virus diese RNA in die zu befallende Zelle eingebracht hat, muss die RNA in doppelsträngige DNA Desoxyribonukleinsäure (DNA), überführt werden. Dieser Vorgang wird reverse Transkription genannt. Dazu bringt das Virus das Enzym Reverse Transkriptase mit. Diese "schreibt" die RNA des Virus in DNA um, welche dann in das Genom der Wirtszelle integriert.
Normalerweise verläuft die Transkription an der DNA als Matrize, wobei ein komplementärer RNA-Strang synthetisiert wird; eine Ausnahme stellen die Retroviren und die Retroelemente (auch Klasse-I-Transposons genannt) dar. Das Retro bezieht sich auf die Umkehrung dieses Grundsatzes. Deshalb verursachen Retroviren oft latente Infektionen. Man nimmt an, dass das menschliche Genom im Laufe der Evolution mit unzähligen Retroviren durchsetzt wurde, die größtenteils längst nicht mehr infektiös sind. Sie erklären aber vielleicht die Existenz von "springenden Genen".
Da dieser Prozess durch die fehlende Korrekturlese-Fähigkeit der Reversen Transkriptase relativ ungenau ist, erfolgen häufige Mutationen des Virus. Diese ermöglichen eine schnelle Anpassung des Virus an antivirale Medikamente und damit eine Ausbildung von Resistenzen.
Medizinische Bedeutung: Zu den Retroviren gehören die Onkoviren, z.B. HTLV-I, -II, die Lentiviren, darunter der bekannteste Vertreter HIV, sowie die Spuma- oder Foamyviren, die in der Natur bei verschiedenen Tieren vorkommen und die keine Erkrankungen hervorrufen. Das Maedi-Visna-Virus infiziert beispielsweise Schafe.
Vermehrung: Die Vermehrung der integrierten Virus-DNA, auch Pro-Virus genannt, erfolgt entweder bei der Zellteilung mit der Verdopplung der Wirts-DNA oder intrazellulär durch die sogenannte Retrotransposition: Dabei wird der Pro-Virus aus der DNA wieder herausgeschnitten, vermehrt und an verschiedenen Stellen des Genoms wieder integriert.
Genom:
Das provirale Genom eines einfachen Retrovirus enthält in der Regel drei Gene und zwei LTRs (long terminal repeats), die sich am Anfang und am Ende befinden:
- Die LTRs enthalten Steuersequenzen zur Genexpression.
- gag codiert die Proteine der inneren Kapsel (gruppenspezifische Antigene)
- pol codiert die virale Protease, reverse Transkriptase(mit RNaseH) und Integrase
- env codiert die Proteine der Hülle
- ψ ist eine Sequenz für das Verpacken der RNA in die Virenhülle
Komplexe Retroviren, wie z.B. das HI-Virus enthalten noch weitere, regulatorische Gene. Bei HIV sind dies tat, rev, vif, nef, vpu und vpr, deren Genprodukte die Replikation kontrollieren.

Horizontaler Gentransfer:
Im Genom der Primaten befinden sich die Genome von zwei Retro-Viren (HERV-H und HERV-K, wobei "HERV" für "humanes endogenes Retrovirus" steht), die zu unterschiedlichen Zeiten integriert und vermehrt wurden. Ihre Evolution lässt sich auf Grund der Unterschiede in der Basensequenz rekonstruieren.
Erfolgt die Integration eines Retrovirus in eine Keimzelle, wird das Pro-Virus zum endogenen Retrovirus (ERV), es wird an die nächste Generation weitergegeben.
Evolutionärer Vorteil der Retroviren-Sequenzen (siehe Genom):
- Wenn die Retrovirensequenzen in vielfachen Kopien vorliegen, erleichtern sie wie andere repetitive Sequenzen den Stückaustausch zwischen den homologen Chromosomen während der Meiose (crossing over).
- Virale Sequenzen können funktionale Bestandteile von Wirtsgenen werden. So ist das Gen für das virale Hüllprotein env des HERV-W identisch mit dem Enzym Syncytin, das für den Aufbau der Plazenta benötigt wird. Möglicherweise unterdrückt das Protein die Abstoßung des Keimes durch das Immunsystem der Mutter. Ein HERV-Element, das in Nachbarschaft eines Amylase-Gens integriert wurde, steuert dessen Aktivität in den Speicheldrüsen.
- Besondere Bedeutung haben aber die LTR-Sequenzen (long terminal repeats) der HERVs. Sie befinden sich am Anfang und am Ende eines viralen Genoms und steuern seine Expression. Da die beiden LTR-Sequenzen miteinander rekombinieren können, ist im Laufe der Evolution ein Großteil der viralen Gensequenzen verloren gegangen. Übriggeblieben sind einzelne LTRs, die 8,5 % des Gesamtgenoms ausmachen. Vollständige virale Sequenzen machen nur 0,5 % aus. Mindestens 60 % dieser LTRs sind im menschlichen Genom noch aktiv und steuern Wirtsgene. Dabei lässt sich eine gewebespezifische Aktivität bestimmter HERVs feststellen: HERV-L in den Keratozyten der Haut, HERV-H in Lungen-Fibroblasten und Astrozyten.
Weblinks: VU-Wien - Retroviren
Lentivirus
[Bearbeiten]Lentiviren sind behüllte Einzel(+)-Strang-RNA-Viren, (ss(+)RNA), mit Besonderheiten und bilden eine Gattung innerhalb der Familie der Retroviren. Sie können im Gegensatz zu den anderen Retroviren auch nicht teilungsaktive, eukaryotische Zellen infizieren.
Die Bezeichnung Lentiviren leitet sich von lat.: lentus = langsam ab, da diese Viren langsam fortschreitende, chronisch degenerative Krankheiten auslösen. Die am längsten bekannte Krankheit ist die Maedi-Visna-Erkrankung bei Schafen, die in den 1930ern und 1940ern erstmals in Island beobachtet wurde. Das auslösende Virus wurde in den 1950ern als das Maedi-Visna-Virus, abgekürzt MVV, beschrieben.
Zu den Lentiviren werden gezählt:
- das Humane Immundefizienz-Virus HIV mit den beiden Arten HIV-1 und HIV-2
- das Maedi-Visna-Virus der Schafe
- das Feline Immundefizienz-Virus der Haus- und Großkatzen
- das CAE Virus der Ziegen
- das BIV (Bovines Immundefizienz-Virus) der Rinder
- das Jembrana disease virus (Rind)
- das EIA Virus der Equiden (Pferde, Esel)
EIA und Jembrana gehören zu den Lentiviren, sie können jedoch im Gegensatz zu den anderen Viren eine akute Erkrankung hervorrufen.
HIV
[Bearbeiten]| Humanes Immundefizienz-Virus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Morphologie | ||||||||||||||||||
| umhüllt, ikosaedrisch | ||||||||||||||||||
HIV (Humanes Immundefizienz-Virus, Menschliches Immunschwäche-Virus, engl.human immunodeficiency virus) ist die Bezeichnung für ein Virus, das die Krankheit Aids (Erworbenes Immundefektsyndrom, engl. acquired immunodeficiency syndrome) verursacht. Es gehört zur Klasse der Retroviren. Eine vollständige Entfernung des HI-Virus aus dem menschlichen Körper ist nicht möglich, da Retroviren in der Lage sind, ihren genetischen Code in das Erbgut des Wirts einzubauen. Eine Ansteckung führt nach einer unterschiedlich langen, meist mehrjährigen Inkubationsphase zu Aids, einer unheilbaren Immunschwächekrankheit. Bei einer Minderheit (< 5 %) – den sogenannten Long Term Non-Progressors – bricht die Krankheit erst nach Jahrzehnten oder möglicherweise nie aus.
HI-Viren werden unterteilt in den weltweit vorkommenden Stamm HIV-1 mit den Subtypen A bis I sowie O, und den Stamm HIV-2. Während HIV-1 inzwischen weltweit verbreitet ist, kommt HIV-2 hauptsächlich in Westafrika vor. Beide Typen ähneln sich hinsichtlich des klinischen Infektionsverlaufs und der krankmachenden Eigenschaften und sehen unter dem Elektronenmikroskop gleich aus. Sie unterscheiden sich jedoch im Molekulargewicht der Proteine und in der Anordnung der Gene.
In Deutschland leben rund 45.000 Menschen mit HIV, darunter etwa 34.000 Männer, rund 10.500 Frauen und zirka 400 Kinder. Jedes Jahr kommt es gegenwärtig zu durchschnittlich 2.400 Neuinfektionen. In Österreich infizierten sich im Jahr 2005 insgesamt 453 Menschen mit HIV.
Dieser Artikel beschreibt das HIV und seine Eigenschaften. Ausführliches zum Aids (Symptome, Untersuchung, Verlauf, Therapie, Vorbeugung etc.) ist im Artikel Aids zu finden.
Struktur und Aufbau des HI-Virus: Das HIV ist ein kugelförmiges Retrovirus und gehört zur Familie der Lentiviren. Infektionen mit Lentiviren verlaufen meist chronisch, mit langer klinischer Latenzzeit und unter Beteiligung des Nervensystems.
Das Viruspartikel hat einen Durchmesser von etwa 100 nm und ist von einer Lipoproteinhülle umgeben. Eingebettet in diese Hülle sind 72 etwa 10 nm große env-Glykoproteinkomplexe, die aus einem externen Anteil (gp120) und einem Transmembranprotein (gp41) bestehen. Gp120 ist für die Bindung des Virus an die CD4-Rezeptoren der Zielzellen von entscheidender Bedeutung. Da die Hülle des HI-Virus aus der Membran der Wirtszelle entsteht, befinden sich in ihr ebenfalls verschiedene Proteine der Wirtszelle, z. B. HLA Klasse I und II Moleküle sowie Adhäsionsproteine. Die HIV-RNA liegt in zwei Kopien im Viruskapsid vor. Hier befinden sich die für die Vermehrung notwendigen Enzyme reverse Transkriptase (RT), Integrase und Protease.
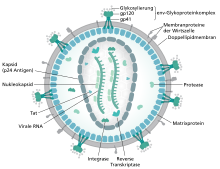

Das Genom des HI-Virus ist deutlich komplexer als das anderer Retroviren. Neben den drei üblichen retroviralen Genen (gag, pol, env) besitzt das HI-Virus sechs zusätzliche (akzessorische) Gene (vif, vpu, vpr, tat, rev, nef), die hauptsächlich regulatorische Funktionen besitzen.
Übertragung: Das HI-Virus wird mit den Körperflüssigkeiten Blut, Sperma, Vaginalsekret, Liquor und Muttermilch übertragen. Potentielle Eintrittspforten sind frische, noch blutende Wunden in Schleimhäuten (Bindehaut, Mund-, Nasen-, Vaginal- und Analschleimhaut) bzw. nicht ausreichend verhornte, leicht verletzliche Stellen der Außenhaut (Eichel, Innenseite der Vorhaut). Als häufigste Infektionswege sind zu nennen der Vaginal- oder Analverkehr ohne Verwendung von Kondomen, dann auch der Oralverkehr und die Benutzung unsteriler Spritzen beim intravenösen Drogenkonsum. Insbesondere homosexuelle Männer gelten als Risikogruppe, da häufige Partnerwechsel und Analverkehr in der Szene weit verbreitet sind. Wie hoch das Risiko beim Geschlechtsverkehr ist, hängt vor allem von der Viruslast in der Samenflüssigkeit, im Scheidensekret und im Blut ab. Diese ist unmittelbar nach der Infektion, bevor sich Antikörper gebildet haben, besonders hoch, nimmt dann aber zunächst ab und steigt in späten Stadien der Erkrankung wieder an.
Bluttransfusionen sind ebenfalls eine mögliche Infektionsquelle, die allerdings heute in Deutschland durch die 1985 eingeführten Routine-Untersuchungen der Blutspender kaum noch Bedeutung hat. Aber auch hier ist ein Risiko vorhanden, da zwischen Ansteckung des Spenders und der Nachweisbarkeit im HIV-Test bis zu drei Monate verstreichen können.
Das Risiko einer Infektion eines Kindes durch eine HIV-infizierte Mutter während der Schwangerschaft oder während der Geburt wird auf 15 bis 30 Prozent geschätzt. Bei bekannter HIV-Infektion der Mutter kann das Risiko einer Übertragung auf das Kind durch die Gabe antiretroviraler Medikamente und die Geburt durch Kaiserschnitt auf ca. 2 % vermindert werden. Eine Übertragung des Virus beim Stillen ist ebenfalls möglich.
Die sogenannte CHAT-Survey-Studie[1] des schweizerischen Bundesamtes für Gesundheitswesen (BAG) - eine Nachbefragung von Menschen, die im Verlauf eines Jahres positive HIV-Tests erhielten - ergab, dass 49% aller Neuinfizierten die Infektion von ihrem festen Sexualpartner erhielten; 38% wurden von einem zwar bekannten, aber nicht festen Gelegenheitspartner infiziert. Die große Mehrheit der neuinfizierten Leute wusste schon vorher, dass ihr Partner HIV-positiv sei. Nur 13 Prozent der Heterosexuellen steckten sich bei anonymen sexuellen Begegnungen an. Bei Homosexuellen spielen bei Infektionen die festen Partner eine kleinere Rolle; anonyme Sexualkontakte machten 26% der Infektionen aus.[2]
Das Risiko, sich durch Zungenküsse anzustecken, kann ausgeschlossen werden, sofern keine blutenden Wunden, so beispielsweise Verletzungen des Zahnfleisches, im Mund vorhanden sind. Die HIV-Konzentration in Tränen, Schweiß und Speichel reicht für eine Ansteckung nach heutigem Erkenntnisstand ebenfalls nicht aus. Außerdem lässt die Aids-Epidemiologie eine Infektion durch Insektenstiche oder durch Tröpfcheninfektion äußerst unwahrscheinlich erscheinen.
Menschen, die einer akuten Ansteckungsgefahr ausgesetzt waren, sollten möglichst bald (idealerweise innerhalb von zwei Stunden!) einen Arzt aufsuchen, um sich beraten zu lassen und gegebenenfalls eine Postexpositionelle Prophylaxe (PEP) durchzuführen. Nach Ablauf von 72 Stunden wird eine medikamentöse PEP nicht mehr als sinnvoll erachtet.
Hinsichtlich der Infektionswahrscheinlichkeiten siehe ausführlich unter AIDS
Vermehrungszyklus des HIV: Zur Vermehrung benötigt das Virus Wirtszellen, die den CD4-Rezeptor auf der Oberfläche tragen. Dies sind vor allem die CD4-tragenden T-Lymphozyten (T4-Zellen), die beim Menschen für die so genannte zelluläre Immunabwehr zuständig sind und die Antikörperbildung unterstützen. Neben T-Lymphozyten besitzen auch Monozyten, Makrophagen und dendritische Zellen CD4-Rezeptoren.
Fusion mit der Wirtszelle
Um mit der Wirtszelle verschmelzen zu können, binden die Oberflächenproteine GP120 an die CD4-Rezeptoren. Durch die Bindung kommt es zu einer Konformationsänderung im Transmembranprotein GP41, ein Mechanismus, der einer „Schnappfeder“ oder einer „Mausefalle“ ähnelt. Der neu entwickelte Wirkstoff T20 ist ein Peptid, das die Konformationsänderung blockiert und somit die Anheftung des Virus erschwert (siehe unten).
Neben den CD4-Rezeptoren sind weitere Co-Rezeptoren an der Bindung des HI-Virus an die Zelle beteiligt. Der Chemokin-Rezeptor CCR5 an monozytären Zellen und CXCR4 Rezeptoren an T-Zellen ist an der Bindung beteiligt. Die unterschiedliche Ausprägung dieser Rezeptoren beeinflusst den Verlauf der HI-Infektion und die Ansteckungswahrscheinlichkeit. Moleküle, die die CCR5 Rezeptoren blockieren sollen, werden zurzeit getestet. Da die Bedeutung dieser Rezeptoren für den Organismus jedoch noch nicht genau geklärt ist, ist es bis zur Marktreife noch ein weiter Weg. Wichtig ist zu erwähnen, dass das HI-Virus innerhalb der ersten Monate nach der Infektion in der Regel (nach einer kurzen Anfangsphase mit CXCR4-Tropismus) eine außerordentliche Bevorzugung von Zellen mit dem CCR5-Korezeptor zeigt. Dies führt zu einer überwiegenden Infektion von Zellen des monozytären/makrophagozytären Systems und weniger der sog. T-Helferzellen. Mit Hilfe der monozytären Zellen gelangt das Virus in für die antiretrovirale Therapie später schwer zugängliche Kompartimente des Körpers, wie z.B. die Hoden und das Gehirn. Bedeutsam wird das auch hinsichtlich der schweren Hirnschäden, die das Virus bei einem Teil der Infizierten schon früh verursachen kann.
PMID 8649511 PMID 8674120 PMID 8649512 PMID 8629022 PMID 9108481 PMID 8791690 PMID 9430590 PMID 9334379 PMID 9334378 PMID 9634238
Einbau des HI-Virus-Genoms in die Wirtszelle
Das HIV baut zur Vermehrung sein RNA-Genom nach der so genannten reversen Transkription in doppelsträngige DNA in das Genom der Wirtszelle ein. Die Umwandlung von viraler RNA in provirale DNA im Cytoplasma der Wirtszelle durch das Enzym Reverse Transkriptase ist ein entscheidender Schritt im Reproduktionszyklus der Retroviren. Dieser Vorgang kommt ansonsten nicht in menschlichen Zellen vor. Daher ist das Enzym Reverse Transkriptase ein wichtiges Ziel therapeutischer Intervention und Ansatzpunkt zweier pharmakologischer Wirkstoffklassen. Nach reverser Transkription schließt sich die Integration des Virus-Genoms in das menschliche Erbgut durch ein weiteres virales Enzym, die Integrase, an. In neueren Arbeiten wurde gezeigt, dass die virale DNA schon vor der Integration abgelesen wird und virale Proteine gebildet werden. Demnach liegt die HIV-DNA als integrierte und nicht-integrierte Form vor. Auch existieren zirkuläre Formen von HIV-DNA. Als erste virale Proteine wurden der virale Transaktivator Tat und das Nef-Protein nachgewiesen. Nef ist essentiell, um T-Zellen produktiv infizieren zu können, während Tat die virale Transkription reguliert. Die Synthese viraler Proteine wird durch alternatives Spleißen und die virale Kontrolle des RNA-Exports durch das Rev-Protein moduliert.
Das Virus in infizierten und ruhenden CD4-positiven T-Zellen entzieht sich dem Angriff durch antivirale Medikamente und dem Immunsystem. Zu einer Aktivierung dieser Immunzellen kommt es nach Antigenkontakt, zum Beispiel im Rahmen gewöhnlicher oder einer opportunistischen Infektion. Während die Zelle gegen einen anderen Krankheitserreger vorgehen will, beginnt sie Virusproteine zu produzieren und neue Viren freizusetzen. Diese infizieren dann wiederum andere Zellen.
Was das HI-Virus so außergewöhnlich überlebensfähig macht, ist seine Wandlungsfähigkeit oder, besser gesagt, seine schnelle Evolutionsrate. Von den Influenza-Viren (Grippe) zum Beispiel entwickeln sich in derselben Zeit auf der ganzen Welt nicht einmal halb so viele neue Unterarten wie vom HI-Virus in einem einzelnen Infizierten.
Die lange Inkubationszeit von zehn Jahren ist ein Problem, da viele Infizierte unter Umständen noch jahrelang andere Personen infizieren, bevor ihre Infektion erkannt oder von ihnen selbst bemerkt wird.

Verlauf der HIV-Infektion
Eine unbehandelte HIV-Infektion verläuft in der Regel in mehreren Stadien. 3 bis 6 Wochen nach der Ansteckung kommt es meist zu einer akuten HIV-Infektion. Diese ist durch Fieber, Abgeschlagenheit, Hautausschläge, orale Ulzerationen, oder Arthralgie gekennzeichnet. Wegen der Ähnlichkeit mit grippalen Infektionen bleibt die akute HIV-Infektion meistens unerkannt. Eine frühe Diagnose ist jedoch wichtig. Durch sie können nicht nur weitere Infektionen von Sexualpartnern verhindert werden. Erste Studien an Patienten, die während der akuten HIV-Infektion antiviral behandelt wurden und nach einiger Zeit die Therapie absetzten, zeigten, dass die HIV-spezifische Immunantwort der Patienten gestärkt werden konnte. Die akute Infektion dauert selten mehr als 4 Wochen an.[3] PMID 11029005 PMID 11148221
In der folgenden, meist mehrjährigen Latenzphase treten keine körperlichen Symptome auf. Danach kommt es vielfach zu ersten Erkrankungen, die auf ein mittelschwer geschwächtes Immunsystem zurückzuführen sind, jedoch noch nicht als Aids-definierend gelten (CDC Klassifikation B, siehe Aids). Im Median nach 8 bis 10 Jahren nach der Erstinfektion kommt es zu einem schweren Immundefekt (< 200 CD4-Zellen/Mikroliter). Dieser führt in der Regel zu Aids-definierenden Erkrankungen (CDC Klassifikation C, siehe Aids). Zu diesen zählen opportunistische Infektionen, die durch Viren, Bakterien, Pilze oder Parasiten bedingt sind, sowie andere Erkrankungen, wie Kaposi-Sarkom, malignes Lymphom, HIV-Enzephalopathie und das Wasting-Syndrom. Nach individuell unterschiedlicher Zeit führen diese unbehandelt meist zum Tod. Ein schwerer Immundefekt bedeutet jedoch nicht, dass sofort Aids auftritt. Je länger ein schwerer Immundefekt vorliegt, desto größer ist die Wahrscheinlichkeit, Aids zu bekommen.



HIV-Enzephalopathie: Unter HIV-Enzephalopathie (kurz HIVE) versteht man eine durch das HIV hervorgerufene Gehirnschädigung. Sie tritt nur bei einem Teil der Aids-Kranken auf. Das HIV befällt dabei die im Gehirn befindlichen Fresszellen. Obwohl die Nervenzellen nicht direkt vom HIV befallen sind, kommt es trotzdem zu Nervenzellschäden. Man erklärt sich diese indirekte Schädigung durch den Einfluss der infizierten Fresszellen der Umgebung. Das Auftreten der HIVE bei Aids-Kranken ist seit Einführung der HAART (siehe Therapie) deutlich rückläufig.
Symptome der HIVE:
- Denkstörungen (Gedächtnis-, Konzentrations-, Sprachstörungen)
- Störungen der Bewegungskontrolle (Verlangsamung, Koordinationsstörungen, Gangunsicherheit)
- Verhaltensänderung (Apathie, Libidoverlust, sozialer Rückzug)
Bei schweren Verläufen kann sich eine Demenz entwickeln.
Von der HIVE abzugrenzen sind Gehirnschäden, die als Folge von Medikamentennebenwirkungen, Infektionen oder Lymphomen auftreten.
Genetische Faktoren: Die Tatsache, dass Individuen trotz gleicher Infektionsquelle oft sehr unterschiedliche Krankheitsverläufe haben, deutet auf einen starken Einfluss von Wirtsfaktoren auf den Verlauf der Infektion hin. Neben der Ausbildung des Immunsystems scheinen auch einige genetische Faktoren eine Rolle zu spielen. So sind homozygote Individuen mit einem genetischen Defekt am CCR5-Rezeptor (CCR5delta32) weitgehend resistent gegen HIV-Infektionen. Dieser Rezeptor dient als Co-Rezeptor bei der Fusion des Virus mit der Wirtszelle. Es wurden nur wenige Individuen gefunden, die eine Infektion trotz Rezeptordefektes haben. Sie infizierten sich mit HI-Viren, die andere Co-Rezeptoren benutzen, wie den CXCR4 Rezeptoren an T-Zellen. Homozygote Genträger dieser Deletion machen ca. 1 % der Bevölkerung aus, heterozygote Genträger etwa 20 %. Heterozygote haben deutlich weniger CCR5 Rezeptoren und scheinen nach Infektion kaum eine längere mittlere Überlebenszeit zu haben.
Der Aids-Forscher J.J. Bouyao hat in Nairobi (Kenia) 600 Prostituierte untersucht und dabei festgestellt, dass 24 von ihnen offenbar gegen das HI-Virus immun sind. Der Grund dafür scheint nach Ansicht von Forschern genetisch bedingt zu sein. Offenbar ist eine Gen-Anomalie dafür verantwortlich, der das Virus daran hindert, in die Zellen einzudringen und sich zu verbreiten.
Geschichte: HIV ist die vom International Committee on Taxonomy of Viruses 1986 empfohlene Bezeichnung, die frühere Benennungen wie Lymphadenopathie-assoziiertes Virus (LAV), humanes T-Zell-Leukämie-Virus III (HTLV III) oder Aids-assoziiertes Retrovirus (ARV) ersetzt. HIV Typ 1 wurde 1983 zum ersten Mal von Robert Gallo, dem Leiter des Tumorvirus-Labors am NIH und Luc Montagnier, dem Direktor des Institut Pasteur in Paris beschrieben. Da beide die Erstentdeckung für sich beanspruchen, folgte ein jahrelanger Rechtsstreit, bei dem es auch um das Patent für den neu entwickelten HIV-Test ging. HIV-2 wurde 1986 entdeckt. Die älteste gesicherte HIV-Infektion stammt aus Zaire 1959.
Im Mai 2005 gelang der Nachweis, dass der Aidserreger HIV von wilden Schimpansen im frühen 20. Jahrhundert in Kamerun (Afrika), auf den Menschen übertragen wurde. Das internationale Forscherteam hatte dazu in der Wildnis Kameruns 446 Kotproben freilebender Schimpansen gesammelt. Etliche enthielten SIV-Antikörper, die Schimpansenversion des HI-Virus, wie sie im US-Fachjournal "Science" veröffentlichten. Ursprüngliche Quelle des HI-Virus sind die Schimpansen jedoch nicht. Sie sollen sich im westlichen Zentralafrika mit SIV oder einem Vorläufer dieses Virus infiziert haben. Damit hat der Aidserreger bereits mindestens zweimal die Artengrenze übersprungen, nämlich vom Affen zum Menschenaffen und anschließend zum Menschen.
HIV-Infektion und AIDS
Die Abkürzung Aids (auch AIDS) steht für Acquired Immune Deficiency Syndrome (englisch für erworbenes Immundefektsyndrom). Aids ist eine Immunschwächekrankheit und die Folge einer Infektion mit dem HI-Virus(HIV), das eine allmähliche Zerstörung des Immunsystems bewirkt. Die Folge sind Sekundärinfektionen (auch opportunistische Infektionen genannt) und Tumore, die in bestimmter Kombination das Syndrom Aids definieren. Trotz Behandlung führen diese Folgeerkrankungen früher oder später zum Tod. Zur Diagnose werden Antikörper oder Virusbestandteile im Blut gesucht. Bereits vor dem Eintreten von Symptomen kommen virenhemmende Medikamente zum Einsatz, die zusammen mit der Behandlung der Sekundärinfektionen die Lebenserwartung verlängern und die Lebensqualität steigern.
Ansteckung: Das HI-Virus wird mit den Körperflüssigkeiten Blut, Sperma, Vaginalsekret, Liquor und Muttermilch übertragen. Potentielle Eintrittspforten sind frische, noch blutende Wunden in Schleimhäuten (Bindehaut, Mund-, Nasen-, Vaginal- und Analschleimhaut) bzw. nicht ausreichend verhornte, leicht verletzliche Stellen der Außenhaut (Eichel, Innenseite der Vorhaut). Als häufigste Infektionswege sind zu nennen der Vaginal- oder Analverkehr ohne Verwendung von Kondomen, dann auch der aufnehmende Oralverkehr (Schleimhautkontakt mit Sperma bzw. Menstruationsblut; bei unverletzter Mundschleimhaut stellt der Kontakt mit Präejakulat oder Vaginalsekret ein vernachlässigbares Infektionsrisiko dar, ebenso der passive Oralverkehr) und die Benutzung (ausgeliehener) kontaminierter Spritzen beim intravenösen Drogenkonsum. Homosexuelle Männer gelten als Risikogruppe, da häufige Partnerwechsel und Analverkehr in der Szene weit verbreitet sind. Wie hoch das Risiko beim Geschlechtsverkehr ist, hängt vor allem von der Viruslast in der Samenflüssigkeit, im Scheidensekret und im Blut ab. Diese ist unmittelbar nach der Infektion, bevor sich Antikörper gebildet haben, besonders hoch, nimmt dann aber zunächst ab und steigt in späten Stadien der Erkrankung wieder an.
Bluttransfusionen sind ebenfalls eine mögliche Infektionsquelle, die allerdings heute in Deutschland durch die 1985 eingeführten Routine-Untersuchungen der Blutspender kaum noch Bedeutung hat. Aber auch hier ist ein Restrisiko vorhanden, da zwischen Ansteckung des Spenders und der Nachweisbarkeit im HIV-Test bis zu drei Monate verstreichen können.
Das Risiko einer Infektion eines Kindes durch eine HIV-infizierte Mutter während der Schwangerschaft oder während der Geburt wird auf 15% bis 30% geschätzt. Bei bekannter HIV-Infektion der Mutter kann das Risiko einer Übertragung auf das Kind durch die Gabe antiretroviraler Medikamente und die Geburt durch Kaiserschnitt auf ca. 2% vermindert werden. Eine Übertragung des Virus beim Stillen ist ebenfalls möglich.
Das Risiko, sich durch Zungenküsse anzustecken, kann ausgeschlossen werden, sofern keine blutenden Wunden, so beispielsweise Verletzungen des Zahnfleisches, im Mund vorhanden sind. Die HIV-Konzentration in Tränen, Schweiß und Speichel reicht für eine Ansteckung nach heutigem Erkenntnisstand ebenfalls nicht aus. Außerdem lässt die Aids-Epidemiologie eine Infektion durch Insektenstiche oder durch Tröpfcheninfektion äußerst unwahrscheinlich erscheinen. Menschen, die einer akuten Ansteckungsgefahr ausgesetzt waren, sollten möglichst bald (idealerweise innerhalb von zwei Stunden) einen Arzt aufsuchen, um sich beraten zu lassen und gegebenenfalls eine Postexpositionelle Prophylaxe (PEP) durchzuführen. Nach Ablauf von 48 Stunden wird eine medikamentöse PEP nicht mehr als sinnvoll erachtet.
PMID 6132270 PMID 6133990 PMID 7491134
Ansteckungswahrscheinlichkeit: Die Infektionswahrscheinlichkeit liegt bei den meisten Übertragungswegen zwischen 1:100 und 1:1000. Wichtigste Ausnahme ist die Übertragung von der Mutter auf das Kind während der Geburt mit einer Infektionswahrscheinlichkeit von ca. 15 % und durch eine verseuchte Bluttransfusion, wo das Infektionsrisiko 95 % beträgt.
Die folgenden Häufigkeiten sind Durchschnittswerte, die durch Partnerstudien und epidemiologische Studien ermittelt wurden. Das individuelle Risiko kann sehr viel höher sein. So erhöht eine gleichzeitig vorliegende andere Geschlechtserkrankung das Infektionsrisiko um das 5- bis 10-fache, eine hohe Viruslast des Überträgers sogar um das 10- bis 30-fache. Geschlechtsverkehr während der Regelblutung der Frau ist mit einem erhöhten Infektionsrisiko für beide Partner verbunden, beschnittene Männer haben ein geringeres Infektionsrisiko. Insgesamt scheint das Infektionsrisiko nicht konstant über die Anzahl der Kontakte zu sein, so dass das Risiko einzelner Kontakte womöglich erheblich zu niedrig angegeben ist. Mit besseren Medikamenten sinkt möglicherweise das Übertragungsrisiko.
- Ungeschützter vaginaler Geschlechtsverkehr mit einem HIV-positiven Partner ist mit einem Risiko einer HIV-Infektion von ca. 0,05 - 0,15 % für die Frau, und zwischen 0,03 - 5,6 % für Männer verbunden, tendenziell jedoch für Männer etwas geringer als für Frauen.
- Das Infektionsrisiko für Oralverkehr beim Mann (Fellatio), bei dem Sperma in den Mund aufgenommen wird, ist geringer, eine Infektion ist jedoch nicht ausgeschlossen. Eine Infektion durch Vorflüssigkeit ("Lusttropfen") ist sehr unwahrscheinlich. Bei Oralverkehr bei der Frau (Cunnilingus) wird das Risiko ebenfalls als geringer als beim vaginalen Geschlechtsverkehr angesehen. Auch das Risiko beim sogenannten Rimming wird als äußerst gering eingeschätzt.
- Bei Analverkehr treten häufig kleine Risse an der Schleimhaut auf. Dementsprechend liegt das Risiko für den passiven Teilnehmer beim Analverkehr um 0,8 % und um 0,3 % für den aktiven Teilnehmer.
- Andere Sexualpraktiken, bei denen kein Kontakt zu Schleimhäuten, Blut, Sperma oder Vaginalsekret besteht, haben ein extrem geringes Infektionsrisiko.
- Das Infektionsrisiko durch Nadelstiche hängt sehr von der Situation ab. Das Infektionsrisiko wird durchschnittlich mit 0,3 % angegeben und steigt mit folgenden Faktoren: sehr tiefe Verletzungen (16-fach erhöht), sichtbare Blutspuren auf der Nadel oder Nadel war vorher in einer Vene oder Arterie des Überträgers (jeweils 5-fach erhöht), bei hoher Viruslast des Überträgers (6-fach erhöht). Das Risiko bei Hohlnadeln ist höher als bei geschlossenen Nadeln.
- Das Risiko, sich bei gemeinsamer Benutzung einer Kanüle, meist beim Spritzen von Heroin, zu infizieren, liegt um 0,7 % und sinkt mit dem zeitlichen Abstand zwischen den Injektionen, allerdings nur langsam, da in der Kanüle eingeschlossene Viren lange infektiös bleiben können, teilweise auch noch nach Tagen. Ein Auskochen der Nadeln ist zwar generell möglich, wenn es lange genug durchgeführt wird, allerdings sind handelsübliche Nadeln nicht dafür geeignet, weil die verwendeten Kunststoffe nicht entsprechend hitzefest sind. Eine chemische Desinfektion (Alkohol oder andere Desinfektionsmittel) ist nicht ausreichend, weil nicht gewährleistet ist, dass die Substanzen ganz in die Kanüle eindringen.
Teilweise besteht die Möglichkeit einer Postexpositionsprophylaxe. Diese besteht aus allgemeinen Maßnahmen (Waschen des Penis nach dem Verkehr, Ausdrücken der Stichwunden und Behandlung mit Desinfektionsmittel) und spezifischen Maßnahmen wie der Gabe von antiretroviralen Medikamenten. Nach einem Ansteckungsverdacht sollte immer sofort ein Arzt aufgesucht werden, der über mögliche Maßnahmen informiert und sie auch einleiten kann.
PMID 1403641, PMID 10430236, PMID 8601226, PMID 15090833, PMID 9091805
HIV-Test: Der Begriff HIV-Test steht für den HIV-Antikörper-Test, der die An- oder Abwesenheit von Antikörpern gegen HIV-Proteine, nicht jedoch das HI-Virus selbst nachweist. Wie gegen andere als "körperfremd" erkannte Eiweißmoleküle bildet das Immunsystem Antikörper, um sich vor eingedrungenen HI-Viren zu schützen. Sind Antikörper vorhanden, ist der Test "HIV-positiv", d. h. es hat ein Kontakt mit dem HI-Virus stattgefunden. Werden keine Antikörper nachgewiesen, lautet das Resultat des Testes "HIV-negativ". Ein Problem beim HIV-Antikörper-Test ist die diagnostische Lücke: In der Zeit, die der Körper braucht, um die ersten Antikörper zu bilden, können solche auch nicht nachgewiesen werden und führen somit zu einem "falsch-negativen" Ergebnis.
Die heute üblichen Tests können in der Regel zwölf Wochen nach der Ansteckung zuverlässig Antikörper nachweisen; 99 % der Infizierten weisen dann bereits Antikörper auf. In den meisten Fällen ist ein Kontakt mit HI-Viren bereits nach drei bis sechs Wochen feststellbar. In seltenen Fällen können aber noch Monate später falsche, auch negative Ergebnisse entstehen. Grundsätzlich gilt: Je länger der Zeitraum zwischen möglicher Ansteckung und Test, um so größer ist seine Aussagekraft.
In Deutschland wird die Diagnose "HIV-positiv" durch zwei Tests gestellt: einen Suchtest und einen Bestätigungstest.
Als Suchtest wird meist ein kostengünstiger HIV-Elisa-Test durchgeführt. Dieser weist Antikörper gegen HIV-1, HIV-2 und HIV-1 Subtyp 0 im Blut nach. Für diesen Test werden von kommerziellen Herstellern Virusproteine in so genannten Elisa-Testplatten vertrieben. Eine Testplatte besteht aus bis zu 96 kleinen Näpfen, in denen die HIV-Proteine auf dem Trägermaterial fixiert wurden.
Von der zu testenden Blutprobe werden die Blutzellen abgetrennt und die verbleibende gelblich-klare Flüssigkeit, das so genannte Serum, in eines der Näpfchen der Testplatte gegeben. Wenn Antikörper im Serum vorliegen, die vom Immunsystem eines HIV-Infizierten gebildet wurden, heften diese sich an die HIV-Proteine. Nach weiteren Arbeitsschritten verbleibt in den Näpfen von HIV-negativen Personen eine glasklare Flüssigkeit und bei HIV-infizierten Menschen eine gefärbte Flüssigkeit. Der Test wird maschinell und immer im Vergleich zu HIV-positiven und HIV-negativen standardisierten Seren abgelesen.
Der HIV-Suchtest ist auch in großen klinisch-chemischen Laborautomaten durchführbar. Es wird dann ein etwas abweichendes Verfahren eingesetzt, der Elektrochemilumineszenz-Immunoassay (ECLIA). Aussagekraft und Beschränkungen sind aber dem ELISA vergleichbar.
Die Empfindlichkeit des Suchtests ist sehr hoch eingestellt, damit auch 'grenzwertig-positive' Seren entdeckt werden. Jedes im Suchtest als positiv oder grenzwertig aufgefallene Serum muss in einem Bestätigungstest überprüft werden.
Als routinemäßiger Bestätigungstest dient die aufwändigere Western-Blot-Methode (syn: Immunoblot), ebenfalls ein Antikörpertest. Hierzu wird eine Reihe unterschiedlicher HIV-Proteine auf einen Teststreifen als Trägermaterial nebeneinander aufgebracht. Der Streifen wird in eine weitere Serumprobe eingelegt. Wenn Antikörper gegen HIV vorhanden sind, heften sich diese an die Virusproteine. Nach weiteren Arbeitsschritten werden dunkle Striche auf dem Teststreifen sichtbar. Sie zeigen an, gegen welche Virusproteine der Mensch Antikörper gebildet hat. Nach WHO-Empfehlung wird die Diagnose 'HIV-positiv' auf Grund von Antikörpern gegen zwei verschiedene Virusproteine gestellt. Auf diese Weise wird der zuvor positive oder grenzwertige Suchtest widerlegt oder bestätigt.
Die Sensitivität des HIV-Test wird mit 99,9 % angegeben. Dies bedeutet, dass von 1000 HIV-positiven Patienten 999 als solche erkannt werden und einer ein falsch-negatives Ergebnis erhält. Die Spezifität beträgt 99,8 %. Dies bedeutet, dass von 1000 nicht HIV-Positiven 998 ein negatives Ergebnis erhalten und 2 ein falsch-positives Ergebnis . Der positive prädiktive Wert, also die Wahrscheinlichkeit, dass eine Person mit positivem Test wirklich infiiziert ist, hängt von der Prävalenz in der getesteten Gruppe ab und kann somit nicht allgemein angegeben werden. Bei niedriger Prävalenz, wie z. B. bei Personen ohne Risikofaktoren liegt er deutlich unter der Spezifität, bei unter 50%. Liegen hingegen Risikofaktoren vor, steigt der Wert schnell an und erreicht Werte nahe der Spezifität. (zur Bewertung eines Testergebnisses siehe auch: Beurteilung eines Klassifikators).
Direkt nachgewiesen werden HI-Viren bzw. die Virus-RNA durch das vergleichsweise kostenintensive RT-PCR-Verfahren. Diese Methode wird meist nach gestellter Diagnose zur Bestimmung der Viruslast angewandt.
Bei Neugeborenen hat ein Antikörper-Test keine Aussagekraft, da die Antikörper der Mutter durch die Plazenta in das Blut des Kindes gehen, und daher ein falsch positives Testergebnis entsteht. Daher ist die gängige Untersuchungsmethode bei Neugeborenen und Säuglingen die RT-PCR.
Zur Diagnostik einer akuten HIV Infektion dient ein positiver HIV-RNA Test durch eine RT-PCR und ein negativer oder "grenzwertiger" Bestätigungstest.
Der umgangssprachlich sogenannte "Aidstest" meint den HIV-Antikörper-Test. Dies ist ein kostengünstiger Suchtest, basierend auf einem Enzyme-linked Immunosorbent Assay (ELISA) oder Elektrochemiluminiszenz-Immunoassay (ECLIA), und eignet sich daher für regelmäßige Untersuchung gefährdeter Personen. Dieser Test weist nicht das Virus selbst, sondern nur die Antikörper im Blut nach und ist frühestens zwölf Wochen nach einem eventuellen Risikoereignis sinnvoll, weil der Organismus bis zu zwölf Wochen braucht um Antikörper in einer Menge zu bilden, die einen sicheren Nachweis erlaubt; 0,01 % der Menschen, die den HI-Virus tragen, benötigen bis zu 6 Monate zur Bildung der ausreichenden Menge Antikörper. Der Test hat eine hohe Sensitivität, d. h. sollten Antikörper vorhanden sein, werden diese auch erkannt. Allerdings sind mit keinem dieser Tests die erkannten Antikörper eindeutig einer HIV-Infektion zuzuweisen. Nach einem "reaktiven" Testergebnis ist grundsätzlich ein so genannter Bestätigungstest durchzuführen.
Zur Sicherung der Diagnose und genaueren Untersuchung der vorhandenen Virusstämme dienen umfassende weiterführende Tests, die nicht nur HIV-Antikörper, sondern das HI Virus selbst nachweisen können. So dient ein Nachweis proviraler HIV-DNA der Sicherung der Diagnose, während sich anhand der HIV-RNA die Virus-"Menge" messen lässt. Mittlerweile werden zunehmend auch solche Nachweismethoden zum diagnostischen Standard, welche Resistenzen in den Virusstämmen gegen antiretrovirale Therapien anzeigen.
Schwierigkeiten bereitet die Diagnose bei Neugeborenen, da die nachgewiesenen Anti-HIV-Antikörper der Klasse IgG üblicherweise von der infizierten Mutter stammen. Kommerziell erhältliche Tests zum Nachweis von IgM- oder IgA-Antikörpern, welche vom Kind gebildet werden, sind noch nicht vorhanden. Somit lässt sich bei positiver Antikörper-Suchreaktion aber negativem Test auf HIV-DNA oder -RNA kein klarer Status erschließen.
Meldepflicht: In Deutschland wird dem feststellenden Arzt im Rahmen der Laborberichtspflicht empfohlen, eine HIV-Infektion anonymisiert dem Robert-Koch-Institut in Berlin zu melden. Eine HIV-Infektion ist in Österreich, im Gegensatz zur Aidserkrankung, nicht meldepflichtig. Diese erfolgt an das Ministerium in anonymisierter Form.
Definition und Klassifikation des AIDS: HIV-Erkrankungen werden in der Regel nach der CDC-Klassifikation eingeteilt, die von den US-amerikanischen Centers for Disease Control and Prevention erstellt und zuletzt 1993 überarbeitet wurde. Die Einteilung basiert auf drei verschiedenen Kategorien, die sich aus dem klinischen Bild ergeben (A-C) und der Einteilung des CD4-T-Helferzellstatus (1-3).
Kategorie A bezeichnet eine asymptomatische HIV-Infektion.
Unter Kategorie B werden Krankheiten zusammengefasst, die nicht als Aids definierend gelten, aber im Zusammenhang mit einem Immundefizit zu stehen scheinen. Zu diesen gehören:
- bazilläre Angiomatosen,
- Entzündungen des kleinen Beckens, besonders bei Komplikationen eines Tuben- oder Ovarialabszesses,
- ausgedehnter oder rezidivierender Herpes zoster,
- thrombozytopene Purpura,
- lang anhaltendes Fieber oder Diarrhoen, die länger als einen Monat anhalten,
- Listeriose,
- orale Haarleukoplakie,
- oropharyngeale Candidosen,
- chronische oder schwer zu therapierende vaginale Candidosen,
- zervikale Dysplasien,
- Carcinoma in situ und
- periphere Neuropathie.
Kategorie C umfasst die Aids definierenden Erkrankungen. Es handelt sich um meist opportunistische oder maligne Erkrankungen, die bei einem gesunden Immunsystem nicht oder nicht in der beschriebenen Weise auftreten. Zu ihnen gehören:
- Candidosen der Atemwege oder der Speiseröhre,
- Cytomegalievirus-Infektionen (außer Leber, Milz und Lymphknoten),
- CMV-Retinitis (mit Einschränkung der Sehschärfe),
- HIV-bedingte Enzephalopathie,
- Herpes simplex mit chronischen Ulzera (>1 Monat) oder durch Herpes simplex bedingte Bronchitis,
- Pneumonie oder Ösophagitis,
- Histoplasmose, chronisch,
- intestinale Isosporiasis,
- Kaposi-Sarkom,
- disseminierte oder extrapulmonale Kokzidiomykose,
- extrapulmonale Kryptokokkose,
- chronisch intestinale Kryptosporidiose,
- immunoblastisches, primär zerebrales oder Burkitt Lymphom,
- extrapulmonale Mykobakterien,
- Pneumocystis-Pneumonie,
- rezidivierende bakterielle Pneumonien (länger als 1/Jahr),
- progressive multifokale Leukenzephalopathie,
- rezidivierende Salmonellen-Septikämie,
- Tuberkulose,
- zerebrale Toxoplasmose,
- Wasting-Syndrom,
- invasives Zervixkarzinom
Die CDC-Klassifikation der Laborkategorien beschreibt die noch vorhandene Anzahl von CD4-Zellen. Kategorie 1 entspricht mehr als 500 CD4-Zellen/pl, Kategorie 2 200 bis 400 und Kategorie 3 unter 200 CD4 Zellen/pl.
Zur Einstufung werden beide Werte herangezogen. Die Erkrankung eines Patienten mit einer oropharyngealen Candidose und mit einem CD4 Zellwert von 300 wird also mit B2 beschrieben. Eine Rückstufung bei Besserung des klinischen Bildes oder des CD4 Zellwertes wird nicht vorgenommen.
In Deutschland wird die Diagnose Aids anhand des klinischen Bildes getroffen, wohingegen in den USA bei einem CD4-Zellwert von unter 200 ebenfalls von Aids gesprochen wird, auch ohne klinische Symptomatik.
Die CDC Klassifikation ist die derzeit gebräuchlichste und wahrscheinlich beste Einteilung der HIV-Erkrankung. Trotzdem weist sie einige Schwächen auf. Zum einen ist sie zuletzt 1993 neu bearbeitet worden, was eine ganze Epoche an neueren HIV-Therapiemöglichkeiten und den damit verbundenen Änderungen des klinischen Bildes nicht mit berücksichtigt. Zum anderen ist sie geprägt durch ihren Entstehungsort (USA). Einige opportunistische Erreger, die in anderen Teilen der Welt eine große Rolle spielen, wie Penicillosen in Asien, tauchen in der Klassifikation nicht auf.
Krankheitsverlauf: Eine HIV-Infektion verläuft in vier Phasen:
1. Akute Phase (4-6 Wochen): 2-6 Wochen nach einer Infektion können grippeähnliche Symptome wie Fieber, Nachtschweiß, geschwollene Lymphknoten, Übelkeit usw. auftreten. Manche Patienten bemerken diese Symptome jedoch nicht oder sie haben keine.
2. Latenzphase (meist mehrjährig): In dieser Zeit vermehrt sich das Virus im Körper. Betroffene, sofern sie von ihrer Infektion wissen, leiden allenfalls psychisch darunter, körperliche Symptome treten hingegen keine auf.
3. (A)ids (R)elated (C)omplex: Es treten die gleichen Beschwerden wie in der Akuten Phase auf. Sie gehen jedoch nicht mehr zurück.
4. Krankheitsphase: Die Diagnose "Aids" wird gestellt, wenn bei einem HIV-Positiven bestimmte Infektionen, die sogenannten Aids definierenden Erkrankungen, festgestellt werden. Diese Infektionen nennt man opportunistische Infektionen. Oft sind die Erreger solcher Infektionen für den gesunden Menschen bzw. ein gesundes Immunsystem harmlos. Durch das geschwächte bzw. vernichtete Immunsystem eines HIV-Positiven kann sich der Organismus jedoch nicht mehr gegen selbst harmlose Erreger wehren und es treten die o. g. Infektionen auf. Als Maß für die Zerstörung des Immunsystems dient die T-Helfer-Zellen-Zahl im Blut eines HIV-Infizierten. Der Standard-Grenzwert ist erreicht, wenn das T-Zell-Niveau eines Patienten unter 200–400 / µl Blut fällt. Die Unterschreitung dieser Grenze stellt eine Behandlungsindikation dar. Es existiert die Theorie, dass nicht jeder, der mit dem HI-Virus infiziert wurde, zwangsläufig Aids entwickelt. Hierzu gibt es jedoch keine gesicherten Erkenntnisse.
Therapie: Durch die Einnahme von HIV-unterdrückenden Medikamenten (sog. antiretrovirale Therapie) und die Behandlung der Sekundärinfektionen kann der Krankheitsverlauf verlangsamt werden. Eine Heilung ist jedoch derzeit nicht möglich.
Die Behandlung einer HIV-Infektion wird unter dem Begriff Antiretrovirale Therapie (ART) zusammengefasst. Da das Virus schnell gegen einzelne Medikamente Resistenzen entwickelt, hat sich die Therapie mit mehreren Medikamenten gleichzeitig durchgesetzt. Hierfür wurde der wenig medizinische Begriff der Highly Active Antiretroviral Treatment (HAART) gewählt. HAART kann das Leben HI-Infizierter deutlich verlängern. Doch es bewirkt keine Wunder: Eine vollständige Elimination (Eradikation) aller Viren und damit eine Heilung ist bisher nicht möglich. Zudem können schwerwiegende Nebenwirkungen auftreten. Wenn einmal eine HAART begonnen wurde, so sollte sie nicht mehr abgesetzt werden, da dies zur Resistenzbildung führen kann. Aus dem selben Grund ist eine regelmäßige Tabletteneinnahme unumgänglich (siehe Adherence). Daraus ergibt sich eine hohe Belastung für den Patienten.
Zur Zeit werden drei Wirkstoffklassen angewendet: Nukleosid- und Nukleotidanaloga (NRTI), Nichtnukleosidische Reverse Transkriptase Inhibitoren (NNRTI) und Protease-Inhibitoren (PI). Zudem gibt es mit der Substanz T-20 eine neue Wirkstoffklasse der Fusionsinhibitoren.
Nukleosidanaloga
Nukleosidanaloga, auch Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI, umgangssprachlich "Nukes") genannt, haben ihren Ansatzpunkt am HIV-Enzym Reverse Transkriptase. Das Enzym "übersetzt" das virale RNA-Genom in doppelsträngige DNA, bevor diese von einem weiteren viralen Enzym, der Integrase, in die DNA der Wirtzelle eingebaut wird. Als alternatives Substrat konkurriert die NRTI mit den physiologischen Nukleosiden, von denen sie sich durch Modifikationen am Zuckermolekül unterscheiden. Durch ihren Einbau kommt es zum Kettenabbruch der DNA, da die NRTI die Struktur der Doppelstrangbindung behindert. Die Wirkstoffe Zidovudin (Azidothymidin, AZT) und Lamivudin (d4T) sind Thymidin-Analoga, Zalcitabin (DDC) und Lamivudin (3TC) sind Cytidin-Analoga, während Didanosin (DDI) ein Inosin und Abacavir ein Guanosin-Analogon ist. Eine Kombination von AZT und d4T bzw. DDC und 3TC ergibt wenig Sinn, da sie den selben Ansatzpunkt haben.
Zahlreiche Nebenwirkungen können bei der Therapie mit NRTI auftreten. Häufig sind Kopfschmerzen, gastrointestinale Beschwerden, Völlegefühl oder Übelkeit, Erbrechen und Diarrhoeen, sowie allgemeine Müdigkeit. Als Folge längerer Anwendung kann es zur Laktatazidose, Myelotoxizität, Polyneuropathie und Pankreatiden kommen. Auch die bei der Therapie mit Protease-Inhibitoren berüchtigte Lipodystrophie kann bei längerer Einnahme von NRTI auftreten.
Viele dieser Nebenwirkungen werden durch die "mitochondrale Toxizität" erklärt: Mitochondrien, die lebenswichtigen Kraftwerke der Zellen, benötigen ebenfalls Nukleoside. Durch den Einbau von NRTI statt Nukleosiden kommt es zu Stoffwechselstörungen und zur Degeneration der Mitochondrien. Bei der Toxizität der einzelnen Substraten gibt es erhebliche Unterschiede.
NRTI werden unverändert in die Zelle aufgenommen und dort durch Phosphorylierung aktiviert. Sie werden überwiegend renal eliminiert und haben daher wenig Wechselwirkung mit Medikamenten, die in der Leber verstoffwechselt werden.
Nicht-Nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTIs)
Während NRTIs als "falsche" Bausteine das Enzym Reverse Transkriptase hemmen, binden NNRTIs direkt an das Enzym, nahe der Substratbindungsstelle für Nukleoside. Zurzeit gibt es drei NNRTis auf dem Markt: Neverapin, Delavirdin und Efavirenz. Während Nevirapin und Efavirenz etwa gleich effektiv sind, spielt Delaviridin in der Therapie kaum eine Rolle und ist in Deutschland (noch) nicht zugelassen.
Als Einzelsubstanz zeigen NNRTIs nur eine begrenzte Wirkung, in Kombinationstherapie mit 2 NRTIs sind sie aus immunologisch-virologischer Sicht mit Proteaseinhibitoren gleichwertig. Jedoch gibt es bisher keine Studie, die den klinischen Effekt der NNRTIs - längeres und gesünderes Leben bei höherer Lebensqualität - nachweist. Zur Zulassung wurden ausschließlich Studien zu verbesserten CD4+ Zellzahlen und zur niedrigeren Viruslast benutzt (Surrogatmarker-Studien). Durch ihre gute Verträglichkeit und die geringere Pillenzahl werden sie häufig den Proteaseinhibitoren vorgezogen. NNRTIs sind recht empfindlich: Schon eine Punktmutation genügt, um eine Resistenz des Virus gegen den Wirkstoff zu bekommen. Zudem bestehen Kreuzresistenzen: Zeigt ein Virus Resistenzen gegen einen NNRTI, so sind meist alle NNRTIs wirkungslos. NNRTIs werden in der Leber verstoffwechselt (Cytochrom P450-System).
Die Nebenwirkungsprofile der einzelnen Wirkstoffe unterscheiden sich erheblich. Bei der Therapie mit Nevirapin stehen vor allem allergische Reaktionen und Lebertoxizität im Vordergrund. Ein Exanthem tritt bei bis zu 20% der Patienten auf und führt bei 7 % zum Abbruch der Nevirapineinnahme. Um die Gefahr von Allergien zu mindern, sollte Nevirapin eingeschlichen werden (mit niedriger Dosierung beginnen). Lebertoxizität ist eine seltene, aber unter Umständen lebensbedrohliche Nebenwirkung von Nevirapin. Daher sollten zur Beginn der Therapie die Leberwerte (vor allem Transaminase) engmaschig kontrolliert werden.
Efavirenz hat vor allem Nebenwirkungen, die das zentrale Nervensystem betreffen. Diese treten meist zur Beginn der Therapie auf und nehmen danach ab. In der ersten vier Wochen traten in einer Studie bei 2/3 der Patienten über Schwindel, nahezu die Hälfte über Albträume und etwa 1/3 über Benommenheit und Schlafstörungen. Diese nahmen aber meist nach einiger Zeit ab. Während Nevirapin zur Vorbeugung einer Mutter-zu-Kind-Übertragung (PMTCT = Prevention of Mother to Child Transmission) eingesetzt wird, ist Efivarenz in der Schwangerschaft kontraindiziert. Auch ist angesichts der ZNS-Nebenwirkung die Verkehrstauglichkeit fraglich. Ein Vorteil von Efavirenz gegenüber Nevirapin ist die geringere Lebertoxizität.
Delavirdin ist wegen der hohen Pillenzahl und der dreimal täglichen Einnahme den anderen Wirkstoffen unterlegen. Zudem ist es zurzeit nicht auf dem deutschen Markt zugelassen.
Proteaseinhibitoren
Ohne die Spaltung des viralen Makromoleküls gag-pol-Polyprotein durch das Enzym HIV-Protease werden Viruspartikel produziert, die nicht infektiös sind. Proteaseinhibitoren wurden mit dem Wissen über die molekulare Struktur des Enzyms so modelliert, dass sie direkt im aktiven Zentrum der Protease binden können. Die gute Wirksamkeit von Proteaseinhibitoren wurde anhand von klinischen Endpunkten nachgewiesen. Sie haben zu einer deutlichen Verbesserung der Therapie beigetragen. Jedoch wurde der anfängliche Optimismus, den die Einführung der Proteaseinhibitoren in die Therapie auslöste, deutlich gebremst. Bei der Langzeitbehandlung zeigen sich einige Probleme. Sie führen zu Störungen im Fettstoffwechsel und können Lipodystrophie und Dyslipidämie auslösen. Der Grund hier für liegt wahrscheinlich in der "Mitochondrialen Toxizität". Proteaseinhibitoren scheinen ähnlich wie Nukleosidanaloga die Mitochondrien, also die "Kraftwerke" der Zellen, zu schädigen. Weitere Nebenwirkungen sind gastrointestinale Beschwerden.
Proteaseinhibitoren habe recht kurze Halbwertszeit im Blut-Plasma. Schon nach 8 Stunden ist die minimale Hemmkonzentration erreicht. Daher müssen die meisten Proteaseinhibitoren 3-mal täglich eingenommen werden.
Der Abbau der Proteaseinhibitoren geschieht in der Leber durch das Cytochrom-P450-Enzymsystem. Der Proteaseinhibitor Ritonavir hemmt dieses System. Man ging daher dazu über, andere Proteaseinhibitoren zusammen mit Ritonavir zu verabreichen, um den Abbau zu verlangsamen und die Plasma-Halbwertszeit zu verlängern. Dies bezeichnet man als "Booster". Mittlerweile gibt es den Proteaseinhibitor Lopinavir kombiniert mit einer Boosterdosis Ritonavir (Kaletra). Dies führt zu einer fast 100-fach größeren Plasma-Konzentration von Lopinavir und zu einer größeren Barriere gegen Resistenzen. Daher wird Lopinavir/Ritonavir (Kaletra) zumeist nach Therapieversagen anderer Medikamente benutzt ("Salvage-Bereich").
PMID 10860901 PMID 9287227 PMID 10202827 PMID 10509516 PMID 9835517
Fusionsinhibitoren
Mit Spannung verfolgten viele Betroffene und Therapeuten die Markteinführung des ersten Fusionsinhibitors T-20 Anfang 2003. T-20 bindet an das für die Fusion des Virus mit der Zellmembran der T-Helferzellen wichtige Transmembranprotein gp41 und blockiert so den Eintritt des Virus in die Zelle. Besonders interessant wird die Substanz dadurch, dass sie keine mitochondrale Toxizität und damit kein Lipodystrophiesyndrom auslöst.
Leider ist T-20 mit seinen 36 Aminosäuren zu groß für eine orale Einnahme. In seiner jetzigen Form muss T-20 täglich subkutan gespritzt oder über eine "Insulinpumpe" verabreicht werden. Ein schwieriger Einnahmemodus, zumal Hautirritationen an der Einstichstelle eine häufige Nebenwirkung zu sein scheinen.
Erste Studien ergaben, dass die eine bloße Hinzugabe von T-20 zu einer klassischen antiretroviralen Therapie nur einen begrenzten Erfolg mit sich bringt. [4] Zwei große Studien, die T-20 zu einer optimierten HAART gegen eine optimierte HAART ohne T-20 verglichen, zeigte jedoch signifikant bessere Werte im T-20 Arm der Studie. Das lässt darauf schließen, dass besonders die Patienten von T-20 profitieren, die gleichzeitig auch noch andere medikamentöse Optionen haben.[5]
Auch für T-20 gilt: Kein Medikament ohne Nebenwirkung! Es scheint zu Interaktionen mit Granulozyten zu kommen, die bei einigen Patienten zu vermehrten Infektionen führten.
Eine rasche Resistenzbildung des Virus ist zudem auch recht wahrscheinlich. Jedoch scheint die virale Fitness der resistenten Stämme vermindert zu sein.
Nichtsdestotrotz ermöglicht T-20 den Patienten eine interessante Option, die auf Grund von Nebenwirkungen oder Resistenzen ihre Therapie umstellen müssen. Erste Wahl zu Therapiebeginn ist T-20 derzeit jedoch nicht, und das nicht nur auf Grund der Studienlage. T-20 ist nach Aussage der Herstellerfirma Hoffmann-La Roche einer der am aufwändigsten zu produzierenden Substanzen der Firmengeschichte. Dies macht sich im Preis deutlich (mehr als €24.000 pro Jahr), der höher ist als einige Dreifachkombinationen herkömmlicher antiretroviraler Medikamente. So dürfte T-20 nicht zum Favoriten der Krankenkassen werden. Andere Firmen werden bald mit neuen Fusionsinhibitoren auf den Markt kommen, und an einer "T-20- einmal-wöchentlich-Spritze" wird intensiv geforscht.
Eine Sammlung mit übersichtlichen Beschreibungen aller zur Zeit angewandten antiretroviralen Therapeutika sowie einiger gängiger Medikamente zur Behandlungen opportunistischer Infektionen findet sich unter HIV.NET.
Highly Active Antiretroviral Therapy (HAART)
Mit "highly active antiretroviral therapy" wird die Kombinationstherapie aus mehreren antiretroviralen Medikamenten bezeichnet. Ziel der Therapie ist es, die Viruslast unter die Nachweisgrenze zu drücken und die CD4-Zellwerte zu erhöhen, um so das Immunsystem gegen opportunistische Infektionen und andere Aids-definierende Erkrankungen zu stärken. In der Regel besteht eine HAART aus 2 verschiedenen Nukleosianaloga (auch als Nuke-Backbone der Therapie bezeichnet) plus entweder einem Nicht-nukleosidischen Reverse Transkriptase Hemmer (NNRTI), einem Proteaseinhibitor (PI) oder einem dritten Nukleosidanalogon. Welche Kombination die beste ist, lässt sich pauschal nicht beantworten, und sollte für jeden Patienten individuell entschieden werden. Denn alle drei Kombinationen haben Vor- und Nachteile:
Die Kombination aus 2 Nukes und einem PI wurde am umfangreichsten getestet und es liegen Daten aus Langzeitstudien zum klinischen Effekt vor. Auch weist diese Kombination eine hohe Barriere gegen Resistenzen auf. Jedoch ist die hohe Pillenzahl eine Belastung für den Patienten und wirkt sich negativ auf seine Adherence aus. Auch ist eine Langzeittoxizität zu befürchten.
2 Nukes plus eine NNRTI scheinen den PIs gleichwertige Virus-Suppression zu haben, allerdings ist der klinische Effekt nicht durch Studien belegt (nur der Effekt auf Laborparameter). Die geringe Pillenzahl (ein mal am Tag für den NNRTI, zweimal am Tag die Nukes, eventuell bald "once daily" für beide) ist ein deutlicher Pluspunkt. Leider sind Allergien zu Beginn der Therapie mit Nevirapin keine Seltenheit. NNRTI sind resistenzanfälliger, und durch Kreuzresistenzen fällt eine ganze Wirkstoffklasse weg.
3 Nukes haben die geringste Pillenzahl und die einfachste Dosierung. AZT + 3TC + Abacavir gibt es in einer Tablette (Trizivir), die 2-mal täglich eingenommen wird. Dass es nur diese Kombination in einer Tablette gibt, liegt nicht an der Machbarkeit, sondern an der Tatsache, dass die Patente zumeist bei verschiedenen Firmen liegen und keiner mit der Konkurrenz teilen will. In Indien, Südafrika, Brasilien und Kenia werden auch 2 Nukes + NNRTI in einer Tablette als Generikum produziert. Es scheint wenige Interaktionen mit anderen Medikamenten zu geben, und sollte es zur Unverträglichkeit oder Resistenzen kommen, so stehen noch 2 andere Wirkstoffklassen zu Verfügung. Es liegen jedoch keine Langzeitdaten mit klinischen Endpunkten vor und die Kombination scheint auch etwas weniger wirksam in der Virusunterdrückung zu sein.
Wann mit HAART beginnen: Wann mit einer Therapie begonnen werden sollte, wird kontrovers diskutiert. Es gilt das Risiko, an Aids zu erkranken, mit den Risiken der Langzeittoxizität und Resistenzbildung abzuwägen. Als Mitte der 1990er Jahre entdeckt wurde, mit welcher Geschwindigkeit das Virus mutieren kann, und als man noch davon ausging, dass es durch eine längere Therapie zur Vernichtung aller Viren kommt (Eradikation), wurde das Behandlungsdogma "Hit hard and early!" ausgerufen. Dieses wurde schon zwei Jahre später durch die Entdeckung der mitochondralen Toxizität hinfällig. Heute sind Therapeuten deutlich zurückhaltender, und mit der HAART wird zumeist erst dann begonnen, wenn das Immunsystem deutlich geschwächt ist.
Die Deutsch-Österreichische Empfehlung zum Therapiebeginn berücksichtigt drei Faktoren: Das klinische Bild des Patienten, seinen CD4-Wert und die Viruslast.
Patienten, die bereits Aids-definierende Erkrankungen haben (CDC C), wird eine HAART dringend empfohlen. Auch beim Auftreten von Erkrankungen, die auf ein geschwächtes Immunsystem hindeuten, jedoch nicht Aids-definierend sind (CDC B), wird eine HAART empfohlen. Dies gilt auch für Patienten, die symptomfrei sind, aber einen CD4+ Wert von kleiner 200 haben, da es dann meist eine Frage der Zeit ist, bis Aids auftritt. Als im Allgemeinen ratsam wird eine Therapie bei Patienten angesehen, die einen CD4+ Wert zwischen 200 und 350 haben. Ebenso angeraten ist der Beginn der HAART laut der Empfehlung bei Patienten mit einem CD4+ Wert zwischen 350 und 500, wenn eine hohe Viruslast vorliegt (>100.000).
Doch gilt hier mehr denn je die Weisheit: Man behandelt nicht die Krankheit oder den Laborwert, sondern den Patienten. So sollte die Entscheidung, wann mit der Therapie begonnen wird, individuell gemeinsam von Therapeut und Patient gefällt werden. Der Beginn der Therapie bedeutet in der Regel eine Entscheidung, die für den Rest des Lebens eine Konsequenz hat. Daher muss der Patient genau über Therapieziele, mögliche Nebenwirkungen und Risiken der HAART Therapie aufgeklärt sein. Dies lässt sich nur schwer in einer Therapiesitzung gewährleisten. Daher sollte, wenn irgend möglich, der Patient Zeit haben, sich mit dem Gedanken vertraut zu machen, mit der Therapie zu beginnen. Letztlich hat die regelmäßige Medikamenteneinnahme eine höhere prognostische Aussagekraft, als der CD4+ Wert zu Beginn der Therapie (siehe Adherence).
Vorbeugung: Prävention ist die effektivste Maßnahme gegen HIV. Durch den Gebrauch von Kondomen, sterilen Nadeln bei der Einnahme von Drogen und bei Impfungen sowie Blutspenden kann man einer Infektion sehr sicher entgehen. Sexuelle Enthaltsamkeit bzw. Treue zu einem einzigen Sexualpartner und ein drogenfreier Lebensstil sind noch wirksamere Präventionsmaßnahmen, die so gut wie alle Neuinfektionen verhindern können. Nach einem Ereignis mit Ansteckungsrisiko kann die Ansteckung verhindert werden, wenn eine sog. Postexpositionsprophylaxe stattfindet.
Eine HIV-Impfung gibt es nicht!
An der hohen Mutationsrate des HI-Virus scheiterten bisher die langjährigen Forschungen um Impfstoffe, die die Bildung von schützenden Antikörpern gegen das Oberflächenprotein gp120 fördern sollten. Als das Mittel endlich gegen das sehr ähnliche SIV (SI-Virus, simian Immunodeficiency virus) der Affen erfolgreich getestet war, hatte das HI-Virus in Freiheit die Struktur seines gp120 Oberflächenproteins verändert.
Nach jahrzehntelangen vergeblichen Versuchen, einen Impfstoff gegen das HI-Virus herzustellen, begann Ende Februar 2004 zum ersten Mal eine klinische Studie an gesunden Probanden. Die Studie wird von den Universitätskliniken Bonn und Hamburg-Eppendorf durchgeführt. Mit ersten Ergebnissen ist Anfang 2005 zu rechnen. Falls diese Ergebnisse überzeugen, wird es mindestens weitere sieben Jahre dauern, bis der Impfstoff industriell gefertigt werden kann. Als Grundlage für die neue Impfung nahmen die Forscher den Subtyp HIV-1, Subtyp C, der vor allem in Afrika vorkommt. Denn hier soll das Hauptanwendungsgebiet liegen. Aus diesem Grund wird die Studie von gemeinnützigen Organisationen wie der International Aids Vaccine Initiative (IAVA) gefördert.
Entstehungstheorien: HIV ist eng mit Viren verwandt, die aidsähnliche Symptome in Primaten auslösen, und es ist allgemein akzeptiert, dass einer dieser Virustypen Anfang des 20. Jahrhunderts auf den Menschen übertragen wurde, obwohl es Hinweise darauf gibt, dass dies in isolierten Fällen bereits früher geschah.
Genaue Angaben über Zeit, Ort, Wirtstier, Art und Anzahl der Übertragungen sind nicht bekannt.
Ein Virus, das fast identisch mit dem menschlichen HI-Virus ist und SIV genannt wird, wurde in Schimpansen gefunden. Nach jüngsten Untersuchungen von Virologen der Universität Birmingham/Alabama löst HIV-1, das von dem im Schimpansen gefundenen SI-Virus abstammt, vermutlich die Immunschwächekrankheit aus. Durch eine genetische Analyse konnten die Wissenschaftler zeigen, dass das SI-Virus eine Kombination aus zwei Virusstämmen ist, die in bestimmten Meerkatzen vorkommen. Da Meerkatzen von Schimpansen gejagt und gefressen werden, müssen sich die Schimpansen mit den zwei Virusstämmen infiziert haben, aus denen sich dann in ihrem Körper das SI-Virus gebildet hat. Die Übertragung dieses SI-Virus auf den Menschen erfolgte nach Ansicht der Forscher wohl bereits in den 30er Jahren des 20. Jahrhunderts durch den Verzehr von Schimpansenfleisch.
Weitere wissenschaftliche Untersuchungen ergaben, dass das HI-Virus zuerst in West-Afrika auftrat, aber es ist nicht mit letzter Sicherheit geklärt, ob es nicht mehrere Virusherde gab. Neue sogenannte phylogenetische Untersuchungen, das heißt Verwandtschaftsvergleiche zwischen den unterschiedlichen Subtypen von HIV und zwischen HIV und SIV, lassen vermuten, dass mehrere unabhängige Übertragungen vom Schimpansen auf den Menschen in Kamerun und/oder dessen Nachbarländern stattfanden.
Die erste Blutprobe, die nachgewiesenermaßen HIV-Antikörper enthält, wurde 1959 im Kongo von einem erwachsenen Menschen genommen. Weitere Proben stammen von einem US-Amerikaner (1969) und einem norwegischen Matrosen (1976).
2006 wurde in Science[6] ein Bericht veröffentlicht, der beweist, dass der Schimpanse Pan troglodytes troglodytes der natürliche Wirt der Zoonose ist. Der erste Mensch hat sich vermutlich durch den Verzehr von Affenfleisch infiziert.[7]
Geschichte: 1981 wurde von Michael Gottlieb erstmals eine Häufung seltener und oft tödlich verlaufender Infektionen bei zuvor gesunden homosexuellen Männern in den USA beschrieben. Besonders auffällig war die Kombination von Pneumocystis carinii-Infektionen und Kaposi-Sarkomen, beides Erkrankungen, die zumeist bei deutlich geschwächten Patienten auftrat. Schon recht früh wurde eine erworbene Immunschwächeerkrankung für die wahrscheinlichste Ursache in Betracht gezogen. Epidemiologische Untersuchungen in den USA zeigten, dass neben Homosexuellen vorwiegend Drogenabhängige, Empfänger von Blut (z. B. durch Bluttransfusionen) und Blutprodukten (Hämophile) und Kleinkinder von infizierten Müttern an Aids erkrankten. Dies führte 1982 zu der Vermutung, dass der Auslöser der neuen Erkrankung ein sexuell und parenteral übertragbarer Erreger sei. In Frankfurt am Main wurde die Krankheit 1982 zum ersten Mal bei einem Patienten diagnostiziert. 1983 isolierte eine französische Forschergruppe um Luc Montagnier das Lymphadenopathie-Virus (LAV), bei dem sie die Ursache für Aids vermuteten. Eine kausale Beziehung zwischen dem Virus und der Immunschwächeerkrankung wurde kurze Zeit später behauptet. Im selben Jahr wurde in Berlin die AIDS-Hilfe gegründet. 1984 wurde im US-Krebsinstitut ein bei Aids-Patienten entdecktes Virus HTLV-III genannt. Bald stellte sich heraus, dass LAV und HTLV-III identisch sind. 1985 erhielt Robert Gallo das US-Patent für den ersten ELISA-Antikörper-Test, der von der US-Zulassungsbehörde zugelassen wurde. Im gleichen Jahr findet in Atlanta (USA) die erste Welt-Aids-Konferenz statt.
Im Jahr 1986 wurde für den Virus der Name Humanes Immundefizit Virus (HIV) etabliert. Ein Jahr später, 1987, wurde mit AZT (Retrovir) das erste Therapeutikum zugelassen. In einer Studie hatte es die Sterberate unter HIV stark reduziert. Im Jahr 1988 wurde von der WHO der 1. Dezember zum Welt-Aids-Tag erklärt. 1989 wurde bei HIV-Patienten die Pentamidin-Inhalation zur Prophylaxe der Pneumocystis-carinii-Pneumonie eingeführt.
Im Jahr 1990 wurde aus Protest gegen die Diskriminierung von HIV-Infizierten auf der Aids-Konferenz in San Francisco das Red Ribbon, ein rotes Armband etabliert. Ein Jahr später wurde die Rote Schleife international zum Symbol für den Kampf gegen Aids. 1992 wurde aufgrund der US-Einreisebestimmungen der Welt-Aids-Kongress von Boston nach Amsterdam verlegt. Außerdem wurde im Gedenken an Freddie Mercury von den verbleibenden Queen-Mitgliedern die Stiftung Mercury Phoenix Trust gegründet.
In der frühen Therapie HIV-Infizierter ergab sich 1993 in einer Studie kein Überlebensvorteil mit der AZT-Therapie. 1994 wurde HIV-PCR als wichtiger Marker für die Therapiekontrolle des Infektionsverlaufes etabliert. Im folgenden Jahr, 1995, kam der erste Protease-Hemmer, Saquinavir, in den USA auf den Markt. Im folgenden Jahr wurde Nevirapin als erster nicht-nukleosidischer Reverse-Transkriptase-Hemmer zugelassen. Durch die intensive Kombitherapie nahm die Sterberate in den USA 1997 drastisch ab. 2003 wurde mit Enfuvirtid (Fuzeon) der erste Fusionshemmer in den USA zugelassen. 2004 wurde von der WHO die Initiative 3 by 5 gestartet: 3 Millionen Infizierte sollten im Jahr 2005 mit Medikamenten versorgt werden.
Zu Anfang galt die Erkrankung in der öffentlichen Wahrnehmung als Problem von Randgruppen wie Homosexuellen und Drogenabhängigen, daher war sie in den USA bis 1982 auch unter den Namen GRID (Gay-Related Immune Deficiency) oder GIDS (Gay People's Immuno Defiency Syndrome) bekannt. Dies änderte sich jedoch auf dramatische Weise durch das Aufkommen von HIV-Tests. Denn auch Menschen ohne klinische Symptome hatten Antikörper, was auf eine Inkubationszeit von mehreren Jahren hindeutete, in der das Virus möglicherweise auch weitergegeben wurde. 1984 ergaben Untersuchungen, dass Aids in Kinshasa bei Männern und Frauen gleich häufig auftrat, unabhängig von Drogenkonsum und Bluttransfusionen.
In den USA wurde 1985 berichtet, dass bei untersuchten Hämophiliekranken ("Blutern"), die sich durch Blutkonserven infiziert hatten, die Ansteckungsrate der Ehefrauen bei 70 % lag. Die Erkenntnis, dass die Ansteckungsgefahr bei heterosexuellem Geschlechtsverkehr deutlich höher zu sein schien als zunächst angenommen, führte zu einem großen öffentlichen Interesse. Die Kombination aus den nun bekannten Ansteckungswegen und langer Inkubationszeit ließen epidemiologische Hochrechnungen ein apokalyptisches Bild zeichnen. Eine geschichtlich einmalige Massenhysterie breitete sich aus: Aids schien zu einer Bedrohung der Menschheit geworden zu sein.
Die jährliche Verdopplung von Neuerkrankungen hielt in Deutschland nur von 1984 bis 1987 an, danach verlief der Anstieg der Zahl von Erkrankten weniger steil, bis sich die Zahlen im Jahre 1993 auf ca. 2000 einpendelte. Dadurch änderte sich auch schnell wieder das öffentliche Interesse an Aids. 2003 steckten sich weltweit ungefähr 4,8 Millionen Menschen neu mit dem Virus an, im selben Jahr starben circa 2,9 Millionen Menschen daran.
Verbreitung des HI-Virus:
Allgemein
Aus epidemiologischer Sicht ist das weltweite Verteilungsmuster von HIV interessant: Während sich die meisten Viren gleichmäßig schnell ausbreiten, war dies bei HIV anders. Während die HIV-Epidemie in den USA bereits vor 20 Jahren begann, gab es einige Länder, die von HIV verschont zu sein schienen, dann aber mit großer Geschwindigkeit vom Virus erobert wurden. So geschah es vor allem in Osteuropa und Asien Mitte der 1990er Jahre. In anderen Ländern, zum Beispiel Kamerun, blieb die Prävalenz von HIV Jahre lang stabil, um dann sprunghaft anzusteigen. Auch eine Obergrenze in der HIV-Prävalenz scheint es nicht zu geben. So stieg die Quote der schwangeren Frauen mit HIV in städtischen Zentren in Botswana nach 1997 in vier Jahren von 38,5 % auf 55,6 %.
Dass HIV erfolgreich zu bekämpfen ist, zeigt das Beispiel Uganda. 1992 lag die Prävalenz von HIV bei schwangeren Frauen bei nahezu 30 % und konnte auf 10 % im Jahre 2000 gesenkt werden. Grundlagen dieses Erfolges waren die landesweite Einführung von Sexualkundeunterricht, flächendeckende Kampagnen zur Steigerung der Akzeptanz von Kondomen, HIV-Tests, deren Ergebnisse noch am selben Tag bekannt gegeben wurden und Selbsthilfe-Kits für sexuell übertragbare Krankheiten. Diese Erfolge sind jedoch nur mit finanziellen Mitteln durchführbar, die viele der Hochendemie-Länder in Afrika nicht allein aufbringen können. Unabdingbar ist ferner ebenso ein politischer Wille, diese Seuche aktiv zu bekämpfen.
Weltweit
| Mit HIV/Aids lebende Personen | Neuinfektionen | Todesfälle | Todesfälle aufsummiert | |
|---|---|---|---|---|
| 1980 | (~ 2.000.000)1 | - | - | - |
| 1993 | (12.900.000)1 | - | - | (2.500.000)1 |
| 1999 | - | 4.000.000 | - | - |
| 2000 | - | 3.800.000 | - | - |
| 2001 | 34.900.000 (40.000.000)1 | 3.400.000 | 2.500.000 | 20 - 22 Mio |
| 2002 | - (42.000.000)1 | 3.500.000 | 3.100.000 | ~ 21.1 Mio |
| 2003 | 37.800.000 | 4.800.000 | 2.900.000 | ~ 24.0 Mio |
| 2004 | 39.400.000 | 4.900.000 | 3.100.000 | ~ 27.1 Mio |
| 2005 | 40.300.000 | 4.900.000 | 3.100.000 | > 25 Mio |
Die Daten für das Jahr 2005 stammen aus "Aids epidemic update December 2005 (UNAIDS)". Für die weiteren Daten sind keine Quellen angegeben.
1Bei der Berechnung der Gesamtzahl aller Infektionen wandte UNAIDS ab 2004 eine neue Methodik an, die eine relative Korrektur der Zahlen nach unten nach sich zog. Nach alter Methodik ermittelte Zahlen sind zur Unterscheidung kursiv gesetzt, für 2001 finden sich zum Vergleich beide Werte angegeben, ein korrigierter Wert für 2002 ist nicht bekannt.
| Globale Verteilung | 2001 | 2002 | 2003 | 2004 | 2005 |
|---|---|---|---|---|---|
| Subsahara-Afrika | 23,8 Mio. | 24,4 Mio. | 25,0 Mio. | 25,4 Mio. | 25,8 Mio. |
| Süd- & Südostasien | 5,9 Mio. | 6,4 Mio. | 6,5 Mio. | 7,1 Mio. | 7,4 Mio. |
| Latein-Amerika | 1,4 Mio. | 1,5 Mio. | 1,6 Mio. | 1,7 Mio. | 1,8 Mio. |
| Osteuropa & Zentralasien | 890.000 | 1,0 Mio. | 1,3 Mio. | 1,4 Mio. | 1,6 Mio. |
| Ostasien | 680.000 | 760.000 | 900.000 | 1,1 Mio. | 870.000 |
| Nordamerika | 950.000 | 970.000 | 1 Mio. | 1 Mio. | 1,2 Mio. |
| West- und Zentraleuropa | 540.000 | 600.000 | 580.000 | 610.000 | 720.000 |
| Nordafrika und Naher Osten | 340.000 | 430.000 | 480.000 | 540.000 | 510.000 |
| Karibik | 400.000 | 420.000 | 430.000 | 440.000 | 300.000 |
| Ozeanien | 24.000 | 28.000 | 32.000 | 35.000 | 74.000 |
Alle Zahlen von UNAIDS.
Im südlichen Afrika ist die Rate am höchsten. Die Rate der schwangeren HIV-Infizierten unter 20 Jahren ist in Südafrika auf 15,4 % gesunken (1998: 21 %); dies bedeutet, dass Aufklärungsprogramme langsam Erfolge zeigen. Jedoch sind die Aids-Raten bei älteren Frauen immer noch sehr hoch. 32 % der Frauen zwischen 24 und 29 Jahren sind derzeitig mit der Krankheit infiziert. Insgesamt sind 20 % der Bevölkerung Südafrikas mit HIV infiziert. Das Land mit der weltweit höchsten Aids-Rate ist das benachbarte Swasiland (seit 2018 Eswatini), wo 2005 42 % der Bevölkerung infiziert waren.
Deutschland: Die Zahl der Neuinfektionen lag einige Jahre relativ konstant bei knapp 2.000 pro Jahr. 2005 betrug die Zahl der Neuinfizierten in Deutschland ca. 2.490. Ende 2005 lebten ca. 49.000 HIV-infizierte Menschen in der Bundesrepublik, davon 39.500 Männer und 9.500 Frauen, sowie ca. 300 Kinder. 8.000 von ihnen zeigten das Vollbild Aids.
Von den 2.490 Neuinfizierten waren ca. 85 % Männer, 70 % Männer, die Sex mit Männern hatten, 20 % waren Übertragungen durch heterosexuellen Sex, 9% Infektionen durch infizierte Spritzen bei Drogenmissbrauch und 1% Übertragungen von der Mutter auf das Kind, meist während der Geburt.
Die Zahl der neu an Aids Erkrankten liegt bei ca. 850 pro Jahr und ist ebenfalls relativ konstant. Etwa 750 Menschen sind 2005 an den Folgen einer HIV-Infektion beziehungsweise an Aids verstorben. Von Anfang der 1980er Jahre bis 2005 haben sich in der Bundesrepublik Deutschland etwa 75.000 Menschen mit HIV infiziert, etwa 31.500 Menschen sind an Aids erkrankt und etwa 26.000 sind an den Folgen der HIV-Infektion gestorben.
Manche befürchten einen Anstieg der Infizierungsrate, weil zum einen die Aufklärungswelle der 1990er-Jahre verebbt sei und sich zum anderen gerade bei Jugendlichen zwischen 13 und 16 Jahren eine erstaunliche Unkenntnis in Bezug auf die latente Ansteckungsgefahr beim ungeschützten Sexualakt zeigt. So behauptet erschreckenderweise jeder fünfte Jugendliche, dass man einem HIV-Positiven „die Krankheit ansehen könne“. Hinzu kommt eine Verharmlosung und gelegentliche Faszination von Gefahren, die bei manchen zu bewusst risikoreicherem Verhalten (Barebacking) führt.
Grund zur Besorgnis gibt weiterhin der kontinuierliche Anstieg von anderen sexuell übertragbaren Krankheiten. Nicht nur, dass sich damit das Risiko einer Ansteckung erhöht, es zeigt auch, dass die Akzeptanz von Kondomen rückläufig zu sein scheint. Diese Befürchtungen werden bestärkt durch die Tatsache, dass sich laut des Berliner Robert-Koch-Instituts (RKI) in den ersten acht Monaten des Jahres 2005 zwanzig Prozent mehr Menschen mit HIV angesteckt haben als im vergleichbaren Zeitraum des Vorjahres.
Mehr als 80 Prozent sind Männer und nahezu 70 Prozent der Gesamtzahl sind Männer, die gleichgeschlechtliche Kontakte hatten. Das Infektionsrisiko für diese Männer ist damit doppelt so groß wie vor vier Jahren - und so hoch wie seit zwölf Jahren nicht mehr.
Österreich: Ende 2004 lebten etwa 9.400 HIV-Infizierte in Österreich, mehr als die Hälfte davon in Wien. Die Zahl der Neuinfizierungen beträgt seit 2003 etwa 450 pro Jahr. Die niedrigste Rate war 1997 mit 297, die höchste 1993 mit 561 Neuinfektionen. Der Anstieg der Neuinfektionen kann durch das Ende der Aufklärungswelle der 1990er-Jahre erklärt werden.
Zwischen 1983 und 1. Dezember 2005 sind in Österreich 2.463 Menschen an Aids erkrankt und 1.418 gestorben. Von 2003 mit 50 neuen Erkrankungen, stiegen sie im Jahr 2004 auf 65 an.
Im Vergleich der ersten drei Quartale, stiegen die HIV-Neuinfektionen von 317 im Jahr 2003 auf 364 in den Jahren 2004 und 2005 an.
Schweiz: In der Schweiz wurden im Jahr 2005 702 positive HIV-Tests gemeldet. Seit 2002 hat die Anzahl der Neuansteckungen von 791 leicht abgenommen. Besonders stark betroffen sind die Kantone Zürich, Waadt und Genf.
Infektionen: Bei den Männern sind 2005 die meisten Ansteckungen mit 49,1 % nach homosexuellem Geschlechtsverkehr zu verzeichnen. Seit 2003 zeigt sich in dieser Gruppe eine Zunahme von 13,9 % und bewegt sich damit über dem Höchststand von 1994. Die Anzahl der Ansteckungen nach heterosexuellem Kontakt folgt mit 38,1 %. Diese Gruppe stieg nach 2002 wieder an, konnte sich aber 2005 wieder senken und scheint sich auf gleich bleibend hohem Niveau zu halten. Die Ansteckungen nach Drogenkonsum sinken seit 2003 weiter auf 9,7 %.
Bei den Frauen ist das Ansteckungsrisiko bei heterosexuellem Kontakt mit 80,6 % am grössten und stieg seit 2002 um 10,7 %. Die Infizierungen nach Drogenkonsum bleiben mit 11,1 % auf konstantem Niveau.
Bei Ansteckungen nach homosexuellen Kontakten sind hauptsächlich Bürger aus der Schweiz mit etwa 72 % betroffen, gefolgt mit 15 % von Personen aus der EU. Das Verhältnis bewegt sich bei Ansteckungen nach Drogenkonsum etwa im gleichen Verhältnis (63 % aus der Schweiz und 20,4 % EU). Bei den heterosexuellen Beziehungen zeigt sich jedoch ein stark grösserer Anteil an ausländischen Personen. Besonders stark betroffen sind Personen aus der Subsahara mit 41 %.
Aids in Afrika:
Ausbreitung
Die Aids-Pandemie hat ihre schlimmsten Ausmaße südlich der Sahara. Hier leben 26 Millionen Menschen mit einer HIV-Infektion. In einigen Ländern hat sich durch die Immunschwächeerkrankung die Lebenserwartung um mehr als zehn Jahre gesenkt. Warum sich die Erkrankung hier so viel schneller verbreitet, ist nicht ganz geklärt.
Es scheint einige Faktoren zu geben, die die Ausbreitung des HI-Virus begünstigen: während in Europa und Nordamerika schon kurz nach der Entdeckung des HI-Virus die Massenmedien große Teile der Bevölkerung mit Informationskampagnen über die tödlichen Gefahren einer HIV-Infektion und Prävention informierten, blieb Aids in vielen Teilen Afrikas ein Tabuthema. So hatte das HI-Virus fast zwanzig Jahre mehr Zeit, sich ungehindert auszubreiten.
Sozialethische Beurteilung: Das Krankheitssyndrom Aids hat sich weltweit zu einer ernsten Herausforderung für direkt Betroffene, für die medizinische Wissenschaft, aber auch für all jene, die derartige Patienten zu betreuen haben oder mit ihnen zusammenleben müssen, entwickelt.
Fernab von jeder Stigmatisierung aidskranker Patienten gilt es, Mittel und Wege zu finden, ihnen besser wirksam zu helfen: Sei es durch immer noch nicht ausreichend verfügbare therapeutische Maßnahmen, sei es im Sinn der symptomatischen Therapie und palliativen Medizin. Geboten ist zudem umfassende und wirksame Prävention.
Die Suche nach einer ethisch vertretbaren Aids-Bekämpfungsstrategie führt zu teils gegenteiligen Ergebnissen: Die einen betonen die unbedingte Notwendigkeit eines ausschließlich oder doch primär „technischen“ Schutzes gegen die Ausbreitung der Krankheit. Andere sehen diese Antwort als nicht ausreichend an bzw. lehnen diese aus Gründen einer religiösen Ethik ab. Sie betonen den Wert der dauerhaften ehelichen Treue neu bzw. fordern im konkreten Fall auch zeitweise oder völlige Enthaltsamkeit ein. Die Propagierung von Kondomen als Schutz gegen Aids sei vom religiös-christlichen Standpunkt aus bedenklich. Man argumentiert, auf diese Weise werde ein mit Promiskuität und gewissen sexuellen Praktiken assoziierter verantwortungsloser Lebensstil gefördert, der die eigene Person sowie andere Menschen einer todbringenden Gefahr aussetze.
Im Oktober 2003 deckte die BBC in einer Reportage auf, dass Priester, Nonnen und katholische Sozialarbeiter auf direkte Weisung des Vatikans überall in der dritten Welt die Unwahrheit verbreiten, Kondome böten keinen Schutz vor Aids. Das Virus könne jederzeit durch das Latex schlüpfen, weil es 450-mal kleiner sei als ein Spermatozoon und damit auch deutlich kleiner als Poren im Material. So macht etwa der Erzbischof von Nairobi, Raphael Ndingi Nzeki, in Kenia, wo nach offiziellen Schätzungen bereits 20 % der Bevölkerung mit HIV infiziert sind, die Verfügbarkeit von Kondomen für die rasche Ausbreitung der Epidemie verantwortlich. Nach Aussage von Gesundheitsarbeitern erzählen manche Priester sogar, dass die Kondome selbst mit dem Virus beschichtet seien.[8]
Viele Gesundheitsorganisationen betrachten die religiös motivierte und sachlich irreführende Anti-Kondom-Propaganda zahlreicher Kirchen als ein großes Hindernis für ihre Präventionsarbeit. Sie sei in hohem Maße unethisch, weil sie die Wahrung einer restriktiven Sexualmoral für wichtiger als oder ausreichend für die mögliche Eindämmung der Aids-Epidemie halte.
Literatur und Weblinks:
Deltaretrovirus
[Bearbeiten]Humanes T-lymphotropes Virus
[Bearbeiten]| Humanes T-lymphotropes Virus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Morphologie | ||||||||||||||||||
| umhüllt, ikosaedrisch | ||||||||||||||||||
Das humane T-Zell-lymphotrope Virus Typ I (HTLV-I) (früher auch: humanes T-Zell-Leukämie-Virus Typ I) ist ein Retrovirus, das Menschen und andere verwandte Primaten infizieren kann. Es infiziert primär CD4-positive T-Lymphozyten und kann bei einer kleinen Minderheit der Infizierten eine T-Zell-Leukämie oder neurologische Erkrankungen verursachen.
Historisches: HTLV-I wurde 1979/1980 als erstes humanpathogenes Retrovirus durch die Arbeitsgruppe um Robert Gallo am NIH entdeckt. Dem vorangegangen war eine jahrzehntelange Suche nach menschlichen Retroviren, nachdem man Retroviren aus dem Tierreich schon seit vielen Jahrzehnten kannte. Die Entdeckung war dementsprechend eine wissenschaftliche Sensation. Kurz danach wurde ein zweites, mit HTLV-I eng verwandtes humanes Retrovirus entdeckt, das dementsprechend dann als HTLV-II bezeichnet wurde. Die ersten HTLV-I-Virusisolate stammten von Patienten mit T-Zell-Leukämien. Der Name "HTLV" stand daher zunächst für "humanes T-Zell-Leukämievirus". Später entdeckte man, dass HTLV-I auch andere nicht-maligne Erkrankungen verursachen kann und der Name wurde in "T-Zell-lymphotropes Virus" abgeändert. In den folgenden Jahren entdeckte man bei Primaten verschiedene, mit HTLV-I und HTLV-II eng verwandte Retroviren, die dann analog als simian T-cell lymphotropic viruses oder primate T-cell lymphotropic viruses (T-Zell lymphotrope Viren von Affen bzw. Primaten) bezeichnet wurden. Heute geht man davon aus, dass die humanen Viren HTLV-I und HTLV-II durch Übertragung von Affenretroviren vor etlichen Tausend Jahren auf den Menschen entstanden sind.
Taxonomie: Taxonomisch wird HTLV-I zu den Deltaretroviren gezählt und aufgrund der engen genetischen Verwandtschaft mit den Deltaretroviren der Primaten in eine Untergattung "Primaten-Deltaretroviren" eingeteilt.
Epidemiologie: Weltweit schätzt man ca. 15-20 Millionen HTLV-I-Infizierte (zum Vergleich: HIV: ca. 40 Millionen 2006). Im Gegensatz zu HIV hat sich die Zahl der Infizierten in den letzten Jahrzehnten wohl nicht wesentlich verändert (nach Schätzungen, genaue Zahlen existieren für die meisten Länder nicht). Im Gegensatz zu HIV, das sich seit Anfang der 80er Jahre vor allem im Afrika südlich der Sahara geradezu explosionsartig ausgebreitet hat und zur Pandemie geworden ist, sind die HTLV-I-Infektionen weitgehend auf bestimmte Endemiegebiete beschränkt geblieben. Die Ursachen liegen wohl in der wesentlich weniger effizienten Übertragung von HTLV-I im Gegensatz zu HIV. Bekannte Endemiegebiete sind:
- Japan, insbesondere die südlichen Inseln Kyushu, Shikoku und Okinawa
- die Karibik und Anrainergebiete, z. B. Mittelamerika
- bestimmte Gebiete von Äquatorialafrika
- bestimmte Gebiete von Südamerika
- die Region um die Stadt Mashhad im Nordosten Irans
- die USA (hier insbesondere bestimmte Bevölkerungsgruppen)
Für viele Länder existieren jedoch keine verlässlichen Zahlen. In Europa kommt HTLV-I fast nicht vor (eine Ausnahme sind Einwanderer aus Endemiegebieten wie z.B. karibische Einwanderer in Großbritannien). Im Gegensatz zu den USA werden in Deutschland Blutspender wegen der Seltenheit nicht routinemäßig auf HTLV-I getestet).
Genetik: Das HTLV-I-Genom besteht aus RNA und umfasst ca. 8500 Basen (zum Vergleich: menschliches Genom ca. 6.000.000.000 Basenpaare). Es besteht an den Enden aus zwei identischen flankierenden Sequenzen (den sogenannten long terminal repeats). Dazwischen liegen die für alle Retroviren typischen 3 Genregionen gag (Genregion für die Virusstrukturproteine, aus denen die innere Virushülle aufgebaut ist), pol (Virusenzyme, die für die Umschreibung des Virusgenoms in DNA und die Integration in das zelluläre Genom wichtig sind) und env (Virusproteine, die in die äußere Virushülle eingebaut sind und entscheidend dafür sind, welche Zellen das Virus infizieren kann).
Zusätzlich besitzt HTLV-I allerdings noch weitere Gene, die für Proteine kodieren, die die Expression von Virusgenen und auch zellulären Genen beeinflussen. Zumindest eines dieser Gene - tax - scheint entscheidend an der malignen Transformation der infizierten Zelle und der Entstehung der T-Zell-Leukämie beteiligt zu sein.
Infektionswege: Drei wesentliche Infektionswege sind bekannt:
- perinatale Infektion des Säuglings durch die Muttermilch infizierter Mütter
- durch Transfusion infizierter Blutprodukte
- durch Sexualkontakt.
Assoziierte Erkrankungen: HTLV-I verursacht hauptsächlich zwei Erkrankungen:
- die adulte T-Zell-Leukämie, eine Sonderform der T-Zell-Leukämie (manchmal abgekürzt ATL)
- die tropische spastische Paraparese bzw. HTLV-I-assoziierte Myelopathie (manchmal abgekürzt TSP/HAM).
Diese Erkrankungen treten nur bei einem kleinen Teil der HTLV-I-Infizierten auf. Beispielsweise gab es in Japan in den 90er Jahren mehr als eine Million HTLV-I-Infizierte, aber es wurden nur zwischen 500 und 1000 Fälle von ATL jährlich beobachtet. Man schätzt, dass das lebenslange Risiko für diese Erkrankungen bei Infektion bei jeweils ca. 1-2% liegt. Dies ist ein wesentlicher Unterschied zur HIV-Infektion, bei der praktisch 100% der Infizierten, sofern sie nicht behandelt werden, früher oder später AIDS entwickeln.
In Japan erfolgte die Infektion früher hauptsächlich perinatal über die Muttermilch infizierter Mütter. Seitdem dieser Übertragungsweg bekannt ist, gibt es Programme, die diesen Müttern den Verzicht auf das Stillen nahelegen. Dadurch ist es in Japan tatsächlich zu einer signifikanten Senkung der Rate an Neuinfektionen gekommen. Interessant ist, dass die ATL meist im höheren Lebensalter auftritt (das Durchschnittsalter der Erkrankten beträgt >60 Jahre). Bei einer vorwiegend perinatalen Infektion muss man also von einer enorm langen Latenzzeit des Virus ausgehen (60 Jahre und mehr). Auch das ist ein wesentlicher Unterschied zu HIV, wo die Zeit zwischen Infektion und Entwicklung von AIDS meist weniger als 10 Jahre beträgt, wenn keine Behandlung erfolgt. Auch muss betont werden, dass es sich bei der adulten T-Zell-Leukämie um eine ganz spezielle Sonderform der T-Zell-Leukämie handelt, die nur in HTLV-I-Endemiegebieten auftritt. In Europa, wo HTLV-I kaum vorkommt, gibt es durchaus auch T-Zell-Leukämien, diese haben aber ursächlich nichts mit HTLV-I zu tun.
Therapie: Eine wirksame Therapie der HTLV-I-Infektion ist nicht bekannt. Bei einer Infektion persistiert das Virus lebenslang im Organismus und kann in der Regel durch das Immunsystem nicht mehr eliminiert werden (das Virusgenom wird bei der Infektion in das Genom der infizierten Zelle eingebaut). Es ist also ein Fehlschluss, anzunehmen, dass jemand, bei dem Antikörper gegen HTLV-I im Blut nachweisbar sind, gegen dieses Virus immun ist. Die Antikörper zeigen im Gegenteil an, dass der Betroffene mit dem Virus Kontakt hatte und dauerhaft infiziert ist (genauso wie bei HIV). Eine wirksame Impfung gegen das Virus existiert bisher nicht.
Die durch HTLV-I ausgelösten Erkrankungen ATL und TSP/HAM müssen entsprechend behandelt werden. Die ATL wird beispielsweise wie eine Leukämie behandelt. Eine antivirale Therapie findet dabei nicht statt. Die Prognose der Erkrankungen ist im allgemeinen ungünstig.
Weblinks:
- Robert Gallo Die Jagd nach dem Virus - AIDS, Krebs und das menschliche Retrovirus. Die Geschichte seiner Entdeckung. S. Fischer Verlag, Frankfurt/Main, 1991, ISBN 3-10-024404-4 (seine wissenschaftliche Autobiografie)
- Gallo RC The discovery of the first human retrovirus: HTLV-1 and HTLV-2. Retrovirology 2005, 2:17 (englischsprachiger Übersichtsartikel, frei zugänglich in BioMed Central: Volltext
- Poiesz BJ, Ruscetti FW, Gazdar AF, Bunn PA, Minna JD, Gallo RC. Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proc Natl Acad Sci USA 1980; 77: 7415–7419. (PubMed: 6261256, Erstbeschreibung)
Quellen
[Bearbeiten]- ↑ CHAT-Survey-Studie
- ↑ Viele holen sich beim Partner HIV
- ↑ http://www.hiv-symptome.de
- ↑ http://63.126.384/2002/Abstract/13592.htm
- ↑ http://amedeo.com/lit.php?id=12637625
- ↑ 2006; doi: 10.1126/science.1126531
- ↑ http://www.aerzteblatt.de/v4/news/news.asp?id=24352
- ↑ http://www.guardian.co.uk/print/0,3858,4770493-106925,00.html
