Biochemie und Pathobiochemie: Pyridoxalphosphat-Stoffwechsel
Allgemeines
[Bearbeiten]Pyridoxalphosphat ist das zentrale Vitamin des Aminosäurenstoffwechsels. Es ist z.B. als Cofaktor der Transaminasen und Decarboxylasen aktiv.
Biosynthese / Herkunft
[Bearbeiten]
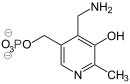
Zur Vitamin B6-Gruppe (Pyridoxine) gehören das Pyridoxamin, das Pyridoxal und das Pyridoxin sowie die jeweiligen 5'-Phosphat-Ester und zusätzlich noch das Pyridoxat, das mit dem Urin ausgeschieden wird. Die wasserlöslichen Vitamine können bis auf Pyridoxat ineinander umgewandelt werden. Biologisch aktiv ist das Pyridoxal-5'-phosphat (PLP, PALP). Die Biosynthese erfolgt bei Bakterien, Pilzen und Pflanzen z.B. aus Glycerinaldehyd-3-phosphat (Glycolyse) und D-Ribulose-5-phosphat (Pentosephosphatweg) oder aus D-Erythrose-4-phosphat (Pentosephosphatweg).
Aktivierung der B6-Vitamine (Recycling von Pyridoxalphosphat)
[Bearbeiten]| ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| ATP
ADP |
Pyridoxalkinase | 2.7.1.35 | Tr | |||||||
|
||||||||||
| ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| ATP
ADP |
Pyridoxalkinase | 2.7.1.35 | Tr | |||||||
|
||||||||||
| O2
H2O2 |
Pyridoxinphosphat-Oxidase | 1.4.3.5 | Ox | PNPO-Defizienz | ||||||
|
||||||||||
| ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| ATP
ADP |
Pyridoxalkinase | 2.7.1.35 | Tr | |||||||
|
||||||||||
| H2O, O2
NH3, H2O2 |
Pyridoxinphosphat-Oxidase | 1.4.3.5 | Ox | PNPO-Defizienz | ||||||
|
||||||||||
Biologische Funktionen
[Bearbeiten]Pyridoxalphosphat (PLP, PALP) ist das zentrale Vitamin des Aminosäurenstoffwechsels. Je nach Proteinanteil (Apo-Enzym) werden folgende Reaktionen katalysiert:
- Transaminierungen durch Transaminasen z.B. Alanin-Transaminase, Aspartat-Transaminase (Aspartatzyklus), Ornithin-Aminotransferase (Ornithinsynthese aus und -abbau zu Glutamat), Phosphoserin-Transaminase (Biosynthese von L-Serin und Glycin), Alanin--Glyoxylat-Transaminase, α-Aminoadipat-Transaminase (Lysin-Abbau), Tyrosin-Transaminase und Verzweigtkettige-Aminosäuren-Transaminase.
- Decarboxylierungen: Synthese biogener Amine wie z.B. GABA aus Glutamat, Tyramin aus Tyrosin und Dopamin aus L-Dopa, Histamin aus Histidin, Serotonin aus 5-Hydroxy-Tryptophan. Weiterhin Decarboxylierung von Phosphatidylserin zu Phosphatidylethanolamin und Biosynthese von Putrescin.
- Aldolspaltung: Aldolasen spalten Serin in Glycin und eine Hydroxymethylgruppe sowie Threonin in Glycin und Acetaldehyd.
- α-,β-Eliminierung: Die L-Serin-Deaminase (syn. L-Serin-Dehydratase) deaminiert Serin zu Pyruvat, die Threonin-Ammoniak-Lyase (syn. L-Threonin-Dehydratase) deaminiert Threonin.
- Transsulfurierung und Cystein-Biosynthese im Abbauweg des Methionins.
- Erster Schritt der Häm-Biosynthese als Cofaktor der δ-Aminolävulinat-Synthase.
- PLP ist außerdem ein Bestandteil der Glycogen-Phosphorylase, wobei PLP hier etwas anders arbeitet als im Aminosäurenstoffwechsel (Säure-Basen-Katalyse durch die Phosphat-Gruppe).
Funktionsweise (Reaktionen mit Aminosäuren)
[Bearbeiten]Die Aldehyd-Gruppe von PLP bildet mit der Aminogruppe der Aminosäure eine Schiff-Base (Aldimin), unterstützt von einer kationischen Gruppe des Enzyms. Der PLP-Stickstoff zieht Elektronen an und schwächt dadurch die Bindungen am Cα-Atom der Aminosäure, so dass je nach Apo-Enzym unterschiedliche Reaktionen ermöglicht werden.
- Schwächung der Bindung zwischen dem Cα-Atom und der Aminogruppe: Transaminierung (PLP deaminiert eine Aminosäure und überträgt die Aminogruppe dann auf eine Ketosäure)
- Schwächung der Bindung zwischen dem Cα-Atom und der Carboxylgruppe: Decarboxylierung
- Schwächung der Bindung zwischen dem Cα- und dem Cβ-Atom: Aldolspaltung
- Schwächung der Bindung zwischen dem Cα- und dem H-Atom, sowie dem Cβ-Atom und einem Substituenten: α-,β-Eliminierung
Pathobiochemie
[Bearbeiten]Vitamin B6-Mangelerkrankungen sind selten und oft unspezifisch: Seborrhoische Dermatitis, Glossitis, neurologische Symptome (Krampfanfälle, Neuritis, Depressionen, Reizbarkeit), Wachstumsstörungen, Anämie.
Weblinks
[Bearbeiten]
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.