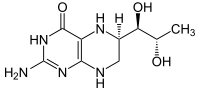
Biochemie und Pathobiochemie: Biopterin-Stoffwechsel
Allgemeines
[Bearbeiten]
Biopterin ist ein nicht-essentieller Co-Faktor. Das Molekül enthält wie die Folsäure und das Flavin ein stickstoffhaltiges Pteridin-Ringsystem. Alle drei werden aus dem Purin GTP gebildet, davon jedoch nur das Biopterin auch im Menschen.
Das Dihydrobiopterin/Tetrahydrobiopterin-System bildet neben dem NAD- und FAD-System ein weiteres wichtiges Redox-System. Eine besondere Rolle spielt es bei der Oxidation (Hydroxylierung) aromatischer Ringe, wobei es molekularen Sauerstoff verwendet.
Vorkommen:
- Biosynthese von Serotonin aus Tryptophan
- Biosynthese von Tyrosin aus Phenylalanin
- Biosynthese von L-DOPA aus Tyrosin
Vom Biopterin-Syntheseweg zweigt auch die Bildung von Molybdopterin ab, einem Molybdän-bindenden Cofaktor.
Biosynthese von Biopterin aus GTP
[Bearbeiten]| ⇓ | Subst. | (⇑) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| H2O
|
GTP-Cyclohydrolase | 3.5.4.16 | Hyd | HPABH4B, DOPA- responsive Dystonie | ||||||
|
||||||||||
| H2O | GTP-Cyclohydrolase | 3.5.4.16 | Hyd | HPABH4B, DOPA- responsive Dystonie | ||||||
|
||||||||||
| GTP-Cyclohydrolase | 3.5.4.16 | Hyd | HPABH4B, DOPA- responsive Dystonie | |||||||
|
||||||||||
|
|
GTP-Cyclohydrolase | 3.5.4.16 | Hyd | HPABH4B, DOPA- responsive Dystonie | ||||||
|
||||||||||
|
|
Mg | 6-Pyruvoyltetra-hydropterin-Synthase | 4.2.3.12 | Ly | HPABH4A | |||||
|
||||||||||
| NADPH/H+ | Sepiapterin-Reduktase | 1.1.1.153 | Ox | L-Dopa- responsive Dystonie | ||||||
|
||||||||||
| NADPH/H+ | Sepiapterin-Reduktase | 1.1.1.153 | Ox | L-Dopa- responsive Dystonie | ||||||
|
||||||||||
| NAD(P)+ | NAD(P)+ | 6,7-Dihydropteridin-Reduktase | 1.5.1.34 | Ox | HPABH4C | |||||
|
||||||||||
Funktionsweise des Dihydrobiopterin/Tetrahydrobiopterin-Systems
[Bearbeiten]| ⇓ | Subst. | (⇑) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| O2, Aromat
Hydroxy-Aromat |
Fe | Monooxygenase (Hydroxylase) | 1.14.16.1 1.14.16.2 1.14.16.4 | Ox | ||||||
|
||||||||||
|
|
4a-Hydroxytetrahydrobiopterin- Dehydratase | 4.2.1.96 | Ly | HPABH4D | ||||||
|
||||||||||
| NAD(P)H/H+ | NAD(P)H/H+ | 6,7-Dihydropteridin-Reduktase | 1.5.1.34 | Ox | HPABH4C | |||||
|
||||||||||
Die Hydroxylase überträgt vom molekularen Sauerstoff ein Sauerstoff-Atom auf den Aromaten und ein Sauerstoff-Atom auf BH4, dass dadurch zum 4a-Hydroxytetrahydrobiopterin oxidiert wird. Dieses gibt den aufgenommen Sauerstoff in Form von Wasser wieder ab. Der verlorene Wasserstoff wird durch die nachfolgende Reduktion wieder ersetzt.
Biosynthese von Molybdopterin
[Bearbeiten]| ⇓ | Subst. | (⇑) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| S-Adenosylmethionin, H2O
L-Methionin, Deoxyadenosin, PPi |
MOCS1 | ? | Cyc | MoCo-Defizienz Typ A | ||||||
|
||||||||||
| 2 L-Cystein, Cu
2 L-Alanin, H+ |
Molybdopterin-Synthase (MOCS2) | 2.8.1.- | Tr | MoCo-Defizienz Typ B | ||||||
|
||||||||||
| Molybdat, ATP, H2O
Cu, AMP, PPi |
Gephyrin | 2.-.-.- | Tr | MoCo-Defizienz Typ C | ||||||
|
||||||||||
| L-Cystein | MOCOS | 2.8.1.- | Tr | Xanthinurie II | ||||||
|
||||||||||
Molybdopterin bindet mit seinen zwei Thio-Gruppen ein Molybdän-Atom (mit zwei Sauerstoffatomen, also eigentlich MoO2) und dient in dieser Form als Cofaktor der Sulfit-Oxidase. Um die Enzyme Xanthin-Oxidase (XOD) und Aldehyd-Oxidase zu aktivieren, wird noch ein weiterer Schritt, der Austausch eines der o.g. Sauerstoffatome gegen Schwefel benötigt. Es exisieren also zwei verschiedene Molybdän-Cofaktoren im Menschen.
Der Molybdän-Cofaktor wird zu Urothion abgebaut.
Literatur
[Bearbeiten]Tetrahydrobiopterin: PMID 10727395
Molybdopterin: PMID 19675644 PMID 19623604 PMID 18092812 PMID 17351249 PMID 16261263 PMID 2522104
Weblinks
[Bearbeiten]
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.